1.本发明涉及一种药物组合物,包含溶栓肽-四氢异喹啉缀合物和药学上可接受的载体,且其ph小于ph 6.5。
附图说明
2.图1a显示了dc009的化学结构。
3.图1b显示了具有nh-lys-ala-pro细节的dc009的化学结构。
具体实施方式
4.本文公开了一种药物组合物,其包含dc009或其药学上可接受的盐以及药学上可接受的载体。dc009也缩写为lt3001,化学名称为3s-6,7-二羟基-1,1-二甲基-1,2,3,4-四氢-异喹啉-3-甲酰基-lys(pro-ala-lys),或n6-(l-脯氨酰基-l-丙氨酰基-l-赖氨酰基)-n2-[[(3s)-1,2,3,4-四氢-6,7-二羟基-1,1-二甲基-3-异喹啉基]羰基]-l-赖氨酸(cas rn:1639303-73-3)。dc009的结构示于图1a,赖氨酸连接臂与pro-ala-lys肽之间的酰胺键示于图1b。dc009是二元缀合物,其可以通过将溶栓肽(pro-ala-lys)和具有两个c1-4烷基的四氢异喹啉化合物经由赖氨酸连接臂偶联而形成。dc009化合物的制备公开于us 2016-0083423的实施例63,将其通过引用并入本文。dc009的药学上可接受的盐包括任何药学上可接受的盐;例如,盐酸盐,即n6-(l-脯氨酰基-l-丙氨酰基-l-赖氨酰基)-n2-[[(3s)-1,2,3,4-四氢-6,7-二羟基-1,1-二甲基-3-异喹啉基]羰基]-l-赖氨酸盐酸盐(1:3)(cas rn:2419930-71-3)。
[0005]
术语“药学上可接受的”是指对于在动物或人类中体内使用是生物学或药理学上相容的。在一些实施方式中,“药学上可接受的”是指由联邦或州政府的监管机构批准或在美国药典或其他普遍认可的药典中列出供动物(尤其是人类)使用。
[0006]
通常,药物组合物如下制备:将活性成分与液体载体和/或均匀细切的固体载体均匀紧密地结合在一起,然后,必要时将产品成型为所需的制剂。在药物组合物中,活性目标化合物的含量是以足以对疾病的过程或状况产生所需效果的量。因此,在一些实施方式中,本发明的药物组合物包括通过将0.1%至50%的活性成分与药学上可接受的载体混合而制成的任何组合物。在另一些实施方式中,本发明的药物组合物包括通过将0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、1.5%、2%、2.5%、3%、3.5%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%或50%的活性成分与药学上可接受的载体混合而制成的任何组合物。在某些实施方式中,本发明的药物组合物包括通过将0.2%至5%的活性成分与药学上可接受的载体混合而制成的任何组合物。在其他实施方式中,本发明的药物组合物包括通过将0.5%至5%的活性成分与药学上可接受的载体混合而制成的任何组合物。
[0007]
作为非活性成分的药学上可接受的载体可以由本领域技术人员使用常规标准来选择。药学上可接受的载体包括但不限于非水基溶液、悬浮液、乳液、微乳液、胶束溶液、凝
胶和软膏。药学上可接受的载体还可以包含以下成分,这些成分包括但不限于:盐水和电解质水溶液;离子和非离子渗透剂,例如氯化钠、氯化钾、甘油和右旋糖;ph调节剂和缓冲剂,例如氢氧根、磷酸根、柠檬酸根、乙酸根、硼酸根的盐和三乙醇胺;抗氧化剂,例如酸性亚硫酸、亚硫酸、焦亚硫酸、硫代亚硫酸、抗坏血酸、乙酰半胱氨酸、半胱氨酸、谷胱甘肽、丁基化羟基茴香醚、丁基化羟基甲苯、生育酚和抗坏血酸棕榈酸酯的盐、酸和/或碱;表面活性剂,例如卵磷脂、磷脂,包括但不限于磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰肌醇;泊洛沙姆和泊洛沙胺(ploxamine),聚山梨酯,例如聚山梨酸酯80、聚山梨酯60和聚山梨酯20,聚乙烯基类,例如聚乙烯醇和聚维酮;纤维素衍生物,例如甲基纤维素、羟丙基纤维素、羟乙基纤维素、羧甲基纤维素和羟丙基甲基纤维素及它们盐;石油衍生物,例如矿物油和白凡士林;脂肪,例如羊毛脂、花生油、棕榈油、大豆油;单、双和三酸甘油酯;丙烯酸的聚合物,例如羧基聚亚甲基凝胶和疏水性修饰的交联丙烯酸酯共聚物;多糖和糖胺聚糖,例如透明质酸钠。可以使用众所周知的防腐剂来保存这种药学上可接受的载体以防止细菌污染,这些防腐剂包括但不限于苯扎氯铵、乙二胺四乙酸及其盐、苄索氯铵、氯己定、三氯叔丁醇、对羟基苯甲酸甲酯、硫柳汞和苯乙醇,或可以配制成未防腐处理的制剂,用于单次使用或多次使用。
[0008]
在一些实施方式中,药物组合物包含dc009和药学上可接受的载体,其中该组合物的ph《7或ph《6.5。在一些实施方式中,该组合物的ph约为ph 1至ph 6。在一些实施方式中,该组合物的ph约为ph 2至ph 5.5。在一些实施方式中,该组合物的ph约为ph 3至ph 6。在一些实施方式中,该组合物的ph约为ph 3.5至ph 5.5。在一些实施方式中,该组合物的ph约为ph 3.5、ph 4、ph 4.5、ph 5或ph 5.5。在一些实施方式中,该组合物的ph约为4.5。
[0009]
如在本技术中使用的,“约”是指所叙述的值的
±
5%。
[0010]
在一些实施方式中,药物组合物包含dc009和药学上可接受的赋形剂,其中药学上可接受的赋形剂是二糖或糖醇。
[0011]
在一些实施方式中,糖醇是甘露醇、山梨糖醇、乙二醇、甘油、赤藓糖醇、苏糖醇、阿拉伯糖醇、木糖醇、核糖醇、半乳糖醇、岩藻糖醇、艾杜糖醇、肌醇、倭勒米糖醇、异麦芽糖醇、麦芽糖醇或乳糖醇。在一些实施方式中,糖醇是阿拉伯糖醇、木糖醇、核糖醇、甘露醇、山梨糖醇、半乳糖醇、岩藻糖醇、艾杜糖醇或肌醇。在一些实施方式中,糖醇为阿拉伯糖醇、木糖醇、核糖醇、甘露醇、山梨糖醇、半乳糖醇、岩藻糖醇、艾杜糖醇或肌醇。优选的糖醇是甘露醇或山梨糖醇。
[0012]
在一些实施方式中,二糖是蔗糖、乳糖、海藻糖(β,β-海藻糖、α,β-海藻糖)、乳果糖、麦芽糖、纤维二糖、壳二糖、曲二糖、黑曲霉糖、槐糖、昆布二糖、龙胆二糖、松二糖、麦芽酮糖、帕拉金糖、龙胆二酮糖、甘露二糖、蜜二糖、车前二糖、芸香糖、芸香酮糖(rutinulose)或木二糖。在一些实施方式中,二糖是蔗糖、乳果糖、乳糖、海藻糖、纤维二糖或壳二糖。优选的二糖是蔗糖、乳糖或海藻糖。
[0013]
在本技术中,dc009与药学上可接受的赋形剂的重量比(dc009/赋形剂之比)可以表示为例如9:1或9。例如,dc009/赋形剂之比表示为0.5:1,与dc009/赋形剂之比表示为0.5是相同的。例如,dc009/赋形剂之比的范围可以表示为1:1至9:1。
[0014]
在一些实施方式中,药物组合物包含dc009和药学上可接受的赋形剂,其中药学上可接受的赋形剂是甘露醇、山梨糖醇、蔗糖、乳糖或海藻糖,并且其中dc009与药学上可接受的赋形剂的重量比为1:1至1:9。如果该比率小于1:1,则体积太小以至于不能冻干;如果该
比率大于1:9,则渗透压太高而不能用于静脉内使用。
[0015]
在一些实施方式中,dc009与药学上可接受的赋形剂之比为1:9。在一个实施方式中,药物组合物包含约1%的dc009和约9%的药学上可接受的赋形剂。例如,药学上可接受的赋形剂是蔗糖、乳糖、山梨糖醇或海藻糖。
[0016]
在一些实施方式中,药物组合物包含dc009和药学上可接受的赋形剂,其中药学上可接受的赋形剂是甘露醇,并且dc009与甘露醇的重量比为1:1至1:7,优选1:1至1:5。例如,dc009与甘露醇的重量比为约1:1、1:1.3、1:3.8或1:5。在各种实施方式中,dc009与甘露醇的重量比为1:5。在一个实施方式中,药物组合物包含约1%的dc009和约5%的甘露醇。
[0017]
在各种实施方式中,dc009与药学上可接受的赋形剂之比为约1:3.8。在一个实施方式中,药物组合物包含约1%的dc009和约3.8%的甘露醇。在一个实施方式中,药物组合物包含约4%的dc009和约14.8%的甘露醇。
[0018]
在各种实施方式中,dc009与药学上可接受的赋形剂之比为约1:1.3。在一些实施方式中,药物组合物包含约2%的dc009和约2.6%的甘露醇。
[0019]
在一些实施方式中,药物组合物包含约1%的dc009和约3.8%的甘露醇,并且其中所述组合物的ph为约ph 3.5至ph 5.5,更优选地,所述组合物的ph为约ph 4.5。
[0020]
在一些实施方式中,药物组合物包含约2%的dc009和约2.6%的甘露醇,并且其中所述组合物的ph为约ph 3.5至ph 5.5,更优选地,所述组合物的ph为约4.5。
[0021]
下列实施例进一步阐明本发明。这些实施例仅意在说明本发明,而不应理解为是限制性的。
[0022]
实施例
[0023]
实施例1.dc009的制备和纯度确定
[0024]
dc009是根据us 2016-0083423制备。将最终产物用dcm、thf和乙醚重复洗涤数次,以提高最终产物的纯度。用hplc在以下条件下测定溶液中dc009的浓度和纯度。
[0025]
管柱:烷基反相键合相管柱
[0026]
流动相(mp):mp a:di水中的0.1体积%的tfa/mp b:乙腈中的0.1体积%的tfa
[0027]
检测波长:214和280nm
[0028]
管柱温度:20-25℃
[0029]
样品温度:10-15℃
[0030]
进样体积:10-20μl
[0031]
梯度:mp a和mp b。
[0032]
在实施例2至6中,每种制剂的稳定性显示为“样品回收率”或“相对纯度值”。如上所述,用hplc分析每个时间点的样品。对于“样品回收率”,%数值是通过将时间点处的dc009浓度除以t=0时的dc009浓度计算得到的。对于“相对纯度值”,%数值如下计算:(tn时的dc009的峰面积%/t0时的dc009峰面积%)*100%。
[0033]
实施例2.不同ph的溶液中的制剂稳定性
[0034]
制备了表1中列出的包含10mg/ml dc009的7种制剂,将dc009溶解在每种缓冲液中,并用naoh和hcl调节至所指示的ph。
[0035]
表1.制剂t-1至t-7
[0036]
制剂idph缓冲液
t-145mm乙酸钠t-255mm乙酸钠t-365mm柠檬酸钠t-4750mm磷酸钠t-57di水t-670.9%naclt-785mm磷酸钠
[0037]
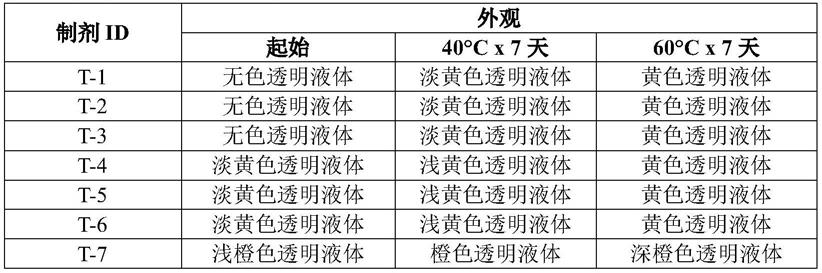
将这些制剂在40℃和60℃下储存以评估样品回收率和总杂质。表2和表3中记录了每种储存条件下的外观和稳定性。在任何样品中均未观察到沉淀。
[0038]
表2.制剂t-1至t-7的外观
[0039][0040]
表3.制剂t-1至t-7的稳定性
[0041][0042][0043]
在加速稳定性研究中,在40℃的第4天,t-1(ph 4)和t-2(ph 5)的样品回收率≥98%,在60℃为95%。在40℃的第7天,t-1和t-2在第7天的样品回收率为95%和96%,在60℃均为90%(数据未示出)。而在ph为7至8(t-4至t-7)下,制剂在60℃储存4天后的样品回收率降至90%以下,这表明杂质%显著增加。这些数据表明,dc009在酸性条件下稳定,并且在4至5之间的ph下非常稳定。对于10mg/ml的dc-009溶液,5mm乙酸钠足以维持ph 4至ph 5之间的稳定ph。
[0044]
实施例3.不同ph的溶液中的制剂稳定性
[0045]
在另一独立实验中,制备了表4中所列的包含10mg/ml dc009的9种制剂,将dc009溶于每种缓冲液中,并用naoh和hcl调节至所指示的ph。
[0046]
表4.制剂p1至p6
[0047]
样品ph缓冲液p1ph 7.05mm磷酸钠
p2ph 6.55mm磷酸钠p3ph 6.05mm柠檬酸钠p4ph 5.55mm柠檬酸钠p5ph 5.05mm乙酸钠p6ph 4.05mm乙酸钠p7ph 3.55mm乙酸钠p8ph 2.05mm乙酸钠p9ph 1.05mm乙酸钠
[0048]
将这些制剂在60℃下储存以评估样品在不同ph下的稳定性。所有制剂中的dc009的相对纯度值记录在表5中,dc009的纯度定义为在t=0时为100%。数据表明,dc009在所有酸性条件下(ph《7)都是稳定的,并且在60℃下持续10天保持纯度》95%。在60℃下保存一个月(第38天)后,dc009在ph 1至ph 6下是稳定的,并保持》86%的纯度值。在ph 2.0至5.5下显示出最佳的稳定性。
[0049]
表5.制剂p1至p7的稳定性(相对纯度值)
[0050][0051]
*相对纯度值:(tn时的dc009的峰面积%/t0时的dc009峰面积%)*100%
[0052]
实施例4a.不同赋形剂中的制剂稳定性
[0053]
制备了表6中列出的包含10mg/ml dc009和不同量的赋形剂(mg/g)的6种制剂,每种制剂均用naoh和hcl调至ph 4.5。将这些制剂在40℃和60℃下储存以评估样品回收率和总杂质。稳定性数据总结在表7中。
[0054]
表6.制剂e1至e6
[0055]
成分(mg/g)e1e2e3e4e5e6dc-009101010101010无水乙酸钠5 mm5mm5mm5mm5mm5mmedta2na 2h2o0.0550.0550.0550.0550.0550.055甘氨酸22
ꢀꢀꢀꢀꢀ
乳糖 90
ꢀꢀꢀꢀ
甘露醇
ꢀꢀ
50
ꢀꢀꢀ
二水合海藻糖
ꢀꢀꢀ
90
ꢀꢀ
蔗糖
ꢀꢀꢀꢀ
90 [0056]
表7.制剂e1至e5的稳定性
[0067]
表10.制剂m1至m4的稳定性
[0068][0069]
在加速稳定性研究中,60℃下2周时m1至m3的样品回收率≥90。数据表明,与没有甘露醇的m4制剂相比,添加甘露醇改善了制剂稳定性。
[0070]
实施例6.冻干制剂的制剂稳定性研究
[0071]
制备了表11中列出的2种制剂。将每种制剂在冻干机中冻干,并在25℃和40℃下储存以评样品定回收率。表12总结了每种储存条件下的稳定性结果。
[0072]
表11.冻干制剂
[0073]
成分f-1f-1hdc00912甘露醇3.82.6di水补足100补足1001n naoh/hcl至ph 4.5 dc009/甘露醇比率1:3.81:1.3
[0074]
表12.冻干制剂的稳定性
[0075][0076]
分别开发了10mg/ml和20mg/ml dc009的2种稳定的静脉内溶液冻干制剂(f-1和f-1h)。根据所进行的稳定性测试,f-1和f-1h在25℃和40℃下物理和化学稳定3个月。这些冻干制剂可以在静脉内注射之前用生理盐水回溶。
[0077]
现在以完整、清楚、简要并准确的术语描述了本发明及其制造和使用的方式和过程,以使所属领域的技术人员能够制造和使用本发明。应当理解,前述内容描述了本发明的优选实施方式,并且可以在不脱离权利要求书所述的本发明范围的情况下对其进行修改。为了特别指出并清楚地要求保护被视为发明的主题,以下权利要求总结了本说明书。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。