作为抗病毒剂的patentiflorin a类似物
1.相关申请的交叉引用
2.本技术要求于2019年8月26日提交的美国临时专利申请序列号 62/891,441和2020年8月25日提交的美国非临时专利申请序列号16/947,935 的优先权的权益,其出于所有目的全文据此以引用方式并入。
技术领域
3.本公开一般涉及芳基萘糖苷衍生物、其制备方法及其作为抗病毒剂的用途。更特别地,本公开涉及可用作抗病毒剂如抗hiv、抗冠状病毒、抗埃博拉病毒、抗马尔堡病毒和抗流感病毒剂的patentiflorin a类似物。本公开还提供了用于治疗病毒感染,如hiv、冠状病毒、埃博拉病毒、马尔堡病毒和流感病毒感染的方法。
背景技术:
4.病毒是在人类和其他哺乳动物中引起感染性疾病的重要病原体。它们在大小、形状、化学组成、宿主范围以及对宿主的效应上差别很大。历经数十年的研究,仅有限数量的抗病毒剂可用于治疗和/或预防由病毒如hiv、冠状病毒、埃博拉病毒、马尔堡病毒、甲型和乙型流感病毒以及丙型肝炎病毒引起的疾病。由于它们对宿主的毒性效应,许多抗病毒剂在其应用上受到限制。对抗病毒剂的耐药性通常非常迅速地发展,并且许多病毒性疾病如hiv没有可用的疫苗来治疗或预防它们。因此,需要一种对宿主没有毒性或低毒性的安全且有效的抗病毒剂来对抗广谱病毒。
5.aids(获得性免疫缺陷综合征)仍然是对公共卫生最严重的威胁之一。在unaids(世界防治aids联合会(uniting the world against aids))报告中,约有7700万人感染有人类免疫缺陷病毒(hiv),并且自1981年hiv 流行开始以来,3790万人死于aids有关的疾病。自1987年第一种抗hiv 药物齐多夫定(azt)被开发出并得到批准以来,超过40种抗hiv药物已经被美国食品和药物管理局(u.s.food and drug administration,fda)正式批准用于治疗hiv感染。这些药物被分类为核苷类逆转录酶抑制剂(nrti)、非核苷类逆转录酶抑制剂(nnrti)、蛋白酶抑制剂(pi)、侵入和融合抑制剂以及hiv整合酶链转移抑制剂。虽然这些药物显著延长了hiv阳性者的寿命,但令人担忧的是,自2001年全球推广抗逆转录病毒疗法(art)以来,hiv耐药性的流行率已从11%增加到29%。此外,当前art的高成本和有限的可用性使得发展中国家的患者没有获益于联合疗法。因此,迫切需要持续开发出新型、更有效、容易获得且价格低廉的抗hiv治疗剂。
6.流感(即呼吸系统的严重病毒感染)仍然是人类健康的主要威胁。世界范围内禽流感病毒(aiv)的高致病性h5n1亚型的爆发以及新型人甲型流感/h1n1的出现提高了公众对潜在全球流感大流行的认识。除了家禽之外, aiv还可感染野生鸟、猪、猫、人和其他动物。三种药物即巴洛沙韦、扎那米韦和磷酸奥司他韦已被批准用于治疗流感。然而,扎那米韦的低口服生物利用度和快速肾排除,以及奥司他韦抗药性的快速出现使得迫切需要进一步开发出更有效、持续时间更长的治疗药物来对抗潜在的人流感病毒引起的大流行。
7.属于丝状病毒科(filoviridae)的病毒含有负链rna作为其基因组。丝状病毒科下存在两个属,即马尔堡病毒属(marburgvirus)和埃博拉病毒属 (ebolavirus)。马尔堡病毒是马尔堡病毒属中的唯一成员。埃博拉病毒属存在五个成员,即扎伊尔埃博拉病毒(zaire ebolavirus)、苏丹埃博拉病毒(sudanebolavirus)、科特迪瓦埃博拉病毒(cote d’ivoire ebolavirus)、雷斯顿埃博拉病毒(reston ebolavirus)和本迪布焦型埃博拉病毒(bundibugyo)。由于它们的致病潜力、高病例死亡率以及对受感染的人缺乏有效的治疗剂,丝状病毒科的成员已被分类为“生物安全4级”病毒。线状病毒感染可能导致出血热。事实上,这两个属均包含能够在人类以及非人灵长类中引起严重出血热流行的物种。埃博拉病毒(ebov)疾病的爆发在刚果民主共和国(democratic republicof the congo)多次发生。自1976年以来,埃博拉爆发了多次。1976年在 yambuku首次爆发,报告了318起病例,死亡率为88%。后来,在1995年和2007年有两次大规模爆发,每次爆发报告了超过250起埃博拉病例。在 2014-2015年,西非经历了最大规模的埃博拉爆发。这次爆发有超过28,000 起病例,并且致死率达到40%。最近,从2018年4月4日起再次出现了埃博拉爆发。截至2019年5月30日,共报告了1945起病例,死亡率为67%。尚无fda批准的特异性治疗线状病毒感染的受试者的治疗剂。在埃博拉爆发期间,遭受线状病毒感染的患者主要依赖于恢复后病人的全血或血浆用于治疗。然而,该类型的经验性治疗具有许多限制,包括大批量生产的困难以及供体与受体之间血型的相容性。一些潜在候选药物(包括法匹拉韦、zmapp 和gs-5734)的使用仍在研究当中。需要更多的临床数据来证明这些候选药物在治疗线状病毒感染中的安全性和功效。
8.新型冠状病毒(sars-cov-2)的出现引起了国际上的关注,并且科学家力求发现针对新型冠状病毒的有效抑制剂。冠状病毒(cov)是有包膜的单链正向rna病毒,包括冠状病毒科(coronaviridae)、动脉炎病毒科 (arteriviridae)和杆套病毒科(roniviridae)。引起当前covid-19大流行的 sars-cov-2是β-冠状病毒。已经有六种cov被鉴定为人类易感病毒。其中两种即sars-cov和mers-cov可导致严重或甚至致命的呼吸道感染。截至2020年8月21日,在超过1550万起感染病例中,covid-19流行已引起 797,428人死亡。几种ebov抑制剂如瑞德西韦、托瑞米芬和法匹拉韦被重新用作针对sars-cov-2具有活性的抗病毒剂。然而,它们中没有一种能高度有效地控制covid-19流行。因此,迫切需要高度有效的病毒抑制剂来对抗冠状病毒。
9.在现代药物发现中,天然产物已成为发现先导化合物的丰富来源。通过筛选超过3,500种植物提取物,我们确定野靛棵(justicia cf.patentiflora)有有效的抗hiv活性。该植物的茎和皮的甲醇提取物的生物活性指导下的分级导向分离产生了三种anl(芳基萘)糖苷化合物。所述化合物展示出针对广泛 hiv临床毒株的有效抑制活性,其抗病毒的ec
50
值在14-37nm范围内[齐多夫定(azt):77-95nm]。它们还显示对耐药性hiv毒株的显著抑制效应。
[0010]
文献中已报道了一些芳基萘木脂素具有抗病毒活性。虽然这些化合物中的一些显示出针对各种病毒株的显著抗病毒活性,但由于它们的低选择性指数(si),它们不被认为是潜在的抗病毒候选药物。
[0011]
因此,需要开发出解决至少一些前述需求的改进的抗病毒剂。
技术实现要素:
[0012]
本公开涉及一类新的patentiflorin a类似物、这些化合物和新中间体的制备,以及它们用于治疗如hiv、cov、ebov和aiv等病毒感染的用途。
[0013]
在第一方面,本文提供了化合物在制备用于治疗病毒感染的药物中的用途,其中化合物具有式(i):
[0014][0015]
或其药学上可接受的盐或前药,其中
[0016]
x为氧或硫;
[0017]
r1为r
15
、-or
15
、-c(o)r
15
、或-c(o)or
15
;
[0018]
r2、r5、r6、r
10
、r
13
和r
14
各自为氢;
[0019]
r3和r4各自独立地选自-or
15
和-oc(o)r
15
;或者r3和r4与它们所连接的碳原子一起形成任选地被1、2、3、4或5个独立地选自r
16
的基团取代的5-6元杂环基;
[0020]
r7、r8和r9各自独立地选自-or
15
和-oc(o)r
15
;或者r7和r8与它们所连接的碳原子一起形成任选地被1、2、3、4或5个独立地选自r
16
的基团取代的5-6元杂环基;或者r8和r9与它们所连接的碳原子一起形成任选地被 1、2、3、4或5个独立地选自r
16
的基团取代的5-6元杂环基;
[0021]r11
和r
12
一起形成氧代基;或者在r
11
和r
12
中的一者为氢或卤素时, r
11
和r
12
中的另一者选自r
15
、-or
15
、-c(o)r
15
和-c(o)or
15
;
[0022]r15
在每次出现时独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、杂芳基、-or
17
、-c(o)r
18
、-c(o)n(r
17
)r
18
、-c(o)or
17
、-oc(o)r
17
、
‑ꢀ
s(o)2r
17
、-s(o)2n(r
17
)r
18
、-n=c(r
17
)r
18
、-n(r
17
)r
18
、-n(r
17
)n(r
17
)r
18
、
‑ꢀ
n(r
17
)c(o)r
18
、-n(r
17
)s(o)2r
18
、任选地被1、2、3、或4个独立地选自烷基的基团取代的1,3,2-二氧杂环戊硼烷、糖苷基团、任选地被三烷基硅烷取代的炔基、任选地被1、2、3、4或5个独立地选自r
16
的基团取代的烃基、任选地被1、2、3、4或5个独立地选自r
16
的基团取代的杂环基,以及任选地被1、2、3、4或5个独立地选自r
16
的基团取代的-(ch2)
k-杂环基,其中k 为1-6的整数;
[0023]r16
在每次出现时独立地选自炔基、卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
17
、-or
17
、-c(o)r
18
、-c(o)n(r
17
)r
18
、-c(o)or
17
、-oc(o)r
17
、
ꢀ‑
s(o)2r
17
、-s(o)2n(r
17
)r
18
、-n(r
17
)r
18
、-n(r
17
)n(r
17
)r
18
、-n(r
17
)c(o)r
18
和
ꢀ‑
n(r
17
)s(o)2r
18
;并且
[0024]r17
和r
18
在每次出现时独立地为氢、烷基、炔基、环烷基、芳基、或杂芳基,或者选自烃基和杂环基,其任一者任选地被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代;
[0025]
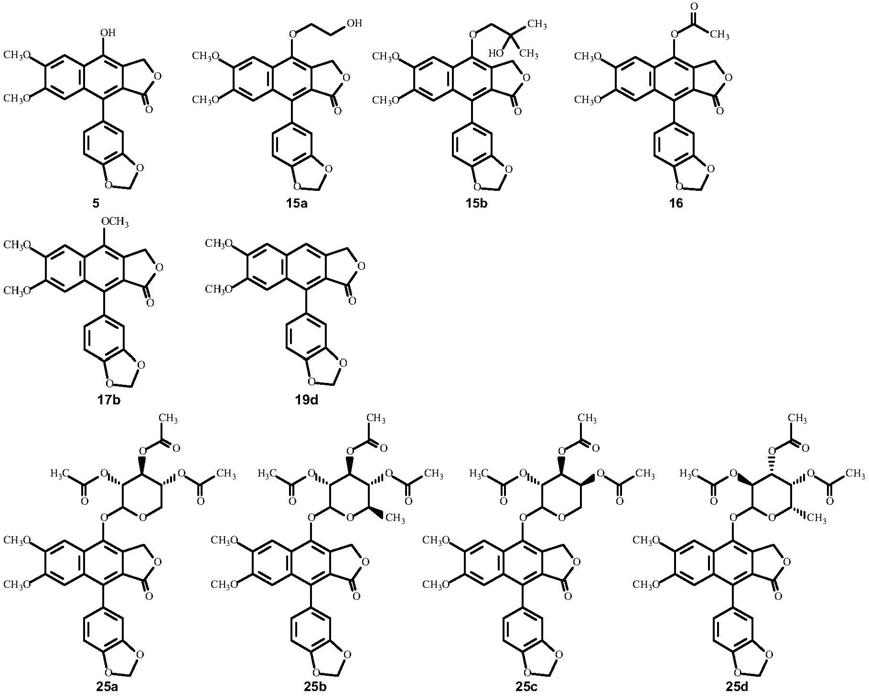
条件是式(i)的化合物不为选自5、15a、15b、16、17b、19d、25a-25g和 26a-26g的化
合物:
[0026]
[0027][0028]
在用途的某些实施方案中,r3和r4中的每者为-o-烷基;r8和r9与它们所连接的碳原子一起形成亚甲二氧基环;
[0029]
r1为杂芳基、-or
15
、-c(o)r
15
、-n(r
17
)r
18
、-n(r
17
)c(o)r
18
、-n=c(r
17
)r
18
、
[0030]
频哪醇硼基、-os(o)2cf3、糖苷基团、任选地被1或2个独立地选自r
16
的基团取代的杂环基、或任选地被三烷基硅烷取代的炔基;或者
[0031]
r1为-o(ch2)
m-氰基、-o(ch2)
m-炔基、-o(ch2)
m-c(o)n(r
17
)r
18
、或
‑ꢀ
o(ch2)
m-c(o)or
17
,其中m为选自1-4的整数;并且r
11
和r
12
一起形成氧代基。
[0032]
在用途的某些实施方案中,化合物选自12a、12b、13、14a、14b、17a、 17c、17d、17e、17f、17g、17h、18、19a、19b、19c、19e、19f、19g、19h、 19i、19j、19k、19l、19m、19n、19o、19p、20、21、22、23和24:
[0033]
[0034]
[0035][0036]
在用途的某些实施方案中,病毒感染选自hiv、冠状病毒、流感病毒、埃博拉病毒和马尔堡病毒。
[0037]
在用途的某些实施方案中,r1为炔基、频哪醇硼基、-och
2-氰基、-och2‑ꢀ
c(o)n(r
17
)r
18
、或-och
2-c(o)or
17
;r3和r4中的每者为-och3;r8和r9与它们所连接的碳原子一起形成亚甲二氧基环;r
11
和r
12
一起形成氧代基;并且病毒感染为hiv。
[0038]
在用途的某些实施方案中,r1为由式(v)表示的糖苷基团:
[0039][0040]
其中r
19
和r
20
一起形成氧代基;或者在r
19
和r
20
中的一者为氢或卤素时,r
19
和r
20
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
和
ꢀ‑
oc(o)or
27
;
[0041]r21
和r
22
一起形成氧代基;或者在r
21
和r
22
中的一者为氢或卤素时, r
21
和r
22
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
和
‑ꢀ
oc(o)or
27
;或者r
20
和r
22
与它们所连接的碳原子一起形成任选地被1、2、 3、4或5个独立地选自r
16
的基团取代的5-6元杂环基;
[0042]r23
和r
24
一起形成氧代基;或者在r
23
和r
24
中的一者为氢或卤素时, r
23
和r
24
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
和
‑ꢀ
oc(o)or
27
;或者r
22
和r
24
与它们所连接的碳原子一起形成任选地被1、2、 3、4或5个独立地选自r
16
的基团取代的5-6元杂环基;
[0043]r25
和r
26
一起形成氧代基;或者在r
25
和r
26
中的一者为氢或卤素时, r
25
和r
26
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
、
‑ꢀ
oc(o)or
27
、-ch2r
27
和-c(o)r
27
;或者r
24
和r
26
与它们所连接的碳原子一起形成任选地被1、2、3、4或5个独立地选自r
16
的基团取代的5-6元杂环基;
[0044]r27
在每次出现时独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、-or
29
、-c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、
ꢀ‑
s(o)2n(r
29
)r
30
、-n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
、
‑ꢀ
n(r
29
)s(o)2r
30
、任选地被1、2、3、4或5个独立地选自r
28
的基团取代的烃基、任选地被1、2、3、4或5个独立地选自r
28
的基团取代的杂环基,以及任选地被1、2、3、4或5个独立地选自r
28
的基团取代的-(ch2)
k-杂环基,其中k为1-6的整数;
[0045]r28
在每次出现时独立地选自卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
29
、-or
29
、-c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、
ꢀ‑
s(o)2r
29
、-s(o)2n(r
29
)r
30
、-n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
和
ꢀ‑
n(r
29
)s(o)2r
30
;并且
[0046]r29
和r
30
在每次出现时各自独立地为氢,或者选自烃基和杂环基,其任一者任选地
被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代。
[0047]
在用途的某些实施方案中,r
19
、r
21
、r
23
和r
25
各自为氢;r
20
、r
22
和 r
24
各自独立地选自-or
27
、-oc(o)n(r
27
)r
27
、-oc(o)r
27
和-oc(o)or
27
;并且r
26
为氢、甲基、-or
27
、-oc(o)r
27
或-ch
2-oc(o)r
27
;或者r
20
和r
22
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、 2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;或者r
22
和 r
24
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被 1、2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;或者r
24
和r
26
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;并且糖苷是单糖。
[0048]
在用途的某些实施方案中,糖苷是选自α-l异构体和β-l异构体的单糖。
[0049]
在用途的某些实施方案中,化合物选自27aa、27ab、27ac、27ad、27ae、 27af、27ba、27bb、27bc、27bd、27be、27bf、28ab1、28ab2、28ab3、28bb1、 28bb2、28bb3、29a、29b、30a、30b、30c、30d、30e、30f、30g、30h、30i、 30j、30k、30l、31a、31b、31c、31d、31e、31f、31g、31h、31i、31j、31k、 31l、32a、32b、32c和32d:
[0050]
[0051]
[0052]
[0053][0054]
在用途的某些实施方案中,病毒感染选自hiv、冠状病毒、流感病毒、埃博拉病毒和马尔堡病毒。
[0055]
在用途的某些实施方案中,r3和r4中的每者为-och3;r8和r9与它们所连接的碳原子一起形成亚甲二氧基环;r
11
和r
12
一起形成氧代基;r
19
、 r
21
、r
23
个r
25
各自为氢;r
20
、r
22
和r
24
各自独立地选自-or
27
、
‑ꢀ
oc(o)n(r
27
)r
27
、-oc(o)r
27
和-oc(o)or
27
;r
26
为氢、甲基、-or
27
、-oc(o)r
27
或-ch
2-oc(o)r
27
;或者r
20
和r
22
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1或2个独立地选自c
1-6
烷基的基团取代;或者r
22
和r
24
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1或2个独立地选自c
1-6
烷基的基团取代;或者r
24
和r
26
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1或2 个独立地选自c
1-6
烷基的基团取代;并且糖苷为单糖;并且病毒感染为hiv、冠状病毒、流感病毒、埃博拉病毒、或马尔堡病毒。
[0056]
在第二方面,本文提供了一种式(i)的化合物:
[0057][0058]
或其药学上可接受的盐或前药,其中
[0059]
x为氧或硫;
[0060]
r1为r
15
、-or
15
、-c(o)r
15
、或-c(o)or
15
;
[0061]
r2、r5、r6、r
10
、r
13
和r
14
各自为氢;
[0062]
r3和r4各自独立地选自-or
15
和-oc(o)r
15
;或者r3和r4与它们所连接的碳原子一起形成任选地被1、2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代的5-6元杂环基;
[0063]
r7、r8和r9各自独立地选自-or
15
和-oc(o)r
15
;或者r7和r8与它们所连接的碳原子一起形成任选地被1、2、3、4或5个独立地选自c
1-6
烷基和 c
1-6
烷氧基的基团取代的5-6元杂环基;或者r8和r9与它们所连接的碳原子一起形成任选地被1、2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代的5-6元杂环基;
[0064]r11
和r
12
一起形成氧代基;或者在r
11
和r
12
中的一者为氢或卤素时, r
11
和r
12
中的另一者选自r
15
、-or
15
、-c(o)r
15
和-c(o)or
15
;
[0065]r15
在每次出现时独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、杂芳基、-or
17
、-c(o)r
18
、-c(o)n(r
17
)r
18
、-c(o)or
17
、-oc(o)r
17
、
‑ꢀ
s(o)2r
17
、-s(o)2n(r
17
)r
18
、-n=c(r
17
)r
18
、-n(r
17
)r
18
、-n(r
17
)n(r
17
)r
18
、
‑ꢀ
n(r
17
)c(o)r
18
、-n(r
17
)s(o)2r
18
、任选地被1、2、3、或4个独立地选自烷基的基团取代的1,3,2-二氧杂环戊硼烷、糖苷基团、任选地被三烷基硅烷取代的炔基、任选地被1、2、3、4或5个独立地选自r
16
的基团取代的烃基、任选地被1、2、3、4或5个独立地选自r
16
的基团取代的杂环基,以及任选地被1、2、3、4或5个独立地选自r
16
的基团取代的-(ch2)
k-杂环基,其中k 为1-6的整数;
[0066]r16
在每次出现时独立地选自炔基、卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
17
、-or
17
、-c(o)r
18
、-c(o)n(r
17
)r
18
、-c(o)or
17
、-oc(o)r
17
、
ꢀ‑
s(o)2r
17
、-s(o)2n(r
17
)r
18
、-n(r
17
)r
18
、-n(r
17
)n(r
17
)r
18
、-n(r
17
)c(o)r
18
和
ꢀ‑
n(r
17
)s(o)2r
18
;并且
[0067]r17
和r
18
在每次出现时独立地为氢、烷基、炔基、环烷基、芳基、或杂芳基,或者选自烃基和杂环基,其任一者任选地被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代,
[0068]
条件是式(i)的化合物不为选自5、15a、15b、16、17b、19d、25a-25g和 26a-26g的化合物:
[0069][0070]
[0071]
在化合物的某些实施方案中,r3和r4中的每者为-o-烷基;r8和r9与它们所连接的碳原子一起形成亚甲二氧基环;并且r
11
和r
12
一起形成氧代基。
[0072]
在化合物的某些实施方案中,r1为杂芳基、-or
15
、-c(o)r
15
、-n(r
17
)r
18
、
ꢀ‑
n(r
17
)c(o)r
18
、-n=c(r
17
)r
18
、频哪醇硼基、-os(o)2cf3、任选地被三烷基硅烷取代的炔基、或任选地被1或2个独立地选自r
16
的基团取代的杂环基;或者r1为-o(ch2)
m-氰基、-o(ch2)
m-炔基、-o(ch2)
m-c(o)n(r
17
)r
18
、或
‑ꢀ
o(ch2)
m-c(o)or
17
,其中m为选自1-4的整数。
[0073]
在化合物的某些实施方案中,r1为杂芳基、-or
15
、-c(o)r
15
、-n(r
17
)r
18
、
ꢀ‑
n(r
17
)c(o)r
18
、-n=c(r
17
)r
18
、频哪醇硼基、-os(o)2cf3、任选地被1或2 个独立地选自r
16
的基团取代的杂环基、或任选地被三烷基硅烷取代的炔基;或者r1为-o(ch2)
m-氰基、-o(ch2)
m-炔基、-o(ch2)
m-c(o)n(r
17
)r
18
、或
‑ꢀ
o(ch2)
m-c(o)or
17
,其中m为选自1-4的整数;r3和r4中的每者为-ome; r8和r9与它们所连接的碳原子一起形成亚甲二氧基环;并且r
11
和r
12
一起形成氧代基。
[0074]
在化合物的某些实施方案中,r1为炔基、频哪醇硼基;-n(r
17
)r
18
、-och2‑ꢀ
氰基、-och
2-炔基、-och
2-c(o)n(r
17
)r
18
、或-och
2-c(o)or
17
。
[0075]
在化合物的某些实施方案中,化合物选自12a、12b、13、14a、14b、17a、 17c、17d、17e、17f、17g、17h、18、19a、19b、19c、19e、19f、19g、19h、 19i、19j、19k、19l、19m、19n、19o、19p、20、21、22、23和24:
[0076]
[0077]
[0078][0079]
在化合物的某些实施方案中,r1是选自单糖、二糖、三糖、四糖以及含有少于30个单糖的多糖基团的糖苷基团,其中糖苷基团包含一种或多种选自α-d、α-l、β-d和β-l的单糖异构体。
[0080]
在化合物的某些实施方案中,r1为由式(v)表示的糖苷基团:
[0081][0082]
其中r
19
和r
20
一起形成氧代基;或者在r
19
和r
20
中的一者为氢或卤素时,r
19
和r
20
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
和
ꢀ‑
oc(o)or
27
;
[0083]r21
和r
22
一起形成氧代基;或者在r
21
和r
22
中的一者为氢或卤素时, r
21
和r
22
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
和
‑ꢀ
oc(o)or
27
;或者r
20
和r
22
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;
[0084]r23
和r
24
一起形成氧代基;或者在r
23
和r
24
中的一者为氢或卤素时, r
23
和r
24
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
和
‑ꢀ
oc(o)or
27
;或者r
22
和r
24
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;
[0085]r25
和r
26
一起形成氧代基;或者在r
24
和r
25
中的一者为氢或卤素时, r
25
和r
26
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
、
‑ꢀ
oc(o)or
27
、-ch2r
27
和-c(o)r
27
;或者r
24
和r
26
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;
[0086]r27
在每次出现时独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、-or
29
、-c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、
ꢀ‑
s(o)2n(r
29
)r
30
、-n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
、
‑ꢀ
n(r
29
)s(o)2r
30
、任选地被1、2、3、4或5个独立地选自r
28
的基团取代的烃基、任选地被1、2、3、4或5个独立地选自r
28
的基团取代的杂环基,以及任选地被1、2、3、4或5个独立地选自r
28
的基团取代的-(ch2)
k-杂环基,其中k为1-6的整数;
[0087]r28
在每次出现时独立地选自卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
29
、-or
29
、-c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、
ꢀ‑
s(o)2r
29
、-s(o)2n(r
29
)r
30
、-n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
和
ꢀ‑
n(r
29
)s(o)2r
30
;并且
[0088]r29
和r
30
在每次出现时各自独立地为氢,或者选自烃基和杂环基,其任一者任选地
被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代。
[0089]
在化合物的某些实施方案中,r
19
、r
21
、r
23
和r
25
各自为氢;r
20
、r2和 r
24
各自独立地选自-or
27
、-oc(o)n(r
27
)r
27
、-oc(o)r
27
和-oc(o)or
27
;并且r
26
为氢、甲基、-or
27
、-oc(o)r
27
、或-ch
2-oc(o)r
27
;或者r
20
和r
22
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、 2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;或者r
22
和 r
24
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被 1、2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;或者r
24
和r
26
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;并且糖苷是单糖。
[0090]
在化合物的某些实施方案中,糖苷是选自α-l异构体和β-l异构体的单糖。
[0091]
在化合物的某些实施方案中,化合物选自27aa、27ab、27ac、27ad、27ae、 27af、27ba、27bb、27bc、27bd、27be、27bf、28ab1、28ab2、28ab3、28bb1、28bb2、28bb3、29a、29b、30a、30b、30c、30d、30e、30f、30g、30h、30i、 30j、30k、30l、31a、31b、31c、31d、31e、31f、31g、31h、31i、31j、31k、 31l、32a、32b、32c和32d:
[0092]
[0093]
[0094]
[0095][0096]
在第三方面,本文提供了一种药物组合物,该药物组合物包含如本文所述的化合物以及至少一种药学上可接受的赋形剂。
[0097]
本文还提供了一种具有通式(i)或(ii)的芳基萘木脂素化合物或其药学上可接受的盐或前药,以用于在患者中治疗、预防病毒感染或者延缓病毒感染的进展。
[0098][0099]
或其立体异构体;或其对映体;或其药学上可接受的盐或前药,其中
[0100]
x为氧或硫;
[0101]
r1、r2、r3、r4、r5、r6、r7、r8、r9和r
10
各自独立地为氢、卤素、或包含1至30个选自碳、硼、氮、氧、硅和硫的多价原子的部分;或者r2和r3、r3和r4、r4和r5、r6和r7、r7和r8、r8和r9、或r9和r
10
可以与它们所连接的碳原子一起形成环状基团,该环状基团任选地被1、2、3、4或 5个独立地选自卤素以及包含1至30个选自碳、硼、氮、氧、硅和硫的多价原子的部分的基团取代;
[0102]r11
和r
12
一起形成氧代基;或者在r
11
和r
12
中的一者为氢或卤素时, r
11
和r
12
中的另一者选自r
15
、-or
15
、-c(o)r
15
和-c(o)or
15
;
[0103]r13
和r
14
一起形成氧代基;或者在r
13
和r
14
中的一者为氢或卤素时, r
13
和r
14
中的另一者选自r
15
、-or
15
、-c(o)r
15
和-c(o)or
15
;
[0104]r15
独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、-or
17
、
ꢀ‑
c(o)r
18
、-c(o)n(r
17
)r
18
、-c(o)or
17
、-oc(o)r
17
、-s(o)2r
17
、-s(o)2n(r
17
)r
18
、-n(r
17
)r
18
、-n(r
17
)n(r
17
)r
18
、-n(r
17
)c(o)r
18
、-n(r
17
)s(o)2r
18
、任选地被1、 2、3、4或5个独立地选自r
16
的基团取代的烃基、任选地被1、2、3、4或 5个独立地选自r
16
的基团取代的杂环基,以及任选地被1、2、3、4或5个独立地选自r
16
的基团取代的-(ch2)
k-杂环基,其中k为1至6的整数(例如 1、2或3);
[0105]r16
独立地选自卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
17
、
ꢀ‑
or
17
、-c(o)r
18
、-c(o)n(r
17
)r
18
、-c(o)or
17
、-oc(o)r
17
、-s(o)2r
17
、
‑ꢀ
s(o)2n(r
17
)r
18
、-n(r
17
)r
18
、-n(r
17
)n(r
17
)r
18
、-n(r
17
)c(o)r
18
和
‑ꢀ
n(r
17
)s(o)2r
18
;
[0106]r17
和r
18
各自独立地为氢,或者选自烃基和杂环基,其任一者任选地被 1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代;并且
[0107]
r为氢,或者选自烃基和杂环基,其任一者任选地被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代。
[0108]
本公开还提供了一种具有通式(iii)或(iv)的芳基萘木脂素化合物或其药学上可接受的盐或前药,以用于在患者中治疗、预防病毒感染或者延缓病毒感染的进展。
[0109][0110]
或其立体异构体;或其对映体;或其药学上可接受的盐或前药,其中
[0111]
x为氧或硫;
[0112]
糖苷基团通常为碳水化合物基团,尤其是单糖、二糖、三糖、四糖或多糖基团,并且能够以各种异构形式存在,例如α-d、α-l、β-d或β-l形式;碳水化合物基团可以任选地被其他类型的取代基或甚至额外的糖苷基团取代;式(iii)和式(iv)的化合物的化学结构中所含的单糖和取代的单糖的总数量不可超过30;
[0113]
r1、r2、r3、r4、r5、r6、r7、r8和r9各自独立地为氢、卤素、或包含 1至30个选自碳、氮、氧和硫的多价原子的部分;或者r1和r2、r2和r3、 r3和r4、r5和r6、r6和r7、r7和r8、r8和r9可以与它们所连接的碳原子一起形成环状基团,该环状基团任选地被卤素或包含1至30个选自碳、氮、氧和硫的多价原子的部分取代;
[0114]r10
和r
11
可以一起形成氧代基;或者在r
10
和r
11
中的一者为氢或卤素时,r
10
和r
11
中的另一者选自r
27
、-or
27
、-c(o)r
27
和-c(o)or
27
;
[0115]r12
和r
13
可以一起形成氧代基;或者在r
12
和r
13
中的一者为氢或卤素时,r
12
和r
13
中的另一者选自r
27
、-or
27
、-c(o)r
27
和-c(o)or
27
;
[0116]r19
和r
20
一起形成氧代基;或者在r
19
和r
20
中的一者为氢或卤素时, r
19
和r
20
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖和取代的四糖;
[0117]r21
和r
22
一起形成氧代基;或者在r
21
和r
22
中的一者为氢或卤素时, r
21
和r
22
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖和取代的四糖;
[0118]r23
和r
24
一起形成氧代基;或者在r
23
和r
24
中的一者为氢或卤素时, r
23
和r
24
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的
三糖、四糖和取代的四糖;
[0119]r25
和r
26
一起形成氧代基;或者在r
25
和r
26
中的一者为氢或卤素时, r
25
和r
26
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、-ch2r
31
和
‑ꢀ
c(o)r
31
;
[0120]r27
独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、-or
29
、
ꢀ‑
c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、-s(o)2n(r
29
)r
30
、
ꢀ‑
n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
、以及-n(r
29
)s(o)2r
30
、任选地被1、2、3、4或5个独立地选自r
28
的基团取代的烃基、任选地被1、2、 3、4或5个独立地选自r
28
的基团取代的杂环基,以及任选地被1、2、3、 4或5个独立地选自r
28
的基团取代的-(ch2)
k-杂环基,其中k为1至6的整数(例如1、2或3);
[0121]r28
独立地选自卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
29
、
ꢀ‑
or
29
、-c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、
‑ꢀ
s(o)2n(r
29
)r
30
、-n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
和
‑ꢀ
n(r
29
)s(o)2r
30
;
[0122]r29
和r
30
各自独立地为氢,或者选自烃基和杂环基,其任一者任选地被 1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代;
[0123]r31
独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、-or
29
、
ꢀ‑
c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、-s(o)2n(r
29
)r
30
、
ꢀ‑
n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
、-n(r
29
)s(o)2r
30
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖、取代的四糖、任选地被1、2、3、4或5个独立地选自r
28
的基团取代的烃基,以及任选地被1、 2、3、4或5个独立地选自r
28
的基团取代的杂环基;并且
[0124]
r为氢,或者选自烃基和杂环基,其任一者任选地被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代。
[0125]
本发明的第四方面是一种包含芳基萘木脂素化合物或其药学上可接受的盐或前药的药物制剂,以用于在患者中治疗、预防病毒感染或者延缓病毒感染的进展。
[0126]
本发明的第五方面是一种包含糖苷芳基萘木脂素化合物或其药学上可接受的盐或前药的药物制剂,以用于在患者中治疗、预防病毒感染或者延缓病毒感染的进展。
[0127]
本发明的第六方面是一种包含山荷叶素类似物或其药学上可接受的盐或前药的药物制剂,以用于在患者中治疗、预防病毒感染或者延缓病毒感染的进展。
[0128]
本发明的第七方面是一种包含patentiflorin a类似物或其药学上可接受的盐或前药的药物制剂,以用于在患者中治疗、预防病毒感染或者延缓病毒感染的进展。
[0129]
本发明的另一方面涉及提供合成新芳基萘木脂素化合物以及合成期间的中间体化合物的方法。此外,本发明涉及一种可用于制备本发明的其他化合物的中间体化合物。
[0130]
本发明的化合物能够以不同的形式存在,如游离酸、游离碱、酯以及其他前药、盐和互变异构体,并且本公开包括这些化合物的所有变体形式。
[0131]
保护的程度包括含有或声称含有本发明的化合物的假冒或虚假产品,而不管它们实际上是否含有这样的化合物以及不管任何这样的化合物是否以治疗有效量被含有。
[0132]
包括在保护范围内的是包括描述或说明书的包装,所述描述或说明书指示该包装含有本发明的物类或药物制剂以及产品,所述产品是或包含,或者声称是或包含这样的制剂或物类。这样的包装可能是但不一定是假冒或虚假的。
[0133]
结合本发明的特定方面、实施方案或实施例描述的特性、整数、特征、化合物、化学部分或基团应理解为适用于本文所述的任何其他方面、实施方案或实施例,除非与其不相
容。
附图说明
[0134]
图1显示patentiflorin a的结构和碳编号以及山荷叶素(5)的示意性制备。
[0135]
图2显示山荷叶素类似物12-17的示意性制备(对于化合物14a的制备,反应试剂和条件为a:nh4cl、hatu、et3n、ch2cl2;对于化合物14b的制备,反应试剂和条件为b:menh2、edci、hobt和thf;对于化合物15a 的制备,反应试剂和条件为c:pdcl2、k2co3、tbab、h2o、60℃;对于制备化合物15b,反应试剂和条件为d:cs2co3、dmf、120℃;对于化合物17a
‑ꢀ
17c的制备,反应试剂和条件为e:cs2co3、丙酮、室温;对于化合物17d的制备,反应试剂和条件为f:k2co3、dmf、100℃;对于化合物17e-17h的制备,反应试剂和条件为g:et3n、dmap、ch2cl2、25℃)。
[0136]
图3显示山荷叶素类似物18-24的示意性制备(对于化合物19a的制备,反应试剂和条件为a:[pd(dppf)cl2]ch2cl2、koac、b2(pin)2、二氧杂环己烷、 100℃;对于制备19b的化合物,反应试剂和条件为b:[pd(dppf)cl2]ch2cl2、 alme3、甲苯、100℃;对于化合物19c的制备,反应试剂和条件为c: [pd(dppf)cl2]ch2cl2、na2co3、吡啶-4-硼酸、h2o、二氧杂环己烷、100℃;对于化合物19d的制备,反应试剂和条件为d:pd(oac)2、pph3、et3n、hco2h、 dmf、100℃;对于化合物19e和19f的制备,反应试剂和条件为e:pd(oac)2、 binap、cs2co3、rh、甲苯、100℃;对于化合物19g的制备,反应试剂和条件为f:pd(pph3)4、et2zn、thf、100℃;对于化合物19h-19j的制备,反应试剂和条件为g:pd(pph3)4、k2co3、rb(oh)2、dmf、100℃;对于化合物19k的制备,反应试剂和条件为h:pd(pph3)4、na2co3、呋喃-2-硼酸、h2o、二氧杂环己烷、100℃;对于化合物19l的制备,反应试剂和条件为i:pd(pph3)4、 na2co3、1-boc-3,6-二氢-2h-吡啶-4-硼酸频哪醇酯、h2o、二氧杂环己烷、 100℃;对于化合物19m的制备,反应试剂和条件为j:pd2(dba)3、xantphos、 cs2co3、吗啉dmf、100℃;对于化合物19n的制备,反应试剂和条件为k: pd(pph3)2cl2、三丁基(1-乙氧基乙烯基)锡、phme、100℃,继之以50%hcl;对于化合物19o的制备,反应试剂和条件为l:pd(pph3)2cl2、cui、et3n、 dmf、三甲基甲硅烷基乙炔、80℃;对于化合物19p的制备,反应试剂和条件为m:pd(oac)2、cs2co3、xantphos、et3n、二苯甲酮亚胺、二氧杂环己烷、100℃;对于化合物20的制备,反应试剂和条件为n:nabh4、meoh、室温;对于化合物21的制备,反应试剂和条件为o:k2co3、meoh、室温;对于化合物22的制备,反应试剂和条件为p:hcl、thf、室温,继之以koh、室温;对于化合物23的制备,反应试剂和条件为q:cs2co3、炔丙基溴、 mecn、室温;对于化合物24的制备,反应试剂和条件为r:ac2o、吡啶、室温)。
[0137]
图4显示patentiflorin a类似物25a-25g和26a-26g的示意性制备。化合物26a、26b、26c、26d、26e、26f和26g分别由25a、25b、25c、25d、25e、 25f和25g产生。
[0138]
图5显示patentiflorin a类似物27aa-27af、27ba-27bf、28ab1-28ab3、 28bb1-28bb3、29a、29b、30a-30l和31a-31l的示意性制备(对于化合物27aa
‑ꢀ
27af和27ba-27bf的制备,反应试剂和条件为a:ac2o、tbaoac、mecn、 40℃;对于化合物28ab1至28ab3以及28bb1至28bb3的制备,反应试剂和条件为b:allococl、et3n、ch2cl2、0℃至室温;对于化合物29a和29b 的制备,反应试剂和条件为c:accl、ch2cl2、meoh、0℃至室温;对于化合物30a-k的制备,反应试剂和条件为d:et3n、dmap,无水ch2cl2、0℃至室温;对于化合物30l的制备,反应试剂
和条件为e:koh、18-冠醚-6、 thf、室温;对于化合物31a-l的制备,反应试剂和条件为f:(pph3)4pd、pph3、 et3n、hcooh、thf、n2、55℃)。化合物27aa、27ab、27ac、27ad、27ae 和27af由26a产生。化合物27ba、27bb、27bc、27bd、27be和27bf由26b 产生。化合物28ab1、28ab2和28ab3由27ab产生。化合物28bb1、28bb2 和28bb3由27bb产生。化合物29a和29b分别由28ab3和28bb3产生。化合物30a和30l由29a产生。化合物30b、30c、30d、30e、30f、30g、30h、 30i、30j和30k由29b产生。化合物31a、31b、31c、31d、31e、31f、31g、 31h、31i、31j、31k和31l分别由30a、30b、30c、30d、30e、30f、30g、 30h、30i、30j、30k和30l产生。
[0139]
图6显示patentiflorin a类似物32a-32d的示意性制备。化合物32a由 26f产生。化合物32b-32d由26g产生。
具体实施方式
[0140]
本公开不限于本文所述的任何具体实施方案的范围。以下实施方案仅提供用于举例说明。
[0141]
贯穿本说明书的描述和权利要求,词语“包含(comprise)”和该词语的其他形式如“包含(comprising)”和“包含(comprises)”意指包括但不限于,并且不旨在排除例如其他添加剂、组分、整数或步骤。
[0142]
如在描述和所附权利要求中所用,单数形式“一个”、“一种”和“所述”包括复数指代,除非上下文另有明确规定。因此,例如,提及到的“一种组合物”包括两种或更多种这样的组合物的混合物,提及到的“所述化合物”包括两种或更多种这样的化合物的混合物,提及到的“一种试剂”包括两种或更多种这样的试剂的混合物等。
[0143]“任选的”或“任选地”意指随后描述的事件或情形可以或不可发生,并且该描述包括事件或情形发生的情况以及不发生的情况。
[0144]
如本文所用,“受试者”意指个体。因此,“受试者”可包括驯养动物(例如猫、狗等)、家畜(例如牛、马、猪、绵羊、山羊等)、实验室动物(例如小鼠、兔、大鼠、豚鼠等)和鸟类。“受试者”还可包括哺乳动物,例如灵长类或人类。
[0145]
所谓的“减少(reduce)”或该词语的其他形式,例如“减少(reducing)”或“减少(reduction)”意指降低事件或特征(例如肿瘤生长)。应当理解,这通常与某些标准或预期值有关,换言之,它是相对的,但并不总是需要提及该标准或相对值。例如,“减少肿瘤生长”意指相对于标准或对照而言减少肿瘤生长率。
[0146]
所谓的“预防”或该词语其他形式,如“预防(preventing)”或“预防 (prevention)”意指停止特定事件或特征,稳定或延缓特定事件或特征的发展或进展,或者使特定事件或特征发生的机会最小化。预防不需要与对照比较,因为它通常比例如减少更绝对。如本文所用,某物可被减少但不被预防,但是减少的某物也可被预防。同样,某物可被预防但不被减少,但预防的某物也可被减少。应当理解,在使用减少或预防的情况下,除非另外特别指出,否则其他词语的使用也明确地公开。
[0147]
所谓的“治疗(treat)”或该词的其他形式,如“治疗(treated)”或“治疗 (treatment)”意指给药组合物或者执行方法以减少、预防、抑制、或消除特定特征或事件(例如肿瘤生长或存活)。术语“控制”与术语“治疗”同义使用。
[0148]
术语“抗病毒”是指抑制特定病毒复制,抑制病毒传播,或者预防病毒在其宿主体
内建立自身,以及改善或减轻病毒感染引起的疾病的症状的能力。如果病毒载量减少、死亡率和/或发病率减小,则认为该治疗是治疗性的。
[0149]
术语“治疗有效”意指所用组合物的量是足以改善疾病或障碍的一种或多种病因或症状的量。这样的改善仅需要减少或改变,而不必消除。
[0150]
如本文所用,术语“药学上可接受的盐”是指本发明的化合物的任何盐,其保留其生物学性质,并且对于药物用途没有毒性或者不是其他方面不期望的。这样的盐可衍生自本领域公知的多种有机和无机抗衡离子并且包括它们。这样的盐包括:(1)与有机或无机酸形成的酸加成盐,所述有机或无机酸如盐酸、氢溴酸、硫酸、硝酸、磷酸、氨基磺酸、乙酸、三氟乙酸、三氯乙酸、丙酸、己酸、环戊基丙酸、乙醇酸、戊二酸、丙酮酸、乳酸、丙二酸、琥珀酸、山梨酸、抗坏血酸、苹果酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、3-(4-羟基苯甲酰基)苯甲酸、苦味酸、肉桂酸、扁桃酸、邻苯二甲酸、月桂酸、甲磺酸、乙磺酸、1,2-乙烷-二磺酸、2-羟基乙磺酸、苯磺酸、4-氯苯磺酸、2-萘磺酸、4-甲苯磺酸、樟脑酸、樟脑磺酸、4-甲基二环[2.2.2]-辛-2-烯
‑ꢀ
1-羧酸、葡庚糖酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、月桂基硫酸、葡糖酸、苯甲酸、谷氨酸、羟基萘酸、水杨酸、硬脂酸、环己基氨基磺酸、奎宁酸、粘康酸等酸;或者(2)当存在于母体化合物中的酸性质子(a)被金属离子(例如,碱金属离子、碱土金属离子或铝离子)、或碱金属或碱土金属氢氧化物(例如,钠、钾、钙、镁、铝、锂、锌和钡氢氧化物)、氨替代,或者(b)与有机碱配位时形成的盐,所述有机碱如脂族、脂环族、或芳族有机胺,如氨、甲胺、二甲胺、二乙胺、甲基吡啶、乙醇胺、二乙醇胺、三乙醇胺、乙二胺、赖氨酸、精氨酸、鸟氨酸、胆碱、n,n'-二苄基乙二胺、氯普鲁卡因、二乙醇胺、普鲁卡因、n-苄基苯乙胺、n-葡甲胺哌嗪、三(羟甲基)
‑ꢀ
氨基甲烷、四甲基氢氧化铵等。此外,盐的实例包括钠、钾、钙、镁、铵、四烷基铵等,并且当化合物含有碱性官能团时包括无毒有机或无机酸的盐,如氢卤化物(例如,盐酸盐和氢溴酸盐)、硫酸盐、磷酸盐、氨基磺酸盐、硝酸盐、乙酸盐、三氟乙酸盐、三氯乙酸盐、丙酸盐、己酸盐、环戊基丙酸盐、乙醇酸盐、戊二酸盐、丙酮酸盐、乳酸盐、丙二酸盐、琥珀酸盐、山梨酸盐、抗坏血酸盐、苹果酸盐、马来酸盐;富马酸盐、酒石酸盐、柠檬酸盐、苯甲酸盐、3-(4-羟基苯甲酰基)苯甲酸盐、苦味酸盐、肉桂酸盐、扁桃酸盐、邻苯二甲酸盐、月桂酸盐、甲烷磺酸盐(甲磺酸盐)、乙烷磺酸盐、1,2-乙烷-二磺酸盐、2-羟乙基磺酸盐、苯磺酸盐(benzenesulfonate)(苯磺酸盐(besylate))、 4-氯苯磺酸盐、2-萘磺酸盐、4-甲苯磺酸盐、樟脑酸盐、樟脑磺酸盐、4-甲基二环[2.2.2]-辛-2-烯-1-羧酸盐、葡庚糖酸盐、3-苯基丙酸盐、三甲基乙酸盐、叔丁乙酸盐、月桂基硫酸盐、葡糖酸盐、苯甲酸盐、谷氨酸盐、羟萘甲酸盐、水杨酸盐、硬脂酸盐、环己基氨基磺酸盐、奎尼酸盐、粘康酸盐等。
[0151]
如本文所用,术语“糖苷”或“糖苷的”化合物是可互换的,并且包括提及的水解时产生糖和糖苷配基的任何类别的化合物。
[0152]
如本文所用,术语“anl”或“芳基萘木脂素(aryl naphthalene lignan)”或“芳基萘木脂素(arylnaphthalene lignan)”化合物是可互换的。
[0153]
如本文所用,术语“芳基萘木脂素(aryl naphthalene lignan)”或“芳基萘木脂素(arylnaphthalene lignan)”或“anl”包括提及的包含如下所示的2,3-二甲基-1-苯基-萘的基础结构的化合物:
[0154][0155]
如本文所用,芳基萘木脂素分子的碳编号包括提及的包含如下所示的编号系统的化合物:
[0156][0157]
在一类芳基萘化合物的核心结构中,两个甲基形成γ-内酯环以变成如下所示的芳基萘并呋喃-2-酮木脂素或芳基萘并呋喃-3-酮木脂素:
[0158][0159]
如本文所用,芳基萘木脂素糖苷分子的碳编号包括提及的包含如下所示的编号系统的化合物:
[0160][0161]
如本文所用,术语“烃基”包括提及的仅由氢和碳原子组成的部分;这样的部分可
包含脂族和/或芳族部分。所述部分可包含1、2、3、4、5、6、7、 8、9、10、11、12、13、14、15、16、17、18、19或20个碳原子。烃基的实例包括c
1-6
烷基(例如,c1、c2、c3或c4烷基,例如甲基、乙基、丙基、异丙基、正丁基、仲丁基或叔丁基);被芳基(例如苄基)或者被环烷基(例如环丙基甲基)取代的c
1-6
烷基;环烷基(例如,环丙基、环丁基、环戊基或环己基);芳基(例如,苯基、萘基或芴基);c
1-6
烯基(例如,乙烯基、2
‑ꢀ
丙烯基或3-丁烯基);c
1-6
炔基(例如,乙炔基、2-丙炔基或3-丁炔基)等。
[0162]
如本文所用,术语“烷基”和“c
1-6
烷基”包括提及的具有1、2、3、4、5或 6个碳原子的直链或支链烷基部分。该术语包括提及的如甲基、乙基、丙基 (正丙基或异丙基)、丁基(正丁基、仲丁基或叔丁基)、戊基、己基等基团。特别地,烷基部分可具有1、2、3或4个碳原子。
[0163]
如本文所用,术语“烯基”包括提及的具有2、3、4、5、6、7、8、9、10、 11、12、13、14、15、16、17、18、19或20个碳原子并且另外具有至少一个双键的直链或支链烷基部分,并且在适用的情况下为e或z立体化学。该术语包括提及的如乙烯基、2-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、1-己烯基、2-己烯基和3-己烯基等基团。
[0164]
如本文所用,术语“炔基”包括提及的具有2、3、4、5、6、7、8、9、10、 11、12、13、14、15、16、17、18、19或20个碳原子并且另外具有至少一个三键的直链或支链烷基部分。该术语包括提及的如乙炔基、2-丙炔基、1
‑ꢀ
丁炔基、2-丁炔基、3-丁炔基、1-戊炔基、2-戊炔基、3-戊炔基、1-己炔基、 2-己炔基和3-己炔基等基团。
[0165]
如本文所用,术语“烷氧基”和“c
1-6
烷氧基”包括提及的-o-烷基,其中烷基是直链或支链的并且包含1、2、3、4、5或6个碳原子。在一类实施方案中,烷氧基具有1、2、3或4个碳原子。该术语包括提及的如甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、叔丁氧基、戊氧基、己氧基等基团。
[0166]
如本文所用,术语“环烷基”包括提及的具有3、4、5、6、7或8个碳原子的脂环族部分。该基团可为桥联或多环环系。更常见的环烷基是单环的。该术语包括提及的如环丙基、环丁基、环戊基、环己基、降冰片基、双环[2.2.2] 辛基等基团。
[0167]
如本文所用,术语“芳基”包括提及的包含6、7、8、9、10、11、12、13、 14、15或16个环碳原子的芳族环系。芳基通常为苯基,但可为具有两个或更多个环的多环环系,所述环中的至少一者为芳族。该术语包括提及的如苯基、萘基、芴基、薁基、茚基、蒽基等基团。
[0168]“环状基团”意指环或环系,其可为不饱和或部分不饱和的,但通常是饱和的,通常含有5至13个成环原子,例如5-或6-元环。其包括碳环基和杂环基部分。
[0169]
如本文所用,术语“碳环基”包括提及的具有3、4、5、6、7、8、9、10、 11、12、13、14、15或16个碳环原子的饱和的(例如环烷基)或不饱和的 (例如芳基)环部分。特别地,碳环基包括3-至10-元环或环系,特别是5
‑ꢀ
或-6元环,其可为饱和的或不饱和的。碳环部分例如选自环丙基、环丁基、环戊基、环己基、降冰片基、双环[2.2.2]辛基、苯基、萘基、芴基、薁基、茚基、蒽基等。
[0170]
如本文所用,术语“杂环基”包括提及的具有3、4、5、6、7、8、9、10、 11、12、13、14、15或16个环原子的饱和的(例如杂环烷基)或不饱和的 (例如杂芳基)杂环部分,所述环原子中的至少一者选自硼、氮、氧、磷、硅和硫。特别地,杂环基包括3-至10-元环或环系,更特别地5-或-6元环,其可为饱和的或不饱和的。
[0171]
杂环部分选自例如环氧乙烷基、吖丙因基、1.2-氧硫杂环戊烷基、咪唑基、噻吩基、
呋喃基、四氢呋喃基、吡喃基、噻喃基、噻蒽基、异苯并呋喃基、苯并呋喃基、色烯基、2h-吡咯基、吡咯基、吡咯啉基、吡咯烷基、吡咯里西啶基、咪唑基、咪唑烷基、苯并咪唑基、吡唑基、吡嗪基、吡唑烷基、噻唑基、异噻唑基、二噻唑基、噁唑基、异噁唑基、吡啶基、吡嗪基、嘧啶基、哌啶基、哌嗪基、哒嗪基、吗啉基、硫吗啉基,尤其是硫代吗啉基、吲哚嗪基、异吲哚基、3h-吲哚基、吲哚基、苯并咪唑基、香豆素基(cumaryl)、吲唑基、三唑基、四唑基、嘌呤基、4n-喹嗪基、异喹啉基、喹啉基、四氢喹啉基、四氢异喹啉基、十氢喹啉基、八氢异喹啉基、苯并呋喃基、二苯并呋喃基、苯并噻吩基、二苯并噻吩基、酞嗪基、萘啶基、喹喔啉基、喹唑啉基、喹唑啉基、噌啉基、蝶啶基、咔唑基、b-咔啉基、菲啶基、吖啶基、咟啶基、菲咯啉基、呋咕基、吩嗪基、吩噻嗪基、吩噁嗪基、色烯基、异色满基、色满基、1,3,2-二氧杂环戊硼烷等。
[0172]
如本文所用,术语“杂环烷基”包括提及的具有3、4、5、6或7个环碳原子以及1、2、3、4或5个选自氮、氧、磷和硫的环杂原子的饱和杂环部分。该基团可为多环环系,但更通常为单环。该术语包括如氮杂环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、环氧乙烷基、吡唑烷基、咪唑基、吲哚里西啶基、哌嗪基、四氢噻唑基、吗啉基、硫吗啉基、喹嗪基等基团。
[0173]
如本文所用,术语“杂芳基”包括提及的具有5、6、7、8、9、10、11、 12、13、14、15或16个环原子的芳族杂环环统,所述环原子中的至少一者选自氮、氧和硫。该基团可为具有两个或更多个环的多环环系,所述环中的至少一者为芳族,但更通常为单环。该术语包括提及的如嘧啶基、呋喃基、苯并噻吩基、噻吩基、吡咯基、咪唑基、吡咯烷基、吡啶基、苯并呋喃基、吡嗪基、嘌呤基、吲哚基、苯并咪唑基、喹啉基、吩噻嗪基、三嗪基、酞嗪基、2h-色烯基、噁唑基、异噁唑基、噻唑基、异吲哚基、吲唑基、嘌呤基、异喹啉基、喹唑啉基、蝶啶基等基团。
[0174]
本文所用,术语“卤素”包括提及的f、cl、br或i。
[0175]
如本文所用,表述“含卤素部分”包括提及的包含1至30个选自碳、氮、氧和硫的多价原子的部分,该部分包括至少一种卤素。该部分可为烃基,例如c
1-6
烷基或c
1-6
烷氧基,或者碳环基,例如芳基。
[0176]
如本文所用,提及到部分的术语“取代的”意指所述部分中的一个或多个,尤其是多至5个,更尤其是1、2或3个氢原子彼此独立地被相应数量的所描述取代基替代。如本文所用,术语“任选取代的”意指取代的或未取代的。当然,应当理解,取代基仅处于化学上可能的位置,本领域的技术人员无需不适当的努力就能够决定(实验上或理论上)特定的取代是否可能。
[0177]
当两个或更多个部分被描述为“各自独立地”选自原子或基团的列表时,这意味着所述部分可以相同或不同。因此,每个部分的特性独立于一个或多个其他部分的特性。
[0178]
如本文所用,术语“对映体”意指彼此具有镜像的两种立体异构体之一。
[0179]
如本文所用,术语“立体异构体”意指这样一类异构分子:其具有相同的分子式以及键合原子顺序,但它们的原子在空间上具有不同的三维取向。
[0180]
术语“互变异构体”意指易于通过化学反应相互转化的异构分子。该反应通常导致氢原子迁移,这导致单键和相邻双键的转换。
[0181]
前药是作为非活性(或小于全活性)化学衍生物给药的药物,其随后在体内通常通过正常代谢过程转化为活性药剂。
[0182]
cc
50
是测试药物抑制50%细胞生长的浓度的细胞毒性量度。
[0183]
ec
50
是测试药物抑制50%病毒生长的有效浓度的抗病毒活性量度。
[0184]
术语“选择指数”或“si”意指通过将给定cc
50
值除以测试药物的ic
50
值 (cc
50
/ic
50
)来测量细胞毒性与抗病毒活性之间的窗口的比率。更高的si比率意指测试药物在体外实验中对于给定的病毒感染将更有效且更安全。
[0185]
化学结构中的符号或或表示指定化学结构与另一化学结构键合的位置。
[0186]
化学结构中的符号“β”指示键连接在纸或屏幕平面的上方(或前方)。化学结构中的符号“α”指示键连接在纸或屏幕平面的下方(或后方)。
[0187]
化学结构中的实心楔形物指示该键在朝向观察者的纸或屏幕平面的上方(或前方)。化学结构中的虚线(或断线)楔形物指示键连接在逐渐远离观察者的纸或屏幕平面的下方(或后方)。
[0188]
本文提供了一种化合物和该化合物在制造用于治疗病毒感染的药物中的用途,以及使用该化合物在受试者中治疗病毒感染的方法,该方法包括向受试者给药治疗有效量的化合物的步骤,其中化合物具有式(i):
[0189][0190]
或其药学上可接受的盐或前药,其中
[0191]
x为氧或硫;
[0192]
r1为r
15
、-or
15
、-c(o)r
15
、或-c(o)or
15
;
[0193]
r2、r5、r6、r
10
、r
13
和r
14
各自独立地为氢或卤素;
[0194]
r3和r4各自独立地选自-or
15
和-oc(o)r
15
;或者r3和r4与它们所连接的碳原子一起形成任选地被1、2、3、4或5个独立地选自r
16
的基团取代的5-6元杂环基;
[0195]
r7、r8和r9各自独立地选自-or
15
和-oc(o)r
15
;或者r7和r8与它们所连接的碳原子一起形成任选地被1、2、3、4或5个独立地选自r
16
的基团取代的5-6元杂环基;或者r8和r9与它们所连接的碳原子一起形成任选地被 1、2、3、4或5个独立地选自r
16
的基团取代的5-6元杂环基;
[0196]r11
和r
12
一起形成氧代基;或者在r
11
和r
12
中的一者为氢或卤素时, r
11
和r
12
中的另一者选自r
15
、-or
15
、-c(o)r
15
和-c(o)or
15
;
[0197]r15
在每次出现时独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、杂芳基、-or
17
、-c(o)r
18
、-c(o)n(r
17
)r
18
、-c(o)or
17
、-oc(o)r
17
、
‑ꢀ
s(o)2r
17
、-s(o)2n(r
17
)r
18
、-n=c(r
17
)r
18
、-n(r
17
)r
18
、-n(r
17
)n(r
17
)r
18
、
‑ꢀ
n(r
17
)c(o)r
18
、-n(r
17
)s(o)2r
18
、任选地被1、2、3、或4个独立地选自烷基的基团取代的1,3,2-二氧杂环戊硼烷、糖苷基团、任选地被三烷基硅烷取代的炔基、任选地被1、2、3、4或5个独立地选自r
16
的基团取代的烃基、任选地被1、2、3、4或
5个独立地选自r
16
的基团取代的杂环基,以及任选地被1、2、3、4或5个独立地选自r
16
的基团取代的-(ch2)
k-杂环基,其中k 为1-6的整数;
[0198]r16
在每次出现时独立地选自炔基、卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
17
、-or
17
、-c(o)r
18
、-c(o)n(r
17
)r
18
、-c(o)or
17
、-oc(o)r
17
、
ꢀ‑
s(o)2r
17
、-s(o)2n(r
17
)r
18
、-n(r
17
)r
18
、-n(r
17
)n(r
17
)r
18
、-n(r
17
)c(o)r
18
和
ꢀ‑
n(r
17
)s(o)2r
18
;并且
[0199]r17
和r
18
在每次出现时独立地为氢、烷基、炔基、环烷基、芳基、或杂芳基,或者选自烃基和杂环基,其任一者任选地被1、2、3、4或5个独立地选自卤素、三氯甲基、三氟甲基、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代。
[0200]
在某些实施方案中,式(i)的化合物不为选自5、15a、15b、16、17b、19d、 25a-25g和26a-26g的化合物:
[0201]
[0202][0203]
在某些实施方案中,r1为氢、烷基、芳基、杂芳基(如呋喃、噻吩、吡啶等)、-n(r
17
)r
18
、-n=c(r
17
)(r
18
)、任选地被三烷基硅烷取代的炔基、糖苷基团、任选地被1、2、3、或4个独立地选自烷基的基团取代的1,3,2-二氧杂环戊硼烷、或-o-(cr2)
m-r
16
,其中m为选自1-4、1-3、或1-2的整数;r在每次出现时独立地为氢、烷基、环烷基、或芳基;并且r
16
为炔基、氰基、
‑ꢀ
or
17
、-n(r
17
)r
18
、-c(o)n(r
17
)r
18
、或-c(o)or
17
。
[0204]
在某些实施方案中,r1为-o-ch
2-r
16
,其中r
16
为-c≡ch、氰基、-or
17
、
ꢀ‑
n(r
17
)r
18
、-c(o)n(r
17
)r
18
、或-c(o)or
17
。
[0205]
在某些实施方案中,r3和r4中的每者独立地选自-or
15
和-oc(o)r
15
,其中r
15
为氢、烷基、环烷基、杂环基、芳基和杂芳基;或者r3和r4与它们所连接的碳原子一起形成5-6元杂环基。在某些实施方案中,r3和r4为
‑ꢀ
or
15
,其中r
15
为c
1-c6烷基、c
1-c4烷基、或c
1-c2烷基。
[0206]
在某些实施方案中,r8和r9中的每者独立地选自-or
15
和-oc(o)r
15
,其中r
15
为氢、烷基、环烷基、杂环基、芳基和杂芳基;或者r8和r9与它们所连接的碳原子一起形成5-6元杂环基。在某些实施方案中,r8和r9与它们所连接的碳原子一起形成亚甲二氧基环。
[0207]
在某些实施方案中,r
11
和r
12
一起形成氧代基。
[0208]
在某些实施方案中,r3和r4中的每者为-o-烷基;r8和r9与它们所连接的碳原子一起形成亚甲二氧基环;r1为杂芳基、-or
15
、-c(o)r
15
、-n(r
17
)r
18
、
ꢀ‑
n(r
17
)c(o)r
18
、-n=c(r
17
)r
18
、频哪醇硼基、-os(o)2cf3、糖苷基团、任选地被1或2个独立地选自r
16
的基团取代的杂环
基、或任选地被三烷基硅烷取代的炔基;或者r1为-och
2-氰基、-och
2-c≡ch、-och
2-c(o)n(r
17
)r
18
、或-c(o)or
17
;并且r
11
和r
12
一起形成氧代基。
[0209]
在某些实施方案中,化合物是所选择的化合物12a、12b、13、14a、14b、 17a、17c、17d、17e、17f、17g、17h、18、19a、19b、19c、19e、19f、19g、 19h、19i、19j、19k、19l、19m、19n、19o、19p、20、21、22、23和24:
[0210]
[0211][0212]
在某些实施方案中,r1为由式(v)表示的糖苷基团:
[0213][0214]
其中r
19
和r
20
一起形成氧代基;或者在r
19
和r
20
中的一者为氢或卤素时,r
19
和r
20
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
和
ꢀ‑
oc(o)or
27
;
[0215]r21
和r
22
一起形成氧代基;或者在r
21
和r
22
中的一者为氢或卤素时, r
21
和r
22
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
和
‑ꢀ
oc(o)or
27
;或者r
20
和r
22
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代;
[0216]r23
和r
24
一起形成氧代基;或者在r
23
和r
24
中的一者为氢或卤素时, r
23
和r
24
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
和
‑ꢀ
oc(o)or
27
;或者r
22
和r
24
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代;
[0217]r25
和r
26
一起形成氧代基;或者在r
25
和r
26
中的一者为氢或卤素时, r
25
和r
26
中的另一者选自r
27
、-or
27
、-oc(o)r
27
、-oc(o)n(r
27
)r
27
、
‑ꢀ
oc(o)or
27
、-ch2r
27
和-c(o)r
27
;或者r
24
和r
26
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代;
[0218]r27
在每次出现时独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、-or
29
、-c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、
ꢀ‑
s(o)2n(r
29
)r
30
、-n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
、
‑ꢀ
n(r
29
)s(o)2r
30
、任选地被1、2、3、4或5个独立地选自r
28
的基团取代的烃基、任选地被1、2、3、4或5个独立地选自r
28
的基团取代的杂环基,以及任选地被1、2、3、4或5个独立地选自r
28
的基团取代的-(ch2)
k-杂环基,其中k为1-6的整数;
[0219]r28
在每次出现时独立地选自卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
29
、-or
29
、-c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、
ꢀ‑
s(o)2r
29
、-s(o)2n(r
29
)r
30
、-n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
和
ꢀ‑
n(r
29
)s(o)2r
30
;并且
[0220]r29
和r
30
在每次出现时各自独立地为氢,或者选自烃基和杂环基,其任一者任选地被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代。
[0221]
在某些实施方案中,糖苷基团为单糖、二糖、三糖、四糖或多糖基团,并且能够以任何异构形式(例如α-d、α-l、β-d或β-l形式)存在。在某些实施方案中,糖苷是选自α-l异构体和β-l异构体的单糖。
[0222]
在某些实施方案中,r
19
、r
21
、r
23
和r
25
各自为氢;r
20
、r
22
和r
24
各自独立地选自-or
27
、-oc(o)n(r
27
)r
27
、-oc(o)r
27
和-oc(o)or
27
;并且r
26
为氢、甲基、-or
27
、-oc(o)r
27
或-ch
2-oc(o)r
27
;或者r
20
和r
22
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、3、4或 5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;或者r
22
和r
24
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、3、4 或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;或者r
24
和r
26
与它们所连接的碳原子一起形成5-6元杂环基,该5-6元杂环基任选地被1、2、 3、4或5个独立地选自c
1-6
烷基和c
1-6
烷氧基的基团取代;并且糖苷是单糖。
[0223]
在某些实施方案中,r
20
、r
22
和r
24
各自独立地选自-or
27
、
‑ꢀ
oc(o)n(r
27
)r
27
、-oc(o)r
27
和-oc(o)or
27
,其中r
27
在每次出现时独立地选自氢、烷基、环烷基、烯基、芳基、芳烷基、杂芳基、全卤代烷基和-c(o)ch2cn。
[0224]
在r1为糖苷基团的情况下,化合物可选自:27aa、27ab、27ac、27ad、 27ae、27af、27ba、27bb、27bc、27bd、27be、27bf、28ab1、28ab2、28ab3、 28bb1、28bb2、28bb3、29a、29b、30a、30b、30c、30d、30e、30f、30g、 30h、30i、30j、30k、30l、31a、31b、31c、31d、31e、31f、31g、31h、31i、 31j、31k、31l、32a、32b、32c和32d:
[0225]
[0226]
[0227]
[0228][0229]
本公开还提供了可用于治疗病毒感染的芳基萘糖苷化合物,包括山荷叶素、patentiflorin a、爵谱卡明(justiprocumin)a或爵谱卡明b的衍生物。
[0230]
在某些实施方案中,化合物具有式(i)或(ii):
[0231][0232]
或其立体异构体;或其对映体;或其药学上可接受的盐或前药,其中
[0233]
x为氧或硫;
[0234]
r1、r2、r3、r4、r5、r6、r7、r8、r9和r
10
各自独立地为氢、卤素、或包含1至30个选自碳、氮、氧和硫的多价原子的部分;或者r2和r3、r3和r4、r4和r5、r6和r7、r7和r8、r8和r9、或r9和r
10
可以与它们所连接的碳原子一起形成环状基团,该环状基团任选地被卤素以及包含1至30 个选自碳、氮、氧和硫的多价原子的部分取代;
[0235]r11
和r
12
一起形成氧代基;或者在r
11
和r
12
中的一者为氢或卤素时, r
11
和r
12
中的另一者选自r
15
、-or
15
、-c(o)r
15
和-c(o)or
15
;
[0236]r13
和r
14
一起形成氧代基;或者在r
13
和r
14
中的一者为氢或卤素时, r
13
和r
14
中的另一者选自r
15
、-or
15
、-c(o)r
15
和-c(o)or
15
;
[0237]r15
独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、任选地被 1、2、3、4或5个r
16
取代的烃基、任选地被1、2、3、4或5个r
16
取代的杂环基、任选地被1、2、3、4或5个r
16
取代的-(ch2)
k-杂环基、-or
17
、
‑ꢀ
c(o)r
18
、-c(o)n(r
17
)r
18
、-c(o)or
17
、-oc(o)r
17
、-s(o)2r
17
、-s(o)2n(r
17
)r
18
、
ꢀ‑
n(r
17
)r
18
、-n(r
17
)n(r
17
)r
18
、-n(r
17
)c(o)r
18
和-n(r
17
)s(o)2r
18
,其中k为1 至6的整数(例如1、2或3);
[0238]r16
独立地选自卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
17
、
ꢀ‑
or
17
、-c(o)r
18
、-c(o)n(r
17
)r
18
、-c(o)or
17
、-oc(o)r
17
、-s(o)2r
17
、
‑ꢀ
s(o)2n(r
17
)r
18
、-n(r
17
)r
18
、-n(r
17
)n(r
17
)r
18
、-n(r
17
)c(o)r
18
和
‑ꢀ
n(r
17
)s(o)2r
18
;并且
[0239]r17
和r
18
各自独立地为氢,或者选自烃基和杂环基,其任一者任选地被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的取代基取代。
[0240]
在某些实施方案中,化合物具有式(iii)或(iv):
[0241][0242]
或其立体异构体;或其对映体;其药学上可接受的盐或前药,其中
[0243]
x为硫或氧;
[0244]
r1、r2、r3、r4、r5、r6、r7、r8和r9各自独立地为氢、卤素、或包含1至30个选自碳、氮、氧和硫的多价原子的部分;或者r1和r2、r2和r3、 r3和r4、r5和r6、r6和r7、r7和r8、和/或r8和r9与它们所连接的碳原子一起形成环状基团,该环状基团任选地被1、2、3、4或5个选自卤素以及包含1至30个选自碳、氮、氧和硫的多价原子的部分的基团取代;
[0245]r10
和r
11
一起形成氧代基;或者在r
10
和r
11
中的一者为氢或卤素时, r
10
和r
11
中的另一者选自r
22
、-or
22
、-c(o)r
22
和-c(o)or
22
;
[0246]r12
和r
13
一起形成氧代基;或者在r
12
和r
13
中的一者为氢或卤素时, r
12
和r
13
中的另一者选自r
22
、-or
22
、-c(o)r
22
和-c(o)or
22
;
[0247]r19
和r
20
一起形成氧代基;或者在r
19
和r
20
中的一者为氢或卤素时, r
19
和r
20
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖和取代的四糖;
[0248]r21
和r
22
一起形成氧代基;或者在r
21
和r
22
中的一者为氢或卤素时, r
16
和r
17
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖和取代的四糖;
[0249]r23
和r
24
一起形成氧代基;或者在r
23
和r
24
中的一者为氢或卤素时, r
23
和r
24
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖和取代的四糖;
[0250]r25
和r
26
一起形成氧代基;或者在r
25
和r
26
中的一者为氢或卤素时, r
25
和r
26
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、-ch2r
31
和
‑ꢀ
c(o)r
31
;
[0251]r27
独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、-or
29
、
ꢀ‑
c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、-s(o)2n(r
29
)r
30
、
ꢀ‑
n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
、-n(r
29
)s(o)2r
30
、任选地被1、 2、3、4或5个选自r
23
的基团取代的烃基、任选地被1、2、3、4或5个选自r
28
的基团取代的杂环基,以及任选地被1、2、3、4或5个选自独立选择的r
28
基团的基团取代的-(ch2)
k-杂环基,其中k为1至6的整数(例如1、 2或3);
[0252]r28
独立地选自卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
29
、
ꢀ‑
or
29
、-c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、
‑ꢀ
s(o)2n(r
29
)r
30
、-n(r
29
)r
30
、-n
(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
和
‑ꢀ
n(r
29
)s(o)2r
30
;
[0253]r29
和r
30
各自独立地为氢,或者选自烃基和杂环基,其任一者任选地被 1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代;
[0254]r31
独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、-or
29
、
ꢀ‑
c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、-s(o)2n(r
29
)r
30
、
ꢀ‑
n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
、-n(r
29
)s(o)2r
30
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖、取代的四糖、任选地被1、2、3、4或5个选自r
28
的基团取代的烃基,以及任选地被1、2、 3、4或5个选自r
28
的基团取代的杂环基;并且
[0255]
r为氢,或者选自烃基和杂环基,其任一者任选地被1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代。
[0256]
在某些实施方案中,糖苷基团可为碳水化合物基团,如单糖、二糖、三糖、四糖或多糖基团,并且能够以任何异构形式(例如α-d、α-l、β-d或β
‑ꢀ
l形式)存在。碳水化合物基团可任选地被其他类型的取代基或甚至额外的糖苷基团取代。然而,化合物的化学结构中所含的单糖和取代的单糖的总数量通常为30或更少。
[0257]
在某些实施方案中,糖苷基团可包含一个或多个式(v)或(vi)的单糖单元:
[0258][0259]
其中r
19
和r
20
一起形成氧代基;或者在r
19
和r
20
中的一者为氢或卤素时,r
19
和r
20
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖和取代的四糖;
[0260]r21
和r
22
一起形成氧代基;或者在r
21
和r
22
中的一者为氢或卤素时,r
21
和r
22
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖和取代的四糖;
[0261]r23
和r
24
一起形成氧代基;或者在r
23
和r
24
中的一者为氢或卤素时, r
23
和r
24
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖和取代的四糖;
[0262]r25
和r
26
一起形成氧代基;或者在r
25
和r
26
中的一者为氢或卤素时, r
25
和r
26
中的另一者选自r
27
、-or
27
、-c(o)r
27
、-c(o)or
27
、-ch2r
31
和
‑ꢀ
c(o)r
31
;
[0263]r27
独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、-or
29
、
ꢀ‑
c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、-s(o)2n(r
29
)r
30
、
ꢀ‑
n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
、-n(r
29
)s(o)2r
30
、任选地被1、 2、3、4或5个独立地选自r
28
的基团取代的烃基、任选地被1、2、3、4或 5个独立地选自r
28
的基团取代的杂环基,以及任选地被1、2、3、4或5个独立地选自r
28
的基团取代的-(ch2)
k-杂环基,其中k为1至6的整数(例如 1、2或3);
[0264]r28
独立地选自卤素、三氯甲基、三氟甲基、氰基、硝基、氧代基、=nr
29
、
ꢀ‑
or
29
、-c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、
‑ꢀ
s(o)2n(r
29
)r
30
、-n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
和
‑ꢀ
n(r
29
)s(o)2r
30
;
[0265]r29
和r
30
各自独立地为氢,或者选自烃基和杂环基,其任一者任选地被 1、2、3、4或5个独立地选自卤素、氰基、氨基、羟基、c
1-6
烷基和c
1-6
烷氧基的基团取代;并且
[0266]r31
独立地选自氢、卤素、三氯甲基、三氟甲基、氰基、硝基、-or
29
、-c(o)r
30
、-c(o)n(r
29
)r
30
、-c(o)or
29
、-oc(o)r
29
、-s(o)2r
29
、-s(o)2n(r
29
)r
30
、
ꢀ‑
n(r
29
)r
30
、-n(r
29
)n(r
29
)r
30
、-n(r
29
)c(o)r
30
、-n(r
29
)s(o)2r
30
、单糖、取代的单糖、二糖、取代的二糖、三糖、取代的三糖、四糖、取代的四糖、任选地被1、2、3、4或5个独立地选自r
28
的基团取代的烃基、任选地被1、2、 3、4或5个独立地选自r
28
的基团取代的杂环基,以及任选地被1、2、3、 4或5个独立地选自r
28
的基团取代的-(ch2)
k-杂环基,其中k为1至6的整数(例如1、2或3)。
[0267]
在某些实施方案中,糖苷基团包含1、2、3、或4个单糖单元,其中糖苷基团中的每个单糖单元在每次出现时独立地为式(iii)或式(iv)的单糖单元。
[0268]
在某些实施方案中,r1、r4、r5、r8和r9各自独立地为氢、羟基或甲氧基;r2和r3各自独立地为氢、羟基、甲氧基,或者与它们所连接的碳原子一起形成[1,3]间二氧杂环戊烯环状基团;r6和r7各自独立地为氢、羟基、甲氧基;或者r6和r7与它们所连接的碳原子一起形成[1,3]间二氧杂环戊烯环状基团;r
10
和r
11
一起形成氧代基;r
12
和r
13
各自独立地为氢;并且x 为氧。
[0269]
示例性糖苷基团包括吡喃葡萄糖苷、吡喃半乳糖苷、吡喃甘露糖苷、吡喃岩藻糖苷、吡喃阿拉伯糖苷、吡喃葡萄糖苷、吡喃半乳糖苷、葡糖苷酸、吡喃乳糖苷、吡喃木糖苷、氨基葡萄糖苷、氨基半乳糖苷、阿洛糖苷(alloside)、来苏糖苷、塔洛糖苷(taloside)、苏糖苷(threoside)、核糖苷、果糖苷、鼠李糖苷和葡萄糖苷(guloside)基团。更特别地,糖苷基团可选自α-d-吡喃葡萄糖苷、α-d-吡喃半乳糖苷、α-d-吡喃甘露糖苷、α-l-吡喃岩藻糖苷、α-l-吡喃阿拉伯糖苷、β-d-吡喃葡萄糖苷、β-d-吡喃半乳糖苷、β-d-葡糖苷酸、β-d-吡喃乳糖苷、β-d-吡喃木糖苷、β-d-氨基葡萄糖苷、β-d-氨基半乳糖苷、β-d-阿洛糖苷、β-d-来苏糖苷、β-d-塔洛糖苷、β-d-苏糖苷、β-d-核糖苷、β-d-果糖苷、β-d-鼠李糖苷和β-l-葡萄糖苷基团。
[0270]
本公开的化合物的实例包括以下所示的那些。当然,应当理解,在适当的情况下,每种化合物可为游离化合物、酸或碱加成盐、或前药的形式。
[0271]
本公开还提供了一种药物组合物,该药物组合物包含至少一种本文所述的化合物以及至少一种药学上可接受的赋形剂。
[0272]
根据标准药学实践,本文所述的化合物及其药学上可接受的盐可以单独地或者与药学上可接受的赋形剂、载体和/或稀释剂组合地以药物组合物给药于受试者。化合物可以口服或胃肠外给药。肠胃外给药包括静脉内、肌内、腹膜内、皮下和局部,优选的方法是静脉内和局部给药。
[0273]
因此,本公开提供了药学上可接受的组合物,该药学上可接受的组合物包含治疗有效量的一种或多种本文所述的化合物,所述化合物与一种或多种药学上可接受的赋形剂、载体(添加剂)和/或稀释剂一起配制。本公开的药物组合物可以尤其配制用于以固体或液体形式给药,包括适于以下的那些: (1)肠胃外给药,例如,通过皮下、肌内、静脉内或硬膜外注射,作为例子如无菌溶液或混悬剂、或持续释放制剂;以及(2)口服给药,例如,灌服剂 (水性或非水性溶液或混悬剂)、片剂(例如,针对颊面、舌下和全身吸收的那些)、大丸剂、散剂、颗粒剂、用于施用于舌的糊剂。
[0274]
如本文所陈述,本文所述的化合物的某些实施方案可含有碱性官能团,如氨基,并因此能够与药学上可接受的酸形成药学上可接受的盐。在这方面,术语“药学上可接受的盐”是指本公开的化合物的相对无毒的无机和有机酸加成盐。这些盐可在给药媒介物或剂型制造过程中原位制备,或者通过使经纯化的呈其游离碱形式的本发明化合物与合适的有机或无机酸单独地反应,并且在后续纯化期间分离由此形成的盐来制备。代表性的盐包括氢溴酸盐、盐酸盐、硫酸盐、硫酸氢盐、硝酸盐、乙酸盐、戊酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、苯甲酸盐、乳酸盐、磷酸盐、甲苯磺酸盐、柠檬酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐、萘酸盐、甲磺酸盐、葡庚糖酸盐、乳糖酸盐和月桂基磺酸盐等。
[0275]
本公开的化合物的药学上可接受的盐包括化合物的常规无毒盐或季铵盐,例如来自无毒有机或无机酸。例如,这样的常规无毒盐包括衍生自无机酸的那些,所述无机酸如盐酸、氢溴酸、硫酸、氨基磺酸、磷酸、硝酸等;以及由有机酸制备的盐,所述有机酸如乙酸、丙酸、琥珀酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、棕榈酸、马来酸、羟基马来酸、苯乙酸、谷氨酸、苯甲酸、水杨酸、磺胺酸、2-乙酰氧基苯甲酸、富马酸、甲苯磺酸、甲磺酸、乙烷二磺酸、草酸、异硫羰酸等。
[0276]
在其他情况下,本文所述的化合物可以含有一个或多个酸性官能团,并因此能够与药学上可接受的碱形成药学上可接受的盐。在这些情况下,术语“药学上可接受的盐”是指本公开的化合物的相对无毒的无机和有机碱加成盐。这些盐同样可在给药媒介物或剂型制备过程中原位制备,或者通过使经纯化的呈其游离酸形式的化合物与合适的碱(如药学上可接受的金属阳离子的氢氧化物、碳酸盐或碳酸氢盐),与氨,或者与药学上可接受的有机伯胺、仲胺或叔胺单独地反应来制备。代表性的碱金属或碱土金属盐包括锂、钠、钾、钙、镁和铝盐等。可用于形成碱加成盐的代表性有机胺包括乙胺、二乙胺、乙二胺、乙醇胺、二乙醇胺、哌嗪等。
[0277]
润湿剂、乳化剂和润滑剂(如月桂基硫酸钠和硬脂酸镁),以及着色剂、释放剂、包衣剂、甜味剂、矫味剂和芳香剂、防腐剂、增溶剂、缓冲剂和抗氧化剂也可存在于组合物中。
[0278]
制备这些制剂或化合物的方法包括使本文所述的化合物与载体或赋形剂以及任选地一种或多种辅助成分结合的步骤。通常,通过将本公开的化合物与液体载体(液体制剂)、液体载体继之以冻干(用于经无菌水等重构的粉末制剂)、或细粒固体载体、或这两者均匀且紧密地结合,然后根据需要使产物成形或包装来制备制剂。
[0279]
适用于肠胃外给药的本公开的药物组合物包含一种或多种本文所述的化合物,该化合物组合有一种或多种药学上可接受的无菌等渗水性或非水性溶液、分散体、混悬剂或乳剂、或者可在临用前重构为无菌可注射溶液或分散体的无菌粉末,其可含有糖、醇、抗氧化剂、缓冲剂、抑菌剂、螯合剂、使得制剂与预期受体的血液等渗的溶质或悬浮剂或增稠剂。
[0280]
可用于本公开的药物组合物中的合适的水性和非水性载体的实例包括水、乙醇、多元醇(如甘油、丙二醇、聚乙二醇等)以及它们的合适的混合物、植物油(如橄榄油)和可注射有机酯(如油酸乙酯)。适当的流动性可例如通过使用如卵磷脂的包衣材料,通过在分散体的情况下维持所需的粒度,以及通过使用表面活性剂来维持。
[0281]
这些组合物还可以含有佐剂,如防腐剂、润湿剂、乳化剂和分散剂。可以通过包含各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸等来确保防止微生物对本公开的化合物的作用。还可期望在组合物中包括等渗剂,如糖、氯化钠等。此外,可注
射药物形式的延长吸收可以通过包含延缓吸收的试剂如单硬脂酸铝和明胶来实现。
[0282]
本公开提供了具有抗hiv和抗流感病毒活性的山荷叶素和patentiflorin a类似物以及它们的合成。合成本公开的化合物并且评价它们的抗hiv和抗流感病毒活性。
[0283]
山荷叶素的合成或半合成类似物的例示可为12a、12b、13、14a、14b、 15a、15b、16、17a、17b、17c、17d、17e、17f、17g、17h、18、19a、19b、 19c、19d、19e、19f、19g、19h、19i、19j、19k、19l、19m、19n、19o、19p、 20、21、22、23和24。
[0284]
patentiflorin a的合成或半合成类似物的例示可为25a、25b、25c、25d、 25e、25f、25g、26a、26b、26c、26d、26e、26f、26g、27aa、27ab、27ac、 27ad、27ae、27af、27ba、27bb、27bc、27bd、27be、27bf、28ab1、28ab2、 28ab3、28bb1、28bb2、28bb3、29a、29b、30a、30b、30c、30d、30e、30f、 30g、30h、30i、30j、30k、30l、31a、31b、31c、31d、31e、31f、31g、31h、 31i、31j、31k、31l、32a、32b、32c和32d。
[0285]
[0286]
[0287]
[0288]
[0289]
[0290]
[0291][0292]
实施例
[0293]
下文阐述以下实施例以示出根据所公开的主题的方法和结果。这些实施例不旨在包括本文所公开的主题的所有方面,而是示出代表性的方法、组合物和结果。这些实施例并不旨在排除本发明的等同物和变型形式,其对于本领域的技术人员是显而易见的。
[0294]
除非另外说明,份为重量份,温度为℃或者为环境温度,并且压力等于或接近大气压。存在反应条件的多种变型形式和组合,例如组分浓度、温度、压力,以及可用于优化由所描述过程获得的产物纯度和收率的其他反应范围和条件。仅需要合理和常规的实验来优化这样的过程条件。
[0295]
本公开的化合物的实例包括以下所示的那些。当然,应当理解,在适当的情况下,每种化合物可为游离化合物、酸或碱加成盐、或前药的形式。
[0296]
通过使用山荷叶素(5)作为结构骨架,其在c-7上的c-o衍生化的一般合成路线示于图2中。酯12a和12b由5通过取代反应进行制备。酯12a 的酸性水解提供酸13,其通过在1-[双(二甲氨基)亚甲基]-1h-1,2,3-三唑并 [4,5-b]吡啶鎓3-氧化物六氟磷酸盐(hatu)或1-羟基苯并三唑水合物(hobt) 存在下与氯化铵(nh4cl)或胺偶联而转化为酰胺14a和14b。o-烷氧基醇15a和15b分别由5与相应的环氧化物即环氧乙烷和甲基环氧丙烷反应而获得。衍生物17a-17h分别在一个步骤中由5制备。将5用碳酸铯(cs2co3),继之以溴乙腈、碘甲烷或炔丙基溴烷基化,分别得到衍生物17a-17c。在100℃,将碳酸钾(k2co3)和2-氯嘧啶添加到含5的二甲基甲酰胺(dmf)中,提供化合物17d。类似地,将三甲胺(me3n)、4-二甲基氨基吡啶(dmap)和相应的酰氯添加到5中,以分别给出17e-17h。c-7烷基衍生物的合成(图 3)设想将5转化为相应的三氟甲磺酸盐18,其将经历钯催化的偶联反应,以得到衍生物19a-19p和20-24。
[0297]
制备图4所概述的含有不同糖单元的anl类似物和化合物25a-25g和 26a-26g,并对其进一步修饰,以提供图5所概述的额外的anl类似物27aa
‑ꢀ
27bf、28ab1-28bb3、29a、29b、30a-30l和31a-30l。
[0298]
在c-7处用不同的糖单元(a-g)糖基化山荷叶素(5),分别合成一系列山荷叶素糖苷(26a-26g)(图4)。该合成涉及通过全乙酰化糖苷的溴化反应,随后在四丁基溴化铵(tbab)存在下在40℃用0.1mol/l氢氧化钠水溶液 (naoh)对其进行相转移催化(ptc)糖基化处理来产生溴代糖。所得的全乙酰基糖苷25a-25g随后用k2co3在甲醇(meoh)中脱乙酰化,以分别得到脱保护的糖苷26a-26g。
[0299]
为了显著增加anl文库化合物的数量,建议对anl的糖单元中的羟基进行进一步的结构修饰(图5)。首先,由乙酸酐(ac2o)和四丁基乙酸铵 (tboac)与相应的26a和26b的反应制备3
”‑
o-乙酰基山荷叶素糖苷27aa
‑ꢀ
27af和27ba-27bf。通过硅胶柱色谱法分离26a的反应混合物,得到六种单一化合物27aa-27af(27aa、27ab、27ac、27ad、27ae和27af)。通过硅胶柱色谱法分离26b的反应混合物,得到六种单一化合物27ba-27bf(27ba、 27bb、27bc、27bd、27be和27bf)。用氯甲酸烯丙酯(allococl)处理化合物27ab或27bb,以给出双保护的anl糖苷,即相应的28ab1-28ab3和 28bb1-28bb3。通过硅胶柱色谱法分离27ab的反应混合物,得到三种单一化合物28ab1-28ab3(28ab1、28ab2和28ab3)。通过硅胶柱色谱法分离27bb 的反应混合物,得到三种单一化合物28bb1-28ab3(28bb1、28bb2和28bb3)。通过用乙酰氯(accl)进一步处理来移除化合物28ab3或28bb3中的乙酰基,以分别给出双氯甲酸酯保护的anl糖苷29a和29b。用三乙胺(et3n) 和dmap,继之以不同的酰氯取代29a或29b,分别得到衍生物30a-k。在室温将氢氧化钾(koh)、18-冠醚-6和苄基溴添加到含29a的四氢呋喃(thf) 中,提供化合物30l。通过用thf中的四(三苯基膦)钯(0)[pd(pph3)4]、三苯基膦(pph3)、et3n和hcooh处理,使30a-l的两个烯丙基脱保护,以分别产生衍生物31a-l。
[0300]
本文所述的化合物可表现出广泛的抗病毒性。根据本公开的方法,将式 (i)的化合物给药于患者以抑制病毒(如hiv、冠状病毒、埃博拉病毒、马尔堡病毒或流感病毒)的复制或者减少病毒的细胞病变效应。可被式(i)的化合物抑制的其他病毒包括但不限于巨细胞病毒(cmv)、hsv-1(1型单纯疱疹病毒)、hsv-2(2型单纯疱疹病毒)、hbv(乙型肝炎病毒)、hcv(丙型肝炎病毒)、hpv(人乳头状瘤病毒)、甲型流感、乙型流感、rsv(呼吸道合胞病毒)、rv(鼻病毒)、av(腺病毒)、piv(人副流感病毒)、巴二氏病毒 (ebv)、水痘带状疱疹病毒(vzv)、登革病毒和寨卡病毒。
[0301]
本文所述的化合物、药物组合物和治疗方法可用于预防或治疗或改善 hiv感染。
[0302]
本文所述的化合物、药物组合物和治疗方法可用于预防、治疗、或改善由流感病毒引起的感染,包括但不限于:甲型流感、乙型流感、或丙型流感的任何亚型。
[0303]
在某些实施方案中,本文所公开的化合物、药物组合物和治疗方法可用于预防、治疗、或改善由甲型流感病毒引起的感染,包括但不限于毒株h1n1、 h1n2、h1n3、h1n4、h1n5、hin6、h1n7、hin8、h1n9、h2n1、h2n2、 h2n3、h2n4、h2n5、h2n6、h2n7、h2n8、h2n9、h3n1、h3n2、h3n3、 h3n4、h3n5、h3n6、h3n7、h3n8、h3n9、h4n1、h5n2、h5n3、h5n4、 h5n5、h5n6、h5n7、h5n8、h5n9、h6n1、h6n2、h6n3、h6n4、h6n5、 h6n6、h6n7、h6n8、h6n9、h7n1、h7n2、h7n3、h7n4、h7n5、h7n6、 h7n7、h7n8、h7n9、h8n1、h8n2、h8n3、h8n4、h8n5、h8n6、h8n7、 h8n8、h8n9、h9n1、h9n2、h9n3、h9n4、h9n5、h9n6、h9n7、h9n8、 h9n9、h10n1、h10n2、h10n3、h10n4、h10n5、h10n6、
h10n7、h10n8、 h10n9、h11n1、h11n2、h11n3、h11n4、h11n5、h11n6、h11n7、hi1n8、 h11n9、h12n1、h12n2、h12n3、h12n4、h12n5、h12n6、h12n7、h12n8、 h12n9、h13n1、h13n2、h13n3、h13n4、h13n5、h13n6、h13n7、h13n8、 h13n9、h14n1、h14n2、h14n3、h14n4、h14n5、h14n6、h14n7、h14n8、h14n9、h15n1、h15n2、h15n3、h15n4、h15n5、h15n6、h1n7、h15n8 和h15n9中的任一者。
[0304]
在某些实施方案中,本文所公开的化合物、药物组合物和治疗方法可用于预防、治疗、或改善由具有5型血凝素蛋白的甲型流感病毒株引起的感染。在某些实施方案中,甲型流感病毒株具有5型血凝素蛋白以及选自1至11 型的神经氨酸酶蛋白。在某些实施方案中,甲型流感病毒选自h5n1和h5n2。
[0305]
在某些实施方案中,本文所公开的化合物、药物组合物和治疗方法可用于预防、治疗、或改善由h5n1引起的感染。
[0306]
如本文所用,术语“hiv”是指人类免疫缺陷病毒,并且包括hiv-1、hiv
‑ꢀ
2和siv。在某些实施方案中,hiv是指hiv-1和/或hiv-2。“hiv-1”意指1 型人类免疫缺陷病毒。hiv-1可包括但不限于细胞外病毒颗粒以及与hiv-1 感染的细胞相关的hiv-1形式。hiv-1病毒可包括任何已知的主要亚型(a、 b、c、d、e、f、g和h类)或偏远亚型(o组),包括实验室毒株和原代分离株。“hiv-2”意指2型人类免疫缺陷病毒。hiv-2可包括但不限于细胞外病毒颗粒以及与hiv-2感染的细胞相关的hiv-2形式。术语“siv”是指猿猴免疫缺陷病毒,其为感染猴、黑猩猩和其他非人灵长类的hiv样病毒。siv 可包括但不限于细胞外病毒颗粒以及与siv感染的细胞相关的siv形式。
[0307]
在某些实施方案中,本文所公开的化合物、药物组合物和治疗方法可用于预防、治疗、或改善由hiv-1和/或hiv-2引起的感染。在某些实施方案中,本文所公开的化合物、药物组合物和治疗方法可用于预防、治疗、或改善由hiv-1亚型b引起的感染。
[0308]
在某些实施方案中,本文所公开的化合物、药物组合物和治疗方法可用于预防、治疗、或改善由siv引起的感染。
[0309]
本文所述的化合物、药物组合物和治疗方法可用于预防、治疗、或改善由包括但不限于以下的线状病毒引起的感染:马尔堡病毒、扎伊尔埃博拉病毒、苏丹埃博拉病毒、科特迪瓦埃博拉病毒、雷斯顿埃博拉病毒和本迪布焦型埃博拉病毒。
[0310]
本文所述的化合物、药物组合物和治疗方法可用于预防、治疗、或改善由冠状病毒(包括但不限于sars-cov-2、sars-cov和mers-cov)引起的感染。
[0311]
使用“一石二鸟”假型测定进行抗病毒评价.
[0312]
hiv假病毒体的产生.该方案被设计成用于鉴定hiv、冠状病毒、埃博拉病毒、马尔堡病毒和流感病毒复制(入浸(post entry)步骤)的潜在抑制剂。分别通过如下方式产生hiv/vsvg或hiv/sarsp或hiv/ha或hiv/ebov 或hiv/marv病毒体:将0.5μg vsvg(水泡性口炎病毒糖蛋白)包膜表达质粒、0.5μg sarsp(sars-cov-2突刺蛋白)表达质粒或0.5μg血凝素(ha) 包膜表达质粒与0.5μg神经氨酸酶(na)表达质粒或0.5μg ebvg(埃博拉病毒糖蛋白)包膜表达质粒或0.5μg mavg(马尔堡病毒糖蛋白)包膜表达质粒和2μg复制缺陷型hiv载体(pnl4-3.luc.re)经由pei(聚乙烯亚胺) (invitrogen,carlsbad,ca,usa)共转染到六孔板中的人胚胎肾293t细胞 (90%汇合)中,如先前关于改良的程序所描述。通过aid研究和参考试剂项目(aids research and reference reagent program)(division of aids,
niaid, nih)获得hiv载体pnl4-3.luc.re。在转染后十六小时,将所有培养基用新鲜的完全dmem替代。在转染后八小时,将所有培养基用新鲜的完全 dmem替代。在转染后四十八小时,将上清液收集并过滤通过0.45-μm孔径过滤器(millipore,billerica,ma,usa),并且假病毒直接用于感染。
[0313]
抗hiv和抗h5n1流感病毒评价测定.该方案用于鉴定hiv和流感病毒复制(入浸步骤)的潜在抑制剂。在该系统中,将hiv载体pnl4-3.luc.re 与vsvg共转染,以生成hiv/vsvg病毒体(在病毒表面上具有vsv糖蛋白的hiv病毒体),并且将相同的hiv载体与h5n1 ha和na构建体共转染,以生成在病毒表面上具有禽流感ha的hiv病毒体[hiv/ha(在病毒表面上具有ha和na糖蛋白的hiv病毒体)]。该pnl4-3衍生自si(合胞体诱导型)的t嗜性病毒的感染性分子克隆,其为复制缺陷型,因为hiv是 env-和vpr-。此外,该重组hiv载体携带的荧光素酶基因(luc)充当用于 hiv复制(逆转录、整合和hiv基因表达)的报道基因。感染水平以感染细胞中的相对光单位(rlu)测量。用hiv载体pnl4-3.luc.re感染的293t 细胞的荧光素酶活性达到10
5-106rlu的范围,比使用不具有vsvg的hiv 病毒体测量时的背景水平高大约100倍。评价原则在于细胞中的荧光素酶活性水平应当与病毒进入和复制的水平成比例。如果样品可能干扰hiv复制/ 或ha介导的病毒进入,则感染细胞中的荧光素酶活性水平将下降。因此,使用该方案可以鉴定能够抑制hiv或流感病毒复制的样品。如下评价测试馏分或化合物。将靶a549人肺细胞以每孔0.5
×
105个细胞(24孔板)接种到完全dmem介质中。使用肺细胞系是因为它对ha介导的病毒进入敏感。首先将原液hiv/vsvg或hiv/ha病毒体(靶细胞上大约2
×
106相对光单位或rlu)与各个样品混合,并且将混合物与a549靶细胞一起孵育24小时。将10微升的系列浓度(例如,20、10、5、2.5、1.25、0.625和0.3125μg/ml) 和190μl假病毒与靶细胞一起孵育。在感染后二十四(24)小时,从靶细胞中移除含有样品和病毒的所有培养基,并用新鲜和完全dmem替代。在感染后四十八(48)小时,使靶细胞裂解并且测定荧光素酶活性。可能出现两种不同的测试结果:1)一些样品可对hiv/vsvg和hiv/ha病毒体两者均“抑制复制”(对于ha和vsvg而言luc较低),因为这些样品中的一些可在病毒进入靶细胞期间或病毒刚进入靶细胞后进行阻断,或者它们中的一些仅对靶细胞有细胞毒活性。这些样品被分类为抗hiv。2)可特异性抑制 hiv/ha病毒进入(对于hiv/ha而言luc较低,但对于hiv/vsvg并非如此)的样品将被分类为抗ha抑制剂(流感病毒抑制剂)。ec
50
值为测定的抑制病毒感染力50%的药物浓度。
[0314]
抗hiv、抗埃博拉和抗马尔堡病毒评价测定.该方案由前述抗h5n1流感病毒评价测定改良而成,其被设计成用于鉴定hiv、埃博拉和马尔堡病毒复制(入浸步骤)的潜在抑制剂。在该系统中,将hiv载体pnl4-3.luc.r.e. 与vsvg共转染,以生成hiv/vsvg病毒体,并且将相同的hiv载体与埃博拉或马尔堡糖蛋白(gp)构建体共转染,以生成在病毒表面上具有埃博拉或马尔堡gp的hiv病毒体(hiv/ebvg或hiv/mavg)。感染水平以感染细胞中的相对光单位(rlu)测量。用hiv载体pnl4-3.luc.r.e.感染的293t 细胞的荧光素酶活性达到10
5-106rlu的范围,比使用不具有vsvg的hiv 病毒体测量时的背景水平高大约100倍。评价原则在于细胞中的荧光素酶活性水平应当与病毒进入和复制的水平成比例。如果化合物可能干扰hiv复制/或ebvg或mavg介导的病毒进入,则感染细胞中的荧光素酶活性水平将下降。因此,使用该方案,可以鉴定能够抑制hiv、ebov和marv复制的化合物。如下评价测试化合物。将靶a549人肺细胞以每孔0.5
×
105个细胞 (24孔板)接种到完全dmem介质中。使用肺细胞
系是因为它对ebvg或 mavg介导的病毒进入敏感。首先将原液hiv/vsvg或hiv/ebvg或mavg 病毒体(靶细胞上大约2
×
106相对光单位或rlu)与各个样品混合,并且将混合物与a549靶细胞一起孵育24小时。将10微升不同浓度的每种样品和190μl假病毒与靶细胞一起孵育。在感染后二十四(24)小时,从靶细胞中移除含有样品和病毒的所有培养基,并且用新鲜和完全dmem替代。在感染后四十八(48)小时,使靶细胞裂解并且测定荧光素酶活性。
[0315]
抗-sars-cov-2评价测定.该方案由前述抗h5n1流感病毒评价测定改良而成,其被设计成用于鉴定sars-cov-2的潜在抑制剂。在该测定中,将 hiv载体pnl4-3.luc.r.e.与sars-cov-2突刺蛋白(sarsp)表达质粒共转染,以生成sars-cov-2假病毒体(hiv/sarsp)。将靶hep g2肝癌细胞以每孔4
×
103个细胞(96孔板)接种到完全emem中。使用肝细胞系是因为它对sars-cov-2介导的病毒进入敏感。将10微升不同浓度的每种样品和 190μl hiv/sarsp与靶细胞一起孵育。在感染后四十八(48)小时,使靶细胞裂解并且测定荧光素酶活性。阿比朵尔在实验中用作阳性对照。阿比朵尔针对sars-cov-2假病毒体的ic
50
值测量为5.23μm,这与文献报道的值 (4.11μm)一致。
[0316]
使用hiv-1临床毒株进行抗hiv评价.
[0317]
将hiv-1临床毒株如bal和sf162(巨噬细胞-嗜性:m-嗜性)、bal (t-细胞系嗜性:t-嗜性)和89.6(双重嗜性毒株)、hiv-1
lav
(野生型)、 nrti(核苷类逆转录酶抑制剂)-抗性分离株(hiv-1
1617-1
)(得自aids库的 azt抗性毒株)和nnrti(非核苷类逆转录酶抑制剂)-抗性分离株(hiv
‑ꢀ1n119
)(得自aids库的奈韦拉平抗性毒株)用于本研究中。使用标准化人外周血单核细胞培养物(pbmc)测定来确定这些hiv-1毒株的化合物敏感性。 azt(即临床使用的抗hiv药物)用作阳性对照。所有数据由三个独立实验生成,每个实验一式三份执行。在hiv-1感染之前,在每个实验中使用新鲜人pbmc。简而言之,将供体pbmc悬浮于r-3培养基[rpmi 1640培养基,补充有15-20%fbs(胎牛血清)、5%il-2(人白介素-2)、250u青霉素/ml、 250μg链霉素/ml和2mm l-谷氨酰胺]中,用pha(植物血凝素,2-3μg/ml) 刺激七天。将制备物(样品)添加到培养的细胞中,并使用不同的hiv-1毒株攻击96孔板中的培养细胞[每孔1
×
105个细胞,具有1000tcid
50
(病毒 50%组织培养感染剂量)的hiv毒株]。在孵育七天之后,收集上清液,并且使用p24抗原elisa来测定感染细胞的hiv p24水平。为了测量ic
50
值,使用一系列浓度(例如,5、1、0.2、0.04、0.008、0.016和0μg/ml)来测试每种药物。通过将含样品孔的p24抗原值与不含药物的对照孔的那些进行比较来计算ic
50
。对于p24测定,最大截断值应当为约120-150pg/ml。
[0318]
使用感染性流感病毒进行抗病毒评价.
[0319]
将一组流感病毒如流感h1n1(a/hk/415742/09)、h3n2(a/hongkong/1/1968)、h5n1(a/vietnam/1203/2004h)、h7n1(a/rhea/northcarolina/39482/93)、h7n7(a/netherlands/219/2003)、h7n9(a/anhui/1/2013) 和h9n2(a/chicken/y280/97)用于本研究中。评价样品针对a549细胞中流感病毒的抗病毒活性。简而言之,将制备物(样品)添加到培养的细胞中,并使用不同的流感毒株攻击24孔板中的培养细胞(每孔1
×
105个细胞)。在移除未结合的病毒之后,将细胞孵育48小时。收集病毒上清液,并且在 mdck(狗肾传代)细胞中通过标准噬斑测定来测定病毒滴度。
[0320]
使用srb测定进行细胞毒性评价.
[0321]
使用磺酰罗丹明b(srb)测定来测量样品对a549细胞的细胞毒性 (vichai v,
kirtikara k.nature protocols 2006;1:1112
–
1116)。简而言之,将 190μl的a549细胞(2
×
104个细胞/ml)接种到96孔细胞培养板的每个孔中。在24小时之后,将10μl单独的dmso、10μl含齐多夫定(azt,作为阳性对照)的10%dmso,以及10μl含每种样品的10%(v/v)dmso 分别添加到96孔组织培养板的孔中。将10μl的10%(v/v)dmso添加到 96孔组织培养板的每个空白孔中作为背景计算板。在37℃温育2天之后,将50μl的冷50%(w/v)三氯乙酸(tca)添加到板的每个孔中,并且在 4℃进一步温育1小时。然后将板用低流动自来水洗涤四次,并允许其在室温(r.t.)下干燥。将50μl的0.4%(w/v)srb溶液添加到每个孔中。将板在室温静置5至10分钟,并且用1%(v/v)乙酸快速冲洗以移除未结合的染料。允许板在室温干燥。将100ml的10mm tris碱溶液(ph 10.5)添加到每个孔中,并且将板在转动摇床上振荡至少30分钟以溶解蛋白结合的染料。在酶标仪中于515nm测量od值。使用graphpad prism版本5.0(graphpadsoftware,san diego,ca)计算cc
50
(引起50%细胞毒性的试剂浓度)值。
[0322]
小鼠中的毒性评价.
[0323]
对所选样品进行小鼠中的重复剂量毒性研究。动物研究已获得批准,并且根据香港浸会大学(hong kong baptist university)的动物伦理委员会动物护理和使用指南(animal care and use guidelines of the animal ethics committee) 执行,并且按照nih(national institute of health,usa)设定的动物护理和使用(animal care and use)指南执行。balb/c裸鼠(spf级,雄性或雌性, 6-8周龄)购自charles river laboratories。在实验之前,将小鼠保持在spf 级实验室条件下适应一周。然后,将小鼠分成三组:两个剂量(25和50mg/kg: 10只小鼠/每个剂量组)组的anl化合物以及一个剂量的媒介物(阴性对照: 10只小鼠)。在28天内,预定每天在i.p.部位注射。测量小鼠的体重每周两次,直到实验结束。另外检查小鼠的皮肤状况、食物摄取、水消耗和姿态。在实验结束时处死所有小鼠,以检查必要器官如肝、心脏、肾、肺和脾。
[0324]
表1:anl的抗hiv活性.a[0325]
[0326][0327]a结果表示为cc
50
(引起宿主a549细胞的细胞生长抑制50%的浓度) 和ec
50
(抑制病毒生长50%的化合物的有效浓度)值(以nm计),并且数据获自一式三份实验。si=cc
50
/ec
50
。
[0328]bne:在宿主a549细胞中测试的cc
50
没有效应。
[0329]c阳性对照化合物。
[0330]
表2:anl的抗h5n1病毒活性.a[0331]
[0332][0333]a结果来自三个一式三份的实验。
[0334]b阳性对照化合物。
[0335]
表3:所选择的anl针对h5n1病毒、ebov、vsv和a549细胞的抑制效应.a[0336]
[0337][0338]a结果来自三个一式三份的实验。
[0339]b阳性对照化合物。
[0340]
化合物26b(patentiflorin a)被鉴定为得自野靛棵(j.cf.patentiflora)(的根和茎)以及爵床(j.procumbens)(地上部分)的甲醇提取物中的抗hiv先导化合物,并且化合物5(山荷叶素)被分离为得自爵床(地上部分)的甲醇提取物中的纯化合物。化合物5也通过我们先前研究中的26b的全合成作为中间体获得。在我们当前的“一石二鸟”评价系统中,化合物26b和5显示出抗hiv活性,分别测定得到ec
50
值为21.1和37.1nm,并且si分别为 16.4和97.3。为了改善它们的抗病毒活性以及减少它们的细胞毒性,我们合成了这两种化合物的许多类似物。我们设计了合成路线以用不同的官能团替代5的羟基而制备了化合物12-24(图2)。我们进一步设计了合成路线以用不同的糖单元替代26b的6-脱氧甲基葡萄糖单元,或者选择性地取代26a-g 的糖部分上的一个或两个或三个或四个羟基而制备了化合物25-32(图4-6)。使用“一石二鸟”系统评价这些化合物的抗病毒活性。如表1的结果所示,就 si值而言,化合物17a、17b、17c、19a、19d、22、25a、26d、27bb、31c和 31i展示出比patentiflorin a(26b)和山荷叶素(5)改善得多的抗hiv活性。观察到在某些情况下,观察到糖单元的立体化学对于这些合成的山荷叶素糖苷中的生物活性是必需的。与26e相比,26d的抗hiv活性高得多(26d, ec
50
=42.3nm,并且si》426.1;26e,在9496.9nm的浓度下无病毒抑制活性)。26d的较高抗hiv活性和选择性是由于26d中的l-(-)-岩藻糖替代了 26e中的d-( )-岩藻糖来实现的。选择化合物12b、17a、19a和21作了进一步的针对抗广谱hiv-1临床和抗性毒株进行评价。化合物12b显示出针对 sf162、89.6、bal、lav.04、1617-1和n119的抑制效应,ic
50
值分别为340、 376、458、312、537和638nm(针对pbmc的cc
50
值》100μm)。化合物 17a显示出针对sf162、89.6、bal、lav.04、1617-1和n119的抑制效应,ic
50
值分别为122、134、168、151、174和203nm(针对pbmc的cc
50
值》100μm)。化合物19a显示出针对sf162、89.6、bal、lav.04、1617-1和n119的抑制效应,ic
50
值分别为154、143、188、138、152和185nm(针对pbmc的 cc
50
值》100μm)。化合物21显示出针对sf162、89.6、bal、lav.04、1617
‑ꢀ
1和n119的抑制效应,ic
50
值分别为23.9、28.7、26.5、30.1、39.3和42.1 nm(针对pbmc的cc
50
值为25.6μm)。选择化合物19p、26f、28ab1、31a、 31e、31g、31j、31l、32b、32c和32d测试了它们在几种浓度下针对h5n1 病毒、ebov(埃博拉病毒)和vsv(水泡性口炎病毒)的抑制效应,并且与它们针对a549宿主细胞的抑制效应进行了比较(表3)。化合物28ab1、 31e、31g、31l、31j和32b显示出在低于12.5ng/ml的浓度下针对三种病毒 (h5n1病毒、ebov和vsv)的抑制效应超过77%。因此进一步测试了化合物系列26-32针对h5n1病毒、ebov和vsv的抗病毒活性。化合物26b、 26f、26g、28ab1、28ab2、28ab3、29a、30a、31e、31j、31l、32a、32b、32c、 32d和azt(阳性对照)显示针对h5n1病毒的抑制效应,ec
50
值分别为 4.48、371.3、63.6、5.05、0.23、1.16、5.57、3.88、0.74、0.84、0.013、0.63、 0.77、5.20、199.8和3.48nm。化合物26b、26f、26g、28ab1、28ab2、28ab3、 29a、30a、31e、31j、31l、32a、32b、32c、32d、azt(阳性对照)和托瑞米芬(阳性
对照)显示针对ebov的抑制效应,ec
50
值分别为54.8、515.6、 123.0、18.9、16.3、0.98、10.6、1.84、1.13、0.84、0.19、1.20、0.85、20.3、 395.7、3.80和212.1nm。化合物26b、26f、26g、28ab1、28ab2、28ab3、 29a、30a、31e、31j、31l、32a、32b、32c、32d和azt(阳性对照)显示针对vsv的抑制效应,ec
50
值分别为42.5、1035、210.1、3.78、4.98、0.85、 10.6、8.60、2.41、0.91、0.37、18.1、3.15、123.9、286.1和7.06nm。化合物 5、26b、26e、28ab1、31j、32a、32b、32c、32d和阿比朵尔(阳性对照) 显示针对sars-cov-2的抑制效应,ec
50
值分别为150.1、67.2、30.4、26.3、 10.3、2.95、3.01、50.8、80.4和4,110nm。化合物26b、26f、26g、28ab1、 28ab2、28ab3、29a、30a、31e、31j、31l、32a、32b、32c和32d和紫杉醇 (阳性对照)显示针对宿主细胞系a549的抑制效应,cc
50
值分别为386.1、 8649、4129、190.0、108.2、6.14、121.6、35.2、17.7、6.68、4.85、61.6、30.7、 1038、1349和2.99nm。与媒介物对照组相比,进一步评价了化合物17a和 25a在小鼠中的毒性,所述化合物各自具测定了25和50mg/kg的两个剂量。在动物研究结束时,所有组的小鼠均未观察到毒性症状(体重减轻、皮肤损伤、食物和水摄入障碍以及姿态异常)和死亡率。所有小鼠的切除器官在实验结束时均看起来正常。
[0341]
材料和方法
[0342]
一般实验程序
[0343]
在bruker drx-400mhz光谱仪(rheinstetten,germany)上记录1d和 2d nmr光谱。化学位移(δ)以ppm表示,并且偶合常数(j)以hz报告。所有nmr实验通过使用供应商供应的标准脉冲序列获得。化学位移(δ)相对于溶剂信号以ppm表示(cd3od:1h:3.31ppm,
13
c:49.00ppm;cdcl3:1h:7.27ppm,
13
c:77.23ppm;dmso-d6:1h:2.50ppm,
13
c:39.51ppm;丙酮-d6:1h:2.05ppm,
13
c:29.92,206.68ppm),并且偶合常数(j)以hz 报告。柱色谱法在硅胶(230-400目,natland international corporation,researchtriangle park,nc,usa)上进行。薄层色谱法(tlc)在涂覆有0.25mm硅胶60f254(kassel,germany)层的emd玻璃背板上执行。hrtofms光谱在micromass qtof-2(milford,ma,usa)、agilent 6540q-tof(santa clara, ca,usa)、agilent 6460triple quadrupole、或bruker q-tof质谱仪(bremen, germany)上记录。所有试剂均购自商业来源且不作进一步纯化即进行使用。
[0344]
化合物5
[0345]
向粗制2-溴-4,5-二甲氧基苯甲醛(30g,125mmol)在甲苯(1l)中的悬浮液添加乙二醇(14ml,250mmol)和对甲苯磺酸(tsoh)(5.2g,25 mmol)。将填充有甲苯(phme)的dean-stark设备装配到圆底烧瓶上,并使反应回流过夜。在冷却至室温(r.t.)之后,减压移除甲苯。然后,将粗制混合物溶解于乙酸乙酯(etoac)中,并且用碳酸氢钠(nahco3)水溶液、水,然后用盐水洗涤,用无水硫酸钠(na2so4)干燥,并且减压浓缩。在硅胶快速色谱(减活化硅胶,含16%-25%etoac的正己烷)上分离混合物,得到呈灰白色固体的2-(2-溴-4,5-二甲氧基苯基)-1,3-二氧戊环(2)(33.5g,95%)。在冷却至-78℃之后向搅拌的乙缩醛(2)(30g,104mmol)的1l四氢呋喃 (thf)溶液中,在额外的30分钟里滴加正丁基锂(n-buli)(1.8m,69.3 ml,124.8mmol),将反应混合物在-50℃继续搅拌30分钟,然后添加胡椒醛(114.4mmol)。将混合物在-78℃搅拌0.5小时,然后允许反应温热至室温额外的2小时。然后用水猝灭反应,并用etoac萃取水层。将合并的有机层用水,然后用盐水洗涤,用na2so4干燥并减压浓缩,以得到浅黄色浆液(syrup) (3),使其立即经受狄尔斯-阿尔德反应。向粗制中间体的二氯甲烷(ch2cl2) (100ml)溶液中添加乙酸(acoh)(35ml)和乙炔二羧酸二甲酯
(dmadc) (16.7ml,104mmol)。将反应在140℃搅拌12小时。在冷却至室温后,将反应用水稀释,并且用ch2cl2萃取水层。将合并的有机层洗涤、干燥并过滤通过硅胶塞,以移除大部分杂质。通过在乙醇(etoh)中重结晶来纯化所得的红色粘性油状物。将粗制二酯(4a,5mmol)溶解于thf(70ml)中并且滴加硼氢化钠(nabh4)(0.945g,25mmol),并且将反应在80℃搅拌12 小时。然后使反应冷却回室温。用稀hcl(2m)将所得的浆液酸化至大约2 的ph值。在酸化后,将水层用etoac萃取,并将合并的有机层用水,然后用盐水洗涤,用na2so4干燥并浓缩。通过硅胶柱色谱法来纯化所得的红色粘性油状物,从而得到目标化合物5:hr-eims m/z[m h]
381.0974(计算值381.0912);1h nmr(400mhz,丙酮-d6)δ7.69(1h,s,h-2),7.09(1h,s,h
‑ꢀ
5),6.96(1h,d,j=7.9hz,h-5’),6.85(1h,d,j=1.6hz,h-2’),6.91(1h,dd,j= 7.9,1.7hz,h-6’),6.09(1h,br s,och2o),6.07(1h,br s,och2o),5.37(2h,s, h-9),3.99(3h,s,3-och3),3.73(3h,s,4-och3)。
[0346]
化合物12a
[0347]
向山荷叶素(5,190mg,0.5mmol)和t-buococh2br(193mg,1mmol) 的dmf(5ml)溶液中添加cs2co3(326mg,1mmol)。将混合物在室温搅拌2小时。在用水猝灭之后,然后将水层用etoac萃取,并将合并的有机层用水,然后用盐水洗涤,用na2so4干燥并减压浓缩。通过制备型tlc纯化混合物得到淡黄色固体(12a,247mg,99%):hr-eimsm/z[m h]
495.1638 (计算值495.1655);1h nmr(400mhz,cdcl3)δ7.73(1h,s,h-2),7.07(1h,s, h-5),6.96(1h,d,j=7.9hz,h-5’),6.82(1h,d,j=1.3hz,h-2’),6.79(1h,dd, j=7.9,1.7hz,h-6’),6.09(1h,br s,-och2o-),6.05(1h,br s,-och2o-),5.48 (2h,s,h-9),4.69(2h,s,och2c=o),4.09(3h,s,3-och3),3.81(3h,s,4-och3), 1.51(9h,s,t-bu);
13
c nmr(100mhz,cdcl3)δ169.5(c-9’),167.8(o-c=o), 151.8(c-3),150.4(c-4),147.5(c-4’,c-7),146.7(c-3’),135.5(c-7’),130.8(c
‑ꢀ
6),128.3(c-1’),126.4(c-8’),126.2(c-1),123.6(c-6’),119.1(c-8),110.7(c-2’), 108.2(c-5’),106.2(c-5),101.3(c-2),100.9(-och2o-),82.9(t-bu),69.8 (och2c=o),66.4(c-9),56.2(3-och3),55.9(4-och3),28.1(t-bu)。
[0348]
化合物12b
[0349]
向山荷叶素(5,38mg,0.1mmol)和etococh2br(33mg,0.2mmol) 的1ml dmf溶液中添加cs2co3(65mg,0.2mmol)。将混合物在室温搅拌 2小时。在用水猝灭之后,然后将水层用etoac萃取,并将合并的有机层用水,然后用盐水洗涤,用na2so4干燥并减压浓缩。通过制备型tlc纯化混合物得到12b(46mg,99%):hr-eimsm/z 467.1316[m h]
(计算值467.1342);1h nmr(400mhz,dmso-d6)δ7.73(1h,s,h-2),7.03(1h,d,j=7.9hz,h-5’), 6.96(1h,s,h-5),6.87(1h,d,j=1.5hz,h-2’),6.75(1h,dd,j=7.9,1.7hz,h
‑ꢀ6’
),6.12(2h,br s,-och2o-),5.59(2h,s,h-9),5.02(2h,s,och2c=o),4.23(2h, q,j=7.1hz,et),3.95(3h,s,3-och3),3.66(3h,s,4-och3),1.24(3h,t,j=7.1 hz,et);
13
c nmr(100mhz,dmso-d6)δ169.0(c-9’),169.0(o-c=o),151.4 (c-3),150.1(c-4),147.0(c-3’),146.9(c-4’),146.0(c-7),133.8(c-7’),129.6(c
‑ꢀ
6),128.2(c-1’),126.0(c-8’),125.6(c-1),123.6(c-6’),118.8(c-8),110.8(c-2’), 108.0(c-5’),105.5(c-5),101.2(c-2),100.9(-och2o-),68.7(och2c=o),66.4 (c-9),61.0(et),55.7(3-och3),55.3(4-och3),14.1(et)。
[0350]
化合物13
[0351]
向12a(247mg,0.5mmol)的10ml ch2cl2溶液中添加1ml dmf和 2ml tfa。将混合物
在室温搅拌12小时。tlc显示出反应已经完成,并且出现具有较高极性的新斑点。在使反应混合物浓缩之后,添加etoh以促进沉淀。收集固体得到13(210mg,95%):hr-eims m/z[m h]
439.100(计算值439.1029);1h nmr(400mhz,dmso-d6)δ7.78(1h,s,h-2),7.04(1h,d, j=8.0hz,h-5’),6.97(1h,s,h-5),6.89(1h,d,j=1.5hz,h-2’),6.77(1h,dd, j=7.9,1.7hz,h-6’),6.13(2h,s,-och2o-),5.76(1h,s,oh),5.60(2h,s,h-9), 4.93(2h,s,och2c=o),3.96(3h,s,3-och3),3.67(3h,s,4-och3);
13
c nmr (100mhz,dmso-d6)δ170.9(c-9’),169.4(o-c=o),151.7(c-3),150.5(c-4), 147.4(c-3’),147.3(c-4’),146.7(c-7),134.1(c-7’),130.0(c-6),128.7(c-1’), 126.3(c-6’),126.1(c-8’),124.0(c-1),119.3(c-8),111.3(c-2’),108.4(c-5’), 105.9(c-5),101.6(c-2),101.5(-och2o-),69.1(och2c=o),66.8(c-9),56.1(3
‑ꢀ
och3),55.7(4-och3)。
[0352]
化合物14a
[0353]
在25℃向13(44mg,0.1mmol)的ch2cl2(10.00ml)溶液中添加et3n (30mg,0.3mmol)、nh4cl(16mg,0.3mmol)和hatu(114mg,0.3 mmol),将反应在25℃搅拌16小时。在用水猝灭之后,然后将水层用etoac 萃取,并将合并的有机层用水,然后用盐水洗涤,用na2so4干燥并减压浓缩。通过制备型tlc纯化混合物得到14a(40mg,92%):hr-eims m/z 438.1167[m h]
(计算值438.1189);1h nmr(400mhz,dmso-d6)δ7.80(1h, s,nh2),7.70(1h,s,h-2),7.55(1h,s,nh2),7.04(1h,d,j=7.9hz,h-5’),6.97 (1h,s,h-5),6.89(1h,d,j=1.5hz,h-2’),6.77(1h,dd,j=7.9,1.6hz,h-6’), 6.12(2h,s,-och2o-),5.60(2h,s,h-9),4.70(2h,s,och2c=o),3.97(3h,s,3
‑ꢀ
och3),3.66(3h,s,4-och3);
13
c nmr(100mhz,dmso-d6)δ170.1(c-9’), 169.0(o-c=o),151.3(c-3),150.0(c-4),147.0(c-3’),146.9(c-4’),146.1(c-7), 133.7(c-7’),129.6(c-6),128.3(c-1’),126.1(c-8’),125.7(c-1),123.6(c-6’), 118.9(c-8),110.9(c-2’),108.0(c-5’),105.5(c-5),101.2(c-2,-och2o-),70.6 (och2c=o),66.5(c-9),55.8(3-och3),55.3(4-och3)。
[0354]
化合物14b
[0355]
在25℃向13(44mg,0.1mmol)在ch2cl2(10.00ml)和dmf(1ml) 中的溶液中添加et3n(30mg,0.3mmol),menh2(0.3ml,0.3mmol)和 hatu(114mg,0.3mmol),将所得的混合物在25℃搅拌16小时。在用水猝灭之后,然后将水层用etoac萃取,并将合并的有机层用水,然后用盐水洗涤,用na2so4干燥并减压浓缩。通过制备型tlc纯化混合物得到14b(30 mg,66%):hr-eims m/z 452.1312[m h]
(计算值452.1345);1h nmr(400 mhz,dmso-d6)δ7.61(1h,s,h-2),6.96(1h,d,j=7.9hz,h-5’),6.90(1h,s, h-5),6.81(1h,d,j=1.5hz,h-2’),6.69(1h,dd,j=7.9,1.7hz,h-6’),6.04(2h, s,-och2o-),5.50(2h,s,h-9),4.65(2h,s,och2c=o),3.90(3h,s,3-och3), 3.58(3h,s,4-och3),2.60(3h,s,nh-me);
13
c nmr(100mhz,dmso-d6)δ 169.0(c-9’),168.2(o-c=o),151.4(c-3),150.1(c-4),147.0(c-3’),146.9(c-4’), 146.1(c-7),133.9(c-7’),129.6(c-6),128.3(c-1’),126.5(c-8’),125.8(c-1), 123.6(c-6’),118.9(c-8),110.9(c-2’),108.0(c-5’),105.5(c-5),101.2(c-2), 101.1(-och2o-),71.0(och2c=o),66.4(c-9),55.8(3-och3),55.3(4-och3), 25.6(nh-me)。
[0356]
化合物15a
[0357]
将tbab(16mg,0.05mmol)、pdcl2(1.7mg,0.01mmol)和k2co
3 (6.9mg,0.05mmol)的混合物溶解于去离子h2o(2.00ml)中,并在60℃搅拌15分钟。然后,添加山荷叶素(5,38mg,
0.1mmol)和0.3ml环氧乙烷并在60℃搅拌5小时。tlc显示出反应完成,并且形成一个具有较小极性的主斑点。使混合物浓缩给出黄绿色固体,将其通过etoh洗涤后给出期望的产物15a(40mg,95%):hr-eims 425.1207m/z[m h]
(计算值 425.1236);1h nmr(400mhz,dmso-d6)δ7.76(1h,s,h-2),7.03(1h,d,j= 7.9hz,h-5’),6.97(1h,s,h-5),6.89(1h,d,j=1.5hz,h-2’),6.77(1h,dd,j= 7.9,1.6hz,h-6’),6.12(2h,s,-och2o-),5.75(1h,s,oh),5.58(2h,s,h-9), 4.28-4.22[2h,m,o(ch2)2oh],3.95(3h,s,3-och3),3.81[2h,m,o(ch2)2oh], 3.66(3h,s,4-och3);
13
c nmr(100mhz,dmso-d6)δ169.2(c-9’),151.2(c
‑ꢀ
3),150.0(c-4),146.9(c-3’),146.8(c-4’),146.6(c-7),133.3(c-7’),129.6(c-6), 128.4(c-1’),126.6(c-8’),126.1(c-1),123.7(c-6’),118.9(c-8),110.9(c-2’), 108.0(c-5’),105.5(c-5),101.1(c-2,-och2o-),74.4[o(ch2)2oh],66.6(c-9), 60.4[o(ch2)2oh],55.7(3-och3),55.2(4-och3)。
[0358]
化合物15b
[0359]
将cs2co3(100mg,0.3mmol)添加到5(38mg,0.1mmol)和甲基环氧丙烷(71mg,1mmol)在2ml dmf中的混合物,并在120℃搅拌12小时。tlc显示出反应已经完成,且形成一个具有较小极性的主斑点。使混合物浓缩给出黄绿色固体,将其通过etoh洗涤后给出期望的产物15b(38mg, 84%):hr-eims m/z[m h]
453.1524(计算值453.1549);1h nmr(400mhz, dmso-d6)δ7.71(1h,s,h-2),7.04(1h,d,j=7.9hz,h-5’),6.97(1h,s,h-5), 6.89(1h,d,j=1.6hz,h-2’),6.77(1h,dd,j=7.9,1.7hz,h-6’),6.13(2h,s,
‑ꢀ
och2o-),5.63(2h,s,h-9),4.03(2h,s,ch2),3.95(3h,s,3-och3),3.67(3h,s, 4-och3),1.34(6h,s,me);
13
c nmr(100mhz,dmso-d6)δ169.1(c-9’),151.1 (c-3),149.9(c-4),146.9(c-3’),146.8(c-4’),146.7(c-7),132.8(c-7’),129.5(c
‑ꢀ
6),128.4(c-1’),125.5(c-8’),125.5(c-1),123.6(c-6’),118.9(c-8),110.8(c-2’), 107.9(c-5’),105.5(c-5),101.1(c-2),101.0(-och2o-),79.9(ch2),69.1(c), 66.6(c-9),55.5(3-och3),55.2(4-och3),26.4(me)。
[0360]
化合物16
[0361]
将5(19mg,0.05mmol)的无水吡啶(1ml)溶液添加到ac2o(7.1 μl,0.075mmol)中。将所得的混合物在室温搅拌过夜。在反应完成之后,将其用ch2cl2稀释并用10%hcl溶液洗涤。将合并的有机相用饱和nahco3水溶液进一步萃取,并经na2so4干燥。在浓缩之后,用制备型tlc(1:1正己烷:乙酸乙酯)纯化粗产物得到呈无色固体的16(20mg,94.6%):hr-eims 423.1077m/z[m h]
(计算值423.1080);1h nmr(400mhz,cdcl3)δ7.17(1h, s,h-2),7.12(1h,s,h-5),6.97(1h,d,j=7.8hz,h-5’),6.86(1h,d,j=1.4hz, h-2’),6.83(1h,dd,j=7.9,1.7hz,h-6’),6.10(1h,d,j=1.5hz,-och2o-), 6.05(1h,d,j=1.5hz,-och2o-),5.26(2h,s,h-9),4.06(3h,s,3-och3),3.81 (3h,s,4-och3),2.53(3h,s,oac)。
[0362]
化合物17a
[0363]
向5(38mg,0.1mmol)和溴乙腈(24mg,0.2mmol)的1ml丙酮溶液中添加cs2co3(65mg,0.2mmol)。将混合物在室温搅拌2小时。tlc显示出一个具有较小极性的斑点。通过制备型tlc纯化混合物给出期望的产物17a(40mg,95%):hr-eimsm/z[m h]
420.1053(计算值420.1083);1hnmr(400mhz,dmso-d6)δ7.52(1h,s,h-2),7.05(1h,d,j=7.9hz,h-5’), 7.01(1h,s,h-5),6.91(1h,d,j=1.6hz,h-2’),6.79(1h,dd,j=1.7,7.9hz,h
‑ꢀ6’
),6.13(2h,s,-och2o-),5.60(2h,s,ch2),5.34(2h,s,h-9),3.99(3h,s,3
‑ꢀ
och3),3.68(3h,s,4-och3)
;
13
c nmr(100mhz,dmso-d6)δ168.8(c-9’), 151.8(c-3),150.2(c-4),147.1(c-3’),147.0(c-4’),144.7(c-7),135.5(c-7’), 129.8(c-6),128.4(c-1’),127.9(c-8’),126.0(c-1),123.6(c-6’),118.8(c-8), 117.1(c≡n),110.8(c-2’),108.1(c-5’),105.8(c-5),101.2(c-2),100.3(
‑ꢀ
och2o-),66.1(c-9),58.0(ch2),55.9(3-och3),55.3(4-och3)。
[0364]
化合物17b
[0365]
向5(19mg,0.05mmmol)的丙酮(0.6ml)溶液中添加cs2co3(32.5 mg,0.1mmol),并使溶液冷却至0℃。滴加碘甲烷(10.6mg,0.075mmol) 并使混合物温热至室温。如由tlc所示,反应在12小时后完成。将混合物用饱和nh4cl溶液猝灭,用etoac萃取,并用盐水洗涤。在干燥(na2so4) 之后,减压移除溶剂,并且通过制备型tlc(正己烷:乙酸乙酯,3:1)纯化残余物得到呈白色固体的产物17b(17.7mg,90%):hr-eims m/z[m h]
395.1125(计算值395.1131);1h nmr(400mhz,cdcl3)δ7.54(1h,s,h-2), 7.05(1h,s,h-5),6.95(1h,d,j=7.8hz,h-5’),6.78(2h,m,h-2’,h-6’),6.09 (1h,d,j=1.5hz,-och2o-),6.04(1h,d,j=1.5hz,-och2o-),5.54(2h,s,h
‑ꢀ
9),4.13(3h,s,och3),4.07(3h,s,3-och3),3.80(3h,s,4-och3)。
[0366]
化合物17c
[0367]
向5(38mg,0.1mmol)和丙炔基溴(30mg,0.2mmol)的丙酮溶液中添加cs2co3(65mg,0.2mmol)。将混合物在室温搅拌2小时。tlc显示出一个具有较小极性的斑点。通过硅胶柱纯化混合物给出期望的产物17c(40 mg,95%):hr-eims m/z[m h]
419.1112(计算值419.1131);1h nmr(400 mhz,dmso-d6)δ7.57(1h,s,h-2),7.04(1h,d,j=7.9hz,h-5’),6.98(1h,s, h-5),6.91(1h,d,j=1.5hz,h-2’),6.78(1h,dd,j=7.9,1.6hz,h-6’),6.12(2h, s,-och2o-),5.62(2h,s,h-9),5.04(2h,d,j=2.4hz,ch2),3.96(3h,s,3-och3), 3.71(1h,t,j=2.4hz,c≡ch),3.66(3h,s,4-och3);
13
c nmr(100mhz, dmso-d6)δ169.0(c-9’),151.4(c-3),150.1(c-4),147.0(c-3’),147.0(c-4’), 145.6(c-7),134.2(c-7’),129.7(c-6),128.2(c-1’),127.2(c-1),126.3(c-8’), 123.7(c-6’),118.8(c-8),110.9(c-2’),108.1(c-5’),105.6(c-5),101.2(c-2), 100.8(-och2o-),79.7(ch2),79.5(c≡ch),66.6(c-9),55.7(3-och3),55.3(4
‑ꢀ
och3)。
[0368]
化合物17d
[0369]
向5(38mg,0.1mmol)和2-氯嘧啶(23mg,0.2mmol)的1ml dmf 溶液中添加k2co3(40mg,0.3mmol)。将混合物在100℃搅拌12小时。 tlc显示出一个具有较小极性的斑点。通过制备型tlc纯化混合物给出期望的产物17d(35mg,76%):hr-eimsm/z[m h]
459.1161(计算值459.1192);1h nmr(400mhz,dmso-d6)δ8.71(2h,d,j=4.8hz,嘧啶),7.37(1h,t,j= 4.8hz,嘧啶),7.19(1h,s,h-2),7.08(1h,s,h-5),7.08(1h,d,j=7.9hz,h-5’), 7.01(1h,d,j=1.5hz,h-2’),6.87(1h,dd,j=7.9,1.7hz,h-6’),6.15(2h,br s,
ꢀ‑
och2o-),5.24(2h,s,h-9),3.81(3h,s,3-och3),3.69(3h,s,4-och3);
13
cnmr(100mhz,cdcl3)δ169.8(嘧啶),169.1(c-9’),160.1(嘧啶),160.0(嘧啶), 151.6(c-3),150.2(c-4),147.1(c-4’),147.1(c-3’),146.8(c-7),134.9(c-7’), 129.9(c-6),128.8(c-1’),127.7(c-1),127.0(c-8’),123.8(嘧啶),123.8(c-6’), 119.2(c-8),110.9(c-2’),108.4(c-5’),106.2(c-5),101.0(c-2),100.8(-och2o-), 66.7(c-9),56.03(3-och3),55.4(4-och3)。
[0370]
化合物17e
[0371]
将5(38mg,0.1mmol)、et3n(30mg,0.3mmol)和dmap(催化量) 溶解于2ml的无水ch2cl2中。在0℃将环丙烷甲酰氯(31mg,0.3mmol) 添加到混合物中。允许反应混合物温热至25℃并在25℃保持搅拌2小时。通过硅胶柱纯化混合物给出期望的产物17e(43mg,98%):hr-eims m/z [m h]
449.1241(计算值449.1236);1h nmr(400mhz,cdcl3)δ7.20(1h,s, h-2),7.10(1h,s,h-5),6.96(1h,d,j=7.9hz,h-5’),6.85(1h,d,j=1.5hz,h
‑ꢀ2’
),6.82(1h,dd,j=7.9,1.7hz,h-6’),6.09(1h,br s,-och2o-),6.04(1h,br s,
ꢀ‑
och2o-),5.24(2h,s,h-9),4.05(3h,s,3-och3),3.80(3h,s,4-och3),2.12
‑ꢀ
2.04(1h,m,环丙烷羰基),1.34-1.27(2h,m,环丙烷羰基),1.20(2h,dt,j= 3.3,8.0hz,环丙烷羰基);
13
c nmr(100mhz,cdcl3)δ172.2(环丙烷羰基), 169.4(c-9’),152.3(c-3),150.4(c-4),147.7(c-3’),147.6(c-4’),138.2(c-7), 137.5(c-7’),130.7(c-6),130.3(c-1),128.0(c-1’),126.3(c-8’),123.6(c-6’), 119.1(c-8),110.7(c-2’),108.3(c-5’),106.4(c-5),101.3(c-2),99.2(-och2o-), 66.3(c-9),56.0(3-och3),55.9(4-och3),12.7(环丙烷羰基),9.9(环丙烷羰基)。
[0372]
化合物17f
[0373]
将5(38mg,0.1mmol)、et3n(30mg,0.3mmol)和dmap(催化量) 溶解于2ml的无水ch2cl2中。在0℃,将环戊烷甲酰氯(40mg,0.3mmol) 添加到混合物中。允许反应混合物温热至25℃并在25℃保持搅拌2小时。通过硅胶柱纯化混合物给出期望的产物17f(45mg,97%):hr-eims m/z [m h]
477.1547(计算值477.1549);1h nmr(400mhz,cdcl3)δ7.12(1h,s, h-2),7.04(1h,s,h-5),6.90(1h,d,j=7.9hz,h-5’),6.79(1h,d,j=1.5hz,h
‑ꢀ2’
),6.76(1h,dd,j=7.9,1.7hz,h-6’),6.09(1h,br s,-och2o-),6.04(1h,br s,
ꢀ‑
och2o-),5.16(2h,s,h-9),3.96(3h,s,3-och3),3.74(3h,s,4-och3),3.16 (1h,p,j=8.0hz,环戊烷羰基),2.19-2.08(2h,m,环戊烷羰基),2.07-1.96 (2h,m,环戊烷羰基),1.80(2h,dt,j=6.1,17.0hz,环戊烷羰基),1.70(2h,tdd, j=2.2,4.0,11.4hz,环戊烷羰基);
13
c nmr(100mhz,cdcl3)δ173.8(环戊烷羰基),169.4(c-9’),152.2(c-3),150.4(c-4),147.7(c-3’),147.6(c-4’),138.2 (c-7),137.5(c-7’),130.7(c-6),130.2(c-1),128.0(c-1’),126.3(c-8’),123.7(c
‑ꢀ6’
),119.1(c-8),110.7(c-2’),108.3(c-5’),106.4(c-5),101.3(c-2),99.2(
‑ꢀ
och2o-),66.3(c-9),56.0(3-och3),55.9(4-och3),43.8(环戊烷羰基),30.5 (环戊烷羰基),25.9(环戊烷羰基)。
[0374]
化合物17g
[0375]
将5(38mg,0.1mmol)、et3n(30mg,0.3mmol)和dmap(催化量) 溶解于2ml的无水ch2cl2中。在0℃,将4-氟苯甲酰氯(40mg,0.3mmol) 添加到混合物中。允许反应混合物温热至25℃并在25℃保持搅拌2小时。通过硅胶柱纯化混合物给出期望的产物17g(45mg,90%):hr-eims m/z [m h]
503.1133(计算值503.1142);1h nmr(400mhz,cdcl3)δ8.37(2h,dd, j=8.9,5.3hz,4-氟苯甲酰基),7.29(2h,t,j=8.6hz,4-氟苯甲酰基),7.21(1h, s,h-2),7.15(1h,s,h-5),6.98(1h,d,j=7.9hz,h-5’),6.88(1h,d,j=1.3hz, h-2’),6.85(1h,dd,j=7.9,1.7hz,h-6’),6.09(1h,br s,-och2o-),6.04(1h,brs,-och2o-),5.29(2h,s,h-9),3.95(3h,s,3-och3),3.82(3h,s,4-och3);
13
cnmr(100mhz,cdcl3)δ169.7(c-9’),168.4(4-氟苯甲酰基),165.8(4-氟苯甲酰基),163.1(4-氟苯甲酰基),152.8(c-3),150.9(c-4),148.1(c-3’),148.0(c
‑ꢀ4’
),138.5(c-7),138.3(c-7’),133.6(4-氟苯甲酰基),133.5(4-氟苯甲酰基), 131.2(c-1),130.8(c-6),128.3(c-1’),126.7(c-8’),124.1(c-6’),119.6
(c-8), 116.9(4-氟苯甲酰基),116.7(4-氟苯甲酰基),111.1(c-2’),108.7(c-5’),106.9 (c-5),101.7(c-2),99.5(-och2o-),66.8(c-9),56.4(3-och3),56.3(4-och3)。
[0376]
化合物17h
[0377]
将5(38mg,0.1mmol)、et3n(30mg,0.3mmol)和dmap(催化量) 溶解于2ml的无水ch2cl2中。在0℃,将4-甲氧苯甲酰氯(51mg,0.3 mmol)添加到混合物中。允许反应混合物温热至25℃并在25℃保持搅拌2 小时。通过硅胶柱纯化混合物给出期望的产物17h(45mg,90%):hr-eims m/z[m h]
515.1338(计算值515.1342);1h nmr(400mhz,cdcl3)δ8.33
‑ꢀ
8.25(2h,m,4-甲氧苯甲酰基),7.26(1h,s,h-2),7.14(1h,s,h-5),7.10-7.03 (2h,m,4-甲氧苯甲酰基),6.97(1h,d,j=7.9hz,h-5’),6.88(1h,d,j=1.4hz, h-2’),6.86(1h,dd,j=7.9,1.7hz,h-6’),6.09(1h,d,j=1.4hz,-och2o-), 6.04(1h,d,j=1.4hz,-och2o-),5.29(2h,s,h-9),3.94(3h,s,3-och3),3.93 (3h,s,4-甲氧苯甲酰基),3.81(3h,s,4-och3);
13
c nmr(100mhz,cdcl3)δ 169.4(c-9’),164.7(4-甲氧苯甲酰基),163.4(4-甲氧苯甲酰基),152.3(c-3), 150.4(c-4),147.7(c-3’),147.6(c-4’),138.5(c-7),137.5(c-7’),132.7(4-甲氧苯甲酰基),130.7(c-6),130.6(c-1),128.0(c-1’),126.6(c-8’),123.7(c-6’), 120.3(4-甲氧苯甲酰基),119.2(c-8),114.4(4-甲氧苯甲酰基),110.7(c-2’), 108.3(c-5’),106.4(c-5),101.3(c-2),99.4(-och2o-),66.6(c-9),56.0(3-och3), 55.9(4-och3),55.7(4-甲氧苯甲酰基)。
[0378]
化合物18
[0379]
在氮气下,将山荷叶素(5,760mg,2mmol)和dmap(488mg,4 mmol)溶解于10ml无水ch2cl2中。使溶液冷却至0℃。然后,在5分钟内经由注射器缓慢地添加三氟甲磺酸酐(tf2o)(0.5ml,2.4mmol)。允许反应温热至室温,并在室温搅拌4小时。tlc显示出反应已经完成,并且形成一个新斑点。使混合物真空浓缩给出黄色固体,将其用etoh洗涤后给出期望的产物18(0.97g,95%):hr-eims m/z[m h]
513.0455(计算值 513.0467);1h nmr(400mhz,dmso-d6)δ7.35(1h,s,h-2),7.11(1h,s,h-5), 7.08(1h,d,j=7.9hz,h-5’),7.01(1h,d,j=1.6hz,h-2’),6.87(1h,dd,j=7.9, 1.7hz,h-6’),6.15(2h,s,-och2o-),5.56(2h,s,h-9),3.99(3h,s,3-och3), 3.72(3h,s,4-och3);
13
c nmr(100mhz,dmso-d6)δ167.7(c-9’),153.1(c
‑ꢀ
3),150.6(c-4),147.5(c-3’),147.1(c-4’),139.7(c-7),135.2(c-7’),131.6(c-6), 130.2(c-1),126.8(c-1’),125.2(c-8’),123.6(c-6’),119.7(otf),119.4(c-8), 110.7(c-2’),108.1(c-5’),106.2(c-5),101.3(c-2),98.7(-och2o-),65.4(c-9), 55.9(3-och3),55.5(4-och3)。
[0380]
化合物19a
[0381]
在烘箱干燥的圆底烧瓶中,在氮气气氛下置入[pd(dppf)cl2]ch2cl2复合物(244mg,0.025mmol)、b2pin2(191mg,0.75mmol)、koac(147mg, 1.5mmol)和18(256mg,0.5mmol)。向烧瓶中添加新鲜蒸馏的1,4-二氧杂环己烷(2ml)。将混合物用n2脱气。烧瓶配备有回流冷凝器,并且在氮气气氛下于100℃加热3小时。使混合物真空浓缩给出黄色固体,将其用etoh 洗涤后给出期望的产物19a(229.5mg,85%):hr-eimsm/z[m h]
491.3626 (计算值491.1882);1h nmr(400mhz,dmso-d6)δ7.51(1h,s,h-2),7.04(1h, d,j=7.9hz,h-5’),6.98(1h,s,h-5),6.92(1h,d,j=1.6hz,h-2’),6.79(1h, dd,j=7.9,1.7hz,h-6’),6.13(2h,br s,-och2o-),5.43(2h,s,h-9),3.94(3h,s, 3-och3),3.66(3h,s,4-och3),1.06
(12h,s,me);
13
c nmr(100mhz,dmso
‑ꢀ
d6)δ169.5(c-9’),151.5(c-3),149.8(c-4),147.0(c-3’,c-4’),139.9(c-7),138.4 (c-7’),133.0(c-6),128.4(c-1’),127.8(c-1),123.5(c-6’),118.9(c-8),117.9(c
‑ꢀ8’
),110.7(c-2’),108.0(c-5’),106.7(c-5),105.0(c-2),101.2(-och2o-),79.1 (c-o),73.6(c-o),68.1(c-9),55.9(3-och3),55.2(4-och3),25.0(ch3)。
[0382]
化合物19b
[0383]
向烘箱干燥的10ml烧瓶加入pd(dppf)cl2(3.7mg,0.005mmol)和18 (51mg,0.1mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加甲苯 (2.00ml),然后添加alme3(0.15ml,0.3mmol)。将反应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶液浓缩,并通过制备型tlc纯化给出期望的产物19b(25 mg,66%):hr-eims m/z[m h]
379.1156(计算值379.1182);1h nmr(400 mhz,dmso-d6)δ7.40(1h,s,h-2),7.04(1h,d,j=7.9hz,h-5’),7.01(1h,s, h-5),6.88(1h,d,j=1.6hz,h-2’),6.77(1h,dd,j=7.9,1.7hz,h-6’),6.12(2h, s,-och2o-),5.44(s,2h,h-9),3.99(3h,s,3-och3),3.65(3h,s,4-och3),2.57 (3h,s,me);
13
c nmr(100mhz,dmso-d6)δ169.9(c-9’),151.3(c-3),149.3 (c-4),147.0(c-3’,c-4’),138.2(c-7),136.5(c-7’),131.5(c-6),128.6(c-1’), 128.1(c-1),125.6(c-8’),123.6(c-6’),117.4(c-8),110.8(c-2’),108.0(c-5’), 105.9(c-5),102.8(c-2),101.2(-och2o-),67.9(c-9),55.8(3-och3),55.2(4
‑ꢀ
och3),14.3(ch3)。
[0384]
化合物19c
[0385]
向烘箱干燥的10ml烧瓶加入pd(dppf)2cl2(7.31mg,0.01mmol)、 na2co3(65mg,0.6mmol)、18(102mg,0.2mmol)和吡啶-4-硼酸(52mg, 0.4mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加二氧杂环己烷和 h2o(2/0.4ml)。将反应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶液浓缩,并通过制备型tlc纯化给出期望的产物19c(22mg,50%):hr-eims m/z[m h]
442.1300(计算值442.1291);1h nmr(400mhz,dmso-d6)δ8.79(2h,d,j= 5.8hz,吡啶),7.62(2h,s,h-2,吡啶),7.09(1h,s,吡啶),7.08(1h,d,j=8.1 hz,h-5’),7.01(1h,s,h-5),6.97(1h,d,j=1.5hz,h-2’),6.85(1h,dd,j=7.9, 1.7hz,h-6’),6.14(2h,s,-och2o-),5.27(2h,s,h-9),3.72(3h,s,3-och3), 3.68(3h,s,4-och3);
13
c nmr(100mhz,dmso-d6)δ169.2(c-9’),151.8(c
‑ꢀ
3),150.4(吡啶),149.7(c-4),147.1(c-3’),147.0(c-4’),143.8(吡啶),138.9(c
‑ꢀ
7),138.2(c-7’),129.9(c-6),128.5(c-1),128.0(c-1’),124.5(吡啶,c-8’),123.5 (c-6’),117.9(c-8),110.6(c-2’),108.1(c-5’),105.8(c-5),103.3(c-2),101.2(
‑ꢀ
och2o-),67.5(c-9),55.4(3-och3),55.3(4-och3)。
[0386]
化合物19d
[0387]
向烘箱干燥的10ml烧瓶加入pd(oac)2(1.1mg,0.01mmol)、pph3(2.6 mg,0.02mmol)和18(0.1mmol)。将烧瓶加盖,然后用氩气回填(这重复额外两次)。经由注射器添加dmf(1.00ml),然后以类似方式添加et3n(43 ml,0.3mmol)和hco2h(8μl,0.2mmol)。将反应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶液浓缩,并通过制备型tlc纯化给出期望的产物19d(35mg, 98%):hr-eims m/z[m h]
365.1010(计算值365.1025);1h nmr(400mhz, dmso-d6)δ7.94(1h,s,h-7),7.51(1h,s,
h-2),7.05(1h,d,j=7.9hz,h-5’), 6.99(1h,s,h-5),6.92(1h,d,j=1.6hz,h-2’),6.80(1h,dd,j=7.9,1.7hz,h
‑ꢀ6’
),6.13(2h,s,-och2o-),5.43(2h,s,h-9),3.94(3h,s,3-och3),3.66(3h,s, 4-och3);
13
c nmr(100mhz,dmso-d6)δ169.5(c-9’),151.5(c-3),149.8(c
‑ꢀ
4),147.0(c-3’,c-4’),139.9(c-7),138.3(c-7’),132.9(c-6),128.4(c-1’),127.8 (c-1),123.5(c-6’),118.8(c-8),117.9(c-8’),110.7(c-2’),108.0(c-5’),106.7 (c-5),105.0(c-2),101.2(-och2o-),68.1(c-9),56.0(3-och3),55.8(4-och3)。
[0388]
化合物19e
[0389]
向烘箱干燥的10ml烧瓶加入pd(oac)2(1.12mg,0.005mmol)、binap (5mg,0.008mmol)、cs2co3(49mg,0.15mmol)和18(51mg,0.1mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加4-氨基三氟甲苯(32mg,0.2 mmol)的phme溶液。将反应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶液浓缩,并通过制备型tlc纯化给出期望的产物19e(45mg,86%):hr-eims m/z [m h]
(计算值524.1321);1h nmr(400mhz,cdcl3)δ7.44(2h,d,j=8.5 hz,三氟甲苯),7.32(1h,s,h-2),7.15(1h,s,h-5),6.93(1h,d,j=7.9hz,h
‑ꢀ5’
),6.86(1h,d,j=1.5hz,h-2’),6.83(1h,dd,j=7.9,1.7hz,h-6’),6.70(2h, d,j=8.4hz,三氟甲苯),6.06(1h,br s,-och2o-),5.96(1h,br s,-och2o-), 5.13(2h,s,h-9),3.88(3h,s,3-och3),3.81(3h,s,4-och3);
13
c nmr(100 mhz,cdcl3)δ170.6(c-9’),152.6(c-3),150.7(c-4),148.2(三氟甲苯),148.1 (c-3’),148.0(c-4’),138.3(c-7),136.0(c-7’),130.9(三氟甲苯),130.8(c-6), 128.6(c-8’),128.5(c-1),127.3(c-1’),124.0(c-6’),119.4(c-8),114.3(三氟甲苯),111.0(c-2’),108.6(c-5’),107.1(c-5),101.9(c-2),101.8(-och2o-),67.8 (c-9),56.5(3-och3),56.3(4-och3)。
[0390]
化合物19f
[0391]
向烘箱干燥的10ml烧瓶加入pd(oac)2(1.12mg,0.005mmol)、binap (5mg,0.008mmol)、cs2co3(49mg,0.15mmol)和18(51mg,0.1mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加氨基苯(19mg,0.2mmol) 的phme溶液。将反应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶液浓缩,并通过制备型tlc纯化给出期望的产物19g(38.7mg,85%):hr-eims m/z[m h]
(计算值456.1447);1h nmr(400mhz,cdcl3)δ7.40(1h,s,h-2),7.22(2h,dd, j=8.5,7.4hz,氨基苯),7.14(1h,s,h-5),6.93(1h,d,j=7.9hz,h-5’),6.89
‑ꢀ
6.87(1h,m,氨基苯),6.86(1h,d,j=1.5hz,h-2’),6.83(1h,dd,j=7.9,1.7 hz,h-6’),6.72(2h,dd,j=1.0,8.5hz,氨基苯),6.06(1h,br s,-och2o-),5.98 (1h,br s,-och2o-),5.07(2h,s,h-9),3.89(3h,s,3-och3),3.80(3h,s,4-och3);
13
c nmr(100mhz,cdcl3)δ170.4(c-9’),151.9(c-3),150.1(c-4),147.6(c
‑ꢀ3’
),147.6(c-4’),144.6(c-7),136.4(c-7’),133.9(氨基苯),130.4(c-6),129.8 (c-1),129.7(c-8’),129.5(氨基苯),128.6(c-1’),123.7(c-6’),120.2(c-8),119.2 (氨基苯),115.6(氨基苯),110.8(c-2’),108.2(c-5’),106.7(c-5),101.7(c-2), 101.3(-och2o-),67.7(c-9),56.1(3-och3),55.9(4-och3)。
[0392]
化合物19g
[0393]
向烘箱干燥的10ml烧瓶加入pd(pph3)4(6.22mg,0.005mmol)和18 (51mg,0.1mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加thf (2.00ml),然后添加et2zn。将反
应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶液浓缩,并通过制备型tlc纯化给出期望的产物19g(25mg,64%):hr-eimsm/z[m h]
393.1324(计算值393.1338);1h nmr(400mhz,dmso-d6)δ7.43 (1h,s,h-2),7.04(1h,d,j=8.1hz,h-5’),7.02(1h,s,h-5),6.90(1h,d,j=1.3 hz,h-2’),6.77(1h,dd,j=7.7,1.3hz,h-6’),6.12(2h,s,-och2o-),5.47(2h, s,h-9),3.99(3h,s,3-och3),3.65(3h,s,4-och3),3.03(2h,q,j=7.3hz,et), 1.28(3h,t,j=7.5hz,et);
13
c nmr(100mhz,dmso-d6)δ169.9(c-9’),151.5 (c-3),149.3(c-4),147.0(c-3’),146.9(c-4’),137.7(c-7),136.7(c-7’),131.7(c
‑ꢀ
6),130.6(c-1),128.7(c-8’),128.5(c-1’),123.6(c-6’),117.6(c-8),110.8(c-2’), 108.1(c-5’),106.1(c-5),102.5(c-2),101.2(-och2o-),67.6(c-9),55.8(3
‑ꢀ
och3),55.2(4-och3),21.5(et),13.9(et)。
[0394]
化合物19h
[0395]
向烘箱干燥的10ml烧瓶加入pd(pph3)4(6.22mg,0.005mmol)、k2co
3 (40mg,0.3mmol)、18(51mg,0.1mmol)和噻吩-2-硼酸(26mg,0.2 mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加dmf。将反应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用 ch2cl2萃取。将所获得的溶液浓缩,并通过制备型tlc纯化给出期望的产物19h(38mg,92%):hr-eimsm/z[m h]
447.0889(计算值447.0902);1hnmr(400mhz,dmso-d6)δ7.87(1h,dd,j=5.1,1.2hz,噻吩),7.42(1h,dd, j=3.5,1.2hz,噻吩),7.41(1h,s,h-2),7.33(1h,dd,j=5.1,3.5hz,噻吩), 7.07(1h,d,j=7.9hz,h-5’),7.06(1h,s,h-5),6.95(1h,d,j=1.5hz,h-2’), 6.83(1h,dd,j=7.9,1.7hz,h-6’),6.13(2h,br s,-och2o-),5.32(2h,s,h-9), 3.77(3h,s,3-och3),3.67(3h,s,4-och3);
13
c nmr(100mhz,dmso-d6)δ 169.2(c-9’),151.7(c-3),149.6(c-4),147.0(c-3’,c-4’),139.6(c-7),138.7(噻吩),135.4(c-7’),131.4(c-6),129.0(c-1),128.6(c-1’),128.1(噻吩),128.1(噻吩),128.1(噻吩),123.6(c-6’),123.5(c-8’),118.0(c-8),110.6(c-2’),108.1(c
‑ꢀ5’
),105.7(c-5),103.7(c-2),101.2(-och2o-),67.9(c-9),55.4(3-och3),55.3 (4-och3)。
[0396]
化合物19i
[0397]
向烘箱干燥的10ml烧瓶加入pd(pph3)4(6.22mg,0.005mmol)、k2co
3 (42mg,0.3mmol)、18(51mg,0.1mmol)和吡啶-3-硼酸(25mg,0.2 mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加2ml dmf。将反应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶液浓缩,并通过制备型tlc纯化给出期望的产物19i(30mg,75%):hr-eimsm/z[m h]
442.1293(计算值442.1291);1h nmr(400mhz,dmso-d6)δ8.80(2h,s,吡啶),8.09(1h,s,吡啶),7.71 (1h,s,h-2),7.09(1h,s,吡啶),7.08(2h,d,j=8.3hz,h-5’),6.97(1h,d,j= 4.2hz,h-2’),6.95(1h,s,h-5),6.85(1h,dd,j=8.6,4.2hz,h-6’),6.14(2h,brs,-och2o-),5.36-5.19(2h,m,h-9),3.71(3h,s,3-och3),3.68(3h,s,4-och3);
13
c nmr(100mhz,dmso-d6)δ169.3(c-9’),151.7(c-3),149.6(c-4,吡啶), 147.1(c-3’,c-4’),139.0(c-7,吡啶),138.7(吡啶),138.0(c-7’),130.8(c-6,吡啶),128.5(c-1’,c-1),128.1(吡啶),127.1(c-8’),123.5(c-6’),117.8(c-8),110.6 (c-2’),108.1(c-5’),105.7(c-5),103.4(c-2),101.2(-och2o-),67.5(c-9),55.4 (3-och3),55.3(4-och3)。
[0398]
化合物19j
[0399]
向烘箱干燥的10ml烧瓶加入pd(pph3)4(6.22mg,0.005mmol)、k2co
3 (42mg,0.3mmol)、18(51mg,0.1mmol)和噻吩-3-硼酸(26mg,0.2 mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加2ml dmf。将反应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶液浓缩,并通过制备型tlc纯化给出期望的产物19j(22mg,50%):hr-eimsm/z[m h]
447.0867(计算值447.0902);1h nmr(400mhz,dmso-d6)δ7.91(1h,d,j=1.4hz,噻吩),7.84(1h,d,j= 4.7hz,噻吩),7.44(1h,d,j=4.9hz,噻吩),7.27(1h,s,h-2),7.06(1h,d,j= 7.9hz,h-5’),7.05(1h,s,h-5),6.95(1h,d,j=1.0hz,h-2’),6.83(1h,dd,j= 7.8,1.3hz,h-6’),6.13(2h,s,-och2o-),5.32(2h,s,h-9),3.76(3h,s,3-och3), 3.66(3h,s,4-och3);
13
c nmr(100mhz,dmso)δ170.0(c-9’),151.9(c-3), 150.0(c-4),147.5(c-3’,c-4’),139.0(c-7),138.3(c-7’),136.0(噻吩),131.3(c
‑ꢀ
6),129.2(c-1),129.0(噻吩),128.8(c-1’),127.8(c-8’),126.6(噻吩),125.9(噻吩),123.9(c-6’),118.4(c-8),111.1(c-2’),108.5(c-5’),106.1(c-5),104.4(c
‑ꢀ
2),101.7(-och2o-),68.4(c-9),55.8(3-och3),55.7(4-och3)。
[0400]
化合物19k
[0401]
向烘箱干燥的10ml烧瓶加入pd(pph3)4(6.22mg,0.005mmol)、na2co
3 (32mg,0.3mmol)、18(51mg,0.1mmol)和呋喃-2-硼酸(26mg,0.2 mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加二氧杂环己烷和h2o (2/0.4ml)。将反应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶液浓缩,并通过制备型 tlc纯化给出期望的产物19k(30mg,70%):hr-eimsm/z[m h]
431.1098 (计算值431.1131);1h nmr(400mhz,dmso-d6)δ7.99(1h,dd,j=1.8,0.7 hz,呋喃),7.73(1h,s,h-2),7.14(1h,dd,j=3.4,0.6hz,呋喃),7.07(1h,d,j =7.9hz,h-5’),7.06(1h,s,h-5),6.95(d,1h,j=1.5hz,呋喃),6.82(1h,dd,j =7.9,1.8hz,h-6’),6.82(1h,d,j=1.9hz,h-2’),6.14(2h,s,-och2o-),5.51 (2h,s,h-9),3.92(3h,s,3-och3),3.68(3h,s,4-och3);
13
c nmr(100mhz, dmso-d6)δ169.2(c-9’),152.0(c-3),149.6(c-4),148.9(呋喃),147.1(c-3’), 147.0(c-4’),143.9(呋喃),138.5(c-7),138.4(c-7’),129.1(c-6),128.9(c-1), 128.2(c-1’),123.5(c-6’),119.8(c-8),118.3(c-8’),112.1(呋喃),111.8(呋喃), 110.7(c-2’),108.1(c-5’),105.9(c-5),104.1(c-2),101.3(-och2o-),68.6(c-9), 55.5(3-och3),55.2(4-och3)。
[0402]
化合物19l
[0403]
向烘箱干燥的10ml烧瓶加入pd(pph3)4(24mg,0.02mmol)、na2co
3 (120mg,1.2mmol)、18(204mg,0.4mmol)、3,6-二氢-2h-吡啶-1-n-boc
‑ꢀ
4-硼酸和频哪醇酯(186mg,0.6mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加二氧杂环己烷和水(4/0.8ml)。将反应混合物加热至80℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。通过硅胶柱纯化混合物给出期望的产物19l(69mg,27%):hr-eimsm/z[m h]
546.2109(计算值546.2128);1h nmr(400mhz,cdcl3)δ7.12(1h,s,h-2), 7.11(1h,s,h-5),6.96(1h,d,j=7.9hz,h-5’),6.84(1h,br s,h-2’),6.81(1h, d,j=8.1hz,h-6’),6.09(1h,br s,-och2o-),6.04(1h,br s,-och2o-),5.88(1h, s,3,6-二氢-2h-吡啶),5.29(2h,s,h-9),4.42-4.05(2h,m,3,6-二氢-2h-吡啶) 3.99(3h,s,3-och3),3.80(3h,s,4-och3),3.69(2h,s,3,6-二氢-2h-吡啶),2.59
ꢀ‑
2.29(2h,m,3,6-二氢-2h-吡啶),1.53(9h,s,boc);
13
c nmr
(100mhz,cdcl3) δ170.1(c-9’),155.1(boc),151.7(c-3),149.8(c-4),147.6(c-3’),147.6(c-4’), 138.9(c-7),136.9(c-7’),131.9(3,6-二氢-2h-吡啶),130.7(c-6),129.4(c-1), 128.4(c-1’),124.5(3,6-二氢-2h-吡啶),123.6(c-6’),123.5(c-8’),118.3(c-8), 108.3(c-2’,c-5’),106.5(c-5),103.3(c-2),101.3(-och2o-),80.2(boc), 67.7(3,6-二氢-2h-吡啶),67.1(c-9),55.9(3-och3),55.9(4-och3),53.5(3,6-二氢-2h-吡啶),29.4(3,6-二氢-2h-吡啶),28.5(boc)。
[0404]
化合物19m
[0405]
向烘箱干燥的10ml烧瓶加入pd2(dba)3(4.58mg,0.005mmol)、 xantphos(2.89mg,0.005mmol)、cs2co3(65mg,0.2mmol)和18(51mg, 0.1mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加吗啉(17mg,0.2 mmol)的甲苯溶液。将反应混合物加热至100℃保持10小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶液浓缩,并通过制备型tlc纯化给出期望的产物19m(20mg,40%):hr-eimsm/z[m h]
(计算值450.1553);1h nmr(400mhz,cdcl3)δ7.79(1h,s,h-2),7.07(1h,s, h-5),6.96(1h,d,j=7.9hz,h-5’),6.82(1h,d,j=1.4hz,h-2’),6.79(1h,dd, j=7.9,1.7hz,h-6’),6.09(1h,br s,-och2o-),6.05(1h,br s,-och2o-),5.52 (2h,s,h-9),4.07(3h,s,3-och3),4.05-4.01(2h,m,吗啉),3.93(2h,td,j= 10.9,2.2hz,吗啉),3.80(3h,s,4-och3),3.28(2h,td,j=11.3,2.9hz,吗啉), 3.13(2h,d,j=11.8hz,吗啉);
13
c nmr(100mhz,cdcl3)δ169.6(c-9’), 151.8(c-3),150.1(c-4),147.5(c-3’,c-4’),142.2(c-7),139.4(c-7’),136.8(c
‑ꢀ
6),132.1(c-1),130.5(c-8’),129.9(c-1’),128.6(c-8),123.5(c-6’),110.6(c
‑ꢀ2’
),108.2(c-5’),106.5(c-5),102.6(c-2),101.2(-och2o-),67.8(吗啉),67.3 (c-9),55.9(3-och3),55.9(4-och3),51.5(吗啉)。
[0406]
化合物19n
[0407]
将18(256mg,0.5mmol)、三丁基(1-乙氧基乙烯基)锡烷(216mg,0.6 mmol)和5ml甲苯的溶液在搅拌下脱气30分钟。然后添加pdcl2(pph3)
2 (34mg,0.05mmol),并将溶液在搅拌下加热至100℃过夜。将10ml的 50%hcl(水溶液)添加到反应混合物中并将溶液搅拌6小时,然后过滤通过硅藻土,该硅藻土有效地除去钯黑。通过硅胶柱纯化混合物给出期望的产物19n(180mg,88%):hr-eims m/z[m h]
393.1324(计算值393.1338);1h nmr(400mhz,dmso-d6)δ7.64(1h,s,h-2),7.07(1h,d,j=7.9hz,h-5’), 7.06(1h,s,h-5),6.96(1h,d,j=1.6hz,h-2’),6.82(1h,dd,j=7.9,1.7hz,h
‑ꢀ6’
),6.14(2h,s,-och2o-),5.55(2h,s,h-9),3.97(3h,s,3-och3),3.68(3h,s, 4-och3),2.76(3h,s,ch3);
13
c nmr(100mhz,dmso-d6)δ202.0(me-c=o), 168.9(c-9’),152.4(c-3),149.7(c-4),147.3(c-3’),147.1(c-4’),141.6(c-7), 139.6(c-7’),129.4(c-6),129.1(c-1),129.0(c-8’),127.9(c-1’),123.5(c-6’), 118.0(c-8),110.6(c-2’),108.2(c-5’),106.0(c-5),104.4(c-2),101.4(-och2o-), 68.6(c-9),55.9(3-och3),55.3(4-och3),31.8(ch3)。
[0408]
化合物19o
[0409]
向烘箱干燥的25-ml烧瓶加入pd(pph3)2cl2(17.5mg,0.025mmol)、 cui(14.3mg,0.075mmol)和18(255mg,0.5mmol)。将烧瓶加盖,然后用n2回填。经由注射器添加三甲基甲硅烷基乙炔(100mg,1mmol)和et3n (150mg,1.5mmol)的5ml dmf溶液。将反应混合物加热至80℃保持10 小时。在冷却至室温之后,将反应溶液用水猝灭并用ch2cl2萃取。将所获得的溶
液浓缩并通过硅胶柱纯化给出期望的产物19o(207mg,90%):hr-eimsm/z[m h]
461.1404(计算值461.1420);1h nmr(400mhz,cdcl3)δ7.62(1h, s,h-2),7.06(1h,s,h-5),6.90(1h,d,j=7.9hz,h-5’),6.78(1h,d,j=1.5hz, h-2’),6.75(1h,dd,j=7.9,1.7hz,h-6’),6.03(1h,br s,-och2o-),5.99(1h,brs,-och2o-),5.34(2h,s,h-9),4.02(3h,s,3-och3),3.75(3h,s,4-och3),0.29 (9h,s,tms);
13
c nmr(100mhz,cdcl3)δ169.9(c-9’),152.6(c-3),150.3(c
‑ꢀ
4),147.9(c-3’),147.7(c-4’),143.2(c-7),140.1(c-7’),133.3(c-6),128.9(c
‑ꢀ1’
),128.1(c-1),123.7(c-8’,c-6’),118.5(c-8),110.7(c-2’),108.4(c-5’),106.5 (c-5),106.2(c≡c),104.5(c≡c),101.5(c-2),98.8(-och2o-),68.3(c-9),56.1 (3-och3),56.0(4-och3),0.23(tms)。
[0410]
化合物19p
[0411]
向25ml圆底烧瓶(配备有热电偶、顶置式搅拌和氮气入口)加入碳酸铯(74.1mg,0.228mmol)、乙酸钯(ii)(0.7mg,0.003mmol)和4,5-双-二苯基膦-9,9-二甲基-9h-氧杂蒽(xantphos,2.82mg,0.005mmol)。将烧瓶抽真空并用氮气回填3
×
。添加二氧杂环己烷(2ml),然后进行另一组三个抽真空和用氮气回填的循环。将淡黄色(canary yellow)浆液在室温搅拌10分钟,并且添加三乙胺(0.68μl,0.005mmol)。在室温继续搅拌10分钟,颜色从黄色逐渐变为红色。经由注射器将18(83mg,0.162mmol)和二苯甲酮亚胺(32.7μl,0.195mmol)添加到1ml的二氧杂环己烷中(1ml洗液)。使反应混合物温热至100℃的内部温度保持12小时。使反应混合物冷却至环境温度,然后将浆液倾注到10ml的乙酸乙酯中。将有机物用2
×
50ml的水洗涤,并使乙酸乙酯溶液真空浓缩。通过快速色谱法在硅胶上纯化混合物,用1:1正己烷:乙酸乙酯洗脱给出呈黄色固体的19p(50mg,57%);1h nmr (400mhz,cdcl3)δ7.88(2h,dt,j=7.1,1.4hz,苯基),7.64-7.55(1h,m,h
‑ꢀ
2),7.50(2h,ddd,j=8.1,6.5,1.4hz,苯基),7.37-7.30(2h,m,苯基),7.25
‑ꢀ
7.18(2h,m,苯基),7.16-7.10(2h,m,苯基),7.10(1h,s,h-5),6.94(1h,dd,j =7.9,0.5hz,h-5’),6.82(1h,dd,j=1.7,0.5hz,h-2’),6.79(1h,dd,j=7.9,1.7 hz,h-6’),6.08(1h,d,j=1.5hz,-och2o-),6.03(1h,d,j=1.5hz,-och2o-), 5.29(2h,s,h-9),3.98(3h,s,3-och3),3.82(3h,s,4-och3);
13
c nmr(100 mhz,cdcl3)δ170.1(c-9’),151.3(c-3),149.8(c-4),147.2(c-3’),147.2(c-4’), 135.7(c-7),134.6(c-7’),131.5(c-6),130.2(c-1),129.9(c-1’),129.8(苯基), 129.3(苯基),128.4(苯基),128.3(苯基),128.2(苯基),128.1(苯基),126.0(c
‑ꢀ6’
),123.6(c-8’),118.3(c-8),110.8(c-2’),107.9(c-5’),106.3(c-5),101.7(c
‑ꢀ
2),101.0(-och2o-),67.0(c-9),56.0(3-och3),55.6(4-och3)。
[0412]
化合物20
[0413]
向19n(41mg,0.1mmol)的1ml meoh溶液中添加nabh4(6mg, 0.15mmol)。将混合物在室温搅拌1小时。tlc显示出反应已经以一个斑点结束,并且通过制备型tlc纯化混合物给出期望的产物20(40mg,99%): hr-eims m/z[m h]
409.1272(计算值409.1287);1h nmr(400mhz,dmso
‑ꢀ
d6)δ7.48(1h,d,j=2.1hz,h-2),7.03(1h,d,j=7.9hz,h-5’),6.99(1h,d,j= 4.0hz,h-5),6.89(1h,dd,j=5.8,1.5hz,h-2’),6.76(1h,ddd,j=7.8,6.0,1.7 hz,h-6’),6.12(2h,s,-och2o-),5.70(1h,m,ch-oh),5.59(2h,br s,h-9),3.97 (3h,s,3-och3),3.64(3h,s,4-och3),1.51(3h,dd,j=6.3,1.3hz,me);
13
cnmr(100mhz,dmso-d6)δ169.5(c-9’),151.2(c-3),149.2(c-4),147.0(c
‑ꢀ3’
),146.9(c-4’),137.2(c-7),136.2(c-7’),
2”),5.12(1h,dd,j=8.3,6.2hz, h-4”),4.26(1h,dd,j=11.8,5.2hz,h-5”a),4.16
–
4.10(1h,m,h-5”b),4.07 (3h,s,3-och3),3.80(3h,s,4-och3),2.12(3h,s,-oac),2.10(3h,s,-oac), 2.04(3h,s,-oac)。
[0429]
全乙酰化patentiflorin a(25b,总收率71%)
[0430]
hr-eims m/z[m h]
653.1744(计算值653.1870);1h nmr(400mhz, cdcl3)δ7.53(1h,d,j=1.9hz,h-2),7.07(1h,s,h-5),6.96(1h,d,j=7.8hz, h-5’),6.85
–
6.81(1h,m,h-2’),6.81
–
6.77(1h,m,h-6’),6.12
–
6.04(2h,m,
‑ꢀ
och2o-),5.50
–
5.43(2h,m,h-9),5.39(1h,dd,j=14.7,2.4hz,h-2”),5.27 (1h,t,j=9.6hz,h-3”),5.12(1h,d,j=7.9hz,h-1”),5.00(1h,t,j=9.6hz, h-4”),4.07(3h,s,3-och3),3.81(3h,s,4-och3),3.61(1h,ddd,j=9.7,6.1, 1.2hz,h-5”),2.12(3h,s,-oac),2.06(3h,s,-oac),2.06(3h,s,-oac),1.28 (3h,dd,j=6.1,1.4hz,h-6”)。
[0431]
7β-d-木糖氧基山荷叶素(26a,总收率66%)
[0432]
hr-eims m/z[m h]
513.1389(计算值513.1397);1h nmr(400mhz, methanol-d6)δ8.13(1h,s,h-2),7.09(1h,d,j=1.8hz,h-5),6.97(1h,d,j= 7.9hz,h-5’),6.82(1h,dd,j=3.1,1.3hz,h-2’),6.79(1h,dt,j=7.9,1.8hz, h-6’),6.08-6.04(2h,m,-och2o-),5.58(1h,dd,j=15.2,1.6hz,h-9),5.46 (1h,dd,j=15.2,2.0hz,h-9),4.03(3h,s,3-och3),3.98(1h,d,j=6.5hz,h
‑ꢀ
1”),3.98-3.92(1h,m,h-5”),3.74(3h,s,4-och3),3.64(1h,m,h-2”),3.51
‑ꢀ
3.44(1h,m,h-4”),3.16-3.11(2h,m,h-3”,h-5”)。
[0433]
patentiflorin a(26b,总收率68%)
[0434]
hr-eims m/z[m h]
527.1526(计算值527.1553);1h nmr(400mhz, cd3od)δ7.99-7.92(1h,m,h-2),6.86(1h,m,h-5),6.82-6.77(1h,m,h-5’), 6.63(1h,m,h-2’),6.59(1h,m,h-6’),5.94(1h,d,j=1.2hz,-och2o-),5.93 (1h,dd,j=2.2,1.3hz,-och2o-),5.50-5.27(2h,m,h-9),4.67(1h,d,j=7.9 hz,h-1”),3.88(3h,s,3-och3),3.57(3h,s,4-och3),3.54(1h,m,h-2”),3.33 (1h,t,j=9.1hz,h-3”),3.05(1h,t,j=9.2hz,h-4”),3.170(1h,m,h-5”), 1.21(3h,m,h-6”)。
[0435]
7-o-α-l-阿拉伯糖基山荷叶素(26c,总收率45%)
[0436]
hr-eims m/z[m h]
513.1305(计算值513.1397);1h nmr(400mhz, 丙酮-d6)δ8.21(1h,s,h-2),7.07(1h,d,j=2.2,h-5),6.95(1h,d,j=7.9hz, h-5’),6.85(1h,dd,j=5.8,1.7hz,h-2’),6.79(1h,dt,j=7.9,2.0hz,h-6’), 6.10-6.04(2h,m,-och2o-),5.62-5.34(3h,m,h-9,h-1”),4.98(1h,dt,j= 4.2,1.9hz,oh-3”),4.87(1h,dd,j=7.1,2.0hz,h-1”),4.24(1h,t,j=5.9hz, oh-2”),4.03(1h,ddd,j=8.7,7.0,4.3hz,h-2”),3.96(3h,s,3-och3),3.98
‑ꢀ
3.94(1h,m,h-5”),3.91-3.84(1h,m,h-4”),3.70(3h,s,4-och3),3.68-3.72 (1h,m,h-3”),3.57(1h,d,j=12.4hz,h-5”)。
[0437]
7-o-β-l-吡喃岩藻糖基山荷叶素(26d,总收率49%)
[0438]
hr-eims m/z[m h]
527.1433(计算值527.1553);1h nmr(400mhz, dmso-d6)δ8.20d(1.9hz,h-2),7.05(1h,dd,j=7.9,1.4hz,h-5’),6.99(1h, d,j=2.1hz,h-5),6.94(1h,dd,j=11.1,1.5hz,h-2’),6.81(1h,ddd,j=7.8, 6.0,1.6hz,h-6’),6.13(2h,s,-och2o-),5.59-5.44(3h,m,h-9,oh-2”),4.89 (1h,dd,j=14.7,3.1hz,oh-3”),4.70(1h,dd,j=7.7,4.9hz,h-1”),4.20(1h, d,j=7.3hz,oh-4”),3.95(3h,s,3-och3),3.75(dd,j
=9.4,7.7hz,1h),3.67 (3h,s,4-och3),3.62(1h,d,j=6.4hz,h-2”),3.50-3.42(3h,m,h-3”,h-4”, h-5”),1.19(3h,d,j=6.2hz,h-6”)。
[0439]
7-o-β-d-吡喃岩藻糖基山荷叶素(26e,总收率67%)
[0440]
hr-eims m/z[m h]
527.1550(计算值527.1553);1h nmr(400mhz, 丙酮-d6)δ8.29-8.08(1h,m,h-2),7.12-7.01(1h,m,h-5),6.96(1h,q,j=7.8 hz,h-5’),6.81(2h,m,h-2’,h-6’),6.08(2h,t,j=7.5hz,-och2o-),5.62-5.48 (1h,m,h-9),5.50-5.35(1h,m,h-9),5.30-5.15(1h,m,oh-2”),4.87(1h,dt, j=11.7,6.2hz,h-1”),4.69(1h,s,oh-4”),4.02-3.95(2h,m,h-3”,h-4”),3.79 (3h,d,j=7.4hz,3-och3),3.76-3.72(1h,m,h-2”),3.70(4h,m,4-och3,h
‑ꢀ
5”),1.29(q,j=8.2,7.7hz,3h)。
[0441]
7-o-β-d-吡喃葡萄糖基山荷叶素(26f,总收率48%)
[0442]
hr-eims m/z[m h]
543.1500(计算值543.1503);1h nmr(400mhz, 丙酮-d6)δ8.22(1h,dq,j=9.0,4.9hz,h-2),7.05(1h,m,h-5),6.95(1h,tq,j =8.2,4.0hz,h-5’),6.89-6.74(2h,m,h-2’,h-6’),6.07(2h,m,-och2o-),5.73 (1h,m,h-9),5.48-5.36(1h,m,h-9),5.22(1h,q,j=4.3hz,oh-3”),4.91(1h, tt,j=7.6,3.9hz,oh-4”),4.65(1h,d,j=4.6hz,h-1”),4.43(1h,d,j=4.8hz, oh-6”),3.97(4h,m,3-och3,h-6”),3.70(5h,m,4-och3,h-6”,h-2”),3.61
‑ꢀ
3.43(2h,m,h-5”,h-3”),3.39(1h,m,h-4”)。
[0443]
7-o-β-d-吡喃半乳糖基山荷叶素(26g,总收率64%)
[0444]
hr-eims m/z[m h]
543.1370(计算值543.1503);1h nmr(400mhz, 丙酮-d6)δ8.22(1h,d,j=1.0hz,h-2),7.10(1h,s,h-5),6.98(1h,dt,j=7.9, 0.6hz,h-5’),6.91-6.85(1h,m,h-2’),6.85-6.79(1h,m,h-6’),6.13-6.06(2h, m,-och2o-),5.84-5.35(2h,m,h-9),4.96-4.83(1h,m,h-1”),4.34-4.19(1h, m,oh),4.08-4.01(2h,m,h-2”,h-4”),4.00(3h,s,3-och3),3.97-3.82(3h, m,h-5”,h-6”),3.73(3h,s,4-och3),3.54-3.69(1h,m,h-3”)。
[0445]
一般程序b:3
”‑
羟基的选择性修饰
[0446]
在四丁基乙酸铵(tboac)(27mg,0.09mmol)存在下,在40℃允许糖苷26a或26b(0.3mmol)与含乙酸酐(32μl,0.32mmol)的无水乙腈 (mecn)(1.5ml)反应12小时。使溶液真空浓缩得到呈浅黄色固体的含有27aa-27af的混合物(总混合物收率,得自26a:52%)或含有27ba-27bf 的混合物(总混合物收率,得自26b:50%)。通过快速柱色谱法(石油醚 /etoac=1.5/1)纯化含有27aa-27af的化合物混合物得到六种单一化合物 27aa-27af(27aa、27ab、27ac、27ad、27ae和27af)。通过快速柱色谱法(石油醚/etoac=1.5/1)纯化含有27ba-27bf的化合物混合物得到六种单一化合物27ba-27bf(27ba、27bb、27bc、27bd、27be和27bf)。
[0447]
在0℃向27ab或27bb(0.036mmol)在ch2cl2(3ml)中的悬浮液添加三乙胺(et3n)(50μl,0.36mmol)和氯甲酸烯丙酯(allococl)(10.7μl, 0.1mmol),并使反应缓慢地温热至室温。在12小时之后,将反应混合物倾注到h2o中,并用ch2cl2萃取。将有机层用盐水洗涤,经na2so4干燥,并减压蒸发给出呈白色固体的含有28ab1-28ab3的化合物混合物(总混合物收率,得自27ab:45%)或含有28bb1-28bb3的化合物混合物(总混合物收率,得自27bb:52%)。通过快速柱色谱法(石油醚/etoac=1/1)纯化含有28ab1
‑ꢀ
28ab3的化合物混合物得到三种单一化合物28ab1-28ab3(28ab1、28ab2和 28ab3)。通过快速柱色谱法(石油醚/etoac=1/
1)纯化含有28bb1-28bb3的化合物混合物得到三种单一化合物28bb1-28bb3(28bb1、28bb2和28bb3)。
[0448]
在0℃向28ab3或28bb3(0.004mmol)的6ml meoh/ch2cl2(v/v=1/2) 溶液中滴加乙酰氯(accl)(15μl)。将反应混合物搅拌72小时,然后用et3n 猝灭。真空移除挥发物。通过硅胶柱色谱法(石油醚/etoac 1/1)纯化所得的残余物得到呈白色固体的29a或29b(18.4mg,67%)。
[0449]
将29a或29b(0.05mmol)、et3n(20.8μl,0.15mmol)和4-二甲基氨基吡啶(dmap)(催化量)溶解于2ml的无水ch2cl2中。在0℃,将所选择的酰氯(0.15mmol)添加到混合物中。允许反应混合物温热至25℃并在 25℃保持搅拌2小时。通过制备型tlc(石油醚/etoac=1/1)纯化混合物给出期望的产物30a-30k。
[0450]
向29a(20mg,0.036mmol)的无水thf(2ml)溶液中相继地添加新鲜粉状koh(3.6mg,0.0648mmol)、18-冠醚-6(0.4mg,0.0014mmol)和苄基溴(11μl,0.09mmol)。将混合物在室温搅拌,并且通过tlc监测反应;在反应结束时,将混合物用ch2cl2稀释并用水洗涤数次。将合并的有机相经na2so4干燥并浓缩。通过制备型tlc(石油醚/etoac=1/1)纯化所获得的残余物给出期望的产物30l。
[0451]
向30a-30l(0.045mmol)的无水thf(4ml)溶液中依序添加三苯基膦 (pph3)(5.9mg,0.023mmol)、et3n(31.2μl,0.225)、hcooh(17μl, 0.45mmol)和四(三苯基膦基)钯(0)[pd(pph3)4](5mg,0.0025mmol)。在氮气下,将溶液在55℃搅拌4小时并真空浓缩给出混合物。将该混合物在制备型tlc(石油醚/etoac=1/1)上色谱分离给出期望的产物31a-31l。
[0452]4”‑
乙酰基-7-o-β-d-木糖基山荷叶素(27aa)
[0453]
hr-eims m/z[m h]
555.1406(计算值555.1503);1h nmr(400mhz, 丙酮-d6)δ7.63(1h,d,j=1.0hz,h-2),7.07(1h,d,j=2.3hz,h-5),7.01
–
6.94 (1h,m,h-5’),6.85(1h,d,j=1.6hz,h-2’),6.80(1h,ddd,j=7.9,1.6,0.4hz, h-6’),6.10(2h,dt,j=4.9,1.0hz,-och2o-),5.60
–
5.45(2h,m,h-9),5.33(1h, d,j=7.8hz,h-1”),5.22(1h,dd,j=9.1,7.8hz,h-2”),4.08(1h,dd,j=11.4, 5.2hz,h-5”a),4.03(3h,s,3-och3),3.70-3.80(1h,m h-3”),3.70-3.80(1h,mh-4”),3.73(3h,s,4-och3),3.46(1h,dd,j=11.3,10.1hz,h-5”b),2.09(3h,s, oac)。
[0454]3”‑
乙酰基-7-o-β-d-木糖基山荷叶素(27ab)
[0455]
hr-eims m/z[m h]
555.1439(计算值555.1503);1h nmr(400mhz, 丙酮-d6)δ8.08(1h,d,j=3.3hz,h-2),7.05(1h,br s,h-5),6.99-6.93(1h,m, h-5’),6.89(1h,m,h-2’),6.79(1h dd,j=1.8,6.0hz,h-6’),6.13-6.07(2h,m,
ꢀ‑
och2o-),5.53(1h,d,j=15.0hz,h-1”),5.41(1h d,j=15.1hz,h-3”),5.11
ꢀ‑
5.01(2h,m,br s,h-9),4.04(1h,m,h-5”),3.94(3h,s,3-och3),3.91-3.82 (1h,m,h-2”),3.69(3h,d,j=6.5hz,4-och3),3.47-3.35(1h,m,h-5”),2.10 (3h,s,oac);
13
c nmr(100mhz,丙酮-d6)δ171.0(oac),169.8(c-9’),153.0 (c-3),151.5(c-4),148.4(c-3’),148.3(c-4’),145.8(c-7),136.7(c-7’),131.4(c
‑ꢀ
1),129.7(c-6),128.1(c-1’),124.6(c-6’),120.0(c-8),111.8(c-8’),111.7(c-2’), 108.7(c-5’),106.7(c-5),106.6(c-1”),102.4(c-2),102.2(-och2o-),78.8(c
‑ꢀ
3”),73.2(c-2”),69.1(c-4”),67.8(c-9),66.8(c-5”),56.4(3-och3),55.8(4
‑ꢀ
och3),21.2(-oac)。
[0456]
3”,4
”‑
二乙酰基-7-o-β-d-木糖基山荷叶素(27ad)
alloc),4.10 (1h,dd,j=11.2,5.5hz,h-5”a),4.02(3h,s,3-och3),3.99(1h,br td,j=10.2, 5.5hz,h-4”),3.72(3h,s,4-och3),3.51(1h,br t,j=10.9hz,h-5”b),2.08(3h, s,oac)。
[0476]2”‑
o-烯丙基氧羰基-3
”‑
乙酰基-7-o-β-d-木糖基山荷叶素(28ab2)
[0477]
hr-eims m/z[m h]
639.1514(计算值639.1714);1h nmr(400mhz, 丙酮-d6)δ8.09(1h,s,h-2),7.10(1h,dd,j=4.1,1.6hz,h-5),6.98(1h,dd,j= 7.9,1.6hz,h-5’),6.91
–
6.85(1h,m,h-2’),6.85
–
6.78(1h,m,h-6’),6.10(2h, dt,j=5.2,1.3hz,-och2o-),5.93(1h,ddt,j=16.2,10.8,5.6hz,o-alloc),5.76 (1h,dt,j=5.0,2.4hz,o-alloc),5.60
–
5.41(2h,m,h-9),5.29(1h,bt t,j=9.5 hz,h-3”),5.25
–
5.20(1h,m,o-alloc),5.14(1h,d,j=7.6hz,h-1”),4.88(1h, br td,j=9.5,5.5hz,h-4”),4.68
–
4.54(2h,m,o-alloc),4.26(1h,dd,j=11.6, 5.5hz,h-5”a),4.03(1h,dd,j=9.5,7.6hz,h-2”),3.96(3h,s,3-och3),3.72 (3h,s,4-och3),3.61(1h,br t,j=11.2hz,h-5”b),2.06(3h,s,oac)。
[0478]
2”,4
”‑
o-二烯丙基氧羰基-3
”‑
乙酰基-7-o-β-d-木糖基山荷叶素(28ab3)
[0479]
hr-eims m/z[m h]
723.1703(计算值723.1925);1h nmr(400mhz, cdcl3)δ7.55(1h,s,h-2),7.09(1h,s,h-5),6.96(1h,dd,j=8.2,1.0hz,h-2’), 6.87-6.77(2h,m,h-5’,6’),6.12-6.04(2h,m,-och2o-),5.90(2h,m,h-9), 5.52-5.20(8h,m,o-alloc),5.05(1h,d,j=7.7hz,h-1”),5.04-4.95(1h,m, h-3”),4.75-4.59(4h,m,o-alloc),4.24(1h,dd,j=11.8,5.5hz,h-5”),4.06 (3h,s,3-och3),3.81(3h,s,4-och3),3.36(1h,dd,j=11.7,10.1hz,h-5”), 2.11(3h,s,oac);
13
c nmr(100mhz,丙酮-d6)δ170.2(oac),169.6(c-9’), 155.3(o-alloc),155.1(o-alloc),153.2(c-3),151.5(c-4),148.4(c-3’),148.3(c
‑ꢀ4’
),144.7(c-7),132.9(o-alloc),132.8(o-alloc),136.7(c-7’),131.4(c-1),129.6 (c-6),127.2(c-1’),124.6(c-6’),120.1(c-8),119.2(o-alloc),118.9(o-alloc), 111.7(c-2’),111.7(c-8’),108.7(c-1”,c-5’),106.9(c-5),102.5(c-2),102.2(
‑ꢀ
och2o-),79.1(c-3”),75.7(c-2”),72.1(c-4”),69.6(o-alloc),69.3(alloc),67.5 (c-9),63.4(c-5”),56.5(3-och3),55.8(4-och3),21.2(o-alloc)。
[0480]
2”,4
”‑
o-二烯丙基氧羰基-3
”‑
乙酰基-7-o-β-d-patentiflorin a(28bb3)
[0481]
hr-eims m/z[m h]
737.1950(计算值737.2082);1h nmr(400mhz, cdcl3)δ7.56(1h,s,h-2),7.08(1h,s,h-5),7.00-6.91(1h,m,h-5’),6.86
‑ꢀ
6.73(2h,m,h-2’,6’),6.08(1h,br s,och2o)6.04(1h,br s,-och2o-),5.90(2h, m,h-9),5.53-5.20(9h,m,o-alloc,2”,4”),5.08(1h,dd,j=8.5,4.4hz,h-1”), 4.78(1h,td,j=9.4,4.5hz,h-3”),4.65(4h,dt,j=22.0,5.1hz,o-alloc),4.04 (3h,s,3-och3),3.79(3h,s,4-och3),3.58(1h,dq,j=10.5,5.0hz,h-5”),2.06 (3h,s,oac),1.27(3h,d,j=25.1hz,h-6”);
13
c nmr(100mhz,cdcl3)δ 170.1(oac),169.6(c-9’),154.1(o-alloc),152.2(c-3),150.3(c-4),147.6(c-3’), 147.5(c-4’),143.3(c-7),137.0(c-7’),131.5(c-6),131.2(c-8),131.0(c-1), 130.8(o-alloc),128.1(c-1’),123.6(c-6’),119.9(o-alloc),119.4(o-alloc),118.9 (c-8’),110.6(c-2’),108.2(c-5’),106.3(c-1”),101.5(c-5),101.3(c-2),100.0 (-och2o-),75.9(c-3”),72.3(c-2”),70.4(c-4”),69.4(o-alloc),69.1(o-alloc), 68.5(c-5”),67.2(c-9),56.6(3-och3),55.9(4-och3),20.7(c-6”),17.4(oac)。
[0482]
2”,4
”‑
o-二烯丙基氧羰基-7-o-β-d-木糖基山荷叶素(29a,收率92%)
[0483]
hr-eims m/z[m h]
681.1696(计算值681.1819);h nmr(400mhz,丙酮-d6)δ7.58(1h,s,h-2),6.99(1h,s,h-5),6.86(1h,m,h-5’),6.72(2h,m,h
‑ꢀ2’
,6’),5.98(2h,m,h-9),5.85(9h,m,o-alloc,-och2o-,h-1”,h-2”,h-4”), 4.73(1h,d,j=7.7hz,h-5”),4.56(4h,m,o-alloc),4.12(1h,m,h-3”),3.92 (3h,s,3-och3),3.61(3h,s,4-och3),3.42(1h,m,h-5”);
13
c nmr(100mhz, 丙酮-d6)δ169.6(c-9’),155.4(o-alloc),155.2(o-alloc),153.2(c-3),151.6(c
‑ꢀ
4),148.4(c-3’),148.3(c-4’),144.7(c-7),138.1(c-7’),132.9(o-alloc),132.8 (o-alloc),131.4(c-1),129.1(c-6),127.2(c-1’),124.6(c-8),124.5(c-6’),120.1 (o-alloc),119.2(o-alloc),118.9(c-8’),111.7(c-2’),108.7(c-1”,c-5’),106.9 (c-5),102.6(c-2),102.2(-och2o-),78.7(c-3”),75.7(c-2”),72.1(c-4”),69.6 (o-alloc),69.3(o-alloc),67.5(c-9),63.4(c-5”),56.5(3-och3),55.8(4-och3)。
[0484]
2”,4
”‑
o-二烯丙基氧羰基-7-o-β-d-patentiflorin a(29b,收率83%)
[0485]
hr-eims m/z[m h]
695.1911(计算值695.1976);1h nmr(400mhz, cdcl3)δ7.62(1h,s,h-2),7.09(1h,s,h-5),6.95(1h,dd,j=8.2,1.4hz,h-5’), 6.84-6.77(2h,m,h-2’,6’),6.12-6.01(2h,m,-och2o-),5.93(2h,m,o-alloc), 5.50-5.25(6h,m,h-9,o-alloc),5.15(1h,dd,j=9.7,8.1hz,h-1”),4.99(1h, d,j=8.1hz,h-2”),4.74-4.63(5h,m,h-4”,o-alloc),4.06(3h,s,3-och3), 3.88(1h,t,j=9.5hz,h-3”),3.80(3h,s,4-och3),3.49(1h,ddt,j=12.7,6.6, 4.9hz,h-5”),1.31(3h,dd,j=6.1,1.7hz,h-6”);
13
c nmr(100mhz,cdcl3) δ169.8(c-9’),155.0(o-alloc),154.9(o-alloc),152.3(c-3),150.4(c-4),147.7 (c-3’),147.7(c-4’),143.7(c-7),137.0(c-7’),131.1(c-8),130.9(c-1),128.3(c
‑ꢀ
6),126.9(c-1’),123.7(c-6’),120.2(o-alloc),119.7(o-alloc),119.3(c-8’),110.8 (c-2’),108.3(c-5’),106.4(c-1”),101.6(c-5),101.4(c-2),100.2(-och2o-), 79.3(c-3”),78.2(c-1”),73.5(c-4”),70.5(c-5”),69.7(o-alloc),69.4(o-alloc), 67.3(c-9),56.7(3-och3),56.0(4-och3),17.5(c-6”)。
[0486]
2”,4
”‑
o-二烯丙基氧羰基-3
”‑
o-二甲基氨基甲酰基-7-o-β-d-木糖基山荷叶素(30a,收率99%)
[0487]
hr-eims m/z[m h]
752.2133(计算值752.2191);1h nmr(400mhz, cdcl3)δ7.56(1h,s,h-2),7.07(1h,d,j=1.8hz,h-5),6.93(1h,dd,j=8.1, 1.1hz,h-5’),6.83
–
6.74(2h,m,h-2’,h-6’),6.05(2h,dt,j=17.9,1.5hz,
‑ꢀ
och2o-),5.89(2h,ddtd,j=17.6,10.4,5.8,1.5hz,o-alloc),5.52
–
5.39(2h, m,h-9),5.35(1h,m,h-1”),5.31(1h,br t,j=1.6hz,h-3”),5.27
–
5.23(4h, m,o-alloc),5.10
–
5.06(1h,m,h-2”),5.02(1h,tdd,j=9.7,4.8,2.1hz,h-4”), 4.73
–
4.59(4h,m,o-alloc),4.20(1h,ddd,j=11.8,5.4,1.1hz,h-5”a),4.04 (3h,s,3-och3),3.78(3h,s,4-och3),3.40(1h,ddd,j=11.9,9.9,0.9hz,h
‑ꢀ
5”b),2.91[6h,s,oc(o)n(ch3)2].
[0488]
2”,4
”‑
o-二烯丙基氧羰基-3
”‑
o-(3,5-二硝基苯甲酰基)-7-o-β-d-木糖基山荷叶素(30b,收率90%)
[0489]
hr-eims m/z[m h]
889.1763(计算值889.1940);1h nmr(400mhz, cdcl3)δ9.26(1h,t,j=2.1hz,3,5-二硝基苯甲酰基),9.15(2h,d,j=2.1hz, 3,5-二硝基苯甲酰基),7.59(1h,s,h-2),7.09(1h,d,j=1.2hz,h-5),6.94(1h, dd,j=7.9,3.8hz,h-5’),6.81(1h,dd,j=9.7,1.6hz,h-2’),6.78
–
6.72(1h,m, h-6’),6.10
–
6.01(2h,m,-och2o-),5.76
(2h,ddt,j=17.2,16.1,5.7hz,o
‑ꢀ
alloc),5.61(1h,t,j=9.4hz,o-alloc),5.54
–
5.48(1h,m,o-alloc),5.48
–
5.43 (2h,m,h-9),5.24(1h,d,j=8.2hz,h-1”),5.20(2h,ddd,j=8.0,2.8,1.4hz, o-alloc),5.14(1h,dd,j=6.4,1.2hz,h-2”),5.11(1h,dd,j=6.5,1.2hz,h
‑ꢀ
3”),5.02(1h,t,j=9.5hz,h-4”),4.55(4h,ddt,j=20.0,5.7,1.4hz,o-alloc), 4.06(3h,s,3-och3),3.79(3h,s,4-och3),3.73
–
3.67(1h,m,h-5”),1.37(3h, dd,j=6.1,1.7hz,h-6”)。
[0490]3”‑
o-二甲基氨基甲酰基-7-o-β-d-木糖基山荷叶素(31a,两步的收率 69%)
[0491]
hr-eims m/z[m h]
584.1723(计算值584.1768);1h nmr(400mhz, 丙酮-d6)δ8.15(1h,d,j=1.6hz,h-2),7.10(1h,d,j=4.4hz,h-5),6.98(1h, dd,j=7.9,1.5hz,h-5’),6.88(1h,dd,j=15.7,1.6hz,h-2’),6.83(1h,td,j= 7.9,1.7hz,h-6’),6.10(2h,dt,j=4.8,1.3hz,-och2o-),5.56-5.38(3h,m,h
‑ꢀ
9,h-1”),5.02(1h,d,j=7.6hz,h-3”),4.79-4.67(2h,m,oh-2”,oh-4”),4.05 (1h,ddd,j=11.5,5.5,1.9hz,h-2”),3.97(3h,s,3-och3),3.89(2h,m,h-4”, h-5”),3.73(3h,d,j=1.4hz,4-och3),3.39(1h,ddd,j=11.4,10.0,1.1hz,h
‑ꢀ
5”),3.02(3h,s,ocon(ch3)2),2.93(3h,s,ocon(ch3)2);
13
c nmr(100mhz, 丙酮-d6)δ169.8(c-9’),158.3(ocon(ch3)2),153.0(c-3),151.5(c-4),148.4(c
‑ꢀ3’
),148.3(c-4’),145.9(c-7),136.7(c-7’),131.5(c-1),131.4(c-6),129.7(c
‑ꢀ1’
),128.1(c-8),124.6(c-6’),120.0(c-8’),111.8(c-2’),111.7(c-5’),108.7(c
‑ꢀ
1”),106.8(c-2),102.4(c-5),102.2(-och2o-),81.5(c-3”),73.5(c-2”),69.3 (c-4”),67.8(c-9),66.7(c-5”),56.3(3-och3),55.8(4-och3), 36.7(ocon(ch3)2),36.2(ocon(ch3)2)。
[0492]3”‑
o-(3,5-二硝基苯甲酰基)-7-o-β-d-patentiflorin a(31b,两步的收率77%)
[0493]
hr-eims m/z[m h]
721.1337(计算值721.1517);1h nmr(400mhz, 丙酮-d6)δ9.17(3h,m,3,5-二硝基苯甲酰基),8.11(1h,dt,j=6.9,3.1hz,h-2), 7.13-7.05(1h,m,h-5),6.99(1h,dd,j=7.7,1.7hz,h-5’),6.89(1h,dd,j= 11.2,1.5hz,h-2’),6.83(1h,ddd,j=9.4,5.5,1.6hz,h-6’),6.16-6.08(2h,m,
ꢀ‑
och2o-),5.75-5.41(4h,m,h-9,oh-2”,oh-4”),5.18(1h,d,j=7.8hz,h
‑ꢀ
1”),4.95(1h,d,j=4.9hz,h-2”),4.21(1h,ddd,j=9.7,7.8,5.3hz,h-4”), 3.95(3h,s,3-och3),3.71(5h,m,4-och3,h-3”,h-5”),1.41(3h,d,j=5.1hz, h-6”);
13
c nmr(100mhz,丙酮-d6)δ169.8(c-9’),163.4(3,5-二硝基苯甲酰基),152.9(c-3),151.4(3,5-二硝基苯甲酰基),151.3(3,5-二硝基苯甲酰基), 149.7(c-4),148.3(c-3’),148.3(c-4’),145.8(c-7),136.7(c-7’),134.8(3,5-二硝基苯甲酰基),131.4(c-1),130.1(3,5-二硝基苯甲酰基),129.6(c-8),128.1(c
‑ꢀ
6),124.6(c-1’),123.3(c-6’),120.0(3,5-二硝基苯甲酰基),111.7(c-8’),111.7 (c-2’),108.7(c-5’),106.7(c-2),105.5(c-1”),102.3(c-5),102.2(-och2o-), 81.4(c-3”),74.1(c-2”),73.4(c-4”),73.0(c-5”),67.8(c-9),56.3(3-och3), 55.8(4-och3),18.1(c-6”)。
[0494]3”‑
o-丁酰基-7-o-β-d-patentiflorin a(31c,两步的收率77%)
[0495]
hr-eims m/z[m h]
597.1968(计算值597.1972);1h nmr(400mhz, 丙酮-d6)δ8.12(1h,s,h-2),7.08(1h,t,j=4.7hz,h-5),6.98(1h,ddd,j=8.0, 3.6,1.3hz,h-5’),6.93-6.75(2h,m,h-2’,h-6’),6.14-6.05(2h,m,h-9),5.64
ꢀ‑
5.39(2h,m,-och2o-),5.31(1h,ddt,j=6.2,4.6,1.8hz,h-1”),5.13-5.02 (2h,m,oh),4.52(1h,d,j=6.0hz,h-3”),3.96(3h,d,j=2.9hz,3-och3), 3.91-3.82(1h,m,h-2”),3.71(3h,dd,j=5.5,3.1hz,4-och3),
3.55(1h,dd,j =9.7,5.9hz,h-4”),3.37(1h,ddd,j=9.6,5.6,3.8hz,h-5”),2.38(2h,td,j= 7.4,1.6hz,o-丁酰基),1.66(2h,dd,j=7.5,1.6hz,o-丁酰基),1.35(3h,dd,j =5.9,1.8hz,o-丁酰基),0.97(3h,td,j=7.4,1.7hz,h-6”);
13
c nmr(100 mhz,丙酮-d6)δ173.6(o-丁酰基),169.8(c-9’),152.9(c-3),151.4(c-4),148.3 (c-3’),148.3(c-4’),145.9(c-7),136.6(c-7’),131.4(c-1),131.3(c-6),129.7(c
‑ꢀ1’
),128.2(c-8),124.6(c-6’),111.8(c-8’),111.7(c-2’),108.6(c-5’),106.6(c
‑ꢀ
2),105.8(c-1”),102.4(c-5),102.2(-och2o-),78.3(c-3”),74.5(c-2”),73.7 (c-4”),73.1(c-5”),67.9(c-9),56.3(3-och3),55.7(4-och3),36.7(o-丁酰基), 19.0(c-6”),18.1(o-丁酰基),13.9(o-丁酰基)。
[0496]3”‑
o-苯甲酰基-7-o-β-d-patentiflorin a(31d,两步的收率72%)
[0497]
hr-eims m/z[m h]
631.1810(计算值631.1816);1h nmr(400mhz, 丙酮-d6)δ8.13(1h,dt,j=6.2,3.0hz,h-2),8.11-8.04(2h,m,o-苯甲酰基), 8.01(1h,dd,j=8.3,2.7hz,o-苯甲酰基),7.51(2h,d,j=6.1hz,o-苯甲酰基), 7.05(1h,dq,j=10.2,3.4hz,h-5),6.95(1h,dq,j=6.9,3.8hz,h-5’),6.90
‑ꢀ
6.73(2h,m,h-2’,h-6’),6.07(2h,q,j=2.9,2.2hz,-och2o-),5.62-5.28(4h, m,h-9,oh),5.12(1h,dd,j=7.8,2.1hz,h-1”),4.07(1h,q,j=9.1,6.1hz,h
‑ꢀ
3”),3.91(3h,q,j=2.9,2.5hz,3-och3),3.67(3h,dt,j=7.1,3.5hz,4-och3), 3.64-3.53(3h,m,h-2”,4”和5”),1.42-1.32(3h,m,h-6”);
13
c nmr(100 mhz,丙酮-d6)δ169.9(c-9’),166.6(o-苯甲酰基),152.9(c-3),151.4(c-4), 148.3(c-3’),148.3(c-4’),146.0(c-7),136.6(c-7’),133.8(o-苯甲酰基), 133.7(o-苯甲酰基),131.6(c-1),131.5(c-6),131.3(c-8),130.5(o-苯甲酰基), 130.4(o-苯甲酰基),129.3(o-苯甲酰基),129.3(o-苯甲酰基),128.2(c-1’), 124.6(c-6’),111.8(c-8’),111.7(c-2’),108.7(c-5’),106.6(c-2),105.8(c-1”), 102.4(c-5),102.2(-och2o-),79.5(c-3”),74.5(c-2”),73.8(c-4”),73.1(c-5”), 67.9(c-9),56.3(3-och3),55.7(4-och3),18.2(c-6”)。
[0498]3”‑
o-p-二甲氨基苯甲酰基-7-o-β-d-patentiflorin a(31e,两步的收率51%)
[0499]
hr-eims m/z[m h]
674.2099(计算值674.2238);1h nmr(400mhz, 丙酮-d6)δ8.21(1h,d,j=1.7hz,h-2),7.95-7.90(2h,m,o-p-二甲氨基苯甲酰基),7.11(1h,d,j=2.9hz,h-5),7.01-6.96(1h,m,h-5’),6.93-6.81(2h,m, h-2’,6’),6.79-6.75(m,2h,o-p-二甲氨基苯甲酰基),6.10(2h,ddd,j=4.4, 1.7,1.1hz,-och2o-),5.60(1h,d,j=15.0hz,h-1”),5.50-5.42(2h,m,h-9), 5.24(1h,t,j=9.3hz,oh),5.11(1h,d,j=7.8hz,oh),4.67(1h,dd,j=5.7, 1.0hz,h-3”),4.07-3.99(1h,m,h-2”),3.96(3h,s,3-och3),3.73(3h,d,j= 1.2hz,4-och3),3.65-3.57(1h,m,h-5”),3.52(1h,td,j=9.2,5.5hz,h-4”), 3.07(6h,s,o-p-二甲氨基苯甲酰基),1.39(3h,dd,j=6.0,1.5hz,h-6”);
13
cnmr(100mhz,丙酮-d6)δ169.9(c-9’),167.4(o-p-二甲氨基苯甲酰基),154.6 (o-p-二甲氨基苯甲酰基),153.0(c-3),151.5(c-4),148.4(c-3’),148.3(c-4’), 146.1(c-7),136.6(c-7’),132.3(o-p-二甲氨基苯甲酰基),132.1(o-p-二甲氨基苯甲酰基),131.4(c-1),131.4(c-6),129.7(c-8),128.2(c-1’),124.6(c-6’), 120.0(o-p-二甲氨基苯甲酰基),117.8(o-p-二甲氨基苯甲酰基),111.8(c-8’), 111.5(c-2’),108.7(c-5’),106.7(c-2),105.9(c-1”),102.5(c-5),102.2(
‑ꢀ
och2o-),78.9(c-3”),74.7(c-2”),74.0(c-4”),73.2(c-5”),67.9(c-9),56.3(3
‑ꢀ
och3),55.8(4-och3),40.1(o-p-二甲氨基苯甲酰基),40.1(o-p-二甲氨基苯甲酰基),18.2(c-6”)。
[0500]3”‑
o-二甲基氨基甲酰基-7-o-β-d-patentiflorin a(31f,两步的收率66%)
[0501]
hr-eims m/z[m h]
674.2099(计算值598.1925);1h nmr(400mhz, 丙酮-d6)δ8.16(1h,d,j=2.7hz,h-2),7.07(1h,d,j=4.9hz,h-5),6.97(1h, dd,j=7.9,2.7hz,h-5’),6.92-6.78(2h,m,h-2’,6’),6.13-6.07(2h,m,
‑ꢀ
och2o-),5.59-5.47(2h,m,h-9),5.42(1h,dd,j=15.0,0.8hz,h-1”),5.02 (1h,d,j=7.8hz,h-3”),4.80-4.72(2h,m,oh),3.95(3h,s,3-och3),3.90 (1h,ddd,j=9.4,7.8,4.5hz,h-2”),3.70(3h,d,j=2.6hz,4-och3),3.56-3.45 (1h,m,h-4”),3.39(1h,td,j=9.2,4.4hz,h-5”),3.02(3h,s,o-二甲基氨基甲酰基),2.92(3h,s,o-二甲基氨基甲酰基),1.35(3h,dd,j=6.0,1.5hz,h-6”);
13
c nmr(100mhz,丙酮-d6)δ169.9(c-9’),158.4(o-二甲基氨基甲酰基), 152.9(c-3),151.4(c-4),148.3(c-3’),148.2(c-4’),146.0(c-7),136.6(c-7’), 131.6(c-1),131.5(c-6),129.7(c-8),128.2(c-1’),124.6(c-6’),111.8(c-8’), 111.7(c-2’),108.6(c-5’),106.6(c-2),105.9(c-1”),102.5(c-5),102.2(
‑ꢀ
och2o-),81.4(c-3”),74.7(c-2”),74.0(c-4”),73.0(c-5”),67.9(c-9),56.3(3
‑ꢀ
och3),55.7(4-och3),36.7(o-二甲基氨基甲酰基),36.2(o-二甲基氨基甲酰基),18.1(c-6”)。
[0502]3”‑
o-环丙烷羰基-7-o-β-d-patentiflorin a(31g,两步的收率62%)
[0503]
hr-eims m/z[m h]
595.1808(计算值595.1816);1h nmr(400mhz, 丙酮-d6)δ8.15(1h,d,j=2.1hz,h-2),7.09(1h,d,j=4.2hz,h-5),6.98(1h, dd,j=7.9,2.8hz,h-5’),6.91-6.79(2h,m,h-2’,6’),6.12-6.07(2h,m,
‑ꢀ
och2o-),5.61-5.40(3h,m,h-9,1”),5.10-5.01(2h,m,oh),4.69-4.61(1h, m,h-3”),3.95(3h,s,3-och3),3.89(1h,ddd,j=12.2,8.3,4.1hz,h-2”),3.71 (3h,d,j=2.3hz,4-och3),3.59-3.49(1h,m,h-4”),3.38(1h,dd,j=10.7,7.7 hz,h-5”),1.69(1h,tt,j=7.9,4.7hz,o-环丙烷羰基),1.35(3h,dd,j=6.1,1.5 hz,h-6”),0.90-0.83(4h,m,o-环丙烷羰基);
13
c nmr(100mhz,丙酮-d6)δ 175.1(o-环丙烷羰基),169.8(c-9’),152.9(c-3),151.4(c-4),148.3(c-3’),148.3 (c-4’),146.0(c-7),136.6(c-7’),131.4(c-1),131.3(c-6),129.7(c-8),128.2(c
‑ꢀ1’
),124.6(c-6’),111.7(c-8’),111.7(c-2’),108.6(c-5’),106.6(c-2),105.8(c
‑ꢀ
1”),102.5(c-5),102.2(-och2o-),78.7(c-3”),74.5(c-2”),73.7(c-4”),73.1 (c-5”),67.9(c-9),56.3(3-och3),55.7(4-och3),18.1(c-6”),13.6(o-环丙烷羰基),8.7(o-环丙烷羰基),8.2(o-环丙烷羰基)。
[0504]3”‑
o-p-氯苯甲酰基-7-o-β-d-patentiflorin a(31h,两步的收率80%)
[0505]
hr-eims m/z[m h]
665.1413(计算值665.1426);1h nmr(400mhz, 丙酮-d6)δ8.15(1h,d,j=2.4hz,h-2),8.14-8.08(2h,m,o-p-氯苯甲酰基), 7.61-7.55(2h,m,o-p-氯苯甲酰基),7.08(1h,d,j=6.3hz,h-5),7.00-6.95 (1h,m,h-5’),6.93-6.78(2h,m,h-2’,6’),6.13-6.08(2h,m,-och2o-),5.61
‑ꢀ
5.42(3h,m,h-5,1”),5.35(1h,t,j=9.2hz,oh),5.15(1h,dd,j=7.8,1.2hz, oh),4.80(1h,dd,j=5.7,1.1hz,h-3”),4.09(1h,ddd,j=9.5,7.8,5.4hz,h
‑ꢀ
2”),3.94(3h,s,3-och3),3.70(3h,d,j=3.7hz,4-och3),3.68-3.54(2h,m, h-4”,5”),1.40(3h,dd,j=5.9,1.2hz,h-6”);
13
c nmr(100mhz,丙酮-d6)δ 169.9(c-9’),165.8(o-p-氯苯甲酰基),152.9(c-3),151.4(c-4),148.3(c-3’), 148.3(c-4’),145.9(c-7),139.5(o-p-氯苯甲酰基),136.7(c-7’),132.2(o-p-氯苯甲酰基),131.4(c-1),131.3(c-6),130.4(c-8),129.5(o-p-氯苯甲酰基),128.2 (c-1’),124.6(c-6’),111.8(c-8’),
111.7(c-2’),108.7(c-5’),106.6(c-2),105.7 (c-1”),102.4(c-5),102.2(-och2o-),79.8(c-3”),74.4(c-2”),73.7(c-4”),73.1 (c-5”),67.9(c-9),56.3(3-och3),55.7(4-och3),18.2(c-6”)。
[0506]3”‑
o-吡嗪羰基-7-o-β-d-patentiflorin a(31i,两步的收率52%)
[0507]
hr-eims m/z[m h]
633.1709(计算值633.1720);1h nmr(400mhz, 丙酮-d6)δ8.89(1h,d,j=1.5hz,o-吡嗪羰基),8.49(1h,d,j=2.4hz,o-吡嗪羰基),8.43(1h,dd,j=2.5,1.5hz,o-吡嗪羰基),7.62(1h,d,j=2.1hz,h-2), 6.60(1h,dd,j=7.9,2.4hz,h-5’),6.55(1h,d,j=2.7hz,h-5),6.49(1h,dd,j =12.2,1.7hz,h-6’),6.36(1h,ddd,j=8.6,7.9,1.7hz,h-2’),5.89(1h,dd,j= 5.6,3.3hz,h-3”),5.68(2h,q,j=1.2hz,-och2o-),5.16-5.01(3h,m,h-9, 1”),4.76(1h,t,j=9.3hz,oh),4.60(1h,dd,j=7.8,4.9hz,oh),3.47(3h,s, 3-och3),3.45-3.39(1h,m,h-2”),3.22(3h,s,4-och3),3.16-3.07(2h,m,h
‑ꢀ
4”,5”),0.86-0.80(3h,m,h-6”);
13
c nmr(100mhz,丙酮-d6)δ169.9(c-9’), 168.6(o-吡嗪羰基),153.0(c-3),151.5(c-4),149.7(c-3’),148.3(c-4’),146.2 (o-吡嗪羰基),145.9(o-吡嗪羰基),145.5(c-7),144.8(o-吡嗪羰基),144.2(o
‑ꢀ
吡嗪羰基),136.8(c-7’),131.5(c-1),131.4(c-6),130.1(c-8),128.2(c-1’),124.6 (c-6’),111.8(c-8’),111.7(c-2’),108.7(c-5’),105.6(c-1”),102.4(c-5),102.2, (-och2o-),81.5(c-3”),74.2(c-2”),73.5(c-4”),73.0(c-5”),67.9(c-9),56.3 (3-och3),55.8(4-och3),18.2(c-6”)。
[0508]3”‑
o-氰基乙酰基-7-o-β-d-patentiflorin a(31j,两步的收率49%)
[0509]
hr-eims m/z[m h]
594.1609(计算值594.1612);1h nmr(400mhz, 丙酮-d6)δ7.85(1h,s,h-2),7.09(1h,m,h-5),6.98(1h,dd,j=7.9,2.5hz,h
‑ꢀ5’
),6.89(1h,dd,j=12.2,1.6hz,h-2’),6.85-6.79(1h,m,h-6’),6.15-6.02 (2h,m,-och2o-),5.70-5.37(2h,m,h-9),5.12-4.98(2h,m,h-1”,h-3”), 3.96(3h,d,j=1.6hz,3-och3),3.91(1h,dd,j=9.5,7.8hz,h-2”),3.78-3.66 (3h,m,4-och3),3.55(1h,ddd,j=9.5,6.1,1.2hz,h-4”),3.35(3h,m,o-氰基乙酰基,h-5”),1.36(3h,dd,j=6.0,1.3hz,h-6”);
13
c nmr(100mhz,丙酮
‑ꢀ
d6)δ169.9(c-9’),167.8(o-氰基乙酰基),153.0(c-3),151.5(c-4),148.4(c-3’), 148.3(c-4’),146.0(c-7),136.6(c-7’),131.4(c-1),131.3(c-6)129.7(c-8),128.2 (c-1’),124.6(c-6’),113.8(o-氰基乙酰基),111.8(c-2’),111.8(c-8’),108.7(c
‑ꢀ5’
),106.7(c-2),105.8(c-1”),102.5(c-5),102.2(-och2o-),79.2(c-3”),74.6 (c-2”),73.9(c-4”),73.1(c-5”),67.9(c-9),56.4(3-och3),55.8(4-och3),25.1 (o-氰基乙酰基),18.2(c-6”)。
[0510]3”‑
o-三氯乙酰基-7-o-β-d-patentiflorin a(31k,两步的收率53%)
[0511]
hr-eims m/z[m h]
671.0325(计算值671.0490);1h nmr(400mhz, 丙酮-d6)δ8.15(1h,d,j=1.5hz,h-2),7.11(1h,t,j=2.4hz,h-5),6.98(1h, dd,j=7.9,2.5hz,h-5’),6.90(1h,d,j=1.6hz,h-2’),6.88-6.80(1h,m,h
‑ꢀ6’
),6.10(2h,dt,j=4.7,1.2hz,-och2o-),5.74-5.66(1h,m,4
”‑
oh),5.61
‑ꢀ
5.41(2h,m,h-9),5.12-5.02(1h,m,2
”‑
oh),4.92(1h,t,j=9.3hz,h-1”), 4.84(1h,d,j=8.7hz,h-3”),3.97(3h,d,j=1.3hz,3-och3),3.91(1h,ddd,j =9.5,7.8,5.4hz,h-2”),3.73(3h,d,j=1.6hz,4-och3),3.56(1h,dq,j=12.2, 6.2hz,h-4”),3.42(1h,td,j=9.3,5.9hz,h-5”),1.36(3h,dd,j=6.1,1.5hz, h-6”);
13
c nmr(100mhz,丙酮-d6)δ169.8(c-9’),162.5(o-三氯乙酰基), 153.0(c-3),151.5(c-4),148.4(c-3’),148.3(c-4’),145.9(c-7),136.7(c-7’), 131.5(c-1),131.4(c-6),
129.7(c-8),128.2(c-1’),124.6(c-6’),111.8(c-8’), 111.7(c-2’),108.7(c-5’),106.7(c-2),105.7(c-1”),102.5(c-5),102.2(
‑ꢀ
och2o-),91.4(o-三氯乙酰基),79.6(c-3”),74.1(c-2”),73.3(c-4”),73.1(c
‑ꢀ
5”),67.9(c-9),56.4(3-och3),55.8(4-och3),18.1(c-6”)。
[0512]3”‑
o-苄基-7-o-β-d-木糖基山荷叶素(31l,两步的收率59%)
[0513]
hr-eims m/z[m h]
603.1676(计算值603.1866);1h nmr(400mhz, cdcl3)δ7.85(1h,s,h-2),7.30(5h,m,o-bn),7.01(1h,m,h-5),6.89(1h,m, h-5’),6.74(1h,m,h-2’),6.74(1h,m,h-6’),5.99(2h,m,-och2o-),5.38(2h, m,h-9),4.96(1h,m,h-1”),4.69(2h,m,o-bn),3.96(3h,s,3-och3),3.81(1h, ddj=8.6,7.2hz,h-3”),3.73(3h,s,4-och3),3.60(3h,m,h-2”,4”,5”),3.12 (1h,m,h-5”);
13
c nmr(100mhz,cdcl3)δ169.9(c-9’),152.0(c-3),150.2 (c-4),147.6(c-3’),147.5(c-4’),144.3(c-7),137.6(c-7’),136.6(o-bn),130.8 (c-1),130.7(c-6),128.8(c-8),128.8(o-bn),128.5(o-bn),128.3(o-bn),128.3 (c-1’),127.9(o-bn),127.0(o-bn),123.6(c-6’),119.2(c-8’),110.7(c-2’),108.2 (c-5’),106.4(c-2),104.8(c-1”),101.3(c-5),100.9(-och2o-),81.1(c-3”), 75.6(c-2”),75.3(c-4”),73.4(c-5”),73.04(o-bn),67.4(c-9),56.3(3-och3), 55.9(4-och3)。
[0514]
3”,4
”‑
缩丙酮-4-o-β-d-吡喃葡萄糖基山荷叶素(32a)
[0515]
向化合物26f(54.2mg,0.1mmol)的3ml 2,2-二甲基丙烷(dmp)溶液中添加催化量的tsoh(0.19mg,0.001mmol)(如图6所示)。将反应在室温下搅拌12小时之后,减压蒸发移除过量的dmp。通过硅胶柱分离(正己烷:乙酸乙酯=1:1)纯化残余物得到呈白色固体的32a(11.4mg,20%): hr-eims m/z[m h]
583.1656(计算值583.1816);1h nmr(400mhz,丙酮
‑ꢀ
d6)δ8.22(1h,s,h-2),7.09(1h,s,h-5),6.97(1h,dd,j=7.8,2.2hz,h-5’),6.87 (1h,dd,j=6.8,2.2hz,h-2’),6.81(1h,q,j=7.4hz,h-6’),6.10(2h,d,j=3.6 hz,-och2o-),5.52
–
5.34(2h,m,h-9),5.32(1h,s,-oh),5.03(1h,dd,j=7.7, 2.8hz,h-1”),4.66(1h,s,-oh),3.98(3h,s,3-och3),3.96-3.82(2h,m,h-2”, h-3”),3.79(1h,td,j=7.9,3.3hz,h-6”),3.72(3h,s,4-och3),3.68-3.64(2h, m,h-5”,h-6”),3.34(1h,q,j=7.9,6.8hz,h-4”),1.52(3h,s,o-亚异丙基), 1.32(3h,s,o-亚异丙基)。
[0516]
向化合物26g(50mg,0.09mmol)的3ml dmp溶液中添加催化量的 tsoh(0.19mg,0.001mmol)(如图6所示)。将反应在室温搅拌12小时之后,减压蒸发移除过量的dmp。通过硅胶柱分离(含45-52%乙酸乙酯的正己烷)纯化残余物分别得到各自呈白色固体的32b(18mg,34%)、32c(20 mg,38%)和32d(2mg,4%)。
[0517]
3”,4
”‑
缩丙酮-4-o-β-d-吡喃半乳糖基山荷叶素(32b)
[0518]
hr-eims m/z[m h]
583.1666(计算值583.1816);1h nmr(400mhz, 丙酮-d6)δ8.21(1h,s,h-2),7.09(1h,s,h-5),6.97(1h,d,j=7.4hz,h-5’),6.90
ꢀ–
6.75(2h,m,h-2’,h-6’),6.10(2h,d,j=4.5hz,-och2o-),5.78(1h,d,j= 15.6hz,-oh),5.48
–
5.39(2h,m,h-9),4.88(1h,d,j=9.5hz,h-1”),4.28(1h, d,j=5.9hz,h-3”),4.23(1h,t,j=6.0hz,h-4”),4.07(1h,q,j=5.7,5.2hz, h-2”),4.00(3h,s,3-och3),3.96-3.83(3h,m,h-5”,h-6”),3.73(3h,s,4-och3), 1.53(3h,s,o-亚异丙基),1.33(3h,s,o-亚异丙基)。
[0519]
4”,6
”‑
缩丙酮-4-o-β-d-吡喃半乳糖基山荷叶素(32c)
[0520]
hr-eims m/z[m h]
583.1688(计算值583.1816);1h nmr(400mhz, 丙酮-d6)δ
8.28
–
8.19(1h,m,h-2),7.09(1h,s,h-5),6.98(1h,dt,j=8.0,1.1 hz,h-5’),6.90
–
6.78(2h,m,h-2’,h-6’),6.10(2h,dt,j=5.0,1.1hz,-och2o-), 5.84
–
5.32(2h,m,h-9),4.94
–
4.83(1h,m,h-1”),4.32
–
4.20(1h,m,h-6”), 4.04(1h,dt,j=9.6,7.6hz,h-2”),4.00(3h,s,3-och3),3.97
–
3.81(3h,m,h
‑ꢀ
3”,h-4”,h-6”),3.73(3h,s,4-och3),3.66(1h,tt,j=6.7,4.3hz,h-5”),1.53 (3h,s,o-亚异丙基),1.33(3h,s,o-亚异丙基)。
[0521]
2”,3
”‑
缩丙酮-4-o-β-d-吡喃半乳糖基山荷叶素(32d)
[0522]
hr-eims m/z[m h]
583.1648(计算值583.1816);1h nmr(400mhz, 丙酮-d6)δ8.25(1h,s,h-5),7.11(1h,s,h-5),6.98(1h,dd,j=7.8,1.0hz,h
‑ꢀ5’
),6.90
–
6.86(1h,m,h-2’),6.83(1h,dd,j=7.9,1.7hz,h-6’),6.10(2h,dd, j=4.3,1.0hz,-och2o-),5.65
–
5.45(2h,m,h-9),4.96
–
4.90(1h,m,h-1”), 4.26(1h,d,j=3.5hz,h-3”),4.15(1h,dt,j=12.8,2.1hz,h-2”),4.01(3h,s, 3-och3),3.93
–
3.83(2h,m,h-6”),3.73(3h,s,4-och3),3.68(1h,ddd,j=9.5, 7.9,3.6hz,h-4”),3.57-3.50(1h,m,h-5”),1.47(3h,s,o-亚异丙基),1.41(3h, s,o-亚异丙基)。
[0523]
为了清楚理解的目的,现在已经通过例示和实施例的方式在一些细节上充分描述了本发明,对于本领域的普通技术人员显而易见的是,在不影响本发明或其任何具体实施方案的范围的情况下,同样可以通过在条件、制剂及其他参数的较宽和等同范围内修改或改变本发明来执行,并且这样的修改或改变旨在涵盖在所附权利要求的范围内。所采用的术语和表达被作为描述而非限制性的术语使用,并且并非旨在使用这样的术语和表达排除所示出和描述的特性的任何等同物或其部分,但是应当认识到,在所要求保护的本发明的范围之内,各种修改均是可能的。因此,应当理解,尽管本发明已经由优选的实施方案和可选的特性具体地公开,但是本领域技术人员可采用本文所公开的概念的修改和变化,并且认为这样的修改和变化在本发明的范围内。
[0524]
如本文所用,“包含”与“包括”同义。“含有”或“特征在于”是包括性或开放性的,并且不排除额外未列举的要素或方法步骤。如本文所用,“由
……
组成”排除权利要求要素中未规定的任何要素、步骤、或成分。如本文所用,“基本上由
……
组成”不排除实质上不影响权利要求的基本和新颖特征的材料或步骤。在本文的每种情况下,术语“包含”、“基本上由
……
组成”和“由
……
组成”中的任一者可以被其他两个术语中的任一者替代。
[0525]
当在本文中公开一组材料、组合物、组分或化合物时,应理解那些组的所有各个成员及其所有亚组单独地公开。当在本文中使用马库什组或其他分组时,该组的所有各个成员以及该组的所有可能的组合和子组合旨在单独地包括在本公开中。除非另行指出,本文描述或例示的组分的每一种制剂或组合可用于实践本发明。无论何时在说明书中给出范围,例如温度范围、时间范围、或组合物范围,所有中间范围和子范围,以及包括在给出范围中的所有各个值均旨在包括在本公开中。在本公开和权利要求中,“和/或”意指除此之外或另选地。此外,任何使用的单数形式的术语也涵盖复数形式。
[0526]
本文引用的所有参考文献据此全文以引用方式并入,其程度与本说明书的公开内容不存在不一致。本文所提供的一些参考文献以引用方式并入,以提供关于本发明的起始材料来源、额外的起始材料、额外的试剂、额外的合成方法、额外的分析方法、额外的生物材料、额外的细胞以及额外的用途的细节。本文使用的所有标题仅是为了方便。说明书中所提及的所有专利和出版物指示了本发明所属领域的技术人员的技术水平,并且以引用方式并
入本文,其程度如同每各个的出版物、专利或专利申请被具体地和单独地指示以引用方式并入。本文引用的参考文献全文以引用方式并入本文,以指示如其公开或申请日的技术状态,并且旨在该信息可根据需要在本文中采用以排除现有技术中的具体实施方案。例如,当要求保护物质组合物时,应理解在申请人的发明之前本领域已知和可获得的化合物(包括在本文引用的参考文献中提供的允许公开的化合物)不旨在包括在本文的物质组合物权利要求中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。