多潜能关节祖细胞、其组合物及制备方法
1.相关申请的交叉引用
2.本技术要求于2019年8月27日提交的题为multipotent joint progenitor cells,compositions and methods thereof的临时专利申请号62/892,067的优先权,其内容通过引用以其全文并入本文。
技术领域
3.本公开提供了一种使用多潜能(multipotent)关节祖细胞(joint progenitor cell,jpc)的治疗方法。还提供了jpc、组合物以及使用和制备jpc的方法。
背景技术:
4.膝关节由三个主要结构组成,关节软骨(articular cartilage)、半月板(menisci)和前十字韧带(anterior cruciate ligament,acl)。关节软骨由深带软骨细胞和浅层细胞组成,其表达润滑素(lubricin)以减少摩擦,使运动更顺畅。半月板是一种纤维软骨组织,作用在于分散我们的体重并减少摩擦。acl提供针对膝关节处角度形成(angulation)和旋转的稳定性。这些组织的创伤、运动损伤和老化是骨关节炎(osteoarthritis,oa)的最常见原因,骨关节炎是导致残疾和慢性疼痛的主要原因之一,影响着全世界数百万人。这些组织的自我修复能力非常有限,可能是由于成人的祖细胞耗竭所致。已经开发了基于细胞的治疗方法,例如关节注射外源性干细胞(例如,骨髓msc),但结果可能并不理想,因为关于细胞进行正确分化和修复的环境线索还不够充分。因此,鉴定出一种更优化的启动有效修复过程的祖细胞类型尤为重要。
技术实现要素:
5.本文提供了一种治疗关节疾病的方法,包括在有此需要的受试者的关节处施用多潜能关节祖细胞(joint progenitor cells,jpc),其中从间区(interzone)获得的所述jpc是lgr5
和/或col22a1
。
6.本文提供了多潜能关节祖细胞(jpc)在制备用于治疗有此需要的受试者中的关节疾病的医疗产品中的用途,其中从间区获得的所述jpc是lgr5 和/或col22a1 。
7.本文提供了多潜能关节祖细胞(jpc)用于治疗关节疾病,包括在有此需要的受试者的关节处施用多潜能关节祖细胞(jpc),其中从间区获得的所述jpc是lgr5 和/或col22a1 。
8.在一个实施方案中,关节疾病是韧带和关节软骨创伤或相关的退行性疾病。在一个实施方案中,关节疾病与骨关节炎有关或与关节组织相关的损伤有关。
9.在一个实施方案中,jpc分化为肌腱细胞、十字韧带、滑膜、半月板和/或关节软骨细胞(articular chondrocyte)。
10.本文提供了一种治疗韧带缺损(ligament defect)或肌腱缺损(tendon defect)的方法,包括在有此需要的受试者的关节处施用多潜能关节祖细胞(jpc),其中从间区获得
的所述jpc表达mkx和scx。
11.本文提供了多潜能关节祖细胞(jpc)在制备用于治疗有此需要的受试者中的韧带缺损或肌腱缺损的医疗产品中的用途,其中从间区获得的所述jpc表达mkx和scx。
12.本文提供了多潜能关节祖细胞(jpc)用于治疗韧带缺损或肌腱缺损,包括在有此需要的受试者的关节处施用多潜能关节祖细胞(jpc),其中从间区获得的所述jpc表达mkx和scx。
13.本文提供了一种治疗关节软骨细胞或半月板缺损的方法,包括在有此需要的受试者的关节处施用多潜能关节祖细胞(jpc),其中从间区获得的所述jpc表达pax9、cdh13、lrrc17和col26a1。
14.本文提供了多潜能关节祖细胞(jpc)在制备用于治疗有此需要的受试者中的关节软骨细胞或半月板缺损的医疗产品中的用途,其中从间区获得的jpc表达pax9、cdh13、lrrc17和col26a1。
15.本文提供了多潜能关节祖细胞(jpc)用于治疗关节软骨细胞或半月板缺损,包括在有此需要的受试者的关节处施用多潜能关节祖细胞(jpc),其中从间区获得的所述jpc表达pax9、cdh13、lrrc17和col26a1。
16.本文提供了一种产生关节祖细胞(jpc)的细胞系的方法,包括以下步骤
17.(i)提供诱导的多能干细胞(induced pluripotent stem cell,ipsc)或扩增潜能干细胞(expanded potential stem cell,epsc);
18.(ii)在糖原合成酶激酶-3β抑制剂的存在下培养ipsc或epsc;
19.(iii)激活来自步骤(ii)的ipsc或epsc的tgf-β信号传导;
20.(iv)在fgf2和mmp2的存在下培养来自步骤(iii)的ipsc或epsc,其中从(ii)到(iv)步骤的培养为约5天以形成中内胚层;
21.(v)从ipsc或epsc培养物中去除步骤(ii)的糖原合成酶激酶-3β抑制剂;
22.(vi)抑制tgf-β信号传导,将ipsc或epsc培养约4天以形成中胚层;
23.(vii)在ipsc或epsc培养物中将中胚层分化为jpc;
24.(viii)激活wnt信号传导约5天;和
25.(ix)调节ipsc或epsc培养物中的hedgehog(hh)浓度。
26.在一个实施方案中,糖原合成酶激酶-3β抑制剂是chir99021。
27.在一个实施方案中,tgf-β信号传导被激活素a(activin a)激活。
28.在一个实施方案中,tgf-β信号传导被fgf2、bmp2和sb431542抑制。
29.在一个实施方案中,在fgf2和gdf5的存在下,所述中胚层分化为jpc。
30.在一个实施方案中,通过添加r-spondin来调节wnt信号传导。
31.在一个实施方案中,ipsc或epsc包含能够在ipsc或epsc中表达gfp的lgr5-gfp报告基因构建体。
32.在一个实施方案中,所述方法进一步包括监测所述ipsc或epsc中的gfp表达的步骤。
33.本文提供了通过本公开的方法产生的jpc群体。
34.本文提供了一种治疗关节疾病的方法,包括施用所述jpc。
附图说明
35.通过以下附图的描述和示例,本公开的具体实施方案的前述和其他目的、特征和优点将是显而易见的。
36.图1:lgr5在发育中的指和膝关节中的表达
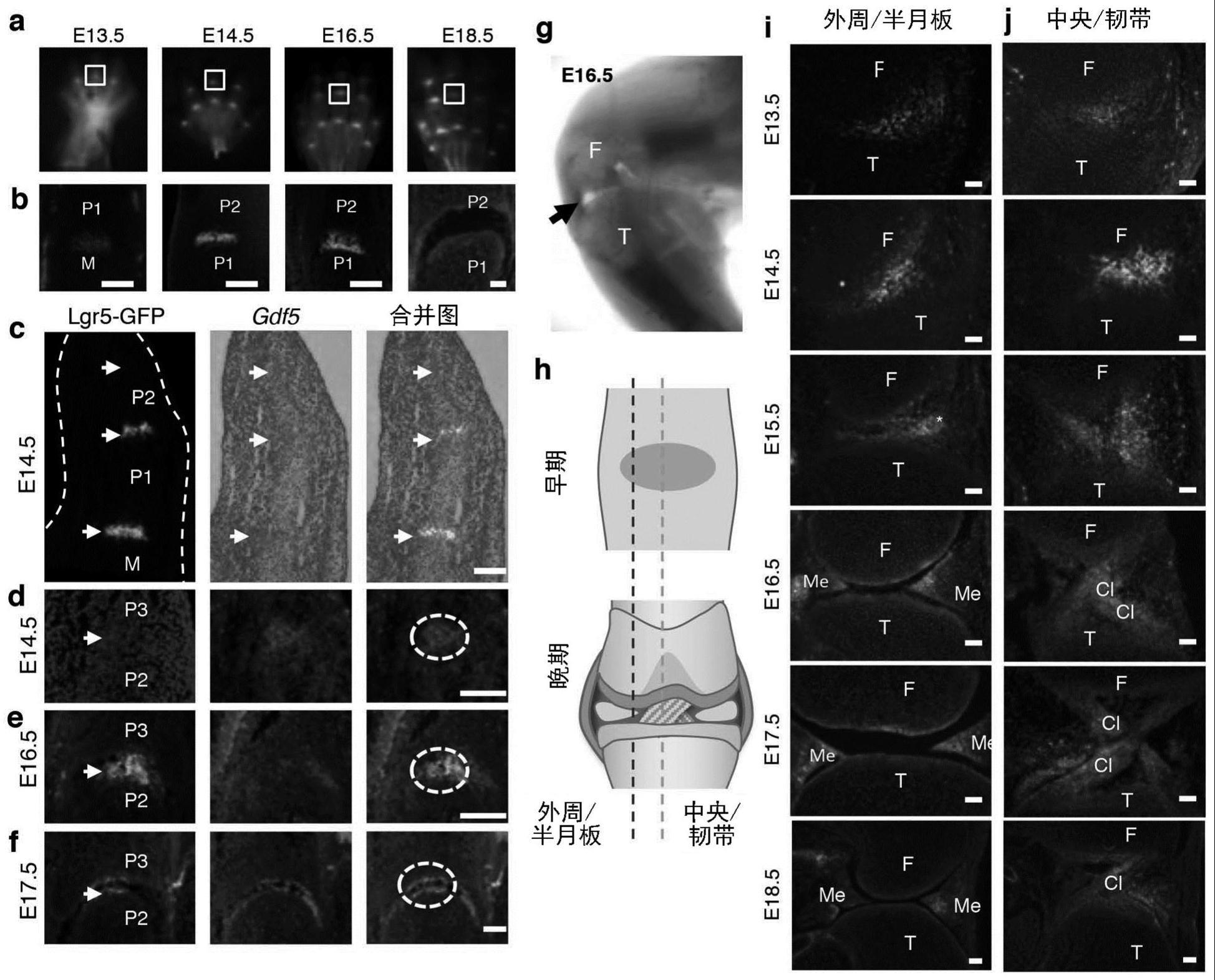
37.(a)来自lgr5-gfp胚胎(e13.5-e18.5)的后肢的整体图像。(b)(a)中方框区域的矢状切面,显示lgr5(gfp)的表达。(c)来自e14.5后肢第iii指的相邻矢状切片的gfp(绿色)免疫染色和gdf5(红色)原位杂交,显示在发育中lgr5表达晚于gdf5。在p1/p2和m/p1关节间区,lgr5标记的细胞位于表达gdf5细胞区域的中心。(d)p2/p3关节的更高倍放大,显示在e14.5时gdf5表达而lgr5不表达,及其在发育中随时间的表达(圆圈),如在e16.5(e)和e17.5(f)时同一关节中所示。(g)来自e16.5胚胎的膝的整体图像。(h)显示选择用于分析的切面的位置和结构的图示。从e13.5至e18.5,关节软骨/半月板(i)和十字韧带(j)形成期间的lgr5表达。m,掌骨(metacarpal);p1,近端指骨(proximal phalange);p2,中节指骨(middle phalange);p3,远端指骨(distal phalange);f,股骨;t,胫骨;ac,关节软骨。比例尺=100μm。
38.图2:lgr5 间区细胞在发育中的滑膜关节中的命运
39.在e13.5向携带lgr5-gfp;r26r基因敲入的孕鼠注射他莫昔芬(tamoxifen),分别在e15.5(a)和(b)、e17.5(c)和(d)以及出生后3周(e)和(f)收集子代的指和膝关节以进行分析。间区(iz)细胞被标记,如e15.5时针对lacz 细胞染色的整体胚胎和矢状切面中所示(黑色箭头)。在指和膝关节的关节表面(ac)处不同阶段谱系追踪的的子代细胞(蓝色箭头)。在膝中,还在半月板(me;红色箭头)、十字韧带(cl;黄色箭头)、髌内脂肪垫(ifp;绿色箭头)和滑膜(sm;橙色箭头)中检测到lacz 细胞。比例尺=100μm。
40.图3:lgr5和胶原蛋白xxii在膝关节发育中的动态时空表达
41.(a)根据指bulk转录组,与lgr5-相比,lgr5 中具有更高表达的基质基因。“ ∞”表示基因不在lgr5-细胞群体中表达。带星号的基因表示发育中的关节的表达数据可在eurexpress中获得。(b&c)lgr5(gfp)和col22a1mrna在指(b)和膝关节(c)中的共表达。(d)e14.5和e18.5时lgr5-gfp胚胎的发育中的膝关节的矢状切面上lgr5-gfp(绿色)和colxxii(红色)双重荧光免疫染色(另参见图12a和b)。关节软骨的形成从lgr5 细胞(白色空心箭头)进行到表达lgr5和colxxii两者的细胞(白色实心箭头),到仅表达colxxii的细胞(实心箭头)。(e)lgr5和colxxii在发育中的关节软骨和半月板中的共定位。colxxii基质层在完全发育的关节软骨和半月板的浅表面聚集成一个非常狭窄的区域。(f)在关节软骨和半月板的colxxii 浅表层(括号)处检测到lgr5(在e13.5被注射他莫昔芬(tm)并在e17.5收获组织)的lacz 子代细胞(箭头)。(g)该层(括号)中的所有细胞在相当的切面中表达col22a1。colxxii与lgr5(gfp)(h)和scx(gfp)(i)的共定位。用爱新蓝(alcian blue)和核固红(nuclear fast red)染色的同一切片的组织学((h&i)下图)。f,股骨;t,胫骨;cl,十字韧带。比例尺=200μm。
42.图4:通过单细胞转录组揭示的e14.5膝关节间区中lgr5 细胞的特性和分子特征(molecular signature)
43.使用2d(a)或3d(b)的tsne作图分析5,460个细胞中的基因表达,确定了6个主要簇。(c&d)gdf5 和lgr5 细胞分布的3d视图。不同簇中lgr5表达的相对分布以饼图显示在
(d)中。(e&f)廓线图(contour plot)显示了表达(b)中所示的lgr5和(c)中所示的gdf5的细胞的密度,并具有相应的彩色密度图。(g)2d-tsne显示了在表达gdf5 的细胞中lgr5 的分布。簇1中的方框区域的更高倍放大显示在右侧图中,突出显示了相对的lgr5 /gdf5-(蓝绿色)和lgr5 /gdf5 (紫色)细胞。(h)venn图显示了细胞的lgr5-/gdf5 (绿色)、lgr5 gdf5-(蓝绿色)和lgr5 /gdf5 (紫色)亚群的分布和百分比。(i)2d-tsne图突出显示了簇5中lgr5 /ki67 的分布(相对于簇1中lgr5 /ki67-细胞的主占),且lgr5 /ki67 的百分比显示在饼图中。(j)e14.5膝关节中表达lgr5-gfp和ki67的细胞的双重免疫荧光检测。lgr5细胞群体的外周用虚线标记,且箭头表示双阳性细胞,其更高倍放大显示在方框区域中。从三个胚胎确定的lgr5 /ki67 的相对百分比也显示在饼图中。f,股骨;t,胫骨。(k)venn图显示了簇1相对于非簇1的deg(n=110,蓝色圆圈)和lgr5 细胞相对于lgr5-细胞的deg(n=75,黄色圆圈)。用这两个基因列表鉴定出48个常见的deg。显示了每个扇区中的转录因子。图20中提供了完整的基因列表。
44.图5:膝关节的谱系轨迹
45.(a)热图显示了从每个簇中随机选择的作为代表的200个细胞的谱的前5%分散基因(全基因组)的聚类。确定了与关节发育、韧带、细胞周期和软骨相关的基因簇。(b)每个簇的特征的汇总图,其中将簇1、2、5和6定义为间区细胞。(c)对来自簇1、2、5和6的细胞的拟时序分析(pseudotime analysis)确定了八个细胞状态,并且显示了来自单个簇的细胞的分布和沿拟时序线的合并图谱。(d)所有lgr5 细胞沿拟时序线的分布,以及在每个所示细胞状态中分布的相对百分比,同时还显示了增殖的lgr5 /ki67 细胞。(e)拟时序轨迹预测了“早期”(深蓝色)到晚期(浅蓝色)细胞的梯度,主要分化至两条轨迹a和b,其中箭头指示预测的方向。将韧带(f)和软骨细胞(g)基因的表达分布映射至2d tsne上。每个圆圈的大小是基因表达水平的相对反映,lgr5 细胞以绿色表示。(h)图示显示了lgr5间区细胞的主要谱系分化。(i&j)表达韧带(i)和软骨(j)基因的细胞沿拟时序线的分布。方框突出显示了表达成熟韧带标志物tnmd而非col22a1的处于状态ii的细胞的具体比较。
46.图6:lgr5 间区组织修复软骨缺损(lesion)的能力
47.(a)关于分离lgr5 间区组织(用gfp和tdtomato两者标记)并移植到关节软骨缺损中进行修复的实验设计。右图显示了移植后缺损内的tdtomato 组织。(b)在植入后15天,植入的间区组织(tdtomato )与宿主软骨整合,并分化为关节软骨中的细胞和浅表层中的扁平细胞(箭头)。在15天后对有和没有进行lgr5 植入的缺损区域进行组织学(c)和ecm标志物分析(d-g)。其他动物的数据如图14所示。
48.图7:祖细胞在关节形成中的贡献和分化(divergence)模型
49.显示膝关节发育过程的示意图。(a)含有表达sox9的软骨细胞的软骨间叶原基(cartilage anlagen)的形成。(b)sox9 软骨细胞在假定的关节部位去分化为gdf5 间区细胞。(c)通过从周围募集间充质细胞和部分增殖的lgr5 细胞,间区得到扩张,并分层为特定区域。(d&e)lgr5 间区细胞是多潜能祖细胞,参与形成膝关节的所有内部结构,包括十字韧带、关节软骨和半月板。lgr5 /col22a1 细胞是可构建关节软骨和半月板的定向祖细胞(committed progenitor),而lgr5 /scx /col22a1-细胞仅限于构建韧带的细胞谱系。
50.图8:人类关节祖细胞(jpc)区分于诱导多能干细胞(ipsc)或扩增潜能干细胞(epsc)。
51.图9:定量pcr显示了gdf5和lgr5在指间区(iz)中的表达
52.从e14.5胚胎的指间区和周围的非间区区域提取mrna以生成cdna用于qpcr。将gapdh的表达标准化为1.0,高于1.0的值表明这些基因上调,反之亦然。在所有选择的干细胞/祖细胞标志物中,已知的关节间区标志物gdf5和本文中鉴定的新标志物lgr5在间区区域上调。
53.图10:lgr5-gfp突变体发育的正常膝和指关节
54.用阿尔蓝和核固红染色的代表性组织切片,显示了lgr5 / 、lgr5gfp/ 和lgr5gfp/gfp e18.5胚胎的发育中的膝(a)和指(b)关节之间没有可观察到的差异(每个基因型n=3)。(c)关节软骨似乎已正常形成,其中colxxii在浅表层中的表达和定位如预期。f=股骨,t=胫骨,cl=十字韧带,m=掌骨,p1=近端指骨,p2=中节指骨,p3=远端指骨,比例尺=200μm。
55.图11:对关节发育中的细胞群体的bulk转录组学分析。
56.(a)分离的三个细胞群体。一个群体来自e13.5的sox9-egfp小鼠指骨中表达sox9的细胞,另外两个群体分别来自发育中的e14.5的lgr5-gfp小鼠的lgr5 指间区区域(红色箭头)和周围的非gfp区域(黄色箭头)
57.(b)。(c)从所有分离的细胞中分选出合适的细胞群体用于进行后续rna-seq以生成三个数据集的方案的图示说明。(d)bulk rnaseq数据处理的工作流程。(e)维恩图显示了确定的基因数量以及数据集之间的重叠。在lgr5 群体中具有较高表达的基因显示在右侧。(f)热图描绘了参与特定分子途径中表达水平较高的基因的相对表达水平。 倍数变化(fold change,fc)表示在lgr5 细胞中的表达的增加,而-fc表示在lgr5 细胞中的表达的减少。“ ∞”表示仅在lgr5 细胞中表达的基因。将可从eurexpress数据库获得表达数据的基因用星号标记。
58.图12:lgr5和colxxii在指关节和膝关节中的表达。
59.lgr5(绿色)和colxxii(红色)在e18.5(a)和新生小鼠(p0)(b)指关节中的表达共定位。(c)p10时在m/p1、ta/m和膝关节中的表达。m,跖骨。p1,近端指骨。p2,中节指骨。p3,远端指骨。ta/m,跗跖关节。(d)与p6小鼠的较深区域中的圆形软骨细胞(黄色箭头)相比,嵌入colxxii层的细胞是扁平的。在与colxxii基质直接接触的细胞的两侧均发现粘着斑(focal adhesion)(β1-整联蛋白)(白色箭头)。比例尺=(a-c)中为100μm且(d)中为10μm。
60.图13:关于单细胞分析的其他信息
61.(a)火山图(volcano plot)显示了gdf5(红色圆圈)是lgr5 /gdf5-和lgr5 /gdf5 亚群之间唯一的差异表达基因(differential expressing gene,deg),并且这些细胞基本相同。(b)火山图显示了来自簇1和簇5的lgr5 细胞之间的deg,也表明它们是相同的细胞,区别仅是簇5中的细胞处于增殖。(c)图(b)中的deg(圆圈)的go term分析。(d-g)对5,460个e14.5膝关节细胞的主成分分析(principle component analysis,pca)。(d)廓线图显示了细胞的密度,发现了两个主峰。(e)峰1对应于表达gdf5和lgr5的间区细胞,峰2对应于表达成熟软骨细胞标志物comp和epyc的非间区。(f)t-sne簇1、2、5和6位于峰1,而簇3和4位于峰2,这与2d t-sne的发现相一致。(g)细胞周期基因的廓线图显示了间区簇(簇5)和非间区簇(簇4)中细胞的增殖亚群的存在。(h)小提琴图(violin plot)显示了每个簇中代表性的软骨、韧带和细胞周期基因的表达图谱,为它们的细胞特性和分子特征提供依据。
62.图14:用于修复软骨缺损的lgr
5
间区组织移植
63.对接受间区组织移植的另外两只动物进行分析。在所有三只手术动物中均有相似的阳性结果,包括间区向表达胶原蛋白ii的软骨细胞的分化、浅表层(表达cilp1)的重建以及对胶原蛋白i表达和纤维化组织的抑制。另请参见图6。
64.图15:仅由一个细胞群表达的基因(按表达水平排名前100)(指bulk)。
65.图16:在特定细胞群体中表达的转录因子(指关节的bulk转录组)。
66.图17:在所有三个群体中表达的转录因子,且在lgr5 细胞群中的表达比其他两个群体高1.5倍(指关节的bulk转录组)。
67.图18:参与分子信号传导通路、细胞-基质接触、ecm降解和合成的基因(e14.5指关节的bulk转录组)。
68.图19:单细胞转录组测序和分析的详细信息和参数。
69.图20:“簇1vs.非簇1”和“lgr5 vs.lgr5
‑”
的deg(e14.5膝关节的单细胞转录组)。
70.图21:本文中使用的引物。
具体实施方式
71.间区是胚胎期关节形成过程中的暂时性结构。间充质细胞聚集群去分化形成gdf5 间区细胞,标记了未来关节形成的位置。间区中心的细胞表达lgr5(我们新鉴定的标志物)。在这个阶段,约12%的lgr5 细胞是增殖性的,它们主要位于lgr5簇的外部区域。与从周围募集的细胞一起,间区扩张并开始分隔成不同的区室。我们的谱系追踪实验表明,lgr5 间区细胞可促成关节软骨、半月板和acl的形成。出生后,这些区室中的lgr5 细胞数量显著减少,这可能是关节组织愈合能力差的原因。这些lgr5 间区细胞可促进软骨缺损修复并再生表达关节软骨细胞标志物的透明软骨样结构(hyaline cartilage like structure)。公开了一种在实验室中生成无限制的多潜能关节祖细胞的分化方案,和对这些关节祖细胞(jpc)的特性的研究。
72.从e14.5胚胎中解剖出形成膝关节的区域和含有分化软骨细胞的周围组织。对5.6k细胞进行了测序,并且显示仅有一种类型的jpc,因为它们共有相似的基因表达谱并且在聚类分析中聚类在一起(tsne和pca)。通过比较jpc和非jpc(分化的关节细胞和软骨细胞),已经鉴定了137个jpc的标签基因(signature gene),其中18个基因是tf。jpc可分化为两个谱系细胞,因为它们表达了韧带特异性tf,mkx、scx和meox2,以及成软骨性tf,osr2和trps1。使用monocle 2算法将所有关节细胞在虚拟时间轴上排序,它们沿着所述时间轴显示转录组的连续变化。仅有一种类型的jpc,它们是多潜能的,因为它们表达韧带和软骨两种谱系细胞的tf。在谱系特化至韧带或关节软骨细胞之前,超过80%的jpc显示处于最年轻/原始的状态。因此,它们是原始细胞,并且在谱系特化之前保持多潜能状态。jpc的命运很可能受其微环境中的外部信号控制。本文公开了作为可追踪jpc谱系特化的细胞表面和基质分子的tf的表达。mkx和scx的表达可以标记定向分化为韧带的细胞,而pax9、cdh13、lrrc17和col26a1标记定向分化为关节软骨和半月板的细胞。
73.滑膜关节由关节将要形成的区域(即间区)中的祖细胞池发展而来。gdf5和wnt9a的表达已被用于标记间区和祖细胞形成中最早的细胞过程。然而,我们对于关节不同组织的谱系特化和发展过程理解不足。在这里,通过谱系追踪研究,我们鉴定到一个lgr5 间区
kong))进行测序。将cdna片段序列与小鼠基因组(mm10)进行比对。生成每千个碱基的外显子每百万映射读取的片段数(fragments per kilobase of exon per million fragments mapped,fpkm)值以进行比较(图11d)。将fpkm》=5的基因视为表达基因。分别使用david(huang da et al.,2009)和eurexpress(diez-roux et al.,2011)数据库进行通路和表达分析。将数据集上传到基因表达综合数据库(gene expression omnibus,geo)以供公众访问(gse110281)。
87.1.6单细胞转录组分析
88.借助gfp表达,从e14.5 lgr5
gfp/
胚胎解剖膝间区和周围的软骨组织。将分离的细胞合并,使用10x genomics chromium single cell controller(10xgenomics inc.)进行单细胞rna测序。根据制造商的说明(chromium
tm
single cell 3'reagent kits v2和chromium
tm
single cell a chip kit)制备cdna文库,然后在illunina hiseq 1500平台上进行测序。使用cell-ranger pipeline(2.1.0版;10x genomics inc.)处理原始数据,以进行与mm10的比对、umi(独特分子标识符(unique molecular identifier))定量和降维(tsne)分析。将数据与creer
t2
序列进行比对以评估lgr5-egfp-creer
t2
等位基因的表达。将表达lgr5和/或lgr5-egfp-creer
t2
等位基因的细胞视为lgr5 细胞。分别使用cell-ranger和monocle2进行聚类和拟时序轨迹分析。参数设置的详细信息如图19所示。这个数据集存放在geo(gse130919)上。
89.1.7软骨穿刺和使用lgr5 间区组织进行修复
90.将lgr5-gfp小鼠与rosa26-tdtomato小鼠进行杂交以产生双杂合lgr5-gfp;tdtomato胚胎。从e13.5胚胎发育中的膝关节解剖出gfp 组织,并将其移植到用27g针在8周龄c56bl/6小鼠(n=3,图6a)的滑车沟(trochlear groove)处穿刺的缺损区域。没有进行组织移植的穿刺动物作为对照。
91.1.8人关节祖细胞(jpc)的分化
92.人关节祖细胞(jpc)将通过以下方案分化自诱导多能干细胞(induced pluripotent stem cell,ipsc,ixcells biotechnologies)或扩增潜能干细胞(expanded potential stem cell,epsc,来自pentao liu教授实验室的馈赠,xuefei gao et al.,2019),参见图8。
93.·
第一阶段(第1-5天)从干细胞到中内胚层
94.通过提供chir99021(一种糖原合成酶激酶-3β抑制剂)和激活素a(激活tgf-β信号传导),然后是fgf2和bmp2,使人干细胞为中内胚层细胞作准备。
95.·
第二阶段(第5-9天)从中内胚层到中胚层
96.将通过从培养基中去除chir99021和激活素a并替换为fgf2、bmp2和sb431542(tgf-β信号传导抑制剂),使细胞分化为中胚层细胞。
97.·
第三阶段(第9-14天)从中胚层到jpc
98.将通过添加fgf2和gdf5使细胞分化为jpc。基于对胚胎关节发育的观察,通过在第9-11天添加r-spondin来激活wnt信号传导,然后在最后阶段调节hh(通过滴定培养基中的hh浓度)。
99.分化方案的评估
100.对干细胞进行遗传工程化以包含lgr5-gfp报告基因
101.分化的jpc将表达gfp,且我们有一组jpc标志物来评估方案的效率。
102.实施例1:lgr5作为发育中的滑膜关节中的不同细胞的新标志物
103.由于间区细胞是祖细胞,我们用一组干细胞标志物筛选这些细胞,并通过q-rt-pcr检测lgr5表达(图9)。利用lgr5-egfp-ires-creert2(lgr5-gfp)小鼠中的gfp表达,我们确认了lgr5为间区细胞的标志物。lgr5-gfp是空白无效等位基因(null allele),其中gfp表达取代了lgr5(barker et al.,2007)。这个等位基因的杂合子小鼠是正常且可存活,而纯合子小鼠在围产期死亡(barker et al.,2007)。然而,我们在纯合子中没有观察到四肢发育或滑膜关节形成的异常(图10)。对滑膜关节中的lgr5/gfp表达的所有分析均在这个等位基因的杂合子小鼠中进行。指关节的发育从近端到远端,由此提供了关于进展的信息。通过对lgr5-gfp小鼠的整体胚胎分析,我们检测了从e13.5至e18.5指关节中的gfp(图1a)。在e13.5,近端m/p1关节明显呈gfp阳性,而p1/p2关节仅显示微弱信号,且p2/p3关节没有信号(图1a),这一结果得到了组织学分析的证实(图1b)。在指iii的m/p1关节处,在e13.5可以检测到信号在间区细胞中呈“盐和胡椒(salt and pepper)”散在分布模式,从e14.5开始,信号更加强烈和均匀地分布在间区中心。随着关节腔的形成,在未来关节软骨的边缘区域检测到lgr5 细胞,且表达的细胞的强度和数量显著减少。
104.实施例2:在指关节形成中lgr5表达在gdf5表达之后开始
105.gdf5是间区细胞的标志物(merino et al.,1999;storm and kingsley,1999)。我们比较了指iii中相邻切片(图1c-1f)中lgr5与gdf5的表达。在p2/3间区,即在e14.5形成的最后一个关节已经有gdf5表达(图1c),但尚未表达lgr5(图1c),这表明后者表达较晚。在更近端的p1/p2和m/p1关节中,gdf5和lgr5均有表达。有趣的是,lgr5的表达定位于每个关节中表达gdf5的间区细胞的中央靠边缘位置(图1d)。在e16.5,就在关节腔形成之前,gdf5在间区区域持续表达并呈现明显的马蹄形状分布(图1e),其中lgr5 细胞定位于马蹄中心(图1f,圆圈),两侧有明显的gdf5 细胞。随着关节腔的形成,lgr5 细胞的数量减少,而一些gdf5 细胞则保留在关节表面(图1f)。因此,lgr5在间区中标记了间区中一个表达gdf5的细胞亚群,其在关节发育中具有独特的时间和空间模式。
106.实施例3:lgr5在发育中的膝关节中的表达
107.膝关节因其具有半月板和十字韧带的额外结构而更为复杂。e16.5的整体胚胎成像可见特异性lgr5表达(图1g)。我们检查了从e13.5到e18.5的发育中的关节的外周(图1i)和中央(图1j)区域的组织切片,如图1h所示。lgr5早在e13.5就在间区中表达,早于半月板、关节软骨和十字韧带的形成。从e16.5,伴随着早期关节腔形成以及半月板和十字韧带的形成,到e18.5关节发育成熟,lgr5的表达变得局限于膝关节的未来关节表面并且减弱(图1i;外侧切片)。然而,在这个阶段,许多lgr5 细胞在发育中的外侧和内侧半月板中变得明显(图1i,外侧切片)。这些lgr5 细胞位于半月板的中央游离缘和较薄的区域。出生后,lgr5表达减少,在第10天(p10)在关节软骨或半月板细胞中几乎检测不到或检测不到(图12c)。十字韧带的形成也开始于间区。在十字韧带中检测到强lgr5表达(图1j,中央切片),遍布韧带起止点到软骨元件全长(图1j)。
108.实施例4:lgr5 间区细胞是膝关节内部结构的祖细胞
109.我们使用lgr5-egfp-ires-creert2小鼠来标记和追踪发育关节中的lgr5 细胞。在e13.5将他莫昔芬单次注射到lgr5-gfp;rosa26-lacz(r26r)怀孕小鼠中,显示了在e15.5
在指(图2a)和膝(图2b)关节间区中-半乳糖苷酶标记的(lacz )细胞。在e17.5,lgr5 细胞的子代在关节腔形成时持续存在(图2c),并且在p21,指关节显示lgr5 子代遍布关节软骨的整个厚度(图2e)。在发育中的膝关节中,在e17.5可以在靠近关节软骨表面(图2d,蓝色箭头)、半月板(图2d,红色箭头)、髌内脂肪垫(图2d,绿色箭头)和发育中的十字韧带(图2d,黄色箭头)处检测到lgr5 细胞的子代。当追踪至p21时,也可以检测到它们(图2f)。有趣的是,在韧带中检测到的lgr5 细胞的子代比根据e15.5标记的有限间区细胞所预期的要多得多,这表明这个谱系中有细胞增殖。因此,韧带中的lgr5 细胞来源于lgr5 间区细胞,这持续至p21(图2f),并且可以定位在滑膜中(图2f,橙色箭头)。总之,我们的发现支持了lgr5 间区细胞是促成所有关节结构的祖细胞。
110.实施例5:关节软骨细胞谱系的标志物col22a1
111.为了更好地了解lgr5 细胞,我们使用rna-seq进行了转录组分析。我们使用荧光激活细胞分选(fluorescence-activated cell sorting,facs)分离三种细胞类型:来自sox9ires-egfp/ (sox9-gfp)胚胎在e13.5的聚集间充质的掌骨软骨间叶原基的sox9-gfp 细胞,来自e14.5的发育中的指关节间区的lgr5 (gfp )细胞,以及来自lgr5gfp/ 胚胎的间区的周围组织的lgr5-(gfp-)细胞(图11a、b和c)。通过将阳性判断值(cut-off)设置为fpkm≥5,在每个池中鉴定出约8,000个基因:其中7,356个基因是所有三个数据集所共有的,一些是两个数据集所共有的,并且每个数据集包含独特表达的基因(图11e)。最常表达的lgr5 bulk数据集特异性基因包括转录因子(glis1、barx2和pknox2)和ecm蛋白(cilp和col22a1)。报道与关节形成相关的数种转录因子在来自指关节的lgr5 细胞中特异性表达或更强烈表达,例如gata3(singh et al.,2018)、barx1/2(makarenkova and meech,2012)、irx1/2(zulch et al.,2001)和sox5/6(dy et al.,2010)(图11e、15、16和17)。我们的lgr5 数据集中也显示丰富的调控间区分化的已知通路,例如wnt、tgf和mapk(decker et al.,2014;gunnell et al.,2010)(图11f和18)。我们的数据与文献中对间区细胞的描述相一致,证实了我们数据集的质量。
112.接下来,我们寻找新的向关节软骨细胞谱系发展的信息和潜在标志物。对lgr5 细胞的ecm环境分析可以为伴随细胞微环境(cell niche)变化的谱系进展提供线索。cilp和col22a1是lgr5 细胞中差异表达最大的ecm基因(图3a),其中col22a1为lgr5 细胞特异性表达(图11e)。lgr5 细胞中表达的ecm相关基因表明其是尚未表达comp或prg4的软骨祖细胞表型(图3a)。因此,cilp和col22a1是ecm细胞的潜在谱系进展标志物。我们把重点放在col22a1(colxxii),因为它位于组织连接处,并在成熟滑膜关节的表面检测到(koch et al.,2004)。为了比较关节发育期间的lgr5和col22a1表达,我们对e14.5至p0的指和膝关节中的col22a1使用原位杂交(图3b和3c),并对其中的colxxii(图3d和3e)和gfp(lgr5)蛋白使用免疫染色。在e14.5 p1/p2指关节中,lgr5 间区区域中的col22a1/colxxii表达有限(图3b和3d);然而,在更成熟的m/p1关节中观察到更高水平的colxxii(图3d)。这表明col22a1表达的开始时间晚于lgr5。在关节腔形成之前,许多细胞共表达lgr5和colxxii(图3d)。随着关节腔形成(e16.5),lgr5 细胞较少,而表达colxxii的lgr5-细胞较多(图3d,e16.5)。以e16.5的p1/p2关节为例,我们清楚地鉴定出表达lgr5但不表达col22a1的细胞(图3d,空心箭头)、双阳性细胞(图3d,实心箭头)和许多仅表达colxxii的细胞(图3d,实心箭头)。由于colxxii是一种ecm蛋白,我们将gfp (细胞内)且细胞周具有对colxxii的染色
的细胞定义为双阳性细胞。这得到了col22a1 mrna在表达lgr5的细胞中的直接共定位的支持(图3b)。到e18.5时,仅有少数lgr5 细胞,它们很可能对colxxii呈双阳性,因为它们嵌入富含colxxii的ecm层中(图12a)。在这个阶段,表达colxxii的细胞标记了未来关节软骨的表面。到出生时(p0),含有colxxii的ecm的薄层变得清晰,且近端/远端表达差异不再明显(图12b)。类似地,在p10(图12c),沿指关节的整个表面不再检测到lgr5 细胞。
113.在膝中,观察到类似的表达关系(图3c和3e)。因为间区细胞聚集以形成关节软骨和半月板,lgr5在e13.5(图3e)和e14.5(图3c和3e)时表达。在e13.5时lgr5 细胞首先标记未来半月板的结构,然后是从e15.5至e18.5表达colxxii的细胞沿表层进行聚集(图3e)。半月板浅表细胞的分化也很可能涉及从lgr5到表达colxxii的细胞的转变。事实上,在边界处通过在e15.5的免疫染色(图3e)和在e17.5的原位杂交(图3c)检测到lgr5/colxxii双阳性细胞。到e18.5时(图3c和图3e),在半月板的深部出现明显的含有colxxii的基质层,且有一些lgr5 细胞。与指关节相似,在p10不再检测到lgr5 细胞,但colxxii层持续存在(图12c)。在e17.5,我们在含有colxxii的浅表层(图3f)中检测到在e13.5标记的lgr5子代细胞(lacz ),其中还检测到col22a1转录物(图3g),表明该层中的一些细胞来自lgr5 间区细胞。此外,嵌入该层的细胞与ecm相互作用,这表现为β1-整合蛋白聚集形成粘着斑(图12d)。
114.因为lgr5也在发育中的韧带中表达,我们分析了它在e15.5与colxxii的表达/定位关系,此时十字韧带开始形成(图3h和3i)。有趣的是,尽管lgr5 细胞在间区的整个中心区域均可以检测到,但colxxii表达位于发育中的韧带之外的侧翼区域(图3h)。此外,对scx-gfp小鼠中colxxii表达的分析表明,scx(gfp)的明显表达限制在发育中的韧带内,而不在间区的侧翼colxxii阳性区域中(图3i)。这支持了lgr5 祖细胞向韧带细胞和关节软骨细胞的谱系分化(具有互不相同的表达模式),并且这两个谱系存在独特的ecm微环境。含有colxxii的微环境将支持关节软骨和半月板的形成。
115.实施例6:lgr5 间区细胞针对软骨细胞或韧带谱系的的不同标签
116.为了研究发育中的膝关节中不同细胞群的关系,我们对来自e14.5的lgr5gfp/ 胚胎的膝间区区域的细胞进行了单细胞rna-seq分析。排除血细胞后,对5,460个间区和周围细胞进行了测序(图19)。t分布随机邻域嵌入(t-distributed stochastic neighbour embedding,tsne)分析将具有相似表达谱的细胞分为六个簇。当在二维中观察t-sne图谱(2d-tsne)时,簇4和5似乎远离主要的簇(1、2、3、6)(图4a)。3d视图(3d-tsne)显示马蹄形,其中簇1和簇5在马蹄形的顶端(图4b)。所有间区细胞的标志物gdf5在分散在六个簇中的细胞中均有表达(图4c),但似乎集中在簇1、2、5和6中(图4e)。总共鉴定出207个表达lgr5的细胞,其中表达内源性lgr5的细胞(n=94)、表达lgr5-egfp-creert2等位基因的细胞(n=87)或表达两者的细胞(n=26)。有趣的是,lgr5表达集中在马蹄形顶端的簇1(占所有lgr5 细胞的64%)和簇5(13%)(图4d),并很好地显示在2d-tsne热图中(图4f)。其他lgr5 细胞散布在整个簇图谱上(图4d)。
117.接下来,我们评估了lgr5 和gdf5 细胞之间的关系。根据我们在e14.5进行的体内分析,预期lgr5 细胞是gdf5 (图1c和1d)。我们观察到gdf5 /lgr5-和gdf5 /lgr5 细胞,然而还有gdf5-/lgr5 细胞(图4g和4h)。对lgr5 /gdf5-和lgr5 /gdf5 细胞的差异表达基因(deg)分析发现,唯一的差异是gdf5表达的不存在或存在(图13a)。因此,这两个细胞群是相同的,并且差异可能源于在gdf5在一些lgr5 细胞中的表达较低时,gdf5在scrnaseq
(kharchenko et al.,2014)中的“丢失(dropout)”事件。对lgr5 细胞簇1和5的类似deg分析表明,关键差异在于簇5中额外表达了映射到对应于细胞周期事件的go terms的基因(图13b和c)。我们选择了ki67作为最差异表达的细胞周期基因之一,并在将其表达映射在2d-tsne谱中。所有簇中有总共14%的lgr5 细胞表达ki67;他们中的大多数在簇5中,但不在簇1中(图4i)。类似地,我们发现e14.5膝间区区域中有12.2%
±
2.1%(n=3)的lgr5 细胞表达ki67;这些细胞位于lgr5 间区区域的外周(图4j)。
118.由于大多数lgr5 细胞在簇1中,我们对簇1相对于其他五个簇进行了deg分析。我们鉴定出110个deg(图4k和20),包括与关节发育相关的转录因子,例如osr2、trps1、barx1和sox4。当我们提高簇1中的lgr5 细胞与整个群体中的lgr5-细胞比较的差异筛选标准时,我们鉴定出75个deg(图20),其中有48个与先前的基因集重叠,包括转录因子mkx和scx。27个基因在lgr5 细胞中特异性表达,包括转录因子meox2(图4k)。总之,这些分析描述了lgr5 细胞在针对软骨细胞谱系和韧带谱系的间区中的特征。
119.实施例7:关节谱系特化的轨迹
120.为了对这些簇进行注释,将分散基因的前5%(所有5,460个细胞的全基因组)聚类成一个热图。鉴定了与间区、韧带、细胞周期和软骨相关的基因模块(图5a)。正如gdf5表达的2d-tsne热图所预期的那样(图4e),簇1、2、5和6中的细胞表达与间区细胞相关的基因,包括gdf5、osr2、sfrp2、sulf1和sox4。相对于其他簇,簇5和6中的细胞表达更高水平的与韧带相关的基因,例如lox、col1a1、aspn和scx。簇5和簇6之间的主要差异是簇5中细胞周期相关基因的丰度高,例如ki67、ccna2、birc5和top2a,其也在簇4中表达。簇2、3和4中的细胞表达软骨相关基因,例如epyc、matn1、acan、lect1和sox9。当我们使用主成分分析对相同的数据集进行分析时,我们发现间区和非间区细胞的聚类相似,且这些簇中细胞的细胞周期状态相似(图13d-g)。每个簇中的表达图谱与软骨和韧带的代表性基因以及细胞周期基因的小提琴图相一致(图13h)。因此,将簇1、2、5和6认为是“间区簇”,而将3和4定义为“非间区簇”(图5b)。簇1富含lgr5 /gdf5 间区细胞,并且映射在具有韧带(簇6)和软骨细胞(簇2)标签的簇之间,在边界处有一些细胞“混合(mixing)”,这表明簇1的间区细胞向软骨细胞或韧带谱系的潜在分化(图5b)。
121.为了研究细胞谱系分化,我们对间区簇(1、2、5和6)进行了拟时间线分析,映射至八个潜在细胞状态(图5c)。簇1中的细胞主要映射在状态i中,且有一些细胞散布在其他状态。具有韧带标签的簇5和6中的细胞分布在状态i、ii和iii,而具有软骨细胞标签的簇2中的细胞主要分布在细胞状态v、vi、vii和viii(图5c)。状态iv混合了来自所有四个簇的细胞。接下来,我们评估了lgr5 /ki76 细胞的分布,发现它们分布在lgr5 /ki67-细胞内,但大多数lgr5 细胞映射至状态i(图5d),其代表了拟时间线中所预测的最原始/年轻的状态(图5e)。从状态i分支的两条主要轨迹:轨迹a由状态ii/iii的细胞(图5e,绿色箭头)组成,轨迹b包括状态v/vi/vii/viii的细胞(图5e,红色箭头)。
122.为了对轨迹进行表征,我们评估了所鉴定的差异表达的转录因子的表达(图4k)。scx、meox2和mkx在韧带细胞中表达,且它们的表达富集于簇1和6的细胞(图5f;绿色椭圆形),但在簇2的细胞中较少(图5f,粉红色椭圆形)。osr2和barx1在软骨发育中表达,且它们的表达富集于簇1和2中,但在簇6中较少(图5g)。sox9是一种关键的成软骨转录因子,其在簇1中或在lgr5 细胞中的表达没有差异:总体而言,它的表达在簇2中上调,但在簇6中没有
上调(图5g)。这支持了簇1的细胞具有“双潜能”分化状态,可以向韧带或关节软骨谱系分化(图5h)。接下来,我们将对韧带(图5i)和软骨(图5j)特异的转录因子和ecm基因映射到拟时间线上,发现它们富集于所支持的相关组织轨迹的细胞状态中(图5e)。基于所述算法,一些细胞在谱系分化之前同时表达韧带和软骨转录因子。例如,来自簇6的细胞分布在状态i末端,表达meox2(图5i中的蓝色圆圈,左图)和osr2(图5j中的蓝色圆圈,左图)两者。作为对体内数据的支持(图3h),轨迹a的状态ii的细胞不表达col22a1,但确实表达成熟韧带标志物tnmd(图5i和5j,蓝色方框)。col22a1在轨迹b的细胞中表达,这支持了我们的假设,即col22a1标示了软骨细胞谱系不同于韧带谱系。因此,我们的单细胞转录组数据连同我们的谱系追踪实验表明,lgr5 间区细胞很可能是多潜能的,并且代表了关节形成的一个阶段,在该阶段谱系分成韧带和关节软骨细胞(图5h)。
123.实施例8:lgr5 间区组织修复软骨缺损
124.lgr5 间区细胞具有“原始性”和多潜能性,因此可适用于软骨修复。为了测试这种能力,我们解剖了来自e13.5 lgr5-gfp;rosa-tdtomato胚胎的lgr5-gfp 间区组织,并将其移植到8周龄小鼠膝滑车沟处的全厚度针刺缺损处(n=3)(图6a和14)。针刺后15天,在缺损处检测到tdtomato 细胞,在关节软骨的中间和深层区域有分化中的圆形软骨细胞(图6b和6c,箭头),并且在浅表区域有分化中的扁平细胞(图6b和6c,箭头)。愈合的缺损包含源自移植组织的细胞,其产生了富含蛋白多糖的基质(图6c)和胶原蛋白ii沉积(图6d)。新组织与宿主软骨结合良好(图6c,方框),其中含有胶原蛋白xxii和cilp1的新浅表层嵌入宿主关节软骨的浅表区域(图6d和6e)。植入的组织抑制了缺损处胶原蛋白i(图6g)的表达,这可能导致软骨修复过程中出现不想要的纤维化。总之,我们的发现表明lgr5 间区细胞具有修复关节软骨的能力。
125.2.讨论
126.滑膜关节的多种组织来源于发育中的间区的间充质细胞,其中大部分或全部表达gdf5(koyama et al.,2008)。对gdf5-creer
t2
小鼠的追踪研究表明,在成软骨细胞(chondrogenic cell)初次去分化为gdf5 间区细胞后,gdf5 区域的进一步扩张主要是通过区域性间充质细胞的募集而不是gdf5 间区细胞的增殖(shwartz et al.,2016)。此外,shwartz et al(2016)提出,间区内的细胞响应周围环境的信号,且它们产生不同关节组织的能力受位置效应的控制。此处,我们鉴定了一个新的表达gdf5的间区细胞亚群,其以共表达lgr5来区分,lgr5是一种已知的高度增殖干细胞标志物(leung et al.,2018),尽管间区内的细胞很少分裂(shwartz et al.,2016)。值得注意的是,gdf5 群体中的这个表达lgr5的细胞亚群还可以产生多种关节组织,包括滑膜、十字韧带、半月板和关节软骨。
127.lgr5 间区细胞促成不同关节结构的形成
128.lgr5 细胞池在表达gdf5的细胞最初出现后不久就出现,其标记出未来的关节部位。因此,lgr5 细胞很可能来源于已经历去分化的gdf5 细胞,这与使用gdf5-cre小鼠的细胞命运映射结果一致(koyama et al.,2008),并且从gdf5 到lgr5 细胞的进行性分化是一个连续事件。在指关节中,由于lgr5 细胞出现并保持在间区的中心,因此在连续内流模型(continuous influx model)(shwartz et al.,2016)中提出的gdf5 细胞被认为是中央lgr5 细胞池的外周细胞。我们的单细胞转录组显示,lgr5 池的扩张部分是通过外周间区细胞的分化和增殖,表现为在发育中的关节中出现lgr5 /ki67 细胞,以及在tsne图谱所示
的细胞簇中存在差异仅在表达活性细胞周期相关基因的lgr5 细胞群体。在较复杂的膝间区中,可能存在其他机制。
129.在我们的映射研究中,在e13.5激活lacz会标记这个早期的lgr5 细胞池,并且我们观察到它们可促成关节的所有结构。通过单次他莫昔芬注射对仅少数表达lgr5 的细胞的标记允许我们评估对关节不同结构的贡献水平。在发育中的膝关节中,lgr5 细胞对关节软骨、半月板和滑膜的贡献没有可观察到的差异。有趣的是,在十字韧带中发现了更多的子代细胞,表明它们已经增殖。此外,lgr5在发育中的韧带的细胞中持续表达,这与由e13.5间区的标记的lgr5 细胞的扩张一致,在e17.5的韧带中有大量子代细胞。这得到了在来自e14.5间区的单细胞转录组数据的tsne图中鉴定出具有活性细胞周期基因的韧带细胞簇的支持。
130.lgr5 细胞在谱系分化开始时是预备的祖细胞
131.与体内分析一致,来自bulk和单细胞分析的转录组学数据都支持了lgr5 细胞作为祖细胞,预备向关节软骨细胞或韧带谱系分化。使用代表间区细胞的簇来产生拟时间线,我们确定了八种细胞状态,将具有大部分lgr5 细胞的簇1放在一起,作为“预备的”祖细胞的最“初始的”状态i(图5d)。许多处于状态i的lgr5 细胞同时表达韧带和软骨细胞的基因标签,然后特化为韧带或软骨细胞谱系的更多不同标签。谱系特异性转录因子平衡的变化可以控制该分化。
132.有趣的是,发现约10%的lgr5 细胞处于状态v,预测其源自状态i,并且其原因尚不清楚。这些细胞可能是由于在关节发育中以不同方式募集的细胞(shwartz et al.,2016),不排除这种情形。每个韧带或软骨细胞轨迹中均存在多种细胞状态,这表明每个谱系中均存在细胞亚类,这可能与它们沿十字韧带的位置有关,或与软骨细胞位于关节或半月板区域之间的差异有关。例如,软骨-肌腱/韧带连接处的多潜能scx /sox9 祖细胞池会产生肌腱细胞/韧带细胞和软骨细胞(sugimoto et al.,2013)。基于我们当前的发现所建立的模型中所示,我们提出,在发育中的膝关节内可能存在这些细胞的位置信息(图7)。
133.lgr5和wnt信号传导在关节发育中的作用
134.尽管lgr5-gfp纯合子小鼠在围产期死亡(barker et al.,2007),但它们在关节中未显示出组织学异常(图10)。这可能是由于三种lgr蛋白(lgr4、5和6)之间的功能性冗余所致(ruffner et al.,2012)。在我们的转录组数据集中lgr4有表达,而lgr6不表达。lgr5的表达可能反映了适当水平的wnt配体对其激活的位置效应,并且lgr5对wnt信号传导的增强反过来通过与r-spondin相互作用维持更高的信号传导水平(de lau et al.,2011),这是进展到下一阶段所必需的,为形成其他结构和关节腔形成作准备。
135.col22a1对来自表达lgr5的间区细胞的关节软骨谱系进行标记
136.随着关节腔形成lgr5表达在早期关节表面细胞中减少,这符合减少抑制软骨形成的wnt信号以用于关节软骨细胞分化的需要。我们对这个谱系的分子控制知之甚少。软骨形成性bmp信号传导起着重要的作用(rountree et al.,2004),支持这一观点的证据有gdf5持续表达而lgr5减少使平衡倾向于软骨形成,我们鉴定col22a1为这些谱系的中间标志物,以及细胞共表达col22a1和lgr5。col22a1/colxxii表达从近端开始,随后在发育中的间区内位于未来关节表面的边缘附近。这在较不复杂的指关节中得到了最好的说明,并且与提出的模型一致,即发育中的间区分为三层,两个外层包含最终成为关节软骨细胞的细胞,中
international society for matrix biology 39,5-10.
145.decker,r.s.,um,h.b.,dyment,n.a.,cottingham,n.,usami,y.,enomoto-iwamoto,m.,kronenberg,m.s.,maye,p.,rowe,d.w.,koyama,e.,et al.(2017).cell origin,volume and arrangement are drivers of articular cartilage formation,morphogenesis and response to injury in mouse limbs.dev biol 426,56-68.
146.diez-roux,g.,banfi,s.,sultan,m.,geffers,l.,anand,s.,rozado,d.,magen,a.,canidio,e.,pagani,m.,peluso,i.,et al.(2011).a high-resolution anatomical atlas of the transcriptome in the mouse embryo.plos biol 9,e1000582.
147.dowthwaite,g.p.,bishop,j.c.,redman,s.n.,khan,i.m.,rooney,p.,evans,d.j.,haughton,l.,bayram,z.,boyer,s.,thomson,b.,et al.(2004).the surface of articular cartilage contains a progenitor cell population.j cell sci 117,889-897.
148.dy,p.,smits,p.,silvester,a.,penzo-mendez,a.,dumitriu,b.,han,y.,de la motte,c.a.,kingsley,d.m.,and lefebvre,v.(2010).synovial joint morphogenesis requires the chondrogenic action of sox5 and sox6 in growth plate and articular cartilage.dev biol 341,346-359.
149.gao,b.,hu,j.,stricker,s.,cheung,m.,ma,g.,law,k.f.,witte,f.,briscoe,j.,mundlos,s.,he,l.,et al.(2009).a mutation in ihh that causes digit abnormalities alters its signalling capacity and range.nature 458,1196-1200.
150.gunnell,l.m.,jonason,j.h.,loiselle,a.e.,kohn,a.,schwarz,e.m.,hilton,m.j.,and o'keefe,r.j.(2010).tak1 regulates cartilage and joint development via the mapk and bmp signaling pathways.journal of bone and mineral research:the official journal of the american society for bone and mineral research 25,1784-1797.
151.guo,x.z.,day,t.f.,jiang,x.y.,garrett-beal,l.,topol,l.,and yang,y.z.(2004).wnt/beta-catenin signaling is sufficient and necessary for synovial joint formation.genes&development 18,2404-2417.
152.hartmann,c.,and tabin,c.j.(2001).wnt-14 plays a pivotal role in inducing synovial joint formation in the developing appendicular skeleton.cell 104,341-351.
153.huang da,w.,sherman,b.t.,and lempicki,r.a.(2009).systematic and integrative analysis of large gene lists using david bioinformatics resources.nature protocols 4,44-57.
154.hunter,w.(1995).of the structure and disease of articulating cartilages.1743.clinical orthopaedics and related research,3-6.
155.kharchenko,p.v.,silberstein,l.,and scadden,d.t.(2014).bayesian approach to single-cell differential expression analysis.nat methods 11,740-742.
156.koch,m.,schulze,j.,hansen,u.,ashwodt,t.,keene,d.r.,brunken,w.j.,
lgr5.plos one 7,e40976.
168.shwartz,y.,viukov,s.,krief,s.,and zelzer,e.(2016).joint development involves a continuous influx of gdf5-positive cells.cell reports 15,2577-2587.
169.shwartz,y.,and zelzer,e.(2014).nonradioactive in situ hybridization on skeletal tissue sections.methods mol biol 1130,203-215.
170.singh,p.n.p.,yadav,u.s.,azad,k.,goswami,p.,kinare,v.,and bandyopadhyay,a.(2018).nfia and gata3 are crucial regulators of embryonic articular cartilage differentiation.development 145.
171.soriano,p.(1999).generalized lacz expression with the rosa26 cre reporter strain.nature genetics 21,70-71.
172.storm,e.e.,and kingsley,d.m.(1999).gdf5 coordinates bone and joint formation during digit development.dev biol 209,11-27.
173.sugimoto,y.,takimoto,a.,akiyama,h.,kist,r.,scherer,g.,nakamura,t.,hiraki,y.,and shukunami,c.(2013).scx /sox9 progenitors contribute to the establishment of the junction between cartilage and tendon/ligament.development 140,2280-2288.
174.zulch,a.,becker,m.b.,and gruss,p.(2001).expression pattern of irx1 and irx2 during mouse digit development.mech dev 106,159-162.
175.zwolanek,d.,veit,g.,eble,j.a.,gullberg,d.,ruggiero,f.,heino,j.,meier,m.,stetefeld,j.,and koch,m.(2014).collagen xxii binds to collagen binding integrins via the novel motifs glqger and gfkger.the biochemical journal.
176.xuefei gao et al.(2019).establishment of porcine and human expanded potential stem cells.nat cell biol.21(6):687-699
177.前述描述的具体实施方案充分地公开了本公开的一般性质,使得其他人可以通过应用相关领域技术范围内的知识(包括本文中引用的内容和通过引用并入的文件的内容)而容易地修改和/或调整此具体实施方案的各种应用,而无需过度实验,且不脱离本公开的整体构思。因此,基于本文中呈现的教导和指导,此类调整和修改旨在位于所公开实施方案的等价物的含义和范围内。应当理解,本文中的措辞或术语是为了描述而非限制的目的,使得本说明书的术语或措辞应通过本领域技术人员根据本文中呈现的教导和指导,并结合相关领域技术人员的认知来解释。
178.尽管上文已经描述了本公开的多个实施方案,但是应当理解,它们是通过实施例而非限制的方式呈现的。对于相关领域的技术人员来说,可以在本文的形式和细节上进行各种改变是显而易见的,并不脱离本公开的精神和范围。因此,本公开不应当受到任意上述示例性实施方案的限制,而应当仅根据所附权利要求及其等价物来限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。