一种新型手性p,n(h),p配体及其制备方法和应用
技术领域
1.本发明涉及有机合成领域,具体涉及一种新型手性p,n(h),p配体及其制备方法和在fe催化不对称氢化反应中的应用。
背景技术:
2.配体设计、合成是均相催化研究的核心,对均相催化的发展和繁荣具有至关重要的作用。在过去的几十年里,大量的配体被设计、合成并成功应用于各类均相催化反应中。其中具有二级胺结构的三齿p,n(h),p-配体由于其特殊的螯合配位作用,在配位化学和均相催化研究中长期受到关注并在新近出现的廉价金属催化氢化研究中获得了极大成功[(1)zhang,z.;butt,n.a.;zhou,m.;liu,d.;zhang,w.chin.j.chem.2018,36,443-454;(2)alberico,e.;sponholz,p.;cordes,c.;nielsen,m.;drexler,h.j.;baumann,w.;junge,h.;beller,m.angew.chem.int.ed.2013,52,14162
–
14166;(3)chakraborty,s.;dai,h.;bhattacharya,p.;fairweather,n.t.;gibson,m.s.;krause,j.a.;guan,h.j.am.chem.soc.2014,136,7869
–
7872;(4)chakraborty,s.;brennessel,w.w.;jones,w.d.j.am.chem.soc.2014,136,8564
–
8567;(5)werkmeister,s.;junge,k.;wendt,b.;alberico,e.;jiao,h.;baumann,w.;junge,h.;gallou,f.;beller,m.angew.chem.int.ed.2014,53,8722
–
8726;(6)bielinski,e.a.;lagaditis,p.o.;zhang,y.y.;mercado,b.q.;wurtele,c.;bernskoetter,w.h.;hazari,n.;schneider,s.j.am.chem.soc.2014,136,10234
–
10237;(7)chakraborty,s.;lagaditis,p.o.;forster,m.;bielinski,e.a.;hazari,n.;holthausen,m.c.;jones,w.d.;schneider,s.acs catal.2014,4,3994
–
4003;(8)bornschein,c.;werkmeister,s.;wendt,b.;jiao,h.;alberico,e.;baumann,w.;junge,h.;junge,k.;beller,m.nat.commun.2014,5,4111;(9)xu,r.;chakraborty,s.;bellows,s.m.;yuan,h.;cundari,t.r.;jones,w.d.acs catal.2016,6,2127
–
2135.]。但这类配体在fe-催化不对称氢化反应中的应用直到最近才获得了成功,morris报道了首例阴离子型手性fe/p,n,p-配体在芳香酮催化不对称氢化反应中的例子,获得了优异的对映选择性[(9)smith,s.a.m.;lagaditis,p.o.;lupke,a.;lough,a.j.;morris,r.h.chem.eur.j.2017,23,7212
–
7216.]。目前,有效的手性p,n(h),p-配体还极其有限[(10)garbe,m.;wei,z.;tannert,b.;spannenberg,d.;jiao,h.;bachmann,s.;scalone,m.;junge,k.;m.beller,adv.synth.catal.2019,361,1913-1920.],因此设计和发展新的手性三齿p,n(h),p-配体,对廉价金属特别是fe-催化不对称氢化反应研究的深入开展具有积极的科学和现实意义。
技术实现要素:
[0003]
本发明的目的是提供一种合成简便、性质稳定的新型手性三齿p,n(h),p-配体及其制备方法和在铁催化芳香酮不对称氢化反应中的应用。
[0004]
具体地,本发明所述手性三齿p,n(h),p-配体,其结构如式i所示;
[0005][0006]
其中,r1选自氢、c
1-c
40
烷基、c
3-c
12
环烷基、苯基及取代苯基、苄基和取代苄基等;所述苯基以及苄基的取代基各自独立地选自c
1-c
40
烷基、c
1-c
40
烷氧基、卤素、硝基、酯基或氰基中的一种或多种,取代基数目为1-5个;所述卤素为f、cl、br和i。
[0007]
r2,r3为c
1-c
40
烷基、c
3-c
12
环烷基、苯基或取代苯基、萘基或取代萘基、杂环芳香基团或取代杂环芳香基团;所述取代苯基、取代萘基、取代杂环芳香基团的取代基选自c
1-c
40
烷基、c
1-c
40
烷氧基、卤素、硝基、酯基或氰基中的一种或多种,取代基数目为1-5个;所述卤素为f、cl、br和i;所述杂环芳香基团是指含一种或多种n、o、s等杂原子的五元或六元芳香基团;
[0008]
r2,r3可以为相同或不同基团;
[0009]
在本发明中,如无特殊说明,本发明所述的r1,r2,r3基团均如此处所定义。
[0010]
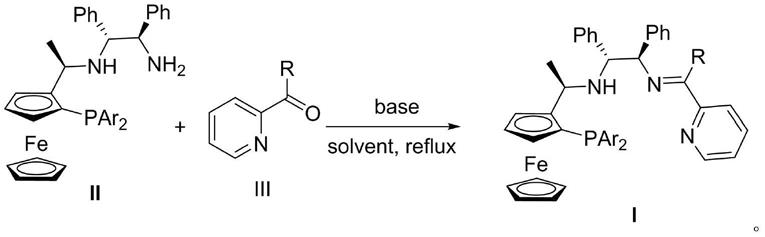
为实现上述目的,在本发明中,所述手性三齿p,n(h),p-配体i的制备方法按以下反应路线进行;
[0011][0012]
在本发明中,所述手性三齿p,n(h),p-配体i的制备方法包括以下步骤:
[0013]
氮气保护下,将手性二茂铁膦-醋酸酯化合物ii、膦-胺化合物iii与碱分别加入反应介质中回流搅拌6-24小时,反应完毕后减压浓缩至基本无溶剂,硅胶柱层析分离,减压浓缩,真空干燥制备手性三齿p,n(h),p-配体。
[0014]
在本发明中,所述碱添加剂为无机碱或有机碱,选自ipr2net、net3、koh、naoh、k2co3和cs2co3等中的一种或多种;优选为net3。
[0015]
在本发明中,所述反应介质选自质子性溶剂和/或非质子性溶剂,包括甲醇、乙醇、四氢呋喃、甲苯、乙腈和二氯甲烷中的一种或多种;优选为乙醇或甲苯。(上述反应介质均为无水介质)。
[0016]
在本发明中,所述手性二茂铁膦-醋酸酯化合物与膦-胺化合物的摩尔比1:0.1-10,优选为1:2。
[0017]
在本发明中,所述手性二茂铁膦-醋酸酯化合物与碱的摩尔比1:0.5-5,优选为1:1。
[0018]
在本发明中,所述手性三齿p,n(h),p-配体i,其优势配体结构如下:
[0019][0020]
本发明还涉及上述配体在fe-催化芳香酮不对称氢化反应中的应用。
[0021]
本发明提供的手性三齿p,n(h),p-配体,其可用于芳香酮的fe-催化不对称氢化反应中,将手性三齿p,n(h),p-配体与fe催化剂前体按摩尔比1.1:1组成催化剂,反应底物与催化剂的比例为0.01-1:1,反应时间0.5-24小时。
[0022]
其中,所述铁金属催化剂前体为铁盐或铁金属配合物,选自无水fe(otf)2(三氟甲磺酸亚铁(ii))、fecl2、fe(oac)2(醋酸亚铁)、fe2(co)9、fe3(co)
12
、三羰基环辛四烯基铁中的一种或多种。
[0023]
本发明的有益效果:
[0024]
本发明的手性三齿p,n(h),p-配体,其制备方法简单,性质稳定、对空气和湿度具有很好的忍耐力,结构易修饰。其与fe金属前体形成的催化剂对芳香酮的不对称氢化具有优异的反应活性和对映选择性。
附图说明
[0025]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。以下,结合附图来详细说明本发明的实施方案,其中:
[0026]
图1为实施例1制备的手性配体(rc,s
p
)-i-1氢谱;
[0027]
图2为实施例1制备的手性配体(rc,s
p
)-i-1碳谱;
[0028]
图3为实施例1制备的手性配体(rc,s
p
)-i-1磷谱;
[0029]
图4为实施例8制备的手性配体(rc,s
p
,rc)-i-2氢谱;
[0030]
图5为实施例8制备的手性配体(rc,s
p
,rc)-i-2碳谱;
[0031]
图6为实施例8制备的手性配体(rc,s
p
,rc)-i-2磷谱;
具体实施方式
[0032]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
[0033]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。本发明所使用的试剂或原料均可通过常规途径购买获得,如无特殊说明,本发明所使用的试剂或原料均按照本领域常规方式使用或者按照产品说明书使用。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。本发明实施例的核磁共振是通过bruker 400核磁共振仪测定。
i-2,66%收率。配体(rc,s
p
,rc)-i-2的核磁共振氢谱、磷谱和碳谱如图4、图5、图6所示:1h nmr(400mhz,cdcl3)δ7.55
–
6.63(m,24h),4.64
–
4.56(m,1h),4.34(q,j=2.0hz,1h),4.21(t,j=2.8hz,1h),4.11
–
4.05(m,1h),3.85(t,j=3.0hz,5h),3.74(d,j=2.2hz,1h),1.09(d,j=4.8hz,3h),0.75(d,j=5.6hz,3h).
13
c nmr(100mhz,cdcl3)δ151.8,151.6,140.7,140.6,137.6,137.6,137.5,137.4,137.2,137.1,135.4,135.2,134.3,134.2,134.1,134.0,133.8,133.7,133.0,132.9,132.9,129.2,129.1,128.7,128.6,128.5,128.5,128.2,128.1,126.8,126.8,126.5,98.9,98.6,75.0,74.9,69.7,69.2,69.0,53.3,53.1,49.8,49.7,22.0,19.2.
31
p nmr(162mhz,cdcl3):δ-16.5,-25.3;hrms cal.for c
44h42
fenp
2
[m h]
:702.2136,found:702.2140.
[0052]
iii-2,(rc,s
p
,rc)-i-2的结构式如下:
[0053][0054]
实施例9(rc,s
p
)-i-1为配体,fe2(co)9为金属前体催化苯乙酮的氢化反应
[0055]
氮气保护下,将fe2(co)9(0.005mmol,1.0mol%),(rc,s
p
)-i-1(0.011mmol,1.1mol%)溶于二氯甲烷(1.0ml)中,室温(25℃)下搅拌1小时,加入苯乙酮(1.0mmol)的二氯甲烷(1.0ml)溶液,将其置于高压反应釜中,氢气置换3次,然后通入60bar氢气,室温反应24小时。慢慢释放氢气,除去溶剂后用硅胶柱分离得到产物1-苯乙醇,转化率99%,83%ee的对映选择性。
[0056]
实施例10(rc,s
p
,rc)-i-2为配体,fe2(co)9为金属前体催化苯乙酮的氢化反应
[0057]
将实施例9中的配体(rc,s
p
)-i-1替换为(rc,s
p
,rc)-i-2,其余同实施例9,得到产物1-苯乙醇,转化率99%,91%ee的对映选择性。
[0058]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。