1.本发明涉及生物医学技术领域,具体为一种靶向肝脏的工程化外泌体制备方法。
背景技术:
2.外泌体是指包含了复杂rna和蛋白质的小膜泡(30-150nm),这些外囊泡可以介导细胞间的通讯,已被用作将各种有效生物活性物质(例如蛋白质、脂质和核酸)输送至受体细胞的传递介质,多种细胞在正常及病理状态下均可分泌外泌体,其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中,所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中,有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究,外泌体被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。
3.外泌体携带有多种蛋白质、脂类、rna等重要信息,近年来,随着外泌体研究的不断深入,其应用已经涉及肿瘤治疗、医学基础和免疫治疗等领域,工程化外泌体作为药物递送载体治疗肝脏疾病受制于“器官特异性分布”的影响,这是由外泌体表面上独特的整合素表达特征决定的,富含整合素αvβ5的外泌体更多地聚集于肝脏,为了制备靶向肝脏的外泌体可以用基因转染的策略,本发明提出一种靶向肝脏的工程化外泌体制备方法。
技术实现要素:
4.(一)解决的技术问题
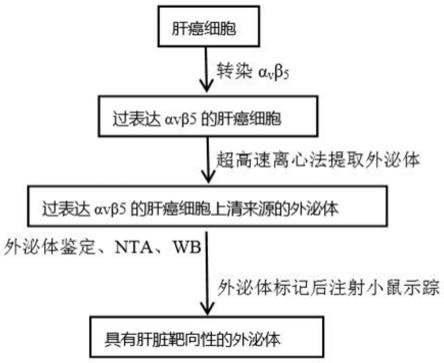
5.针对现有技术的不足,本发明提供了一种靶向肝脏的工程化外泌体制备方法,采用αvβ5转染肝癌细胞hepg2,得到过表达αvβ5的肝癌细胞,收集该细胞的上清,超速离心法获得的外泌体,该外泌体为具有肝脏靶向性的外泌体。
6.(二)技术方案
7.为实现上述目的,在本发明的一个方面,提供一种靶向肝脏的工程化外泌体,该外泌体采用αvβ5转染肝癌细胞hepg2得到过表达αvβ5的肝癌细胞,然后收集细胞上清通过超速离心法获得,制得的工程化外泌体具有肝脏靶向性,可应用在肝脏疾病治疗中。
8.而在本发明的另一方面,提供了该靶向肝脏的工程化外泌体的制备方法,包括以下步骤:
9.1)采用αvβ5对肝癌细胞hepg2进行转染,制得具有过表达整合素αvβ5的肝癌细胞hepg2;
10.2)收集步骤1)制得的具有过表达整合素αvβ5的肝癌细胞hepg2的上清,然后通过超速离心的方法获得该工程化外泌体。
11.在具体的实施方案中,采用αvβ5对肝癌细胞hepg2进行转染具体包括以下步骤:
12.(1)载体构建:基因合成整合素αvβ5,将其构建到表达载体pcdna3.1 上;
13.(2)细胞培养及转染:培养hepg2细胞,待细胞密度达到80%左右,转染上述质粒,
转染8h后换液,48h后收集细胞。
14.同时,收集具有过表达整合素αvβ5的肝癌细胞hepg2的上清,然后通过超速离心的方法获得该工程化外泌体具体包括以下步骤:
15.(1)分别收集对应分组的细胞上清,4℃1000rpm离心10min,去除细胞碎片;
16.(2)将上清放入新的离心管中,4℃2000g离心10min,进一步去除杂质;
17.(3)取上清,15ml超滤管(10kd)浓缩,4℃3500g离心20min;
18.(4)0.22μm滤膜过滤后,超高速离心机120000g离心90min,弃上清,沉淀用pbs重悬。
19.(三)有益效果
20.与现有技术相比,本发明提供了一种靶向肝脏的工程化外泌体制备方法,具备以下有益效果:
21.本发明获得了肝脏靶向性的外泌体,对于肝脏疾病的治疗具有重大意义,其采用αvβ5转染hepg2细胞,获得过表达αvβ5的hepg2细胞,收集该细胞的上清用超速离心的方法获得外泌体,也高表达αvβ5,为了进一步证实该外泌体靶向肝脏,采用pkh26对外泌体进行染色后,注射小鼠,发现荧光聚集于肝脏,这些结果证实了我们得到了靶向肝脏的外泌体,此方法高效便捷,对于疾病的治疗有极大的指导意义。
附图说明
22.图1为本发明制备工程化外泌体的流程示意图;
23.图2为本发明qpcr检测αvβ5表达量的结果示意图;
24.图3为本发明western blot检测αvβ5表达量的结果示意图;
25.图4为本发明nta检测外泌体浓度、大小的结果示意图;
26.图5为本发明tem检测外泌体形态的结果示意图;
27.图6为本发明western blot检测外泌体cd9、tsg101以及整合素αvβ5的表达结果示意图;
28.图7为本发明制得的工程化外泌体进行裸鼠试验的结果示意图。
具体实施方式
29.本发明实施例中所用的试剂如下:
30.0.22μm滤膜(津腾)、离心机(湘仪)、超高速离心机(贝克曼)、实时荧光定量pcr仪(abi)、电泳仪(六一)、trizol(life)、revertra ace qpcrrt kit(东洋纺)、sybr green realtime pcr master mix(东洋纺)、 cd9\tsg101\αvβ5\β-actin抗体(abcam)以及肝癌细胞系hepg2等。
31.下面将结合本发明的实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
32.工程化外泌体作为药物递送载体治疗肝脏疾病受制于“器官特异性分布”的影响,这是由外泌体表面上独特的整合素表达特征决定的,富含整合素αvβ5的外泌体更多地聚集
于肝脏,可以用基因转染的策略制备具有天然的肝脏靶向性的外泌体。
33.基于此,在本发明的一个方面,提供一种靶向肝脏的工程化外泌体,该外泌体采用αvβ5转染肝癌细胞hepg2得到过表达αvβ5的肝癌细胞,然后收集细胞上清通过超速离心法获得,制得的工程化外泌体具有肝脏靶向性,可应用在肝脏疾病治疗中。
34.而在本发明的另一方面,提供了该靶向肝脏的工程化外泌体的制备方法,包括以下步骤:
35.1)采用αvβ5对肝癌细胞hepg2进行转染,制得具有过表达整合素αvβ5的肝癌细胞hepg2;
36.2)收集步骤1)制得的具有过表达整合素αvβ5的肝癌细胞hepg2的上清,然后通过超速离心的方法获得该工程化外泌体。
37.其中,采用αvβ5对肝癌细胞hepg2进行转染具体包括以下步骤:
38.(1)载体构建:基因合成整合素αvβ5,将其构建到表达载体pcdna3.1 上;
39.(2)细胞培养及转染:培养hepg2细胞,待细胞密度达到80%左右,转染上述质粒,转染8h后换液,48h后收集细胞。
40.对收集后的细胞进行qpcr和wertern blot实验,检测是否已成功获得过表达整合素αvβ5的肝癌细胞,试验过程中进行分组,分组如下:
41.hepg2 oe-nc(过表达空载体pcdna3.1的肝癌细胞hepg2);
42.hepg2 oe-αvβ5(过表达αvβ5的肝癌细胞hepg2)。
43.qpcr检测αvβ5表达量,试验步骤如下:
44.(1)rna抽提;
45.a.细胞沉淀加入1ml trizol,用移液枪吹打使其溶解充分,室温静置 5min;
46.b.加入0.2ml氯仿,剧烈振荡15s,静置3min;
47.c.4℃,12000rpm离心10min,取上清至新的1.5ml rnase free ep管;
48.d.加入与上清液等量的异丙醇,上下颠倒混匀数次,冰上静置25min;
49.e.4℃,12000rpm离心10min,弃上清;
50.f.加入1ml预冷的75%乙醇,颠倒洗涤沉淀,4℃,12000rpm
×
5min,弃上清;
51.g.室温干燥5min左右,在rna沉淀变半透明状态时加入适量的depc水溶解,测浓度,-80℃冻存备用;
52.(2)逆转录(revertra ace qpcr rt kit,fsq-101,200t,东洋纺);
53.反应体系如下:
54.55.a.37℃条件下,进行15分钟的逆转录反应;
56.b.98℃条件下,进行5分钟的酶失活反应;
57.c.反应结束之后,加入50μl纯水保存于-20℃条件下;
58.(3)qpcr检测;
59.a.反应体系如下:
[0060][0061]
b.反应条件:
[0062][0063]
(4)结果以2
‑△△
ct分析,如图2所示。
[0064]
western blot检测αvβ5表达量,试验步骤如下:
[0065]
(1)蛋白提取;
[0066]
a.400g离心5min收集细胞沉淀;
[0067]
b.加入适量裂解液ripa(含蛋白酶抑制剂和pmsf);
[0068]
c.4℃旋转器25min;
[0069]
d.12000rpm离心10min收集上清至新的ep管;
[0070]
(2)蛋白浓度测定;
[0071]
使用bca蛋白质浓度测定试剂盒测定样品蛋白浓度,浓度测定后在蛋白样品中加入适量的5
×
蛋白上样缓冲液,95-100℃金属浴10min;
[0072]
(3)western blot;
[0073]
a.制胶:下层分离胶,上层浓缩胶并插好梳子;
[0074]
b.点样:将电泳架放入电泳槽中,加入电泳缓冲液,拔出梳子,将样品加入点样孔中(每孔上样量为40μg);
[0075]
c.电泳:按浓缩胶80v、分离胶120v进行恒压电泳,至溴酚蓝到达胶板下沿;
[0076]
d.转膜:准备转膜滤纸和pvdf膜,pvdf膜在使用之前先用甲醇活化,活化时间5min;按照正负极的方向摆放转膜“三明治”结构,从正极到负极依次为转膜海绵、3层滤纸、pvdf膜、胶、3层滤纸、转膜海绵,摆放过程中要除尽各层中的气泡;按300ma恒流转膜,转膜时间根据目的蛋白分子量大小调整;
[0077]
e.封闭:5%脱脂牛奶室温孵育膜1h;
[0078]
f.一抗孵育:加入相应的一抗,4℃孵育过夜;回收一抗,tbst洗膜3 次,每次5min;
[0079]
g.二抗孵育:根据一抗的来源,常温孵育对应的二抗1h,tbst洗膜3 次,每次5min;
[0080]
显影:滴加新鲜配制的ecl混合溶液(a:b=1:1)到膜的蛋白面侧,暗室中曝光。
[0081]
结果如图3所示。
[0082]
qpcr和western blot结果表明与空载组相比,过表达组肝癌细胞hepg2 中的αvβ5表达水平明显升高,表明已成功获得过表达整合素αvβ5的肝癌细胞。
[0083]
此外,收集具有过表达整合素αvβ5的肝癌细胞hepg2的上清,然后通过超速离心的方法获得该工程化外泌体具体包括以下步骤:
[0084]
(1)分别收集对应分组的细胞上清,4℃1000rpm离心10min,去除细胞碎片;
[0085]
(2)将上清放入新的离心管中,4℃2000g离心10min,进一步去除杂质;
[0086]
(3)取上清,15ml超滤管(10kd)浓缩,4℃3500g离心20min;
[0087]
(4)0.22μm滤膜过滤后,超高速离心机120000g离心90min,弃上清,沉淀用pbs重悬。
[0088]
对制得的外泌体进行各项检测,包括nta检测、tem检测以及western blot 检测,检测过程中进行分组,分组如下:
[0089]
hepg2 oe-nc-evs(肝癌细胞上清外泌体);
[0090]
hepg2 oe-αvβ
5-evs(过表达αvβ5的肝癌细胞上清外泌体)。
[0091]
nta检测外泌体浓度、大小,检测步骤和现有技术中常规检测步骤相同,结果如图4所示,其中,左侧为hepg2 oe-nc-evs,右侧为hepg2 oe-αvβ
5-evs。
[0092]
tem检测外泌体形态,步骤如下:
[0093]
a.取出10μl外泌体滴加于铜网上沉淀1min,滤纸吸去浮液;
[0094]
b.醋酸双氧铀10μl滴加于铜网上沉淀1min,滤纸吸去浮液;
[0095]
c.常温干燥数分钟;
[0096]
d.100kv进行电镜(hitachi,ht-7700)检测成像。
[0097]
获得透射电镜成像结果,如图5所示。
[0098]
western blot检测外泌体cd9、tsg101以及整合素αvβ5的表达,检测步骤和现有技术中常规检测步骤相同,结果如图6所示。
[0099]
上述各检测结果表明外泌体提取成功,并且hepg2 oe-αvβ
5-evs组外泌体中过表达αvβ5[0100]
实验例:将制得的工程化外泌体进行裸鼠实验,实验前进行分组,分组如下:
[0101]
hepg2 oe-nc-evs(肝癌细胞上清外泌体);
[0102]
hepg2 oe-αvβ
5-evs(过表达αvβ5的肝癌细胞上清外泌体)。
[0103]
实验步骤如下:
[0104]
(1)pkh26染色:外泌体(10μg)用亲脂pkh26染料(红色)标记;
[0105]
(2)示踪:将外泌体注射入裸鼠,观察外泌体的组织分布情况,明确其肝脏靶向性。
[0106]
实验结果如图7所示,采用pkh26对外泌体进行染色后,注射小鼠,发现荧光聚集于肝脏,这些结果证实了我们得到了靶向肝脏的外泌体,此方法高效便捷,对于疾病的治疗有极大的指导意义。
[0107]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
