构建产l-缬氨酸的重组微生物的方法及其所用核酸分子和生物材料
技术领域
1.本发明属于微生物变异或遗传工程技术领域,具体涉及构建产l-缬氨酸的重组微生物的方法及其所用核酸分子和生物材料。
背景技术:
2.l-缬氨酸(l-valine),化学名称为α-氨基异戊酸,是支链氨基酸之一,人和动物自身不能合成。l-缬氨酸是人体八种必需氨基酸之一,具有促进蛋白合成、抑制蛋白分解的作用,增强机体的免疫防护作用,有助于纠正因手术、创伤、感染等引起的负氮平衡。另外,l-缬氨酸还具有抗中枢疲劳的作用,抗外周疲劳作用,延缓运动性疲劳,加快运动后机体的修复,因此在食品和医药行业具有广泛的应用及商业价值。由l-缬氨酸配制的复合支链氨基酸输液在血脑屏障、肝昏迷、慢性肝硬化以及肾功能衰竭的治疗,先天性代谢缺陷病的膳食治疗,败血症及术后糖尿病患者的治疗,加快外科创伤愈合的治疗和肿瘤患者的营养支持治疗中应用广泛。l-缬氨酸在食品工业上主要用作食品添加剂、营养增补液及风味剂等。l-缬氨酸凝胶具有带正电的端基,是新型低分子量凝胶,可以制备形成水凝胶,其在生物医药、组织工程、光化学、电化学、食品工业、化妆品等领域已被广泛应用。
3.目前,l-缬氨酸的生产方法主要有提取法、化学合成法、发酵法。提取法和化学合成法由于原料来源受限制、生产成本高、收率低,污染严重,难以实现工业化生产。微生物直接发酵法生产l-缬氨酸具有原料来源广泛,成本低、反应条件温和、容易实现大规模生产等优点,是一种非常经济、高效的生产方法。而工业发酵中获得高产的菌种,对于l-缬氨酸的发酵生产来说是至关重要的,是整个l-缬氨酸发酵工业的核心,是决定发酵产品工业价值的重要因素。随着基因工程育种技术的不断发展,从分子水平上改造生产菌,研究和挖掘相关基因的功能,为l-缬氨酸的工业化发酵生产提供了广阔的前景。选育高产、稳定的生产菌种,促进l-缬氨酸在微生物体内的积累,进一步提高l-缬氨酸的产量将一直伴随l-缬氨酸发酵工业的发展,对于促进l-缬氨酸产业化的进程具有重要的意义。
技术实现要素:
4.本发明所要解决的技术问题是如何提高微生物l-缬氨酸的产量,所要解决的技术问题不限于所描述的技术主题,本领域技术人员通过以下描述可以清楚地理解本文未提及的其它技术主题。
5.为解决上述技术问题,本发明首先提供了一种构建重组微生物的方法,所述方法包括至少下述任一种:
6.f1)将编码蛋白质的核酸分子导入目的微生物,得到所述重组微生物,所述蛋白质名称为cey17_rs14810
g397y
,可为下述任一种:
7.a1)氨基酸序列是seq id no.4的蛋白质,
8.a2)将seq id no.4所示的氨基酸序列经过氨基酸残基的取代和/或缺失和/或添
加得到的与a1)所示的蛋白质具有80%以上的同一性且具有相同功能的蛋白质,
9.a3)在a1)或a2)的n端和/或c端连接标签得到的具有相同功能的融合蛋白质;
10.f2)将seq id no.1所示的dna分子导入目的微生物,得到所述重组微生物;
11.f3)利用基因编辑手段(如单碱基基因编辑)对seq id no.1所示的dna分子进行编辑,使目的微生物中含有seq id no.3所示的dna分子。
12.所述导入可为通过化学转化法或电击转化法等任何已知的转化方法将携带本发明dna分子的载体转化宿主菌。导入的dna分子可以是单拷贝也可以是多拷贝。所述导入可以是将外源基因整合到宿主染色体中,也可以是由质粒在染色体外表达。
13.所述蛋白质cey17_rs14810
g397y
也在本发明的保护范围内。
14.本发明还提供了核酸分子,名称为cey17_rs14810
gg1189-1190ta
所述核酸分子可为下述任一种:
15.b1)编码所述蛋白质cey17_rs14810
g397y
的核酸分子;
16.b2)编码序列是seq id no.3所示的dna分子;
17.b3)核苷酸序列是seq id no.3所示的dna分子。
18.seq id no.3所示的dna分子也为本发明所述cey17_rs14810
gg1189-1190ta
基因。
19.seq id no.3所示的dna分子(cey17_rs14810
gg1189-1190ta
)编码seq id no.4所示的蛋白质cey17_rs14810
g397y
。
20.所述蛋白质cey17_rs14810
g397y
氨基酸序列(seq id no.4)中的第397位的酪氨酸(y)是由甘氨酸(g)突变而来。
21.本发明还提供了生物材料,所述生物材料可为下述任一种:
22.c1)含有所述核酸分子cey17_rs14810
gg1189-1190ta
的表达盒;
23.c2)含有所述核酸分子cey17_rs14810
gg1189-1190ta
的重组载体、或含有c1)所述表达盒的重组载体;
24.c3)含有所述核酸分子cey17_rs14810
gg1189-1190ta
的重组微生物、或含有c1)所述表达盒的重组微生物、或含有c2)所述重组载体的重组微生物。
25.本发明还提供了d1)-d8)中任一项的下述任一种应用:
26.g1)d1)-d8)中任一项在调控微生物的l-缬氨酸的产量中的应用;
27.g2)d1)-d8)中任一项在构建产l-缬氨酸的基因工程菌中的应用;
28.g3)d1)-d8)中任一项在制备l-缬氨酸中的应用;
29.其中,所述d1)-d8)为:
30.d1)所述蛋白质cey17_rs14810
g397y
;
31.d2)所述核酸分子cey17_rs14810
gg1189-1190ta
;
32.d3)所述生物材料;
33.d4)核苷酸序列为seq id no.1的dna分子;
34.d5)seq id no.1所示的核苷酸序列经过修饰和/或一个或几个核苷酸的取代和/或缺失和/或添加得到的与seq id no.1所示的dna分子具有90%以上的同一性,且具有相同功能的dna分子;
35.d6)含有d4)或d5)中所述dna分子的表达盒;
36.d7)含有d4)或d5)中所述dna分子的重组载体、或含有d6)所述表达盒的重组载体;
37.d8)含有d4)或d5)中所述dna分子的重组微生物、或含有d6)所述表达盒的重组微生物、或含有d7)所述重组载体的重组微生物。
38.seq id no.1所示的dna分子也为本发明所述cey17_rs14810基因。
39.seq id no.1所示的dna分子(cey17_rs14810基因)编码seq id no.2所示的蛋白质。
40.本文中,同一性是指氨基酸序列或核苷酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
41.本文中,所述80%以上的同一性可为至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
42.本文中,所述90%以上的同一性可为至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
43.本文所述调控微生物的l-缬氨酸的产量可为提高或降低微生物中l-缬氨酸的积累量(即促进或抑制l-缬氨酸的生物合成)。
44.本发明还提供了一种提高微生物中l-缬氨酸的产量的方法,所述方法包括下述任一种:
45.e1)提高目的微生物中的所述核酸分子cey17_rs14810
gg1189-1190ta
的表达量或含量,得到l-缬氨酸的产量高于所述目的微生物的微生物;
46.e2)提高目的微生物中的d4)或d5)所述dna分子的表达量或含量,得到l-缬氨酸的产量高于所述目的微生物的微生物;
47.e3)对所述目的微生物中的核苷酸序列为seq id no.1的dna分子进行突变(如碱基置换、碱基插入或碱基缺失),得到l-缬氨酸的产量高于所述目的微生物的微生物。
48.上述方法中,所述突变可为将seq id no.1所示dna分子编码的氨基酸序列的第397位的甘氨酸残基突变为另一种氨基酸残基。
49.上述方法中,所述突变可为将seq id no.1所示dna分子编码的氨基酸序列的第397位的甘氨酸残基突变为酪氨酸残基。
50.上述方法中,所述突变可为通过定点突变方法将seq id no.1所示dna分子中第1189-1190位的核苷酸gg突变为ta。
51.所述突变是指通过定点突变改变基因中的某个或某几个碱基,导致对应的蛋白质氨基酸组成发生改变,产生新的蛋白质或使原蛋白质产生新的功能,即基因定点突变。基因的定点突变技术如寡核苷酸引物介导的定点突变、pcr介导的定点突变或盒式突变等是本领域技术人员所熟知的。
52.本文所述载体是本领域技术人员公知的,包括但不限于:质粒、噬菌体(如λ噬菌体或m13丝状噬菌体等)、黏粒(即柯斯质粒)或病毒载体。具体可为pk18mobsacb或pxmj19。
53.本文中,所述微生物可为酵母、细菌、藻或真菌。其中,细菌可来自短杆菌属
091含有seq id no.3所示的突变的基因cey17_rs14810
gg1189-1190ta
。
65.所述重组菌ypv-092含有双拷贝的seq id no.1所示的cey17_rs14810基因;具体地,重组菌ypv-092是将谷氨酸棒杆菌cgmcc no.21260的基因组中上同源臂cey17_02570和下同源臂cey17_02575的间隔区替换为cey17_rs14810基因,保持谷氨酸棒杆菌cgmcc no.21260的基因组中的其它核苷酸不变得到的重组菌。含有双拷贝cey17_rs14810基因的重组菌可以显著和稳定地提高cey17_rs14810基因的表达量。重组菌ypv-092为在基因组上过表达野生型cey17_rs14810基因的工程菌,是将所述重组载体pk18-cey17_rs14810oe导入大肠杆菌dh5α得到的重组菌。
66.所述重组菌ypv-093含有seq id no.3所示的突变的cey17_rs14810
gg1189-1190ta
基因;具体地,重组菌ypv-093是将谷氨酸棒杆菌cgmcc no.21260的基因组中上同源臂cey17_02570和下同源臂cey17_02575的间隔区替换为cey17_rs14810
gg1189-1190ta
基因,保持谷氨酸棒杆菌cgmcc no.21260的基因组中的其它核苷酸不变得到的重组菌。重组菌ypv-093为在基因组上过表达突变型cey17_rs14810
gg1189-1190ta
基因的工程菌,是将所述重组载体pk18-cey17_rs14810
gg1189-1190ta
oe导入大肠杆菌dh5α得到的重组菌。
67.所述重组菌ypv-094含有seq id no.1所示的cey17_rs14810基因,重组菌ypv-094为在质粒上过表达野生型cey17_rs14810基因的工程菌,即由质粒pxmj19-cey17_rs14810在染色体外进行过表达。
68.所述重组菌ypv-095含有seq id no.3所示的突变的cey17_rs14810
gg1189-1190ta
基因,重组菌ypv-095为在质粒上过表达突变型cey17_rs14810
gg1189-1190ta
基因的工程菌,即由质粒pxmj19-cey17_rs14810
gg1189-1190ta
在染色体外进行过表达。
69.所述重组菌ypv-091、ypv-092、ypv-093、ypv-094和ypv-095均在本发明的保护范围内。
70.本发明还提供了一种制备l-缬氨酸的方法,所述方法包括利用本文中所述的重组微生物生产l-缬氨酸。
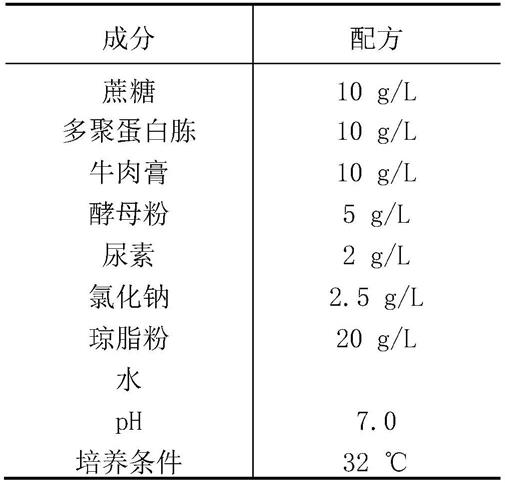
71.上述方法中,所述方法可为发酵法制备l-缬氨酸,所述重组微生物可为棒杆菌属(corynebacterium),具体可为谷氨酸棒杆菌(corynebacterium glutamicum)及其变体。
72.在本发明的一个实施方案中,所述重组微生物为重组菌ypv-091、ypv-092、ypv-093、ypv-094或ypv-095。
73.本发明首先以等位基因置换的方式在谷氨酸棒杆菌(corynebacterium glutamicum)cgmcc no.21260(经测序确认该菌株染色体上保留有野生型的cey17_rs14810基因)的cey17_rs14810基因编码区(seq id no.1)中引入突变,构建了包含突变(gg-ta)的基因工程菌ypv-091。为进一步研究验证在生产菌中过表达野生型cey17_rs14810基因或其突变基因cey17_rs14810
gg1189-1190ta
可以增加l-缬氨酸的产量,分别将外源基因整合到宿主染色体中或由质粒在染色体外表达,构建了基因组上和质粒上过表达cey17_rs14810基因或cey17_rs14810
gg1189-1190ta
基因的工程菌ypv-092、ypv-093、ypv-094和ypv-095。实验表明,cey17_rs14810基因及其变体参与了l-缬氨酸的生物合成,通过对cey17_rs14810基因进行过表达或敲除、或定点突变可以调控l-缬氨酸在微生物内的积累量。对cey17_rs14810基因编码区进行突变或在生产菌中过表达cey17_rs14810基因或其突变基因cey17_rs14810
gg1189-1190ta
,有助于l-缬氨酸产量及转化率的提高,而对cey17_rs14810基因进行敲
除或弱化,不利于l-缬氨酸的积累。可利用cey17_rs14810基因及其变体(如cey17_rs14810
gg1189-1190ta
基因)来构建生产l-缬氨酸的基因工程菌种,以促进l-缬氨酸产量提高,培育符合工业化生产的高产、高质量菌种,对l-缬氨酸的工业化生产具有广泛的应用价值和重要的经济意义。
74.保藏说明
75.菌种名称:谷氨酸棒杆菌
76.拉丁名:corynebacterium glutamicum
77.分类命名:谷氨酸棒杆菌(corynebacterium glutamicum)
78.菌株编号:ypfv1
79.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
80.保藏机构简称:cgmcc
81.地址:北京市朝阳区北辰西路1号院3号
82.保藏日期:2020年11月30日
83.保藏中心登记入册编号:cgmcc no.21260
具体实施方式
84.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
85.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
86.下述实施例中的谷氨酸棒杆菌(corynebacterium glutamicum)ypfv1 cgmcc no.21260是将谷氨酸棒杆菌atcc15168进行诱变获得,并已于2020年11月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏登记号为cgmcc no.21260。谷氨酸棒杆菌(corynebacterium glutamicum)ypfv1,又称为谷氨酸棒杆菌cgmcc no.21260。
87.实施例1构建包含突变的cey17_rs14810基因编码区片段的重组载体
88.依据ncbi公布的谷氨酸棒杆菌(corynebacterium glutamicum)atcc14067基因组序列,设计并合成两对扩增cey17_rs14810基因编码区的引物,以等位基因置换的方式在谷氨酸棒杆菌(corynebacterium glutamicum)cgmcc no.21260(经测序确认该菌株染色体上保留有野生型的cey17_rs14810基因)的cey17_rs14810基因编码区(seq id no.1)中引入突变,所述突变为将cey17_rs14810基因的核苷酸序列(seq id no.1)中的第1189-1190位鸟嘌呤鸟嘌呤(gg)突变为胸腺嘧啶腺嘌呤(ta),得到seq id no.3所示的dna分子(突变的cey17_rs14810基因,名称为cey17_rs14810
gg1189-1190ta
)。
89.其中,seq id no.1所示的dna分子编码氨基酸序列为seq id no.2的蛋白质(所述蛋白质名称为蛋白质cey17_rs14810)。
90.seq id no.3所示的dna分子编码氨基酸序列为seq id no.4的突变蛋白质(所述突变蛋白质名称为cey17_rs14810
g397y
)。所述突变蛋白质cey17_rs14810
g397y
氨基酸序列
(seq id no.4)中的第397位酪氨酸(y)由甘氨酸(g)突变而来。
91.采用nebuilder重组技术进行载体构建,对cey17_rs14810基因进行定点突变,引物设计如下(上海invitrogen公司合成),加粗字体的碱基为突变位置:
92.p1:5'-cagtgccaagcttgcatgcctgcaggtcgactctagcggtgccatcaccttcgccc-3',
93.p2:
94.p3:
95.p4:5'-cagctatgaccatgattacgaattcgagctcggtacccgcgagctgaatctcggcgag-3'。
96.构建方法如下:以谷氨酸棒杆菌atcc14067为模板,分别以引物p1和p2,p3和p4,进行pcr扩增,获得两条分别带有突变碱基,大小分别为646bp和692bp的cey17_rs14810基因编码区的dna片段(cey17_rs14810 up和cey17_rs14810 down)。
97.pcr扩增体系为:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg
2
(25mm)4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl;
98.pcr扩增反应程序为:94℃预变性5min,(94℃变性30s;52℃退火30s;72℃延伸40s;30个循环),72℃过度延伸10min。
99.将上述两条dna片段(cey17_rs14810 up和cey17_rs14810 down)经琼脂糖凝胶电泳分离纯化后,与经过酶切(xbal i/bamh i)后纯化的pk18mobsacb质粒(购自add gene公司,质粒上含有卡那霉素抗性标记)用nebuilder酶(nebuilder hifi dna a ssembly master mix,购自neb公司)进行dna组装反应,反应条件为:50℃连接30min,连接产物转化dh5α(购自takara公司)后长出的单克隆经引物m13(m13f:5
’‑
tgtaaaacgacggccagt-3’,m13r:5
’‑
caggaaacagctatgacc-3’)进行鉴定获得阳性重组载体pk18-cey17_rs14810
gg1189-1190ta
。将酶切正确的重组载体pk18-cey17_rs14810
gg1189-1190ta
送测序公司测序鉴定,并将含有正确突变(gg-ta)的重组载体pk18-cey17_rs14810
gg1189-1190ta
保存备用。
100.经测序鉴定,重组载体pk18-cey17_rs14810
gg1189-1190ta
中含有整合dna片段cey17_rs14810 up和cey17_rs14810 down的dna片段,命名为cey17_rs14810 up-down,cey17_rs14810 up-down dna片段大小为1304bp,序列如seq id no.5所示,其含有突变位点(gg-ta),用于在菌株谷氨酸棒杆菌cgmcc no.21260中的cey17_rs14810基因编码区(seq id no.1)引入核酸改造,所述核酸改造具体为将seq id no.1的第1189位鸟嘌呤(g)突变为胸腺嘧啶(t)、第1190位鸟嘌呤(g)突变为腺嘌呤(a),即将seq id no.1的第1189-1190位的核苷酸gg突变为ta,最终导致编码蛋白的第397位甘氨酸(g)突变为酪氨酸(y)。
101.所述重组载体pk18-cey17_rs14810
gg1189-1190ta
是将pk18mobsacb质粒的xbal i和bamh i识别位点间的片段(小片段)替换为序列表中seq id no.5的第37-1266位所示的dna片段,保持pk18mobsacb载体的其他序列不变,得到的重组载体。
102.所述重组载体pk18-cey17_rs14810
gg1189-1190ta
含有seq id no.3所示的突变基因cey17_rs14810
gg1189-1190ta
的第597-1269位所示的dna分子。
103.实施例2构建包含基因cey17_rs14810
gg1189-1190ta
的工程菌株
104.构建方法如下:将实施例1中的等位替换质粒(pk18-cey17_rs14810
gg1189-1190ta
)通过电击转化入谷氨酸棒杆菌(corynebacterium glutamicum)cgmcc no.21260中后,在培养基中进行培养,培养基成分和培养条件参见表1,对培养产生的单菌落分别通过实施例1中的引物p1和通用引物m13r(5
’‑
caggaaacagctatgacc-3’)进行鉴定,能扩增出1311bp(序列
如seq id no.6所示)大小条带的菌株为阳性菌株。将阳性菌株在含15%蔗糖的培养基上培养,对培养产生的单菌落分别在含有卡那霉素和不含卡那霉素的培养基上培养,选择在不含卡那霉素的培养基上生长,而在含卡那霉素的培养基上不生长的菌株进一步采用如下引物(上海invitrogen公司合成)进行pcr鉴定:
105.p5:5'-cgacggtgtcatcaccgctg-3',
106.p6:5'-cagaatcgcctctgagggat-3'。
107.将得到的pcr扩增产物(270bp)通过95℃高温变性10min、冰浴5min后进行sscp(single-strand conformation polymorphis)电泳(以质粒pk18-cey17_rs14810
gg1189-1190ta
扩增片段为阳性对照,谷氨酸棒杆菌atcc14067扩增片段为阴性对照,水作为空白对照),sscp电泳的page的制备及电泳条件参见表2,由于片段结构不同,电泳位置不同,因此片段电泳位置与阴性对照片段位置不一致且与阳性对照片段位置一致的菌株为等位替换成功的菌株。再次通过引物p5/p6 pcr扩增阳性菌株cey17_rs14810基因片段,并连接到pmd19-t载体进行测序,通过序列比对,碱基序列发生突变(gg-ta)的菌株为等位替换成功的阳性菌株,并被命名为ypv-091。
108.重组菌ypv-091是将所述重组载体pk18-cey17_rs14810
gg1189-1190ta
转化入谷氨酸棒杆菌(corynebacterium glutamicum)cgmcc no.21260中得到的重组菌,重组菌ypv-091含有seq id no.3所示的突变的基因cey17_rs14810
gg1189-1190ta
。
109.表1培养基的组成和培养条件
[0110][0111]
表2 sscp电泳的page的制备及电泳条件
[0112][0113]
实施例3构建基因组上过表达cey17_rs14810基因和cey17_rs14810
gg1189-1190ta
基因的工程菌株
[0114]
采用nebuilder重组技术进行载体构建,依据ncbi公布的谷氨酸棒杆菌atcc14067基因组序列,设计并合成三对扩增上下游同源臂片段及cey17_rs14810或cey17_rs14810
gg1189-1190ta
基因编码区及启动子区的引物,以同源重组的方式在谷氨酸棒杆菌cgmcc no.21260中引入cey17_rs14810或cey17_rs14810
gg1189-1190ta
基因。
[0115]
引物设计如下(上海invitrogen公司合成):
[0116]
p7:5'-cagtgccaagcttgcatgcctgcaggtcgactctaggtagtgccgtgcgtacccca-3',
[0117]
p8:5'-aaaaatgtgcagaatcgcttcccaaccccaatcgcaatgt-3',
[0118]
p9:5'-acattgcgattggggttgggaagcgattctgcacattttt-3',
[0119]
p10:5'-gtgcgggttggggtttttgattagtttgatggagcgccag-3',
[0120]
p11:5'-ctggcgctccatcaaactaatcaaaaaccccaacccgcac-3',
[0121]
p12:5'-cagctatgaccatgattacgaattcgagctcggtacccgttggtttagcggagctgca-3'。
[0122]
构建方法如下:分别以谷氨酸棒杆菌atcc14067或ypv-091为模板,分别以引物p7/p8,p9/p10,p11/p12进行pcr扩增,获得上游同源臂片段795bp(对应于谷氨酸棒杆菌cgmcc no.21260 cey17_rs02570基因及其cey17_rs02575的间隔区,序列如seq id no.7所示),cey17_rs14810基因及其启动子片段1489bp(序列如seq id no.8所示)或cey17_rs14810
gg1189-1190ta
基因及其启动子片段1489bp(序列如seq id no.9所示)及下游同源臂片段769bp(对应于谷氨酸棒杆菌cgmcc no.21260 cey17_rs02575基因及其与cey17_rs02570的间隔区,序列如seq id no.10所示)。
[0123]
pcr反应结束后,对每个模板扩增得到的3个片段采用柱式dna凝胶回收试剂盒分别进行电泳回收。回收后的3个片段与经过xbal i/bamh i酶切后纯化的pk18mobsacb质粒(购自addgene公司,该质粒上含有卡那霉素抗性作为筛选标记)用nebuilder酶(nebuilder hifi dna assembly master mix,购自neb公司)进行dna组装反应,反应条件为:50℃连接30min,连接产物转化dh5α后长出的单克隆用m13引物(m13f:5’tgtaaaacgacggccagt 3’,m13r:5’caggaaacagctatgacc 3’)经pcr鉴定获得阳性整合质粒(重组载体),分别为pk18-cey17_rs14810oe、pk18-cey17_rs14810
gg1189-1190ta
oe,该阳性整合质粒上含有卡那霉素抗
性标记,可以通过卡那霉素筛选获得质粒整合到基因组上的重组子。
[0124]
重组载体pk18-cey17_rs14810oe用于将外源基因cey17_rs14810整合到宿主染色体中,在生产菌中过表达野生型cey17_rs14810基因。
[0125]
重组载体pk18-cey17_rs14810
gg1189-1190ta
oe用于将外源基因cey17_rs14810
gg1189-1190ta
整合到宿主染色体中,在生产菌中过表达突变型基因cey17_rs14810
gg1189-1190ta
。
[0126]
pcr反应体系为:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg
2
(25mm)4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl。
[0127]
pcr反应程序为:94℃预变性5min,94℃变性30s;52℃退火30s;72℃延伸60s(30个循环),72℃过度延伸10min。
[0128]
将测序正确的整合质粒(pk18-cey17_rs14810 oe、pk18-cey17_rs14810
gg1189-1190ta
oe)分别电转化入谷氨酸棒杆菌cgmcc no.21260,在培养基中进行培养,培养基成分和培养条件参见表1,对培养产生的单菌落通过p13/p14引物进行pcr鉴定,pcr扩增出含有大小2214bp(不含突变的序列如seq id no.11所示,含突变的序列第2157-2158位为ta,其余如seq id no.11)的片段的为阳性菌株,扩增不到片段的为原菌。将阳性菌株在含15%蔗糖的培养基上培养,对培养产生的单菌落进一步采用p15/p16引物进行pcr鉴定,扩增出大小为1571bp(不含突变的序列如seq id no.12所示,含突变的序列第693-694位为ta,其余如seq id no.12)的菌为cey17_rs14810或cey17_rs14810
gg1189-1190ta
基因整合到谷氨酸棒杆菌cgmcc no.21260基因组上同源臂cey17_02570和下同源臂cey17_02575的间隔区上的阳性菌株,分别命名为ypv-092(不含突变点)和ypv-093(含突变点)。
[0129]
重组菌ypv-092含有双拷贝的seq id no.1所示的cey17_rs14810基因;具体地,重组菌ypv-092是将谷氨酸棒杆菌cgmcc no.21260的基因组中上同源臂cey17_02570和下同源臂cey17_02575的间隔区替换为cey17_rs14810基因,保持谷氨酸棒杆菌cgmcc no.21260的基因组中的其它核苷酸不变得到的重组菌。含有双拷贝cey17_rs14810基因的重组菌可以显著和稳定地提高cey17_rs14810基因的表达量。重组菌ypv-092为在基因组上过表达野生型cey17_rs14810基因的工程菌,是将所述重组载体pk18-cey17_rs14810oe导入大肠杆菌dh5α得到的重组菌。
[0130]
重组菌ypv-093含有seq id no.3所示的突变的cey17_rs14810
gg1189-1190ta
基因;具体地,重组菌ypv-093是将谷氨酸棒杆菌cgmcc no.21260的基因组中上同源臂cey17_02570和下同源臂cey17_02575的间隔区替换为cey17_rs14810
gg1189-1190ta
基因,保持谷氨酸棒杆菌cgmcc no.21260的基因组中的其它核苷酸不变得到的重组菌。重组菌ypv-093为在基因组上过表达突变型cey17_rs14810
gg1189-1190ta
基因的工程菌,是将所述重组载体pk18-cey17_rs14810
gg1189-1190ta
oe导入大肠杆菌dh5α得到的重组菌。
[0131]
pcr鉴定引物如下所示:
[0132]
p13:5'-cggttagattttttggcccc-3'(对应上同源臂cey17_rs02570的外侧),
[0133]
p14:5'-gcatttcaccagtaggcatg-3'(对应cey17_rs14810编码区区),
[0134]
p15:5'-gccagtactacatcgcattc-3'(对应cey17_rs14810编码区),
[0135]
p16:5'-tctggactgggtgttgcgct-3'(对应下同源臂cey17_rs02575的外侧)。
[0136]
实施例4构建质粒上过表达cey17_rs14810基因或cey17_rs14810
gg1189-1190ta
基因的工程菌株
[0137]
采用nebuilder重组技术进行载体构建,依据ncbi公布的谷氨酸棒杆菌atcc14067基因组序列,设计并合成一对扩增cey17_rs14810和cey17_rs14810
gg1189-1190ta
基因编码区及启动子区的引物,引物设计如下(上海invitrogen公司合成):
[0138]
p17:5'-gcttgcatgcctgcaggtcgactctagaggatccccaagcgattctgcacattttt-3'(带下划线的核苷酸序列为pxmj19上的序列),
[0139]
p18:5'-atcaggctgaaaatcttctctcatccgccaaaacttagtttgatggagcgccag-3'(带下划线的核苷酸序列为pxmj19上的序列)。
[0140]
构建方法如下:分别以谷氨酸棒杆菌atcc14067和ypv-091为模板,以引物p17/p18进行pcr扩增,获得cey17_rs14810基因及其启动子片段(序列如seq id no.13所示)和cey17_rs14810
gg1189-1190ta
基因及其启动子片段1519bp(序列如seq id no.14所示),对扩增产物进行电泳并采用柱式dna凝胶回收试剂盒进行纯化回收,回收的dna片段与经ecor i/kpni酶切回收的穿梭质粒pxmj19(购自addgene公司,该质粒上含有氯霉素抗性作为筛选标记)用nebuilder酶(nebuilder hifi dna assembly master mix,购自neb公司)进行dna组装反应,反应条件为:50℃连接30min,连接产物转化dh5α后长出的单克隆用m13r(-48)(5'agcggataac aatttcacac agga3')/p18引物经pcr鉴定获得阳性过表达载体pxmj19-cey17_rs14810(含有cey17_rs14810基因)和pxmj19-cey17_rs14810
gg1189-1190ta
(含有cey17_rs14810
gg1189-1190ta
基因),将该质粒送测序。因质粒上含有氯霉素抗性标记,可以通过氯霉素来筛选质粒是否转化到菌株中。
[0141]
重组载体pxmj19-cey17_rs14810是将pxmj19载体的ecor i和kpni识别位点间的片段(小片段)替换为核苷酸序列是序列表中seq id no.13的dna片段,保持pxm j19载体的其他序列不变,得到的重组表达载体。重组载体pxmj19-cey17_rs14810用于将外源基因cey17_rs14810通过质粒在染色体外表达,进而在生产菌中过表达野生型cey17_rs14810基因。
[0142]
重组载体pxmj19-cey17_rs14810
gg1189-1190ta
是将pxmj19载体的ecor i和kpni识别位点间的片段(小片段)替换为核苷酸序列是序列表中seq id no.14的dna片段,保持pxmj19载体的其他序列不变,得到的重组表达载体。所述重组载体pxmj19-cey17_rs14810
gg1189-1190ta
用于将外源基因cey17_rs14810
gg1189-1190ta
通过质粒在染色体外表达,进而在生产菌中过表达突变型cey17_rs14810
gg1189-1190ta
基因。
[0143]
pcr反应体系为:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg
2
(25mm)4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl。
[0144]
pcr反应程序为:94℃预变性5min,94℃变性30s;52℃退火30s;72℃延伸60s(30个循环),72℃过度延伸10min。
[0145]
将测序正确的pxmj19-cey17_rs14810和pxmj19-cey17_rs14810
gg1189-1190ta
质粒分别电转化入谷氨酸棒杆菌cgmcc no.21260中,在培养基中进行培养,培养基成分和培养条件参见表1,对培养产生的单菌落通过引物m13r(-48)/p18进行pcr鉴定,pcr扩增出含有大小1558bp(不含突变的序列如seq id no.15所示,含突变的序列第1444-1445位为ta,其余如seq id no.15所示)片段的为阳性菌株,其被命名为ypv-094(不含突变点)和ypv-095(含突变点)。
[0146]
重组菌ypv-094含有seq id no.1所示的cey17_rs14810基因,重组菌ypv-094为在
质粒上过表达野生型cey17_rs14810基因的工程菌,即由质粒pxmj19-cey17_rs14810在染色体外进行过表达。
[0147]
重组菌ypv-095含有seq id no.3所示的突变的cey17_rs14810
gg1189-1190ta
基因,重组菌ypv-095为在质粒上过表达突变型cey17_rs14810
gg1189-1190ta
基因的工程菌,即由质粒pxmj19-cey17_rs14810
gg1189-1190ta
在染色体外进行过表达。
[0148]
实施例5构建基因组上缺失cey17_rs14810基因的工程菌株
[0149]
采用nebuilder重组技术进行载体构建,根据ncbi公布的谷氨酸棒杆菌atcc14067的基因组序列,合成两对扩增cey17_rs14810基因编码区两端片段的引物,作为上下游同源臂片段。引物设计如下(上海invitrogen公司合成):
[0150]
p19:5'-cagtgccaagcttgcatgcctgcaggtcgactctagtgccgagaaattttcattgg-3',
[0151]
p20:5'-gttcggcctcttaaatggcggagaactaatataaaagtaa-3',
[0152]
p21:5'-ttacttttatattagttctccgccatttaagaggccgaac-3',
[0153]
p22:5'-cagctatgaccatgattacgaattcgagctcggtaccccggcaaggctcacatccgtt-3'。
[0154]
构建方法如下:以谷氨酸棒杆菌atcc14067为模板,分别以引物p19/p20和p21/p22进行pcr扩增,获得cey17_rs14810的上游同源臂片段720bp及cey17_rs14810的下游同源臂片段695bp。
[0155]
对扩增的产物进行电泳并采用柱式dna凝胶回收试剂盒进行纯化,回收的dna片段与经过xbal i/bamh i酶切后纯化的pk18mobsacb质粒(购自addgene公司,该质粒上含有卡那霉素抗性作为筛选标记)用nebuilder酶(nebuilder hifi dna assembly master mix,购自neb公司)进行dna组装反应,反应条件为:50℃连接30min,连接产物转化dh5α后长出的单克隆用m13引物(m13f:5
’‑
tgtaaaacgacggccagt-3’,m13r:5
’‑
caggaaacagctatgacc-3’)经pcr鉴定获得阳性敲除载体pk18-δcey17_rs14810,此重组质粒pk18-δcey17_rs14810中包含名称为δcey17_rs14810的up-down dna 1375bp(序列如seq id no.16所示)。
[0156]
将该质粒送测序,将测序正确的敲除质粒pk18-δcey17_rs14810电转化入谷氨酸棒杆菌cgmcc no.21260,在培养基中进行培养,培养基成分和培养条件参见表1,对培养产生的单菌落通过如下引物(上海invitrogen公司合成)进行pcr鉴定:
[0157]
p23:5'-tgccgagaaattttcattgg-3'(对应于谷氨酸棒杆菌cgmcc no.21260cey17_rs11895基因内部),
[0158]
p24:5'-cggcaaggctcacatccgtt-3'(对应于谷氨酸棒杆菌cgmcc no.21260cey17_rs11905基因内部)。
[0159]
上述pcr同时扩增出大小1301bp及2570bp的条带的菌株为阳性菌株,只扩增出2570bp条带的菌株为原菌。阳性菌株在15%蔗糖培养基上筛选后分别在含有卡那霉素和不含卡那霉素的培养基上培养,选择在不含卡那霉素的培养基上生长,而在含卡那霉素的培养基上不生长的菌株进一步采用p23/p24引物进行pcr鉴定,扩增出大小为1301bp条带的菌株为cey17_rs14810基因编码区被敲除的阳性菌株cey17_rs14810。再次通过p23/p24引物pcr扩增阳性菌株cey17_rs14810片段,并连接到pmd19-t载体进行测序,将测序正确的菌株命名为ypv-096(谷氨酸棒杆菌cgmcc no.21260上的基因组上的cey17_rs14810基因被敲除)。
[0160]
实施例6l-缬氨酸发酵实验
[0161]
将上述实施例构建的菌株和原始菌株谷氨酸棒杆菌cgmcc no.21260在blbio-5gc-4-h型号的发酵罐(购自上海百仑生物科技有限公司)中以表3所示的培养基和表4所示的控制工艺进行发酵实验。每个菌株重复三次,结果如表5所示。
[0162]
结果如表5所示,在谷氨酸棒杆菌中对cey17_rs14810基因编码区进行定点突变(如突变为cey17_rs14810
gg1189-1190ta
)及过表达,有助于l-缬氨酸产量及转化率的提高,而对cey17_rs14810基因进行敲除或弱化,不利于l-缬氨酸的积累。
[0163]
表3发酵培养基配方(其余为水)
[0164]
成分配方硫酸铵14g/l磷酸二氢钾1g/l磷酸氢二钾1g/l硫酸镁0.5g/l酵母粉2g/l硫酸亚铁18mg/l硫酸锰4.2mg/l生物素0.02mg/l维生素b12mg/lantifoam(cb-442)消泡剂)0.5ml/l70%葡萄糖(底糖)40g/l
[0165]
表4发酵控制工艺
[0166][0167][0168]
表5 l-缬氨酸发酵实验结果
[0169]
菌株od
610
l-缬氨酸产量(g/l)谷氨酸棒杆菌cgmcc no.2126098.284.1ypv-091100.285.2ypv-092100.184.5ypv-09399.485.7ypv-094100.685.3
ypv-095101.386.1ypv-09697.783.1
[0170]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
