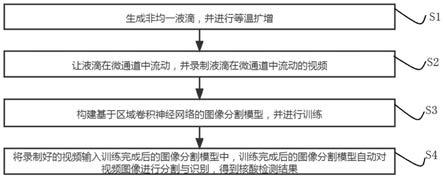
1.本发明属于医药技术领域,尤其是指一种含碳硼烷的苄胍类化合物及其 制备方法和用途。
背景技术:
2.硼中子俘获疗法(boron neutron capture therapy,bnct)是一种有前 景的靶向的化学放射疗法,先进硼药的研发一直是bnct技术的关键,bnct 技术的不断发展对硼药的研究提出以下要求:(1)生物毒性低;(2)肿瘤 靶向特异性高;(3)硼源的有效富集。硼酸及衍生物、闭式硼烷作为第一 代硼药,由于吸收效率低,亦或体内停留时间短,在bnct技术的发展过 程中很快被第二代硼药所取代。
3.目前,第二代硼药4-二羟基硼基苯丙氨酸(bpa)和巯基-闭合式-十二 硼烷二钠盐(bsh)已经进入bnct临床试验。bpa为苯丙氨酸的衍生物, 具有较高的肿瘤靶向性,然而,bpa含硼量低,治疗剂量大,对异质性强的 肿瘤适应性低、肿瘤内分布不均,生物半衰期短(见中国专利cn109988187a 和cn109942608a)。另一种硼药bsh则缺乏主动运输能力,同时bsh在 空气中存在被氧化的倾向,化学稳定性有限。
技术实现要素:
4.针对上述技术问题,本发明提供了一种含碳硼烷的苄胍类化合物及其制 备方法和用途。本发明所述苄胍类化合物可以提供较高含量的硼,且对肿瘤 细胞具有高亲和力,稳定性佳,生物毒性低等优点,因此在制备bnct治 疗药物中具有好的应用前景。
5.一种含碳硼烷的苄胍类化合物或其药学上可接受的盐,所述苄胍类化合 物结构式为:
[0006][0007]
其中,r1为碳硼烷,
[0008]
n1=1-5中任一整数。
[0009]
在本发明的一个实施例中,所述苄胍类化合物结构式如式(1)或式(2) 所示:
[0010][0011]
其中,r1为碳硼烷,
[0012]
n1=1-5中任一整数。
[0013]
在本发明的一个实施例中,所述碳硼烷选自含有8-11个硼原子的笼状 碳硼烷。
[0014]
在本发明的一个实施例中,所述笼状碳硼烷选自以下结构:
[0015][0016]
本发明还提供所述的含碳硼烷的苄胍类化合物或其药学上可接受的盐 的制备方法,包括以下步骤:将化合物与混合溶于有机 溶剂中,并在碱性试
剂、催化剂作用下进行反应得到加入 酸进行脱保护反应,得到所述含碳硼烷的苄胍类化合物或其药学上可接受的 盐;
[0017]
其中,r1为碳硼烷,
[0018]
r2为胺基的保护基;
[0019]
r3为cl、br、i、ots或oms;
[0020]
n1=1-5中任一整数。
[0021]
在本发明的一个实施例中,所述化合物与的摩尔比 为1:1-5。
[0022]
在本发明的一个实施例中,反应的温度为80-110℃。
[0023]
在本发明的一个实施例中,所述有机溶剂为dmf、dma、1,4二氧六环、 dmso、丙酮、乙腈、甲苯、乙醇、甲醇和四氢呋喃中的一种或多种。
[0024]
在本发明的一个实施例中,所述碱性试剂为碳酸钾、碳酸铯、碳酸钠、 叔丁醇钾、氢化钠、氢氧化钠和氢氧化钾中的一种或多种。
[0025]
在本发明的一个实施例中,所述催化剂为四丁基氟化铵、四丁基溴化铵、 四丁基碘化铵、碘化钠或碘化钾。
[0026]
在本发明的一个实施例中,所述胺基的保护基为烷氧羰基、酰基或烷基。
[0027]
一种药物组合物,包括所述的含碳硼烷的苄胍类化合物或其药学上可接 受的盐,以及药学上可接受的辅料。
[0028]
所述的含碳硼烷的苄胍类化合物或其药学上可接受的盐或所述药物组 合物在制备肿瘤药物中的应用。
[0029]
在本发明的一个实施例中,所述肿瘤包括神经系统的肿瘤。
[0030]
在本发明的一个实施例中,所述神经系统的肿瘤为髓母细胞瘤。
[0031]
所述的含碳硼烷的苄胍类化合物或其药学上可接受的盐或所述药物组 合物在制备心脏疾病或帕金森病的诊断或治疗药物中的应用。
[0032]
本发明的上述技术方案相比现有技术具有以下优点:
[0033]
本发明针对目前硼药含硼量低以及缺乏对于神经内分泌肿瘤的特异性, 利用神经内分泌肿瘤细胞高表达的肾上腺素受体作为转运靶点,与胍基类化 合物结合具有高特异性。结合对肿瘤具有高特异性的识别基团,从而得到相 关含硼量较高的含硼化合物,从而实现硼药在肿瘤部位的特异性高浓度富 集。
[0034]
本发明方法所使用的试剂廉价易得,操作简单,易于制备。且生物毒性 较低,相对
于传统的bnct药物,拓宽了肿瘤治疗的领域。在制备治疗神 经内分泌肿瘤药物领域中开辟了新的方法,在肿瘤直接治疗或者bnct治 疗方法中具有良好的应用前景。
具体实施方式
[0035]
下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可 以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0036]
实施例1
[0037]
(1)化合物s2的制备
[0038][0039]
将3.3 g钠加入20 ml无水乙醇中,再加入2 mmol盐酸胍,并加热回流 15分钟,待反应结束,降温冷却,反应液中氯化钠以晶体析出,过滤反应液 中氯化钠,并取滤液,随后将2毫摩尔的化合物s1(374mg,2mmol)的乙 醇溶液加入至滤液中,加热回流36小时。待反应结束,通过旋转蒸发除去溶 剂得到化合物s2,将化合物s2置于甲醇中进行结晶得到化合物s2,其质量 为142mg(0.86mmol),该反应的收率为43%。化合物s2核磁数据为:1h nmr (400mhz,d2o):δ9.31(s,h),8.56(s,2h),7.16(s,h),6.78(d,3h),5.35(s,1h), 3.92(s,2h),2.0(s,1h)。
[0040]
(2)化合物s3的制备
[0041][0042]
将4-二甲氨基吡啶(122mg,1mmol)添加到化合物s2(1.65g,10mmol) 的thf(25ml)溶液中,在5小时内缓慢加入二碳酸二叔丁酯(4.366g,20 mmol)的thf(25.0ml)溶液,并将该混合溶液在室温搅拌过夜,加入另一 份二碳酸二叔丁酯(1.834g,6.2mmol)的thf(10.0ml)溶液,混合搅拌 3h。待反应结束,将反应混合物进行真空浓缩得到无色固体,并将其与50.0ml 的1%乙酸水溶液混合搅拌30分钟,将所得反应液进行过滤,收集沉淀物并 用水洗涤,最后将沉淀物进行真空干燥得到无色固体化合物s3,其中化合物 s3的质量为4.58g,该反应的收率为81%。化合物s3的核磁数据为1h nmr (400mhz,cdcl3):δppm 7.16(s,1h),6.81(d,3h),5.15(d,2h),1.39(m,36h)。
[0043]
(3)化合物s4的制备
[0044][0045]
将化合物邻碳硼烷(292mg,2mmol)溶于6ml无水thf溶剂中,并 在0℃条件下往其中缓慢滴加0.213ml浓度为0.52mmol/ml的n-buli的thf 溶液中,室温下反应约1h,随后将反应置于冰浴条件下,再往其中缓慢加入 氧杂环丁烷(0.260ml,4mmol),室温反应3小时。用tlc原料对照检测, 待tlc检测显示原料消失后,加入10ml饱和nh4cl水溶液淬灭反应。再加 入60ml水和60ml乙酸乙酯混合溶剂萃取三次。收集有机相,使用60ml 饱和食盐水再萃取一次。收集有机相,减压蒸馏得到淡黄色的油状液体化合 物s4,化合物s4的质量为347.5mg,该反应的收率为85%。s4核磁数据1h nmr(400mhz,cdcl3):δppm 3.61(s,1h),3.39(t,2h),2.46-2.35(m,2h), 2.07(t,2h),2.69-1.84(m,11h)。
[0046]
(4)化合物s5的制备
[0047][0048]
将化合物s4(102.2mg,0.5mmol)溶于5ml无水dcm中,冰浴条件 下往其中加入pbr3(271mg,1mmol)。0℃反应1小时后,tlc监测显示原 料消失,将反应液减压蒸馏除去反应溶剂,并经过柱层析分离(pe:ea=10:1) 得到淡黄色油状液体化合物s5,化合物s5的质量为121mg,该反应的收率 为91%。化合物s5的核磁数据为1hnmr(400mhz,cdcl3):δppm 3.58(s,1h), 3.36(t,2h),2.43-2.32(m,2h),2.26-2.21(m,2h),2.06-1.81(m,10h)。
[0049]
(5)化合物s6的制备
[0050]
[0051]
将化合物s3(272mg,0.48mmol)以及化合物s5(190mg,0.72mmol) 溶于10ml dmf中,加入氢氧化钠(400mg,1.2mmol)以及四丁基碘化铵 (180mg,1.2mmol),在氮气保护下加热回流反应24小时,旋蒸去除反应 溶剂,之后使用50ml水以及50ml乙酸乙酯混合溶剂萃取三次,收集有机 相,并进行减压蒸馏得到粗品,将粗品用硅胶柱层析分离(石油醚:乙酸乙酯 =1:4)纯化得到白色固体化合物s6,化合物s6的质量为187mg(0.25mmol), 该反应的收率为52%。化合物s6的核磁数据为1h nmr(400mhz,cdcl3):δ ppm 7.32(d,2h),7.15(d,2h),6.78(d,2h),6.66(d,2h),5.45(s,1h),3.90(s, 2h),1.41(m,36h)。
[0052]
(6)化合物s7的制备
[0053][0054]
将化合物s6(187mg,0.25mmol)溶于6m hcl(7ml)中,并在密封 管中加热至100℃恒温保持8分钟,用二氯甲烷(2
×
15ml)对反应混合物进 行萃取并取有机相,通过减压蒸馏去除水分,最后得到剩余物质,将剩余物 质溶解在最少量的丙酮中,并加入甲基叔丁基醚进行沉淀,过滤取固体物质, 将固体物质真空干燥,即得到化合物s7,其质量为70mg(0.20mmol),该 反应的收率为80%。化合物s7的核磁数据为1h nmr(400mhz,cdcl3):δppm 8.21(d,2h),7.08(d,2h),6.87(d,2h),4.06(t,2h),3.76(s,2h),2.01(s,1h), 1.39(m,5h)。
[0055]
实施例2
[0056]
(1)化合物s9的制备
[0057][0058]
将1.65g钠加入10ml超干乙醇中,再加入1mmol盐酸胍,并回流15 分钟,待反应结束,降温冷却,反应液中氯化钠以晶体析出,过滤反应液中 氯化钠,并取滤液,将1毫摩尔的化合物s8(187mg,1mmol)无水乙醇溶 液加入到滤液中,并回流36小时。待反应结束,通过旋转蒸发除去溶剂得到 化合物s9,将化合物s9置于甲醇中进行结晶得到化合物s9,其质量为66mg (0.4mmol),该反应的收率为40%。化合物s9核磁数据为:1h nmr(400mhz, d2o):δ9.33(s,h),8.46(s,2h),7.26(s,h),6.75(d,3h),5.29(s,1h),3.90(s,2h), 2.32(s,1h)。
[0059]
(2)化合物s10的制备
[0060][0061]
将4-二甲氨基吡啶(244mg,2mmol)添加到化合物s9(3.3g,20mmol) 的thf(50ml)溶液中,在5小时内缓慢加入二碳酸二叔丁酯(8.732g,40 mmol)的thf(50ml)溶液,并将该混合溶液在室温搅拌过夜,加入另一 份二碳酸二叔丁酯(3.668g,12.4mmol)的thf(20.0ml)溶液,混合搅拌 3h。将反应混合物进行真空浓缩得到的无色固体,并将其与100ml的1%乙 酸水溶液混合搅拌30分钟,将所得反应液进行过滤,收集沉淀物并用水洗涤, 最后将沉淀物进行真空干燥得到无色固体化合物s10,其中化合物s10质量为 9.61g,该反应的收率为85%。化合物s10的核磁数据为1h nmr(400mhz, cdcl3):δppm 7.34(s,1h),6.85(d,3h),5.11(d,2h),1.31(m,36h)。
[0062]
(3)化合物s11的制备
[0063][0064]
将化合物邻碳硼烷(146mg,1mmol)溶于6ml无水thf中,于室温 条件下往其中缓慢滴入甲醛水溶液(98μl 1.2mmol含37%甲醛水溶液),在 室温条件下加入四丁基氟化铵(tbaf),用tlc检测反应情况,显色时用 高锰酸钾水溶液浸湿,之后显色观察,反应后加入10ml饱和nh4cl水溶液 淬灭反应。向反应混合液中加入30ml水和30ml乙酸乙酯重复萃取三次, 收集有机相,再加入50ml饱和食盐水再萃取一次,取有机相,将所得有机 相进行减压蒸馏得到目标产物化合物s11,其质量为134mg,该反应的收率 为76%。化合物s11的核磁数据1h nmr(400mhz,cdcl3):δppm 4.02 (s,2h),3.87(s,1h),3.01(s,1h),2.79-1.65(m,10h)。
[0065]
(4)化合物s12的制备
[0066][0067]
取176.2mg化合物s11,溶于10ml无水dcm中,冰浴条件下往其中 加入pbr3(542mg,2mmol)。0℃反应1小时后,tlc监测显示原料消失。 将反应液减压蒸馏经过柱层析分离(pe:ea=10:1)得到淡黄色油状液体化合 物s12,化合物s12的质量为216.6mg,该反应的收率为91%。化合物s12 的核磁数据为1h nmr(400mhz,cdcl3):δppm 3.96(s,1h),3.36(t,2h), 2.40-2.35(m,2h),2.31-2.23(m,2h),2.16-1.80(m,10h)。
[0068]
(5)化合物s13的制备
[0069][0070]
将化合物s10(544mg,0.96mmol)以及化合物s12(343mg,1.44mmol) 溶于20ml dmf中,加入氢氧化钠(800mg,2.4mmol),在氮气保护下回 流反应24小时,反应结束后利用旋转蒸发仪除去反应溶剂,并用80ml水以 及80ml乙酸乙酯萃取三次,收集有机相,减压蒸馏得到粗品。将粗品用硅 胶柱层析分离纯化得到白色固体化合物s13,化合物s13的质量为362mg(0.5 mmol),该反应的收率为51.7%。化合物s13的核磁数据为1h nmr(400mhz, cdcl3):δppm 7.51(d,2h),7.25(d,2h),6.68(d,2h),5.34(s,2h),1.46(m,36h)。
[0071]
(6)化合物s14的制备
[0072][0073]
将化合物s13(362mg,0.5mmol)溶于6m hcl(10ml)中,并在密 封管中加热至100℃恒温8分钟,用二氯甲烷(3
×
20ml)重复洗涤反应混合 物取有机相,将有机相在减压下去除水分得到粗产品,将所得粗产品溶解在 0.5ml的丙酮中,用甲基叔丁基醚沉淀,过滤取沉淀并将沉淀进行真空干燥, 得到化合物s14,化合物s14的质量为130mg(0.4mmol),该反应的收率 为80%。化合物s14的核磁数据为1h nmr(400mhz,cdcl3):δppm 8.25(d, 2h),7.01(d,2h),3.86(s,2h),2.11(s,1h),1.21(m,5h)。
[0074]
测试例
[0075]
实施例1中所得化合物s7的体外试验
[0076]
使用不同来源的细胞株,分别为来源于人的神经母细胞瘤细胞株 sk-n-sh、sk-n-be(2)、kelly以及来源于大鼠的嗜铬细胞瘤细胞株pc-12。 将细胞平铺在组织培养皿上,并且在恒温37℃、5%co2且具有平衡湿润空气 的温育器中进行培养。
[0077]
1、不同细胞对化合物s7的摄取情况
[0078]
将sk-n-sh细胞以75%的细胞密度平铺在培养皿上,并且与溶于dmem 培养基的1,4-二羟基硼苯丙氨酸(bpa对照组,设置两个平行实验)或化合 物s7(化合物s7试验组,设置两个平行实验)温育6小时,且两种含硼化合 物加入量均以相对于硼含量(5
×
10-4
mol/l硼)的等摩尔浓度加入。除去培养 皿中含硼的组织培养基并加入冷磷酸缓冲盐溶剂(pbs溶剂)来结束温育。 使用橡胶淀帚从培养皿上铲下来而收获细胞,在冷的pbs中收集并且通过离 心形成沉淀,所得沉淀即为待用细胞样品。
[0079]
利用bradford标准程序对以上细胞样品进行总蛋白分析。通过直流原生 质原子发射光谱(dcp-aes)对细胞样品进行硼分析,具体步骤为:在60℃下 用硫酸/硝酸(体积比为1/1)对细胞样品(50-130mg)进行硝化,并加入tritonx-100和水,从而得到50mg组织/ml、15%总酸v/v和5%tritonx-100v/v的 浓度,其中,组织为硝化后的细胞样品,硼浓度是基于己知对照样品的。实 验结果见下表1,由表1可以看出,化合物s7对硼的摄取量高于bpa对硼的 摄取量。
[0080]
bpa对照组和化合物s7试验组中的不同的硼化合物来说,硼含量表示为 sk-n-sh细胞中总细胞蛋白的函数(μg硼/g细胞蛋白)(在平行实验1和平 行实验2中培养基中硼含量分别为7.1和7.8μg硼/ml)。
[0081]
表1不同的硼化合物的细胞摄取
[0082][0083]
.2、不同肿瘤细胞对化合物s7的摄取情况
[0084]
将来源于人的神经母细胞瘤细胞株sk-n-sh、sk-n-be(2)、kelly以及 来源于大鼠的嗜铬细胞瘤细胞株pc-12以低细胞密度(细胞密度为40-50%) 和高细胞密度(细胞密度为90-100%)平铺在培养皿上,并且如上述用溶于 组织培养基的化合物s7温育6小时。通过除去含硼培养基以及为了从细胞上 洗去过量的培养基而加入冷的pbs缓冲液来结束温育。通过使用橡胶淀帚从 培养皿上铲下来而收获细胞,在冷的pbs中收集并且通过离心形成沉淀。利 用bradford标准程序对细胞样品进行总蛋白分析,结果见下表2。由表2数据 可知,对于以低密度和高细胞密度测试的所有三种来源于人的神经母细胞瘤 细胞株sk-n-sh、sk-n-be(2)、kelly以及来源于大鼠的嗜铬细胞瘤细胞株 pc-12,s7是一种高效的硼载体。其中,细胞摄取的硼含量表示为总细胞蛋白 的函数(μg硼/g细胞蛋白)。
[0085]
表2化合物s7的细胞摄取
[0086][0087]
3,化合物s7的细胞内保留情况
[0088]
将sk-n-sh细胞以75%的细胞密度平铺在培养皿上,并且与dmem培 养基中的1,4-二羟基硼苯丙氨酸(bpa对照组)或化合物s7(化合物s7试 验组)温育18小时,且两种含硼化合物加入量均以相对于硼含量(5
×
10-4
mol/l 硼)的等摩尔浓度加入,每次以不含硼的组织培养基结束温育。细胞样品分 别在时间点0、2和7小时进行取样,其中0时间点代表刚好用硼化合物温育 18小时。
[0089]
细胞用冷的pbs洗涤,并通过使用橡胶淀帚从培养皿上铲下来而将其收 获,它们在冷的pbs中收集而且通过离心形成沉淀。同上述操作对细胞沉淀 进行总蛋白和硼含量的分析。结果见下表3,随着细胞内的摄取,在组织培养 基中的化合物s7完全耗尽;7h时,保留在肿瘤细胞中的化合物s7为总摄取 的47%。
[0090]
表3清除含硼培养基之后细胞中的硼含量(μg硼/g细胞沉淀)
[0091][0092]
综上所述,化合物s7已经在体外试验中显示出预期的结果,其在肿瘤细 胞摄取、积累和保留方面都优于bpa。
[0093]
4,化合物s7的细胞毒性研究试验
[0094]
将含肽牛血清的细胞培养液置37℃培养24h。将传代培养的人正常肝细 胞l-929细胞,用组织培养基制成1
×
105个/ml的细胞悬液,将该细胞悬液 接种于96孔细胞培养板(100μg/孔),置37℃二氧化碳培养箱中培养24h。 等细胞贴壁生长后,去除上清液,加入对照组(不含化合物s7)和试验组(含 化合物s7)的组织培养基进行孵育培养,其中细胞培养液中化合物7的浓度 为5mmol/l,置37℃二氧化碳培养箱中继续培养。分别孵育2天、7天后取 出,加入mtt液继续培养4h。去除细胞孵育液,随后加入dmso,震荡10 min,最后用酶联免疫检测仪在波长为630nm下测定其吸光度值,并根据其 吸光度按公式计算细胞的相对增殖度(rgr),结果见下表4。
[0095]
表4mtt比色法测得的细胞相对增殖度
[0096]
序号时间(天)rgr(%)1210527100
[0097]
注:细胞的相对增殖度的计算公式为:
[0098][0099]
根据细胞相对增殖度来评定细胞的毒性反应,实验结果见下表5。
[0100]
表5细胞毒性反应评定标准
[0101]
反应相对增殖度rgr(%)0级≧100175~99250~74325~4941~2450
[0102]
结论:由表4和表5中可知,rgr的数值为105%和100%均大于或等于 100,同时结合表5数据可知,化合物s7并没有出现任何的毒性现象。
[0103]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的 限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出 其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而 由此所引申出的显而易见的变化或
变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。