1.本发明属于大肠菌群的检测领域,尤其涉及食品中(水、果汁和牛奶等) 大肠菌群的检测领域。
背景技术:
2.大肠菌群归类在不同的属中,其主要是根据细菌发酵乳糖的能力。然而,大肠菌群通常被描述为革兰氏阴性、杆状肠杆菌科,可发酵乳糖产生酸和气体。大肠菌群主要存在于人畜的粪便,可作为粪便污染指标来评价食品的卫生状况,以推断食品中肠道致病菌污染的可能性。大肠菌群一般认为是无害的,但是一些典型的大肠菌菌株如大肠杆菌o157:h7、肺炎克雷伯氏菌和弗氏柠檬酸杆菌对人类具有致病性。公共卫生场所的传染病传播风险引起了人们的广泛关注,其中包含了大肠菌群以及大肠菌群与其它细菌病毒交叉感染的风险。因此,检测大肠菌群对于食品卫生安全以及公共卫生安全的重要性不言而喻。
3.mpn法(最可能数法)和平板计数法被认为是“金标准”,因为它通过在标准条件下培养得到结果。然而,它不可避免地需要专业技术人员使用微生物细胞培养的特定设施,需经过数天的富集、涂板、分离和鉴定过程,且对存活但不可培养(vbnc)的细菌、细胞束手无策。
4.拥有编码β-半乳糖苷酶的lacz基因是大肠菌群最突出的特征。当前,大肠菌群的检测主要通过对其lacz基因的aacz序列或者其基因产物β-半乳糖苷酶的检测。例如,有利用qpcr方法测定大肠菌群的lac基因,不需要富集步骤, 灵敏度可达112cfu/ml;也有利用对其基因产物β-半乳糖苷酶进行电化学方法检测,6-氯-3-吲哚基-β-d-吡喃半乳糖苷(6-cigp)作为β-半乳糖苷酶反应底物,3h内可以达到1.6log10 cfu/ml至6.6log10 cfu/ml的检测限度。也有利用大肠菌群的产气特征进行检测,但在肠杆菌科中,代谢乳糖产生气体这一生化反应依赖于甲酸水解酶且容易被抑制。因此,通过产气检测大肠菌群缺乏意义。其他方法,比如试剂盒法,膜过滤法,免疫学方法,物理化学方法(电阻抗法) 以及atp生物发光方法等。然而,这些方法都需要精密的仪器以及复杂的操作步骤和数据处理方法,须具备专业知识人员实施。因此现场检测实用性不高,难以在实际检测中快速广泛应用。
5.比色技术由于其易于操作,不需要多而精密的仪器和专业的知识而受到越来越多的关注。已经报道了一些用于大肠菌群相关检测的酶促测定比色方法。例如,携带lacz操纵子的t7噬菌体被用于感染大肠杆菌,利用lacz编码的β-半乳糖苷酶的过度表达来催化比色反应。取决于大肠杆菌葡萄糖氧化酶介导的比色方法也被报道。虽然这些酶促方法操作简单,但利用噬菌体等特异性的生物识别方法通常难以应用于具有广谱性的大肠菌群检测当中。这种检测体系中通过添加酶参与比色反应,会受到各类因素干扰,比如ph、温度以及其余化合物的干扰。这使得该类检测方法,存在着较大的不稳定性,且检测限高,无法较精确测量低浓度的菌落。此外,由于食品基质的成分复杂,在食品基质中检测细菌数量,难以达到理想效果,所以此类报道中很多没有涉及食品样品中菌落的检测分析,在多场景检测应用上存在较大的限制。
技术实现要素:
6.本发明的目的是提供一种检测大肠菌群的方法。本发明所述方法应用了一种异丙基-β-d-硫代半乳糖苷(iptg)、酵母浸粉(yet)和溴-4-氯-3-吲哚-β-d
‑ꢀ
吡喃半乳糖苷(x-gal)混合检测体系(iptg-yet-x-gal)。该检测体系首先诱导大肠菌群乳糖操纵子lac基因的表达,使β-半乳糖苷酶表达并参与代谢,使 x-gal生成蓝色化合物,通过测量吸光度(od
655
)并结合本方法的标准曲线,计算出待测样品中的大肠菌群数量。本发明所述方法,使用的试剂、仪器少,操作简便;检测体系受外部环境的影响小,稳定性好,可适应各种检测环境;在现场环境下即可加样操作,无需特定的实验室条件。该方法对食品中大肠菌群的检测有着广泛的应用前景。
7.本发明目的通过以下技术方案实现:
8.一种检测大肠菌群的方法,检测溶液体系中包括以下组分:检测溶液体系包括以下组分:磷酸盐缓冲液、0.01~0.5g/l酵母浸粉、0.01~2g/l 5-溴-4-氯-3
‑ꢀ
吲哚-β-d-吡喃半乳糖苷及0.024~2.4g/l异丙基-β-d-硫代半乳糖苷。
9.优选地,所述的酵母浸粉的浓度为0.05~0.2g/l;所述的5-溴-4-氯-3-吲哚
‑ꢀ
β-d-吡喃半乳糖苷的浓度为0.1~0.3g/l;所述的异丙基-β-d-硫代半乳糖苷的浓度为0.024~0.36g/l。
10.一种检测大肠菌群的方法,包括以下步骤:
11.(1)将异丙基-β-d-硫代半乳糖苷、5-溴-4-氯-3-吲哚-β-d-吡喃半乳糖苷、酵母浸粉及磷酸盐缓冲液混合均匀,配制得到检测溶液体系;
12.(2)将待测样品和步骤(1)中检测溶液体系混匀,恒温培养1-12h,测量 655nm处的吸光度;
13.(3)根据测得的吸光度结合标准曲线,得出样品中大肠菌群数目。
14.优选地,所述的恒温为37℃,培养4-9h。
15.优选地,所述yet浓度为0.1g/l。
16.优选地,所述为x-gal浓度0.2g/l。
17.优选地,所述iptg浓度为0.024g/l。
18.优选地,所述培养温度为37℃,培养时间为9h。
19.检测溶液体系的检测范围为103~107cfu/ml。
20.所述的标准曲线的绘制包括如下步骤:
21.(1)将异丙基-β-d-硫代半乳糖苷、5-溴-4-氯-3-吲哚-β-d-吡喃半乳糖苷、酵母浸粉及磷酸盐缓冲液混合均匀,配制得到检测溶液体系;
22.(2)配制5组大肠菌群标准溶液,其中每组标准溶液的大肠菌群浓度分别为107、106、105、104、103cfu/ml;
23.(3)将标准溶液和检测溶液体系混匀,37℃下培养9h,测量655nm处的吸光度;
24.(4)根据测得的吸光度绘制标准曲线。
25.优选地,大肠菌群为大肠埃希氏菌、阴沟肠杆菌、产气肠杆菌、肺炎克雷伯氏菌中的任一种或两种以上。
26.所述的方法在检测食品中的大肠菌群的应用,特别是在水、牛奶或果汁食品中的应用。
27.与现有的大肠菌群检测技术相比,本发明具有以下优点和有益效果:
28.(1)本发明检测溶液体系的检测下限低,可达103cfu/ml,比现有技术中的比色法的检测下限104cfu/ml或105cfu/ml低1-2个数量级,适合低含量菌群待测样品。
29.(2)使用的试剂仪器种类少,操作简便,普通人群均可操作。
30.(3)试剂价格低,显色效果明显,费效比低。
31.(4)利用大肠菌群体内的酶参与代谢,受到外部环境影响小,稳定性好。
32.(5)对于待测样品在现场环境下即可加样操作,可适应各种检测环境,无需特定的实验室条件。
附图说明
33.图1是实施例1中显色产物溶液的全波长扫描的od曲线。
34.图2是实施例2中spss与pbs分别作为检测体系溶剂的比色效果。
35.图3是实施例3中对yet和胰蛋白胨浓度的优化结果。
36.图4是实施例3中对iptg浓度的优化结果。
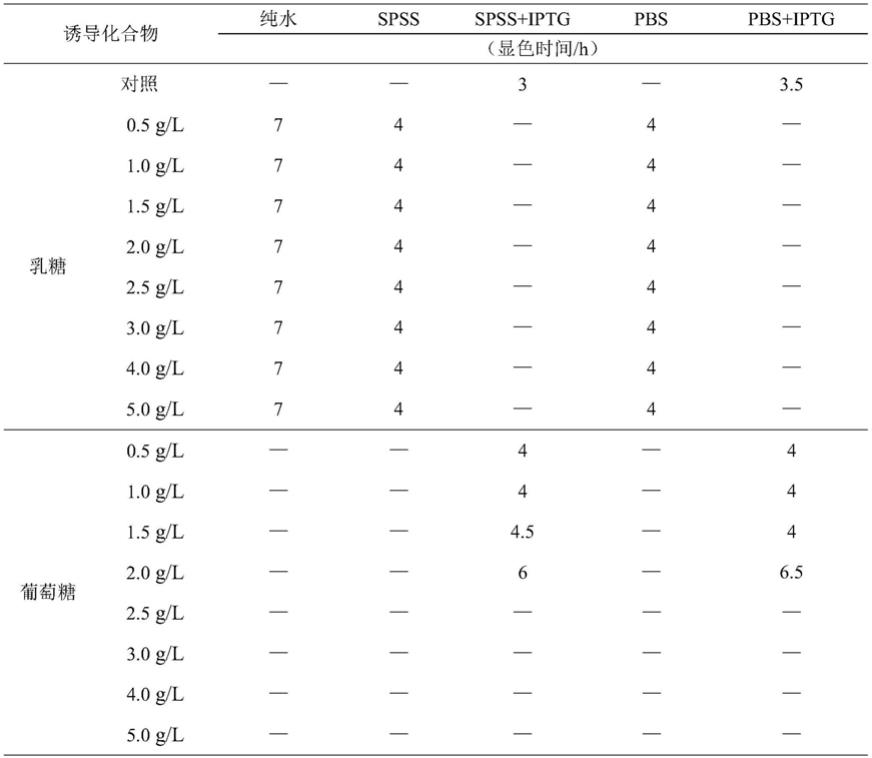
37.图5是实施例3中对x-gal浓度的优化结果。
38.图6是实施例4中不同种属的大肠菌群在该检测体系下的比色效果。
39.图7是实施例5中大肠菌群数量与od
655nm
的标准曲线。
具体实施方式
40.为了进一步描述本发明,下面结合实施例和附图对本发明作进一步详细说明。本发明中所使用的试剂和方法,如无特殊规定,均为本领域内常用试剂和常规方法。
41.一种检测大肠菌群的方法,包括以下工艺步骤:
42.(1)配制检测溶液体系(无菌):iptg与x-gal溶液,均通过0.22μm微孔滤膜;pbs、yet均通过高压蒸汽灭菌法灭菌;然后将各组分混合均匀;
43.(2)取100μl待测样品和9.9ml步骤(1)中的检测溶液体系,混匀,放入 37℃恒温摇床中培养,于1-12h取出,测量od
655nm
。
44.根据测得的吸光度,结合本方法的标准曲线,得出样品中大肠菌群数目。
45.下述实施例按具体情况可参照上述工艺步骤操作,本发明下述实施例所用菌株均来源于广东省微生物菌种保存中心,所有菌株均保存在含有80%的甘油中,冻存在-80℃冰箱中。
46.实施例1
47.筛选本发明中具有良好诱导大肠菌群β-半乳糖苷酶表达效果的化合物。选取如下化合物组合(乳糖、低浓度葡萄糖与iptg均可诱导):乳糖(0.5、1.0、1.5、2.0、2.5、3.0、4.0、5.0g/l)、葡萄糖(0.5、1.0、1.5、2.0、2.5、3.0、4.0、 5.0g/l)、乳糖和葡萄糖(各0.5、1.0、1.5、2.0、2.5、3.0、4.0、5.0g/l等量混合),配制溶剂分别为纯水、生理盐水(spss)、spss iptg、pbs以及pbs iptg 五组溶剂。五组溶剂与x-gal混合形成检测溶液体系,其添加的iptg的浓度均为0.024g/l,x-gal的浓度均为0.2g/l,然后加入菌液混匀(大肠杆菌atcc 25922),其中菌液浓度均为1.0
×
107cfu/ml,放入37℃恒温摇床中培养。测定不同诱导体系对大肠菌群的诱导效果。所有结果详见表1。
48.表1是不同诱导化合物对大肠菌群的诱导效果
[0049][0050]
(注:显色时间大于12h示为“—”)
[0051]
由于乳糖 葡萄糖组所有均不显色,因此在表格中不再重复表达。为了测定该显色体系对不同波长的吸收大小,对该显色产物溶液进行全波长扫描。结果见图1。图1表明,该显色溶液于655nm波长处有着最大吸收值。因此,选择 od
655nm
作为后续测量参数。
[0052]
表1表明,所选的化合物组合中,spss 乳糖、spss iptg、spss iptg 葡萄糖、pbs 乳糖、pbs iptg、pbs iptg 葡萄糖这6组在3到4h内可以达到od
655nm
为0.030的显色效果。考虑到所需添加的试剂种类、操作步骤,显色时间以及显色效果,优选spss iptg与pbs iptg检测体系。
[0053]
实施例2
[0054]
spss iptg与pbs iptg的筛选
[0055]
为了进一步验证spss iptg与pbs iptg检测体系的显色效果,在 spss iptg与pbs iptg检测体系中菌液浓度(大肠杆菌atcc 25922)均为 1
×
106cfu/ml,iptg浓度均为0.024g/l,x-gal浓度均为0.2g/l。反应适当的时间,记录od
655nm
,结果见图2。
[0056]
图2表明,相同条件下,在菌液浓度为1
×
106cfu/ml中,pbs iptg优于spss iptg,显色效果更好。因此,选择pbs iptg检测体系。
[0057]
实施例3
[0058]
pbs iptg检测体系的优化
[0059]
进一步实验发现,在24h培养时间内,实施例1和2中的pbs iptg(不含yet)的检测体系最高只能使菌液浓度为1.0
×
104cfu/ml的检测体系显色(od
655nm
=0.030),其中检测体系中iptg浓度均为0.024g/l,x-gal浓度均为0.2g/l。通过平板计数法检测24h后的菌液浓度,发现检测体系中的菌液在培养24h后,菌落数目明显减少,说明细菌在诱导显色过程中死亡,推测可能是检测体系中存在抑菌物质或者缺乏营养物质,使细菌无法在检测体系中长时间保持活力,最终部分细菌死亡,导致无法正常显色。因此,需加入物质来维持菌液在诱导反应过程中的活力。
[0060]
(1)yet和胰蛋白胨的筛选
[0061]
通过进一步实验发现,在检测体系中加入yet和胰蛋白胨(caseintryptone),验证yet和caseintryptone对大肠菌群的显色效果,分别配制0.01、0.05、0.1、0.2、0.5、1.0g/l的yet和caseintryptone溶液,其中检测体系含iptg浓度均为0.024g/l,x-gal浓度均为0.2g/l,菌液浓度均为1
×
107cfu/ml(大肠杆菌atcc25922)。反应4h,记录od
655nm
。实验每组设置3个平行,结果详见图3
[0062]
图3表明,在0.01~0.5g/l,随着yet与caseintryptone浓度的升高,显色效果均逐渐提升。在yet与caseintryptone浓度均为0.1g/l时,yet的效果更好些。但是溶液体系的yet和caseintryptone浓度过高会导致杂菌污染,如培养基为了增菌而选择了较高浓度的yet和caseintryptone的lb培养基,其配方中yet浓度为5g/l,caseintryptone浓度为10g/l;或平板计数琼脂培养基(pca)中yet的浓度为2.5g/l,caseintryptone的浓度为5.0g/l,这些高浓度的培养基必须在无菌的超净台中进行加样接种操作才能避免杂菌污染。此外,yet和caseintryptone皆为偏弱黄色,添加的浓度高不利于检测溶液体系显色。因此本发明在检测体系中添加yet的浓度为0.01~0.5(优选0.1g/l),可降低杂菌污染的风险,检测时可直接取材现场检测,无需特殊的无菌超净台。
[0063]
(2)iptg浓度的优化
[0064]
为进一步验证不同iptg浓度对检测体系的影响,分别配制iptg溶液的浓度为0.024、0.12、0.24、1.20、2.40g/l,x-gal浓度均为0.2g/l,yet浓度均为0.1g/l,菌液浓度均为1
×
107cfu/ml。反应4h,记录od
655nm
。实验每组设置3个平行,结果详见图4。
[0065]
图4表明,在0.024~2.40g/l范围内,随着iptg浓度的升高,检测体系的od
655nm
越小,效果越差。因此,优选iptg浓度为0.024g/l。
[0066]
期刊报道的方法中表明iptg浓度高(大于0.24g/l)的条件下,可以对β-半乳糖苷酶有着更好的诱导表达效果(noh,etal.,2015,sensorsandactuatorsb:chemical,209,951-956.10.1016/j.snb.2014.12.073;rivas,etal.,2014,lettersinappliedmicrobiology,59(6),594-603.10.1111/lam.12314.)。本方法选择的iptg浓度优选的浓度为0.024g/l,远小于当前应用方法中的iptg浓度,具有预料不到的技术效果,也大大节约了检测的试剂成本。
[0067]
(3)x-gal浓度的优化
[0068]
为进一步验证不同浓度x-gal对检测体系的影响,配制0.1、0.2、0.5、1.0、2.0g/l的x-gal溶液,iptg浓度均为0.024g/l,yet浓度均为0.1g/l,菌液浓度均为1
×
107cfu/ml(大肠杆菌atcc25922)。反应4h,记录od
655nm
。实验每组设置3个平行,结果详见图5。
[0069]
图5表明,在0.01~0.2g/l范围内,随着x-gal浓度的升高,检测体系的od
655nm
越
大,效果越好。在0.2~1.0g/l范围内,随着x-gal浓度的升高,检测体系的od
655nm
越小,效果越差。因此,优选x-gal浓度为0.2g/l。
[0070]
实施例4
[0071]
不同种属的大肠菌群在该检测体系下的比色效果
[0072]
配制大肠菌群检测溶液,pbs溶液中包括有以下含量的组分:yet浓度为 0.1g/l、x-gal浓度0.2g/l,iptg浓度为0.024g/l(均灭菌)。以下大肠菌群浓度均为1
×
107cfu/ml:大肠埃希氏菌e.coli 1(gdmcc 1.252)、大肠埃希氏菌e.coli 2(gdmcc 1.137)、大肠埃希氏菌e.coli 3(gdmcc 1.180)、大肠埃希氏菌e.coli 4(atcc25922)、阴沟肠杆菌1.2022(e.cloacae,gdmcc 1.545)、产气肠杆菌1.2021(e.aerogenes,gdmcc 1.549)、肺炎克雷伯氏菌 (k.pneumoniae,gdmcc 1.548)及上述菌群的混合体系(mixture)。其中的菌群的混合体系,包括上述7种菌,每种约为14
×
106cfu/ml,总的菌群浓度为1
×
107cfu/ml,具体方法为将原始七种菌种(均为1
×
109cfu/ml)等量混合,最后稀释到1
×
107cfu/ml。将上述大肠菌群分别置于该检测体系中反应4 h,测量od
655nm
。实验每组设置3个平行,结果见图6。
[0073]
图6表明,大肠埃希氏菌、阴沟肠杆菌、产气肠杆菌、肺炎克雷伯氏菌在该检测体系下,它们之间的β-半乳糖苷酶活性类似,显色效果类似,在该检测体系下可以进行不同种属大肠菌群的混合检测。
[0074]
实施例5
[0075]
在od
655nm
条件下检测溶液体系测量大肠菌群数量的标准曲线
[0076]
配制待测大肠菌群样品的浓度分别为1
×
107、1
×
106、1
×
105、1
×
104、1
×
10
3 cfu/ml,加入iptg-yet-x-gal检测体系:iptg 0.024g/l,yet 0.1g/l,x-gal 0.2g/l。放入37℃恒温摇床培养,9h测定od
655nm
。实验每组设置3个平行(n=3),结果见图7。待测大肠菌群样品参照实施例4配置菌群的混合体系的方法配置,包含的菌群与该混合体系的菌群种类一致。
[0077]
图7表明,在od
655nm
,大肠菌群浓度在1
×
103~1
×
107cfu/ml(r2=0.99922) 之间存在良好的线性关系。因此,本方法的检测范围为1
×
103~1
×
107cfu/ml。
[0078]
实施例6
[0079]
该方法在果汁、牛奶中的检测应用
[0080]
配制不同浓度的大肠菌群果汁、牛奶样品待测溶液,大肠菌群浓度分别为 1
×
105、1
×
104、1
×
103cfu/ml。取样品匀液100μl,加入检测溶液 (iptg-yet-x-gal)9.9ml,混匀,放入37℃恒温摇床中培养,于9h取出,测量od
655nm
。根据测得的吸光度值,结合本方法的标准曲线,得出样品中大肠菌群数目,计算大肠菌群的回收率。结果见表2与表3。不同浓度的大肠菌群果汁、牛奶样品待测溶液参照实施例4配置菌群的混合体系的方法配置,包含的菌群与该混合体系的菌群种类一致。
[0081]
表2果汁中加标大肠菌群的回收率测试(n=3)
[0082][0083]
表3牛奶中加标大肠菌群的回收率测试(n=3)
[0084][0085]
由表2可知,在果汁中,大肠菌群的回收率为94%~113%,rsd值均低于 8.2%。由表3可知,在牛奶中,大肠菌群的回收率为95%~108%,rsd值均低于7.4%。表明所提出的基于iptg-yet-x-gal比色方法,可以应用在食品样品中进行大肠菌群检测分析,且能够检测的浓度低(达103cfu/ml)准确度高。
[0086]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。