制备猪源干扰素
δ
5的方法和猪源干扰素
δ
5的应用
技术领域
1.本发明属于基因工程产品制备领域,具体涉及一种制备猪源干扰素-δ5(pifn-δ5)的方法以及猪源干扰素δ5的应用。
背景技术:
2.猪病毒性腹泻是严重危害养猪业的重要疫病,对初生仔猪的影响尤为严重,每年因腹泻造成的损失可达100亿元。造成猪病毒性腹泻的病原种类繁多,临床中以猪流行性腹泻病毒(pedv)、猪传染性胃肠炎病毒(tgev)、猪丁型冠状病毒(pdcov)和猪轮状病毒(prov)为最重要病原,其中部分病原的感染可造成初生仔猪100%死亡。
3.干扰素(ifn)是抵御病毒感染的第一道防线,ifn在抗病毒感染中发挥着越来越重要的作用。在抗病毒免疫应答中,ifn的主要功能是诱导抗病毒蛋白的表达,然后进一步激活抗病毒和调节细胞的免疫应答。通常,以据细胞表面受体结构的不同,ifn分为三个亚型:i型、ii型和iii型。其中,i型ifn包括ifn-α、ifn-β、ifn-ε、ifn-ω、ifn-κ、ifn-δ、ifn-τ和ifn-ζ,在抗病毒免疫反应中起直接作用。
4.而作为i型ifn的成员之一,ifn-δ于1993年由lefevre和boulay首次发现,直到近年来cochet等通过基因组数据库筛选报道了数个ifn-δ不同亚型的相关序列,表明ifn-δ存在于众多偶蹄动物中,并在基因组中形成一个明显的簇。已有的研究表明猪源ifn-δ存在11个亚型,分别为ifn-δ1~ifn-δ11,多个猪inf-δ亚型相对高地表达于母猪妊娠阶段和仔猪的肠道,提示ifn-δ也许在仔猪初生阶段发挥着重要的抗感染作用。
5.目前并没有关于大量制备猪源ifn-δ5的技术研究,进而限制了猪源ifn-δ5在抑制猪病毒性腹泻病原菌方面的应用。
技术实现要素:
6.为此,本发明为克服现有技术的缺点和不足,本发明的首要目的在于提供一种制备猪源干扰素δ5(pifn-δ5)的方法。
7.所述制备猪源干扰素δ5(pifn-δ5)的方法包括:步骤s1,获取包含猪源干扰素δ5基因的dna片段;步骤s2,将所述包含猪源干扰素δ5基因的dna片段插入到外源表达载体中,构建得到用于表达猪源干扰素δ5基因的重组表达载体;步骤s3,将所述重组表达载体引入到合适的宿主细胞中,并在所述宿主细胞中驱动表达所述猪源干扰素δ5基因以获得所述猪源干扰素δ5。
8.进一步地,所述包含猪源干扰素δ5基因的dna片段具有seq id no.1所示的序列或者与seq id no.1所示的dna序列具有80%以上同源性的dna序列。
9.进一步地,在步骤s1,用聚肌胞苷酸诱导培养猪小肠上皮细胞ipec-j2或者用猪病毒性腹泻病原菌进行感染来对所述猪小肠上皮细胞ipec-j2进行预处理,从预处理后的细胞中提取总rna,然后利用序列为5
’‑
gcgatatccaattctctgggatccataggt-3’的引物p1和序列为5
’‑
cgaagcttcaagtgtgccttttttctctctt-3’的引物p2进行rt-pcr扩增获取所述包含猪
源干扰素δ5基因的dna片段。
10.进一步地,在步骤s2,所述外源表达载体是原核质粒载体,优选是pet-32a( )。
11.进一步地,在步骤s3,所述宿主是在大肠杆菌bl21(de3)。
12.进一步地,所述方法还包括步骤s4,提纯获取纯化的猪源干扰素δ5。
13.本发明的另一目的在于提供利用上述方法制备的猪源干扰素δ5。
14.本发明还有一个目的在于提供所述猪源干扰素δ5的应用,将所述猪源干扰素δ5用于制备治疗猪病毒性腹泻的药物。
15.本发明相对于现有技术具有如下的优点及效果:首次提供了通过原核表达的途径制备猪源ifn-δ5蛋白的方法,并通过优化条件获得可表达于培养物上清的猪源ifn-δ5蛋白;所选用的pet载体表达系统携带his标签,便于表达产物的进一步纯化;在构建原核表达载体时,通过引物设计将ifn-δ5的信号肽序列去除,使得构建获得的重组表达质粒pet-pifnδ5具有更高的蛋白表达效率。本发明首次提供了大量制备并纯化猪源ifn-δ5蛋白的方法,将制备获得的pifn-δ5蛋白应用于抑制多种猪病毒性腹泻的致病原,从而为制备治疗猪病毒性腹泻的药物提供很好的选择。
附图说明
16.图1是示出扩增获取pifn-δ5基因以及重组质粒的双酶切鉴定结果的图,其中左图a是扩增获取pifn-δ5基因的电泳图,右图b是重组质粒pet-pifnδ5的双酶切鉴定,图中m泳道为dna分子量标准dl2000,图中右侧的箭头分别指示目的条带。
17.图2是示出诱导条件下转化了重组质粒载体pet-pifnδ5的大肠杆菌bl21(de3)中表达目的蛋白的情况,其中左图a示出了诱导条件下转化了重组质粒载体pet-pifnδ5的大肠杆菌bl21(de3)中目的蛋白的表达及可溶性情况,泳道m是蛋白质分子量标准,泳道1是诱导条件下培养的转化了空载体pet-32a( )的大肠杆菌bl21(de3)破碎后的上清,泳道2是诱导条件下培养的转化了空载体pet-32a( )的大肠杆菌bl21(de3)破碎后的沉淀,泳道3是非诱导条件下培养的转化了重组质粒载体pet-pifnδ5的大肠杆菌bl21(de3)破碎后的上清,泳道4是非诱导条件下培养的转化了重组质粒载体pet-pifnδ5的大肠杆菌bl21(de3)破碎后的沉淀,泳道5是诱导条件下培养的转化了重组质粒载体pet-pifnδ5的大肠杆菌bl21(de3)破碎后的上清,泳道6是诱导条件下培养的转化了重组质粒载体pet-pifnδ5的大肠杆菌bl21(de3)破碎后的沉淀;右图b示出了通过western blot对诱导条件下培养的转化了重组质粒载体pet-pifnδ5的大肠杆菌bl21(de3)破碎后上清中目的产物进行检测的结果,其中泳道m是蛋白质分子量标准,泳道1是一个批次的上清样品,泳道2是另一个批次的上清样品。
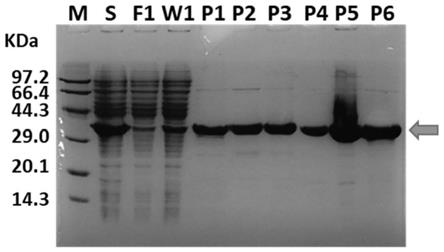
18.图3是示出大量表达pifn-δ5蛋白并进行纯化后的结果的图,其中泳道m是蛋白质分子量标准,泳道s是诱导条件下培养的细菌破碎后的上清样品,泳道f1是纯化操作过程中的流穿样品,泳道w1是纯化操作过程中的洗液样品,泳道p1~p6分别是纯化操作过程中的洗脱样品。
19.图4是示出pifn-δ5蛋白抑制猪病毒性腹泻病原的结果的图,其中pifn-δ5处理组为pifn-δ5蛋白处理并接毒组,对照组为单独接毒组,空白组为既不蛋白处理也不接毒组。
具体实施方式
20.以下实施例用于对本发明的技术方案进行示例性说明,并不用于限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料为市售商品。
21.发明人所在团队研究发现,pedv感染会诱导仔猪小肠ifn-δ5亚型的高表达,提示我们猪ifn-δ5在抗pedv感染中可能发挥重要作用。
22.本发明利用rt-pcr技术克隆获得pifn-δ5的基因,该基因优选具有seq id no.1所示的dna序列或者与其具有80%以上同源性的dna序列。基于pifn-δ5的基因采用重组方法构建原核表达载体,在原核表达系统大肠杆菌bl21(de3)中表达重组pifn-δ5蛋白,该重组蛋白优选具有seq id no.2所示的氨基酸序列或者与其具有80%以上同源性的氨基酸序列。利用上述原核表达系统所表达的pifn-δ5蛋白大量存在于菌体破碎上清中,本发明基于此还提供一种大量表达并纯化pifn-δ5蛋白的方法,并将所制得的pifn-δ5蛋白应用于制备抑制猪病毒性腹泻致病原的新药物或制剂。
23.实施例1:利用原核表达系统制备猪源干扰素δ5(pifn-δ5)蛋白
24.1、克隆载体的构建
25.首先,用pedv感染猪小肠上皮细胞ipec-j2,收集病毒感染后的细胞,用总rna提取试剂盒提取细胞总rna。
26.设计特异性的引物,具体包括上游引物p1:5
’‑
gcgatatccaattctctgggatccataggt-3’;下游引物p2:5
’‑
cgaagcttcaagtgtgccttttttctctctt-3’。利用引物p1和p2,以提取的ipec-j2细胞总rna为模板,用primescript rt-pcr kit进行rt-pcr扩增用于编码pifn-δ5蛋白的基因片段。rt-pcr的反应条件为50℃、30min;94℃、3min;94℃、30s,55℃、30s,72℃、40s,35个循环;72℃、10min,扩增结果如图1中的左图a所示。同时,用ecor
ⅴ
和hind iii限制性内切酶对原核表达载体pet-32a( )进行双酶切处理,并回收获得线性化载体。
27.接下来,按照重组酶说明书(ultra one step cloning kit),将上述扩增获得的pifn-δ5基因片段与线性化pet-32a( )载体连接。将连接产物转化至大肠杆菌dh5α感受态细胞,通过pcr从菌液中筛选出疑似阳性的克隆。进一步扩大培养这些克隆,并从培养物中提取质粒,使用ecor
ⅴ
和hind iii双酶切对质粒进行鉴定,结果如图1中的右图b所示。将酶切显示正确的质粒进一步进行序列测定,获得重组质粒pet-pifn-δ5,测序结果显示pifn-δ5基因片段具有seq id no.1所示的dna序列,其所表达的蛋白具有seq id no.2所示的氨基酸序列。
28.2、重组蛋白的诱导表达与鉴定
29.首先,将重组质粒pet-pifnδ5转化大肠杆菌bl21(de3)。
30.挑取含pet-pifnδ5的阳性克隆bl21(de3),于含氨苄青霉素的lb培养基中加入iptg(异丙基-β-d-硫代半乳糖苷)诱导表达,确定原核表达系统中表达pifnδ5的最佳诱导温度为37℃,时间4h,iptg浓度为0.8mm。
31.将含pet-pifnδ5的阳性克隆bl21(de3)扩增培养至细菌到达对数生长期,细菌在od
600
值为0.6左右,方加入诱导剂iptg,继续诱导表达4h。
32.收集诱导培养后的细菌菌体,将菌体经超声波破碎,离心收集上清和包涵体,经
sds-page蛋白电泳显示,上清中出现与预期大小(约35kd)一致的蛋白条带(见图2中的左图a)。进一步对菌体上清样品进行western blot检测,结果发现同样位置出现特异性条带(见图2中的右图b)。
33.以上结果表明上述构建的含pet-pifnδ5的大肠杆菌bl21(de3)能够成功表达重组pifn-δ5,且目的蛋白存在于菌体破碎上清中。
34.实施例2:大量制备pifn-δ5蛋白
35.将含pet-pifnδ5的阳性克隆bl21(de3)扩大至4l的培养规模。诱导条件下培养结束后,离心收集菌体,用200ml buffer a(含20mm tris-hcl、500mm nacl、1mm pmsf、5%甘油,ph 7.5)将菌体重悬。
36.将重悬后的菌体在700bar下高压破碎3次,在13000rpm下离心30min,收集离心后的上清液。
37.将上述上清液流过ni柱(his trap hp),使用buffer a平衡,然后用buffer b(含20mm tris-hcl、500mm nacl、1mm pmsf、250mm咪唑、5%甘油,ph 7.5)洗脱,获得粗纯化蛋白。
38.采用g-25脱盐柱将上述获得的粗纯化蛋白脱盐至pbs中,并采用bca法测定蛋白浓度。
39.图3示出了将菌体破碎后的上清样品以及纯化过程取样的电泳结果,其中泳道m是蛋白质分子量标准,泳道s是诱导条件下培养的细菌破碎后的上清样品,泳道f1是纯化操作过程中的流穿样品,泳道w1是纯化操作过程中的洗液样品,泳道p1~p6分别是纯化操作过程中的洗脱样品。
40.从图3的结果可看出,利用实施例1所构建的含pet-pifnδ5的阳性克隆bl21(de3)能够容易地获得大量高纯度的重组pifnδ5蛋白,为其在制备抑制猪病毒性腹泻致病原的新药物或制剂中的应用提供了原料基础。
41.实施例3:pifn-δ5蛋白抑制猪腹泻相关病毒的活性
42.ipec-j2细胞、st细胞、llc-pk1细胞和ma104细胞分别经纯化的pifn-δ5蛋白(50ng/ml浓度)处理12h后,按0.1moi的剂量对ipec-j2细胞接种pedv,st细胞接种tgev,对llc-pk1细胞接种pdcov,ma104细胞接种prov。为了便于描述,将这些经纯化的pifn-δ5蛋白处理后接种相应病毒的实验组简称为pifn-δ5处理组。同时设立未经pifn-δ5蛋白处理而仅接种病毒的对照组和既未经pifn-δ5蛋白处理也未接种病毒的空白组。
43.将上述接种了病毒的各细胞分别培养24h后收集细胞样品,提取细胞总rna并检测细胞样品中的病毒拷贝数。
44.结果如图4所示,与单独接毒处理的对照组相比,pifn-δ5处理组中pedv、tgev、pdcov和prov病毒拷贝数均呈现显著的降低趋势,表明pifn-δ5具有优异的病毒抑制活性。通过本发明的方法所制备的pifn-δ5蛋白能应用于制备抑制猪病毒性腹泻致病原的新药物或制剂。
45.申请人结合说明书附图对本发明的实施例做了详细的说明与描述,但是本领域技术人员应该理解,以上实施例仅为本发明的优选实施方案,详尽的说明只是为了帮助读者更好地理解本发明精神,而并非对本发明保护范围的限制,相反,任何基于本发明的发明精神所作的任何改进或修饰都应当落在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。