分泌蛋白ctgf在用于制备治疗急性肺损伤药物中的应用
技术领域
1.本发明属于医药领域,特别涉及一种分泌蛋白ctgf在用于制备治疗急性肺 损伤药物中的应用。
背景技术:
2.急性肺损伤(acute lung injury,ali)是指在严重感染、休克、创伤及烧伤等非 心源性疾病过程中,肺毛细血管内皮细胞和肺泡上皮细胞损伤造成弥漫性肺间 质及肺泡水肿,导致的急性低氧性呼吸功能不全或呼吸衰竭,损伤到一定程度可 以出现急性呼吸窘迫综合征(ards)。1967-1994年国际正式发表的临床研究进 行的mata分析死亡率50%左右(3264例病人)。因此如何预防和有效治疗急性 肺损伤降低急性呼吸窘迫综合征的发病率,对于危重疾病的就是死亡率至关重 要。
3.目前,急性肺损伤主要的治疗方法是呼吸支持治疗和药物治疗,其中呼吸支 持治疗又分为氧疗、无创机械通气和有创机械通气,这些呼吸支持的方式能改善 低氧血症,降低呼吸功,缓解呼吸窘迫,并能够更有效地改善全身缺氧,防止肺 外器官功能损害,但是对于肺泡的修复并没有实质的促进作用。然而不断出现新 的药物治疗方法,有些是抑制炎症因子,减轻炎症反应的,有些是改善氧合,纠 正缺氧,有些是促进肺内液体的吸收,比如体液管理、糖皮质激素治疗、酮康唑、 己酮可可碱、液体通气、一氧化氮(no)、活化蛋白c等还于临床研究阶段,因此 目前任然没有一种能治疗急性肺损伤效果显著的药物。
4.目前急性肺损伤的治疗中主要有以下几个问题:
5.第一、长时间的机械通气能引起并发症,比如,肺泡的气压性损伤、持续的 高气道压尤其高peep可影响回心血量、呼吸道感染、喉损伤、新生儿肺-支气管 发育不良等。
6.第二、药物治疗手段虽多,但至今尚未确定其可靠疗效。肺水清除与液体管 理、肺泡表面活性物质补充疗法、β受体激动剂应用、他汀类药物应用、糖皮 质激素应用、抗凝剂应用、抗氧化剂与酶抑制剂的应用、血液净化治疗、营养干 预等,其有效治疗方法仍在继续探索。
7.因此在急性肺损伤的治疗中,长时间的呼吸支持会引起并发症,而且这些并 发症直接影响机体的肺修复,而药物治疗方法虽多,但是目前仍然没疗效显著的 治疗方法,因此减少机械通气并发症,增强肺泡的损伤修复能力,是急性肺伤治 疗迫切需要解决的问题。
8.结缔组织生长因(connective tissue growth factor,ctgf),也被称为 fisp12,βig-m2,和igf-bp8,它是一种由349个氨基酸组成:
9.当机体发生严重感染、休克、创伤及烧伤等非心源性疾病时,肺毛细血管内 皮细胞和肺泡上皮细胞损伤造成弥漫性肺间质、肺泡水肿以及大量炎症细胞浸 润,引发急性肺损伤(ali),对急性肺损伤后进行蛋白芯片测定的研究发现, 发生急性肺损伤时,肺组织的hippo-yap通路被激活,且肺损伤越严重,通路 激活就越明显,其通路活跃的规律与急性肺损修复过程一致。ctgf则是hipo
‑ꢀ
yap通路的下游效应分子,因此在肺损伤修复过程中,
ctgf的蛋白含量也与急 性肺损修复规律一致,因此ctgf能促进急性肺损伤中肺组织的修复,是一种 潜在的急性肺损伤治疗药物。
10.当机体发生严重感染、休克、创伤及烧伤等非心源性疾病时,肺毛细血管内 皮细胞和肺泡上皮细胞损伤造成弥漫性肺间质、肺泡水肿以及大量炎症细胞浸 润,引发急性肺损伤(ali),对急性肺损伤后进行蛋白芯片测定的研究发现, 发生急性肺损伤时,肺组织的hippo-yap通路被激活,且肺损伤越严重,通路激 活就越明显,其通路活跃的规律与急性肺损修复过程一致。ctgf则是hipo-yap 通路的下游效应分子,因此在肺损伤修复过程中,ctgf的蛋白含量也与急性肺 损修复规律一致,因此ctgf能促进急性肺损伤中肺组织的修复,是一种潜在的 急性肺损伤治疗药物。
技术实现要素:
11.本发明的目的是一种分泌蛋白ctgf在用于制备治疗急性肺损伤药物中的应 用,所述应用能有效治疗肺组织在受到脂多糖(lps)刺激后引起的急性肺损伤, 不但能抑制急性肺损伤后炎症细胞的浸润,还能促进受损后的肺泡快速修复,并 恢复其肺脏组织的肺功能。
12.本发明所述的分泌蛋白ctgf在用于制备治疗急性肺损伤药物中的应用。
13.所述急性肺损伤包括直接肺损伤和间接肺损伤。
14.所述直接肺损伤包括严重肺部感染,胃内容物吸入,肺挫伤,吸入有毒气体, 淹溺、氧气中毒,诱发的肺损伤。
15.所述间接肺损伤严重感染,包括严重非胸部创伤、急性重症胰腺炎、大量输 血、体外循环、弥漫性血管内凝血造成的肺损伤。
16.所述药物促进肺泡组织修复。
17.所述药物抑制炎症细胞的浸润。
18.所述药物通过静脉给药。
19.给药剂量为每日20-50ug/kg。
20.所述药物通过雾化给药。
21.本发明所述应用,其结缔组织生长因子(ctgf)是一种hippo-yap信号通路 的下游信号分子,由349个氨基酸组成,富含半胱氨酸的分泌生长因子,能促进 肺泡组织的修复,疗效显著,不但能通过静脉给药,还能直接雾化给药被肺组织 吸收(ctgf分子蛋白稳定,而且比较小,容易雾化),提高药效,并且该生长 因子在机体的大部分组织细胞中均有表达,不会引起机体的排异反应,使机体肺 泡能快速修复,恢复其肺功能。
22.本发明所述急性肺损伤指在严重感染、休克、创伤及烧伤等非心源性疾病过 程中,肺毛细血管内皮细胞和肺泡上皮细胞损伤造成弥漫性肺间质及肺泡水肿, 导致的急性低氧性呼吸功能不全或呼吸衰竭以肺容积减少、肺顺应性降低、严重 的通气/血流比例失调为病理性特征,在临床上表现为进行性低氧血症和呼吸窘 迫,肺部影像学表现为非均一的渗出性病变,诱发急性肺损伤的原因有很多,比 如严重肺部感染、肺挫伤、吸入有毒气体、严重非胸部创伤、急性重症胰腺炎等, 根据诱发因素的不同分为直接肺损伤和间接肺损伤,申请人采用经典的lps诱 导小鼠急性肺损伤模型,进行ctgf治疗急性肺损伤的药物验证,其结果显示, 控制分泌蛋白ctgf的剂量为20-50ug/kg/天,能促进急性肺损伤后小鼠
肺组织 的损伤修复,且采用10ng/ml剂量刺激肺类器官,可以增强肺类器的增值与分 化,因此ctgf能有效治疗肺组织的急性肺损伤。
附图说明
23.图1蛋白芯片测定急性肺损伤后hippo-yap通路的变化;
24.图2hippo-yap通路示意图;
25.图3ctgf安全性验证;
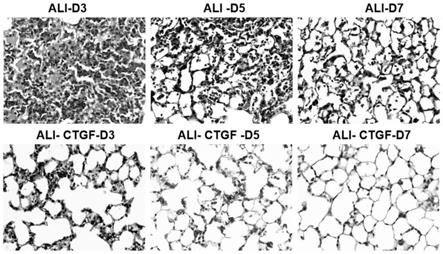
26.图4动物体内验证ctgf治疗效果;
27.图5类器官体外验证ctgf治疗效果。
具体实施方式
28.一.试剂
29.1、试剂:ctgf(品牌:r&d,货号:9237-ct-050);
30.t1α/podoplanin(sigma,货号:1995);
31.epcam(abcam,货号:ab187276);
32.dispase(品牌:corning biocoat,货号:354235)。
33.2、样品来源:野生型c57小鼠肺干祖细胞aec2s培养的肺类器官、野生型 c57小鼠。
34.二.实施例
35.实施例1
36.采用ctgf的浓度梯度尾静脉注射小鼠体内,进行ctgf安全性的验证。
37.选取6-8周龄雄性c57小鼠,气管注射lps,制备急性肺损伤模型,然后根 据小鼠体重,按照20ug/kg、100ug/kg、200ug/kg剂量尾静脉注射ctgf给药, 给药间隔时间为24h,并连续7天给药,给药结束后于第21天取出肺组织,进 行4%多聚甲醛固定、石蜡包埋、切片、masson染色。
38.masson染色结果:能观察到20ug/kg剂量组肺组织没有蓝色着色,显示无肺 组织纤维化,100ug/kg剂量组,肺组织局部有蓝色着色,显示有轻微肺组织纤 维化,200ug/kg剂量组,肺组织有大量蓝色着色,显示有肺组织纤维化,参见 图3。因此,100ug/kg、200ug/kg浓度剂量ctgf治疗急性肺损伤时,会引起肺 组织纤维化,而20ug/kg浓度剂量ctgf治疗急性肺损伤不会引起肺组织纤维化, 因此采用20ug/kg浓度剂量ctgf治疗急性肺损伤具有安全性。
39.实施例2
40.选取6-8周龄雄性c57小鼠,气管注射lps,制备急性肺损伤模型,分为ali 组和ctgf治疗组(ali-ctgf),其中ali-ctgf组根据小鼠体重,按照20ug/kg 剂量尾静脉注射ctgf给药,给药间隔时间为24h,并连续7天给药,分别在给 药的第3、5、7天取出肺组织,进行4%多聚甲醛固定、石蜡包埋、切片、病理 检测he染色。
41.he染色结果:可以观察到急性肺损伤(ali)组第3天,肺组织中肺泡破坏 严重,有大量炎症细胞浸润,大量蛋白组织渗出,少量红细胞漏出;ali-ctgf组 第3天,观察到肺泡中有少量的炎症细胞浸润,肺泡隔增厚,但是无肺泡破坏, 无蛋白组织渗出,无红细胞漏出;ali组第5天,肺组织中右明显肺泡破损,有 大量炎症细胞浸润,有蛋白组织渗出,无红
细胞漏出;ali-ctgf组第5天,观 察到肺泡无炎症细胞浸润,肺泡结构完整,无蛋白组织渗出,无红细胞漏出;ali 组第7天,肺组织中局部肺泡破损,肺泡隔增厚,有炎症细胞清润,局部少量蛋 白组织渗出,无红细胞漏出;ali-ctgf组第7天,观察到肺泡无炎症细胞,肺 泡结构完整,无蛋白组织渗出,无红细胞漏出,实验结果提示,发生急性肺损伤 后,给予ctgf给药,能促进肺损伤的修复(抑制炎症细胞的清润),参见图4。
42.实施例3
43.选取6-8周龄雄性c57小鼠,2%戊巴比妥纳60mg/kg剂量腹腔注射麻醉动 物,75%酒精消毒,取出肺组织,眼科剪剪碎肺组织,加入10u/mldispase消化 酶,37℃水浴消化45min,200目过滤,收集细胞,1:500加入2ult1α,4℃孵育 30min,洗涤三次,加入驴抗小鼠磁珠二抗,4℃孵育15min,磁珠分选版过柱, t1α-细胞加入1:400加入2ulepcam,4℃孵育30min,洗涤,加入驴抗兔磁珠二 抗,4℃孵育15min,分选t1α-epcam 的细胞,按照1.5
×
105个/cm2密度与 matrigel混合培养,培养24h后,分为两组,一组为ns组,使用mtec培养基 培养,另一组为ctgf组,采用mtec中加入10ng/ml的ctgf培养基培养,两组 均隔天换液,显微镜观察记录肺类器官生长规律。
44.ctgf刺激肺类器官实验结果:在体外培养肺类器官中,ctgf刺激肺类器组 比ns组肺类器官的生长速度明显增快,且类器官的球体直径比ns组的大1-2 倍,实验结论:ctgf能促进肺类器的增值与分化,参见图5。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。