一种对映体选择性的合成3,3-二取代异苯并呋喃-1(3h)-酮的方法
技术领域
1.本发明涉及有机合成技术领域,具体涉及一种对映体选择性的合成3,3-二取代异苯并呋喃-1(3h)-酮的方法。
背景技术:
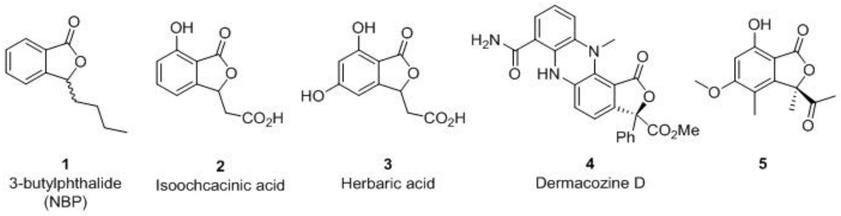
2.异苯并呋喃-1(3h)-酮,又称为苯酞。含有这类结构的天然产物通常具有重要的生物及药物活性。如从芹菜籽里分离出的3-丁基苯酞(nbp),能够抑制血小板凝集、改善微循环、减轻缺血性脑损伤,已成为治疗缺血性脑卒中的有效抗血小板药物,并且手性l-丁苯酞在某些情况下更有效;从菊池链格孢中分离出的isoochracinic acid和从多主枝孢中分离出的herbaric acid具有抗菌和抗微生物活性;从皮生球菌中分离出的dermacozined呈现出对不同肿瘤细胞的毒性;从内生真菌炭疽菌cr1535-02中分离出来的化合物对hepg2细胞株具有细胞毒性并且具有强抗氧化性。
[0003][0004]
目前,3,3-二取代异苯并呋喃-1(3h)-酮的合成方法较少。tanaka等人采用rh(cod)2bf4/solphos为催化剂,经1,6-二炔与炔丙醇的[2 2 2]反应和转移酯化,对映体选择性地生成手性3,3-二取代异苯并呋喃-1(3h)-酮,ee值可达94%,但需用到贵金属rh催化剂。youn等人报道了三唑盐原位脱除质子形成的nhc催化空气对邻烯基苯甲醛的氧化和oxa-michael加成形成3,3-二取代异苯并呋喃-1(3h)-酮的方法,采用手性辛可宁代替体系中的三乙胺,以中到高的收率和ee值合成3,3-二取代异苯并呋喃-1(3h)-酮,但催化剂用量较高,且反应时间长达6.7-15天。sala等人在koh或k3po4和二苯并-18-冠-6的催化下,开发了3-芳基苯酞和α,β-不饱和酮的芳基迈克尔反应,以高产率和非对映选择性得到了相应的3,3-二取代异苯并呋喃-1(3h)-酮,但不具有对映选择性。
[0005]
目前,合成手性3,3-二取代异苯并呋喃-1(3h)-酮类化合物的方法存在着一些缺陷,如需要贵金属催化剂、催化剂用量较多、反应时间过长、对映体选择性不高。
技术实现要素:
[0006]
为弥补现有技术的不足,本发明提供了一种对映体选择性的合成3,3-二取代异苯并呋喃-1(3h)-酮的方法,以较为廉价的铜盐与手性膦配体作为催化剂,对映选择性地催化合成3,3-二取代异苯并呋喃-1(3h)-酮,以有效解决背景技术中所提及的需采用贵金属、反应慢、缺少对映体选择性的技术问题,通过以下技术方案实现:
[0007]
本发明在铜盐-手性膦配体形成的催化剂作用下,使用硅烷作为还原剂,对邻酰苯甲酸酯(ⅰ)和α,β-不饱和酸酯(ⅱ)进行共轭还原/aldol加成/内酯化级联反应,得到3,3-二取代异苯并呋喃-1(3h)-酮(ⅲ)。该方法使用催化量的cu-膦催化剂,cu-膦l1-l6或其对映体,反应条件温和、反应快、具有较高的对映体选择性。
[0008]
一种有选择性的合成3,3-二取代异苯并呋喃-1(3h)-酮的方法,合成路线是:
[0009][0010]
进一步的,所述式ⅰ底物与式ⅲ化合物中的r1为c
1-c
12
的烷基、c
6-c
12
芳基中的一种;式ⅱ化合物与式ⅲ化合物中的r2为c
1-c
12
的烷基;r3为h或c
1-c5的烷基;r4为h或c
1-c5的烷基。
[0011]
具体合成方法为:在休良克瓶1中加入铜盐、膦配体,休良克瓶2中加入式ⅰ底物,抽真空,n2置换三次;保持氮气氛围往休良克瓶2中加入式ⅱ化合物,之后往休良克瓶1和休良克瓶2中分别加入反应溶剂并搅拌10min;再加入硅烷至休良克瓶1中搅拌20min;将休良克瓶2中溶液经双头针加入至休良克瓶1中,反应4-6h即可合成式ⅲ化合物3,3-二取代异苯并呋喃-1(3h)-酮。
[0012]
进一步的,所述的铜盐为cuf(pph3)3·
2meoh、r5co2cu、(r5co2)2cu、(r5co2)2cu
·
mh2o中的一种,m=1或2或3,r5为c
1-c
10
的烷基或c
1-c
10
的取代烷基;或cux、cux2、cui中的一种与naor5的混合物,或cux、cux2、cui中的一种与kor5的混合物,其中x为f、cl、br中的一种。
[0013]
进一步的,所述的膦配体为有如下结构的膦化合物l1-l6的一种,或其对映体的一种;
[0014][0015]
l1-l6中,r6为苯基或取代苯基中的一种,其中,取代苯基指苯基上的一个到全部h原子被取代的苯基,其中取代基为c
1-c4的直链烷基、c
3-c4的支链烷基、c
1-c4的烷氧基、卤素
中的一种或几种。
[0016]
进一步的,所述的硅烷包括r8sih3、r
82
sih2、r
83
sih、ph2mesih、(sihme2)2o、(meo)3sih、(sihme2)2nh、((ch3)2osi)n、r9(osihme)
p
or9中的一种;p=1,2,3,
…
,100的整数,r8为me、et或ph,r9为h、si(ch3)3或si(ch3)2bu
t
。
[0017]
进一步的,所述的反应溶剂为醚类或芳烃类或卤代烷类,包括但并不限于乙醚、丁醚、四氢呋喃、1,4-二氧六环、乙二醇二甲醚、乙二醇二乙醚、甲苯、乙苯、二甲苯、二氯甲烷、1,2-二氯乙烷中的一种或一种以上的混合物。
[0018]
进一步的,所述式ⅰ底物的质量为(1-1000)ml/g。
[0019]
进一步的,所述的铜盐、膦配体、硅烷、式i化合物、式ⅱ化合物的摩尔比为(0.02~0.08):(0.02~0.16):(2~5):1:(2-3)。
[0020]
进一步的,在休良克瓶1中分别加入铜盐、膦配体时,休良克瓶内的温度为-20-45℃。
[0021]
本发明与现有技术相比的有益效果是:
[0022]
本发明采用合适的手性膦配体l1-l6,可以对映体选择性地合成手性3,3-二取代异苯并呋喃-1(3h)-酮,产物ee值高达99%。
[0023]
本发明能对映体选择性地制得3,3-二取代异苯并呋喃-1(3h)-酮,所用原料皆为市售原料,原料易得;该方法只使用了催化量的廉价金属cu化合物为催化剂的金属部分,不需要贵金属催化剂,成本低。
[0024]
本发明的反应快,4-6小时即完成反应。
附图说明
[0025]
图1为实施例1产物的hplc色谱图;
[0026]
图2为实施例2产物的hplc色谱图;
[0027]
图3为实施例3产物的hplc色谱图。
具体实施方式
[0028]
下面通过具体实施例详述本发明,但不限制本发明的保护范围。如无特殊说明,本发明所采用的实验方法均为常规方法,所用实验器材、材料、试剂等均可从商业途径获得。
[0029]
当r
1-r4为相同类型的烷基、芳基和取代芳基时,其制备方法相同,区别仅在于碳的个数不同,不再赘述。
[0030]
实施例1
[0031]
在干燥的休良克瓶1中依次加入0.0050g cu(pph3)3f
·
2meoh和0.0054g对映体纯l1(r6=ph),休良克瓶2中加入0.0400g邻苯甲酰苯甲酸甲酯,抽真空,n2置换三次;保持氮气氛围往休良克瓶2中加入0.0340g甲基丙烯酸甲酯,之后往休良克瓶1和2中分别加入0.5ml无水甲苯后降温至0℃并搅拌10min;再加入3equiv的pmhs至休良克瓶1中并搅拌20min;将休良克瓶2中溶液经双头针加入至休良克瓶1中。反应6h后加入3ml饱和氯化铵水溶液并搅拌1h,过滤、分液,水相用3ml乙酸乙酯萃取两次。合并的有机相经2ml饱和氯化钠溶液洗涤两次,无水硫酸钠干燥、旋蒸、柱层析纯化,得到产物3-苯基-3-(1-甲基-1-甲氧基酰基)乙基异苯并呋喃-1(3h)-酮(
ⅲ‑
1)。
[0032][0033]
实施例2
[0034]
在干燥的休良克瓶1中依次加入0.0058g cu(pph3)3f
·
2meoh和0.0062g对映体纯l1(r6=ph),休良克瓶2中加入0.0502g邻苯甲酰苯甲酸甲酯,抽真空,n2置换三次;保持氮气氛围往休良克瓶2中加入0.0560g甲基丙烯酸乙酯,之后往休良克瓶1和2中分别加入0.8ml无水甲苯降温至0℃并搅拌10min;再加入3equiv的pmhs至休良克瓶1中并搅拌20min;将休良克瓶2中溶液经双头针加入至休良克瓶1中。反应5h后加入3ml饱和氯化铵水溶液并搅拌1h,过滤、分液,水相用3ml乙酸乙酯萃取两次。合并的有机相经2ml饱和氯化钠溶液洗涤两次,无水硫酸钠干燥、旋蒸、柱层析纯化,得到产物3-苯基-3-(1-甲基-1-乙氧基酰基)乙基异苯并呋喃-1(3h)-酮(
ⅲ‑
2)。
[0035][0036]
实施例3
[0037]
在干燥的休良克瓶1中依次加入0.0058g cu(pph3)3f
·
2meoh和0.0065g对映体纯l1(r6=ph),休良克瓶2中加入0.0480g邻苯甲酰苯甲酸甲酯,抽真空,n2置换三次;保持氮气氛围往休良克瓶2中加入0.0711g甲基丙烯酸苄酯,之后往休良克瓶1和2中分别加入0.8ml无水四氢呋喃降温至0℃并搅拌10min;再加入3equiv的pmhs至休良克瓶1中并搅拌20min;将休良克瓶2中溶液经双头针加入至休良克瓶1中。反应4h后加入3ml饱和氯化铵水溶液并搅拌1h,过滤、分液,水相用3ml乙酸乙酯萃取两次。合并的有机相经2ml饱和氯化钠溶液洗涤两次,无水硫酸钠干燥、旋蒸、柱层析纯化,得到产物3-苯基-3-(1-甲基-1-苯甲氧基酰基)乙基异苯并呋喃-1(3h)-酮(
ⅲ‑
3)。
[0038][0039]
实施例4
[0040]
在干燥的休良克瓶1中依次加入0.0048g cu(pph3)3f
·
2meoh和0.0082g对映体纯l1(r6=ph),休良克瓶2中加入0.0490g邻苯甲酰苯甲酸甲酯,抽真空,n2置换三次;保持氮气氛围往休良克瓶2中加入0.1060g甲基丙烯酸月桂醇酯,之后往休良克瓶1和2中分别加入0.8ml无水甲苯降温至-10℃并搅拌10min;再加入3equiv的ph2sih2至休良克瓶1中并搅拌20min;将休良克瓶2中溶液经双头针加入至休良克瓶1中。反应6h后加入3ml饱和氯化铵水溶液并搅拌1h,过滤、分液,水相用3ml乙酸乙酯萃取两次。合并的有机相经2ml饱和氯化钠溶液洗涤两次,无水硫酸钠干燥、旋蒸、柱层析纯化,得到产物3-苯基-3-(1-甲基-1-十二烷氧基酰基)乙基异苯并呋喃-1(3h)-酮(
ⅲ‑
4)。
[0041][0042]
实施例5
[0043]
在干燥的休良克瓶1中依次加入0.0018g cubr、0.0092g对映体纯l2(r6=ph),和0.0470g kobu
t
休良克瓶2中加入0.0480g邻苯甲酰苯甲酸甲酯,抽真空,n2置换三次;保持氮气氛围往休良克瓶2中加入0.0570g甲基丙烯酸烯丙酯,之后往休良克瓶1和2中分别加入
0.8ml无水甲苯并搅拌10min;再加入3equiv的(me2sih)2o至休良克瓶1中并搅拌20min;将休良克瓶2中溶液经双头针加入至休良克瓶1中。反应6h后加入3ml饱和氯化铵水溶液并搅拌1h,过滤、分液,水相用3ml乙酸乙酯萃取两次。合并的有机相经2ml饱和氯化钠溶液洗涤两次,无水硫酸钠干燥、旋蒸、柱层析纯化,得到产物手性3-苯基-3-(1-甲基-1-烯丙氧基酰基)乙基异苯并呋喃-1(3h)-酮(
ⅲ‑
5)。
[0044][0045]
实施例6
[0046]
在干燥的休良克瓶1中依次加入0.0019g cu(oac)2和0.0035g l3(r6=ph),休良克瓶2中加入0.0350g邻戊酰苯甲酸甲酯,抽真空,n2置换三次;保持氮气氛围往休良克瓶2中加入0.0320g甲基丙烯酸甲酯,之后往休良克瓶1和2中分别加入0.8ml无水四氢呋喃降温至0℃并搅拌10min;再加入3equiv的pmhs至休良克瓶1中并搅拌20min;将休良克瓶2中溶液经双头针加入至休良克瓶1中。反应6h后加入3ml饱和氯化铵水溶液并搅拌1h,过滤、分液,水相用3ml乙酸乙酯萃取两次。合并的有机相经2ml饱和氯化钠溶液洗涤两次,无水硫酸钠干燥、旋蒸、柱层析纯化,得到产物手性3-正丁基-3-(1-甲基-1-甲氧基酰基)乙基异苯并呋喃-1(3h)-酮(
ⅲ‑
6)。
[0047][0048]
对比例1
[0049]
给休良克瓶中加入0.003g cu(pph3)3f
·
2meoh、0.023g邻苯甲酰苯甲酸甲酯,抽真空/n2置换三次后,给其中加入0.022g甲基丙烯酸甲酯/0.5ml无水甲苯的溶液,降温至0℃并搅拌10min,缓慢加入3equiv的pmhs,反应6h后加入3ml饱和氯化铵水溶液并搅拌1h,过滤、分液,水相用3ml乙酸乙酯萃取两次。合并的有机相经2ml饱和氯化钠溶液洗涤两次,无水硫酸钠干燥、旋蒸、柱层析纯化,得到3-苯基-3-(1-甲基-1-甲氧基酰基)乙基异苯并呋喃-1(3h)-酮(
ⅲ‑
6)0.017g,收率57%。
[0050]
以上所述,仅为本发明创造较佳的具体实施方式,但本发明创造的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明创造披露的技术范围内,根据本发明创造的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明创造的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。