一种将ips细胞诱导成nk细胞的试剂盒及其应用方法
技术领域
1.本发明属于生物技术领域,具体地,涉及一种将ips细胞诱导成nk细胞的试剂盒及其应用方法。
背景技术:
2.诱导多潜能干细胞(inducedpluripotentstemcells,ips细胞)可以在适当条件下,在体外分化成含各个胚层来源的拟胚体(embryoidbody,eb),并进一步向目标类型细胞进行定向分化,如胰岛素分泌细胞、造血细胞、神经细胞等。由于ips细胞直接由患者的体细胞重编程而来,所以在进行细胞移植的时候不存在免疫排斥,且不用考虑细胞来源的伦理问题,因此,具有广阔的临床应用前景。
3.自然杀伤细胞作为一类独立的淋巴细胞群,无需抗原预先致敏即可直接杀伤靶细胞,包括肿瘤细胞、病毒或细菌感染的细胞以及机体某些衰老正常细胞,因而被视为机体免疫防御系统的第一道防线。随着肿瘤免疫学的发展,越来越多的研究表明,自然杀伤细胞(nk细胞)应用于过继免疫治疗对于消除残留的肿瘤病灶、促进患者免疫系统的重建具有显著的效果,成为了化学治疗和造血干细胞移植后清除残留肿瘤细胞的重要治疗手段。临床nk细胞存在供应不足的情况,目前对nk细胞诱导分化的研究包括细胞共培养技术或添加培养基等方法,但这些方法存在诱导成功的细胞数目少、分化效率低、易受病原污染的缺点。因此,有需要进行进一步研究探索出一种能够将ips细胞诱导成nk细胞的最佳诱导分化体系。
技术实现要素:
4.为了解决上述技术问题,本发明的目的在于提供一种将ips细胞诱导成nk细胞的试剂盒及其应用,以期能够开发出一种高效稳定的培养诱导体系和简单易操作的培养方法,获得高数量、高纯度nk细胞。
5.根据本发明的第一个方面,提供一种将ips细胞诱导为nk细胞的试剂盒,其特征在于,包括以下组分:第一培养液、第二培养液、第三培养液;
6.第一培养液包括:细胞基础培养基1、1~10mg/ml重组人白蛋白、1~10mg/ml去离子牛血清白蛋白、3~15vol%聚乙烯醇、10~150ng/ml亚油酸、10~150ng/ml亚麻酸、1~10μg/ml合成胆碱、300~500umα-硫代甘油、0.1~2vol%胰岛素-转铁蛋白-硒-乙醇胺溶液、2~10vol%无蛋白杂交瘤混合物ii、10~100ug/ml2-磷酸抗坏血酸、5~150ng/m干细胞因子、5~60ng/ml人骨成型蛋白、5~60ng/ml血管内皮生长因子、5~60umy-27632;
7.第二培养液包括:细胞基础培养2、10~20vol%热灭活的人ab血清、1~10mm l-谷氨酰胺、0.1~2μmβ-巯基乙醇、2~8ng/ml亚硒酸钠、10~50μm乙醇胺、10~40mg/l抗坏血酸、5~150ng/ml干细胞因子、5~100ng/ml白细胞介素7、5~100ng/ml白细胞介素15、1~50ng/ml酪氨酸激酶受体3配体。
8.第三培养液包括:第二培养液和2~50ng/ml白细胞介素3。
9.本发明提供了一种将ips细胞诱导为nk细胞的试剂盒及其应用方法,其中的第一培养液可以将ips细胞培养形成单细胞团聚拟胚体(spin eb),第二培养液和第三培养液可以诱导spin eb分化为nk细胞。第一培养液不含血清或饲养细胞,培养基成分含量明确可控且不易受到外源性污染,有利于批量生产,实验结果重复性强,可以使ips细胞高效地形成spin eb。经过我们的实验研究发现,第一培养液中含有的干细胞因子、人骨成型蛋白、血管内表皮生长因子,能够有效诱导中胚层的分化,y-27632能显著减少ips细胞的凋亡,促进其增殖。这几种成分协同作用能够促进细胞间的信号通路传导加上培养液中的其他营养成分,用于ips细胞形成spin eb并有助于spin eb早期增殖分化为nk细胞。
10.我们研究发现,第二培养液和第三培养液中的干细胞因子、白细胞介素7、白细胞介素15和酪氨酸激酶受体3配体(flt-3l)联合作用于spin eb分化为nk细胞的各个阶段。干细胞因子和flt-3l能够促进spin eb的分化,促进nk细胞早期的发育,使之分化为nk祖细胞。干细胞因子、白细胞介素7、白细胞介素15和flt-3l联合作用能够促进spin eb的增殖,进一步使nk细胞的数量增多。白细胞介素7、白细胞介素15能够活化nk细胞,促进nk细胞的快速成熟分化、发育、增殖、提高nk细胞的细胞毒作用及促进nk细胞分泌细胞因子,进而起到免疫调节和杀伤作用。第三培养液中含有的白细胞介素3能够促进nk细胞早期的增殖分化。将第三培养液和第二培养液应用于spin eb分化的不同阶段,这几种成分成分协同作用,加上培养液中的其他营养成分作用于spineb向nk细胞的分化至成熟的各个阶段,有效提高了分化效率,提高了nk细胞的分化成功的比例。
11.优选地,第一培养液包括:86.2vol%细胞基础培养基1、1~10mg/ml重组人白蛋白、2~8mg/ml去离子牛血清白蛋白、5~10vol%聚乙烯醇、10~100ng/ml亚油酸、10~100ng/ml亚麻酸、2~8μg/ml合成胆碱、350~450umα-硫代甘油、0.1~1vol%胰岛素-转铁蛋白-硒-乙醇胺溶液、2~8vol%无蛋白杂交瘤混合物ii、10~100ug/ml2-磷酸抗坏血酸、30~50ng/m干细胞因子、10~30ng/ml人骨成型蛋白、10~30ng/ml血管内皮生长因子、5~15umy-27632;
12.第二培养液包括:75%~83vol%细胞基础培养2、10~20vol%热灭活的人ab血清、2mm l-谷氨酰胺、0.8~1.2μmβ-巯基乙醇、2~8ng/ml亚硒酸钠、50μm乙醇胺、10~40mg/l抗坏血酸、10~30ng/ml干细胞因子、10~30ng/ml白细胞介素7、5~20ng/ml白细胞介素15、5~20ng/ml酪氨酸激酶受体3配体;
13.第三培养液包括:第二培养液和2~8ng/ml白细胞介素3。
14.通过进一步限定各培养基中各组分的含量,使本发明提供的试剂盒将ips细胞诱导为nk细胞的效率更高。
15.优选地,细胞基础培养基1由以下组分组成:imdm培养基:f12培养基=1:1,第一培养液还包括2mm0.5vol%青霉素-链霉素。
16.优选地,细胞基础培养基2由以下组分组成:dmem培养基:f12培养基=5~5.5:2.5~2.8,第三培养液还包括1vol%青霉素-链霉素。
17.优选地,上述将ips细胞诱导为nk细胞的试剂盒,其特征在于,还包括第四培养液;第四培养液在ips细胞离心的过程中使用;第四培养液包括:90vol%细胞基础培养基3和10vol%胎牛血清。
18.优选地,按体积比计算,细胞基础培养基3由以下组分组成:dmem培养基:f12培养
基=1:1。
19.根据本发明的另一个方面,提供一种将ips细胞诱导为nk细胞的方法,其特征在于,包括:
20.s1:采用上述第一培养液将ips细胞培养形成spin eb;
21.s2:采用上述第二培养液和第三培养液将spin eb诱导为nk细胞。
22.优选地,在s1中,具体步骤为:
23.s1.1:将ips细胞接种到铺了matrigel胶溶液的6孔板中;
24.s1.2:培养ips细胞生长至70%~80%融合度时,用生理盐水洗ips细胞2次,弃洗液;
25.s1.3:加入预热的tryple select于培养箱中消化3~10min,后将ips细胞吹散成单个细胞,并转移到15ml离心管中;
26.s1.4:在上述15ml离心管中加入5ml第四培养液,混匀,离心后弃上清液,用生理盐水洗一遍ips细胞;
27.s1.5:用第一培养液重悬ips细胞,调整ips细胞的密度,得ips细胞液;
28.s1.6:按100μl/孔将ips细胞液接种到96孔圆底孔板上,离心后将96孔圆底孔板转移至培养箱中培养6天,得spin eb液。
29.优选地,在s1.1中ips细胞的接种密度为10~50万/孔;在s1.5中,调整ips细胞的密度为5~20万/ml。
30.在将ips细胞培养形成spin eb的步骤中,采用tryple select将ips细胞消化为单细胞再进一步进行离心得到单细胞离心团聚形成的拟胚体(spin eb),此培养方法不仅能进行外源基因导入操作,还可以控制细胞数目,并且通过控制细胞数量进一步调整细胞接种的密度。形成spin eb的ips细胞的数量对于eb细胞的进一步分化效率会产生影响,细胞数量过少时,分化成功的nk细胞的总数偏低,细胞数量过多时,eb细胞的分化效率将会降低。
31.优选地,在s2中,具体步骤为:
32.s2.1:按1ml/孔将1%~3%明胶溶液加入6孔板中,在培养箱中静置1h,得到铺有明胶的6孔板,在其中加入第三培养液;
33.s2.2:将spin eb液弃去大部分上清液后,加入到上述6孔板中
34.s2.3:培养6天后换成第二培养液,继续培养5~7天;
35.s2.4:继续培养3~4周。
36.优选地,在s2.4中,在培养第14天起,每3天换一次第二培养液。
37.本发明提供的将ips细胞诱导到成nk细胞的试剂盒除了提供适用于ips细胞分和nk细胞增殖的适宜营养条件外,还添加的多种有效成分能够作用于ips细胞分化的各个阶段。将该试剂盒中的各个培养液应用于ips细胞培养诱导分化的各步骤中,能够获得分化效率高、纯度高、数量多的nk细胞。
附图说明
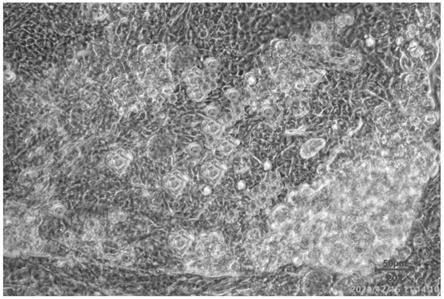
38.图1为实施例2中spin eb诱导分化21天的得到的nk细胞的显微镜图片。
具体实施方式
39.为了使本技术领域的人员更好地理解本发明方案,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料为市售商品。
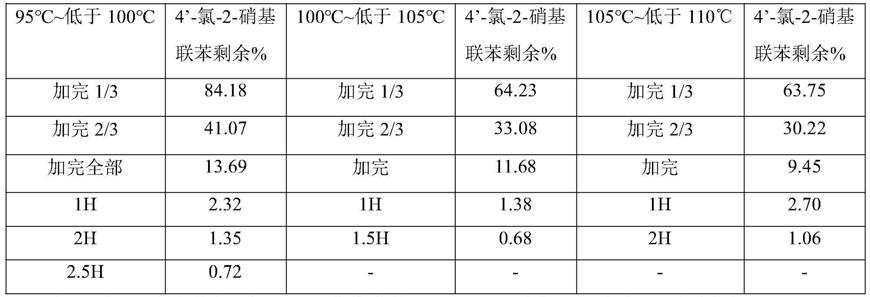
40.表1为实施例1~3和对比例1~4提供的试剂盒中第一培养液、第二培养液、第三培养液的最终成分的含量表。此外实施例1~3和对比例1~4提供的试剂盒中还包括第四培养液,具体成分为:90vol%(dmem培养基:f12培养基=1:1)和10vol%胎牛血清。
41.表1实施例1~3和对比例1~4第一培养液、第二培养液、第三培养液的成分表
42.[0043][0044]
对比例5
[0045]
本对比例中提供的试剂盒包括第一培养液、第二培养液、第三培养液、第四培养液。第一培养液的成分为:细胞基础培养基(imdm:f12=1:1)、2mm0.5%青霉素-链霉素;第二培养液和第三培养液的成分为:99vol%细胞基础培养基(deme:f12=2:1)、1vol%青霉素-链霉素;第四培养液的成分为90vol%(dmem培养基:f12培养基=1:1)和10vol%胎牛血清。
[0046]
利用实施例1~3和对比例1~5提供的试剂盒进行将ips细胞诱导为nk细胞的具体实验操作如下:
[0047]
s1:采用试剂盒中的第一培养液将ips细胞培养形成spin eb;
[0048]
s1.1:将ips细胞按接种密度为50万/孔接种到铺了matrigel胶溶液的6孔板中;
[0049]
s1.2:培养ips细胞生长至80%融合度时,用生理盐水洗ips细胞2次,弃洗液;
[0050]
s1.3:加入预热的tryple select于培养箱中消化6min,后将ips细胞吹散成单个细胞,并转移到15ml离心管中;
[0051]
s1.4:在上述15ml离心管中加入5ml第四培养液,混匀,离心后弃上清液,用生理盐水洗一遍ips细胞;
[0052]
s1.5:用第一培养液重悬ips细胞,调整ips细胞的密度为20万/ml,得ips细胞液;
[0053]
s1.6:按100μl/孔将ips细胞液接种到96孔圆底孔板上,离心后将96孔圆底孔板转移至培养箱中培养6天,得spin eb液。
[0054]
s2:采用试剂盒中的第二培养液和第三培养液将spin eb诱导为nk细胞s2.1:按1ml/孔将3%明胶溶液加入6孔板中,在培养箱中静置1h,得到铺有明胶的6孔板,在其中加入第三培养液;
[0055]
s2.2:将spin eb液弃去大部分上清液后,加入到上述6孔板中;
[0056]
s2.3:培养6天后换成第二培养液,继续培养5天;
[0057]
s2.4:继续培养3周,在培养第14天起,每3天换一次第二培养液。
[0058]
测试例
[0059]
1.本测试例的参试对象为实施例1~3和对比例1~5中的nk细胞。
[0060]
cd3-细胞、cd56
细胞是nk细胞进行体外扩增培养主要检测的细胞免疫表型。本测试例采用流式细胞术检测方法:取s2中将spin eb诱导为nk细胞的诱导培养过程中第7天、14天、21天、后所获得的细胞样本5
×
105细胞/管,pbs洗涤2次。分别加入流式检测抗体进行双标记流式表型检测:fitc标记的鼠抗人cd3抗体和apc标记的鼠抗人cd56抗体;室温下孵育20min,pbs洗涤2次,细胞通过流式细胞仪进行分析。实验结果如表2所示;并统计细胞总数目,结果如表3所示。
[0061]
2.取实施例2中s2.4中诱导分化培养至第21天的细胞,用光学显微镜观察细胞形态,如图1所示。从图1可以看出实施例2在诱导培养21天后,形成了nk细胞集落,形成的nk细胞数目多、细胞呈堆样。
[0062]
表2 cd3-细胞、cd56
细胞在诱导培养过程中的比例
[0063][0064]
表3在诱导培养过程中细胞总数
[0065][0066]
以上实验结果表明,本发明提供的用于将ips细胞诱导为nk细胞的试剂盒能够顺利培养ips细胞形成spin eb,进一步地能够高效诱导分化为nk细胞,将ips细胞诱导为nk细胞的分化效率高、细胞数目多、细胞纯度高。
[0067]
以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照上述实施例对本发明进行了详细的说明,所属领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,但这些修改或替换均在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。