1.本发明涉及用于以工业规模培养悬浮细胞或微生物的生物反应器或发酵器。
背景技术:
2.在生物制药方法中,达到工业规模总是具有特殊意义。经常地,生物反应器体积的增加导致待培养细胞的细胞性能下降,这是因为培养条件的维持经常限制执行大规模培养的可能性。除了大规模生产外,必须满足制成品的质量标准,以及同时必须提供可靠的供应市场的能力。因此,总是期望减小或消除细胞培养性能的尺寸依赖性,以实现一致的高制品滴度和高制品产量。正如预期的那样,所提供的增加的生物反应器或发酵器体积的更高的容积利用率将导致生产率提高。
3.对于细胞的培养,确保理想的生长条件具有重要意义。在此方面,重要的是维持有利的物理化学环境,诸如被期望的溶解氧含量、培养物ph值、温度等等。然而,已知细胞对其环境产生代谢响应。尤其,浓度梯度可抑制大规模生物反应器中的细胞的细胞生长。此外,例如,ph值对周围的介质有重要影响。在搅拌的生物反应器或发酵器中,代谢活跃的细胞分泌co2(其溶解在周围的液体介质中),并从其环境中吸收o2,以完成细胞呼吸。例如,可观察到液体介质中的co2的以下反应(ph《8.0):
[0004][0005]
因此,co2进入生物反应器或发酵器的液相将由于ph值的降低而导致酸性环境。反之,co2的脱气会将使ph值升高。因此,经常的措施是经由气体供应或气体供应单元(称为“起泡器”),向生物反应器或发酵器提供氧气。
[0006]
因此,经常为了达到高制品质量和效率,必须确保恒定的氧供应以及通过所谓的(co
2-)剥离明确限定溶解二氧化碳的消耗。对任何尺寸的生物反应器或发酵器能够对待培养的任何细胞或微生物可靠地放大应该是可能的。
[0007]
生物反应器或发酵器中的常规的气体供应单元引起气泡进入液相(如果使用纯o2作为气体供应,则最初由纯o2组成)。在包含细胞或微生物的反应器中的气泡的停留和上升期间,o2从气相越过进入液相(反应(1)),反之亦然,在代谢反应中形成的co2从液相越过进入气相,即进入气泡(反应(2))。由于亨利定律常数(例如由christian sieblist et al.insights into large-scale cell-culture reactors:ii.gas-phase blend and co2stripping,biotechnol.j.2011,6,1547-1556定义),o2和co2的传递分别以不同的速率发生。
[0008]
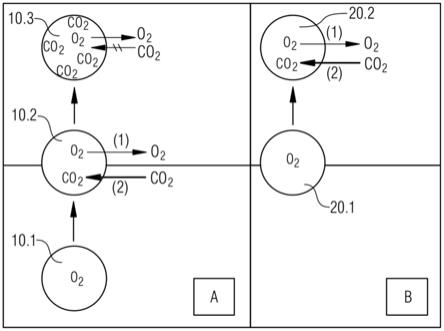
以说明的方式,在生物反应器或发酵器中发生的讨论中的过程和反应如图1所示。图1举例说明了溶解co2在具有气体供应的示意性生物反应器或发酵器中的分布,所述气体供应提供例如纯o2在底部处且靠近搅拌器(未示出)。图1中所示的气泡10在液体中上升时以3种不同的状态示出,即作为开始单纯的气泡10.1,在中部作为气泡10.2,在生物反应器或发酵器的上部作为气泡10.3。因此,从生物反应器的下部处的气体供应开始,含气泡10.1的o2开始上升到液体介质中的表面。在图1的中部示意性地示出了发生的过程和反应:o2气
体从气泡10.2越过进入液相(反应(1)),以及co2气体从液相越过进入气泡10.2(反应(2))。对o2气体和co2气体的亨利定律常数分别是显著不同的(sieblist等人;在上述引文中)。当在相同条件下测量时,对o2的值约为0.0013mol/(kg*bar),以及对co2的值约为0.034mol/(kg*bar);即约更高25番,即对co2的值更大,使得发生加速扩散。因此,与反应(1)的速率相比,反应(2)的速率快得多(其在图1中用不同粗细的箭头说明)。因为对co2的亨利常数高于对o2的相应值,气泡的二氧化碳浓度在通过反应器的路程中增加得比对o2的值减少得更快。结果是对co2传质的驱动力在气泡上升期间减小。
[0009]
事实上,气泡10可向液相供应氧数分钟,但由于co2饱和它的二氧化碳摄取在数秒内停止。当气泡被co2饱和时,它不再吸收二氧化碳。此在图1中以气泡10.3示出。几秒钟后,虽然气泡10.3仍向培养物提供氧,但它不再具有吸收co2的能力。因此,提供在生物反应器的液体介质中的气泡对co2剥离仅是部分时间活性的。因此,在生物反应器或发酵器内特定的上升高度后,气泡达到co2的饱和浓度。因此,在图1的上部,气泡10.3不再吸收co2气体,而只有o2气体从气泡10.3越过进入液相。因此,从图1的下部到上部,从状态10.1中的气泡经由状态10.2到状态10.3,进入液体介质的o2的递送减少,而气泡中的co2浓度增加,直到达到饱和浓度。此以三角形箭头在图1的右侧处示意性地示出,从宽部到箭头头部的箭头(3)象征o2向培养介质的相对递送趋势(即从气相进入液相)正在减少。图1中的箭头(4)象征从箭头头部到宽部,气泡被co2越来越饱和,由此,co2从液相越过进入气相,其比o2的递送进行的快得多。方块(5)示出了不再可能从液相吸收溶解co2进入气泡10.3的区域,因为气泡10.3已经达到了co2的饱和浓度。
[0010]
因此,在非常短的时间之后,气泡10.3被co2气体饱和,以及它不再能从液相中吸收更多的co2,但气泡10.3仍可释放o2气体进入液体环境。在永久提供气体供应的生物反应器或发酵器中,提供整个系列的气泡,其进入液相并促成液相内的co2的梯度。在下部,气泡有吸收co2的能力,该能力在气泡上升到顶部的过程中越来越丢失。
[0011]
尤其在大型生产生物反应器或发酵器中,从培养物中去除co2已知是主要问题,这是因为剥离主要受在其通过生物反应器或发酵器从气体供应系统朝向顶部的运动期间气泡的气体组成的变化的影响。
[0012]
因此,如上所述,o
2-浓度和co
2-浓度的管理在生物制药方法(尤其大规模生物制药方法)中具有特殊意义。为了开发一种策略,所述策略允许改进对大规模系统的co2的剥离的控制和调整,必须详细评价氧和二氧化碳的传质性能。与co2气体有关的要观察的参数是(体积)二氧化碳传质系数k
laco2
,其中,k
l
是对co2的输运系数,以及a是比界面面积,由此a=a/v
l
,即每培养体积v
l
的总传质横截面a(参见christian sieblist等人,在上述引文中)。与o2气体有关的要观察的参数是(体积)氧传质系数k
lao2
。传质系数可基于体积,以及然后是体积传质系数。
[0013]
此外,一方面,必须避免溶解co2的浓度水平过高,以及co2需要被剥离掉。大的生物反应器或发酵器(即具有大高度和因此长距离以用于气泡上升的那些)中co
2-剥离不充分经常导致溶解co2的积累,导致液相中的co2的浓度高,其抑制细胞生长和制品形成。另一方面,核酸的合成需要二氧化碳,且它的量必须不过少。因此,应记住,co2的剥离不应对待培养的细胞或微生物具有任何负面影响。
[0014]
因此,必须开发一策略来增强和允许对大规模系统控制和调整二氧化碳传质系数klaco2
,而不显著影响氧传质系数k
lao2
。
[0015]
为了考查和阐明co2和o2传质的相互关系,我们已执行了各种研究,以确认不同操作条件的影响。尤其,已详细考查在实验室规模和工业规模上co2的混合效率和传质性能。结果总结在图2和图3中。
[0016]
图2和图3示出了在两种不同的体积中,分别在实验室规模和工业规模上对不同的手动给定的表观气体速度w
0g
,二氧化碳的体积传质系数k
laco2
对体积搅拌器功率输入p/v的依赖。具体地,图2示出了在具有2l的体积(高度在cm范围)的充气搅拌生物反应器或发酵器中的实验室规模上的实验;图3示出了在具有12000l的体积(高度在m范围)的充气搅拌生物反应器或发酵器中的工业规模上的实验。
[0017]
正如可预期的那样,图2和图3示出了在两个实验中,即在实验室规模中和在工业规模中,二氧化碳的体积传质系数k
laco2
增加的程度与表观气体速度w
0g
增加的程度相同。另外,发现与工业规模方法相比,二氧化碳的传质性能在实验室规模上显著不同。然而,出乎意料的是,体积搅拌器功率输入对实验室规模具有重要影响,但对工业规模具有很小的影响。从图2和图3可看出,与实验室规模反应器相比,工业规模反应器的体积传质系数k
laco2
上至10倍低。
[0018]
为了更好地说明实验室规模和工业规模实验之间的差异,参考图4,其中示出了实验室规模和工业规模之间二氧化碳的传质系数k
laco2
的比较。图4示出了与在体积功率输入p/v=21w m-3
下测量的体积传质系数相比,比功率输入对体积二氧化碳传质系数的相对影响。在实验室规模和工业规模之间的体积二氧化碳传质系数k
laco2
的比较中,变得明显的是,对工业规模,传质性能不会随着增加体积功率输入p/v而显著提高,而在实验室规模上,co2的传质性能从21w m-3
到168w m-3
,可提高上至70%。因此,图4展示了在实验室规模(2l系统)中,随着搅拌器输入的增加,k
laco2
增加 70%,而在工业规模(12000l系统)中,可观察到k
laco2
仅增加 5%。
[0019]
因此,可以清楚看到,基于图2至图4,对工业规模生物反应器或发酵器,co2的传质性能不会随着增加体积功率输入p/v而显著提高,而在实验室规模上,co2的传质性能可提高上至70%(参见图4)。
[0020]
两个系统的不同行为基本上可通过在系统内的气相停留时间解释,正如上面已经解释的那样。在工业规模上,气泡和液体之间的co
2-浓度的平衡在气泡到达表面之前很久就达到了,而在实验室规模上,停留时间太短而无法达到平衡。因此,随着增加搅拌器频率提高界面面积导致实验室规模上的传质系数更高,而在大规模上,更强分散“死气泡”(即具有co2饱和的那些)是无用的。
[0021]
在氧传质的情况下,进一步的实验已示出即使在工业规模上,也达不到平衡。因此,体积功率输入越高,界面面积越大,以及因此体积传质系数k
lao2
越高。因此,得出结论:二氧化碳的体积传质系数仅能随着较高的气体流率而显著提高,但不能随着较高的体积功率输入而显著提高。
[0022]
在工业规模上,二氧化碳的剥离的困难主要与以下事实有关:仅在设置生物反应器或发酵器的底部上或接近底部的浸没气体供应上方不远,气相已经被二氧化碳饱和。因此,增加二氧化碳的传质性能显然最可行的选择是增加气体流率。然而,这也导致氧传质速率经常不想要的增加,以及因此在生物反应器或发酵器内独立管理o
2-浓度和co
2-浓度是不
vessels”,chemical engineering research and design,elsevier,amsterdam,nl,vol.75,no.5,1997,pp.487-496以及rewatkar v.b.等人.:“role of sparger design on gas dispersion in mechanically agitated gas-liquid contactors”,canadian journal of chemical engineering,1993,vol.71,no.2,pp.278-291。为了评价效果,仅使用单起泡器。反应器中两个起泡器同时存在以及它们之间的距离是不相关的,且未提及。
[0029]
因此,本发明的一个目的是克服现有技术的缺陷,并提供修正的生物反应器或发酵器,其允许在工业规模上的充气搅拌生物反应器或发酵器内,独立于氧浓度,管理二氧化碳浓度。
[0030]
此外,另外的目的是提供通过在工业规模上的充气搅拌生物反应器或发酵器内二氧化碳浓度和氧浓度的独立管理,控制细胞培养或发酵过程的方法。
技术实现要素:
[0031]
惊人地,发现来自现有技术的已知的缺点可以被克服,尤其当第二气体供应(或可选地更多的气体供应)布置在生物反应器内距第一气体供应预先限定的距离处时,可实现工业规模充气搅拌生物反应器或发酵器中o
2-浓度和co
2-浓度的独立管理。
[0032]
因此,为了克服上面提到的缺点,提供了修正的并由此改进的生物反应器或发酵器,用于以工业规模在液体介质中培养悬浮细胞或微生物。根据本公开的用于以工业规模在液体介质中培养悬浮细胞或微生物的生物反应器或发酵器100包括
[0033]
容器102,其包含在具有确定填充高度的液体介质中的培养物;
[0034]
搅拌器120,其设置在容器中以搅拌液体介质;
[0035]
第一起泡器150,其布置在容器102的底部部分105中,被设置为连续地向液体介质供应气泡10、10.1、10.2、10.3,气体选自空气和/或氧气;以及
[0036]
第二起泡器160,其布置在容器102中,并设置在第一起泡器150上方,以连续地向液体介质供应附加的空气泡和/或附加的氧气泡20、20.1、20.2、20.3,
[0037]
由此
[0038]
第二起泡器160位于生物反应器或发酵器100中第一起泡器150上方距离η的位置处,由此η被选择为在以下范围内:从至少第一起泡器150上方约0.4m到至多生物反应器或发酵器100的填充高度下方约0.5m,或
[0039]
第一起泡器上方约0.4m至生物反应器或发酵器100的填充高度的约2/3,或
[0040]
第一起泡器上方约0.4m至生物反应器或发酵器100的填充高度的约1/2,或
[0041]
第一起泡器上方约0.4m至第一起泡器上方约3.0m,或约0.4m至约2.5m,或约0.4m至约2.0m,或约0.4m至约1.5m,或约0.4m至约1.0m,或约0.45m至约0.90m,或约0.5m至约0.80m,或约0.55m至约0.70m,或在约0.6m处。
[0042]
因此,为了提高co2的传质性能,由此同时o2的传质性能不受不利影响,根据本发明,附加的第二气体起泡器设置在在生物反应器或发酵器内第一起泡器上方距离η的位置处,以实现所供应的附加的气体的停留时间短得多(与从浸没起泡器或第一起泡器提供的气体相比)。由于由第二起泡器注入的气体的停留时间短,较少量的氧被传递到液相,而越来越多的co2可被剥离。
[0043]
根据实施方式,第二起泡器可以是侧起泡器,即在侧壁附近提供附加的气泡的起
泡器。
附图说明
[0044]
将参考附图以示例的方式描述现有技术和本发明的实施方式,所述附图是示意性的且不旨在按比例绘制,使得不能做出关于原始尺寸的精确的几何值的假设。本公开的图被并入说明书,并构成说明书的一部分,也说明了本发明的实施方式,但不限于所描述的特定的实施方式。绘图同总体描述和详细描述一起用于解释本公开的原理。在所有图中,相同的特征由相同的参考符号表示。在图中:
[0045]
图1示出了在生物反应器或发酵器中的气泡中发生的关于o2和co2的分布的过程和反应的示意性说明;
[0046]
图2示出了在实验室规模上,对不同表观气体速度w
0g
,二氧化碳的体积传质系数k
laco2
对体积搅拌器功率输入p/v的依赖;
[0047]
图3示出了在工业规模上,对不同表观气体速度w
0g
,二氧化碳的体积传质系数k
laco2
对体积搅拌器功率输入p/v的依赖;
[0048]
图4示出了基于图2和图3中获得的值,实验室规模和工业规模之间二氧化碳的传质系数k
laco2
的比较;
[0049]
图5示出了根据本公开的示例性实施方式,在生物反应器或发酵器中的气泡10中发生的关于o2和co2的分布的过程和反应的示意性说明,没有附加的气体注入时(部分a)以及有附加的气体注入时(部分b;气泡20);
[0050]
图6a分别图示了根据本公开的示例性实施方式的生物反应器或发酵器中的第一起泡器150和第二起泡器160的位置;
[0051]
图6b分别图示了根据本公开的示例性实施方式的生物反应器或发酵器中的第一起泡器150、第二起泡器160和第三起泡器170的位置;
[0052]
图7示出了根据本公开的示例性实施方式的起泡器150、160、170的类型;
[0053]
图8在实施例部分(实施例1)中进行了解释,并示出了根据本公开的示例性实施方式,从饱和度c
co2
=14%至c
co2
=6%的k
laco2
值的说明性评价;
[0054]
图9在实施例部分(实施例2)中进行了解释,并示出了根据本公开的示例性实施方式的工业规模的生物反应器的垂直截面示意图的技术图和附加的第二起泡器(160)的安装位置;
[0055]
图10在实施例部分(实施例2和实施例3)中进行了解释,并表示了根据现有技术以及本公开的示例性实施方式,为确定氧的传质系数(k
lao2
)对气体流率的依赖而执行的四次测量的比较;
[0056]
图11在实施例部分(实施例3)中进行了解释,并表示了根据现有技术以及示例性实施方式,为确定二氧化碳的传质系数(k
laco2
)对气体流率的依赖而执行的四次测量的比较;
[0057]
图12a在实施例部分(实施例3)中进行了解释,并示出了根据本公开确定对氧的传质系数(k
lao2
)的影响因子c
o2
;
[0058]
图12b在实施例部分(实施例3)中进行了解释,并示出了根据本公开确定对二氧化碳的传质系数(k
laco2
)的影响因子c
co2
;
[0059]
图13a在实施例部分(实施例4)中进行了解释,并示出了根据现有技术以及本公开的示例性实施方式,使用侧起泡器型a或侧起泡器型b确定氧的传质系数(k
lao2
)对气体流率的依赖而执行的四次测量的比较;
[0060]
图13b在实施例部分(实施例4)中进行了解释,并示出了根据现有技术以及本公开的示例性实施方式,使用侧起泡器型a或侧起泡器型b确定二氧化碳的传质系数(k
laco2
)对气体流率的依赖而执行的四次测量的比较;
[0061]
图14a在实施例部分(实施例5)中进行了解释,并示出了为确定二氧化碳的传质系数(k
laco2
)对搅拌器频率和浸没气体流率的依赖而执行的测量;
[0062]
图14b在实施例部分(实施例5)中进行了解释,并示出了为确定氧的传质系数(k
lao2
)对搅拌器频率和浸没气体流率的依赖而执行的测量;
[0063]
图15a在实施例部分(实施例5)中进行了解释,并示出了为确定二氧化碳的传质系数(k
laco2
)对搅拌器频率和侧气体流率的依赖而执行的测量;
[0064]
图15b在实施例部分(实施例5)中进行了解释,并示出了为确定氧气的传质系数(k
lao2
)对搅拌器频率和侧气体流率的依赖而执行的测量;
[0065]
图16a在实施例部分(实施例6)中进行了解释,并说明了阶跃响应方法,尤其是系统的输入;
[0066]
图16b在实施例部分(实施例6)中进行了解释,并说明了阶跃响应方法,尤其是系统的输出;
[0067]
图17在实施例部分(实施例6)中进行了解释,并举例说明了在阶跃响应测量中使用的气泡捕集器(漏斗)180;
[0068]
图18在实施例部分(实施例6)中进行了解释,并示出了从应用于12kl充气搅拌釜反应器的阶跃响应方法的典型输入和输出信号;
[0069]
图19在实施例部分(实施例6)中进行了解释,并示出了由100%和50%输入阶跃导致的在气泡捕集器(漏斗)180处的阶跃响应的比较;
[0070]
图20在实施例部分(实施例6)中进行了解释,并示出了与工业规模的生物反应器或发酵器(12000l)相比,在实验室规模的生物反应器或发酵器(30l)中,由阶跃函数响应方法(在实施例部分解释为“sprungantwortmethode”)确定的气相停留时间的测量的结果;以及
[0071]
图21在实施例部分(对照例1)中进行了解释,并示出了在商业上可获取的12000l生物反应器(由此,生物反应器仅包括一个起泡器)中,在常规的补料-分批过程中培养抗体衍生物11天的活细胞密度、细胞活性、滴度和co2的分压的结果。
[0072]
在本说明书的末尾提供了一些图的详细图例。
具体实施方式
[0073]
本文中未具体限定的术语应被给予根据本公开和上下文由本领域技术人员给予它们的意义。
[0074]“生物反应器”是一装置或仪器,在所述装置或仪器中,活的生物体以及尤其细菌和真核细胞生长和/或合成有用的物质,由此消耗培养介质中的营养物,以及在有氧细胞或微生物的情况下,消耗由技术装置(如起泡器)提供的o2。在本公开中,生物反应器是工业规
模的生物反应器。生物反应器可由生物相容性容器组成或包括生物相容性容器,在所述生物相容性容器中,执行化学或生化方法,其涉及生物体和/或源自这些生物体的生化活性物质。生物反应器使用附加设备,例如搅拌器、挡板、一个或多个起泡器(作为例如本发明的主题)和/或端口,所述附加设备尤其允许细胞的培养和繁殖。一般生物反应器是以圆柱形管的形式,具有两个端部,端部形成生物反应器的顶部和底部。生物反应器的尺寸范围从升到立方米,且经常由不锈钢制成。根据本公开的生物反应器用于大规模生产中。
[0075]
培养的细胞,尤其真核细胞(如中国仓鼠卵巢(cho)或酵母细胞)例如被用于生产抗体,诸如单克隆抗体和/或重组蛋白,诸如用于治疗用途的重组蛋白。可替代地,细胞可产生例如肽、氨基酸、脂肪酸或其他有用的生化中间体或代谢物或任何其他有用的物质。
[0076]“发酵器”是微生物在其中合成有用物质,由此维持适合微生物的生长条件的装置或仪器。上面提到的生物反应器的细节经必要修改后参照应用。本公开的发酵器用于大规模发酵中。大规模发酵器的已知商业制品是例如由这些细胞或微生物合成的抗生素、抗体、激素或酶。
[0077]
产生的微生物可用于不同的目的,诸如废水处理,在食品工业中用于食物的生产,在生物技术部门中用于药物(诸如抗生素或胰岛素)的制造、在害虫防治中或在废物、污染物(例如油污)的生物降解中。
[0078]
在本公开中,表述“工业规模”或“大规模”可互换地且同义地使用,以及涉及以大生产量获得的制品,由此经常存在成本优势,每单位输出的成本随着规模增加而降低。在所有其他因素相等的情况下,大制造单位比小单位预期具有更低的每单位输出的成本。与细胞的培养有关时,工业规模可理解为具有所使用的生物反应器的体积等于或大于约2000l。与微生物的培养有关时,工业规模可理解为具有所使用的发酵器的体积等于或大于约1000l。根据一另外的实施方式,用于工业规模的生物反应器或发酵器的体积可等于或大于6000l、8000l、10000l、12000l、15000l或甚至更多。
[0079]“搅拌器”是用于搅拌的物体或机械装置,诸如磁力搅拌器。普遍用于细胞或微生物的培养的任何种类的搅拌器可被使用。可使用的搅拌器是例如叶轮、拉什顿涡轮机、搅拌桨、叶片搅拌器例如斜桨式搅拌器等等。
[0080]“起泡器”是在生物反应器或发酵器中使用的气体供应或进料装置,其提供氧和/或空气泡进入液相,以及其存在于细胞或微生物在其中培养的液相中。根据现有技术的生物反应器或发酵器仅具有一个起泡器,其经常定位于其底部上或靠近其底部。在本公开中,此起泡器也被指定为“第一起泡器”或“浸没起泡器”,这两种表述方式可互换地且同义地使用。
[0081]
根据本公开,已经发现提供另外的起泡器(即第二起泡器,其定位在第一起泡器上方预先限定的距离η处,并连续地向液体介质供应附加的空气泡和/或附加的氧气泡)对培养过程具有多种优点,从前面和下面的描述中,对于本领域技术人员来说,这将是明显的。
[0082]
下面更详细地描述在根据本公开的生物反应器或发酵器中发生的过程和反应。
[0083]
在仅一个气体供应装置(经常在生物反应器或发酵器的下部或底部)存在的生物反应器或发酵器中,进入液相的气泡具有从细胞培养介质中吸收co2的能力,但这种能力在气泡上升的过程中越来越丢失。在生物反应器或发酵器的上部或顶部,不再发生气泡从液相中吸收溶解co2,这取决于如上所解释的高度。因此,co2含量从生物反应器或发酵器的底
部到顶部是增加的,由此导致液相内的co2的梯度。
[0084]
常态地存在于生物反应器或发酵器的液相中的co2梯度以及与co2的这种不均匀分布相关的缺点可通过本公开克服,根据本公开,第二起泡器设置在大规模的生物反应器或发酵器的液相中第一起泡器上方,以距离η与第一起泡器间隔开。第二起泡器设置为抵消建立不再能吸收co2的气泡的co2饱和。第二起泡器添加新的气泡进入液相,使得越过o2和co2的过程可在第一起泡器上方附加地再次进行。
[0085]
以说明的方式,在大规模中的生物反应器或发酵器中的液相中发生的讨论中的过程和反应在图5中示意性地示出。图5左边部分a举例说明了在示意性生物反应器或发酵器(仅具有一个气体供应装置或起泡器,靠近于搅拌器(未示出))中的溶解co2的分布。起泡器位于生物反应器或发酵器的底部处或附近。仅用一个起泡器的标准充气清楚地导致co2梯度。在已经达到特定的高度后,气泡10.2被co2饱和。因此,在图5的下部(部分a),co2的剥离性能是好的,而在上部,co
2-剥离是差的且不可接受的。
[0086]
图5右边部分b说明了在大规模中的示意性生物反应器或发酵器中的溶解co2的分布,这是由于设置在第一起泡器上方的附加的第二气体供应装置或第二起泡器的结果。正如可从图5部分b导出的,第二起泡器提供气泡20.1,该气泡在液体介质中开始它的上升至表面。如在气泡20.2中所示,o2气体从气泡20.2越过进入液相(反应(1)),而co2气体从液相越过进入气泡20.2(反应(2)),由此,由于不同的亨利常数,与反应(1)的速率相比,反应(2)的速率快得多(其在图5中用不同粗细的箭头说明)。因此,在部分b中的液相的中部和上部的co2的剥离类似于在部分a中正如图5的左侧所示的液相的下部的co
2-剥离。因此,避免了液体介质中通过整个上升高度的co2梯度。存在于生物反应器或发酵器中的细胞或微生物将经历更一致的环境,并将受到液体介质的更小程度的波动(其可在细胞或微生物的代谢反应中反映出来)。
[0087]
第二起泡器设置在第一起泡器上方,以便以这种的方式缩短气泡的绝对上升高度,以避免气泡在其上升通过液相期间可能被co2饱和。除此之外,源自第二起泡器的气泡在液相内的停留时间减少,气泡相对较快地上升到液体表面,因为它没有被搅拌器分散。因此,在生物反应器或发酵器的上部,co
2-剥离性能也是好的。
[0088]
根据一另外的实施方式,第三起泡器和另外的起泡器也可存在于第二起泡器等上方,使得3个起泡器、4个起泡器或更多起泡器同时存在于生物反应器或发酵器中。上述对第二起泡器的解释相应地应用于第三起泡器、第四起泡器、第五起泡器和另外的起泡器。
[0089]
因此,大规模生物反应器或发酵器被细分为不同的子隔间,在子隔间的每个中布置起泡器,以便对液相中的co2分布具有直接影响。大规模生物反应器或发酵器在较小单元中的此种“分隔”使得可比性提高,以及因此相对于实验室规模,以工业规模培养的可预测性提高以及反之亦然,有利地带有代谢率提高,活性增加和/或生产率增加。
[0090]
尽管使用了大体积,在大生产规模中运行的生物反应器或发酵器内设置第二起泡器或可选的第三起泡器和另外的起泡器会影响待培养的细胞或微生物的物理化学环境条件的协调。因此,本概念是使工业规模适配于实验室规模的方法,其中,co2分布在整个液相上更加均匀。
[0091]
此外,由于第二起泡器或可选的第三起泡器和另外的起泡器的存在,液相中的溶解co2浓度可降低到合适的浓度或水平。应记住co2浓度影响细胞培养性能,尤其在较高浓度
时,由此,高co2浓度抑制有氧细胞的生长(参见david r.grayet al.,co
2 in large-scale and high-density cho cell perfusion culture,cytotechnology 1996,22,65-78),必须避免细胞培养介质本身中的高co2浓度。第二起泡器和附加的第三起泡器或附加的另外的起泡器帮助阻止在液相中出现这种不被期望的高co2含量。
[0092]
此外,附加的第二起泡器以及第三起泡器和另外的起泡器(其连续地向液体介质供应附加的空气泡和/或附加的氧气泡)也导致o2分布在整个液相上更加均匀。
[0093]
因此,根据一另外的实施方式,可存在设置在第一起泡器、第二起泡器和第三起泡器上方的(一个或多个)另外的起泡器。
[0094]
已经发现考虑到液相中的o
2-浓度和co
2-浓度的管理,第二起泡器和另外的起泡器的位置可对培养的性能和效率产生积极影响。
[0095]
假设第一起泡器位于生物反应器或发酵器的底部或下部处或附近,第二起泡器总是位于第一起泡器上方,例如在生物反应器或发酵器的中部或上部。为了进一步验证第二起泡器的位置,实质上存在两个主要方向来改变第二起泡器在大规模中的生物反应器或发酵器内的位置。一个主要方向是垂直方向,即从生物反应器或发酵器的底部到顶部改变起泡器的位置。也就是说,第二起泡器可定位在例如更靠近生物反应器或发酵器的底部或更靠近生物反应器或发酵器的顶部或在它们之间的任何距离处。在此方面,必须观察生物反应器或发酵器的填充高度而非其绝对体积,因为气泡将被提供在存在的液相内。
[0096]
根据本发明的实施方式,生物反应器或发酵器包括以下范围内的填充高度:从约8m至约20m、或约9m至约15m、或约9.5m至约12m或约10m。
[0097]
可考虑在内的第二主要方向是水平方向,即起泡器的位置在生物反应器或发酵器的侧壁和中央轴线之间。中央轴线是生物反应器或发酵器内的虚线,所述生物反应器或发酵器被推测为具有圆柱形几何形状,以及其到周围侧壁的间距处处相等或几乎处处相等。也就是说,第二起泡器可定位在例如更靠近侧壁或更靠近生物反应器或发酵器的中央轴线或在它们之间的任何距离处。
[0098]
根据一另外的实施方式,连续起泡器可在垂直方向上准确地定位一个在另一个之上。根据另一实施方式,连续的起泡器也可关于垂直方向彼此横向转移地定位。
[0099]
因此,根据本发明,第二起泡器位于生物反应器或发酵器的容器内,距第一起泡器距离η的位置处。距离η应理解为垂直距离,例如沿着生物反应器或发酵器的侧壁,使得第二起泡器位于第一起泡器上方距离η处。距离η被选择为在以下范围内:从至少第一起泡器上方约0.4m到至多生物反应器或发酵器的填充高度下方约0.5m,或
[0100]
第一起泡器上方约0.4m至生物反应器或发酵器填充高度的约2/3,或
[0101]
第一起泡器上方约0.4m至生物反应器或发酵器填充高度的约1/2,或
[0102]
约0.4m至约3.0m,或约0.4m至约2.5m,或约0.4m至约2.0m,或约0.4m至约1.5m,或
[0103]
分别在第一起泡器上方约0.4m至约1.0m,或约0.45m至约0.90m,或约0.5m至约0.80m,或约0.55m至约0.70m,或在约0.6m处。
[0104]
因此,第一起泡器和第二起泡器之间的距离η具有第一起泡器上方约0.4m的下限和生物反应器或发酵器的填充高度下方约0.5m的上限。表述“填充高度”(其与“液体高度”同义使用)应理解为意思是:在培养过程开始时,存在于生物反应器或发酵器中的液体的填充水平,其进一步由液体的表面或存在的液体的标称体积限定。因此,生物反应器或发酵器
的填充高度下方0.5m与培养过程开始时存在于生物反应器或发酵器中的液体的表面下方0.5m同义。
[0105]
如果例如总填充高度为10m,则填充高度下方0.5m为9.5m。然后,在从约0.4m至约9.5m的范围内选择距离η。此范围的下限和上限被认为是本发明的临界值。
[0106]
生物反应器中的两个起泡器的存在本身增加了液体介质中将发生co
2-剥离的区域。如果第二起泡器放置在液体的表面附近,例如生物反应器或发酵器的填充高度下方约0.5m,它可剥离下游区域,而放置在生物反应器的底部附近的第一起泡器可剥离液体介质的上游区域。总之,生物反应器或发酵器的整个填充高度都经受co
2-剥离。
[0107]
距离η可被选择为在从第一起泡器上方约0.4m至生物反应器或发酵器的填充高度的约2/3的范围内。表述“生物反应器或发酵器的填充高度的约2/3”应理解为意思是:第二起泡器位于达到总填充高度的约2/3的位置处。如果例如总填充高度为12m,则总填充高度的2/3为8.0m。然后,在从约0.4m至约8.0m的范围内选择距离η。
[0108]
距离η也可被选择为在从第一起泡器上方约0.4m至生物反应器或发酵器的填充高度的约1/2的范围内。表述“生物反应器或发酵器的填充高度的约1/2”应理解为意思是:第二起泡器位于总填充高度的约1/2或液体体积的约0.5倍存在的位置处。如果例如总填充高度为11m,则总填充高度的1/2为5.5m。然后,在从约0.4m至约5.5m的范围内选择距离η。
[0109]
距离η也可被选择为在以下范围内:从约0.4m至约3.0m,或约0.4m至约2.5m,或约0.4m至约2.0m,或约0.4m至约1.5m,或约0.4m至约1.0m,或约0.45m至约0.90m,或约0.5m至约0.80m,或约0.55m至约0.70m,或在约0.6m处。因此,距离η可被选择为分别在第一起泡器上方约3.0m、约2.9m、约2.8m、约2.7m、约2.6m、约2.5m、约2.4m、约2.3m、约2.2m、约2.1m、约2.0m、约1.9m、约1.8m、约1.7m、约1.6m、约1.5m、约1.4m、约1.3m、约1.2m、约1.1m、约1.0m、约0.95m、约0.90m、约0.85m、约0.80m、约0.75m、约0.70m、约0.65m、0.6m、约0.55m、约0.45m和约0.4m。
[0110]
在另外的实施方式中,距离η可被选择为在以下范围内:从至少第一起泡器上方约0.6m到至多生物反应器或发酵器的填充高度下方约0.5m,或
[0111]
第一起泡器上方约0.6m至生物反应器或发酵器的填充高度的约2/3,或
[0112]
第一起泡器上方约0.6m至生物反应器或发酵器的填充高度的约1/2,或
[0113]
第一起泡器上方约0.6m至约3.0m,或第一起泡器上方约0.6m至约2.5m,或第一起泡器上方约0.6m至约2.0m,或第一起泡器上方约0.6m至约1.5m,或
[0114]
第一起泡器上方约0.6m至约1.0m,或第一起泡器上方约0.6m至约0.90m,或第一起泡器上方约0.6m至约0.80m,或第一起泡器上方约0.6m至约0.70m,或在第一起泡器上方约0.6m处。
[0115]
后跟一值的术语“约”应理解为意思是:所述值
±
5%、或所述值
±
4%、或所述值
±
3%、或所述值
±
2%、或所述值
±
1%。
[0116]
为了确定距离η,当然地,起泡器的气体出口开口的位置(即气泡进入液相的开口)是关键标准。如果一个起泡器中存在几个开口,则可用平均值来确定合适的距离。
[0117]
上面提到的距离η的范围和值是执行的各种实验、计算和评估的结果,根据执行的各种实验、计算和评估,第二起泡器设置在生物反应器或发酵器中,距第一起泡器一距离或在第一起泡器上方的上升高度,在所述距离处,气泡已经达到或将很快达到co2气相饱和浓
度。
[0118]
基于以下考虑,已对工业规模充气搅拌生物反应器或发酵器的高度上的co2气相饱和浓度执行了评估:
[0119]
根据我们的实验(参见图2至图4),在12000l的工业规模充气搅拌生物反应器或发酵器中二氧化碳的体积传质系数k
laco2
比实验室规模(2l)中二氧化碳的体积传质系数k
laco2
低约十倍。相反,对两种系统的体积氧传质系数k
lao2
的量是可比较的。
[0120]
如已知的以及与氧传质相反的,从连续液相进入气相的二氧化碳的传质已经在短时间段后完成。如果在系统中的气相停留时间长于该时间段,直到出现气泡的饱和,则这些气泡不再可用于co2传质。因此,此影响仅出现在工业规模的反应器中,而不在实验室规模中。
[0121]
为了评估时间段(在所述时间段后,在操作期间工业规模系统(例如12000l)中,气泡已被co2饱和,其中,气泡不再有助于co2的剥离),特定的空间边界界面以及co2传质系数k
laco2
必须被考虑在内。
[0122]
因此,首先对气相的停留时间分布做如下评估:
[0123]
气相停留时间已通过阶跃响应方法(“sprungantwortmethode”)确定,如实验部分中详细解释的。详细结果在实验部分中给出。阶跃函数响应方法基于2种不同的气体的使用,一种气体(诸如氧)用于使液体(诸如水)饱和,以及另一种气体(诸如二氧化碳或氮气)用于代替它,并将它驱出液相之外。气体的添加从生物反应器或发酵器的底部进行,以及在液相内反应器的顶部附近测量被驱出的气体。本领域技术人员熟悉此种测量气相停留时间的方法。
[0124]
因此,使用阶跃函数响应方法,实验室规模(30l)的生物反应器或发酵器的气相停留时间已被确定为5s,以及工业规模(12000l)的生物反应器或发酵器的气相停留时间已被发现为21s。
[0125]
然后,根据实验部分中描述的进一步实验测量和评估,co2的传质系数在实验室规模的生物反应器或发酵器(2l)中已被确认为4
±
0.68h-1
。
[0126]
在12000l系统中气泡的尺寸的单分散分布为d=5mm的假设下,可计算单个气泡中的理论二氧化碳剖面。在二氧化碳传质系数k
laco2
=4
±
0.68h-1
也适用于工业规模的假设下,可计算气泡中co2的浓度剖面,如下:
[0127][0128]
从实施例6中所示的实验(由图20说明)可推断在约3.5s后,可观察到约95%的气泡饱和度。
[0129]
基于根据相同的实施例的工业规模生物反应器或发酵器中测量的平均气相停留时间约为21s(图20)和确定的由气泡旅行的总距离为3.6m,平均气泡上升速度可被确定(速度=距离/时间)为0.17m/s。因此,在约h=0.6m(3.5s
×
0.17m/s)的高度后,气相被co2饱和,以及因此不再能观察到co2的剥离。
[0130]
因为上述评估、测量和计算包括一些评价和估计,所获得的0.6m的结果仅仅是对距离η的近似值,所述距离η更好地由以下范围表示:从至少第一起泡器上方约0.4m到至多生物反应器或发酵器的填充高度下方约0.5m。
[0131]
另外,已在实验中发现以距离η设置的第二起泡器的存在对于以工业规模在液体介质中培养悬浮细胞或微生物具有特别的优点。可预期的是,第二起泡器(其位于第一起泡器上方距离η处,所述距离η在上述范围内选择)的存在将对co2剥离具有积极影响。第二起泡器的存在可假设为产生生物反应器或发酵器的培养物(液体介质)中的co2的分压的降低。也就是说,两个生物反应器/发酵器与彼此比较,由此,两个在相同条件下用相同的液体介质操作,以及分别培养相同的细胞或微生物,两个生物反应器/发酵器之间的唯一区别是在一个生物反应器/发酵器中使用一个起泡器(以及因此反映技术的现状),以及在根据本发明的另一个生物反应器/发酵器中使用位于距离η的两个起泡器。然后,可预期的是,与具有一个起泡器的生物反应器/发酵器相比,在具有两个起泡器的生物反应器/发酵器中,co2的分压降低至少约0.5%,或至少约1%,或至少约2%上至约20%。co2的分压降低的程度可基于使用一个起泡器执行的实验(参见对照例1和图21),结合评价测量(其中,已使用两个起泡器(参见实施例2至6),这允许得出关于存在于生物反应器或发酵器的下部、中部和上部的o2和co2的含量的结论)来估计。
[0132]
此外,如果存在第二起泡器(正如根据本发明),与仅使用一个起泡器的生物反应器或发酵器相比,可预期更高的制品滴度和更高的制品产量。所生产的制品滴度和制品产量可被推测为至少约1%、或至少约5%、或至少约10%上至约30%高于在相同条件下操作的仅使用一个起泡器的相同生物反应器或发酵器中。制品滴度或产量的程度可基于使用一个起泡器执行的实验(参见对照例1和图21),结合评价测量(其中,已使用两个起泡器(参见实施例2至6),这允许得出关于存在于生物反应器或发酵器的下部、中部和上部的o2和co2的含量的结论)来估计。应注意的是,在大规模上商业使用的方法中的一个小改进也代表一个值得解决的技术问题。假定有代表性的大规模生物反应器的总体积为10000l或更多,每ml具有数百万的例如蛋白质生产细胞,即使在产量或其他工业特征中的小改进也意味着在大规模生产中非常相关的改进,以及必须被视为重要的。
[0133]
因此,根据本发明已经发现在所述一个范围或多个范围内选择距离η具有显著的优点和技术效果或益处,尤其生物反应器的培养物(液体介质)中co2的分压的降低以及制品滴度的增加将分别发生。
[0134]
根据本发明的生物反应器或发酵器中两个起泡器的存在增加液体介质中将发生co
2-剥离的总区域。第二起泡器可放置在距离η处,由此可选择η,使得由第一起泡器和第二起泡器执行的co
2-剥离的区域重叠到一定程度。一方面,可预期的是,增加起泡器的区域的重叠的程度将显著提高有利影响。另一方面,如果两个起泡器靠得太近,诸如距离η小于0.4m或小于0.3m或甚至更小,第二起泡器将最可能提供越来越小的附加影响到第一起泡器。
[0135]
如果距离η被选择为在从第一起泡器上方约0.4m至生物反应器或发酵器的填充高度的约2/3的范围内,可预期的是,有利的技术效果将变得更加突出。
[0136]
如果距离η被选择为在从第一起泡器上方约0.4m至生物反应器或发酵器的填充高度的约1/2的范围内,可预期的是,有利的技术效果将变得更加突出。
[0137]
如果距离η被选择为在以下范围内:从第一起泡器上方约0.4m至约3.0m,或更优选从第一起泡器上方约0.4m至约2.5m,或第一起泡器上方约0.4m至约2.0m,或第一起泡器上方约0.4m至约1.5m,或最优选从第一起泡器上方约0.4m至约1.0m,或第一起泡器上方约
0.45m至约0.90m,或第一起泡器上方约0.5m至约0.80m,或在第一起泡器上方约0.55m至约0.70m,或在第一起泡器上方约0.6m处,可预期的是,有利的技术效果将变得尤其强。
[0138]
因此,第一起泡器和第二起泡器和所有的另外的起泡器(如果存在的话)之间分别的距离η被选择为在如上所述的一个或多个范围内。
[0139]
因此,如果存在几个起泡器,在一个实施方式中,第二起泡器可位于第一起泡器上方0.4m至10m的距离η
1,2
处;第三起泡器可位于第二起泡器上方0.4m至10m的距离η
2,3
处等。为了区分不同的距离之间,第一起泡器和第二起泡器之间的距离η被指定为η
1,2
,第二起泡器和第三起泡器之间的距离指定为η
2,3
等。
[0140]
因此,两个连续,即一个布置在另一个上方的,起泡器之间的距离可被选择为η。
[0141]
距离η在存在的所有起泡器之间可以是相同的或不同的,但它总是选自所公开的范围。
[0142]
为了更好地理解,提出以下示例:
[0143]
生物反应器或发酵器包括容器并具有10m的填充高度。第一起泡器存在于靠近生物反应器或发酵器的底部。第二起泡器可位于发酵器的生物反应器中第一起泡器和第二起泡器之间的距离η(也指定为η
1,2
)处,由此,距离η
1,2
被选择为与第一起泡器间隔开约0.6m(分别确定为两个起泡器开口之间的距离,其中气泡进入液相)。第三起泡器位于第二起泡器和第三起泡器之间的距离为η
2,3
的位置处。在此示例中,η
2,3
也相当于0.6m。也就是说,第二起泡器位于第一起泡器的位置上方0.6m,以及第三起泡器位于第二起泡器上方0.6m。因此,第三起泡器位于第一起泡器上方2
×
η处。因此,起泡器之间的η
1,2
和η
2,3
同样大。存在的另外的起泡器可具有可以是η
3,4
,η
4,5
,η
5,6
,
…
的距离。
[0144]
然而,并不要求所有距离都具有相同的值,但可从上面公开的范围中彼此独立地选择。换言之,η
1,2
,η
2,3
,η
3,4
,η
4,5
,η
5,6
,
…
可彼此独立地选择以及可以是相同的或不同的。
[0145]
根据第二主方向,第二起泡器可位于更靠近生物反应器或发酵器的侧壁或更靠近生物反应器或发酵器的中央轴线,使得从第二起泡器提供的空气泡和/或氧气泡进入液相,更靠近侧壁或更靠近生物反应器或发酵器的中央轴线。
[0146]
根据另一的实施方式,第二起泡器也可位于起泡器同时具有到生物反应器或发酵器的侧壁和中央轴线相同距离的位置处。
[0147]
因此,根据一实施方式,(一个或多个)起泡器可以是中央起泡器或侧起泡器。
[0148]
在本公开中,“中央起泡器”必须被理解为,从某种意义上说,中心起泡器以一方式被设计,所述方式使得从起泡器提供的空气泡和/或氧气泡进入液相,关于水平方向更靠近中央轴线,而不是靠近生物反应器或发酵器的侧壁。
[0149]
在本公开中,“侧起泡器”必须被理解为这样的起泡器,其以一方式被设计,所述方式使得空气泡和/或氧气泡被提供关于水平方向更靠近侧壁,而不是靠近生物反应器或发酵器的中央轴线。
[0150]
根据一实施方式,第一起泡器可以是中央起泡器或侧起泡器。
[0151]
根据另一实施方式,第一起泡器可以是中央起泡器,以及第二起泡器可以是中央起泡器。
[0152]
根据另一实施方式,第一起泡器可以是中央起泡器,以及第二起泡器可以是侧起泡器。
[0153]
根据一另外的实施方式,第一起泡器和第二起泡器可分别是侧起泡器。
[0154]
根据一实施方式,可选的第三起泡器可以是中央起泡器或侧起泡器。
[0155]
根据另一实施方式,第一起泡器可以是中央起泡器,以及第二起泡器可以是中央起泡器,以及可选的第三起泡器可以是中央起泡器。
[0156]
根据另一实施方式,第一起泡器可以是中央起泡器,以及第二起泡器可以是侧起泡器,以及第三起泡器可以是侧起泡器。
[0157]
根据另一实施方式,第一起泡器可以是中央起泡器,以及所有其他的起泡器可以是侧起泡器。
[0158]
根据另一实施方式,第一起泡器可以是侧起泡器,以及所有其他的起泡器可以是侧起泡器。
[0159]
在一实施方式中已经发现如果第二起泡器是侧起泡器,如本文所公开的有利技术效果可显著增加。
[0160]
根据另一实施方式,第二起泡器可以一方式构造,所述方式使得其开口指向下,即气泡以向生物反应器或发酵器的底部的方向提供。
[0161]
生物反应器或发酵器中的起泡器的总数可根据需要选择并取决于存在的填充高度。起泡器可存在于生物反应器或发酵器的整个填充高度或仅其一部分上。所使用的起泡器的数量取决于所选的细胞或微生物的类型、生物反应器或发酵器的尺寸、培养的条件等。基于本文所公开的解释和陈述,本领域技术人员能够容易地为所使用的任何培养系统选择合适数量的起泡器。
[0162]
根据一另外的实施方式,已经发现有利的是存在于生物反应器或发酵器中的搅拌器相对于第一起泡器和/或第二起泡器和可选的另外的起泡器的位置被考虑在内。尽管所使用的搅拌器不受任何方式限制,所选的任何搅拌器具有搅拌器半径rs,所述搅拌器半径定位成围绕穿过生物反应器或发酵器的中央轴线a。许多实验已示出:当第一起泡器布置在距生物反应器或发酵器的中央轴线a一距离处,所述距离使得所提供的气泡在等于或小于搅拌器半径rs的距离处进入液体介质时是有利的。在此方面,第一起泡器是中央起泡器还是侧起泡器无关紧要。在这种情况下,起泡器在搅拌器附近提供气泡,使得在搅拌器的翼尖处提供最大的湍流。液体和气体的这种类型的高能混合被认为在细胞或微生物的培养中是有利的。
[0163]
进一步的实验已示出:优选地,第二起泡器和可选的另外的起泡器安装在距中央比搅拌器半径rs更大的距离处,使得所提供的气泡在外侧或明显在搅拌器运动的外侧。也就是说,第二起泡器和可选的另外的起泡器布置在距中央轴线a一距离处,所述距离使得所提供的气泡在大于搅拌器半径rs的距离处进入液相。在此方面,第二起泡器(和另外的起泡器)是中央起泡器还是侧起泡器无关紧要。在当前情况下,第二起泡器提供与搅拌器间隔开的气泡,使得可使所提供的气泡变形或损坏的湍流被避免。因此,液体和气体的高能混合被认为是不利于第二起泡器和可选的另外的起泡器的有效性,因为有益的技术效果(诸如co
2-剥离的性能和制品的产率)可受到消极影响。
[0164]
在图6a中,示例性地说明了第一起泡器150和第二起泡器160在生物反应器或发酵器100的容器102中的位置。生物反应器或发酵器100具有底部105和侧壁110以及具有直径d。气体供应管140或几个气体供应管(未示出)布置在侧壁110附近,以一方式设计和安装,
methods and results in mass transfer in stirred vessels nonviscous gas-liquid,ind.eng.chem.process des.dev.,vol.18,no.3,1979,p.357-364,其中陈述起泡器可不安装在距中央大于搅拌器半径的距离处。如果第一起泡器安装在距中央轴线等于或小于搅拌器半径rs的距离处,在搅拌器的翼尖处提供最大湍流被认为是有利的。另外,液体和气体的高能混合被认为在细胞或微生物的培养中是有利的。因此,此实施方式被认为具有优点。
[0173]
在图6a中,所有搅拌器r1、r2和r3具有相同的尺寸,使得搅拌器半径rs和直径ds在生物反应器或发酵器100的整个体积上对所有三个搅拌器r1、r2和r3是相同的。其他实施方式是可能的。
[0174]
在所示的示例性实施方式中,搅拌器具有搅拌器半径rs和因此搅拌器直径ds,其以对称方式定位成围绕穿过生物反应器或发酵器100的中央轴线a,由此,第二起泡器160布置在距中央轴线a一距离处,所述距离使得所提供的气泡在大于搅拌器半径rs或搅拌器直径ds的距离处进入液相。如果第二起泡器和可选的(一个或多个)另外的起泡器提供与搅拌器间隔开的气泡,可使所提供的气泡变形或损坏的湍流被避免。因此,液体和气体的高能混合被认为对第二起泡器和可选的另外的起泡器的有效性是不太有利的,因为有益的技术效果(诸如co
2-剥离的性能和制品的产量)可受到消极影响。
[0175]
当几个搅拌器存在时,搅拌器半径或直径经常与位于讨论中的起泡器旁边的搅拌器有关。
[0176]
参考图6b,除了第一起泡器150和第二起泡器160,还提供第三起泡器170,由此第三起泡器170位于生物反应器或发酵器100中第二起泡器160上方高度或距离η
2,3
处。距离η
2,3
可选自如本文所限定的第二起泡器160上方的范围。在图6b中,第二起泡器160位于填充高度的约1/3处,以及第三起泡器170位于生物反应器或发酵器100的填充高度的约2/3处。
[0177]
预期与仅有一个起泡器的生物反应器/发酵器(反映技术的现状)相比,根据本发明的第二起泡器的存在显著降低co2的分压至少约0.5%,或至少约1%,或至少约2%上至约20%。此外,预期与仅使用一个起泡器的生物反应器/发酵器相比,将获得制品滴度增加和制品产量增加至少约1%,或至少约5%,或至少约10%上至约30%。如上所述,甚至在如本发明中在工业规模中使用的方法中的小改进代表关于以下方面的显著改进:例如整个过程的可能持续时间(将补料-分批过程延长几小时,上至1天、2天甚至3天)、活细胞密度(细胞的活性)或产生的制品的滴度。
[0178]
此外,已经发现在大规模中操作的生物反应器或发酵器中,除了第一起泡器,第二起泡器和可选地另外的起泡器的供应已经提供了在生物反应器或发酵器内建立o
2-浓度和co
2-浓度的独立管理的可能性。
[0179]
因此,提供了控制和调整用于以工业规模培养悬浮细胞或微生物的生物反应器或发酵器100中的液体介质中溶解co2的含量和溶解o2的含量的方法,所述生物反应器或发酵器包括容器102,所述容器包含在液体介质中的培养物,所述方法包括:
[0180]
搅拌液体介质;
[0181]
将气泡10、10.1、10.2、10.3从布置在容器102的底部部分105中的第一起泡器150连续供应到液体介质,气体选自空气和/或氧气;
[0182]
将气泡20、20.1、20.2、20.3从布置在容器102中的第二起泡器160连续供应到液体
介质,气体选自空气和/或氧气,由此,第二起泡器160布置在第一喷射150上方,以及第二起泡器160是侧起泡器;
[0183]
基于浸没起泡器或第一起泡器150的气体流率q
sub
和侧起泡器或第二起泡器160的气体流率q
side
,选择和调整修正气体流率q
mod
(o2)以及选择和调整修正气体流率q
mod
(co2),两者都适用于所述培养过程,由此以下等式被应用:
[0184]qmod
(o2)=q
sub
c
o2
×qside
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[1a]
[0185]
以及
[0186]qmod
(co2)=q
sub
c
co2
×qside
ꢀꢀꢀꢀꢀꢀꢀꢀ
[1b]
[0187]
其中
[0188]qsub
表示浸没起泡器或第一起泡器150的气体流率;
[0189]qside
表示侧起泡器或第二起泡器160的气体流率;
[0190]co2
表示体积氧传质的影响因子c,由此c
o2
=0.15;以及
[0191]cco2
表示体积二氧化碳传质的影响因子c,由此c
co2
=0.6。
[0192]
上述控制和调整用于以工业规模培养悬浮细胞或微生物的生物反应器或发酵器中的液体介质中溶解co2的含量和溶解o2的含量的方法将详细解释如下:
[0193]
已经认识到对工业规模充气搅拌生物反应器或发酵器的氧传质性能以及二氧化碳传质性能的更精确的预测仅可基于详细研究作出。因此,已经执行了许多实验,其中,仅存在第一起泡器。可替代地,已经考查了附加的第二起泡器的影响。已经发现在仅存在一个起泡器的情况下,氧传质系数k
lao2
与气体流率直接成比例。也就是说,当气体流率加倍时,传质系数也几乎加倍。也就是说,一个起泡器可能已经提供了足够的氧传质(特征为k
lao2
),以满足培养物的氧需求。
[0194]
此外,已经令人惊讶地发现附加的侧起泡器以及因此附加的侧充气的存在对氧传质系数k
lao2
几乎没有影响或仅有很小的影响。因此,关于氧的传质系数k
lao2
,仅生物反应器或发酵器中的浸没起泡器或第一起泡器的气体流率是重要的。因此,浸没充气的影响可被认为对氧传质是主导的。
[0195]
此外,已经观察到侧喷射导致氧的传质性能小幅增加,而二氧化碳的传质性能显著增加。证实本发明另一方面的此发现也是完全出乎意料的。事实上,侧起泡器对二氧化碳的传质系数有非常强的影响,随着增加侧喷射,二氧化碳的传质系数增加得更强。因此,侧充气的影响可被认为对二氧化碳传质是主导的。
[0196]
因为在工业规模充气搅拌生物反应器或发酵器中气体的侧喷射对氧和二氧化碳的传质系数有不同的影响,可进行氧浓度和二氧化碳浓度的独立管理。独立管理可基于两个原则,即如果总气体流率是恒定的,则co2传质几乎是恒定的,以及侧充气对co2传质和o2传质有不同的影响。
[0197]
在许多评价测量中,已经发现气体的侧喷射的气体流率不能简单地添加到浸没气体流率。事实上,必须假设“修正的”气体流率。因此,修正的二氧化碳的气体流率(q
mod
(co2))和修正的氧的气体流率(q
mod
(o2))必须考虑入内,修正气体流率被认为分别与传质系数(k
lao2
或k
laco2
)成比例。因此,气体流率可被用于分别对培养过程的co2传质和o2传质有直接影响。实验(由图10和图11说明)已显示,“修正的”气体流率可由以下等式表示:
[0198]
对氧:
[0199]qmod
(o2)=q
sub
c
o2
×qside
ꢀꢀꢀꢀꢀꢀꢀ
[1a]
[0200]
其中,c
o2
=0.15。
[0201]
对二氧化碳:
[0202]qmod
(co2)=q
sub
c
co2
×qside
ꢀꢀꢀꢀꢀꢀꢀ
[1b]
[0203]
其中,c
co2
=0.6。
[0204]
所述修正气体流率包括浸没充气q
sub
和侧充气q
side
(其用影响因子c修正和加权)。因子c越高,侧充气对传质性能的影响越大。可在传质与浸没气体流率成线性比例的假设下计算因子c。影响因子c的详细计算在实施例部分(实施例3)中进行了解释和证明。
[0205]
结果显示气体的侧喷射导致氧的传质系数仅由于影响因子c
o2
为0.15而增加,而二氧化碳的传质系数可由于影响因子c
co2
为0.6而提高。也就是说,观察到氧气的传质性能的小幅增加,而二氧化碳的传质性能显著增加。
[0206]
利用此方法,在工业规模充气搅拌生物反应器或发酵器中二氧化碳和氧的独立管理变成可能。换言之,与浸没充气相比,在气体的侧喷射中二氧化碳的影响因子(k
laco2
)约四倍高。因此,氧和二氧化碳的实际或修正气体流率可被选择和调整,以便在培养系统中具有最佳条件。
[0207]
以下示例性案例应阐明上述发现,如下:
[0208]
浸没起泡器或第一起泡器的气体流率q
sub
被选择为具有以下值:q
sub
=120l/min。
[0209]
第二起泡器或侧起泡器的气体流率q
side
被选择为具有以下值:q
side
=60l/min。
[0210]
然后,修正的氧传质的气体流率q
mod
(o2)可根据等式[1a]计算如下:
[0211]qmod
(o2)=120l/min 0.15
×
60l/min=129l/min。
[0212]
此外,修正的二氧化碳传质的气体流率q
mod
(co2)可根据等式[1b]计算如下:
[0213]qmod
(co2)=120l/min 0.6
×
60l/min=156l/min。
[0214]
因为q
mod
(o2)表示被认为与传质系数k
lao2
成比例的修正总气体流率,本领域技术人员可具有关于对氧的传质的影响的直接衡量。此外,q
mod
(co2)表示被认为与传质系数k
laco2
成比例的修正总气体流率,以及本领域技术人员也具有关于对二氧化碳的传质的影响的直接衡量。因此,上面提到的等式[1a]和[1b]允许基于所选的气体流率分别控制和调整o2含量以及co2含量。本领域技术人员能够容易地选择和调整合适的和期望的q
mod
(o2)以及q
mod
(co2),它们对于单独的培养过程是最佳的,并对细胞或微生物培养性能有直接影响。
[0215]
利用此方法,如果提供形式为侧起泡器的第二起泡器,在工业规模充气搅拌生物反应器或发酵器中执行二氧化碳和氧的独立管理因此是可能的。此外,本领域技术人员有可能调整和选择第一起泡器和第二起泡器的气体流率,使得k
lao2
和k
laco2
可被控制和调整,用于细胞或微生物的培养的任何特定的方法。
[0216]
尽管根据本发明的一实施方式,第一起泡器的气体流率q
sub
可被选择为大于第二起泡器的气体流率q
side
,也可选择调整q
sub
为大于q
side
(q
side
》q
sub
)。
[0217]
根据一实施方式并如已经解释的那样,第一浸没起泡器和第二侧起泡器之间的距离η
1,2
可被选择为在如本文所限定的范围内。因此可将第二起泡器布置在第一起泡器上方的高度,在所述高度处,气泡已经达到或将很快达到co2气相饱和浓度。
[0218]
在一另外的实施方式中,第三起泡器170和可选的(一个或多个)另外的起泡器设置在生物反应器或发酵器100中第一起泡器150和第二起泡器160上方,两个连续的,即一个
布置在另一个上方的,起泡器150、160和/或160、170之间的距离被选择为η。
[0219]
除了第一浸没起泡器和第二侧起泡器之外,另外的起泡器可存在于如已经描述的生物反应器或发酵器中。起泡器之间的距离η
1,2
、η
2,3
、η
3,4
可在如已经公开的上述范围内选择。另外的起泡器可以是中央起泡器或侧起泡器,为每个起泡器单独决定。基于关于co2和o2的独立管理的上述发现和解释,根据一实施方式,另外的起泡器都是侧起泡器。
[0220]
因此,根据一另外的实施方式,第一起泡器是中央起泡器或侧起泡器,以及第二起泡器和可选的第三起泡器和另外的起泡器是侧起泡器。根据一另外的实施方式,第一起泡器是中央起泡器,以及第二起泡器和可选的第三起泡器和另外的起泡器是侧起泡器。
[0221]
除了所使用的起泡器的气体流率的改变,还存在其他参数和条件可帮助提高细胞或微生物的培养性能,像例如温度、ph或特定营养物的浓度、搅拌器类型、搅拌器速度、起泡器类型、起泡器尺寸、起泡器几何形状
……
本领域技术人员熟悉这些参数以及如何修正它们。
[0222]
本领域技术人员可从现有技术中选择已知的任何起泡器,以在细胞或微生物的培养过程中使用。然而,所使用的起泡器类型可对氧和二氧化碳的传质性能有影响。存在的开口的数量和尺寸、所选的起泡器的几何形状和尺寸可起一定的作用。推测由于较大的开口、高的气泡上升速度以及因此气体与介质之间的短接触时间导致的较大气泡将允许在仅微弱的氧的供应的情况下更强地去除二氧化碳。因此,本领域技术人员基于其在本领域的平均技术能够容易地选择合适的起泡器,所选的起泡器对每个培养过程都是有利的。
[0223]
根据一实施方式,第一起泡器、第二起泡器和可选的另外的起泡器是静态起泡器,所述静态起泡器选自以下:具有管几何形状的起泡器,例如管型起泡器、如开式管起泡器,烧结板,穿孔板,环形起泡器,蜘蛛型起泡器,盘型起泡器,片型起泡器,杯型起泡器,和衬套型起泡器。
[0224]
在一另外的实施方式中,第一起泡器、第二起泡器和可选的另外的起泡器是相同的或不同的起泡器。
[0225]
根据一另外的实施方式,第一起泡器、第二起泡器和可选的另外的起泡器是具有管几何形状的起泡器,例如管型起泡器、如开式管起泡器。
[0226]
在一另外的实施方式中,第一起泡器、第二起泡器和可选的另外的起泡器分别是月牙管型起泡器。
[0227]
根据一另外的的实施方式,第一起泡器、第二起泡器和可选的另外的起泡器分别是月牙开式管起泡器。
[0228]
管型起泡器,尤其开式管起泡器(诸如月牙开式管起泡器)具有良好清洁能力的优点,以及也提供更容易就地清洁(cip)和就地消毒(sip)的优点。
[0229]
此外,根据本公开,生物反应器或发酵器不受限制。可使用任何已知的充气的和搅拌的生物反应器或发酵器。也可使用气泡柱滴流床反应器、环管反应器等。
[0230]
此外,根据本公开,所使用的细胞不受限制。在本公开的实施方式中,细胞可以是真核细胞,诸如哺乳动物细胞,尤其酵母(酿酒酵母、毕赤酵母)、中国仓鼠卵巢(cho)细胞、人类细胞(例如hek 293)或昆虫细胞。也可使用其他细胞。
[0231]
根据本公开,微生物也不受限制。在本公开的实施方式中,微生物可以是原核细胞,诸如大肠杆菌或枯草芽孢杆菌。
[0232]
本公开也涉及如已经描述的用于在生物反应器或发酵器中培养细胞或微生物的方法,其中,第二起泡器设置在生物反应器或发酵器中如所限定的距离η处,以促进待培养的细胞或微生物的生长、活性、生产率和/或任何其他代谢条件。
[0233]
本公开也涉及如已经描述的用于在生物反应器或发酵器中培养细胞或微生物的方法,其中,除了第一起泡器和第二起泡器,(一个或多个)另外的起泡器分别设置在生物反应器或发酵器中如所限定的距离η处,以促进待培养的细胞或微生物的生长、活性、生产率和/或任何其他代谢条件。
[0234]
本公开也涉及设置在如已经描述的用于培养细胞或微生物的生物反应器或发酵器中的第二起泡器,其中,第二起泡器设置在生物反应器或发酵器中,以促进待培养的细胞或微生物的生长、活性、生产率和/或任何其他代谢条件,由此,第二起泡器位于生物反应器或发酵器中第一起泡器上方距离η的位置处,由此,η被选择为至少第一起泡器上方约0.4m到至多生物反应器或发酵器的填充高度下方约0.5m,或
[0235]
第一起泡器上方约0.4m至生物反应器或发酵器的填充高度的约2/3,或
[0236]
第一起泡器上方约0.4m至生物反应器或发酵器的填充高度的约1/2,或
[0237]
分别在第一起泡器上方约0.4m至约3.0m,或约0.4m至约2.5m,或约0.4m至约2.0m,或约0.4m至约1.5m,或约0.4m至约1.0m,或约0.45m至约0.90m,或约0.5m至约0.80m,或约0.55m至约0.70m,或在约0.6m处。
[0238]
本公开也涉及设置在如已经描述的用于培养细胞或微生物的生物反应器或发酵器中的第二起泡器和(一个或多个)另外的起泡器,其中,第二起泡器和(一个或多个)另外的起泡器设置在生物反应器或发酵器中,以促进待培养的细胞或微生物的生长、活性、生产率和/或任何其他代谢条件,由此第二起泡器位于生物反应器或发酵器中第一起泡器上方距离η的位置处,由此η被选择为至少第一起泡器上方约0.4m到至多生物反应器或发酵器的填充高度下方约0.5m,或
[0239]
第一起泡器上方约0.4m至生物反应器或发酵器的填充高度的约2/3,或
[0240]
第一起泡器上方约0.4m至生物反应器或发酵器的填充高度的约1/2,或
[0241]
分别在第一起泡器上方约0.4m至约3.0m,或约0.4m至约2.5m,或约0.4m至约2.0m,或约0.4m至约1.5m,或约0.4m至约1.0m,或约0.45m至约0.90m,或约0.5m至约0.80m,或约0.55m至约0.70m,或在约0.6m处。
[0242]
因此,在较高位置处气体的附加喷射,诸如附加的侧喷射,例如具有大气泡、高气泡上升速度以及因此气体和介质之间的短接触时间,导致细胞培养过程中的性能提高。
[0243]
此外,根据本发明,现在可提高大规模系统的体积二氧化碳传质系数k
laco2
,而不显著影响氧传质系数k
lao2
。因此,在简化形式中,第一起泡器被用于控制和调整o2传质,以及第二起泡器(其形式为侧起泡器)和可选的(一个或多个)另外的起泡器可被用于控制和调整co2传质。详细地说,第一起泡器可主要被用于向培养过程提供更多的o2,而第二起泡器和可选的(一个或多个)另外的起泡器可主要被用于降低co2含量。
[0244]
实施例
[0245]
实施例1:k
laco2
的确定
[0246]
为了确定体积传质系数k
laco2
,使用动态方法。在所使用的方法中,生物反应器将通入二氧化碳,直至达到15%的饱和度。随后,设定期望的搅拌器频率n和期望的通气速率
q,以及记录二氧化碳的浓度的降低。记录的二氧化碳水平与相应的时间t的关系图是下面等式[2],并可根据以下进行描述
[0247][0248]
其中,体积传质系数k
laco2
以及饱和浓度c*。该等式可转化成如下对数表达式:
[0249][0250]
其中,在时间t'处的浓度c'
co2
以及在时间t”处的浓度c”co2
。等式[3]提供k
laco2
的值作为二氧化碳图的对数函数的斜率。示例性评价可在图8中找到。参考图8,k
laco2
值的评价是从浓度c
co2
=14%到c
co2
=6%进行的。因此,k
laco2
被示出为负值,因为发生了co2的降低。因此,k
l
a值是从所确定的曲线的对数表示的斜率导出的。
[0251]
实施例2:第一评价测量
[0252]
为了考查工业规模充气搅拌生物反应器或发酵器的氧传质性能,第二起泡器(其形式为侧起泡器)已经被设计并安装在反应器中。测量已经在装满了体积约12kl(见下表1)的0.9%(w/v)nacl/h2o的15kl生物反应器中执行。所使用的15kl生物反应器的技术图和附加的侧起泡器的安装位置在图9中示出。在这些测量中,附加的侧起泡器160安装在填充高度表示反应器体积的一半的位置处。v
fill
表示生物反应器100的容器的填充体积。也就是说,侧起泡器160位于表示填充体积的0.5倍(1/2v
fill
)的位置处,在当前情况下,为生物反应器或发酵器的填充高度的约1/2,因为生物反应器或发酵器的形式是圆柱形状。
[0253]
在这些测量中使用的浸没起泡器或第一起泡器(未示出)是侧起泡器,其形式为管型起泡器,具有31
×
2mm的钻孔,即31个开口,每个开口具有2mm的直径。
[0254]
在这些测量中使用的第二起泡器也是侧起泡器,其形式为管型起泡器,具有15
×
3mm的钻孔,即15个开口,每个开口具有3mm的直径。
[0255]
在浸没起泡器(第一起泡器)以及侧起泡器(第二起泡器)中使用的气体是空气。
[0256]
第一评价测量已经被执行,以测量氧的传质速率对气体流率的依赖,搅拌器频率为n=60rpm。所研究的操作条件和通气策略的详细概述在表1中给出。
[0257]
表1:氧的传质速率对气体流率的依赖
[0258][0259]
因此,在测量1至4中,气体流率已改变,而搅拌器速率已保持恒定。
[0260]
在测量1中,浸没起泡器或第一起泡器的气体流率已被设置为120l/min。侧起泡器或第二起泡器不向液体介质提供空气,即第二起泡器的气体流率为0l/min。测量1中的整体或总气体流率(q
total
)因此为:
[0261]qsub
q
side
=120ml/min 0ml/min=120ml/min。
[0262]
在测量2中,浸没起泡器或第一起泡器的气体流率已被设置为100l/min;侧起泡器或第二起泡器的气体流率已被设置为20l/min,则总气体流率为120l/min。
[0263]
在测量3中,浸没起泡器或第一起泡器的气体流率已被设置为120l/min;侧起泡器或第二起泡器的气体流率已被设置为20l/min,则总气体流率为140l/min。
[0264]
在测量4中,浸没起泡器或第一起泡器的气体流率已被设置为120l/min;侧起泡器或第二起泡器的气体流率已被设置为60l/min,则总气体流率为180l/min。
[0265]
测量1(其中没有发生侧通气)已被作为标准,以及相对于此标准测量,已确定测量2至4的体积传质系数k
lao2
。体积传质系数k
lao2
表示对氧的传质速率的直接衡量。
[0266]
在附加的测量中,已经发现传质系数k
lao2
与气体流率直接成比例。当气体流率加倍时,传质系数也几乎加倍。此发现在测量2中被证实,其中,浸没起泡器的气体流率已从120l/min降低到100l/min。尽管在测量1和测量2中总气体流率分别保持在120l/min的恒定水平,与测量1相比,传质系数k
lao2
在测量2中降低到值为-18%。具有气体流率为20l/min的侧起泡器实际上对传质系数k
lao2
没有影响。因此,仅浸没起泡器(第一起泡器)的气体流率对k
lao2
起作用。因此,浸没充气的影响因此被认为对氧传质是主导的。
[0267]
事实上,在测量1至4中,传质系数没有受到气体的附加的侧喷射的显著影响。因此证实侧充气对氧传质系数k
lao2
几乎没有影响或仅有很小的影响。
[0268]
为了说明目的,表1中获得的结果在图10中进行了描绘,图10示出了所执行的四次测量的比较。从图10中可以看出,与测量1相比,在测量2中浸没充气减少16%对o2的传质系数有显著影响,即使在测量1和2中总充气速率是恒定的。然而,与测量1相比,在测量3中侧喷射增加16%显示测量3中氧传质系数k
lao2
仅增加2%,以及在测量4中侧喷射增加50%显示氧传质系数k
lao2
仅增加8%。
[0269]
第一评价测量因此证实空气的侧喷射对氧传质性能仅有很小的影响。
[0270]
实施例3:第二评价测量
[0271]
如在第一评价测量中的相同的测量已被执行,但二氧化碳的体积传质系数k
laco2
已被确定(参见图11)。从图11可导出,与氧的传质系数(8%)(参见图10)相比,二氧化碳的传质系数随着增加侧喷射而增加得强得多(在测量4中上至23%)。
[0272]
第一评价测量和第二评价测量证实侧喷射对氧气和二氧化碳的传质系数有不同的影响,以及因此不能简单地添加到浸没气体流率。因此,在工业规模充气搅拌生物反应器或发酵器中气体的侧喷射能够分别独立管理氧浓度和二氧化碳浓度。
[0273]
从上述评价可得出结论,“修正的”气体流率存在。为了更好地描述“修正的”气体流率,可由以下等式表达:
[0274]qmod
=q
sub
c
×qside
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[1]
[0275]
也就是说,可引入修正气体流率,其包括浸没充气q
sub
和侧充气q
side
(其用影响因子c加权)。因子c越高,侧充气对传质性能的影响越高。可在传质与浸没气体流率成线性比例的假设下计算因子c。此发现在图12a和图12b中进行了说明。从图12a和12b可导出,对氧的体积传质系数k
lao2
,可计算侧喷射因子为c
o2
=0.15,而对二氧化碳(k
laco2
)的因子是四倍高,为c
co2
=0.6。
[0276]
因此,附加的侧喷射导致氧的传质性能小幅增加,而二氧化碳的传质性能显著增
加。实际上,气体的侧喷射导致氧的传质系数以因子0.15增加,而二氧化碳的传质系数可以因子0.6增加。
[0277]
实施例4:第三评价测量
[0278]
如在第一评价测量和第二评价测量中的相同的测量已被执行,但已使用不同的侧起泡器(第二起泡器)。侧起泡器型a具有10
×
3mm的钻孔,以及侧起泡器型b具有32
×
5mm的钻孔。与型a相比,侧起泡器型b具有更多开口,以及每个开口具有更大的直径。
[0279]
获得的结果在图13a和图13b中进行了说明。参考图13a和图13b证实如果总气体流率是恒定的,co2传质也几乎是恒定的。此外,与o2传质相比,侧充气对co2传质具有更大的影响。详细地说,与二氧化碳的传质系数的第二评价测量相比,侧起泡器型b的二氧化碳的体积传质系数k
laco2
随着增加侧喷射而增加得强得多(见图13b:在测量4中上至30%)。也就是说,通过选择起泡器型b可进一步增加co2传质。
[0280]
因此,推测:在较高位置处具有更多较大气泡的气体的附加的侧喷射,即较高的气泡上升速度和因此气体与介质之间的短接触时间,导致细胞培养过程中的性能提高。
[0281]
实施例5:第四评价测量
[0282]
为了验证二氧化碳的传质系数k
laco2
和氧化物的传质系数k
lao2
对搅拌器频率和气体流率的依赖性,已执行了进一步的测量。结果在图14a和图14b以及图15a和图15b中示出。
[0283]
在图14a、14b、15a、15b的图例(在说明书的末尾处提供)中,使用加号(“ ”)总结了结果。图例中的加号有以下含义:
[0284]
................小的影响
[0285]
............大的影响
[0286]
在图14a和图14b中,仅使用一个起泡器,该起泡器是浸没起泡器,位于容器的底部。
[0287]
按照其他实验,在图14a中已发现比功率输入对二氧化碳的传质系数k
laco2
具有小的影响(由加号( )表示),而表观气体流率对二氧化碳的传质系数k
laco2
具有大的影响( )。
[0288]
参考图14b,氧化物的传质系数k
lao2
随着增加比功率输入以及增加表观气体流率而上升。
[0289]
在图15a和图15b中,所使用的第二起泡器是侧起泡器。按照其他实验,在图15a中已发现比功率输入对二氧化碳的传质系数k
laco2
具有小的影响(由加号( )表示),而表观气体流率对二氧化碳的传质系数k
laco2
具有大的影响( )。
[0290]
参考图15b,氧化物的传质系数k
lao2
随着增加比功率输入而上升。然而,增加表观气体流率对氧化物的传质系数k
lao2
仅具有小的影响。
[0291]
基于此方法,在工业规模充气搅拌生物反应器或发酵器中二氧化碳和氧的独立管理是可能的。独立管理可基于两个原则,即如果总气体流率是恒定的,co2传质几乎是恒定的,以及侧充气对co2传质和o2传质具有不同的影响。
[0292]
实施例6:距离η的评价
[0293]
第一起泡器和第二起泡器之间的距离η(也被指定为η
1,2
)是由气泡的co2饱和浓度和气泡将在工业规模的生物反应器或发酵器中达到co2饱和浓度的时间来确定的。因此,在反应器的高度上的气相停留时间已通过阶跃响应方法(“sprungantwortmethode”)确定,此
方法的基本问题将在下文进行解释。
[0294]
6.1.通过阶跃响应法测量充气搅拌釜反应器中的气相停留时间
[0295]
仅可获取非常少数的出版物涉及气相停留时间的确定(wachi s.and nojima y.,gas-phase dispersion in bubble columns,chemical engineering science,vol.45,no.4,pp 901-905,1990;yianatos j.b.and bergh l.g.,international journal of mineral processing,36(1992),p.81-91)。在两相流中的气相停留时间分布可借助于脉冲或阶跃响应方法确定。然而,所描述的脉冲响应方法很难适应,因为使用了或放射性的或有毒的示踪气体。此外,到目前为止,还没有关于充气搅拌釜反应器中的气相停留时间分布的研究被出版。因此,本文使用基于阶跃响应方法修正的测量技术确定气相停留时间。
[0296]
根据控制理论,系统的行为可通过或脉冲或阶跃响应方法确定。两种方法之间的差异是获得的关于系统的信息。停留时间分布可通过脉冲响应方法确定,而停留时间本身可通过阶跃响应方法确定。例如,响应阶跃输入的系统的输出在图16a和图16b中示出。图16a和图16b说明阶跃响应方法:根据leigh,j.r.(2004).control theory 2.ed.,iet control engineering series,london,示出了向系统的输入(图16a)和系统的输出(图16b)。
[0297]
作为在系统的输出处的测量信号,放射性气体示踪剂的辐射(yianatos j.b.,bergh,l.g.,duran,o.u.,diaz,f.j.,heresi,n.m.(1994),measurement of residence time distribution of the gas phase in flotation columns,minerals engineering vol.7,p.333-344)或二氯二氟甲烷(wachi s.和nojima y.,在上述引文中)被使用。出于实际原因,经常不可能使用放射性气体示踪剂来实现输入脉冲。此外,在当前情况下,仅关于停留时间(而不关于分布)的信息是足够的。
[0298]
因此,对于我们在12kl丙烯酸玻璃搅拌釜反应器中的应用,在充气期间仅改变气体类型,以将阶跃信号引入系统。
[0299]
对于阶跃响应方法的应用,充气搅拌釜反应器应在稳定的过程条件下操作,例如,被充气,直到达到溶解氧浓度的平衡。在稳定操作期间,随后充气被转化为纯氮气。在反应器的入口和出口处连续测量氧浓度。为了使反应器的顶部空间内气体混合的影响最小化,在水面上安装漏斗作为“气泡捕集器”。这种气泡捕集器(漏斗)180(其使反应器的顶部空间的影响最小化)在图17中示例性地示出。气泡捕集器(漏斗)180被设计为在横截面上吸收气泡并将收集的气体引导至气体传感器。作为在反应器的入口和出口处的气体传感器,在此情况下已使用光学氧传感器点(presens precision sensing gmbh),响应时间非常低,为t
response
《2s。在图17的所说明的气泡捕集器(漏斗)180中,示出了presens端口185和废气189。
[0300]
来自应用于12kl充气搅拌釜反应器的阶跃响应方法的分别位于浸没起泡器和漏斗处的氧浓度的典型的输入信号以及相应的输出信号在图18中示出。
[0301]
假设停留时间尺度显著小于传质时间尺度,气相停留时间被限定为阶跃输入与废气中的氧浓度已下降超过1%的时间之间的时间。此假设可通过比较100%和50%阶跃输入导致的系统响应证明。在图19中分别示出了100%和50%输入阶跃导致的漏斗处的阶跃响应的比较。关于图19,关于输出氧信号首次下降的时间,没有检测到响应信号的差异。
[0302]
响应阶跃方法关联一些缺陷,这些缺陷在在当前情况下仅是次要的,原因如下:
[0303]-如果第一气泡到达漏斗,信号开始下降。取决于气泡尺寸分布,这可能发生得非常早(通过大尺寸气泡),而最大数量的小气泡可能在系统内停留更长。然而,由于使用pbs和普朗尼克作为溶剂(磷酸盐缓冲盐水 1g/l普朗尼克),气泡尺寸分布是非常窄的,以及该方法应具有可接受的准确度。
[0304]-在非均质流动条件下,可能发生主要气泡羽流未被漏斗捕集。在此情况下,停留时间将被过高估计。
[0305]-在氧和氮气泡之间可能发生溶解氧和氮气的交换,以及可可附加地聚结和分裂。假设此影响可被忽略。
[0306]
总之,用于确定气相停留时间的阶跃响应方法是容易适用的方法,对所描述的系统和条件具有可接受的准确度。
[0307]
在阶跃响应方法中使用的溶剂是pbs(磷酸盐缓冲盐水)和1.0g/l普朗尼克。
[0308]
阶跃响应方法的结果在图20中示出。在图20中,氧浓度(以[%])对采样时间t(以[s])作图。具有30l的实验室规模的生物反应器或发酵器已经与具有12000l的工业规模的生物反应器或发酵器相比较。从实验室规模到工业规模,搅拌器频率n(以[rpm])和气体流率(以[l h-1
])已被改变,以便为每个系统获得可比较的功率输入。因此,对工业规模系统的搅拌器频率为300rpm,对实验室规模的搅拌器频率为80rpm。对实验室系统的气体流率为1l min-1
,以及对工业规模的气体流率为60l min-1
。
[0309]
在图20中,分别示出了对实验室规模(30l)的2条曲线和对工业规模(12000l)的2条曲线。曲线1和2示出了在工业规模中的测量,以及曲线3和4示出了在实验室规模中的测量。在生物反应器或发酵器的底部(进料)和生物反应器或发酵器的顶部(顶部)的气体进料处测量气体浓度。正如可从所提供的曲线中导出,停留时间tr如下:
[0310]
t
r,30l
=5s
[0311]
t
r,12kl
=21s。
[0312]
因此,实验室规模的生物反应器或发酵器的气相停留时间已被确定5s,以及对工业规模的生物反应器或发酵器的气相停留时间已被确定为21s。
[0313]
6.2.co2传质系数k
laco2
的评估
[0314]
co2传质系数k
laco2
的评估已被执行如下:
[0315]
已对2l生物反应器或发酵器中的特定气体边界界面和体积co2传质系数k
laco2
进行了测量。结果已被总结在以下表2中。
[0316]
表2:对2l生物反应器或发酵器中的特定气体边界界面和体积co
2-传质系数的测量结果
[0317][0318]
基于以上测量,co2的传质系数已在2l生物反应器或发酵器中被确认为4
±
0.68h-1
。
[0319]
6.3.平均气泡上升速度的估计
[0320]
在以下假设下:在12000l系统中气泡的尺寸的单分散分布为d=5mm,以及二氧化碳传质系数k
laco2
=4
±
0.68h-1
(如上述)也适用于工业规模,37℃下单个气泡中的理论二氧化碳剖面可计算如下:
[0321][0322]cco2 二氧化碳的浓度
[0323]c*co2 二氧化碳的饱和浓度
[0324]kl 传质系数
[0325]
a 比界面面积,由此a=a /v,
[0326]abubble 气泡的表面积
[0327]vbubble 气泡的体积
[0328]
t 时间
[0329]
由此可推断,在约3.5s后达到95%的气泡的饱和度。
[0330]
基于在工业规模生物反应器或发酵器中测量的平均气相停留时间为约21s以及由气泡旅行的总测量距离为3.6m,平均气泡上升速度可计算如下:
[0331]
速度u=距离/时间:u=0.17m/s。
[0332]
因此,在约h=0.6m(3.6m
×
0.17m/s)的高度之后,气相被co2饱和,以及因此不再能观察到co2的剥离。
[0333]
因为以上评估、测量和计算包括一些评价和估计,所获得的0.6m的结果仅仅是对距离η的近似值,所述距离η更好由如所要求的范围表示。
[0334]
对照例1:仅包括一个起泡器的生物反应器
[0335]
专有的bi hex(boehringer-ingelheim high expression)cho-dg44衍生的细胞系(表达抗体-类蛋白)在商业上可获取的12000l生物反应器中,在常规的补料-分批过程中培养11天。生物反应器包括拉什顿和斜桨式搅拌器,以及具有2:1的h/d(高度/直径比)。下叶轮和上叶轮之间的距离为1.8m。在标称体积下,生物反应器内的液体高度(=填充高度)为4.2m。起泡器位于最低搅拌器下方。对此实验使用源自专有的平台的生长、生产
和饲料介质。通过饲料的添加,培养开始于9000l处,并结束于约1100l处。在整个过程中,培养温度被控制在36.5
±
0.5℃,ph保持在7
±
0.6的范围内,以及葡萄糖浓度在0至10g/l的范围内。通过喷射空气和氧提供氧供应。溶解氧浓度维持在30%。
[0336]
结果在以下表a至d中示出,并在图21a至d中形象地描绘。细胞呈指数生长至第5天,之后细胞数保持大致恒定。在培养的11天期间,细胞活性不断下降,最终略低于80%。制品滴度从第3天开始测量,并显著增加直到第11天。培养的pco2剖面在10%左右处开始,并急剧下降直到第4天,之后pco2再次增加,直到它在第11天达到起始值。
[0337]
表a:赋范的活细胞生长曲线。数据以此运行达到的最大细胞密度的百分比给出。
[0338]
运行时间[d]活细胞密度[%]0316214332456579685787888986101001177
[0339]
表b:细胞活性
[0340]
运行时间[d]细胞活性[%]09819829839849759769478988397910761177
[0341]
表c:由细胞产生的抗体衍生物的浓度曲线。该值以运行中达到的最大制品浓度的百分比给出。
[0342]
运行时间[d]滴度[%]
00102036412521631745858973108711100
[0343]
表d:生物反应器内co2的分压
[0344]
运行时间[d]pco2[%]09.918.526.636.145.556.967.978.588.799.0109.2119.9
[0345]
以上表a至表d的结果在如图21中进行了说明。该图示出了根据对照例1来自示例性12000l制造运行的培养数据。在(a)中,给出了培养的11天的赋范的活细胞生长曲线。数据以此运行中达到的最大细胞密度的百分比给出。在(b)中描绘了用于培养的细胞活性。(c)示出了由细胞产生的抗体衍生物的浓度曲线。该值以运行中达到的最大制品浓度的百分比给出。在(d)中给出了生物反应器内co2的分压。
[0346]
实施例7:包括第一起泡器和第二起泡器的生物反应器
[0347]
可执行根据对照例1的实验,但可使用两个起泡器替代仅一个起泡器,如根据本发明。第一起泡器可位于最低搅拌器下方,以及可以是中央起泡器或侧起泡器。第二起泡器可位于生物反应器或发酵器中第一起泡器上方距离η的位置处,由此,η可被选择为在从生物反应器或发酵器的填充高度下方至少约0.4m到至多约0.5m的范围内。第二起泡器是中央起泡器或侧起泡器。
[0348]
生物反应器中两个起泡器的存在增加液体介质中将发生co
2-剥离的区域。如果第二起泡器放置在液体的表面附近,例如生物反应器或发酵器的填充高度下方约0.5m,它可
剥离下游区域,而放置在生物反应器的底部附近的第一起泡器可剥离液体介质的上游区域。总之,生物反应器或发酵器的整个填充高度经受co
2-剥离。
[0349]
可预期的是,位于第一起泡器上方距离η(其在如上所述的范围内选择)的第二起泡器的存在将对co
2-剥离有显著影响。也就是说,与对照例1的实施方式相比,可推测生物反应器的培养物(液体介质)中co2的分压降低至少约0.5%,或至少约1%,或至少约2%上至约20%。
[0350]
此外,可预期与对照例1相比更高的制品滴度和更高的制品产量。与对照例1的实施方式相比,由细胞产生的抗体或抗体衍生物的浓度可被推测为增加至少约1%,或至少约5%,或至少约10%上至约30%。
[0351]
如在当前情况下,在大规模上商业使用的方法中的小改进(诸如至少约0.5%或至少约1%)也表示有意义的贡献。即使是方法的小改进,诸如剥离性能和产量,在大规模生产中是非常相关的改进,以及必须被视为重要的。
[0352]
在第二起泡器被选择为侧起泡器的情况下,可预期的是,如本文所公开的有利的技术效果,尤其在生物反应器的培养物(液体介质)中co2的分压的降低和制品滴度的增加将分别更加突出。
[0353]
实施例8:第一起泡器和第二起泡器之间的距离η的变化
[0354]
可执行根据实施例7的实验,其中,第一起泡器和第二起泡器之间的距离η将被改变。第一起泡器可位于最低搅拌器下方;第二起泡器可位于生物反应器或发酵器中第一起泡器上方距离η的位置处。第二起泡器位于第一起泡器上方距离η处,所述距离η为生物反应器或发酵器的填充高度的约2/3、生物反应器或发酵器的填充高度的约1/2、约3.0m、约2.9m、约2.8m、约2.7m、约2.6m、约2.5m、约2.4m、约2.3m、约2.2m、约2.1m、约2.0m、约1.9m、约1.8m、约1.7m、约1.6m、约1.5m、约1.4m、约1.3m、约1.2m、约1.1m、约1.0m、约0.95m、约0.90m、约0.85m、约0.80m、约0.75m、约0.70m、约0.65m、约0.6m、约0.55m、约0.45m和约0.4m。
[0355]
生物反应器中两个起泡器的存在增加液体介质中将发生co
2-剥离的区域。第二起泡器可放置在距离η处,由此可选择η,使得由第一起泡器和第二起泡器执行co
2-剥离的区域重叠到一定程度。
[0356]
因此,可预期的是,位于第一起泡器上方距离η(具有上述值中的一个)处的第二起泡器的存在将对co
2-剥离有显著影响。也就是说,与对照例1的实施方式相比,可推测生物反应器的培养物(液体介质)中co2的分压降低至少约0.5%,或至少约1%,或至少约2%上至约20%。
[0357]
此外,可预期与对照例1相比更高的制品滴度和更高的制品产量。与对照例1的实施方式相比,由细胞产生的抗体衍生物的浓度可被推测为增加至少约1%,或至少约5%,或至少约10%上至约30%。
[0358]
此外,如在当前情况下,在大规模上商业使用的方法中的小改进(诸如至少约0.5%或至少约1%)也表示有意义的贡献。即使是方法的小改进,诸如剥离性能和产量,在大规模生产中是非常相关的改进,以及必须被视为重要的。
[0359]
在第二起泡器被选择为侧起泡器的情况下,可预期的是,如本文所公开的有利的技术效果,尤其在生物反应器的培养物(液体介质)中co2的分压的降低和制品滴度的增加将分别更加突出。
[0360]
对照例2:生物反应器包括两个起泡器,但距离η在权利要求的范围之外
[0361]
可执行根据示例7的实验,其中,第一起泡器和第二起泡器之间的距离η在权利要求的范围之外。详细地说,距离η低于0.4m,诸如0.35m或0.3m或0.2m或0.1m。可预期的是,由于第二起泡器的存在,技术效果将不会达到,即由生物反应器的培养物(液体介质)中co2的分压的降低以及更高的制品滴度和更高的制品产量导致的优势将不会获得。在生物反应器中同时存在两个起泡器的积极影响不会发生。实际上,生物反应器的性能将接近于如在对照例1中所描述的仅具有一个起泡器的生物反应器。因此,0.4m的较低值可被认为是临界值。
[0362]
参考符号列表
[0363]
10、10.1、10.2、10.3 来自第一起泡器的气泡
[0364]
20、20.1、20.2、20.3 来自第二起泡器的气泡
[0365]
100
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
生物反应器或发酵器
[0366]
102
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
容器
[0367]
105
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
底部部分
[0368]
110
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
侧壁
[0369]
120
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
搅拌器
[0370]
140
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
气体供应管
[0371]
150
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一起泡器
[0372]
160
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二起泡器
[0373]
170
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第三起泡器
[0374]
180
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
气泡捕集器(漏斗)
[0375]
185
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
presens端口
[0376]
189
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
废气
[0377]aꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
中央轴线
[0378]rs
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
搅拌器半径
[0379]ds
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
搅拌器直径
[0380]
d1、d2
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
由搅拌器半径rs限定的距离
[0381]dꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
生物反应器或发酵器的直径
[0382]
r1、r2、r3、r4
ꢀꢀꢀꢀꢀꢀꢀ
搅拌器
[0383]
η
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
两个起泡器之间的距离
[0384]
η
1,2
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一起泡器和第二起泡器之间的距离
[0385]
η
2,3
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二起泡器和第三起泡器之间的距离
[0386]
η
3,4
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第三起泡器和第四起泡器之间的距离
[0387]
一些图的图例:
[0388]
图2:
[0389]
◆w0g
=0.96mm s-1
[0390]
●w0g
=0.75mm s-1
[0391]w0g
=0.53mm s-1
[0392]
□w0g
=0.32mm s-1
[0393]
传质测量:
[0394]
系统:0.9%nacl-水/空气
[0395]
搅拌器:拉什顿/斜桨
[0396]
体积:2l
[0397]
温度:37℃
[0398]
图3:
[0399]
◆w0g
=0.95mm s-1
[0400]
●w0g
=0.64mm s-1
[0401]w0g
=0.32mm s-1
[0402]
传质测量:
[0403]
系统:0.9%nacl-水/空气
[0404]
搅拌器:拉什顿/斜桨
[0405]
体积:12000l
[0406]
温度:37℃
[0407]
图4:
[0408]
传质测量:
[0409]
系统:0.9%nacl-水/空气
[0410]
搅拌器:拉什顿/斜桨
[0411]
表观气体速度:0.96mm s-1
[0412]
体积:12000l和2l
[0413]
温度:37℃
[0414]
图14a:
[0415][0416]
图14b:
[0417][0418]
图15a:
[0419][0420]
图15b:
[0421][0422]
图18:
[0423]
停留时间测量:
[0424]
填充体积:12m3[0425]
搅拌器:拉什顿/斜桨
[0426]
搅拌器频率:60rpm
[0427]
气体流率:60l/min
[0428]
介质:di-水
[0429]
温度:t=37℃
[0430]
图19:
[0431]
停留时间测量:
[0432]
填充体积:12m3[0433]
搅拌器:拉什顿/斜桨
[0434]
搅拌器频率:60rpm
[0435]
气体流率:60l/min
[0436]
介质:di-水
[0437]
温度:t=37℃
[0438]
图20:
[0439]-1
‑ꢀ
n=300rpm/q=1l min-1
进料
[0440]-2
‑ꢀ
n=300rpm/q=1l min-1
顶部
[0441]-3
‑ꢀ
n=80rpm/q=60l min-1
进料
[0442]-4
‑ꢀ
n=80rpm/q=60l min-1
顶部
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
