用于监测急性b淋巴细胞白血病微小残留病灶的流式细胞术试剂盒及监测方法
技术领域
1.本发明涉及流式细胞术领域,具体讲,涉及一种用于监测急性b淋巴细胞白血病微小残留病灶的流式细胞术试剂盒及监测方法。
背景技术:
2.急性淋巴细胞白血病(all)是原始和幼稚淋巴细胞克隆性增殖的恶性肿瘤,2~5岁儿童多见(19%),其中b-all更为多见。
3.白血病细胞的自我更新能力增强、增殖失控,可导致分化障碍及凋亡受阻,同时抑制骨髓正常造血并可浸润至肝、脾、淋巴结等各个脏器,表现出感染、出血、贫血等临床征象。all的进展非常迅速,并可能在几个月内导致患者死亡,故确诊后应尽快治疗。目前随着多种药物联合应用、危险度分层评估、预防中枢神经系统侵犯及对化疗失败患者临床、分子生物学和治疗反映特征认识的不断提高,患者的预后得到了显著的改善,5年总生存率(overall survival,os)可达90%。但是,仍有少部分患者复发,复发后二次缓解率低,复发仍然是治疗失败的主要原因。
4.微小残留病(mrd)是指急性白血病患者诱导化疗或骨髓移植后,达到临床和血液学的完全缓解(形态学骨髓中原始及幼稚细胞小于5%),体内残存少量白血病细胞的状态,mrd是白血病复发的首要原因。因此对于白血病患者来说,检测mrd的意义非常重要:1.有利于更早的预测白血病的复发;2.指导白血病的临床治疗,根据体内白血病细胞多少决定是否继续化疗或停止治疗,更好的制定有效治疗方案,避免过度治疗;3.有利于较早的发现白血病细胞是否耐药,选择临床更敏感,更具有杀伤力的治疗措施;4.有助于评价自体造血干细胞移植患者的干细胞净化效果。
5.近20年来,随着mrd检测技术日新月异,mrd的多种检测方法已被广泛用于临床评估疗效,如流式细胞术(flow cytometry,fcm)、 pcr(polymerase chain reaction)、fish以及质谱技术等,mrd技术需要灵敏高,实用性强,准确,可靠,快速。骨髓细胞形态学、常规核型分析以及fish技术由于敏感性低,远远不能满足临床对mrd检测敏感性的要求,目前临床mrd主要的检测方法为fcm和聚合酶链反应。两者均具有高敏感性且相关性良好,二者一致性达89.7%,但是pcr-融合基因只能应用于约25%~40%的all患者中,因为并不是所有all患者都有融合基因或存在突变等,而fcm主要通过检测白血病细胞的发育模式和特异性标志的表达是否正常进行判断,几乎可用于所有患者,检测深度可达到10
4-5
。但是目前传统流式检测通道较少,补偿难调,常用的检测抗体只限于每管8~10个,而已有技术中应用于mrd的流式检测抗体大于20个,因此以往的检测只能选择一线抗体和与b细胞发育模式紧密相关的必要抗体,很难将残留的白血病细胞全部检测到,而all-b的患者如果存在mrd,异常的表达和发育多数不同于初诊,需要更广泛的抗体来监测,因此,检测的抗体广度不足是部分患者mrd检测阴性后仍旧复发的主要原因。
6.2017年全光谱流式的问世,一跃将三激光流式的检测通道从传统流式的4-13个提
高到38个,可实现一管25色以上监测,大大提高了检测信息量,提高了诊断精度和免疫学检测的深度。
7.鉴于此,特提出本发明。
技术实现要素:
8.本发明第一发明目的在于提供一种用于监测急性b淋巴细胞白血病微小残留病灶的流式细胞术试剂盒的流式细胞术试剂盒。
9.本发明第二发明目的在于提供该试剂盒的使用方法。
10.本发明的第三发明目的在于提供一种急性b淋巴细胞白血病微小残留病灶的流式细胞术试剂盒的监测方法。
11.为了实现本发明的发明目的,采用的技术方案为:
12.本发明涉及一种用于监测急性b淋巴细胞白血病微小残留病灶的流式细胞术试剂盒,所述试剂盒内含有用于检测b系发育的抗体和用于检测异常表达的抗体,
13.所述用于检测b系发育的抗体包括:抗cd19抗体、抗cd22抗体、抗cd10抗体、抗cd20抗体、抗cd34抗体、抗cd38抗体、抗cd81 抗体、抗cd58抗体、抗cd45抗体、抗cd24抗体、抗cd200抗体、抗 cd21抗体、抗cd73抗体;所述用于检测异常表达的抗体包括:抗cd13 抗体、抗cd33抗体、抗cd15抗体、抗cd65抗体、抗cd66c抗体、抗 cd2抗体、抗cd56抗体、抗cd86抗体、抗cd133抗体、抗ng2抗体、抗cd304抗体、抗cd44抗体、抗cd123抗体。
14.可选的,所述抗cd33抗体连接有荧光素rr600、所述抗cd38抗体连接有荧光素rr778、所述抗cd15抗体连接有荧光素rb515、所述抗 cd65抗体连接有荧光素rb515、所述抗cd24抗体连接有荧光素rv498、所述抗cd133抗体连接有荧光素rr664、所述抗cd73抗体连接有荧光素rv444、所述抗cd123抗体连接有荧光素rv526、所述抗cd86抗体连接有荧光素rv540、所述抗cd58抗体连接有荧光素rv570、所述抗 ng2抗体连接有荧光素rb574、所述抗cd200抗体连接有荧光素rb608、所述抗cd19抗体连接有荧光素rb780、所述抗cd66c抗体连接有荧光素 rb710、所述抗cd45抗体连接有荧光素rb697、所述抗cd304抗体连接有荧光素rb730、所述抗cd13抗体连接有荧光素rb670、所述抗cd10 抗体连接有荧光素rb713、所述抗cd81抗体连接有荧光素rv567、所述抗cd21抗体连接有荧光素rv624、所述抗cd44抗体连接有荧光素 rv645、所述抗cd56抗体连接有荧光素rv656、所述抗cd20抗体连接有荧光素rv681、所述抗cd2抗体连接有荧光素rv710、所述抗cd34 抗体连接有荧光素rv734、所述抗cd22抗体连接有荧光素rv805。
15.可选的,每种所述抗体分别包装,所述抗体的浓度为80~120μg/ml,优选100μg/ml。
16.可选的,每种所述抗体的包装体积为0.5ml;每个待测样本使用每种所述抗体的体积为5μl。
17.本发明还涉及该试剂盒的使用方法,至少包括以下步骤:
18.(1)取2个流式管,标记为样本管和对照管;
19.(2)在样本管中先加入brilliant stain buffer,然后加入连接有荧光素的抗体,混匀;
20.(3)在样本管和对照管中分别加入待测样本,孵育;
21.(4)在样本管和对照管中分别加入红细胞裂解液,裂解;
22.(5)离心,清洗;
23.(6)再匀混,上机检测。
24.可选的,所述孵育的时间为10~20分钟,优选15分钟。
25.可选的,所述裂解的时间为10~15分钟,优选10分钟。
26.可选的,所述使用方法中的操作均在室温条件下进行。
27.本发明还涉及一种监测急性b淋巴细胞白血病微小残留病灶的监测方法,至少包括以下步骤:
28.(1)取2个流式管,标记为样本管和对照管;
29.(2)在样本管中先加入brilliant stain buffer,然后加入连接有荧光素的抗体,混匀;
30.(3)在样本管和对照管中分别加入待测样本,孵育;
31.(4)在样本管和对照管中分别加入红细胞裂解液,裂解;
32.(5)离心,清洗;
33.(6)再匀混,上机检测。
34.本发明至少具有以下有益的效果:
35.本发明的试剂盒包括26个抗体,针对骨髓b细胞的发育模式和all-b 常见的异常表达,结合全光谱流式细胞仪,可一管panel完成以上所有检测,方便快捷,省时省力,操作简单。
附图说明
36.图1为实施例2的流式细胞术的二维点图;
37.图2为实施例2的流式细胞术的二维点图。
具体实施方式
38.该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
39.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也包括复数形式,此外,还应当理解的是,当在本说明中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
40.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
41.本发明结合全光谱流式细胞仪,通过对荧光素进行筛选,并与抗体进行了更合理的搭配和实验优化,设计出一套26色all-b的mrd检测 panel,共包括26个抗体,可对all-b患者进行全面的白血病微小残留病灶检测。试剂盒内含有用于检测b系发育的抗体和用于
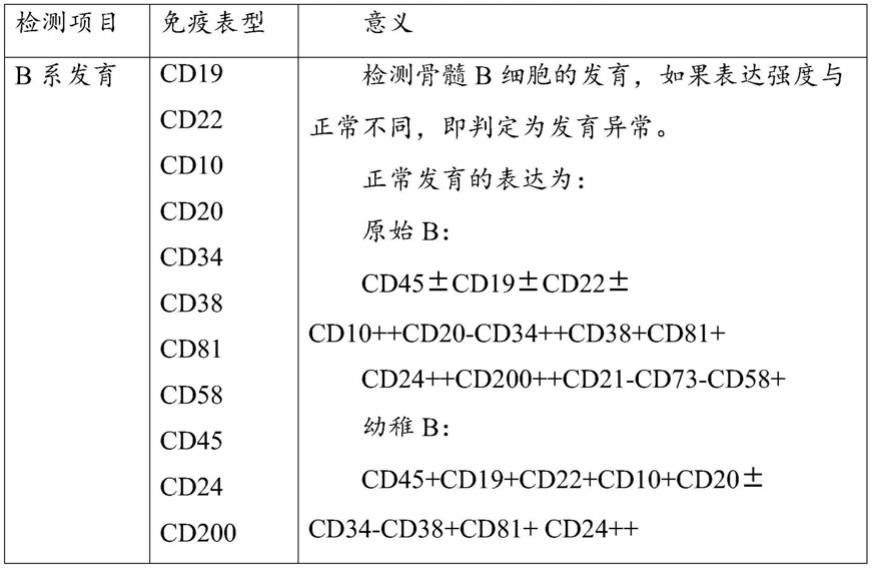
检测异常表达的抗体,用于检测b系发育的抗体包括:抗cd19抗体、抗cd22抗体、抗 cd10抗体、抗cd20抗体、抗cd34抗体、抗cd38抗体、抗cd81抗体、抗cd58抗体、抗cd45抗体、抗cd24抗体、抗cd200抗体、抗cd21 抗体、抗cd73抗体;用于检测异常表达的抗体包括:抗cd13抗体、抗 cd33抗体、抗cd15抗体、抗cd65抗体、抗cd66c抗体、抗cd2抗体、抗cd56抗体、抗cd86抗体、抗cd133抗体、抗ng2抗体、抗cd304 抗体、抗cd44抗体、抗cd123抗体。抗体的检测意义如表1所示:
42.表1
43.[0044][0045]
其中,抗体所连接的荧光素如表2所示:
[0046]
表2
[0047]
[0048][0049]
本发明实施例根据抗体表达强弱配上相应强度的荧光素,这个panel 是使用全光谱多色流式在实验中优化而成的,临床可直接使用,无需预实验,不会导致检测中因为抗体强度表达不合适所致的检测结果不准确。
[0050]
具体的,本发明实施例中每种抗体分别包装,抗体的浓度为80~120 μg/ml,优选100μg/ml。每种抗体的包装体积为0.5ml;每个待测样本使用每种抗体的体积为5μl。抗体保存于添加有0.1wt%叠氮化钠的pbs缓冲溶液中。
[0051]
实验所需的其他试剂有:brilliant stain buffer(bd公司,购买链接为 https://www.bdbiosciences.com/cn/solrsearch?text=566349#);pbs;红细胞裂解液(lyse lysing buffer,来源于bd pharm,购买链接为 https://www.bdbiosciences.com/cn/applications/research/stem-cell-research/ stem-cell-buffers-and-ancillary-reagents/lysing-buffer/p/555899)。
[0052]
本发明实施例试剂盒的具体使用方法为:
[0053]
一、试剂的准备:
[0054]
1、取2个流式管,标记为样本管和对照管;
[0055]
2、在样本管先加入brilliant stain buffer 10μl于样本管中,再加入每种抗体5μl,充分混匀;
[0056]
3、在样本管和对照管中分别加入待测样本100μl,充分混匀,室温孵育15分钟使抗体和细胞抗原结合;
[0057]
3、再次混匀后,在样本管和对照管中分别加入红细胞裂解液4ml,室温裂解10分钟;
[0058]
4、离心1500转(1050rpm)5min,吸弃上清,充分混匀;
[0059]
5、在样本管和对照管中分别加入pbs 4ml,离心1500转(1050rpm) 5min,吸弃上清,充分混匀;
[0060]
6、在样本管和对照管中分别加适量pbs后再混匀,300目滤网过滤,待上机检测。
[0061]
二、上机检测:
[0062]
将制备得到的样本管和对照管,直接用cytek全光谱流式细胞仪检测,用仪器自带分析系统进行数据分析。画出目的细胞,将各目的细胞的发育模式和抗原表达,跟正常人或者该患者初诊时的数据(即参考值)进行比较,看检测的b细胞发育和表达是否正常,从而可对all-b的患者b细胞是否为残留的肿瘤细胞进行评估。
[0063]
实施例1
[0064]
一种用于监测急性b淋巴细胞白血病mrd的流式细胞术试剂盒,其具体组成如表3所示。
[0065]
表3
[0066][0067][0068]
实施例2
[0069]
以正常骨髓标本为待测样本,采用实施例1的试剂盒进行检测,得到流式细胞术的二维点图如图1~图2所示(所圈门的含义如表4所示)。
[0070]
表4
[0071][0072]
采用仪器自带软件进行数据分析,画出目的细胞,显示如表5所示表格。从上到下分别显示获取细胞的总数、淋巴细胞占总细胞的比例和细胞数,b细胞占淋巴细胞的比例和细胞数、以及原始和成熟b细胞占b细胞的比例和细胞数。
[0073]
表5
[0074][0075][0076]
将各目的细胞占有核细胞的百分比,跟参考值进行比较,看检测的细胞亚群(cd19 幼稚b细胞、cd19 cd34 、cd19 cd20 )比例与参考值相比增高还是降低,从而可对待测样本的急性b淋巴细胞白血病微小残留病灶进行评估。
[0077]
本技术虽然以较佳实施例公开如上,但并不是用来限定权利要求,任何本领域技术人员在不脱离本技术构思的前提下,都可以做出若干可能的变动和修改,因此本技术的保护范围应当以本技术权利要求所界定的范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。