1.本发明属于食品技术领域,具体涉及一种大球盖菇风味活性肽基料及其制备方法和应用。
背景技术:
2.大球盖菇风味肽是一种菌物源性的天然呈味物质,具有的风味特性和营养价值,不仅能带来愉悦的味觉感受,还能提供多肽及氨基酸等营养成分,在保障人体健康中发挥着重要的营养作用和生物活性。随着崇尚营养健康消费时代的到来,开发兼具愉悦感官和药理活性的菌物源风味肽产品,作为一种重要的食品和药品新资源进行应用,符合我国大健康产业的发展需求。
3.血管紧张素转换酶(ace),又称激肽酶ⅱ或肽基-羧基肽酶,属血管内皮细胞膜结合酶,其可以通过肾素-血管紧张素系统,将血管紧张素ⅰ转化成具有升压作用的血管紧张素ⅱ;同时还可以使缓激肽失活。进而由于血管紧张素转换酶的上述两种功能,使其成为治疗高血压、心力衰竭、2型糖尿病和糖尿病肾病等疾病的理想靶点。因此,开发安全性高、成本低的食源性ace抑制肽,应用于相关保健或疾病辅助治疗,具有重要的应用价值。现有技术中存在多种植物来源的ace抑制肽,如以玉米或大豆来源的ace抑制肽,但是以大球盖菇为原料制备兼具ace抑制活性和呈鲜呈咸愉悦感官特征的风味活性肽基料,现有技术中还未见报道。
技术实现要素:
4.本发明的目的在于提供一种大球盖菇风味活性肽基料及其制备方法和应用,本发明制备的大球盖菇风味活性肽基料兼具更强的ace抑制活性和呈鲜呈咸愉悦感官特征。
5.本发明提供了一种大球盖菇风味活性肽基料的制备方法,包括如下步骤:
6.以碱性蛋白酶酶解大球盖菇,得到大球盖菇风味活性肽基料;
7.所述碱性蛋白酶的酶活为2
×
105u/g,用量为大球盖菇质量的0.5%~1.5%。
8.优选的,所述酶解的时间为30~90min,温度为40~60℃,ph值为8.5~10.5。
9.优选的,所述酶解包括超声辅助酶解,所述超声的模式包括平板超声。
10.优选的,所述超声辅助酶解的功率密度为120w/l,频率为20khz,超声辅助酶解的时间为30~60min。
11.优选的,在所述酶解前,还包括制备大球盖菇菌菇液;
12.所述大球盖菇菌菇液的制备方法包括:将水与所述大球盖菇的干品混合,所述大球盖菇的干品的质量与水的体积比为(40~60)g:1l。
13.优选的,在所述酶解前,对所述大球盖菇菌菇液进行预处理;所述预处理包括酶解预处理或超声预处理。
14.优选的,所述酶解预处理包括纤维素酶酶解;
15.所述纤维素酶的酶活为5
×
105u/g,用量为大球盖菇干品质量的0.8%~1.2%;所
述纤维素酶酶解的时间为50~130min,温度为60℃,ph值为5.0。
16.优选的,所述超声预处理的模式包括聚能超声;所述超声预处理的功率密度为120~350w/l,频率为20khz,时间为15~20min。
17.本发明还提供了一种利用上述技术方案所述制备方法制备得到的大球盖菇风味活性肽基料。
18.本发明还提供了上述技术方案所述的大球盖菇风味活性肽基料在减盐增鲜调味品和/或在制备ace抑制剂中的应用。
19.有益效果:
20.本发明提供了一种大球盖菇风味活性肽基料的制备方法,采用碱性蛋白酶对大球盖菇进行酶解,有效提高了大球盖菇风味活性肽基料的ace抑制活性、呈鲜呈咸愉悦感官特征。实施例的结果显示,咸味感官电子舌风味评价值为12.93~23.33(对照组无咸味特征),鲜味感官电子舌风味评价值较对比例提高1.21~1.28倍,ace抑制活性较对比例提升3.07倍。
21.同时,采用本发明制备方法得到的风味活性肽基料中的大球盖菇活性肽的含量更高,其含量高达461.31~492.87mg/g干重。
附图说明
22.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
23.图1为实施例2~14和对比例1~9中纤维素酶和超声预处理结果图;
24.图2为实施例15中蛋白酶筛选结果图;
25.图3为实施例16~18和对比例10~11中大球盖菇风味活性肽基料中活性肽含量结果图;
26.图4为实施例16,19~20和对比例12~13中大球盖菇风味活性肽基料中活性肽含量结果图;
27.图5为实施例16,21~24中大球盖菇风味活性肽基料中活性肽含量结果图;
28.图6为实施例16,25~28中大球盖菇风味活性肽基料中活性肽含量结果图;
29.图7为实施例16,29~32中大球盖菇风味活性肽基料中活性肽含量结果图;
30.图8为实施例33中大球盖菇风味活性肽基料中的活性肽含量为响应值结果图;
31.图9为实施例35中超声辅助酶解制备得到的大球盖菇风味活性肽基料中活性肽含量随超声处理酶解时间的变化图。
具体实施方式
32.本发明提供了一种大球盖菇风味活性肽基料的制备方法,包括如下步骤:
33.以碱性蛋白酶酶解大球盖菇,得到大球盖菇风味活性肽基料;
34.所述碱性蛋白酶的酶活为2
×
105u/g,用量为大球盖菇质量的0.5%~1.5%。
35.本发明优选对大球盖菇菌菇液进行酶解。本发明所述大球盖菇菌菇液的制备方法优选包括将水与所述大球盖菇混合,得到所述大球盖菇菌菇液。在本发明中,优选采用大球盖菇的干品进行所述混合;所述干品优选为将大球盖菇干燥和剪切菇丁后所得到的干品。
本发明优选采用大球盖菇菇柄及残次菇,以达到降低原料成本和对低值菌物蛋白开发和利用的技术效果。本发明所述干燥方式优选为热风干燥;所述干燥的温度优选为40~60℃,进一步优选为45~58℃,更优选为50~55℃;所述干燥的通风量优选为3500m3/h;所述干燥的时间优选为6~8h;经过本发明所述干燥后的大球盖菇干品的含水量<8%。本发明所述干品优选为菌菇丁,所述菌菇丁的体积优选为3
×3×
3mm。本发明对所述大球盖菇的品种和来源没有特殊限定,采用本领域技术人员常规购买所得即可;在本发明具体实施例中,所述大球盖菇,由上海菇林源菌业专业合作社提供。在本发明中,所述大球盖菇的干品与水的质量体积比优选为(40~60)g:1l,更优选为50g:1l。
36.得到所述大球盖菇菌菇液后,本发明优选对所述大球盖菇菌菇液进行预处理,得到预处理的菌菇液。本发明所述预处理优选包括酶解预处理或超声预处理。本发明所述酶解预处理优选包括纤维素酶酶解,所述纤维素酶的酶活优选为5
×
105u/g;所述纤维素酶的用量优选为大球盖菇的0.8wt.%~1.2wt.%。本发明所述纤维素酶的酶解时间优选为50~130min,进一步优选为60~120min,更优选为100~120min。所述纤维素酶的酶解温度优选60℃;所述纤维素酶酶解的ph优选5.0。本发明所述酶解处理可以使大球盖菇中蛋白质释放的效果更好,酶解后的菌菇液中可溶性蛋白质含量较高,适用于对进一步酶解法制备风味活性肽的原料进行预处理。
37.本发明优选还可以对大球盖菇菌菇液进行超声预处理,所述超声预处理的模式优选包括聚能超声。本发明所述超声预处理的功率密度优选为120~350w/l,更优选为150~300w/l。本发明所述超声预处理的频率优选20khz。本发明所述超声预处理的时间优选为12.5~33min,进一步优选为15~30min,更优选为15~20min。本发明所述超声预处理同样可以使大球盖菇中蛋白质更好地释放,处理后的菌菇液中可溶性蛋白质含量较高且超声作用时间短、能耗低,适用于对进一步酶解法制备风味活性肽的原料进行预处理。
38.得到所述预处理的菌菇液后,本发明以碱性蛋白酶酶解预处理的菌菇液,得到所述大球盖菇风味活性肽基料。本发明所述大球盖菇风味活性肽基料中包括大球盖菇风味活性肽。本发明所述碱性蛋白酶的酶活优选为2
×
105u/g,所述碱性蛋白酶的用量为大球盖菇的0.5wt.%~1.5wt.%,优选为0.99wt.%。本发明所述酶解的时间优选为30~90min,更优选为30~60min,最优选为51.62min。本发明所述酶解的温度优选为40~60℃,进一步优选为40~55℃,最优选42.03℃。本发明所述底物浓度优选为40~60g/l,更优选为45~55g/l,最优选为48.45g/l。本发明所述酶解的ph优选为8.5~10.5,进一步优选为8.5;本发明优选采用食品级弱碱性水可以保证基料制备条件,避免后续脱盐等高成本处理。本发明所述以碱性蛋白酶酶解制备大球盖菇活性肽的的方式,能够提高大球盖菇风味活性肽基料中大球盖菇活性肽的含量,同时可降低风味活性肽基料后续脱盐处理成本。
39.本发明所述酶解优选还包括超声辅助酶解,即本发明以超声辅助碱性蛋白酶酶解大球盖菇。本发明所述超声的模式优选平板超声。本发明所述超声辅助酶解的功率密度优选为100~150w/l,更优选为120w/l;所述频率优选20khz;所述超声辅助酶解的时间优选为30~60min,更优选为35~45min,进一步优选为40min。
40.本发明还提供了一种利用上述制备方法制备得到的大球盖菇风味肽活性基料及其在制备减盐增鲜调味品和/或在制备ace抑制剂中的应用。采用所述制备方法制备得到的大球盖菇风味活性肽基料中大球盖菇活性肽的含量更高,且具备愉悦感官需求,更加美味
营养;同时,所述大球盖菇活性肽具有更好的ace抑制活性,对高血压、心血管疾病等需要低钠饮食的特殊人群有重要的利用价值,可用于制备减盐增鲜调味品和ace抑制剂。
41.为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
42.实施例1
43.大球盖菇干品的制备,步骤如下:
44.大球盖菇菇柄及残次菇原料采用热风干燥进行干制,干燥温度为55℃,通风量为3500m3/h,干燥时间为6h,干制后的大球盖菇的水分含量<8%时,收集样品。
45.将上述烘干得到的大球盖菇样品进行剪切,得粒径3
×3×
3mm菇丁原料。
46.实施例2
47.纤维素酶大球盖菇预处理方法,步骤如下:
48.取实施例1制备得到的大球盖菇菇丁与水混合,配制底物浓度50g/l的大球盖菇菌菇液。
49.取上述大球盖菇菌菇液,加入索宝莱纤维素酶(酶活力5
×
105u/g),纤维素酶添加比例(质量比,纤维素酶/菇丁)为1.0%,反应温度60℃,ph为5.0,纤维素酶处理时间为120min,得到纤维素酶处理的原料液,4000rpm离心10min,收集上清液测可溶性蛋白含量。
50.可溶性蛋白含量的测定方法:采用苏州梦犀生物医药科技有限公司的bca法蛋白含量测定试剂盒。取10μl上清液样品,加入190μl试剂盒工作液,60℃烘箱盖上盖子保温30min,于96孔板,562nm处测定吸光值;
51.蛋白含量计算公式为:可溶性蛋白含量(mg/g菇丁干重)=标准品浓度
×
(样品测定的吸光值-空白测定的吸光值)/(标准品测定的吸光值-空白测定的吸光值)
×v÷
w;
52.注:标准品为牛血清蛋白标准品,浓度为0.5mg/ml;空白为水;v为收集到的上清液体积,单位ml;w为菇丁质量,单位g;下述可溶性蛋白含量均采用此测定方法,不再赘述。
53.实施例3
54.与实施例2实验步骤相同,唯一不同之处在于纤维素酶添加量为0.8%。
55.实施例4
56.与实施例2实验步骤相同,唯一不同之处在于纤维素酶添加量为1.2%。
57.对比例1
58.与实施例2实验步骤相同,唯一不同之处在于纤维素酶添加量为0.4%。
59.对比例2
60.与实施例2实验步骤相同,唯一不同之处在于纤维素酶添加量为0.6%。
61.对比例3
62.与实施例2实验步骤相同,唯一不同之处在于纤维素酶添加量为0%。
63.实施例5
64.与实施例2实验步骤相同,唯一不同之处在于纤维素酶处理时间为60min。
65.实施例6
66.与实施例2实验步骤相同,唯一不同之处在于纤维素酶处理时间为80min。
67.实施例7
68.与实施例2实验步骤相同,唯一不同之处在于纤维素酶处理时间为100min。
69.对比例4
70.与实施例2实验步骤相同,唯一不同之处在于纤维素酶处理时间为20min。
71.对比例5
72.与实施例2实验步骤相同,唯一不同之处在于纤维素酶处理时间为40min。
73.实施例2~7和对比例1~5中的蛋白质含量结果如图1中的a图和b图所示:
74.由a图可知,采用纤维素酶预处理时,底物浓度50g/l,预处理时间120min时,在纤维素酶添加比例为0.8~1.2%时,原料蛋白释放效果好,水溶液中可溶性蛋白含量较高,适用于做进一步酶解制备风味活性肽原料预处理。
75.由b图可知,采用纤维素酶预处理时,底物浓度50g/l,纤维素酶添加比例0.8%时,随着纤维素酶处理时间的延长,原料上清液中蛋白含量呈缓慢增加趋势,但增加效果不显著。在60~120min的预时间下,原料蛋白释放效果好,适用于做进一步酶解制备风味活性肽原料预处理。
76.实施例8
77.超声预处理大球盖菇的方法,步骤如下:
78.取实施例1制备得到的大球盖菇菇丁与水混合,配制底物浓度50g/l的大球盖菇溶液。
79.取上述大球盖菇溶液,采用聚能超声处理模式,超声处理功率密度为300w/l,超声频率20khz,超声处理时间20min,得到超声处理的原料液,4000rpm离心10min,收集上清液测可溶性蛋白含量。
80.实施例9
81.与实施例8实验步骤相同,唯一不同之处在于超声处理时间为15min。
82.实施例10
83.与实施例8实验步骤相同,唯一不同之处在于超声处理时间为25min。
84.实施例11
85.与实施例8实验步骤相同,唯一不同之处在于超声处理时间为30min。
86.对比例6
87.与实施例8实验步骤相同,唯一不同之处在于超声处理时间为10min。
88.对比例7
89.与实施例8实验步骤相同,唯一不同之处在于超声处理时间为35min。
90.实施例12
91.与实施例8实验步骤相同,唯一不同之处在于超声处理功率密度为150w/l。
92.实施例13
93.与实施例8实验步骤相同,唯一不同之处在于超声处理功率密度为200w/l。
94.实施例14
95.与实施例8实验步骤相同,唯一不同之处在于超声处理功率密度为250w/l。
96.对比例8
97.与实施例8实验步骤相同,唯一不同之处在于超声处理功率密度为120w/l。
98.对比例9
99.与实施例8实验步骤相同,唯一不同之处在于超声处理功率密度为400w/l。
100.实施例8~14和对比例6~9中制备得到的上清液中的可溶性蛋白含量如图1中的c图和d图所示:
101.由c图可以看出,采用聚能超声对大球盖菇进行预处理时,超声频率20khz,超声功率密度300w/l,底物浓度50g/l,随着超声处理时间增加,蛋白含量呈缓慢变化趋势,15~25min超声处理效果相当,在超声处理30min时蛋白释放效果最好,但增加不显著。因此,在超声处理时间15~20min时,原料蛋白释放效果好,溶液中可溶性蛋白含量较高,适用于做进一步酶解制备风味活性肽原料预处理。
102.由d图可以看出,采用聚能超声对大球盖菇进行预处理时,超声频率20khz,超声处理时间20min时,底物浓度50g/l,超声功率密度120~400w/l,随着超声功率密度的增加,原料上清液中蛋白含量呈缓慢增加趋势,在300w/l处达到最高,随着功率密度的进一步增加,蛋白含量显著下降。因此,原料处理优选超声功率密度在150~300w/l时,原料蛋白释放效果好,溶液中可溶性蛋白含量较高,适用于做进一步酶解制备风味活性肽原料预处理。
103.由实施例2~14及对比例1~9可以得出,纤维素酶和超声预处理原料,均对原料蛋白释放具有促进效果。纤维素酶处理方式,原料蛋白释放速率较超声处理缓慢,酶成本低,处理时间成本高;超声处理时间成本较纤维素酶处理方法低,但原料处理需要相应的设备支持,设备成本高。纤维素酶0.8%添加比例、120min处理效果(实施例3,蛋白含量204.64mg/g干重),与聚能超声功率密度300w/l、处理20min效果(实施例8,蛋白含量201.64mg/g干重)相当。实际工业生产中,可以根据时间成本、设备成本等技术可行和装备支撑综合考虑,选择适用原料处理模式。
104.实施例15
105.制备大球盖菇风味活性肽基料的蛋白酶筛选,步骤如下:
106.取实施例3预处理得到的原料液,根据食品级蛋白酶推荐使用的ph(详见表1),调节上述原料液的ph,得调节大球盖菇原料液。
107.取上述调节大球盖菇原料液,分别加入表1中的蛋白酶(食品级蛋白酶),蛋白酶添加量为原料菇丁质量的1%;各蛋白酶酶解温度按照蛋白酶推荐使用温度(详见表1),酶解时间为60min,得到各个处理的酶解液。
108.将上述得到的酶解液于100℃水浴灭酶10min后,4000rpm离心10min,收集上清液做大球盖菇风味活性肽基料。
109.以上述得到的大球盖菇风味活性肽基料的肽含量、电子舌风味评价值为指标,进行酶解反应水解蛋白酶筛选试验,考察蛋白酶酶种类对大球盖菇风味活性肽基料中大球盖菇活性肽含量及呈味特性的影响。
110.大球盖菇可溶性肽含量的测定方法:取0.5ml液体加入1ml试剂盒提取液,冰浴匀浆静置30min后,12000rpm,4℃离心10min,收集上清液。取10μl上清液样品,加入190μl试剂盒工作液,60℃烘箱保温30min,于96孔板562nm处测定吸光值。
111.肽含量计算公式为:肽含量(mg/g干重)=标准品浓度
×
(样品测定的吸光值-空白测定的吸光值)
÷
(标准品测定的吸光值-空白测定的吸光值)
×v÷
w;注:标准品为四肽标准品,浓度为0.5mg/ml;空白为水;v为收集到的上清液体积,单位ml;w为所用菇丁质量,单位g。酶解上清液中肽含量,进一步换算到其占比所用菇丁干重含量,来比较制备工艺中不同因素水平制备富肽基料的能力。下述肽含量均采用此测定方法,不再赘述。
112.基料呈味特性采用电子舌进行测定,具体方法:测量前对电子舌进行自检、活化、校准和诊断等步骤,以确保采集所得数据的可靠性和稳定性。用30mmol/lkcl溶液与0.3mmol/l酒石酸溶液配成参比溶液。将传感器置于参比溶液中归零30s,随后开始进行味觉测定。测试时间为30s,测试完毕后用参比溶液清洗3s,再次进行回味测定,测试时间30s。准确移取25ml测试液加入电子舌专用的样品杯中,每个样品重复4次,取后3次作为测试结果,结果如图2所示:
113.表1蛋白酶条件设置
114.编号名称酶活温度/℃ph范围供应商信息1胰蛋白酶250.n.f.u/mg376.5~8.5诺维信novozymes2中性蛋白酶50u/mg506.0~7.0上海麦克林生化科技有限公司3碱性蛋白酶200000u/g708.5-10.5北京索莱宝科技有限公司4风味蛋白酶500lapu/g505.5~7.5诺维信novozymes5木瓜蛋白酶2000u/mg506.0~7.0生工生物工程(上海)股份有限公司6胃蛋白酶3000u/mg371.5~2.0上海麦克林生化科技有限公司7复合蛋白酶1.6au-n/g505.5~7.5诺维信novozymes
115.由图2记载可知,中性蛋白酶、碱性蛋白酶、胃蛋白酶和复合蛋白酶酶解制备的风味活性肽基料,与鲜味(谷氨酸钠)和咸味(氯化钠)参照标品(标品浓度1mol/l)风味接近,四种酶可作为呈鲜呈咸风味活性肽基料酶解制备候选酶。进一步肽含量分析可知,碱性蛋白酶水解液中肽含量最高,达到311.05mg/g干重。基于大球盖菇蛋白酶酶解风味活性肽基料风味评价结果和产肽量结果,优选碱性蛋白酶进行后续呈鲜呈咸风味活性肽基料酶解制备。
116.实施例16
117.碱性蛋白酶的酶解条件筛选,步骤如下:
118.配制底物浓度50g/l的大球盖菇原料液,采用实施例3预处理条件,处理得到进一步碱性蛋白酶酶解原料液;碱性蛋白酶加酶量为大球盖菇原料液中菇丁质量的1%,酶解温度为50℃,ph9.0,酶解时间为60min,得到酶解液。
119.实施例17
120.与实施例16实验步骤相同,唯一不同之处在于酶解时间为90min。
121.实施例18
122.与实施例16实验步骤相同,唯一不同之处在于酶解时间为30min。
123.对比例10
124.与实施例16实验步骤相同,唯一不同之处在于酶解时间为120min。
125.对比例11
126.与实施例16实验步骤相同,唯一不同之处在于酶解时间为150min。
127.将实施例16~18和对比例10~11得到的酶解液于100℃水浴灭酶10min后,4000rpm离心10min,收集上清液做大球盖菇风味活性肽基料。
128.以上述得到的风味基料中的肽含量为指标,进行酶解反应的酶解时间筛选试验,考察酶解时间对酶解反应风味活性肽产生的影响,结果如图3图所示。
129.由图3可知,酶解反应60min和90min时,酶解液中肽含量较高,随着酶解时间延长,
肽含量呈下降趋势,酶解制备风味活性肽时间应控制在90min内。因此,在本发明中,碱性蛋白酶水解温度50℃,ph 9.0,底物浓度50g/l,碱性蛋白酶加酶量1%时,所述碱性蛋白酶酶解时间为30~90min。在本发明限定的酶解条件下进行试验,能够获得富含大球盖菇风味活性肽基料。
130.实施例19
131.与实施例16实验步骤相同,唯一不同之处在于碱性蛋白酶加酶量为0.5%。
132.实施例20
133.与实施例16实验步骤相同,唯一不同之处在于碱性蛋白酶加酶量为1.5%。
134.对比例12
135.与实施例16实验步骤相同,唯一不同之处在于碱性蛋白酶加酶量为2.0%。
136.对比例13
137.与实施例16实验步骤相同,唯一不同之处在于碱性蛋白酶加酶量为2.5%。
138.将实施例16、19~20和对比例12~13得到的酶解液于100℃水浴灭酶10min后,4000rpm离心10min,收集上清液做大球盖菇风味活性肽基料。
139.以上述得到的大球盖菇风味活性肽基料中的肽含量为指标,进行酶解反应的加酶量筛选试验,考察加酶量对酶解反应风味活性肽产生的影响,调查结果见图4图所示。
140.由图4记载可知,加酶量0.5%时,酶解液中肽含量较高,随着加酶比例提升,肽含量呈下降趋势,应控制酶解反应加酶量。因此,本发明中,碱性蛋白酶水解温度50℃,ph 9.0,底物浓度50g/l,酶解时间60min时,所述碱性蛋白酶加酶量优选0.5~1.5%,在本发明限定的酶解条件下进行试验,能够获得富含大球盖菇风味活性肽基料。
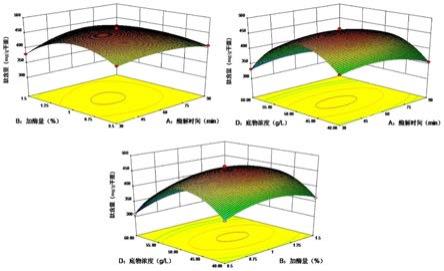
141.实施例21
142.与实施例16实验步骤相同,唯一不同之处在于原料液ph值为8.5。
143.实施例22
144.与实施例16实验步骤相同,唯一不同之处在于原料液ph值为9.5。
145.实施例23
146.与实施例16实验步骤相同,唯一不同之处在于原料液ph值为10。
147.实施例24
148.与实施例16实验步骤相同,唯一不同之处在于原料液ph值为10.5。
149.将实施例16、21~24得到的酶解液于100℃水浴灭酶10min后,4000rpm离心10min,收集上清液做大球盖菇风味活性肽基料。
150.以上述得到的风味基料中的肽含量为指标,进行酶解反应的ph筛选试验,考察酶解初始ph对酶解反应大球盖菇风味活性肽产生的影响,调查结果见图5。
151.因在反应过程中,避免外源钠离子的引入及后续脱盐处理,未对酶解过程中ph调节。由图5可知,不同初始ph对大球盖菇活性肽含量影响不大。因此,在本发明限定的酶解条件下进行试验,采用食品级弱碱性水来保证酶解反应条件。
152.实施例25
153.与实施例16实验步骤相同,唯一不同之处在于酶解温度为40℃。
154.实施例26
155.与实施例16实验步骤相同,唯一不同之处在于酶解温度为45℃。
156.实施例27
157.与实施例16实验步骤相同,唯一不同之处在于酶解温度为55℃。
158.实施例28
159.与实施例16实验步骤相同,唯一不同之处在于酶解温度为60℃。
160.将实施例16、25~28得到的酶解液于100℃水浴灭酶10min后,4000rpm离心10min,收集上清液做大球盖菇风味活性肽基料。
161.以上述得到的风味基料中的大球盖菇活性肽含量为指标,进行酶解反应温度筛选试验,考察温度对酶解反应风味活性肽产生的影响,调查结果见图6。
162.由图6可知,当酶解温度为40~60℃时,酶解液中活性肽的含量差异并不显著。因此,在本发明中,底物浓度50g/l,酶解时间60min,加酶量1%,酶解液ph 9.0时,所述酶解温度优选40~60℃。在本发明限定的酶解条件下进行试验,能够获得富含大球盖菇风味活性肽基料。
163.实施例29
164.与实施例16实验步骤相同,唯一不同之处在于底物浓度为40g/l。
165.实施例30
166.与实施例16实验步骤相同,唯一不同之处在于底物浓度为45g/l。
167.实施例31
168.与实施例16实验步骤相同,唯一不同之处在于底物浓度为55g/l。
169.实施例32
170.与实施例16实验步骤相同,唯一不同之处在于底物浓度为60g/l。
171.将实施例16、29~32得到的酶解液于100℃水浴灭酶10min后,4000rpm离心10min,收集上清液做大球盖菇风味活性肽基料。
172.以上述大球盖菇风味基料中的肽含量为指标,进行酶解反应的底物浓度筛选试验,考察底物浓度对酶解反应大球盖菇活性肽产生的影响,结果如图7所示。
173.由图7可知,在底物浓度为40~60g/l酶解反应中,肽含量均处于较高水平。因此,在本发明中,酶解时间60min,加酶量1%,酶解液ph 9.0,酶解温度50℃时,所述酶解底物浓度为40~60g/l。在本发明限定的酶解条件下进行试验,能够获得富含大球盖菇风味活性肽基料。
174.实施例33
175.选择酶解时间、加酶量、温度、底物浓度四个因素,以大球盖菇肽含量为响应值,设计四因素三水平box-benhnken试验,酶解反应制备风味活性肽工艺。酶解反应后,4000rpm离心10min,收集上清液测定大球盖菇基料中肽含量,确定酶解反应条件。进行酶解前需采用纤维素酶对原料进行预处理,加入纤维素酶的量为0.8wt.%,预处理120min,温度为60℃,ph值为5.0。试验因素水平表见表2,试验结果采用design-expert 8.0.6软件分析,结果见表3和图8。
176.表2响应面优化试验水平表
[0177][0178]
表3响应面实验结果
[0179]
[0180][0181]
由表3和图8记载可知,design-expert.v 8.0.6软件预测的最优酶解制备工艺条件:酶解时间51.62min,加酶量0.99%,酶解温度42.03℃,底物浓度48.45g/l。
[0182]
实施例34
[0183]
采用实施例33软件预测最优酶解工艺条件,验证实际产肽量与预测产肽量数值差异程度。经验证,该工艺实际产肽量平均值为461.31mg/g干重,与模型理论预测值466.51mg/g干重相比,相对误差为1.13%,模型预测最优酶解制备工艺可信。因此,大球盖菇风味活性基料肽酶解制备最佳工艺条件为:酶解时间51.62min,加酶量0.99%,酶解温度42.03℃,底物浓度48.45g/l。
[0184]
实施例35
[0185]
取实施例34大球盖菇风味活性肽基料酶解制备最佳工艺条件,采用平板超声模式,辅助酶解制备大球盖菇风味活性肽。超声功率密度120w/l,超声频率20khz,超声辅助酶解作用时间5~60min,考察平板超声辅助酶解对产肽量的影响。
[0186]
将实施例35制备得到的各个处理时间点的酶解液,于100℃水浴灭酶10min后,4000rpm离心10min,收集上清液做风味活性肽基料。平板超声辅助风味活性肽含量调查结果如图9所示。
[0187]
由图9记载可知,平板超声辅助酶解30min(肽含量469.21mg/g干重),即可达到传统酶解最优条件下的肽含量,较传统酶解时间缩短20min。平板超声辅助酶解40min时,肽含量(492.87mg/g干重)高于传统酶解,较传统酶解提升6.5%,随着进一步超声作用时间的延长,肽含量略有降低呈平稳变化趋势。因此,在本发明中,所述超声辅助酶解,优选平板超声模式,超声功率密度优选120w/l,超声频率20khz,超声辅助酶解时间优选30~60min,进一步优选35~45min,更优选为40min。
[0188]
实施例36
[0189]
取实施例34大球盖菇风味活性肽酶解制备最佳工艺条件,采用平板超声功率密度120w/l,超声频率20khz,平板超声辅助酶解作用时间40min,得平板超声辅助酶解液。酶解
液于100℃水浴灭酶10min后,4000rpm离心10min,收集上清液做风味活性肽基料。
[0190]
对比例14
[0191]
配制底物浓度48.45g/l的大球盖菇水溶液,沸水浸提120min。4000rpm离心10min,收集上清液做风味活性肽水提基料。经检测,沸水浸提得到的大球盖菇风味活性肽水提基料中的肽含量为119.2mg/g干重。
[0192]
将实施例34,36和对比例14得到的风味活性肽基料,进行电子舌风味评价及ace抑制活性分析,其中电子舌风味评价方法同上,不再赘述;
[0193]
ace抑制活性测定方法。风味活性肽基料ace抑制活性测定采用dojindo同仁化学ace kit-wst试剂盒进行分析。取20μl上清液样品,加入20μl试剂盒基质缓冲液和20μl试剂盒酶工作液,37℃培养60min,加入200μl试剂盒指示液,室温下培养10min,于96孔板,450nm处测定吸光值。ace抑制剂活性值(抑制率%)=(无抑制全显色的吸光值-样品测定的吸光值)
÷
(无抑制全显色的吸光值-试剂的空白对照吸光值)
×
100。分别以样品浓度和抑制剂活性为轴横纵坐标制作抑制曲线,由抑制曲线得到抑制率50%时样品的浓度(ic
50
)。
[0194]
电子舌风味评分结果及ace抑制活性结果(ic
50
)见表4-5。
[0195]
表4不同风味活性肽基料风味特性分析
[0196][0197][0198]
由表4记载可知,酶解风味活性肽基料均呈鲜、呈咸,传统酶解及超声辅助酶解40min制备的大球盖菇风味肽基料呈鲜呈咸特性,较对照组均有提升,尤其在咸味特性方面。超声辅助酶解40min制备的大球盖菇风味肽基料呈鲜呈咸特性高于传统酶解制备风味肽基料,超声辅助适度酶解产生的风味肽呈鲜呈咸特性更强。
[0199]
表5不同风味活性肽基料ace抑制活性分析
[0200] ic
50
(mg/ml)对比例140.378实施例340.123实施例360.122
[0201]
由表5记载可知,传统酶解制备和超声辅助酶解制备的大球盖菇风味肽基料ace抑制效果均优于水提制备的风味肽基料,采用本发明所述方法制备得到的风味活性肽基料的ace抑制效果,处于一个较优抑制水平。
[0202]
综上所述,采用本发明所述方法制备得到的风味活性肽基料中,风味肽含量高,在呈咸味、鲜味上都具有一定优势,优化工艺制备的大球盖菇风味活性肽基料可以作为增咸
提鲜调味品基料和降血压功能食品添加剂。
[0203]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。