一种用于抗雌激素受体
α
的氮杂稳定肽、其制备方法及其用途
技术领域
1.本发明属于化学和药学领域,具体涉及抗雌激素受体α的氮杂稳定肽、其制备方法及应用。
背景技术:
2.肿瘤是对全球人类的健康有重大影响的疾病。例如,国际癌症研究机构对2020年的癌症发病率和死亡率的统计,女性乳腺癌现已超过肺癌,成为了全球癌症发病率最主要的疾病(ca cancer j clin 2021,71(3):209-249.)。
3.因此发展新型的治疗药物刻不容缓,但是乳腺癌发生的分子机理复杂多样。其中雌激素受体在70%的乳腺癌中是高表达,并含有erα和erβ两种亚型(nature 1997,389(6652):753-758.)。通过研究发现激活erα可能导致乳腺及子宫细胞的增生,而选择性激动erβ反而有一定的抗细胞增殖的作用(nat genet 2007,39(5):655-660.)。所以靶向erα的配体结合口袋的内分泌药物如“他莫昔芬”已被广泛用于erα阳性乳腺癌的治疗(natrev drug discov 2003,2(3):205-213.)。但是传统的雌激素受体拮抗剂如“他莫昔芬”进行治疗易产生耐药且诱发癌症(cancer lett 2007,256(1):1-24.)。
4.因此发展治疗乳腺癌的新型疗法很有意义,基于靶向雌激素受体与共激活因子的蛋白-蛋白相互作用有望解决药物耐药性(proc natl acad sci usa 2014,111(49):17606-17611.;nat rev cancer 2009,9(9):631-643.)。共激活因子一般通过包含lxxll(其中l代表亮氨酸,x代表任意氨基酸)元件的α螺旋与erα相互作用,理论上体外合成的包含lxxll元件的多肽能够竞争性抑制这一作用,然而线性多肽由于具有不稳定性及很难穿过细胞膜等缺点,限制了其进一步发展。因此,针对雌激素受体α配体结合口袋以外区域开发出新的雌激素受体α抑制剂来治疗癌症显得非常必要。
技术实现要素:
5.针对现有技术中的上述技术问题,本发明要解决的技术问题是制备一种用于抗雌激素受体α的氮杂稳定肽并将其应用于稳定抗雌激素受体α。
6.本发明在研究比较中发现,化学方法(二硫键、烯烃复分解等)可以稳定或直接模拟α螺旋多肽。除此之外,通过对氮杂多肽的大量研究结构显示,氮杂多肽具有优异的代谢稳定性和生物活性,所以氮杂多肽作为蛋白质受体配体和酶抑制剂的研究具有广泛的应用前景,基于氮杂多肽的药物开发具有很大的潜力(ekici,et al.j med chem 2004,47,1889
–
1892;zhang,j et al.,angew.chem.int.ed.engl.2017,56,6284
–
6288)。本发明在上述研究基础上完成。
7.为了实现上述的目的,本发明的技术方案如下:
8.本发明提供了一种多肽,其结构式如式(a)所示:
[0009][0010]
其中,
[0011]
r1选自氢、色氨酸、异硫氰酸荧光素、羟基荧光素、已酰基、苯邻二甲酰亚胺类、蛋白水解靶向嵌合体或者生物素;
[0012]
r2选自氢,甲基,烷基,芳基,芳基取代烷基,氨基,氨基取代烷基,胺基;
[0013]
r3选自氢,甲基,烷基,芳基,芳基取代烷基,氨基,氨基取代烷基,胺基;
[0014]
l1选自叔亮氨酸、γ-甲基-l-亮氨酸或者亮氨酸;
[0015]
l2选自叔亮氨酸、γ-甲基-l-亮氨酸或者亮氨酸;
[0016]
l3选自叔亮氨酸、γ-甲基-l-亮氨酸或者亮氨酸;
[0017]
y选自碳原子或者苯基。
[0018]
xaa选自l-赖氨酸,d-赖氨酸,l-鸟氨酸,d-鸟氨酸,l-2,3-二氨基丙酸或d-2,3-二氨基丙酸;
[0019]
m选自0或者1;
[0020]
n选自-1,0或者1;
[0021]
aza为氮杂氨基酸及其衍生物,其结构如式(b)所示:
[0022][0023]
其中,r选自氢原子、烷基、芳基、杂芳基、芳基取代烷基、杂芳基取代烷基或环烷基取代烷基。
[0024]
较好的,所述抗雌激素受体α的氮杂稳定肽的结构为:r1为氢或荧光标记β丙氨酸,r2为氢,甲基,胺基,r3为氢,甲基,胺基,l1为亮氨酸,l2为亮氨酸,l3为亮氨酸,y为碳原子或苯环,xaa为赖氨酸,m为0,n为-1,或者0。
[0025]
较好的,所述的氮杂稳定肽选自以下化合物中的一个或者若干个:
[0026]
[0027][0028]
一方面,本发明提供了上述抗雌激素受体α的氮杂稳定肽的制备方法。
[0029]
本发明的抗雌激素受体α的氮杂稳定肽的制备方法包括如下步骤:
[0030]
(1)制备寡肽固相树脂:通过标准的固相合成方法在将目标寡肽负载在mbha树脂上;
[0031]
(2)制备化合物ⅲ:以单取代或多取代苄基腙ⅰ为原料和dsc反应生成化合物ⅱ,化合物ⅱ与寡肽固相树脂反应生成化合物ⅲ;
[0032]
(3)制备化合物ⅳ:化合物ⅲ通过脱去保护基团得到化合物ⅳ;
[0033]
(4)制备化合物
ⅴ
:化合物ⅳ通过与羟基酸缩合得到化合物
ⅴ
;
[0034]
(5)制备化合物ⅵ:化合物
ⅴ
通过mitsunobu反应生成化合物ⅵ;
[0035]
(6)制备化合物ⅶ:化合物ⅵ进行还原反应生成化合物ⅶ;
[0036]
(7)制备化合物
ⅷ
:化合物ⅶ进行胺解反应生成化合物
ⅷ
;
[0037]
(8)制备
ⅸ
:化合物
ⅷ
通过标准固相合成方法合成制备化合物
ⅸ
。
[0038]
该制备方法的反应式如下所示:
[0039][0040]
其中,mitsunobu反应(光延反应)是一种双分子亲核取代反应(sn2反应)。1967年,mitsunobu报导了在三苯膦(pph3)和偶氮二甲酸二乙酯(dead)作用下酸和醇缩合成酯的新方法。当底物为仲醇的时候,与羟基相连的碳原子的构型会发生翻转。经过多年的研究和发展,形成了一大类合成方法,统称为mitsunobu反应。
[0041]
再一方面,本发明提供了所述的抗雌激素受体α的氮杂稳定肽的应用,包括识别雌激素受体α并抑制其活性,或者是用作穿膜化合物。
[0042]
本发明还包括所述的氮杂稳定肽在制备缓解或者治疗肿瘤的药物中的应用。
[0043]
所述的肿瘤包括各种良性或者恶性的赘生物、囊肿、肿块、转移物,等等。例如,所述的肿瘤选自乳腺癌或者宫颈癌。
[0044]
本发明的氮杂稳定肽可以用于制备药物组合物,该药物组合物包含治疗有效量或有效剂量的所述的氮杂多肽类似物、或其药学上可接受的盐,以及药学上可接受的载体。该药物组合物也可以所述的氮杂多肽类似物以及其他市售或者已经报道的抗肿瘤药物,尤其是各类缓解或者治疗乳腺癌或者肺癌的药物。
[0045]
本发明还包括所述药物组合物在制备抗癌药物中的应用。所述的药物组合物可以用于制备抗癌药物,也可以应用于制备抗乳腺癌、宫颈癌药物等。
[0046]
本发明中使用的“治疗有效量”或“有效剂量”指的是无毒的但足以达到希望的生物学、治疗的和/或预防的结果的氮杂稳定肽的剂量。该结果可以是疾病的征兆、症状或诱因的减少和/或减轻,或者任何其他希望的生物系统的改变。例如,用于治疗用途的“有效剂量”是产生临床上疾病的显著改善所需的如这里所公开的氮杂稳定肽本身或包含这里的氮杂稳定肽的组合物的量。在任何个别情况中的合适的有效剂量可以由本领域普通技术人员使用常规的试验确定。因此,本发明中使用的氮杂稳定肽的有效剂量指能够达到希望的氮杂稳定肽口服使用的量。
[0047]“药学上可接受的”意思是一种物质在生物学上或其他方面不是不合需要的,即该物质可以施用于个体而不引起不希望的生物学效应或不以有害的方式与包含该物质的组合物中的任何成分发生相互作用。
[0048]
术语“治疗”及其语法上的同义词包括实现治疗效果和/或预防效果。治疗效果意思是进行治疗的基础病症的缓解或根除。治疗效果还通过一种或多种与基础病症相关的生理症状的根除或缓解而获得,从而在患者中观察到改善,尽管事实是患者可能仍受到基础病症的折磨。对于预防效果,可用于临床诊断为肿瘤的患者身上,或者尽管可能还没有诊断出这一状态,但报告有这些状态的一种或多种生理学症状的患者身上实行本发明的方法,或者对这些患者施用本发明的组合物。
[0049]
如本文所用,术语“药学上可接受的载体”指用于治疗即给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的副作用。合适的载体是指本领域普通技术人员所熟知的,在药物中药学上可接受的载体可包括液体,如水、盐水、甘油和吐温。另外,这些载体中还可能存在辅助性的物质,如崩解剂、润湿剂、乳化剂、ph缓冲物质等。
[0050]
本发明提供的治疗肿瘤的药物可以根据不同给药途径而制备成各种剂型。这些剂型可以下面方式之一施用:口服、局部用药(皮肤贴剂、皮下埋植剂)、非肠道用药,如皮下和肌肉,或借助一种外植储器用药。其中治疗肿瘤时优选口服的给药方式。
[0051]
在本发明中,使用药物时,是将安全有效量的氮杂稳定肽施用于大鼠,其中该安全有效量治疗肿瘤时通常至少约80毫克/千克体重,而且在大多数情况下不超过100毫克/千克体重,较佳的剂量是约40-80毫克/千克体重;当然,具体剂量以人为例,还要考虑患者的年龄、体重、自然健康状况、营养状况、化合物活性强度、服用、代谢速率等因素,这些都是本领域技术人员技能范围之内的知识与技能,此不赘述。
[0052]
在给药前,氮杂稳定肽可与羧甲基纤维素钠、生理盐水或为本领域的熟练人员所熟知的任何其他适合的溶液混合。氮杂稳定肽制剂可如需求的那样以固体(冷冻干燥)或液体制剂形式给药。
[0053]
本发明与现有技术相比具有以下有益效果:
[0054]
(1)本发明提供了一种抗雌激素受体α的氮杂多肽类似物,经过初步测试发现,所述抗雌激素受体α的氮杂多肽类似物具有较好的螺旋性,穿膜性和抗癌活性,具有潜在的药用价值。
[0055]
(2)本发明以新颖、绿色、高效的方法得到了氮杂多肽类化合物,并通过易得的羟基酸为底物使用mitsunobu反应对氮杂多肽侧链进行修饰避免了传统方法叔丁醇钾和卤代烃的使用,大大拓宽了氮杂多肽底物的衍生化。
附图说明
[0056]
图1是9a的质谱图谱。表明本发明制备获得纯的该化合物。
[0057]
图2是9b的质谱图谱。表明本发明制备获得纯的该化合物。
[0058]
图3是9c的质谱图谱。表明本发明制备获得纯的该化合物。
[0059]
图4是9d的质谱图谱。表明本发明制备获得纯的该化合物。
[0060]
图5是9e的质谱图谱。表明本发明制备获得纯的该化合物。
[0061]
图6是10a的质谱图谱。表明本发明制备获得纯的该化合物。
[0062]
图7是10b的质谱图谱。表明本发明制备获得纯的该化合物。
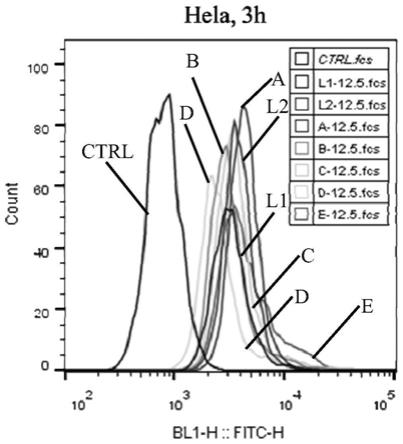
[0063]
图8是10c的质谱图谱。表明本发明制备获得纯的该化合物。
[0064]
图9是10d的质谱图谱。表明本发明制备获得纯的该化合物。
[0065]
图10是10e的质谱图谱。表明本发明制备获得纯的该化合物。
[0066]
图11是本发明氮杂稳定肽(类似物)的螺旋性测试结果图。
[0067]
图12是本发明氮杂稳定肽(类似物)的穿膜活性测试图。
[0068]
其中,control是指未加药物、l1是fam-βala-his-lys-ile-leu-his-arg-leu-leu-gln-nh2、l2是fam-βala-arg-lys-ile-leu-his-arg-leu-leu-gln-nh2、a是10a、b是10b、c是10c、d是10d、e是10e。
[0069]
图13是本发明氮杂稳定肽(类似物)穿膜的显微镜图。
[0070]
其中,control是指未加药物,linear是fam-βala-arg-lys-ile-leu-his-arg-leu-leu-gln-nh2。
[0071]
图14是本发明氮杂稳定肽(类似物)的血清稳定性图。
[0072]
其中linear是fam-βala-arg-lys-ile-leu-his-arg-leu-leu-gln-nh2。
具体实施方式
[0073]
本发明在r-arg-aza-ile-l1-his-arg-l2-l3-gln-nh2基础上,将his或arg替换为xaa,然后在xaa上引入侧链后环化,获得了具备抗雌激素受体α活性的氮杂稳定肽。
[0074]
下面通过具体实施例对本发明进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明的保护范围。
[0075]
下述实施例中,部分物质的全称或相应的中文名称如下:
[0076]
dsc:n,n-二琥珀酰亚胺基碳酸酯。
[0077]
dtbad:偶氮二甲酸二叔丁酯。
[0078]
diea:n,n-二异丙基乙胺。
[0079]
dmf:n,n-二甲基甲酰胺。
[0080]
dcm:二氯甲烷。
[0081]
thf:四氢呋喃。
[0082]
btc:三光气。
[0083]
pbu3:三丁基磷。
[0084]
tbahs:四丁基硫酸氢铵。
[0085]
实施例1:氮杂多肽类似物9a,10a的制备
[0086]
制备路线如下:
[0087][0088]
1.制备寡肽固相树脂:mbha树脂(负载量约为:0.35mmol/g,每肽的起始树脂量为:570mg),通过标准的固相合成方法将nh
2-ile-leu-lys(alloc)-arg(pbf)-leu-leu-gln(trt)-nh2负载在mbha树脂。
[0089]
2.制备化合物3:将dsc(205.4mg,0.8mmol)溶解在3.2ml dmf/dcm(1:1,v/v)中的溶液。然后将(e)-(2-硝基苄基)腙(132.2mg,0.8mmol)溶解在1ml dcm中后加入,然后在室温下搅拌2小时后将母液转移至负载了nh
2-ile-leu-lys(alloc)-arg(pbf)-leu-leu-gln(trt)-nh2的树脂中(0.2mmol)。然后加入diea(206.5μl,1.2mmol)并在摇床上振摇12小时。反应完全后,依次用dmf(3
×
10ml),meoh(3
×
10ml),thf(3
×
10ml)和dcm(3
×
10ml)洗涤树脂。
[0090]
3.制备化合物4:化合物3在dcm中溶胀后抽干后依次加入pd[p(c6h5)](23.1mg,0.02mmol),1,3-二甲基巴比妥酸(312.2mg,2mmol)和dcm(5ml)室温下振摇2小时后依次用dmf(3
×
10ml),meoh(3
×
10ml)和dcm(3
×
10ml)进行洗涤。
[0091]
4.制备化合物5a:将羟基乙酸(152.2mg,2mmol),nhs(230.2mg,2mmol),edci(383.4mg,2mmol),dmap(2.4mg,0.02mmol)溶解在5ml dmf中的溶液,然后在室温下搅拌2小时后将母液转移至负载了4a的树脂中(0.2mmol)。在摇床上振摇12小时,反应完全后,依次用dmf(3
×
10ml),meoh(3
×
10ml),thf(3
×
10ml)和dcm(3
×
10ml)洗涤树脂。
[0092]
5.制备6a:依次向固相管中加入树脂5a,dtbad(322.4mg,1.4mmol)和thf(4ml)后冷却至0℃后加入三丁基磷(538.4μl,2mmol)将混合物搅拌10分钟,析出沉淀后将沉淀物和异丙醇(159.9μl,2mmol)依次加入到树脂5a中(350μl,1.4mmol)。并在摇床上振摇5小时后,依次用dmf(3
×
10ml),thf(3
×
10ml),meoh(3
×
10ml)和dcm(3
×
10ml)洗涤树脂。
[0093]
6.制备7a:树脂6a在dcm中溶胀后抽干加入h2o(4ml)和dcm(4ml)并依次加入连二亚硫酸钠(696.4mg,4mmol),碳酸钾(774.0mg,5.6mmol)和tbahs(135.8mg,0.4mmol)室温下振摇2小时后依次用dmf(3
×
10ml),thf(3
×
10ml),meoh(3
×
10ml)和dcm(3
×
10ml)进行洗涤。
[0094]
7.制备8a:将nh2oh.hcl(278.0mg,4mmol)和间苯二胺(432.6mg,4mmol)在etoh溶
液(5.3ml)溶清后转移至7a(-208mg,0.2mmol),并在60℃下超声反应12小时。反应完全后将树脂用10%diea:dmf(3
×
10ml),dcm-h2o(1:1,v/v),dmf(3
×
10ml),thf(3
×
10ml),meoh(3
×
10ml)和dcm(3
×
10ml)。
[0095]
8.制备9a:将boc-arg(pbf)-oh(526.7mg,1mmol)加入6ml dcm中溶清后加入btc(99.1mg,0.33mmol),随后在通风橱里面加入2,4,6-三甲基吡啶(684.0μl,4.6mmol),搅拌5分钟进行预活化,然后转移至树脂8a中振摇12小时。反应完全后依次用dmf(3
×
10ml),meoh(3
×
10ml),thf(3
×
10ml)和dcm(3
×
10ml)洗涤树脂。通过lc-ms分析样品若显示偶联不完全,则重复偶联12小时。
[0096]
9.制备10a:通过标准的固相多肽合成偶联β丙氨酸后在dmf中使用pybop(3当量),5-羧基荧光素(3当量)和hobt(3当量)作为偶联剂,diea(6当量)作为碱。反应完全后依次用dmf(3
×
10ml),meoh(3
×
10ml),thf(3
×
10ml)和dcm(3
×
10ml)洗涤树脂。最后从树脂裂解下来,粗产物通过制备型rp-hplc纯化。
[0097]
10.使用agilent zorbax sb-aq c18柱(孔径:粒径:5μm;250
×
4.6mm)以1ml/min的流速和5-95%的洗脱梯度洗脱40分钟。
[0098]
9a:lc-ms(5-95%mecn,40min)r.t.=20.462min;hrms(esi)m/z calcd for c
50h89n18o11
[m h] 1117.6953;found 1117.6954
[0099]
10a:lc-ms(5-95%mecn,40min)r.t.=23.492min;hrms(esi)m/z calcd for c
74h104n19o18
[m h] 1546.7801;found 1546.7815。
[0100]
如图1和6所示,9a和10a制备成功,达到预期的化合物的纯度。
[0101]
实施例2:氮杂多肽类似物9b,10b的制备
[0102]
[0103]
按照实施例1的制备方法,将5a步骤中的羟基乙酸替换成boc-ser-oh,制备合成了9b,10b。
[0104]
9b:lc-ms(5-95%mecn,40min)r.t.=17.326min;hrms(esi)m/z calcd for c
51h92n19o11
[m h]
1146.7218;found 1146.7224。
[0105]
10b:lc-ms(5-95%mecn,40min)r.t.=21.401min;hrms(esi)m/z calcd for c
75h107n20o18
[m h]
1575.8067;found 1577.8218。
[0106]
如图2和7所示,9b和10b制备成功,达到预期的化合物的纯度。
[0107]
实施例3:氮杂多肽类似物9c,10c的制备
[0108]
按照实施例1的制备方法,将5a步骤中的羟基乙酸替换成boc-d-ser-oh,制备合成了9c,10c。
[0109]
9c:lc-ms(5-95%mecn,40min)r.t.=17.359min;hrms(esi)m/z calcd for c
51h92n19o11
[m h]
1146.7218;found 1146.7222。
[0110]
9c:lc-ms(5-95%mecn,40min)r.t.=21.480min;hrms(esi)m/z calcd for c
77h114n21o17
[m h]
1575.8067;found 1577.8069。
[0111]
如图3和8所示,9c和10c制备成功,达到预期的化合物的纯度。
[0112]
实施例4:氮杂多肽类似物9d,10d的制备
[0113]
按照实施例1的制备方法,将5a步骤中的羟基乙酸替换成2,2-二甲基-3-羟基丙酸制备合成了9d,10d。
[0114]
9d:lc-ms(5-95%mecn,40min)r.t.=19.760min;hrms(esi)m/z calcd for c
53h95n18o11
[m h]
1159.7422;found 1159.7421。
[0115]
10d:lc-ms(5-95%mecn,40min)r.t.=30.827min;hrms(esi)m/z calcd for c
77h114n21o17
[m h]
1588.8271;found 1588.8299。
[0116]
如图4和9所示,9d和10d制备成功,达到预期的化合物的纯度。
[0117]
实施例5:氮杂多肽类似物9e,10e的制备
[0118]
按照实施例1的制备方法,将5a步骤中的羟基乙酸替换成4-羟甲基苯甲酸制备合成了9e,10e。
[0119]
9e:lc-ms(5-95%mecn,40min)r.t.=19.974min;hrms(esi)m/z calcd for c
56h93n18o11
[m h]
1193.7266;found 1193.7269。
[0120]
10e:lc-ms(5-95%mecn,40min)r.t.=22.323min;hrms(esi)m/z calcd for c
80h108n19o18
[m h]
1622.8114;found 1622.8120。
[0121]
如图5和10所示,9e和10e制备成功,达到预期的化合物的纯度。
[0122]
实施例6:螺旋性测试
[0123]
cd光谱用圆二色光谱仪(chirascan-plus)来测量。常温下,将高纯度的多肽溶解在50%tfe中混匀,用移液枪将多肽溶液加入到1mm比色皿中,在圆二色光谱仪中以20nm/秒的扫描速度采集cd光谱。圆二色谱仪的参数设置为:波长的扫描范围为190nm到260nm,扫描两次,扫描分辨率为0.5nm,响应时间为1s,温度设置为25℃。多肽最终浓度在0.5mm至1mm之间。
[0124]
实验结果显示,抗雌激素受体α的氮杂稳定肽类似物具有较好的螺旋性,其中9a的螺旋度最高(如图11所示),9b和9c的螺旋度接近。
[0125]
实施例7:抗癌活性测试
[0126]
为考察本发明新化合物的抗肿瘤活性,通过初步抗肿瘤药理试验进行肿瘤生长抑制活性评价。采用体外肿瘤细胞模型,mtt法进行活性筛选试验,(所涉及的试剂及材料均可通过公开渠道获得,例如,从赛默飞或者sigma公司订购)试验操作步骤包括:
[0127]
具体步骤:将细胞用胰酶消化,按约5000个每孔接种到96孔板中,每孔加100微升,过夜培养使细胞贴壁,然后加入梯度稀释的多肽药物及对照药物,培养箱培养20小时,然后每孔加10微升cck8试剂继续培养1小时。用酶标仪检测450nm波长处光吸收值,与对照做对比,计算出相对细胞活力。
[0128]
实验结果显示,抗雌激素受体α的氮杂稳定肽9a,9d,9e对雌激素受体α阳性的细胞系明显的作用,所以具有潜在药物用途。
[0129]
表1 氮杂稳定肽类似物活性测试结果
[0130][0131]
tamoxifen,他莫昔芬,化学名称为(z)-2-[4-(1,2-二苯基-1-丁烯)苯氧基]-n,n-二甲基乙胺,是一种有机化合物,分子式为c
26h29
no,临床上用于治疗晚期乳腺癌和卵巢癌。
[0132]
实施例8:穿膜活性测试
[0133]
操作步骤为:先将hela细胞在12孔板种板过夜,使细胞贴壁。然后分别每孔加入12.5μm待测fam标记的多肽,培养3小时。之后吸走培养液,用pbs洗3遍,然后胰酶消化5min,收集细胞并用pbs悬浮,离心后再用pbs清洗,重复3遍。之后用流式细胞仪(bd)检测细胞荧光分布,每次收集分析10000个细胞左右。
[0134]
实验结果显示,抗雌激素受体α的氮杂稳定肽类似物具有较好穿膜性,其中a和e(即10a和10e)的平均荧光强度都很强(如图12所示)。
[0135]
实施例9:激光共聚焦显微成像
[0136]
将hela细胞接种到加有圆形细胞爬片的24孔板中,并使其在含有10%胎牛血清(和1%青霉素/链霉素的高糖的dmem培养基中,在37℃和5%co2的条件下(培养箱设定参数)生长过夜。待细胞贴壁后,用无血清的dmem培养基配12.5μm fam修饰的多肽,在37℃培养箱中培养3h接着加入pbs和0.4%台盼蓝交替洗涤6次,彻底洗净粘在细胞表面的多肽。细胞用4%多聚甲醛在常温下避光固定15分钟,然后用pbs洗3次。圆形细胞爬片用购自sigma公司的包含有dapi染料的封片剂进行染色和固定,取4μl封片剂加入到载玻片上,然后将细胞圆片有细胞的一面倒扣在封片剂上,避光放在4℃冰箱中干燥过夜。第二天用激光共聚焦显微镜,用加dmso的阴性对照和加tat-fam穿膜肽的阳性对照调仪器参数。
[0137]
实验结果显示,抗雌激素受体α的氮杂稳定肽类似物10a能很好的穿膜且主要分布在细胞质中(如图13所示)。
[0138]
实施例10:体外血清稳定性
[0139]
取小鼠新鲜的血液,分离出血清上清液,用pbs将小鼠血清稀释至25%血清。将特定浓度的多肽或多肽-fam添加到25%小鼠血清中,在具体实验过程中需要筛选多肽的浓度和体系的总体积。将样品复合物体系在37℃下分别孵育0、1、2、4、6、12、24小时,在特定时间点上吸取一定体积的样品复合物,加入到120μl的淬灭缓冲液(含12%三氟乙酸的乙腈水溶液中,然后在-20℃冰箱放置持续冷却15分钟以沉淀血清蛋白。将样品高速离心(13000rpm,4℃,10min),取上清样品进行lcms分析。通过比较相应峰的峰面积得到相对的多肽含量的百分比。
[0140]
结果显示,抗雌激素受体α的氮杂稳定肽类似物10a具有更稳定的蛋白水解抗性(如图14所示)。
[0141]
以上所述,仅为本技术的具体实施方式,但本技术的保护范围并不局限于此,凡在本发明的精神和原则之内,所有的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。任何熟悉本领域技术的技术人员在本技术公开的技术范围内,可轻易想到的变化或替换,都应涵盖在本技术的保护范围之内。因此,本技术的保护范围应以所述权利要求的保护范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。