1.本发明涉及一种吸入制剂,具体涉及一种治疗糖尿病药物的雾化吸入制剂,属于制药技术领域。
背景技术:
2.胰岛素是目前治疗糖尿病有效、常用的药物。糖尿病人由于体内胰岛素不足或体内胰岛素相对不足或者对胰岛素敏感性降低,餐后血糖升高后不能有效的降低血糖使其维持在空腹水平,因此需要给予餐时胰岛素来控制。目前已上市的餐时胰岛素制剂有重组人胰岛素、门冬胰岛素、赖脯胰岛素、谷赖胰岛素。
3.门冬胰岛素是利用酿酒酵母,采用重组dna技术生产得到的一种快速起效的胰岛素衍生物,其是一种利用基因工程dna重组技术将人胰岛素b28位脯氨酸替换成门冬氨酸的速效胰岛素类似物,使胰岛素链形成二聚体和六聚体的能力受到影响,分子间聚合减少,更容易被吸收。它不但能够模拟人胰岛素的分泌模式,而且由于其作用持续时间短,不易与下餐前或者夜间胰岛素作用发生叠加,在控制血糖的同时显著降低低血糖发生的风险。
4.在贮存期间的胰岛素降解对胰岛素制剂来说是一个巨大的挑战,其通过物理变化和化学反应而发生降解或失去效力,包括:a)沉淀;b)原纤维形成;c)水解反应,特别是在a18、a21和b3位置脱酰胺;d)通过转酰氨基作用或schiff-碱形成的共价二聚化;e)二硫化物交换反应。目前,胰岛素、胰岛素类似物主要剂型为液体制剂,其化学/物理稳定性主要由药物制剂成分决定,如溶剂、ph、蛋白质浓度、金属离子浓度、离子强度、防腐剂等;市售的胰岛素液体制剂通常包含六聚体构型的胰岛素和防腐剂或稳定剂(如酚类化合物),为了保持药品稳定,需要将药品在低温运输和储存。
5.门冬胰岛素形成六聚体的倾向降低,导致其稳定性较人胰岛素差。门冬胰岛素化学稳定性影响因素除脱酰胺、肽链裂解和聚合反应之外,还容易受到氧气的氧化破坏,特别是在光照条件下,这是提高门冬胰岛素制剂稳定性急需解决的问题。
技术实现要素:
6.基于现有技术的不足,本发明经过深入考察和研究,将门冬胰岛素制备成可雾化吸入制剂,所述门冬胰岛素吸入制剂稳定性好,能够在25℃下储存较长时间;配制成溶液经口吸入后在肺部吸收,为无创给药,改善患者顺应性,降低病人用药的难度,减少对咽喉和肺部的不良反应;与口服制剂相比,雾化吸入制剂更适合婴幼儿及吞咽困难患者给药,可为婴幼儿及吞咽困难患者提供一种更方便的给药方式。
7.本发明第一方面,提供一种吸入制剂,包含活性成分门冬胰岛素,其中,吸入制剂经雾化器雾化后的雾滴体积粒径为1.0μm-5.0μm的雾滴占雾滴总量的比大于60%。在一些实施方式中,吸入制剂经雾化器雾化后的雾滴体积粒径为1.0μm-5.0μm的雾滴占雾滴总量的比大于65%。在一些实施方式中,吸入制剂经雾化器雾化后的雾滴体积粒径为1.0μm-5.0μm的雾滴占雾滴总量的比大于70%。在一些实施方式中,吸入制剂经雾化器雾化后的雾滴
体积粒径为1.0μm-5.0μm的雾滴占雾滴总量的比大于75%。所述吸入制剂,为溶液时,溶液雾化后1.0μm-5.0μm的雾滴比例高,有利于药物的吸入。
8.按照门冬胰岛素效价单位与吸入制剂总体积的比,所述门冬胰岛素的浓度范围为50u/ml-2000u/ml。在一些实施方式中,按照门冬胰岛素效价单位与吸入制剂总体积的比,所述门冬胰岛素的浓度范围为100u/ml-1000u/ml。在一些实施方式中,所述门冬胰岛素的浓度范围为50u/ml-300u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为50u/ml-600u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为50u/ml-1000u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为50u/ml-1200u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为50u/ml-1500u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为100u/ml-300u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为100u/ml-600u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为100u/ml-1200u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为300u/ml-600u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为300u/ml-1000u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为300u/ml-1200u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为300u/ml-1500u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为600u/ml-1000u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为600u/ml-1200u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为600u/ml-1500u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为600u/ml-2000u/ml;在一些实施方式中,所述门冬胰岛素的浓度范围为1000u/ml-1500u/ml。在一些实施例中,所述门冬胰岛素的浓度为100u/ml,300u/ml,或者600u/ml。
9.在一些实施方式中,所述吸入制剂中门冬胰岛素的规格为0.5u/揿-25u/揿。在一些实施方式中,所述吸入制剂中门冬胰岛素的规格为1u/揿-12u/揿。在一些实施方式中,所述吸入制剂中门冬胰岛素的规格为1u/揿-18u/揿;在一些实施方式中,所述吸入制剂中门冬胰岛素的规格为1u/揿-7u/揿;在一些实施方式中,所述吸入制剂中门冬胰岛素的规格为1u/揿-4u/揿。在一些实施方式中,所述吸入制剂中门冬胰岛素的规格为3u/揿-20u/揿;在一些实施方式中,所述吸入制剂中门冬胰岛素的规格为3u/揿-15u/揿;在一些实施方式中,所述吸入制剂中门冬胰岛素的规格为3u/揿-10.u/揿;在一些实施方式中,所述吸入制剂中门冬胰岛素的规格为3u/揿-7u/揿。在一些实施例中,所述吸入制剂中门冬胰岛素的规格为1.12u/揿,3.36u/揿,或者6.72u/揿。
10.所述吸入制剂还可以包含冻干保护剂,缓冲剂,稳定剂,等渗调节剂和抑菌剂中的至少之一。在一些实施方式中,所述吸入制剂还包含冻干保护剂。在一些实施方式中,所述吸入制剂还包含缓冲剂。在一些实施方式中,所述吸入制剂还包含稳定剂。在一些实施方式中,所述吸入制剂还包含等渗调节剂。在一些实施方式中,所述吸入制剂还包含抑菌剂。在一些实施方式中,所述吸入制剂还包含缓冲剂和冻干保护剂。在一些实施方式中,所述吸入制剂还包含冻干保护剂、缓冲剂和稳定剂。在一些实施方式中,所述吸入制剂还包含冻干保护剂、缓冲剂和等渗调节剂。在一些实施方式中,所述吸入制剂还包含冻干保护剂、缓冲剂和抑菌剂。在一些实施方式中,所述吸入制剂还包含冻干保护剂、缓冲剂、稳定剂和抑菌剂。在一些实施方式中,所述吸入制剂还包含冻干保护剂、缓冲剂、稳定剂、抑菌剂和等渗调节剂。
11.所述冻干保护剂包括选自无水乳糖,盐酸赖氨酸,蔗糖,甘露醇,山梨醇,葡萄糖,
海藻糖,麦芽糖,丙氨酸,聚乙二醇,葡聚糖和聚乙烯吡咯烷酮中的至少一种。在一些实施方式中,所述冻干保护剂包括无水乳糖;在一些实施方式中,所述冻干保护剂包括盐酸赖氨酸;在一些实施方式中,所述冻干保护剂包括蔗糖;在一些实施方式中,所述冻干保护剂包括甘露醇;在一些实施方式中,所述冻干保护剂包括山梨醇。在一些实施例中,所述冻干保护剂为蔗糖;在一些实施例中,所述冻干保护剂为无水乳糖;在一些实施例中,所述冻干保护剂为盐酸赖氨酸。
12.按照冻干保护剂重量与吸入制剂总体积的比,所述冻干保护剂的浓度范围为10mg/ml-120mg/ml。在一些实施方式中,所述冻干保护剂的浓度范围为25mg/ml-100mg/ml。在一些实施方式中,所述冻干保护剂的浓度范围为20mg/ml-40mg/ml;在一些实施方式中,所述冻干保护剂的浓度范围为20mg/ml-60mg/ml;在一些实施方式中,所述冻干保护剂的浓度范围为20mg/ml-80mg/ml;在一些实施方式中,所述冻干保护剂的浓度范围为40mg/ml-60mg/ml;在一些实施方式中,所述冻干保护剂的浓度范围为40mg/ml-80mg/ml;在一些实施方式中,所述冻干保护剂的浓度范围为40mg/ml-100mg/ml;在一些实施方式中,所述冻干保护剂的浓度范围为60mg/ml-80mg/ml;在一些实施方式中,所述冻干保护剂的浓度范围为60mg/ml-100mg/ml;在一些实施方式中,所述冻干保护剂的浓度范围为80mg/ml-100mg/ml。在一些实施例中,所述冻干保护剂的浓度为60mg/ml或者80mg/ml。
13.在一些实施方式中,所述冻干保护剂重量与门冬胰岛素重量的比例范围为0.1:1-70:1。在一些实施方式中,所述冻干保护剂重量与门冬胰岛素重量的比例范围为0.5:1-30:1;在一些实施方式中,所述冻干保护剂重量与门冬胰岛素重量的比例范围为1:1-20:1;在一些实施方式中,所述冻干保护剂重量与门冬胰岛素重量的比例范围为1:1-10:1。在一些实施方式中,所述冻干保护剂重量与门冬胰岛素重量的比例范围为2:1-10:1;在一些实施方式中,所述冻干保护剂重量与门冬胰岛素重量的比例范围为2:1-5:1。在一些实施例中,所述冻干保护剂重量与门冬胰岛素重量的比例为0.95:1,1.90:1,2.86:1,3.81:1,4.76:1,5.71:1,7.62:1,9.52:1,11.43:1,17.14:1,22.86:1或者28.57:1。
14.所述缓冲剂包括选自二水磷酸氢二钠,一水磷酸二氢钠,柠檬酸钠,柠檬酸,氨丁三醇,乙酸或乙酸盐,琥珀酸,己二酸,酒石酸,抗坏血酸,苯甲酸,苹果酸或其盐,磷酸二氢钠,磷酸氢二钠,磷酸二氢钾,磷酸氢二钾,碳酸氢钠,三乙醇胺,硼酸或硼酸盐,磷酸三钠,磷酸三钾,磷酸二钾,氨基酸如谷氨酸、甘氨酸、精氨酸或甲硫氨酸,和肽类如鱼精蛋白等试剂中的至少一种。在一些实施方式中,所述缓冲剂包括二水磷酸氢二钠;在一些实施方式中,所述缓冲剂包括一水磷酸二氢钠;在一些实施方式中,所述缓冲剂包括柠檬酸钠;在一些实施方式中,所述缓冲剂包括柠檬酸;在一些实施方式中,所述缓冲剂包括氨丁三醇。在一些实施例中,所述缓冲剂为二水磷酸氢二钠;在一些实施例中,所述缓冲剂为一水磷酸二氢钠;在一些实施例中,所述缓冲剂为柠檬酸钠;在一些实施例中,所述缓冲剂为柠檬酸;在一些实施例中,所述缓冲剂为氨丁三醇。
15.按照缓冲剂重量与吸入制剂总体积的比,所述缓冲剂的浓度范围为0.5mg/ml-20mg/ml。在一些实施方式中,所述缓冲剂的浓度范围为0.5mg/ml-10mg/ml。在一些实施方式中,所述缓冲剂的浓度范围为0.5mg/ml-1mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为0.5mg/ml-2mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为0.5mg/ml-4mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为0.5mg/ml-8mg/ml;在一些实施方式中,所述
缓冲剂的浓度范围为0.5mg/ml-15mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为1mg/ml-2mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为1mg/ml-4mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为1mg/ml-8mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为1mg/ml-10mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为1mg/ml-15mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为1mg/ml-20mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为2mg/ml-4mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为2mg/ml-8mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为2mg/ml-10mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为2mg/ml-15mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为2mg/ml-20mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为4mg/ml-8mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为4mg/ml-10mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为4mg/ml-15mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为4mg/ml-20mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为8mg/ml-15mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为8mg/ml-20mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为10mg/ml-15mg/ml;在一些实施方式中,所述缓冲剂的浓度范围为10mg/ml-20mg/ml。在一些实施例中,所述缓冲剂的浓度为1.25mg/ml,1.35mg/ml,1.65mg/ml,2.4mg/ml,或者4.41mg/ml。
16.在一些实施方式中,所述缓冲剂重量与门冬胰岛素重量的比例范围为0.005:1-12:1。在一些实施方式中,所述缓冲剂重量与门冬胰岛素重量的比例范围为0.01:1-6:1;在一些实施方式中,所述缓冲剂重量与门冬胰岛素重量的比例范围为0.01:1-3:1。在一些实施方式中,所述缓冲剂重量与门冬胰岛素重量的比例范围为0.1:1-1:1;在一些实施方式中,所述缓冲剂重量与门冬胰岛素重量的比例范围为0.1:1-0.5:1。在一些实施例中,所述缓冲剂重量与门冬胰岛素重量的比例为0.06:1,0.08:1,0.12:1,0.16:1,0.23:1,0.42:1,0.68:1或者1.26:1。
17.所述抑菌剂包括选自间甲酚,苯酚,苯扎氯铵,苯扎溴铵,氯甲酚,百里酚,尼泊金甲酯,尼泊金丙酯和尼泊金乙酯中的至少一种。在一些实施方式中,所述抑菌剂包括间甲酚;在一些实施方式中,所述抑菌剂包括苯酚;在一些实施方式中,所述抑菌剂包括苯扎溴铵;在一些实施方式中,所述抑菌剂包括尼泊金甲酯。在一些实施方式中,所述抑菌剂为苯扎溴铵;在一些实施方式中,所述抑菌剂为尼泊金甲酯。
18.按照抑菌剂重量与吸入制剂总体积的比,所述抑菌剂的浓度范围为0.05mg/ml-20mg/ml。在一些实施方式中,所述抑菌剂的浓度范围为0.1mg/ml-10mg/ml。在一些实施方式中,所述抑菌剂的浓度范围为0.1mg/ml-5mg/ml;在一些实施方式中,所述抑菌剂的浓度范围为0.3mg/ml-10mg/ml;在一些实施方式中,所述抑菌剂的浓度范围为1mg/ml-10mg/ml;在一些实施方式中,所述抑菌剂的浓度范围为1mg/ml-5mg/ml。在一些实施例中,所述抑菌剂的浓度为0.1mg/ml,0.3mg/ml,1.5mg/ml,1.72mg/ml,3.22mg/ml或者5mg/ml。
19.在一些实施方式中,所述抑菌剂重量与门冬胰岛素重量的比例范围为0.001:1-12:1。在一些实施方式中,所述抑菌剂重量与门冬胰岛素重量的比例范围为0.001:1-6:1;在一些实施方式中,所述抑菌剂重量与门冬胰岛素重量的比例范围为0.001:1-3:1。在一些实施方式中,所述抑菌剂重量与门冬胰岛素重量的比例范围为0.01:1-12:1;在一些实施方式中,所述抑菌剂重量与门冬胰岛素重量的比例范围为0.05:1-6:1;在一些实施方式中,所
述抑菌剂重量与门冬胰岛素重量的比例范围为0.05:1-3:1。在一些实施例中,所述抑菌剂重量与门冬胰岛素重量的比例为0.005:1,0.01:1,0.08:1,0.15:1,0.3:1,0.5:1,1:1或者1.5:1。
20.所述稳定剂可包括选自能够提供锌离子、钠离子、氯离子的盐如氧化锌、氯化钠,甘氨酸,组氨酸,精氨酸,甘氨酰甘氨酸,鱼精蛋白乙二胺或其盐,柠檬酸盐,乙二胺四乙酸,有机酸如醋酸、苯甲酸,表面活性剂如聚山梨酯、泊洛沙姆,抗氧剂如生育酚、抗坏血酸等试剂中的至少一种。在一些实施方式中,所述稳定剂包括醋酸。在一些实施方式中,所述稳定剂包括苯甲酸。在一些实施方式中,所述稳定剂包括氧化锌和/或氯化钠。在一些实施例中,所述稳定剂为氧化锌和/或氯化钠。
21.按照稳定剂重量与吸入制剂总体积的比,所述稳定剂的浓度范围为0.05mg/ml-20mg/ml。在一些实施方式中,所述稳定剂的浓度范围为0.1mg/ml-10mg/ml。在一些实施方式中,所述稳定剂的浓度范围为0.5mg/ml-4mg/ml;在一些实施方式中,所述稳定剂的浓度范围为0.5mg/ml-8mg/ml;在一些实施方式中,所述稳定剂的浓度范围为0.5mg/ml-15mg/ml;在一些实施方式中,所述稳定剂的浓度范围为4mg/ml-10mg/ml。在一些实施例中,所述稳定剂的浓度为0.6mg/ml。
22.在一些实施方式中,所述稳定剂重量与门冬胰岛素重量的比例范围为0.001:1-12:1。在一些实施方式中,所述稳定剂重量与门冬胰岛素重量的比例范围为0.001:1-6:1;在一些实施方式中,所述稳定剂重量与门冬胰岛素重量的比例范围为0.001:1-3:1。在一些实施方式中,所述稳定剂重量与门冬胰岛素重量的比例范围为0.01:1-12:1;在一些实施方式中,所述稳定剂重量与门冬胰岛素重量的比例范围为0.05:1-6:1;在一些实施方式中,所述稳定剂重量与门冬胰岛素重量的比例范围为0.05:1-3:1。在一些实施例中,所述稳定剂重量与门冬胰岛素重量的比例为0.03:1,0.06:1或者0.18:1。
23.所述等渗调节剂包括选自氯化钠,葡萄糖,甘油,甘露醇,山梨醇,氯化钾,氯化钙,氯化镁等可以调节渗透压的试剂中的至少一种。在一些实施方式中,所述等渗调节剂包括氯化钠。在一些实施方式中,所述等渗调节剂包括葡萄糖。在一些实施方式中,所述等渗调节剂包括甘油。在一些实施例中,所述等渗调节剂为甘油。
24.本发明所述吸入制剂的ph范围可以为6.0-9.0。在一些实施方式中,所述吸入制剂的ph范围为7.0-8.0。在一些实施方式中,所述吸入制剂的ph范围为6.0-7.5;在一些实施方式中,所述吸入制剂的ph范围为6.0-8.0;在一些实施方式中,所述吸入制剂的ph范围为6.5-7.5;在一些实施方式中,所述吸入制剂的ph范围为6.5-8.5;在一些实施方式中,所述吸入制剂的ph范围为7.0-7.5;在一些实施方式中,所述吸入制剂的ph范围为7.0-8.5;在一些实施方式中,所述吸入制剂的ph范围为7.2-7.6。
25.在一些实施方式中,一种门冬胰岛素吸入制剂,包括:
26.(a)门冬胰岛素;
27.(b)缓冲剂,选自二水磷酸氢二钠,一水磷酸二氢钠,柠檬酸钠,柠檬酸和氨丁三醇中的至少一种;和/或
28.(c)冻干保护剂剂,选自无水乳糖,盐酸赖氨酸,蔗糖,甘露醇和山梨醇中的至少一种;和/或
29.(d)稳定剂,选自氧化锌,氯化钠,醋酸和苯甲酸中的至少一种;和/或
30.(e)抑菌剂,选自间甲酚,苯酚,苯扎氯铵,尼泊金甲酯和尼泊金丙酯中的至少一种。
31.在一些实施方式中,一种门冬胰岛素吸入制剂,包括:
32.(a)门冬胰岛素,浓度范围为50u/ml-2000u/ml;
33.(b)缓冲剂,选自二水磷酸氢二钠,一水磷酸二氢钠,柠檬酸钠,柠檬酸和氨丁三醇中的至少一种,浓度范围为0.05mg/ml-20mg/ml;和/或
34.(c)冻干保护剂剂,选自无水乳糖,盐酸赖氨酸,蔗糖,甘露醇和山梨醇中的至少一种,浓度范围为20mg/ml-120mg/ml;和/或
35.(d)稳定剂,选自氧化锌,氯化钠,醋酸和苯甲酸中的至少一种,浓度范围为0.05mg/ml-20mg/ml;和/或
36.(e)抑菌剂,选自间甲酚,苯酚,苯扎氯铵,尼泊金甲酯和尼泊金丙酯中的至少一种,浓度范围为0.05mg/ml-20mg/ml。
37.在一些实施方式中,一种门冬胰岛素吸入制剂,包括:
38.(a)门冬胰岛素,其规格为1u/揿-12u/揿;或者其浓度范围为100u/ml-1000u/ml;
39.(b)缓冲剂,选自二水磷酸氢二钠,一水磷酸二氢钠,柠檬酸钠,柠檬酸和氨丁三醇中的至少一种;所述缓冲剂重量与门冬胰岛素重量的比例范围为0.01:1-6:1;或者所述缓冲剂浓度范围为0.5mg/ml-10mg/ml;和/或
40.(c)冻干保护剂剂,选自无水乳糖,盐酸赖氨酸,蔗糖,甘露醇和山梨醇中的至少一种;所述冻干保护剂重量与门冬胰岛素重量的比例范围为0.5:1-30:1;或者所述冻干保护剂浓度范围为25mg/ml-100mg/ml;和/或
41.(d)稳定剂,选自氧化锌,氯化钠,醋酸和苯甲酸中的至少一种;所述稳定剂重量与门冬胰岛素重量的比例范围为0.001:1-6:1;或者所述稳定剂浓度范围为0.1mg/ml-10mg/ml;和/或
42.(e)抑菌剂,选自间甲酚,苯酚,苯扎氯铵,尼泊金甲酯和尼泊金丙酯中的至少一种;所述抑菌剂重量与门冬胰岛素重量的比例范围为0.001:1-6:1;或者所述抑菌剂浓度范围为0.1mg/ml-10mg/ml;
43.任选地,所述吸入制剂的ph范围为6.0-9.0。
44.在一些实施方式中,一种门冬胰岛素吸入制剂,包括:
45.(a)门冬胰岛素,浓度范围为100u/ml-600u/ml;
46.(b)缓冲剂,选自二水磷酸氢二钠,一水磷酸二氢钠,柠檬酸钠,柠檬酸和氨丁三醇中的至少一种,浓度范围为1mg/ml-5mg/ml;和/或
47.(c)冻干保护剂剂,选自无水乳糖,盐酸赖氨酸,蔗糖,甘露醇和山梨醇中的至少一种,浓度范围为40mg/ml-80mg/ml;和/或
48.(d)稳定剂,选自氧化锌,氯化钠,醋酸和苯甲酸中的至少一种,浓度范围为0.1mg/ml-5mg/ml;和/或
49.(e)抑菌剂,选自间甲酚,苯酚,苯扎氯铵,尼泊金甲酯和尼泊金丙酯中的至少一种,浓度范围为0.1mg/ml-5mg/ml;
50.任选地,所述吸入制剂的ph范围为7.0-8.0。
51.在一些实施方式中,一种门冬胰岛素吸入制剂,包括:
52.(a)门冬胰岛素,浓度范围为100u/ml-1000u/ml;
53.(b)二水磷酸氢二钠和/或柠檬酸钠,浓度范围为0.1mg/ml-10mg/ml;和/或
54.(c)无水乳糖和/或蔗糖,浓度范围为25mg/ml-100mg/ml;和/或
55.(d)氧化锌和/或氯化钠,浓度范围为0.1mg/ml-10mg/ml;和/或
56.(e)苯扎氯铵和/或尼泊金甲酯,浓度范围为0.1mg/ml-10mg/ml;
57.任选地,所述吸入制剂的ph范围为6.0-9.0。
58.在一些实施方式中,一种门冬胰岛素吸入制剂,包括:
59.(a)门冬胰岛素,浓度为100u/ml;
60.(b)二水磷酸氢二钠或者柠檬酸钠,浓度为1.25mg/ml;和/或
61.(c)无水乳糖或者蔗糖,浓度为80mg/ml;和/或
62.(d)氧化锌和氯化钠的组合,所述组合浓度为0.6mg/ml;和/或
63.(e)苯扎氯铵或者尼泊金甲酯,浓度为0.3mg/ml;
64.所述吸入制剂的ph范围为7.0-8.0。
65.在一些实施方式中,一种吸入制剂,包含门冬胰岛素,其中,吸入制剂经雾化器雾化后的雾滴体积粒径为1.0μm-5.0μm的雾滴占雾滴总量的60%以上;按照门冬胰岛素效价单位与吸入制剂总体积的比,所述门冬胰岛素的浓度范围为50u/ml-1000u/ml;所述吸入制剂的ph范围为6.0-9.0。在一些实施例中,一种吸入制剂,包含门冬胰岛素,其中,吸入制剂经雾化器雾化后的雾滴体积粒径为1.0μm-5.0μm的雾滴占雾滴总量的比为70%;按照门冬胰岛素效价单位与吸入制剂总体积的比,所述门冬胰岛素的浓度范围为300u/ml;所述吸入制剂的ph为7.5。在一些实施例中,一种吸入制剂,包含门冬胰岛素,其中,吸入制剂经雾化器雾化后的雾滴体积粒径为1.0μm-5.0μm的雾滴占雾滴总量的比为75%;按照门冬胰岛素效价单位与吸入制剂总体积的比,所述门冬胰岛素的浓度范围为600u/ml;所述吸入制剂的ph为7.3。
66.在一些实施方式中,一种吸入制剂,包含门冬胰岛素,其中,吸入制剂经雾化器雾化后的雾滴体积粒径为1.0μm-5.0μm的雾滴占雾滴总量的比为65%以上;按照门冬胰岛素效价单位与吸入制剂总体积的比,所述门冬胰岛素的浓度范围为100u/ml-800u/ml;所述吸入制剂的ph范围为7.0-8.0;所述吸入制剂还包含冻干保护剂,缓冲剂,稳定剂,等渗调节剂和抑菌剂中的至少之一。上述特征有利于制剂的质量稳定、使用和吸收。
67.本发明所述吸入制剂,可以是溶液或者冻干粉。在一些实施方式中,所述吸入制剂为溶液。在一些实施方式中,所述吸入制剂为冻干粉。所述吸入制剂为冻干粉时,在使用前可用水复溶。
68.另一方面,本发明提供一种制备上述任一吸入制剂的方法。
69.一种制备前述的吸入制剂的方法,包括:将门冬胰岛素溶解于水中,任选地与稳定剂,缓冲剂,冻干保护剂和/或抑菌剂混合,任选地使ph在6.0-9.0和/或冷冻干燥。
70.在一些实施方式中,一种制备所述吸入制剂的方法,包括下列步骤:
71.(a)将稳定剂溶解于水中;
72.(b)将缓冲剂溶解于水中,任选地,加入冻干保护剂和/或抑菌剂;
73.(c)将门冬胰岛素溶解于水中,再加入(a)步骤制备得到的溶液;
74.(d)将(b)步骤制备得到的溶液,与(c)步骤制备得到的溶液混合,搅拌均匀,任选
地,冷冻干燥。
75.在一些实施方式中,一种制备门冬胰岛素吸入制剂的方法,包括下列步骤:
76.(a)将稳定剂溶解于水中;
77.(b)将缓冲剂溶解于水中,任选地,加入冻干保护剂和/或抑菌剂,调节溶液ph至7.0-8.0;
78.(c)将门冬胰岛素溶解于水中,调节ph至2.5-3.5,再加入(a)步骤制备得到的溶液,搅拌均匀后再调节溶液ph至7.0-8.0;
79.(d)将(b)步骤制备得到的溶液,与(c)步骤制备得到的溶液混合,搅拌均匀,任选地,冷冻干燥。
80.所述制备方法,可以包括冷冻干燥步骤,所述冷冻干燥步骤包括一次升华和二次升华。
81.在一些实施方式中,所述一次升华的时长为5h-15h;所述一次升华的温度为-10℃~-30℃。在一些实施方式中,所述一次升华的时长为8h-12h;在一些实施例中,所述一次升华的时长为10h。在一些实施方式中,所述一次升华的温度为-15℃~-25℃;在一些实施例中,所述一次升华的温度为-20℃。
82.在一些实施方式中,所述二次升华的时长为1h-15h;所述二次升华的温度为15℃~30℃。在一些实施方式中,所述二次升华的时长为2h-10h;在一些实施例中,所述二次升华的时长为2h或者8h。在一些实施方式中,所述二次升华的温度为20℃~25℃;在一些实施例中,所述二次升华的温度为20℃或者25℃。
83.本发明所述吸入制剂的制备方法,操作简单,可控性好,适于工业化大生产。
84.术语定义
85.术语“包含”或“包括”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。
86.在本发明的上下文中,无论是否使用“大约”或“约”等字眼,所有在此公开了的数字均为近似值。每一个数字的数值有可能会出现10%以下的差异或者本领域人员认为的合理的差异,如1%、2%、3%、4%或5%的差异。
87.本发明中,mg/ml表示毫克/毫升,u/ml表示门冬胰岛素的效价单位/毫升,min表示分钟,h表示小时,mg表示毫克,g表示克,ml表示毫升,℃表示摄氏度,mbar表示毫巴(气压压强单位)。
88.术语“门冬胰岛素的规格”是指按压喷雾器一次喷出的门冬胰岛素溶液中,所含门冬胰岛素的量,单位为u/揿。
89.术语“api”指药物活性成分。
90.本发明中活性成分门冬胰岛素的浓度,为活性成分效价单位(u)与吸入制剂总体积(ml)的比,例如10u/ml的门冬胰岛素表示每1ml吸入制剂中含有10u的门冬胰岛素。
91.本发明中,计算浓度时涉及到的体积是指吸入制剂在冻干前的体积或者吸入制剂在雾化前的体积。
具体实施方式
92.为了使本领域的技术人员更好地理解本发明的技术方案,下面进一步披露一些非
限制实施例对本发明作进一步的详细说明。
93.本发明所使用的试剂均可以从市场上购得或者可以通过本发明所描述的方法制备而得。
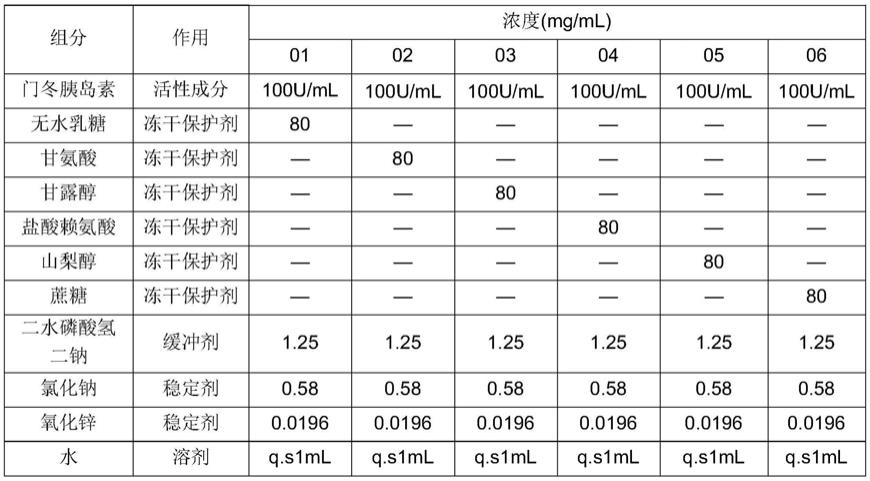
94.实施例1门冬胰岛素冻干粉考察:冻干保护剂筛选
95.表1-1:处方表
[0096][0097]
制备过程:
[0098]
(1)将氧化锌加至稀盐酸中,完全反应溶解后,加水定容;
[0099]
(2)将二水磷酸氢二钠、氯化钠、冻干保护剂加至水中搅拌溶解完全,加入ph调节剂调节ph至7.2~7.6,得到溶液a;
[0100]
(3)将门冬胰岛素加至水中,搅拌分散,调节ph至2.5-3.0,搅拌溶解至澄清,加入(1)制备得到的锌离子溶液搅拌均匀,再调节ph至7.2~7.6左右,得到溶液b;
[0101]
(4)将溶液a在搅拌条件下加至溶液b中,搅拌均匀,冻干。
[0102]
冻干参数见表1-2,稳定性结果见表1-3。
[0103]
表1-2:冻干参数
[0104][0105]
表1-3:25℃条件下放置30天,各批次样品稳定性结果
[0106][0107]
结果显示,25℃条件下放置30天,除02批使用甘氨酸作为冻干保护剂的样品,其他批次样品的有关物质和高分子蛋白含量均未超标,稳定性较好。
[0108]
实施例2门冬胰岛素冻干粉考察:缓冲剂筛选
[0109]
表2-1:处方表
[0110][0111]
制备过程:
[0112]
(1)将氧化锌加至稀盐酸中,完全反应溶解后,加水定容;
[0113]
(2)将无水乳糖、氯化钠、缓冲剂加至水中搅拌溶解完全,调节ph至7.2~7.6,得到溶液a;
[0114]
(3)将门冬胰岛素加至水中,搅拌分散,调节ph至2.5-3.0,搅拌溶解至澄清,加入(1)制备得到的锌离子溶液搅拌均匀,再调节ph至7.2~7.6左右,得到溶液b;
[0115]
(4)将溶液a在搅拌条件下加至溶液b中,搅拌均匀,冻干。
[0116]
冻干参数见表2-2,稳定性结果见表2-3。
[0117]
表2-2:冻干参数
[0118][0119]
表2-3:25℃条件下放置30天,各批次样品稳定性结果
[0120][0121]
结果显示,25℃条件下放置30天,各批次样品的有关物质和高分子蛋白含量均较低,稳定性较好;其中,01批单用二水磷酸氢二钠作为缓冲剂,稳定性最好。
[0122]
实施例3门冬胰岛素溶液考察:抑菌剂筛选
[0123]
表3-1:处方表
[0124][0125][0126]
制备过程:
[0127]
(1)将氧化锌加至稀盐酸中,完全反应溶解后,加水定容;
[0128]
(2)将甘油、二水磷酸氢二钠、氯化钠、抑菌剂加至水中搅拌溶解完全,调节ph至7.2~7.6,得到溶液a;
[0129]
(3)将门冬胰岛素加至水中搅拌分散,调节ph至2.5-3.0,搅拌溶解至澄清,加入(1)制备得到的锌离子溶液搅拌均匀,再调节ph至7.2~7.6左右,得到溶液b;
[0130]
(4)将溶液a在搅拌条件下加至溶液b中,搅拌均匀,定容,过滤除菌,即得。
[0131]
各批次稳定性结果见表3-2。
[0132]
表3-2:25℃条件下放置30天,或者30℃条件下放置7天,各批次样品稳定性结果
[0133][0134]
结果显示,加入抑菌剂的门冬胰岛素溶液,在25℃条件下放置30天,或者30℃条件下放置7天,除04批使用苯甲酸作为抑菌剂的样品,其他批次样品的有关物质和高分子蛋白含量均未超标,稳定性较好。
[0135]
实施例4门冬胰岛素溶液考察:无抑菌剂处方考察
[0136]
表4-1:处方表
[0137][0138]
制备过程:
[0139]
(1)将氧化锌加至稀盐酸中,完全反应溶解后,加水定容;
[0140]
(2)将甘油、二水磷酸氢二钠、氯化钠加至水中搅拌溶解完全,调节ph至7.2~7.6,得到溶液a;
[0141]
(3)将门冬胰岛素加至水中搅拌分散,调节ph至2.5-3.0,搅拌溶解至澄清,加入(1)制备得到的锌离子溶液搅拌均匀,再调节ph至7.2~7.6左右,得到溶液b;
[0142]
(4)将溶液a在搅拌条件下加至溶液b中,搅拌均匀,定容,过滤除菌,即得。
[0143]
各批次稳定性结果见表4-2。
[0144]
表4-2:25℃条件下放置30天或者15天,30℃条件下放置7天,各批次样品稳定性结果
[0145][0146]
结果显示,以二水磷酸氢二钠为缓冲剂的门冬胰岛素溶液,25℃条件下放置30天,有关物质和高分子蛋白含量较低,稳定性较好;以柠檬酸钠为缓冲剂的门冬胰岛素溶液,25℃条件下放置15天,有关物质含量超标;以氨丁三醇或精氨酸为缓冲剂的门冬胰岛素溶液,30℃条件下放置7天,有关物质含量也已经超标。由此可以总结出:门冬胰岛素若制备成溶液,大部分情况下需要添加抑菌剂,但是如果经过筛选得到适合的处方,也可以不加抑菌剂。
[0147]
实施例5门冬胰岛素冻干粉考察:冻干工艺考察
[0148]
表5-1:处方表
[0149][0150]
制备过程:
[0151]
(1)将氧化锌加至稀盐酸中,完全反应溶解后,加水定容;
[0152]
(2)将二水磷酸氢二钠、氯化钠、冻干保护剂加至水中搅拌溶解完全,调节ph至7.2
~7.6,得到溶液a;
[0153]
(3)将门冬胰岛素加至水中,搅拌分散,调节ph至2.5-3.0,搅拌溶解至澄清,加入(1)制备得到的锌离子溶液搅拌均匀,再调节ph至7.2~7.6左右,得到溶液b;
[0154]
(4)将溶液a在搅拌条件下加至溶液b中,搅拌均匀,冻干。
[0155]
冻干参数见表5-2,稳定性结果见表5-3。
[0156]
表5-2:冻干参数
[0157][0158][0159]
表5-3:25℃条件下放置30天或者15天,各批次样品稳定性结果
[0160][0161]
结果显示,以无水乳糖或者盐酸赖氨酸为冻干保护剂、以不同冻干工艺制备得到的门冬胰岛素冻干粉,在25℃条件下放置30天或者15天,有关物质和高分子蛋白含量均较低,稳定性良好。
[0162]
实施例6门冬胰岛素冻干粉考察:冻干保护剂浓度考察
[0163]
表6-1:处方表
[0164][0165]
制备方法和冻干工艺参数同实施例1。
[0166]
结果显示,盐酸赖氨酸浓度为25、30、40、60、100mg/ml,冻干后均能得到白色疏松块状或粉末状的冻干制剂,盐酸赖氨酸浓度为20mg/ml,冻干不成型。
[0167]
本发明的方法已经通过较佳实施例进行了描述,相关人员明显能在本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。
[0168]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“一些实施方式”、“一些实施方案”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0169]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。