1.本发明涉及一种传送载体以及靶向药物载体,特别涉及一种靶向复合载体、载药体系、制备方法及其用途。
背景技术:
2.肝细胞癌(hcc)是最常见的恶性肿瘤之一,是癌症相关死亡的主要原因。目前,手术治疗和肝移植是临床治疗肝癌的主要方法,但总体生存率较低,主要原因是恶性增殖和全身转移。随着对癌症研究的深入,肿瘤微环境(tumor microenvironment,tme)为肿瘤细胞的生长、侵袭和转移提供了必要的土壤条件。因此,靶向肿瘤微环境策略是肿瘤治疗的关键。
3.tme由基质细胞、肿瘤血管、细胞外基质(ecm)和各类因子组成。肿瘤相关成纤维细胞(cafs)作为tme的重要组成部分,已受到广泛关注。其中,cafs不仅能分泌胶原沉积ecm,还与肝癌细胞建立“cross-talk”,诱导肝癌细胞耐药和转移。另外,大量ecm不仅能形成物理屏障,还能压迫肿瘤血管,限制药物在肿瘤中的渗透,降低药物生物利用度。因此,抑制cafs活化和ecm沉积对提高肝癌治疗效果至关重要的。
4.辣椒素(cap)是从红辣椒中提取的一种辛辣的生物碱,具有抗癌、抗增殖和抗氧化等作用。最近研究发现,cap有效抑制成纤维细胞活化,治疗肝纤维化。此外,替米沙坦(telmisartan,tel)是一种血管紧张素ⅱ受体1(angiotensinⅱreceptor 1,at1r)拮抗剂,通过转化生长因子-β(transforming growth factor-β,tgf-β)信号通路抑制caf分泌ecm。
技术实现要素:
5.发明目的:为了解决现有技术的问题,本发明提供了一种靶向复合载体、载药体系、制备方法及其用途。
6.技术方案:本发明所述的一种复合载体,包括第一靶向载体以及第二靶向载体,所述第一靶向载体包括以下组分:二油酰基磷脂酰乙醇胺、卵磷脂、胆固醇琥珀酸单酯、胆固醇、咪唑基胆固醇以及dspe-peg-ha;所述dspe-peg-ha通过dspe-peg-nh2与透明质酸制备而成;所述咪唑基胆固醇通过氯甲酸胆甾醇和n-(3-氨基丙基)咪唑制备而成;所述第二靶向载体包括以下组分:复合磷脂以及甘氨胆酸,所述复合磷脂包括卵磷脂以及dspe-peg-ga;所述第一靶向载体的粒径为150nm~200nm;所述第二靶向载体的粒径为25~50nm。
7.作为本发明一种优选实施方式,所述第一靶向载体包括质量比为10~15:5~10:1~5:1~5:1~5:1~5的二油酰基磷脂酰乙醇胺、卵磷脂、胆固醇琥珀酸单酯、胆固醇、咪唑基胆固醇以及dspe-peg-ha。
8.作为本发明一种具体实施方式,所述第一靶向载体包括质量比为14:6:3:2:2:1的二油酰基磷脂酰乙醇胺、卵磷脂、胆固醇琥珀酸单酯、胆固醇、咪唑基胆固醇以及dspe-peg-ha。
9.作为本发明一种优选实施方式,所述第二靶向载体中,卵磷脂与dspe-peg-ga的质
量比为15~20:1;所述复合磷脂与甘氨胆酸的质量比为1.4~3.5:1。
10.作为本发明一种具体实施方式,所述第二靶向载体中,卵磷脂与dspe-peg-ga的质量比为20:1;所述复合磷脂与甘氨胆酸的质量比为1.7:1。
11.作为本发明一种优选实施方式,所述咪唑基胆固醇为氯甲酸胆甾醇和n-(3-氨基丙基)咪唑在三乙胺存在的条件下合成。
12.作为本发明一种优选实施方式,所述dspe-peg-nh2的分子量为2000~5000da,透明质酸的分子量为2000~5000da。
13.作为本发明一种具体实施方式,所述dspe-peg-nh2的分子量为2000da,透明质酸的分子量为5000da。
14.本发明所述的药物载体,包括质量比为10~15:5~10:1~5:1~5:1~5:1~5的二油酰基磷脂酰乙醇胺、卵磷脂、胆固醇琥珀酸单酯、胆固醇、咪唑基胆固醇以及dspe-peg-ha;所述dspe-peg-ha通过dspe-peg-nh2与透明质酸制备而成;所述咪唑基胆固醇通过氯甲酸胆甾醇和n-(3-氨基丙基)咪唑制备而成;所述载药体系负载的药物为辣椒素以及替米沙坦。
15.本发明所述的药物载体或者为负载阿霉素的药物载体,所述的药物载体包括质量比为1.4~3.5:1的复合磷脂以及甘氨胆酸,所述复合磷脂包括质量比为15~20:1的卵磷脂以及dspe-peg-ga;药物载体负载的药物阿霉素与卵磷脂的质量比为1:15~20。
16.本发明所述的复合载体的制备方法,包括以下步骤:
17.(s1)第一靶向载体的制备
18.(s11)dspe-peg-ha的合成:dspe-peg-nh2经过edc与nhs活化后,与透明质酸在氮气环境下交联反应,得到dspe-peg-ha;
19.(s12)咪唑基胆固醇的合成:在三乙胺的催化作用下,氯甲酸胆甾醇和n-(3-氨基丙基)咪唑合成咪唑基胆固醇;
20.(s13)二油酰基磷脂酰乙醇胺、卵磷脂、胆固醇琥珀酸单酯、胆固醇、咪唑基胆固醇和dspe-peg-ha加入氯仿中,用旋转蒸发器去除氯仿,待形成一层均匀的薄膜时,加入pbs溶液水化,随后在冰浴中超声,过滤,得到第一靶向载体;
21.(s2)第二靶向载体的制备:将卵磷脂、dspe-peg-ga在乙醇中混合,然后慢慢滴注到甘氨胆酸溶液中,乙醇蒸发后,在冰浴中超声,过滤,得到第二靶向载体。
22.本发明所述的一种载药体系,包括第一载药体系以及第二载药体系,所述第一载药体系包括第一靶向载体以及经由第一靶向载体负载的辣椒素以及替米沙坦;所述第一靶向载体包括二油酰基磷脂酰乙醇胺、卵磷脂、胆固醇琥珀酸单酯、胆固醇、咪唑基胆固醇以及dspe-peg-ha;所述dspe-peg-ha通过dspe-peg-nh2与透明质酸制备而成;所述咪唑基胆固醇通过氯甲酸胆甾醇和n-(3-氨基丙基)咪唑制备而成;所述第二载药体系包括第二靶向载体以及经由所述第二靶向载体负载的阿霉素;所述第二靶向载体包括复合磷脂以及甘氨胆酸,所述复合磷脂包括卵磷脂以及dspe-peg-ga;和/或所述第一载药体系中,辣椒素的载药量为2~3%,替米沙坦的载药量为2~3%;所述第二载药体系中,阿霉素的载药量为2~3%。
23.本发明所述的载药体系的制备方法,包括以下步骤:
24.(1)第一靶向载体的制备
25.(1a)dspe-peg-ha的合成:dspe-peg-nh2经过edc与nhs活化后,与透明质酸在氮气环境下交联反应,得到dspe-peg-ha;
26.(1b)咪唑基胆固醇的合成:在三乙胺的催化作用下,氯甲酸胆甾醇和n-(3-氨基丙基)咪唑合成咪唑基胆固醇;
27.(1c)二油酰基磷脂酰乙醇胺、卵磷脂、胆固醇琥珀酸单酯、胆固醇、咪唑基胆固醇、dspe-peg-ha、辣椒素以及替米沙坦加入氯仿中,用旋转蒸发器去除氯仿,待形成一层均匀的薄膜时,加入pbs溶液水化,随后在冰浴中超声,过滤,得到第一载药体系;
28.(2)第二靶向载体的制备:将卵磷脂、dspe-peg-ga在乙醇中混合,然后慢慢滴注到含有甘氨胆酸以及阿霉素的溶液中,乙醇蒸发后,在冰浴中超声,过滤,得到第二载药体系。
29.本发明所述的载药体系在制备肝癌药物中的应用。
30.本发明所述的一种药物组合物,包括辣椒素、替米沙坦以及阿霉素。
31.有益效果:(1)本发明提供了一种复合载体(脂质大球 纳米小球)制剂治疗肝癌通过脂质大球(cthls)共载tel和cap,具有肝癌靶向性和深渗透性,cthls经ha修饰,可以被cd44
的cafs主动摄入;载体中的dope促进脂质体和内含体融合;aim-chol的质子海绵效应促进tel和cap从内含体逃逸,阻断cafs活化,抑制ecm沉积,提高dgns的渗透效率;纳米小球(dgns)负载dox,具有双ph敏感性和cafs靶向性,通过cthls与dgns协同作用,抑制肝癌发展(2)本发明的复合载体中,通过甘草次酸(ga)修饰后的dgns,提高了肝癌细胞摄入效率;(3)本发明通过改变复合磷脂与甘胆酸水合物的比例,制备了粒径30nm的胶束,有利于dox递送至肝癌组织内部;(4)本发明通过建立新型体内外研究模型,评价复合载体“脂质大球 纳米小球”混合制剂的抗肝癌效果,在细胞水平,模拟肝癌环境,建立由bel-7402和肝星状细胞(lx-2)组成的共培养模型:bel-7402 lx-2,通过体外摄取实验评价cthls和dgns的靶向能力,采用3d肿瘤球检测dgns的渗透能力,并分析混合制剂抗增殖和抗迁移特征。建立“h22 m-hscs”共植入小鼠模型、原位肝癌模型和肺转移模型,评价混合制剂抗增殖和转移效果;(5)本发明实现了辣椒素、替米沙坦以及阿霉素的联合用药,tel和cap联合用药抑制cafs活化和ecm沉积,有效调控tme,在tme调控的基础上,加入化疗药物阿霉素(dox),阻断cafs与肝癌细胞间的“cross-talk”,抑制肝细胞癌的耐药和转移;(6)本发明通过靶向载体的制备,克服了dox联合tel和cap治疗面临的障碍,解决了传统的联合制剂靶向性弱,毒副作用大的缺陷,并且通过靶向载体克服了dox、tel和cap对不同细胞的作用靶点不同,体内药代动力学和组织分布不同,难以发挥协同作用的问题;(7)本发明的载药体系解决了现有技术中ecm形成的物理屏障严重阻碍药物穿透肿瘤深部,导致肝癌复发的问题,通过新的药物给药系统,实现药物的高效给药、协同作用和深入渗透。
附图说明
32.图1为本发明载体的制备示意图;
33.图2为dspe-peg-ha载体材料的合成路线与核磁表征图谱,其中,a图为合成路线,b图中的a为ha特征峰b为peg特征峰;
34.图3为不同磷脂投料比的脂质大球在酸性ph值下粒径变化;
35.图4为dgns与cthls的表征图,其中,a图为dgns的粒径分布图,b图为cthls的粒径分布图;c图为dgns在ph7.4条件下的tem图像;d图为cthls在ph7.4条件下的tem图像;e图为
cthls在ph5.0条件下的tem图像;f图为dgns的7天稳定性;g图为cthls的7天稳定性;h图为dgns的体外释放图;i图为cthls在不同ph条件下的体外释放图;
36.图5为dgns的体外摄取和dgns滞留结果,其中,a图为dgns的体外摄取激光共聚焦图像;b图为流式细胞术对dgns摄取的定量;c图为流式细胞术检测各种制剂对dgns滞留的影响;d图为流式细胞术检测各种制剂摄取的定量结果;
37.图6为lx-2对cthls的体外摄取结果,其中,a图为cthls的体外摄取激光共聚焦图像;b图为流式细胞术对cthls摄取的定量;
38.图7为dgns的3d多细胞球体结果,其中,a图为dox、dns和dgns对3d多细胞球体的激光共聚焦图;b图为60μm深度下各组的荧光定量;
39.图8为dgns联合cthls的细胞毒性评价,其中,a图为单独bel-7402模型和lx-2/bel-7402共培养模型示意图;b图为单独bel-7402模型的mtt检测;c图为lx-2/bel-7402共培养模型mtt检测;d图为lx-2/bel-7402共培养模型的活死染色结果;
40.图9为dgns联合cthls对肿瘤细胞迁移抑制率的影响,其中,a图为单独bel-7402模型和lx-2/bel-7402共培养模型示意图;b图为单独bel-7402模型的细胞迁移结果;c图为lx-2/bel-7402共培养模型的细胞迁移结果;d图为单独bel-7402模型的细胞迁移抑制率;e图为lx-2/bel-7402共培养模型的细胞迁移抑制率;
41.图10为dgns联合cthls对细胞迁移机制探究(a)lx-2/bel-7402共培养模型的transwell结果(b)lx-2/bel-7402共培养模型的transwell的定量(c)e-cadherin和vimentin的western blot分析;(d)e-cadherin和vimentin定量分析;
42.图11为dgns和cthls在荷瘤小鼠体内的生物分布(a)dgns和cthls在不同时间点的nir图像(b)不同器官和肿瘤的48h荧光图像(c)在did波长下不同组织的荧光强度分析(d)在dir波长下不同组织的荧光强度分析(e)不同深度下游离did处理组的肿瘤切片(f)不同深度下did-gns处理组的肿瘤切片;
43.图12为cthls对dgns体内渗透的结果(a)不同处理组的肿瘤切片图像(b)肿瘤切片荧光强度的定量;
44.图13为dgns联合cthls对h22皮下移植瘤的抗肿瘤评价(a)h22皮下移植瘤的示意图(b)不同治疗组的瘤体积变化(c)不同治疗组的体重变化(d)不同治疗组的抑瘤率(e)肿瘤照片;
45.图14为不同治疗组的肿瘤和主要器官的h&e图像;
46.图15为dgns联合cthls对m-hsc/h22皮下移植瘤的抗肿瘤评价(a)m-hsc/h22皮下移植瘤示意图(b)不同治疗组的瘤体积变化(c)不同治疗组的体重变化(d)不同治疗组的抑瘤率(e)肿瘤照片;
47.图16为dgns联合cthls对m-hsc/h22皮下移植瘤治疗效果的评价(a)不同治疗组的肿瘤h&e图片(b)不同治疗组的肿瘤masson图片(c)不同治疗组的肿瘤的α-sma免疫组化图片(d)不同治疗组的肿瘤的cd31免疫组化图片(e)肿瘤微血管的数量(f)组织中e-cadherin和vimentin的western blot分析(g)e-cadherin和vimentin定量分析;
48.图17为dgns联合cthls对肝原位移植瘤治疗效果的评价(a)肝原位移植瘤的示意图(b)不同治疗组的肝照片(c)不同治疗组的肿瘤h&e图片(d)不同治疗组的肿瘤masson图片(e)不同治疗组的肿瘤α-sma免疫组化图片(f)不同治疗组的肿瘤的cd31免疫组化图片;
49.图18为dgns联合cthls对肺转移治疗效果的评价(a)肺转移示意图(b)不同治疗组的体重变化(c)不同治疗组的肺结节数量(d)不同治疗组的肺照片(e)不同治疗组的h&e图片。
具体实施方式
50.一、材料来源
51.1.1材料
52.卵磷脂酰胆碱(spc)、1,2-二油酰-sn-甘油-3-磷酸乙醇胺(dope)和胆固醇均购自a.v.t.制药有限公司(中国,上海)。dox、cap、tel均购自中国大连美伦生物科技有限公司。甘氨胆酸(gah)和半琥珀酸胆酯(chems)购自macklin生化有限公司(中国,上海)。dspe-peg
2000-nh2购自西安瑞禧生物科技有限公司(中国,西安)。抗cd31和抗e-cadherin等抗体等均购自abcam公司(美国,ma,usa)。其他化学试剂均为分析级或色谱级。
53.1.2细胞和动物
54.人肝癌细胞系(bel-7402,hepg2)、人源肝星状细胞(lx-2)、鼠源肝癌细胞(h22)和小鼠源肝细胞(m-hscs)均来自北京生物技术研究所。balb/c小鼠(雌性,18~22g)来自中国济南朋悦实验动物中心。所有动物实验均经潍坊医学院动物实验伦理委员会(wfmc,2019-045)批准,实验动物的护理和使用严格遵守中华人民共和国卫生部《动物管理规定》(no.55,2001)。
55.二、样品制备
56.实施例1:dspe-peg-ha的合成
57.通过dspe-peg
2000-nh2与ha(mw 5000)的交联反应,合成了一种新型的功能磷脂:dspe-peg-ha。100mg ha溶解于蒸馏水中,加入46.5mg碳化二亚胺(edc)和34.5mg n-羟基琥珀酰亚胺(nhs)活化。将68mg dspe-peg
2000-nh2加入到ha溶液中,缓慢搅拌。常温下氮气环境下反应24h。将所得溶液纯化、冻干,用1h nmr测定样品结构,结果如图2所示,通过核磁共振氢谱确定了dspe-peg
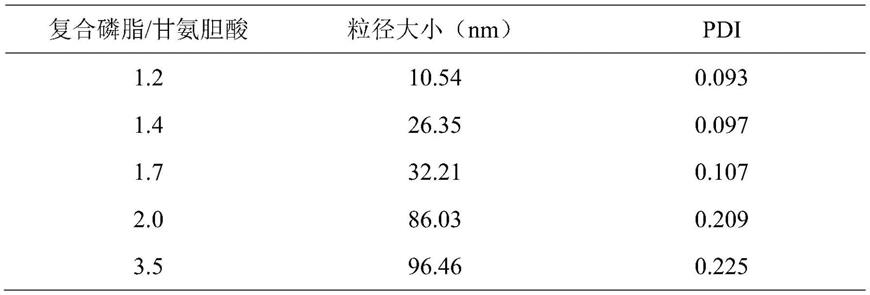
2000-ha聚合物的结构,在2.0ppm处的吸收带属于ha的甲基基团,在3.6ppm处的特征峰为dspe-peg
2000-nh2的peg基团。dspe-peg
2000-ha在3.6ppm和2.0ppm处都有峰表明,ha成功地修饰到dspe-peg
2000-nh2上。
58.实施例2:共载cap和tel脂质大球(cthls)的制备
59.(1)aim-chol合成
60.将氯甲酸胆甾醇(0.45g,1mmol)溶解于二氯甲烷(10ml)中。滴加n-(3-氨基丙基)咪唑(0.6ml,4mmol),再加入200μl三乙胺,在冰浴中搅拌10h,反应结束后用真空蒸馏除去溶剂。采用柱层析法对产物进行纯化。在三乙胺的催化作用下,氯甲酸胆甾醇和n-(3-氨基丙基)咪唑生成了aim-chol。
61.(2)采用薄膜蒸发法ph敏感脂质大球(图1)。首先确定二油酰基磷脂酰乙醇胺(dope)、卵磷脂(spc)的优化比例,按照两者1:3、1:1和7:3比例,加入胆固醇琥珀酸单酯(chems)、胆固醇、咪唑基-胆固醇(aim-chol)和dspe-peg
2000-ha制备脂质体,检测三种脂质体在酸性ph(ph5.5)条件下粒径的变化情况,确定磷脂的投料比。加入辣椒素(cap)和替米沙坦(tel)制备共载脂质大球。
62.结果分析:通过控制dope与spc的投料比(质量比),dope:spc=7:3,dope:spc=1:
1和dope:spc=1:3,制备了三种脂质体。检测不同脂质体在酸性ph值(ph5.5)下粒径的变化情况,确定磷脂的投料比,结果如图3所示,在ph 5.0的条件下,dope:spc为7:3时,脂质体粒径随孵育时间逐渐变大,该投料比具有明显的ph敏感性。因此,我们选择dope:spc=7:3作为酸敏感脂质体的制备处方。
63.(3)cthls的最终优化工艺如下:
64.将二油酰基磷脂酰乙醇胺(dope)70mg、卵磷脂(spc)30mg、胆固醇琥珀酸单酯(chems)15mg、胆固醇15mg、咪唑基-胆固醇(aim-chol)10mg、dspe-peg-ha5mg、辣椒素(cap)5mg、替米沙坦(tel)5mg溶解于5ml氯仿中。用旋转蒸发器去除氯仿,旋蒸条件:40℃,20rpm。待形成一层均匀的薄膜时,加入5ml pbs(ph=7.4),水化1小时。最后,在冰浴中超声5min,并依次通过0.45μm和0.22μm聚醚砜膜,获得cthls。
65.实施例3:载dox肝靶向纳米小球(dgns)的制备
66.采用乙醇注射法制备负载dox的纳米小球(图1)。首先将gah溶解在pbs中,用氢氧化钠溶液调节ph至5.5~6.0。其次,按照gah与磷脂(spc)的不同比例(1.2,1.4,1.7,2.0,3.5),将spc和dspe-peg-ga(cn2018113191397实施例1的方法合成)乙醇溶液(dspe-peg-ga/spc的比例为1:20)滴入到gah溶液中,并加入dox。乙醇蒸发后,在冰浴中超声,并依次通过0.45μm和0.22μm聚醚砜膜。
67.固定spc和dspe-peg-ga的含量(20:1)改变甘氨胆酸的含量,考察复合磷脂/甘氨胆酸质量比对dgns粒径大小的影响。结果如表1所示。随着甘氨胆酸含量的降低,dgns的粒径呈增加的趋势。其中复合磷脂/甘氨胆酸质量比为1.7时,所制备的纳米粒约为32nm。该粒径胶束既有利于dgns在肿瘤部位的渗透有减少了在体外循环时被肾脏代谢。
68.表1不同比例复合磷脂和甘氨胆酸对dgns粒径和pdi的影响
[0069][0070]
dgns的优化工艺为:
[0071]
将spc、dox(spc:dox=20:1)和dspe-peg-ga在乙醇中混合(gah/复合磷脂的比例为1:1.7,dspe-peg-ga/spc的比例为1:20),然后慢慢滴注到gah溶液中。乙醇蒸发后,dgns在冰浴中超声5min,并依次通过0.45μm和0.22μm聚醚砜膜,获得dgns。
[0072]
三、结果分析
[0073]
3.1分析方法
[0074]
3.1.1 cthls和dgns的表征
[0075]
用malvern zetasizer nano zs90分别测量了cthls和dgns的粒径分布和zeta电位。在4℃条件下保存7天,分别测定cthls和dgns在pbs或rpmi 1640中的粒径变化。用透射电子显微镜(tem)观察cthls和dgns的形态。紫外分光光度计在480nm处测定dgns的dox含
量,高效液相色谱(hplc)在280和295nm处测定cthls中的cap和tel含量。载药量(le)和包封率(ee)计算公式如下:
[0076][0077][0078]
3.1.2 cthls和dgns的体外释药
[0079]
(1)在不同ph值(ph 7.4,6.5或5.5)的pbs溶液中,评价cthls药物释放。将1mlcthls加入透析袋(mwco=3500),释放介质为30ml(pbs,0.5%tween-80)。然后将释放系统放入37℃恒温震荡箱中。在设定的时间点,取出2ml的释放介质,然后再补充2ml的释放介质,然后分别在280nm和295nm处用高效液相色谱法测定释放cap和tel的量。(2)1ml dgns加入透析袋(mwco=3500),释放介质(30ml pbs溶液,ph7.4,0.5%tween-80)中,然后将释放系统放入37℃恒温震荡箱中。在设定的时间点,取出2ml的释放介质,然后再补充2ml的释放介质,用紫外分光光度计在480nm处检测dox的吸光值。
[0080]
3.1.3模拟微环境的体外共培养研究模型建立
[0081]
肝癌微环境中,不仅有肝癌细胞,还有肝星状细胞(hscs)等基质细胞,而hscs促进肝癌的增殖和转移。为了模拟真实微环境,我们建立由bel-7402和lx-2细胞组成的共培养模型。把bel-7402和lx-2细胞以5:1的比例加入到培养板中,培养24h,就形成共培养细胞模型。为了区分两种细胞,我们用cfse(一种对活细胞进行荧光标记的新型染料)预处理lx-2细胞成c-lx-2,然后混合培养,制备可分辨的bel-7402/c-lx-2共培养模型。
[0082]
3.1.4细胞摄取和药物滞留试验
[0083]
(1)载dox纳米小球(dns)的制备:将spc和dox(spc:dox=20:1)在乙醇中混合(gah/spc的比例为1:1.7),然后慢慢滴注到gah溶液中。乙醇蒸发后,dns在冰浴中超声5min,并依次通过0.45μm和0.22μm聚醚砜膜,获得dns。
[0084]
(2)cap和tel这两种药物本身不具备荧光,因此在细胞摄取实验中选用疏水性荧光素c6代替两种药物,分别制备载c6脂质大球(c6-ls)以及载c6脂质大球(c6-hls)。载c6脂质大球(c6-ls)的制备:将二油酰基磷脂酰乙醇胺(dope)70mg、卵磷脂(spc)30mg、胆固醇琥珀酸单酯(chems)15mg、胆固醇15mg、咪唑基-胆固醇(aim-chol)10mg、5mg香豆素6(c6)溶解于5ml氯仿中。用旋转蒸发器去除氯仿,旋蒸条件:40℃,20rpm。待形成一层均匀的薄膜时,加入5ml pbs(ph=7.4),水化1小时。最后,在冰浴中超声5min,并依次通过0.45μm和0.22μm聚醚砜膜,获得载c6脂质大球(c6-ls)。载c6脂质大球(c6-hls)的制备:将二油酰基磷脂酰乙醇胺(dope)70mg、卵磷脂(spc)30mg、胆固醇琥珀酸单酯(chems)15mg、胆固醇15mg、咪唑基-胆固醇(aim-chol)10mg、dspe-peg-ha 5mg,5mg香豆素6(c6)溶解于5ml氯仿中。用旋转蒸发器去除氯仿,旋蒸条件:40℃,20rpm。待形成一层均匀的薄膜时,加入5ml pbs(ph=7.4),水化1小时。最后,在冰浴中超声5min,并依次通过0.45μm和0.22μμm聚醚砜膜,获得载c6脂质大球(c6-hls)。摄入实验:将bel-7402和lx-2分别接种于细胞培养皿中(5
×
104细胞/培养皿),检测细胞摄取。bel-7402细胞培养12h,加入游离dox(dox的浓度为10μg/ml)、
载dox纳米小球(dns)(dox的浓度为10μg/ml)和ga修饰的纳米小球(dgns)(dox的浓度为10μg/ml),共孵育0.5h。lx-2细胞培养12h,加入游离香豆素6(c6,c6的浓度为2μg/ml)、载c6脂质大球(c6-ls,c6的浓度为2μg/ml)、ha修饰的载c6脂质大球(c6-hls,c6的浓度为2μg/ml)在不含胎牛血清的dmem培养基中共培养0.5h。pbs洗三次后,dapi染色10min。随后,用共聚焦激光扫描显微镜拍照,并通过accuric6 plus流式细胞仪定量。
[0085]
滞留实验:将bel-7402/lx-2共培养细胞接种于6孔板(每孔细胞接种量为50万/个),加入dox(dox浓度为2μg/ml)、dox cap tel(dox浓度为2μg/ml、cap浓度为2μg/ml、tel浓度为2μg/ml)、dgns(dox浓度为2μg/ml)、dgns cthls(dox浓度为2μg/ml、cap浓度为2μg/ml、tel浓度为2μg/ml),孵育12小时。收集细胞并在accuric6 plus流式细胞仪检测细胞内药物量。
[0086]
3.1.5体外抗肿瘤实验
[0087]
为了更好地评价药物在肿瘤微环境中的作用,我们建立了两种细胞模型:(1)bel-7402细胞;(2)“bel-7402 lx-2”共培养细胞。首先将这两种细胞模型分别接种在96孔板中,每个孔加入6
×
103个细胞,然后在37℃培养24小时。加入dox、cap tel、dox cap tel(药物浓度比dox:cap:tel为1:1:1)、cthls、dgns、dgns cthls(药物浓度比dox:cap:tel为1:1:1)等制剂组,dox浓度设定为0.01~10μg/ml,培养48h。然后,在每个孔中加入mtt溶液,再孵育4小时。去除培养基,每孔加入150μldmso。应用酶标仪(elx800,biotek,usa)检测od值(490nm),并计算各组的细胞毒性。采用calcein-am/pi双染色试剂盒检测bel-7402细胞和lx-2细胞共培养模型的活死细胞染色特征。
[0088]
3.1.6细胞迁移分析
[0089]
采用划痕试验和transwell实验分析细胞迁移和侵袭特征。(1)细胞划痕试验。将bel-7402细胞和bel-7402/c-lx-2混合细胞分别以6
×
105每孔接种到6孔板中,37℃孵育24小时。用200μl吸管尖划伤细胞,在不同药物(药物在细胞中的终浓度为2μg/ml)形成的无血清培养基中培养24小时。在0小时和24小时用尼康eclipse ti-s显微镜监测划伤创面并拍照。利用image j软件测量间隙闭合率。(2)应用transwell分析细胞侵袭。将bel-7402/c-lx-2共培养细胞(5
×
104)接种在上室。培养24h后,将附着于下室的细胞用4%聚甲醛固定,然后用结晶紫染色。随后,使用尼康eclipse ti-s显微镜捕获细胞。
[0090]
3.1.7 3d肿瘤球药物渗透分析
[0091]
用液体覆盖法构建3d肿瘤球模型。将1.5%低熔点琼脂糖(50μl)加入96孔板中,经紫外线照射灭菌30min后,将2
×
103个bel-7402细胞悬液接种于孔板中,孵育10天,使其长成球形。去除介质,分别加入dox(dox浓度为10μg/ml)、dns(dox浓度为10μg/ml)和dgns(dox浓度为10μg/ml)。共孵育8h后,采用共聚焦激光扫描显微镜检测药物在肿瘤球的分布特征。
[0092]
3.1.8 western blot分析抗肝癌机制
[0093]
采用western blot检测肝癌细胞中e-cadherin,vimentin等蛋白的表达情况。裂解肿瘤细胞和肝癌组织提取蛋白质,点样在10%或12%sds-page凝胶上电泳,并转移到pvdf膜上。然后,将pvdf膜用5%的乳剂tbst在室温下密封2小时,然后与一抗在4℃下孵育过夜。随后,加入二抗,室温孵育1h。用超敏ecl化学发光溶液检测蛋白表达情况。
[0094]
3.1.9活体成像和组织渗透分析
[0095]
did-gns的制备方法:将spc和did(did:spc=1:30)和dspe-peg-ga在乙醇中混合
(gah/spc的比例为1:1.7,dspe-peg-ga/spc的比例为1:20),然后慢慢滴注到gah溶液中。乙醇蒸发后,dns在冰浴中超声5min,并依次通过0.45μm和0.22μm聚醚砜膜,获得did-gns。
[0096]
dir-hls的制备方法:将二油酰基磷脂酰乙醇胺(dope)70mg、卵磷脂(spc)30mg、胆固醇琥珀酸单酯(chems)15mg、胆固醇15mg、咪唑基-胆固醇(aim-chol)10mg、dspe-peg-ha 5mg、dir 2mg溶解于5ml氯仿中。用旋转蒸发器去除氯仿,旋蒸条件:40℃,20rpm。待形成一层均匀的薄膜时,加入5ml pbs(ph=7.4),水化1小时。最后,在冰浴中超声5min,并依次通过0.45μm和0.22μm聚醚砜膜,获得dir-hls。
[0097]
选用did和dir两种荧光物质代替药物,检测cthls和dgns在h22荷瘤小鼠体内的生物分布。将2
×
106h22细胞悬液皮下注射到balb/c小鼠中,建立h22荷瘤模型。当肿瘤体积约为200mm3时,将小鼠分为did、dir、did-gns、dir-hls和did-gns dir-hls。将不同制剂用无菌pbs(ph=7.4)稀释,使did和dir的浓度为60μg/ml,按照小鼠体重每10g尾静脉注射0.1ml。采用近红外荧光成像系统(nirf)在不同时间点监测did和dir在小鼠体内的生物分布。48h后取器官及肿瘤,离体分析荧光强度。
[0098]
为了评价dgns的通透性,建立h22荷瘤小鼠模型。当肿瘤体积约200mm3时,将小鼠分为5组:did、did-gns、did-gns(tel预处理)、did-gns(tel cap预处理)、did-gns(cthls预处理)。所有预处理组均经尾静脉连续治疗3天,静脉注射药物剂量:dox(3mg/kg)、cap(3mg/kg)、tel(3mg/kg)。注射did后12小时处死小鼠,分离肿瘤。然后将肿瘤组织切成10μm厚的切片。肿瘤切片采用dapi染色,然后使用共聚焦激光扫描显微镜(tcssp8;徕卡)。
[0099]
3.1.10建立3种体内抑制瘤模型,全面评价抑瘤效果
[0100]
(1)单荷瘤模型。选取雌性balb/c小鼠,在右侧皮下接种2
×
106个h22细胞,等肿瘤体积长到约150mm3时,小鼠随机分组(n=5),开展药物治疗。
[0101]
(2)共植入模型。选取雌性balb/c小鼠,按照5:1比例混合h22和m-hsc细胞,在右侧皮下接种2
×
106个细胞,等肿瘤体积增长到约150mm3时,随机分组(n=5),开展药物治疗。
[0102]
(3)原位移植瘤模型。我们建立了两种皮下肿瘤模型(h22荷瘤模型,m-hsc/h22共植入模型)。用5%水合氯醛麻醉balb/c小鼠,纵向切开腹腔至暴露出肝脏。用无菌注射器注入肝叶5
×
105h22细胞(pbs,25μl matrigel),然后缝合腹部伤口。
[0103]
3.1.11皮下移植瘤的抑瘤评价
[0104]
为了评估cthls和dgns的肝癌治疗效果,建立h22皮下荷瘤小鼠模型,肿瘤体积约为150mm3,分为7组(n=5组):(1)生理盐水;(2)cap tel;(3)dox;(4)dox cap tel;(5)cthls;(6)dgns;(7)dgns cthls。
[0105]
建立m-hsc/h22共植入模型,当肿瘤达到约150mm3被分成8组(n=5):(1)h22对照组;(2)m-hsc/h22对照组;(3)cap tel;(4)dox;(5)dox cap tel;(6)cthls;(7)dgns;(8)dgns cthls。
[0106]
静脉注射药物剂量:dox(3mg/kg)、cap(3mg/kg)、tel(3mg/kg),共7次。药物治疗后每隔一天监测小鼠的肿瘤大小和体重。两周后,处死小鼠,摘取肿瘤并称重。
[0107]
4%多聚甲醛固定肿瘤及重要脏器。然后对肿瘤切片进行h&e染色、免疫组织化学分析、masson三色染色和western blot分析。
[0108]
3.1.12原位移植瘤的抑瘤评价
[0109]
为了进一步评价dgns和cthls的抑瘤效果,我们构建了hcc原位肿瘤模型。2周后,
将小鼠分为5组:(1)生理盐水;(2)dox cap tel;(3)cthls(4)dgns(5)dgns cthls。dgns(dox浓度为300μg/ml)和cthls(cap浓度为300μg/ml、tel浓度为300μg/ml)用无菌pbs(ph=7.4)稀释后,按照小鼠体重每10g注射0.1ml。每2天给小鼠注射不同剂型。14天后,对所有动物实施安乐死,分离器官进行分析。
[0110]
3.1.13肺转移实验
[0111]
尾静脉注射2
×
106h22细胞,构建肝癌肺转移模型。然后,将小鼠随机分为7组(n=3):(1)生理盐水;(2)cap tel;(3)dox;(4)dox cap tel;(5)cthls;(6)dgns;(7)dgns cthls。dgns(dox浓度为300μg/ml)和cthls(cap浓度为300μg/ml、tel浓度为300μg/ml)用无菌pbs(ph=7.4)稀释后,按照小鼠体重每10g注射0.1ml。每2天注射不同剂型的小鼠。14天后处死小鼠。取下肺并用4%多聚甲醛固定。然后测量转移结节数量,并对肺组织切片进行h&e染色。
[0112]
3.1.14统计分析
[0113]
数据以平均数
±
标准差表示。使用prism 8.0(graphpad)进行数据制图和统计分析。两组间差异采用学生t检验或方差分析,以p《0.05为差异有统计学意义。
[0114]
3.2结果和讨论
[0115]
3.2.1 dgns和cthls的理化性质分析
[0116]
cthls和dgns的表征如表2所示。dgns的平均粒径约为32nm(图4中a图所示),既避免了粒径过小引起的肾脏代谢,又有利于dgns向肿瘤深部浸润。dgns的zeta电位为负。dox的包封率和载药量分别为88.9%和2.38%。cthls的平均粒径为160nm(图4中b图所示),具有负电位的电位特性。cap的包封率和载药量分别为83.7%和2.79%,tel的包封率和载药量分别为83.1%和2.77%。tem图像显示dgns和cthls在ph为7.4时呈规则的球形,而cthls在ph为5.0时粒径增大,形状不规则(图4中c图-e图)。其次,研究dgns和cthls在pbs和rpmi 1640培养基中的稳定性。如图4中f图和g图所示,结果表明dgns和cthls在7天内保持稳定。
[0117]
dox从dgns的释放如图4中h图所示。与游离dox相比,dgns在8h内的体外累积释放率较低,说明dgns具有长循环性。另外,通过测定不同ph条件下cthls的释放速率,验证其对ph的敏感性。如图4中i图所示,cap在ph 5.0下48h内的累积释放率为72.5%,显著高于ph 6.5(54.3%)和ph 7.4(42.5%),说明在酸性条件下dope具有增强药物释放的作用。tel的累积释放率在ph 5.0(10.4%)和ph 6.5(42.8%)下显著低于ph 7.4(69.2%),其主要原因是其酸度较弱。因此,ph敏感脂质体将tel从溶酶体快速释放到细胞质中有利于tel发挥其作用。
[0118]
表2 dgns和cthls的表征
[0119][0120]
3.2.2细胞摄取和药物滞留检测
[0121]
研究显示,纳米载体的粒径、电位、表面修饰等因素对肿瘤细胞的摄取起着重要作
用。小于20nm的纳米粒在体内血液循环中被肾脏快速清除,而大于100nm的纳米颗粒则不利于细胞摄取。在本研究中,我们制备了32nm的纳米小球。如图5中a图所示,dns组比游离dox组荧光信号更强,说明粒径较小的纳米胶束更容易被细胞吸收。此外,与dns组相比,dgns组显示出更强的荧光信号,显示dgns可能通过ga介导的胞吞作用增加hcc细胞对dox的摄取。用流式细胞术定量各组的荧光强度,其结果与激光共聚焦结果一致(图5中b图)。我们也检测了lx-2对cthls的摄取情况,如图6中a图-b图所示,非靶向脂质体组处理的细胞表现出更强的绿色。这可能是由于cd44受体在lx-2细胞表面过表达,ha修饰的脂质体可以促进受体介导的细胞内吞。
[0122]
研究显示,肝癌微环境中的cafs能诱导肿瘤细胞的药物外排,降低肿瘤对药物的敏感性。我们建立lx-2/bel-7402共培养模型,模拟体内环境,检测不同制剂组的药物滞留效果(图5中c图所示)。与单独bel-7402相比,lx-2/bel-7402组的荧光信号较弱,说明cafs可以减少dox在肿瘤细胞中的积累。有趣的是,在共培养模型中加入cap和tel后,各组的荧光信号均显著增强,说明cap和tel能有效抑制药物外排。采用流式细胞仪检测细胞内dox量(图5中d图所示),与clsm检测结果相一致。
[0123]
3.2.3检测dgns在3d肿瘤球的渗透
[0124]
为了评价dgns的穿透能力,建立了3d肿瘤球模型,并采用clsm的z-stack扫描监测不同配方的渗透能力。如图7中a图-b图所示,dox主要分布在3d肿瘤球的外围,而不是内部。相比之下,两个纳米粒组可以渗透到球体内部。而dgns组在肿瘤深处的荧光强度明显高于dns组,说明甘草次酸的修饰提高了纳米粒的渗透效果。
[0125]
3.2.4 cthls增强dgns的细胞毒性
[0126]
肿瘤的发生和发展与tme密切相关,tme中的cafs可以提高肿瘤细胞的耐药性。然而,传统的体外研究模型是肿瘤细胞,无法真实模拟tme。在本研究中,在肝癌细胞(bel-7402)基础上,我们新建立bel-7402/lx-2共培养细胞模型,模拟tme,检测不同剂型的体外药物毒性(图8中a图所示)。如图8中b图-c图所示,各组具有明显的浓度依赖性。与单独bel-7402细胞相比,游离药物组在bel-7402/lx-2共培养细胞中的ic50显著降低。其中,游离dox对共培养体系的ic50为7.13μg/ml,比bel7402细胞高出6.4倍。这是因为激活lx-2降低了bel-7402对药物的敏感性,导致肿瘤耐药。同时,dgns cthls组比游离dox cap tel组具有更高的毒性。这可能是由于dgns通过ga受体介导作用增加了药物摄取,这也在细胞摄取研究中得到了证明。活/死染色结果也表明dgns cthls组比其他制剂组具有更强的促凋亡效果(图8中d图所示)。
[0127]
3.2.5 cthls通过阻断emt抑制肝癌细胞迁移
[0128]
为探讨不同制剂对细胞迁移的影响,我们建立bel-7402单细胞模型和bel-7402/lx-2共培养模型(图9中a图所示)。如图9中b图和d图所示,bel-7402/lx-2共培养细胞的迁移率(49.3%)显著高于单独bel-7402细胞的迁移率(39.97%),说明lx-2促进了细胞迁移。此外,dgns cthls组能有效抑制单独bel-7402和bel-7402/lx-2的细胞迁移(图9中c图和e图所示),这可能是由于cthls联合dgns治疗能效抑制了lx-2与bel-7402间的cross-talk,从而有效地抑制了细胞迁移。除细胞划痕研究外,我们采用transwell实验进一步检测细胞侵袭能力。如图10中a图-b图所示,与其他组相比,dgns cthls组中侵袭的细胞更少,显示脂质大球 纳米小球混合制剂有效抑制了肿瘤的侵袭和迁移。
[0129]
研究显示,cafs通过诱导肿瘤细胞emt促进肿瘤迁移。我们通过western blot实验检测了emt相关蛋白的表达。如图10中c图-d图所示,与bel-7402细胞相比,lx-2/bel-7402共培养系统中vimentin表达明显上调,e-cadherin的表达明显下调,表明cafs能促进肿瘤细胞的emt。此外,与对照组相比cap tel组vimentin表达明显下调,e-cadherin的表达明显上调,表明cap联合tel可以能有效抑制cafs介导的emt,抑制肿瘤细胞迁移。
[0130]
3.2.6 dgns和cthls在体内组织分布研究
[0131]
为了评估纳米小球和脂质大球在体内的组织分布,将did和dir分别包裹在dgns和cthls中,通过nirf技术观察did-gns和dir-hls在体内的生物分布。如图11a所示,在did激发波长下,观察到did-gns聚集在肿瘤部位,这是由于甘草次酸的修饰提高了did-gns的肝癌靶向能力。在dir激发波长下,观察到dir-hls也能分布在肿瘤部位,这可能是由于脂质体的epr作用提高了dir在肿瘤区域的积累。另外,在肿瘤部位观察到共振能量转移(fret)效应。在did激发波长处,与did-gns dir-hls组相比,did-gns组的did荧光强度(激发峰为648nm;发射峰为670nm)明显增强。相反,在dir激发波长处,与did-gns dir-hls组相比,dir-hls组的dir荧光强度(fret受体:激发峰,750nm;发射峰为782nm)明显降低,这说明did-gns和dir-hls都能在肿瘤部位聚集,有利于发挥剂型的协同抗肿瘤作用。同时,体外荧光定量结果也证实了fret效应(图11中的b图-d图)。此外,我们对did-gns组肿瘤进行冷冻切片,与游离did组相比,did-gns组在肿瘤深部部位的荧光强度更强(图11中e图和f图),表明小粒径的纳米小球更有利于组织渗透。
[0132]
3.2.7 cthls增强did-gns在组织的深渗透
[0133]
最近的研究表明,肿瘤微环境中的cafs和ecm抑制了药物在肿瘤组织的渗透,降低了肿瘤治疗效果。因此,通过cthls抑制cafs活化,减少肿瘤微环境中的ecm,可以有效增加药物深渗透。为了证实这一说法,构建h22/m-hscs共植入荷瘤模型。治疗3天后,观察各治疗组药物渗透情况。如图12中a图-b图所示,与游离did相比,did-gns组的荧光强度更强,这与3d肿瘤球的实验结果一致。此外,加入tel或tel cap后,肿瘤深处的荧光强度增强,这说明tel和cap能够促进微环境疏松,提高药物的通透性。而加入cthls后,肿瘤组织内部的荧光更强,说明cthls比游离tel cap具有更强的微环境调控效果,有效增强did-gns在肝癌组织的深渗透。
[0134]
3.2.8 gns联合cthls抑制h22皮下移植瘤发展
[0135]
建立h22荷瘤小鼠模型,评价dgns联合cthls的抗肿瘤活性(图13中a图所示)。如图13中b图和d图所示,与生理盐水组相比,药物治疗组显示不同程度的肿瘤生长抑制效果,其中,dgns cthls组的肿瘤体积远小于dgns或cthls组,表明dgns联合cthls能提高抗肿瘤的效果。组织学分析结果显示,在dgns cthls组,肿瘤组织有明显的核仁溶解和胞浆空泡化,表明联合治疗组具有较好的抗肿瘤疗效(图13中a图所示)。体重检测结果显示,所有纳米制剂组与对照组相似,而游离dox组的体重均较低(图13中c图所示)。另外,器官h&e结果显示(图14中a图所示),经纳米制剂处理后,细胞核大小均匀,结构无明显变化,心肌肌纤维排列紧密,形态规则,而dox治疗组小鼠心肌核固缩或破裂,心肌排列紊乱松散,明显溶出和破裂。以上结果表明,纳米制剂有效降低了dox的毒副作用。
[0136]
3.2.9 cthls促进dgns对m-hsc/h22共植入荷瘤模型的抑制效果
[0137]
肝癌微环境包括肝星状细胞、免疫细胞等多种基质细胞,这些基质细胞在原发肿
瘤的发生发展中发挥重要作用。有报道称,肿瘤微环境中的cafs促进肿瘤细胞增殖和迁移。因此,为了模拟tme,我们将鼠源hsc(m-hsc)与h22细胞混合,共植入小鼠右背侧,建立m-hsc/h22共植入荷瘤模型,验证各制剂的体内抗肿瘤作用(图15中a图所示)。
[0138]
如图15中b图和d图所示,与传统h22荷瘤小鼠模型相比,m-hsc/h22荷瘤小鼠模型的肿瘤体积明显增大。这是由于tme中的cafs促进了肿瘤的增殖。此外,与游离药物组相比,dgns或cthls的肿瘤体积均有不同程度的减小,说明脂质大球和纳米小球可显著提高抗肿瘤疗效。h&e染色显示,dgns或cthls的凋亡区域比游离药组明显增多(图16中a图所示),而dgns cthls联合治疗组对肿瘤生长的抑制作用最强。这可能是由于cthls释放cap和tel,抑制cafs的活化,增强了dgns的肝癌治疗效果。masson染色和α-sma免疫组化实验显示(图16中b图-c图),dgns cthls组比dgns组的胶原沉积更少,α-sma阳性区域更小,这表明cthls能有效地抑制caf活化,降低胶原蛋白的生成。另外,cd31蛋白免疫组化实验显示,与游离药相比,dgns cthls组肿瘤微血管明显减少,表明基于纳米载体的联合治疗策略可抑制肿瘤血管新生(图16中d图-e图)。
[0139]
为了分析dgns cthls的抗肿瘤机制,我们进行了western blot检测。如图16中f图-g图所示,与h22小鼠相比,mhsc/h22小鼠中e-cadherin的表达下降,vimentin的表达则相反。这说明,加入m-hscs细胞可促进hcc细胞emt。加入药物后,dgns cthls组的e-cadherin表达显著升高,vimentin表达明显降低,提示dgns联合cthls治疗能有效逆转hcc的emt。
[0140]
3.2.10 dgns联合cthls抑制原位肿瘤
[0141]
为了深入评价dgns联合cthls的抗hcc效果,我们建立了原位肝癌移植瘤模型(图17中a图所示)。如图17中b图-c图所示,相比于游离dox cap tel治疗组,dgns cthls治疗组的肿瘤面积明显减少,肿瘤凋亡区域更多,表明dgns联合cthls可以有效提高抗肝癌疗效。masson和免疫组化显示(图16中d图-f图所示),与dgns治疗组相比,dgns cthls治疗组的α-sma阳性区域更小,胶原沉积更少,新生血管减少。这表明cthls调控了肿瘤微环境,有效地抑制了微环境中cafs活化,降低了ecm沉积,减少了新生血管的生成。
[0142]
3.2.11 dgns联合cthls抑制肺转移
[0143]
肝癌转移是肝癌预后不良的主要原因。为了检测dgns联合cthls抑制肝癌肺转移的疗效,我们通过静脉注射h22细胞建立了肝癌肺转移模型(图18中a图所示)。图18中b图显示,与对照组相比,纳米制剂组没有明显的体重变化。图18中c图-d图显示肺转移结节情况,dgns cthls组结节数量比其他组更少,表现出更强的抑制肺转移效果。肺脏h&e染色图像显示(图17中e图所示),各治疗组均有不同程度的肺转移灶,而dgns cthls组肺转移灶小,提示dgns联合cthls有效抑制肝癌转移。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
