用于检测肺癌标志物的免泵sers微流控芯片及其制备方法和使用方法
技术领域
1.本发明涉及生物医学工程技术领域,尤其涉及一种用于检测肺癌标志物的免泵sers微流控芯片及其制备方法和使用方法。
背景技术:
2.肺癌是全世界癌症相关死亡的主要原因。不幸的是,早期肺癌往往没有症状,75%的人在癌症晚期才被诊断出来。作为肺癌的一个主要组织学类别,非小细胞肺癌(nsclc)约占所有病例的85%,而全世界nsclc的5年总生存率仍低于15%。因此,早期诊断对于延长nsclc患者的生存期具有重要意义。循环肿瘤dna(ctdna)作为一种来源于肿瘤细胞的肿瘤特异性dna,也被称为“液体活检”,含有与肿瘤组织相同的遗传信息,已成为诊断肿瘤的理想生物标志物。最近,人们开发了各种检测ctdna的方法,包括聚合酶链式反应(pcr) 和下一代测序(ngs)。然而,这些传统方法受到灵敏度低、检测时间长和检测成本高的限制。因此,对于nsclc的早期诊断来说,一种快速而敏感的ctdna检测方法是非常有必要的。
3.表面增强拉曼光谱(sers)作为近年来快速发展的振动光谱技术,已被广泛应用于环境化学和生物化学领域的有机化合物分析,能够对各种生化成分进行超灵敏检测,其优势在于能够在极小的检测体积内提供目标分子的极低检测水平的指纹信息。首先,sers由于其指纹特征,在复杂的样品系统中对分子具有较好的检测精度;其次,sers具有良好的稳定性和便携性,可以对拉曼信号进行高强度的放大和量化。由于电磁和化学的影响,sers信号在纳米材料粗糙的表面或间隙处“热点”大大增加,使得sers信号比传统的拉曼光谱高出10-14个数量级。金钯纳米棒(pd-aunrs)由于具有独特的、可调节的局部表面等离子体共振而被广泛应用。核心-外壳的空间结构使钯壳能够通过长程电磁增强从金核中借用高的sers活性,提高表面上修饰的信号分子的信号强度。另外,pd-aunrs之间的纳米间隙可以产生更多的“热点”,导致更显著的电磁场耦合,引起强烈的sers增强。
4.尽管sers显示出众多优异的性能,但它仍然受到实验中繁琐的离心和孵化等繁琐步骤的困扰。为了解决这些问题,有必要寻找一种新的定量分析方法。微流控技术也被称为“芯片上的实验室”,呈现出样品损失少、产量高、分析速度快、易于小型化等优点,成为理想的新型检测平台。传统的微流控芯片一般需要注射泵和蠕动泵驱动来控制液体的流动,限制了它在便携式测试和推广中的应用。为此人们提出了免泵微流控芯片,将毛细管泵设计在芯片上,微流控通道使液体运输不受外部阀门和泵的影响。这种微流控芯片可以实现快速混合、反应和检测,无需专业培训和昂贵的仪器。基于这些优势,免泵sers微流控芯片有望克服传统的sers技术灵敏度低、测量精度低以及操作不便的问题。sers和微流控芯片的结合,使检测条生物传感器能够进行定量检测,在一定程度上提高了检测灵敏度。但对于一些低浓度的待测物,仍不能满足检测的要求,因此引入信号放大策略迫在眉睫。催化发卡自组装(cha) 是一种新型的ctdna信号放大手段,无需酶催化,在室温下无需扩增设备即可进行。在cha 反应中,两条发卡dna互补,嵌入到茎环内的互补区域限制了其自发杂交,使它们
在溶液中可以稳定存在。当有引发链存在时,支点会引发链置换反应,打开其中一条dna链的发卡结构,进而引发两条发卡dna链的组装,置换出来的ctdna继续引发下一轮杂交反应,从而使检测信号得到放大。
5.目前,基于信号放大的免泵sers微流控芯片检测核酸类标志物在国内外尚无相关报道。既往sers对肺癌的研究多数集中在cea、nse、ck-19等蛋白质类相关指标,涉及ctdna 相关的研究也鲜有报道。
技术实现要素:
6.本发明旨在解决现有技术中存在的技术问题。为此,本发明提供一种用于检测肺癌标志物的免泵sers微流控芯片及其制备方法和使用方法,目的是实现肿瘤核酸标志物的快速、定量、高灵敏检测。
7.基于上述目的,本发明提供了一种用于检测肺癌标志物的免泵sers微流控芯片的制备方法,包括如下步骤:
8.步骤一、构建荷瘤裸鼠模型,收集不同时期裸鼠血清样本;
9.步骤二、利用种子生长法制备金钯纳米棒;
10.步骤三、将步骤二制备得到的金钯纳米棒的表面分别标记拉曼信号分子4-mba和 dtnb,接着分别修饰发卡dna结构hp
1-1
和hp
1-2
,形成两种sers探针;其中,4-mba 为4-巯基苯甲酸,dtnb为5,5'-二硫代双(2-硝基苯甲酸);
11.步骤四、在磁珠表面分别修饰发卡dna结构hp
2-1
和hp
2-2
,形成两种捕获探针;
12.步骤五、构建基于催化发卡自组装和磁珠聚集形成信号双放大的免泵微流控芯片。
13.作为一种可选的方式,所述步骤一中构建荷瘤裸鼠模型,收集不同时期裸鼠血清样本的方法包括如下步骤:将裸鼠消毒后经皮下注射pc9细胞后,饲养至成瘤,成瘤后每5天测量瘤子大小并收集新鲜血清样本冰冻保存。
14.作为一种可选的方式,所述步骤二中利用种子生长法制备金钯纳米棒的方法包括如下步骤:
15.(1)取氯金酸(haucl4)加入十六烷基三甲基溴化铵(ctab)中,之后注入冰浴中配置的硼氢化钠(nabh4)溶液,经剧烈搅拌后形成种子溶液a,静置保存备用;其中,十六烷基三甲基溴化铵与氯金酸及硼氢化钠的摩尔比为900-1000:2-3:5-7;
16.(2)取氯金酸加入十六烷基三甲基溴化铵与油酸钠(naol)的混合溶液中,搅拌至溶液变为无色时加入硝酸银(agno3),继续搅拌后加入酸调节ph至5-6,之后依次加入抗坏血酸(aa)及所述种子溶液a,经静置反应、离心、清洗后得到金纳米棒;
17.(3)将金纳米棒分散于水中,之后取金纳米棒分散液加入到十六烷基三甲基溴化铵溶液中,经超声、离心后,沉淀与十六烷基三甲基溴化铵溶液配置成种子溶液b;
18.(4)取种子溶液b与氯化铜溶液及氯钯酸溶液混合静置反应后,加入抗坏血酸混合反应后,经乙醇和超纯水离心后,得到金钯纳米棒。
19.优选的,制备金钯纳米棒的方法包括如下步骤:
20.(1)在9-10ml 0.1mol/l的ctab中加入200-300l的10mmol/l haucl4,搅拌10min,然后快速注入0.5-0.7ml新鲜冰浴配制的10mmol/l的nabh4,剧烈搅拌2min,得到的种子溶
液a在28℃静置保存30min;
21.(2)将7-8g的ctab和0.987g的naol溶解于400ml去离子水中,然后在磁力搅拌下向溶液中注入10-30ml 10mmol/l的haucl4溶液,当溶液变为无色时加入5-10ml 10 mmol/l agno3,继续搅拌5min,然后注入1-2ml盐酸以调节混合物的ph,之后添加 500-800l 0.1mol/l aa,约30s后,在搅拌下注入上述制备的1ml种子溶液a,在30℃下静置12h后反应完成,反应溶液以9000r/min的速率离心15min,清洗两次,最终得到的金纳米棒分散在10ml去离子水中。
22.(3)取180l金纳米棒分散液加入到1ml 0.1mol/l ctab水溶液中,超声1h,离心1 次后,沉淀加入0.1mol/l ctab至200-500l,得到种子溶液b;
23.(4)取50l的上述种子溶液b,加入到1ml的20mmol/l ctab溶液中,静置10min 后,加入5-50l 2mmol/l的cucl2水溶液,20-40l 10mmol/l的h2pdcl4,静置5min后,加入10-15l的0.1mol/l aa,摇晃均匀后,置于30℃下反应12h,最后将金钯纳米棒分别用乙醇和超纯水离心后分散在超纯水中,将金钯纳米棒溶液存放在4℃冰箱中待用,用于后续sers探针的制备。
24.作为一种可选的方式,所述步骤三中金钯纳米棒的表面标记拉曼信号分子4-mba的方法是将4-mba乙醇溶液加入到金钯纳米棒溶液中,经搅拌10-50min后得到 pd-aunrs@4-mba溶液;金钯纳米棒的表面标记拉曼信号分子dtnb的方法是将dtnb的乙醇溶液加入到金钯纳米棒溶液中,经搅拌10-50min后得到pd-aunrs。4-mba和dtnb可通过au-s键偶联到金钯纳米棒表面,优选的,将30-80l 1mm的4-mba乙醇溶液加入到 0.5-3ml步骤二所合成的金钯纳米棒溶液中,搅拌10-50min后得到pd-aunrs@4-mba溶液溶液,然后用同样的方法获得dtnb标记的pd-aunrs。
25.所述步骤三中修饰发卡dna结构hp
1-1
和hp
1-2
形成两种sers探针的方法是将hp
1-1
和 hp
1-2
分别用tcep缓冲液活化后,再分别与相应的pd-aunrs@4-mba溶液及pd-aunrs溶液混合10-18h,得到pd-aunrs@4-mba@hp
1-1
溶液和pd-aunrs@dtnb@hp
1-2
溶液,之后分别在pd-aunrs@4-mba@hp
1-1
溶液和pd-aunrs@dtnb@hp
1-2
溶液中加入牛血清白蛋白溶液,经孵育、离心、pbs缓冲液溶解的nacl溶液处理后,再将沉淀溶解在pbs缓冲溶液中,即得两种sers探针。
26.优选的,将10-30l 0.5mm的hp
1-1
与20-50l新鲜制备的0.5-2mm的tcep缓冲液混合1-3h,用于活化hp
1-1
;然后,将活化后的hp
1-1
与0.5-2ml pd-aunrs@4-mba溶液混合 10-18h,得到pd-aunrs@4-mba@hp
1-1
溶液;然后用同样的方法获得 pd-aunrs@dtnb@hp
1-2
溶液;接着加入2-20l 30-80g/ml的牛血清白蛋白溶液,孵育0.5-3 h,阻断羧基多余的结合位点,然后离心5-20min,加入用0.01m pbs缓冲液溶解的2-20l 的2-8m nacl溶液,使nacl溶液在混合溶液中的浓度逐渐变为0.2-1m,将沉淀溶解在pbs 溶液中供进一步使用,最终得到两种sers探针。
27.作为一种可选的方式,所述步骤四中在磁珠表面分别修饰发卡dna结构hp
2-1
和hp
2-2
,形成两种捕获探针的方法包括如下步骤:
28.将磁珠依次经pbs溶液分散、活化、一次孵育、封闭磁珠表面位点、磁铁分离后,分离出的磁珠加入pbs溶液,然后分别与haxzp
2-1
与hp
2-2
混溶后,再分别经二次孵育后得到 hp
2-1
@mbs溶液和hp
2-2
@mbs溶液。
29.优选的,所述活化是采用edc和nhs活化磁珠表面的羧基,一次孵育是在室温下震荡孵育0.5h,二次孵育是在室温下震荡孵育2h,封闭磁珠表面位点是采用滴加10%bsa溶液对磁珠表面位点封闭。
30.优选的,形成两种捕获探针的方法包括如下步骤:首先取400-800l 0.5mg/m l磁珠,将试管倾斜,磁铁放置于试管底部,磁珠会在磁力的作用下集合在试管底部,用移液枪将上清液吸取出去,再加入400-600l 10m m的pbs溶液(ph7.2)分散后,分散均匀后,重复上述步骤,对磁珠共洗涤两遍,在室温下,通过edc(5l,0.1m)和nhs(5l,0.1m)活化 mbs表面的羧基,然后进行0.5h的室温500rpm震荡孵育,滴加10l 10%bsa溶液,其目的是对磁珠mbs表面位点封闭,接着,用磁铁分离磁珠mbs,吸取上清液,用400-600l10m m的pbs溶液反复洗涤两次,洗涤出的磁珠再加入400-600l pbs溶液,加入10-30l 0.5 mm的hp
2-1
,在进行两小时的室温500rpm震荡孵育,得到了hp
2-1
@mbs溶液;加入10-30l0.5mm的hp
2-2
,在进行两小时的室温500rpm震荡孵育,两种溶液最后封藏于试管中,放置在4℃冷藏。
31.作为一种可选的实施方式,所述步骤五中构建基于催化发卡自组装和磁珠聚集形成信号双放大的免泵微流控芯片的方法包括如下步骤:
32.(1)将制备的pdms基片打孔,之后与载玻片经超声清洗、烘干、等离子处理后,将 pdms基片与载玻片进行贴合,以形成微流控芯片;
33.(2)采用聚乙二醇对制备好的微流控芯片进行亲水性处理,以得到亲水性的微流控芯片。
34.优选的,步骤五的具体方法包括如下步骤:
35.(1)取聚二甲基硅氧烷(pdms)10-30g,置于一次性塑料杯中,随后,再取1-3g固化剂放置于此杯中,固化剂与pdms比例为1:10,用一次性搅拌棒顺时针搅拌30min,充分将固化剂与pdms的混合液搅拌均匀后放置于真空箱中,打开抽气阀,进行30min的真空抽气可以观察到,溶液中的小气泡消失,将混合液体浇筑到模具上,放置于加热板上,70℃下固化3h,随后进行剪切,可得pdms基片,再用打孔器在pdms基片上打孔,将做好的基片和载玻片,先后泡入乙醇,异丙醇试剂瓶中放置于超声清洗仪中清洗5min后,取出放置于加热板上烘干,最后,将烘干后的基片和载玻片放置于等离子清洗机中,进行等离子处理30s,取出后将基片与载玻片进行贴合。
36.(2)为保证芯片的亲水性,使用聚乙二醇对制备好的芯片进行亲水性处理。方法为:将聚乙二醇取适量放置于加热盘上,聚乙二醇能够浸没芯片底层通道即可,将芯片具有通道一面放置于聚乙二醇溶液上将加热板调制到150℃,加热0.5h,微流控芯片取出,用异丙醇洗净,放置于4℃环境下冷却1h。
37.本发明还提供一种用于检测肺癌标志物的免泵sers微流控芯片,采用所述用于检测肺癌标志物的免泵sers微流控芯片的制备方法制得。
38.本发明还提供一种所述用于检测肺癌标志物的免泵sers微流控芯片的使用方法,包括如下步骤:
39.s1、将捕获探针hp
2-1
@mbs和hp
2-2
@mbs加入第一加样口,将稀释后的样品溶液滴在第二加样口,sers探针加入第三加样口,在磁铁的吸引下,带有磁珠的反应复合产物固定于收集室内;
40.s2、将采集到的荷瘤裸鼠模型不同时期的血清点样到免泵sers微流控芯片上,37
℃更稳反应后,进行sers检测。
41.本发明的免泵sers微流控芯片检测待检测样本中braf v600e和kras g12v的检测方法,所述检测方法包括以下步骤:
42.(1)将捕获探针hp
2-1
@mbs和hp
2-2
@mbs加入第一加样口,将稀释后的样品溶液滴在第二加样口,sers探针加入第三加样口,在磁铁的吸引下,带有磁珠的cha反应符合产物被固定在收集室内,检测收集室内的复合物的sers光谱,通过sers信号强度的变化来定量检测braf v600e和kras g12v;
43.(2)将braf v600e和kras g12v溶解于不同体积的pbs缓冲液或者血清中,配置得到不同浓度的braf v600e和kras g12v标准样的混合溶液;点样到免泵sers微流控芯片上,在37℃恒温箱反应一段时间后,进行sers测试,根据1593cm-1和1330cm-1特征峰处的信号强度,分别做出braf v600e和kras g12v浓度的对数和sers信号强度变化的工作曲线;
44.(3)采集荷瘤裸鼠模型不同时期的血清,点样到免泵sers微流控芯片上,在37℃恒温箱反应一段时间后,进行sers检测。
45.(4)将步骤3)得到的1593cm-1和1330cm-1特征峰处的信号强度代入步骤(2)所确定的工作曲线中,测定braf v600e和kras g12v的浓度。
46.优选地,步骤(2)杂交反应时的杂交时间是不低于5min。
47.综上,本发明首先利用种子生长法制备金钯纳米棒,然后将制备得到的金钯纳米棒的表面分别标记拉曼信号分子4-mba和dtnb,接着分别修饰生物素标记的发卡hp
1-1
和hp
1-2
,形成两种sers探针。由于磁铁的吸引,cha反应后的复合物 pd-aunrs@4-mba@hp
1-1
@hp
2-1
@mbs(或pd-aunrs@dtnb@hp
1-2
@hp
2-2
@mbs)可被富集在收集室,并在纳米颗粒之间形成更多的热点,通过优化制备条件,构建免泵sers微流控芯片。该免泵sers微流控芯片具有组装过程简单、特异性强、均一性好、重复性优和灵敏度高等优点,通过测定pbs缓冲液和小鼠血清中不同浓度braf v600e和kras g12v 对应的sers信号强度,建立braf v600e和kras g12v的浓度和sers信号强度之间的定量关系,根据定量关系检测了裸鼠模型血清中braf v600e和kras g12v的浓度,准确性非常高,结果表明本发明的免泵sers微流控芯片可用于临床样本样品中低丰度肿瘤核酸标志物的快速、定量、高灵敏检测,为拓展sers在肺癌早期检测中的广泛应用提供了技术支持。
48.本发明的有益效果:
49.(1)本发明提供的金钯纳米棒合成方法简单,sers增强效果好。
50.(2)本发明的金钯纳米棒具有成本低,制备简单和生物相容性高的优点.
51.(3)本发明涉及的免泵sers微流控芯片具有操作简单、价格低廉、反应时间短、便于携带且检测过程不需要大型仪器的辅助等优势。
52.(4)本发明制备的免泵sers微流控芯片重复性良好,能够实现规模化的制备。
53.(5)本发明中催化发卡自组装(cha)是一种新型的ctdna信号放大手段,无需酶催化,在室温下无需扩增设备即可进行。在cha反应中,两条发卡dna互补,嵌入到茎环内的互补区域限制了其自发杂交,使它们在溶液中可以稳定存在。引发链存在时可以引发两条发卡dna杂交形成双链产物,同时释放并且循环利用引发链进行信号放大。由此,少量的引发链即可触发大量的发卡dna自组装,产生几百倍的催化信号放大且背景信号较低,结合sers信号输出,可以被应用于诸多目标物的灵敏检测。具有检测简单快速、用量少、高通量等优
点。
附图说明
54.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
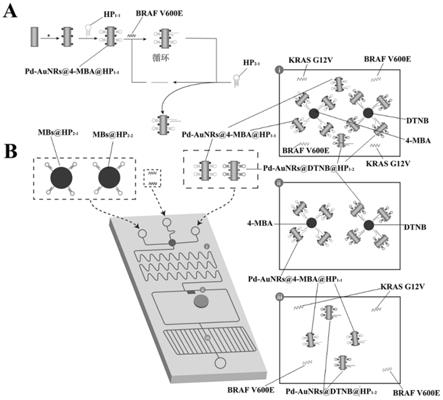
55.图1是催化发卡自组装(cha)和磁珠聚集形成信号双放大的免泵微流控芯片用于肿瘤标志物braf v600e和kras g12v的sers检测示意图;
56.图2a是实施例1中所制备的金钯纳米棒的sem照片;
57.图2b是实施例1中所制备的金钯纳米棒的tem照片;
58.图2c是实施例1中所制备的金钯纳米棒的高分辨tem照片;
59.图2d是实施例1中所制备的金钯纳米棒的saed衍射图照片;
60.图2e是实施例1中所制备的金钯纳米棒的haadf-stem成像图;
61.图2f是实施例1中所制备的金钯纳米棒中金元素的edx成像图;
62.图2g是实施例1中所制备的金钯纳米棒中钯元素的edx成像图;
63.图2h是实施例1中所制备的金钯纳米棒中金、钯元素的edx成像图;
64.图2i是实施例1中所制备的金钯纳米棒的edx光谱图;
65.图2j是实施例1中所制备的金钯纳米棒的uv-vis-nir光谱;
66.图2k是实施例1中拉曼信号分子4-mba、dtnb、pd-aunrs@4-mba、pd-aunrs@dtnb 的拉曼光谱图;
67.图3a是实施例2中金钯纳米棒的tem照片;
68.图3b和3c是实施例2中模拟金钯纳米棒的电磁场分布;
69.图4a和4b是实施例3中制备的磁珠的sem照片;
70.图4c是实施例3中制备的磁珠的tem照片;
71.图4d是实施例3中制备的磁珠的溶液照片;
72.图5a是实施例4中所制备的免泵sers微流控芯片中墨水随时间自行流动的照片;
73.图5b是实施例4中所制备的免泵sers微流控芯片储存于空气中不同时间后检测目标 braf v600e和kras g12v的sers光谱图;
74.图5c是实施例4中所制备的免泵sers微流控芯片储存于空气中不同时间后检测目标 braf v600e和kras g12v的sers光谱图在1330cm-1
和1593cm-1
特征峰处强度直方图;
75.图6a是实施例4中所制备的免泵sers微流控芯片两个检测点的显微镜照片;
76.图6b是实施例4中所制备的免泵sers微流控芯片两个检测点测得的sers光谱图;
77.图7a是实施例4中所制备的免泵sers微流控芯片检测过程中收集室的显微镜照片;
78.图7b是实施例4中所制备的免泵sers微流控芯片检测过程中收集室测得的sers信号在1330cm-1
特征峰处强度随时间变化的直方图;
79.图8是实施例5中使用样品溶液后,收集室测得的sers信号在1330cm-1
和1593cm-1
处对应的sers强度折线图:(ⅰ)10am kras g12v 10pm braf v600e;(ⅱ)100am kras g12v
10pm braf v600e;(ⅲ)1fm kras g12v 10pm braf v600e;(ⅳ)10fm kras g12v 10pm braf v600e;(
ⅴ
)100fm kras g12v 10pm braf v600e;(ⅵ)1pm kras g12v 10pm braf v600e;
80.图9a和9b是实施例6中braf v600e和kras g12v的cha反应琼脂糖凝胶电泳照片;
81.图10a是实施例7中braf v600e和kras g12v存在的情况下,收集室测得的sers 光谱图;
82.图10b是实施例7中braf v600e存在,kras g12v不存在的情况下,收集室测得的 sers光谱图;
83.图10c是实施例7中braf v600e不存在,kras g12v存在的情况下,收集室测得的 sers光谱图;
84.图10d是实施例7中braf v600e和kras g12v不存在的情况下,收集室测得的sers 光谱图;
85.图11a是实施例8中添加靶ctdnas后的孵育时间的优化;
86.图11b是实施例8中braf v600e的sers探针体积的优化;
87.图11c是实施例8中kras g12v的sers探针体积的优化;
88.图11d是实施例8中发夹dna结构hp2-1浓度的优化;
89.图11e是实施例8中发夹dna结构hp
2-2
浓度的优化;
90.图11f是实施例8中反应缓冲剂种类的优化;
91.图12a是实施例9中所制备的免泵sers微流控芯片检测目标braf v600e和kras g12v、两种单碱基错配ctdna、两种三碱基错配ctdna、随机错配ctdna以及空白对照的 sers光谱图;
92.图12b和图12c是实施例9中所制备的免泵sers微流控芯片检测目标braf v600e 和kras g12v、两种单碱基错配ctdna、两种三碱基错配ctdna、随机错配ctdna以及空白对照在1330cm-1
和1593cm-1
特征峰处强度直方图;
93.图12d是实施例9中不同批次制备的免泵sers微流控芯片检测目标braf v600e和k ras g12v的sers光谱图;
94.图12e是实施例9中制备的免泵sers微流控芯片检测目标braf v600e和kras g1 2v时收集室不同位置测得的sers光谱图;
95.图12f是实施例9中制备的免泵sers微流控芯片检测目标braf v600e和kras g1 2v时收集室不同位置在1330cm-1
和1593cm-1
特征峰处强度直方图;
96.图13a是实施例10中不同分组荷瘤裸鼠不同时期的成瘤照片和20天后成瘤部位苏木精伊红染色病理切片照片;
97.图13b是实施例10中不同分组荷瘤裸鼠20天后解剖获取瘤子的照片;
98.图13c-g是实施例10中不同分组荷瘤裸鼠不同时期体重变化的折线图;
99.图13h-l是实施例10中不同分组荷瘤裸鼠不同时期体表测得肿瘤长轴和短轴大小变化的直方图;
100.图14a是实施例11中制备的免泵sers微流控芯片用于检测分散在pbs缓冲液中不同浓度braf v600e和kras g12v,收集室测得的sers光谱图;
101.图14b是实施例11中制备的免泵sers微流控芯片用于检测分散在pbs缓冲液中不
同浓度braf v600e和kras g12v,收集室测得的sers信号在1330cm-1
和1593cm-1
处特征峰处强度和浓度的对数的线性拟合图;
102.图14c是实施例11中制备的免泵sers微流控芯片用于检测分散在小鼠血清中不同浓度 braf v600e和kras g12v,收集室测得的sers光谱图;
103.图14d是实施例11中制备的免泵sers微流控芯片用于检测分散在小鼠血清中不同浓度 braf v600e和kras g12v,收集室测得的sers信号在1330cm-1
和1593cm-1
处特征峰处强度和浓度的对数的线性拟合图;
104.图15a是实施例12中制备的免泵sers微流控芯片用于检测不同时期小鼠血清中braf v600e和kras g12v,收集室测得的平均sers光谱图;
105.图15b是实施例12中制备的免泵sers微流控芯片用于检测不同时期小鼠血清中brafv600e和kras g12v,收集室测得的sers信号在1330cm-1
和1593cm-1
处特征峰处平均强度直方图。
具体实施方式
106.为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
107.需要说明的是,除非另外定义,本发明实施例使用的技术术语或者科学术语应当为本公开所属领域内具有一般技能的人士所理解的通常意义。
108.本发明所用的仪器设备以及测试条件如下:
109.扫描电子显微镜(tem)照片是由日本日立公司生产的s-4800ii型场发射扫描电子显微镜测得。
110.透射电子显微镜(sem)照片是由荷兰飞利浦公司生产的tecnai 10型投射电子显微镜测得。
111.拉曼光谱是由英国雷尼绍公司生产的invia reflex型激光显微拉曼光谱仪测得。测试条件为激光波长785nm,曝光时间为10s,激光强度为50mw,50
×
物镜。
112.sers成像是由美国赛默飞公司生产的dxrxi显微拉曼成像光谱仪测得。
113.实施例1
114.一种金钯纳米棒的合成及表征
115.1)在9.75ml 0.1mol/l的ctab中加入250l的10mmol/l haucl4,搅拌10min,然后快速注入0.6ml新鲜冰浴配制的10mmol/l的nabh4,剧烈搅拌2min随后种子溶液在28℃静置保存30min。将7.2g的ctab和0.987g的naol溶解于400ml去离子水中,然后在磁力搅拌下向溶液中注入20ml 10mmol/l的haucl4溶液。当溶液变为无色时加入8ml 10 mmol/l agno3,继续搅拌5min,然后注入1.2ml盐酸以调节混合物的ph。接下来,添加 640l 0.1mol/l aa,约30s后,在搅拌下注入上述制备的1ml种子溶液。体系在30℃下静置12h后反应完成,反应溶液以9000r/min的速率离心15min,清洗两次。最终得到的金纳米棒分散在10ml去离子水中。取180l金纳米棒加入到1ml 0.1mol/l ctab水溶液中,超声1h,离心1次后,沉淀加入0.1mol/l ctab至300l。取50l的上述种子,加入到1ml 的20mmol/l ctab溶液中,静置10min后,加入5~50l 2mmol/l的cucl2水溶液,25l 10 mmol/l的h2pdcl4。静置5min后,加入12.5l的0.1mol/l aa,摇晃均匀后,置于30℃下反应12h。最后将金钯纳米棒分别用乙醇和超纯水离
心后分散在超纯水中,将金钯纳米棒溶液存放在4℃冰箱中待用,用于后续sers探针的制备。
116.2)金钯纳米棒的形貌及sers效应的表征。
117.通过sem、tem、高分辨tem、saed成像图检测金钯纳米棒的形貌和结构。
118.参见图2a以及图2b,分别是合成的金钯纳米棒的sem照片和tem照片。sem图像清楚地表明,金钯纳米棒具有很好的分散性和均一的形貌。tem图像显示,金钯纳米棒的平均长度为70nm,平均宽度为30nm。在图2c中,金纳米棒晶面间的平面距离为0.19nm,对应的是pd的{100}平面。图2d为金钯纳米棒的sead图像,它表明pd-aunrs在{111},{200}, {220}和{311}等方向上随机生长。利用图2(e-h)所示的haadf-stem和元素能谱成像验证了金钯纳米棒的核-壳纳米结构。可以清楚地看到,中间致密的部分为金纳米棒,而稀疏的pd 壳层分布在外侧,厚度约为6nm。图2i的元素光谱进一步证实了金钯纳米棒的元素组成, cu元素的出现是由于使用铜网负载金钯纳米棒。金钯纳米棒中au的含量达到33.52%(wt%), pd仅占18.89%,由此可见au元素占多数,pd元素形成的壳层相对较薄。uv-vis-nir光谱如图2j所示,在748nm和519nm处有两个明显的吸收峰。图2h中,在波长785nm,激光强度5mw条件下,4-mba或dtnb标记的金钯纳米棒产生了很强的拉曼信号。从图中可以清楚地看到,在信号分子耦合到金钯纳米棒表面上后,拉曼信号被显著放大。以上结果表明金钯纳米棒可以作为理想的纳米结构用于sers分析。
119.实施例2
120.金钯纳米棒的电磁场模拟
121.为进一步探究金钯纳米棒的sers增强效应,使用fdtd法对金钯纳米棒的电磁场分布进行模拟。首先根据图3a中的tem图,构建了金钯纳米棒的结构模型。tem图像显示金钯纳米棒平均长度为70nm,平均宽度为30nm。图3b和3c所示,在785nm的激发波长下,单个金钯纳米棒表面的热点主要分布在表面所包含的尖端和边缘,而多聚体金钯纳米棒的热点主要集中在纳米粒子之间的间隙处。表明金钯纳米棒组装可引发电磁场强度的显著增强,纳米粒子彼此间的lspr会形成间隙,等离子体使得热点区域的电磁场高度局域化,远远强于单个纳米粒子带来的电磁场增强效果。
122.实施例3
123.磁珠的形貌表征
124.通过tem和sem表征了磁珠的尺寸和形状。磁珠溶液如图4d所示。如图4a和图4b 所示,合成的磁珠颗粒呈良好的球形,分散性较好。由于存在大量的羧基,其粗糙的表面可以被发夹dna二(hp
2-1
和hp
2-2
)修饰。图4c为磁珠的tem图像,显示其形貌良好,平均粒径约为250nm。
125.实施例4
126.免泵sers微流控芯片的性能评估
127.采用peg涂层对微流控通道进行亲水性处理后,为了评价亲水性处理对微流控芯片的运行效果和通道内的液体流速,在芯片中加入红色和蓝色墨水溶液,测试溶液在通道中自动流动时的密封性能和亲水性。如图5a所示,在三个加样口中加入50ml溶液后,墨水在表面张力的作用下流动。结果表明,墨水溶液可在60s内填满通道,亲水处理效果完好,可完全替代重型注射器泵。此外,在实验中没有发现泄漏,证明了其良好的密封性能。如图5b和
图5c所示,亲水性微流控芯片在室温下放置约两周后,亲水性基本不受影响,稳定性良好,在1330cm-1
特征峰处的强度偏差为7.31%。因此,亲水性处理可以实现液体在通道中通过毛细力的自动输送,且稳定性良好。由于免泵微流控芯片的材料也存在相应的拉曼信号,因此在进行sers痕量检测实验之前,有必要对微流控芯片上的反应过程进行验证。如图6a所示,在通道中选择两个点进行sers测量,分别代表复合结构形成之前和之后。区域(ⅰ)和区域(ⅱ) 分别表示捕获探针出口和用于存储和检测复合结构的检测室。图6a中的插图为两个检测区域的显微图像,对应的sers光谱。如图6b所示,从sers光谱中可以发现,只能在(ⅱ)区域检测能检测到较强的sers信号,这说明只有当sers探针连接到捕获探针时才能检测到信号。此外,(ⅱ)中检测到的芯片材料产生的拉曼背景与复合结构信号相比相当弱。因此,免泵微流控芯片材料对靶ctdna的sers检测没有影响,磁珠信号非常微弱,可以忽略不计。微流控芯片对复合结构的采集能力直接影响实验结果。因此,通过检测室捕获复合材料结构随时间变化的显微图片,测试免泵微流控芯片的收集效果(图7a)。由于永磁体的强磁场,当复合结构覆盖检测室的底部时,时间是3min。图7b为在1330cm-1
特征峰处的峰值强度变化图,可以观察到当时间来到5min时,检测室的sers信号强度几乎不再变化,表明了整个反应基本完成。因此,所制备的免泵sers微流控芯片具有良好的采集能力,最佳检测时间为5min。
128.实施例5
129.两种目标ctdnas之间的交叉反应性评价
130.为了评估两个目标ctdnas之间的交叉反应性,将10pm braf v600e与浓度范围为10 am至1pm的kras g12v混合。检测室检测到相应ctdna的sers强度如图8所示。结果表明,无论kras g12v浓度如何,10pm braf v600e的强度具有一致性。而kras g12v 的信号强度随着浓度的增加呈明显的线性变化。因此,不存在交叉反应,证实了同时检测 braf v600e和kras g12v的可行性。
131.实施例6
132.cha反应的可行性评估
133.为了评估cha反应的可行性,琼脂糖凝胶电泳结果如图9所示,可以发现泳道5中(图 9)几乎是泳道2泳道3中hp
1-1
和hp
2-1
的一个简单叠加,表明在没有目标ctdna存在的情况下,hp
1-1
和hp
2-1
之间不会发生杂交反应。在泳道6中,将braf v600e与hp
1-1
孵育,出现了一个分子量更大的新条带,表明发生了杂交反应。当hp
1-1
与hp
1-1
靶ctdna孵育时, hp
1-1-hp
2-1
复合物出现较强的条带,靶ctdna被释放,证明cha反应进展顺利。这些结果表明了发夹dna靶驱动杂交的成功设计,并证明了cha辅助无泵浦sers微流控芯片的可行性。同理,验证了hp
2-1
与hp
2-2
之间的cha反应(图8b)。
134.实施例7
135.两种目标mirnas的定性分析
136.基于免泵sers微流控芯片对pbs缓冲液中的braf v600e和kras g12v进行定性分析。验证所提出的无泵浦sers微流控芯片用于braf v600e和kras g12v快速检测的可行性。如图9a所示,当待测样品中同时存在braf v600e和kras g12v时,sers光谱中可以清晰地观察到1330cm-1
(dtnb)和1593cm-1
(4-mba)的特征峰。相比之下,当仅存在 braf v600e(或kras g12v)时,sers光谱在1330cm-1
(或1593cm-1
)处仅出现一个特征峰 (图9b、图9c)。
137.在没有braf v600e和kras g12v的情况下,sers光谱中没有观察到明显的特征峰(图 9d),说明收集室中没有捕捉到复合结构。实验结果表明,所提出的免泵sers微流控芯片能够有效识别braf v600e和kras g12v。
138.免泵sers微流控芯片的优化制备
139.为了使免泵sers微流控芯片达到最佳的分析性能,我们进一步优化了实验条件,包括反应时间,两种sers探针的用量、两种发夹dna的浓度、以及反应缓冲液的种类。随着时间的增加,1330cm-1
和1593cm-1
特征峰处的sers强度逐渐增大(图10a),5min后变化不明显,说明反应基本完成。因此,5min为后续实验的最佳时间。由于cha反应在本文提出的免泵sers微流控芯片的信号放大中起着至关重要的作用,因此很有必要对反应条件进行优化,以在很大程度上保证放大反应的充分进行。在图10b,我们优化braf v600e探针的体积,sers信号出现先增加后又逐渐降低的现象,在3l时出现最大值。这一结果归因于标记体积的增加增强了目标响应信号以及背景信号,当braf v600e探针用量低于3l时,目标响应信号逐渐增强,而进一步增加braf v600e探针体积超过3l时,背景信号贡献较多。因此,本发明中选用3l的braf v600e探针进行后续实验。同样,kras g12v的最佳 sers探针的量为4l(图10c)。图10d为hp
2-1
浓度优化结果,可以发现当浓度低于3fm 时信号强度逐渐增强,当浓度超过3fm时信号强度呈下降趋势。因此,我们选择3fm作为hp
2-1
的实验浓度,同样地将hp
2-2
的浓度优化为4fm(图10e)。为了提高微流控芯片的检测灵敏度,我们测试了tris-acetate、pbs、hepes等几种缓冲溶液对杂交反应的效率地影响,从而确定最佳的缓冲溶液类型。结果表明,在pbs中效率最高(图10f)。因此,选择pbs 作为实验缓冲溶液。
140.实施例8
141.免泵sers微流控芯片的特异性、重复性及均一性
142.1)同实施例7制备免泵sers微流控芯片;
143.2)为了保证芯片能够准确检测目标ctdna,我们引入了两个类似物作为干扰项,包括两个单碱基错配序列(mt1)和两个三碱基错配序列(mt-3)来研究其特异性。图11a为不同测试对象的sers光谱,图11b和图11c为1330cm-1
和1593cm-1
对应的峰值强度。结果表明,braf v600e和kras g12v的信号强度比干扰项和空白对照的信号强度更显著,表明即使序列稍差,其信号强度也可能相差很大。因此,该微流控芯片对目标ctdna具有良好的特异性。图11d为使用5个不同批次制备的免泵sers微流控芯片检测目标ctdna的sers 光谱。结果表明,并无明显差异,rsd为6.82%。由于均匀性是影响信号检测的另一个重要因素,我们在收集室中随机选取5个点。图11e记录了这5个点的sers光谱,可以看出,只有特征峰和光谱形状存在少许差异。在1330cm-1
和1593cm-1
特征峰处sers信号强度的 rsd分别为7.35%和9.11%(图11f)。综上所述,该免泵sers微流控芯片具有良好的特异性、重复性及均一性,为braf v600e和kras g12v的准确检测奠定了坚实的基础。
144.表1
145.namesequence(5'-3')hp
1-1
hs-tagctacagagaaatccgacatctaactagcttatcagacthp
1-2
hs-gttggagctgttggcgtagcgacatctaactagcttatcagacthp
2-1
acatcgatgttagatgtcgtagcttatcagactcgacatctaachp
2-2
cgaggttggttagatgtcgtagcttatcagactcgacatctaac
mt1-1gatttctgtgtagctamt1-2ctacgccatcagctccaacmt3-1gatctctcagtacctamt3-2ctaggccatcagctgcaacrandomacggccttacgtacgaacbraf v600egatttctctgtagctakras g12vctacgccaacagctccaac
146.实施例9
147.荷瘤裸鼠模型的构建
148.为了进一步研究nsclc发生发展过程中ctdna表达水平的变化,评价本发明提出的免泵sers微流控芯片对靶ctdna的实时监测能力,我们建立了非小细胞肺癌荷瘤裸鼠模型,并将其分为5组进行比较。裸鼠皮下注射细胞后,5组小鼠在第5天均可见异种移植物,肿瘤形成率为100%(图12a(a-e))。如图12(c-g)所示,裸鼠第20天增重分别为1.0g、0.8 g、1.0g、0.9g和0.9g。图12a(f-t)记录荷瘤裸鼠第10、15、20天的数码照片。图12b为异种移植物的最终大小,没有观察到显著差异。图12(h-l)为不同时期测量的小鼠皮下肿瘤的长径和短径,表明肿瘤在nsclc的病程不断深入。取出异种移植物后,处死5只荷瘤小鼠,制作病理切片。图12a(u-y)为苏木精伊红染色的肿瘤细胞。清晰显示肿瘤细胞密集成团生长,排列紧密,有丝分裂期多,大小不一,形状各异:球形、多边形、不规则。肿瘤细胞胞浆少,细胞核大,呈深蓝色,异型性明显。结果证明成功构建了荷瘤裸鼠模型,小鼠血清可用于后续实验。
149.实施例10
150.免泵sers微流控芯片检测样本中braf v600e和kras g12v
151.1)同实施例7制备免泵sers微流控芯片;
152.2)将braf v600e和kras g12v分散到pbs缓冲液或小鼠血清中,配置得到浓度10 am、100am、1fm、10fm、100fm、1pm、10pm和100pm的braf v600e和kras g12v 的混合溶液。将不同浓度的braf v600e和kras g12v样品溶液加入免泵sers微流控芯片5min后进行sers测试,检测得到4-mba和dtnb的信号。利用手持拉曼检测收集室中复合物的拉曼信号,得出braf v600e和kras g12v不同浓度时4-mba和dtnb在1594 cm-1
和1337cm-1
处的拉曼信号强度的变化,每组实验至少重复3次,拟合出braf v600e和 kras g12v的定量线性图。
153.图13显示随着目标物浓度的增加,收集室中检测得到的sers信号不断增强。图13a是 sers传感器检测pbs缓冲液中不同浓度的braf v600e和kras g12v的sers光谱。整体特征峰强度随着braf v600e和kras g12v浓度的增加而逐渐增大。对横坐标进行对数处理,可以看出:目标物浓度在10am~100pm范围内时,收集室中检测的sers信号在1330 cm-1
and 1593cm-1
特征峰处的强度与目标物浓度的对数之间分别存在良好的线性关系。图13b 中,braf v600e的线性回归方程为y=1742.78x 322.53,其中y代表收集室中检测的sers 强度,x为目标物的浓度对数,r2=0.9901,检测限为3.116am。图13b中,kras g12v的线性回归方程为y=1531.79x 522.87,r2=0.9921,检测限为3.921am。免泵sers微流控芯片被用来进一步检测小鼠血清中不同浓度的braf v600e和kras g12v。图13c显示整体特征峰强度随着braf v600e和kras g12v浓度的增加而逐渐增大。目标物浓度在10 am~100pm范围内时,收集室中检测的sers信号在1330cm-1
and 1593cm-1
处的sers信号强度与目标物浓度的对数
之间分别存在良好的线性关系。图13d中,braf v600e的线性回归方程为y=1594.76x 133.26,r2=0.9861,检测限为4.257am。图13d中,kras g12v的线性回归方程为y=1367.32x 258.55,r2=0.9914,检测限为6.183am。因此,我们提出的免泵 sers微流控芯片能够在am水平上同时检测到两种肺癌生物标志物,具有很高的灵敏度,完全满足临床诊断的实际需要。图14a和图14b显示小鼠血清中braf v600e和kras g12v 的表达量,随着肿瘤的发展不断升高。sers和qrt-pcr检测结果一致。表明该免泵sers 微流控芯片在临床样品的核酸检测中具有良好的应用前景。
154.所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。
155.本发明的实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。