1.本发明属于生物技术和植物学领域,更具体地,本发明涉及影响植物的抗热性的基因及其应用。
背景技术:
2.在真核生物中,非编码rna和mirna能参与多种多样的生命过程,并且能够被广泛应用于实际。有研究表明天然反义转录本(nats)在调节植物的基因表达中也具有关键作用。然而,目前尚不清楚天然反义转录本与mirna之间的调控关系。
3.mirna是一类约22个核苷酸长度的非编码rna,首次在线虫中发现,后来在多种动植物体内发现了它的踪迹。它通过序列互补与相应基因配对,主要通过对靶基因进行翻译抑制或者mrna剪切来实现对靶标基因的调控。在植物中,mirna基因往往位于编码基因之间,但仍有一些来自于内含子,外显子,转座子,甚至trna。mirna在rna聚合酶ii的作用下转录形成具有帽子和polya结构的pri-mirna,pri-mirna具有一个发夹结构,在dicer-like1(dcl1),双链rna结合蛋白hyponastic leaves1(hyl1),c2h2锌指蛋白serrate(se),细胞核cap binding complex(cbc)等蛋白形成的剪切复合体的作用下,在细胞核d-bodies内被剪切形成pre-mirna并进一步被剪切形成mirna/mirna*。随后在甲基转移酶hua enhancer1(hen1)的作用下对其3’端核苷酸进行甲基化,从而阻碍它们的尿苷化和随后的降解,甲基化的mirna/mirna*随后在hasty(hst)和其他未知因子的作用下从细胞核运输到细胞质中。多数成熟的mirna会进入argonaute(ago)复合体并通过碱基互补配对与它的靶标基因结合,从而通过剪切和翻译抑制等作用调控靶标基因的表达。
4.拟南芥编码四个dcl蛋白,分别是dcl1,dcl2,dcl3和dcl4。其中植物mirna前体的剪切主要是由dcl1蛋白完成的;dcl2参与形成天然反义srnas的形成,如在盐胁迫下参与形成来自于正义反义转录本互补配对区的24-nt sirnas;dcl3形成介导异染色质形成的24-nt异染色质sirnas;dcl4形成21-nt trans-acting sirnas。除此之外,dcl2,dcl3和dcl4还形成病毒诱导的srnas,从而参与植物抗病毒过程。
5.dcl1与动物中dicer蛋白互为同源蛋白,蛋白分子量约为220kda,包括一个rna螺旋结构域,一个paz结构域,两个rnase iii结构域和两个dsrna结合结构域。有研究表明,在弱的dcl1-9插入突变体中,pri-mirna增加而pre-mirna降低,表明dcl1在pri-mirna剪切形成pre-mirna过程中的重要性。除了dcl1,hyl1和se也在mirna的形成过程中扮演着十分重要的作用。hyl1是一个双链rna结合蛋白,包括两个双链rna结合结构域,一个核定位信号和一个蛋白质—蛋白质相互作用结构域,se是一个c2h2锌指蛋白,它们均是dcl1的分子伴侣蛋白,在形成mirna的过程中具有重要作用。在hyl1和se突变体中,成熟的mirna的量降低,pri-mirna积累。实验表明,se和hyl1与dcl1共定位在d-bodies中,且dcl1与hyl1相互作用,hyl1和se之间也具有相互作用。hyl1和se增加dcl1对pri-mirna剪切的有效性和精确度。
技术实现要素:
6.本发明的目的在于提供影响植物的抗热性的基因及其应用。
7.在本发明的第一方面,提供一种调控植物抗热性(耐热性)的方法,包括:调节(以人工方式调节)mir398或其反义基因,或调节mir398与其反义基因的相互(调控)作用,调节mir398的水平,从而调节植物抗热性。
8.在一个优选例中,所述方法包括:
9.提高mir398水平,从而提高植物的抗热性;
10.降低mir398水平,从而降低植物的抗热性;
11.降低mir398的反义基因(nat398)的水平,从而提高植物的抗热性;或
12.提高mir398的反义基因(nat398)的水平,从而降低植物的抗热性。
13.在另一优选例中,所述的mir398通过靶向于csd基因发挥调节植物抗热性的作用。
14.在另一优选例中,所述的csd基因包括但不限于csd1、csd2。
15.在另一优选例中,所述的降低mir398水平包括:上调mir398基因,或上调mir398的反义基因(nat398),或过表达nat-sir398。
16.在另一优选例中,所述的提高mir398水平包括:下调mir398基因表达,下调mir398的反义基因(nat398)。
17.在另一优选例中,所述mir398与其反义基因的相互作用包括:mir398激活其反义基因;较佳地,mir398通过转录激活作用增强其反义基因的表达。
18.在另一优选例中,nat398基因分别通过转录后干扰抑制pri-mir398的表达量,从而降低mir398的合成,引起mir398靶标基因的上调。
19.在另一优选例中,所述调节mir398的水平进一步调节h2o2积累,进而影响热激作用;较佳地,上调mir398水平增加h2o2积累;或上调mir398的反义基因(nat398)较少h2o2积累。
20.在另一优选例中,所述的上调包括:促进、过表达、提高、增强等,其是统计学意义的或显著性的上调、促进、提高或增强,如上调、促进、提高或增强20%、40%、60%、80%、90%或更高。
21.在另一优选例中,所述的下调包括:弱化、减弱、降低、抑制;表示显著性的下调、减弱、降低、抑制,如下调、减弱、降低、抑制或下调20%、40%、60%、80%、90%或更低。
22.在另一优选例中,降低靶基因水平包括:在植物中敲除或沉默靶基因(或其前体),抑制靶基因(或其前体)的活性;较佳地,包括:以特异性干扰靶基因(或其前体)的干扰分子来沉默靶基因(或其前体),以crispr系统进行基因编辑从而敲除靶基因(或其前体),以同源重组的方法敲除靶基因(或其前体),或在含有靶基因(或其前体)的植物中将靶基因(或其前体)进行功能丧失性突变。所述的靶基因可以是前述mir398、mir398、mir398的反义基因。
23.在另一优选例中,提高靶基因水平包括:在植物中过表达靶基因,例如构建过表达载体并使之表达。所述的靶基因可以是前述mir398、mir398、mir398的反义基因。
24.在另一优选例中,所述的沉默靶基因(或其前体)包括:利用基于target mimicry技术的mir398沉默体下调靶基因(或其前体)的表达。
25.在本发明的另一方面,提供mir398或其反义基因的应用,用于调节植物抗热性;较
佳地,其通过调节mir398的水平进而调节植物抗热性。
26.在一个优选例中,所述调节包括:
27.提高mir398水平,从而提高植物的抗热性;
28.降低mir398水平,从而降低植物的抗热性;
29.降低mir398的反义基因(nat398)的水平,从而提高植物的抗热性;或
30.提高mir398的反义基因(nat398)的水平,从而降低植物的抗热性。
31.在另一优选例中,所述的降低mir398水平包括:上调mir398基因,或上调mir398的反义基因(nat398),或过表达nat-sir398。
32.在另一优选例中,所述的提高mir398水平包括:下调mir398基因表达,下调mir398的反义基因(nat398)。
33.在另一优选例中,所述的植物包括:表达mir398、mir398、mir398的反义基因或其同源物的植物;较佳地,所述的植物包括(但不限于):十字花科植物,禾本科植物,豆科植物。
34.在本发明的另一方面,提供一种分离的植物细胞或器官(非植物,不具有繁殖为植物的能力),其由本发明所述的方法制备获得。
35.本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
36.图1、白菜和拟南芥中mir398基因及其反义基因的位置模式图。(a)白菜中brpmir398基因及其反义基因的位置模式图。(b)拟南芥中atmir398基因及其反义基因的位置模式图。侧翼基因,mirna基因和外显子分别用黑色、白色和红色矩形表示;实线表示内含子和基因间区域;箭头表示转录方向。
37.图2、拟南芥中pri-mir398b/c及其顺式天然反义转录本之间的互补配对区。(a)pri-mir398b与atnat398b之间的互补配对区。(b)pri-mir398c与atnat398c之间的互补配对区。黄色代表mir398*,红色代表成熟的mir398,下划线代表互补配对区。
38.图3、拟南芥中atmir398基因的表达量及其atmir398a的表达模式。(a)拟南芥col-0中atmir398a,atmir398b和atmir398c基因的表达量,actin为内参基因,atmir398a表达量为1。(b)atmir398a的表达模式。(c)northern blotting显示出crmir398植株(crispr/cas9获得)中mir398的积累量。(d)crmir398中atcsd1的表达量。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01,***p《0.001)。
39.图4、拟南芥中atmir398b/c和atnat398b/c基因的表达模式。(a)拟南芥中atmir398b和atnat398b基因的表达模式。(b)拟南芥中atmir398c和atnat398c基因的表达模式。(c)拟南芥中p35s::nat398b-gfp的表达模式。(d)拟南芥中p35s::nat398c-gfp的表达模式。
40.图5、过表达atmir398b/c基因减少了mir398的表达。(a)northern blotting显示出p35s::mir398b植株中mir398的积累量。(b)qrt-pcr显示出p35s::mir398b植株中相关基因的表达水平。(c)northern blotting显示出p35s::mir398c植株中mir398的积累量。(d)qrt-pcr显示出p35s::mir398c植株中相关基因的表达水平。(e)northern blotting显示出
p35s::mir398a植株中mir398的积累量。(f)qrt-pcr显示出p35s::mir398a植株中atmir398a和atcsd1基因的表达水平。(g)qrt-pcr显示出烟草叶片中瞬时表达atmir398基因时mir398的积累量。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01,***p《0.001)。
41.图6、atnat398b和atnat398c抑制mir398的合成。(a)qrt-pcr显示出p35s::amir-nat398b植株中atnat398b,atmir398b和atcsd1基因的表达水平。(b)qrt-pcr显示出p35s::amir-nat398c植株中atnat398c,atmir398c和atcsd1基因的表达水平。(c)nat398b-d突变体中t-dna的插入位点。(d)qrt-pcr显示出nat398b-d突变体中相关基因的表达水平。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01,***p《0.001)。
42.图7、过表达atnat398b和atnat398c抑制mir398的合成。(a)northern blotting显示出p35s::nat398b植株中mir398的积累量。(b)qrt-pcr显示出p35s::nat398b植株中相关基因的表达水平。(c)northern blotting显示出p35s::nat398c植株中mir398的积累量。(d)qrt-pcr显示出p35s::nat398c植株中相关基因的表达水平。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01,***p《0.001)。
43.图8、atnat398b和atnat398c不能激活它们正义基因的转录。chip实验检测过表达atnat398b和atnat398c植株中rna聚合酶ii的结合量。引物1,2,3,4和1/act7位于相应基因位置。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01,***p《0.001)。
44.图9、atnat398b/c和pri-mir398b/c之间形成双链rna。引物c1,c2和c3位于正反义转录本互补配对区,引物i1位于正反义转录本非互补配对区。actin作为阴对照。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01,***p《0.001)。
45.图10、atnat398b/c影响pri-mir398b/c的稳定性。(a)烟草中瞬时表达atnat398b/c与atmir398b/c时atmir398b/c的表达量。(b)拟南芥中稳定表达atnat398b/c与atmir398b/c时atmir398b/c的表达量。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01,***p《0.001)。
46.图11、atnat398b/c影响pri-mir398b/c的降解速率。(a)过表达atnat398b和野生型植株在actd处理后pri-mir398b和atgapdh的表达量。(b)过表达atnat398c和野生型植株在actd处理后pri-mir398c和atgapdh的表达量。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05)。
47.图12、atnat398b增加了pri-mir398b的5’单链区不正确剪切位点的产生。蓝色碱基代表mir398*,红色碱基代表成熟的mir398,小箭头代表检测到的剪切位点。
48.图13、过表达nat-sir398降低pri-mir398b和pri-mir398c的表达水平。(a)qrt-pcr检测p35s::mir398b/c和p35s::nat398b/c中nat-sir398b-1的积累量。(b)qrt-pcr检测p35s::mir398b/c和p35s::nat398b/c植株中nat-sir398b-2的积累量。(c)p35s::nat-sir398b-1植株中atmir398b和atmir398c的表达量。(d)在多种srna形成突变体内nat-sir398b-1的表达量。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01,***p《0.001)。
49.图14、atmir398b和atmir398c激活它们的反义基因。(a)p35s::nat-sir398b-1植株中atnat398b和atnat398c的积累量。(b)mir398c突变体中t-dna的插入位点。(c)
northern blotting显示出mir398c突变体中mir398的积累量。(d)qrt-pcr检测mir398c突变体中相关基因的表达量。(e)qrt-pcr检测p35s::mir398b植株中相关基因的表达量。(f)qrt-pcr检测p35s::mir398c植株中相关基因的表达量。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01,***p《0.001)。
50.图15、atmir398b和atmir398c激活它们反义基因的转录。chip实验检测p35s::mir398b和p35s::mir398c植株中rna聚合酶ii结合在atnat398b和atnat398c转录起始位置上的积累量。引物1,2,3,4,5,6和1/act7位于相应基因位置。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01)。
51.图16、p35s::amir398b/c幼苗中相关基因的表达。p35s::amir398b/c幼苗中atcsd1,atcsd2,atnat398b和atnat398c基因的表达量。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(***p《0.001)。
52.图17、atnat398b和atnat398c受热抑制。(a)northern blotting显示出野生型热激后mir398的积累量。(b)qrt-pcr显示出野生型植株热激后atmir398b/c和atnat398b/c基因的表达水平。(c)野生型和p35s::nat398b植株热激前后atcsd1的表达量。(d)野生型和p35s::nat398b植株热激前后mir398的表达量。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05,**p《0.01,***p《0.001)。
53.图18、转基因和突变体植株中dab染色。土壤内生长了19天的拟南芥植株转移到38℃和22℃的光照培养箱处理1小时,然后取莲座叶片在dab染色液中染色。室温避光摇晃19个小时后用70%的乙醇漂洗多遍,直至叶片叶绿素完全褪去。标尺为1cm。
54.图19、crnat398b中的突变位点和植株中相关基因的表达量。(a)crnat398b中的突变位点。(b)northern blotting显示出crnat398b植株中mir398的积累量。(c)crnat398b中atmir398b和atcsd1的表达量。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05)。
55.图20、转基因植株的抗热性。(a)cds1突变体中t-dna的插入位点和atcsd1的表达量。(b)qrt-pcr检测p35s::csd1植株中atcsd1的表达量。(c)野生型,p35s::mir398a,p35s::mir398b,p35s::mir398c和p35s::csd1在热处理后花的存活率。(d)野生型,p35s::mir398a,p35s::mir398b,p35s::mir398c和p35s::csd1离体叶片热处理后表型。(e)野生型,p35s::mir398a,p35s::mir398b,p35s::mir398c和p35s::csd1离体叶片热处理后的绿叶比率。误差线为
±
sd,n=15-30。实验至少重复了三遍,图中为代表性的一次实验结果。显著性水平用t检验获得(*p《0.05)。标尺为1cm。
56.图21、转基因和突变体植株的抗热性。(a)野生型,csd1,p35s::amir-nat398b,p35s::amir-nat398c,p35s::nat398b,p35s::nat398c和crnat398b在热处理后花的存活率。(b)野生型,csd1,p35s::amir-nat398b,p35s::amir-nat398c,p35s::nat398b,p35s::nat398c和crnat398b离体叶片热处理后的表型。(c)野生型,csd1,p35s::amir-nat398b,p35s::amir-nat398c,p35s::nat398b,p35s::nat398c和crnat398b离体叶片热处理后的绿叶比率。误差线为
±
sd(n=15-30)。实验至少重复了三遍,图中为代表性的一次实验结果。显著性水平用t检验获得(*p《0.05)。标尺为1cm。
57.图22、paa6::brpnat398b-2植株的mir398积累量。(a)paa6::brpnat398b-2植株中mir398的积累量。(b)paa6::brpnat398b-2植株中brpnat398b-2基因的表达水平。(c)
paa6::brpnat398b-2植株中brpcsd1和brpcsd2基因的表达水平。误差线为
±
sem。三次生物学重复。显著性水平用t检验获得(*p《0.05)。
58.图23、mirna基因和反义基因组成调控环路的模型示意图。
具体实施方式
59.在植物中,mirna和顺式天然反义转录本调控基因的表达,在植物的生长发育与逆境胁迫过程中起着重要的作用。mirna与其反义基因之间的分子调控方式在本领域中还没有被揭。本发明人通过深入研究发现,mir398与其反义基因nat398相互调控,即nat398基因通过转录后干扰抑制pri-mir398的表达量,从而降低mir398的合成,引起mir398靶标基因的上调,而mir398也通过转录激活作用增强相应反义基因的表达。这些发现不仅增加了高等植物基因表达调控的层次,也为改良遗传操作手段从而提高植物抗逆性提供了理论基础。
60.mirna反义基因的存在影响了mirna的生物合成,改变了植物的抗热性
61.本发明人通过对白菜和拟南芥全基因组和转录组测序数据以及相关数据库的分析,发现一系列mirna基因具有顺式天然反义转录本(其中白菜中有22个,拟南芥中有25个),包括白菜中的brpmir398b-1和brpmir398b-2以及拟南芥中的atmir398b和atmir398c。表达模式分析显示atmir398b和atmir398c在维管组织中分别与反义基因atnat398b和atnat398c共表达。野生型中,atmir398a的表达量比atmir398b和atmir398c低。过表达atmir398a增加mir398的表达,引起mir398靶标基因atcsd1的下调;而过表达atmir398b和atmir398c却降低了mir398的表达,引起atcsd1的上调。
62.为了解atmir398反义基因的作用,本发明人培育了增加和降低atnat398表达量的转基因植株。结果表明过表达atnat398b和atnat398c基因分别影响pri-mir398b和pri-mir398c的稳定性,降低了pri-mir398b和pri-mir398c的表达量,导致mir398的水平下调,引起atcsd1的上调;而降低atnat398b和atnat398c基因的表达,分别增加pri-mir398b和pri-mir398c的稳定性,增加了pri-mir398b和pri-mir398c的表达量,导致mir398的水平增加,引起atcsd1的下调,证明atnat398b/c调控mir398的生物合成。利用crispr/cas9方式获得的crnat398b植株不影响pri-mir398b和atcsd1的表达,排除了atnat398b编码蛋白质调控mir398生物合成的可能性。
63.过表达atnat398b和atnat398c基因减弱了植株的抗热性,人工降低atnat398b和atnat398c基因的表达量则增强了植株的抗热性,crnat398b植株不影响植株的抗热性。这些结果表明,atmir398b/c反义转录本的存在是在削弱植物的抗热性,并且atnat398b/c调节mir398的生物合成与植物抗热性。
64.rna酶保护实验表明atnat398b和atnat398c转录本分别与pri-mir398b和pri-mir398c形成双链结构。烟草中瞬时转化和拟南芥中稳定转化实验检测发现,增加atnat398b或atnat398c的表达,叶片中pri-mir398b或pri-mir398c的表达量会显著降低。rna降解实验表明过表达atnat398b和atnat398c分别增加pri-mir398b和pri-mir398c的降解速率。race实验表明过表达atnat398b增加而降低atnat398b表达减少pri-mir398b的5’单链区断点数。通过srna深度测序本发明人发现一些21nt的nat-sirna。人工过表达nat-sir398-1有效抑制了pri-mir398b/c的表达量。突变体检测发现rdr6有利于nat-sir398b-1
的产生,而dcl2,dcl3和dcl4在nat-sir398b-1的产生过程中具有冗余作用。这些结果表明,atnat398b/c的存在干扰了pri-mir398的加工。
65.在白菜中过表达brpnat398b-2,mir398的表达量降低,而靶标基因brpcsd1和brpcsd2的表达量上升。白菜和拟南芥中相似的调控机制暗示出mirna和反义基因之间的调控作用可能普遍存在于十字花科物种中。
66.至此,本发明人认为mirna反义基因的存在影响了mirna的生物合成,改变了植物的抗热性。此结果丰富了mirna生物合成的理论,为解释植株抗热性的分子机制,在遗传上改良植物抗逆性提供了科学依据。
67.mirna天然反义转录本广泛存在
68.本发明人发现,结球白菜bre中至少有22个cis-nats对应于mirnas的前体,而拟南芥中至少有25个cis-nats对应于mirnas的前体。通过对78个物种的分析,本发明人发现在被子植物中,mir398及其顺式天然反义基因是保守的。在本发明人分析的十二个十字花科物种中,全部存在nat398,并且它们编码的蛋白也很保守,分别编码乙酰氨基葡萄糖转移酶,多核糖核苷酸核苷酸转移酶或高亲和能力的硝酸根转运蛋白2.7。虽然本发明人在白菜和拟南芥中检测到一系列mirna基因具有顺式天然反义转录本,然而因为很多顺式天然反义转录本被生物和非生物胁迫诱导表达,因此本发明人推测植物胁迫处理后可能会发现更多的mirna对应的顺式天然反义转录本。虽然本发明集中在顺式天然反义转录本,但是生物体内的反式天然反义转录本也具有调控作用,它们的存在会大大增加生物体内天然反义转录本的调控复杂度。
69.atmir398基因增强其反义基因的转录
70.本发明人研究的mir398在拟南芥和白菜基因组中分别有三个和四个拷贝(yu等,2012),并且分别有两个具有顺式天然反义转录本。拟南芥中,gus染色显示atmir398b和atmir398c分别与它们的反义基因atnat398b和atnat398c共表达在植物幼苗维管束组织中,因为表达模式的相似,它们之间可能具有相互调控的作用。在拟南芥atmir398b和atmir398c稳定knockdown株系中,atnat398b或atnat398c的表达被抑制,而在atmir398b和atmir398c稳定过表达株系中,atnat398b或atnat398c的表达被促进,然而过表达人工mir398不会影响反义基因的表达。前人研究多集中于成熟的mirna通过调控相对的靶标基因来调控植株多种生长发育过程。与前人的研究不同,本发明首次报道了mirna基因正向调控反义基因表达的现象。有文章报道,正义基因通过招募rna聚合酶ii来调控反义基因在细胞内的积累量,那么mirna基因是否也这样来调控反义基因呢?本发明人检测了在过表达atmir398b和atmir398c的转基因植株中,atnat398b或atnat398c的转录活性以及rna聚合酶ii在反义基因上的积累量,发现atnat398b和atnat398c转录活性和rna聚合酶ii在反义基因上的积累量提高;因此,转录活性的增强可能是atmir398b和atmir398c调控反义基因的一种方式。通过研究本发明人发现,mirna基因除了直接通过成熟mirna靶向剪切和翻译抑制靶标基因作用之外新的调控机制。
71.之前有文章报道过表达atmir398b前体序列的转基因植株会出现共抑制现象,即在转基因植株中atmir398b和atmir398c的前体表达量显著性低于野生型,但是却不影响atmir398a的前体表达,从而导致mir398的生物合成降低(yamasaki等,2007;sunkar等,2006)。在本发明人的工作中,本发明人在野生型植株中过表达的atmir398b序列比sunkar
等和yamasaki等过表达的序列要长,与atnat398b有更长的互补配对区且不覆盖atnat398b的启动子,在后代转基因植株中,用与前人一致的引物对序列去检测mir398b的前体表达量,发现atmir398b的前体表达量升高,没有出现共抑制现象,但是本发明人仍旧没有获得mir398b增加的转基因植株。前人研究表明过表达atmir398c序列可以获得过表达mir398c的植株(dugas和bartel,2008),根据本发明人race的实验结果,本发明人过表达的atmir398c序列比dugas等过表达的序列要长,与atnat398c有更长的互补配对区且不覆盖atnat398c的启动子。
72.拟南芥中atnat398b/c抑制mir398的生物合成
73.mirna可影响植物的发育过程,这种调控多是通过对靶标基因的降解和翻译抑制来完成的(chen,2004;palatnik等,2003)。因此mirna基因的反义基因是否以及如何调控mirna的表达是一个重要的问题。根据本发明人的实验结果,在拟南芥atnat398b和atnat398c稳定knockdown株系中,pri-mir398b和pri-mir398c的表达量分别被增强,同时减少了mir398靶标基因atcsd1的表达量;在拟南芥atnat398b和atnat398c稳定过表达株系中,pri-mir398b和pri-mir398c的表达分别被抑制,同时增加了mir398靶标基因atcsd1的表达量。之前有文章报道mir398-csd1通路调控多种逆境胁迫抗性,因此atnat398b和atnat398c可能会通过影响mir398-csd1通路来影响多种植物逆境抗性。那么这种atnat398b和atnat398c抑制相应正义基因表达的调控机理是什么呢?反义基因通过调控正义基因的转录来调控正义基因的表达(crampton等,2006;prescott和proudfoot,2002)。本发明人通过chip实验,发现atnat398b和atnat398c对atmir398b和atmir398c上rna聚合酶ii的积累量没有影响,暗示出atnat398b和atnat398c对正义基因的调控并不是通过调节正义基因的转录造成的。
74.rna的二级或三级结构影响非编码rna和mirna前体的稳定性(yuan等,2014;johnsson等,2013;faghihi等,2008)。其中proliferating cell nuclear antigen(pcna)的顺式天然反义转录本pcna-as1通过与正义转录本形成rna双链来增加正义转录本的稳定性。通过rna酶保护实验,本发明人发现pri-mir398b和pri-mir398c能够和它们的顺式天然反义转录本形成双链rna,这种双链结构必然也会影响pri-mir398b和pri-mir398c的二级或三级结构。烟草瞬时表达和拟南芥稳定转化分析以及降解速率实验表明,在烟草和拟南芥中,atnat398b和atnat398c分别降低pri-mir398b和pri-mir398c的稳定性。pri-mir398b和pri-mir398c稳定性的降低改变了pri-mir398b和pri-mir398的表达量,进一步导致pre-mirna和mir398量的变化。前人研究表明pri-mirna的精确剪切影响mirna的形成(dong等,2008)。因此atnat398b和atnat398c除了影响pri-mir398b和pri-mir398c的稳定性,是否也改变pri-mirna的剪切位点,从而影响pre-mirna的形成,并进一步影响成熟的mirna的形成呢?进一步的race实验结果表明,atnat398b会增加pri-mir398b的5’单链区上剪切位点的产生,这种影响可能导致mir398的形成受阻。之前有报道称天然反义转录本通过形成nat-sirna来调控正义基因转录本的表达(borsani等,2005)。本发明人的进一步实验显示来源于atnat398b的21-nt的nat-sir398b-1在过表达atnat398b植株中累积。并且过表达该nat-sir398b-1,有效降低pri-mir398b和pri-mir398c的表达量,这表明mirna基因受nat-sirna的调控。因为pri-mir398b和pri-mir398c形成mir398的过程需要dcl1等蛋白的作用,又因为nat-sir398b-1的产生需要rdr6,dcl2,dcl3和dcl4等,这暗示出rdr6和dcl2/3/4在
mir398形成过程中所起到的功能。这种调控作用把mirna的生物合成与nat-sirna的生物合成联系了起来,为了解拟南芥体内调控网络的复杂性增添了重要数据。
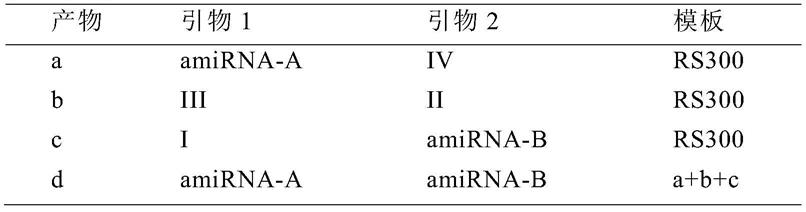
75.因为atnat398b是编码基因,本发明人试图了解nat398b蛋白是否具有调控植株pri-mir398b表达的能力。本发明人利用crispr/cas9技术构建了相应转基因植株,后代筛选鉴定出的纯合crnat398b株系显示出对pri-mir398b的表达水平没有明显的影响,这个结果排除了nat398b蛋白功能对pri-mir398b的影响。
76.在作物品种白菜中,brpmir398b-1和brpmir398b-2有顺式天然反义转录本(yu等,2013)。本发明人发现与拟南芥中atmir398b与atnat398b之间的调控相似,brpnat398b-2负调控它的正义基因并影响mir398的表达量和靶标基因的表达量。因此提示反义基因对正义mirna前体的干扰作用普遍存在于不同物种中,并且这种调控作用为农业改良提供新的思考角度。
77.atnat398b/c削弱植物抗热性
78.在多种逆境中,高温被认为是造成农作物产量损失的一种主要的非生物胁迫。有研究表明,37℃热胁迫迅速诱导拟南芥幼苗中mir398的产生,同时下调mir398靶基因atcsd1、atcsd2和atccs的表达,还影响植物活性氧的含量,并进而影响热响应基因的表达。而且过表达抵抗mir398的atcsd1、atcsd2和atccs的转基因植株比过表达正常的atcsd1、atcsd2和atccs的转基因植株在营养生长期对热更敏感;而csd1,csd2和ccs的突变体植株在营养生长期则表现出比野生型更抗热(guan等,2013),该研究揭示了拟南芥mir398-csd1/csd2/ccs抵抗热胁迫的调控网路,并且这种调控对拟南芥营养生殖期的抗热性起重要作用。本发明人的抗热性检测实验确认了csd1突变体植株更抗热,而atcsd1过表达植株更不抗热的结论。p35s::mir398a的抗热性强于野生型,而p35s::mir398b和p35s::mir398c的抗热性弱于野生型。表明拟南芥通过mir398-csd1的调控通路来正向调节拟南芥植株的抗热性。为了检测atnat398b/c基因是否能调控植株的抗热性。本发明人进一步抗热性检测实验显示p35s::amir-nat398b和p35s::amir-nat398c的植株抗热性强于野生型,而p35s::nat398b和p35s::nat398c的抗热性弱于野生型,crnat398b植株的抗热性与野生型差异不大。因为mir398表达量降低的植株和过表达atcsd1的植株抗热性弱于野生型,而mir398过表达植株和csd1突变体的抗热性强于野生型,所以atnat398b knockdown植株增加的抗热性可能是由增加的mir398和降低的atcsd1引起的,过表达atnat398b植株降低的抗热性可能是由减少的mir398和增加的atcsd1引起的,而crnat398b的抗热性与野生型差异不大是因为mir398与atcsd1的表达量和野生型差异不大。这些结果表明atnat398b和atnat398c可以调控mir398和它的靶标基因,以及atnat398b和atnat398c基因可以削弱植株抗热性。
79.在拟南芥遭受高温胁迫后,atmir398的表达量迅速增加,这种快速诱导mir398的响应有利于增加植株的抗热性。而在拟南芥遭受高温胁迫后,atnat398b和atnat398c的表达会被快速抑制,这种抑制作用会降低atnat398b和atnat398c对mir398的抑制作用,从而使mir398的表达量快速增加,这一调控作用使高等植物在面临高温逆境时,快速做出反应,从而增加植物抗热性。有研究显示某些基因在拟南芥不同生长时期所起的抗热性作用不同,如dehydration-responsive element binding protein 2c(dreb2c)和heat stress transcription factor a3(hsfa3)基因(chen等,2010),所以atnat398b和atnat398c调控网络在拟南芥营养生殖期抗热性中起着削弱作用的同时,是否也在其它时期,如幼苗期起
着相似的作用是一个值得考虑的细节,需要进一步的研究。
80.mirna基因和反义基因组成调控环路去控制植物抗逆性
81.mir398基因和它们反义基因之间关系的发现在生命调控网络中增加了一条新分支。本发明人发现,mir398基因和它们的反义基因之间科互相调控。根据结果,本发明人提出一种调控模型(图23)。在该模型中,mirna基因激活它们的反义基因;而天然反义转录本通过调控pri-mir398b/c的稳定性来抑制mir398的合成从而通过mirna靶标基因来调控植物抗热性。虽然本发明集中在顺式天然反义转录本atnat398与相应正义基因之间的调控作用,但是由于pri-mir398b和pri-mir398c序列相似性高,本发明人预期atnat398b也会调控pri-mir398c的表达量。
82.本发明首次把视角放在了mirna基因和它们的反义基因的相互调控上。在遗传转化时,过表达mirna基因被广泛地采用去沉默mirna的靶标基因从而增强农作物的产量和质量。当mirna基因存在反义基因时,本发明人通过设计人工mirna基因或者通过调控反义基因的表达来达到相应的调节靶标基因的目的。因此mirna和它们的反义基因之间的关系为改良遗传操作手段从而提高植物抗逆性提供了理论基础。
83.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
84.材料与方法
85.1、植物材料和生长条件
86.2、植物材料和生长
87.salk_033232,salk_024857,salk_089121和salk_038698种子是从abrc种质资源库购买得到(http://signal.salk.edu/cgi-bin/tdnaexpress)。
88.p35s::mir398a,p35s::mir398b,p35s::mir398c,p35s::nat398b,p35s::nat398c,pnat398b::nat398b,pnat398c::nat398c,pmir398a::gus,pmir398b::gus,pmir398c::gus,pnat398b::gus,pnat398c::gus,pcsd1::gus,p35s::amir-nat398b,p35s::amir-nat398c,p35s::nat-sir398-1,p35s::amir398,cra-2,crnat398b和野生型col-0种子为本发明人利用常规方法构建。
89.paa6::brpnat398b-2和bre种子为本发明人利用常规方法构建。
90.生长条件:植物组培间温度22℃,16小时光照,8小时黑暗。人工培养间温度20-24℃,相对湿度65-70%,光照强度80-200μmol/m2/s,16小时光照,8小时黑暗。
91.3、质粒和菌株
92.peasy-blunt,peasy-t1:基因克隆载体和rna体外转录载体;
93.pcambia1301,pcambia2301:植物双元载体,用于基因过表达;
94.pcambia1301-paa6-taa6:植物双元载体,用于白菜基因过表达;
95.pbi101.1:植物双元载体,用于基因启动子表达模式分析;
96.crispr/cas9载体:基因敲除中间载体;
97.dh5α:质粒转化受体大肠杆菌;
98.gv3101:植物转化农杆菌;
99.rs300载体:人工mirna模板。
100.4、药品试剂
101.kod fx neo dna聚合酶(toyobo),taq dna聚合酶(takara),反转录酶(takara),rna酶抑制剂(takara),dntp(takara),dna酶(takara),碱性磷酸酶(takara),各种限制性内切酶(neb),t4 dna连接酶(neb),trizol(invitrogen),ser5p pol ii抗体(abcam),prota琼脂糖磁珠(bio-rad),蛋白酶抑制剂(roche),dna片段胶回收试剂盒(博大泰克),体外转录反应试剂(takara),race 5/3’试剂盒(clontech),化学发光核酸检测试剂盒(pierce),放线菌素d,测序和引物合成由生工或美吉完成。
102.5、培养基
103.lb培养基:用于大肠杆菌和农杆菌培养。
104.murashige&skoog(ms)培养基:用于拟南芥和白菜无菌培养。
105.6、种子的层积化和春化
106.拟南芥种子播前需在湿润条件下置4℃冰箱内进行3至4d的层积化处理(stratification)。白菜种子需要置4℃冰箱内进行一个月以上春化处理(vernalization)。
107.7、植株栽培
108.无菌栽培:
109.少量收获后烘干保存的拟南芥或白菜种子放于2ml的离心管中,加1.5ml 75%的乙醇,摇晃1min。离心一下,用移液枪移去酒精。加1:4稀释后的漂水1.5ml于离心管中,恒温振荡器22℃条件下140rpm震荡11min,短暂离心一下。在紫外灭菌后的超净台中打开离心管,用移液枪移去漂水,尽量移除干净。用无菌水漂洗5次。加入含0.1%琼脂的无菌水。用1ml移液枪吸取种子,点铺于相应的正常的ms培养基,尽量使种子铺的分布均匀。在超净台上打开培养皿盖,吹干种子。后用polyfilm封口,4℃冰箱春化三天。放入组培间培养,观察并统计发芽情况。
110.土中栽培与抗热性检测:
111.幼苗移栽入土的前一天,在人工培养间把蛭石:黑土:珍珠岩按照2:1:1的比例混合,挑出或捏碎大颗粒的土块,把混好的土均匀装入塑料小盆中,将添加绿肥的水(2g/l)加入底盘,让土吸饱水。第二天,把在培养间生长约1周,长出两片叶子后的拟南芥幼苗移栽入吸饱水的土中,写好标签,覆上保鲜膜。2天后揭去保鲜膜,后期每天去观察植株状态,见表面土壤干后即可浇水于托盘中,但是不要让托盘中存有积水,以防病虫害的发生。在结实期要控制水量,当植株成熟时不必继续浇水,以加速植株的成熟。为了检测成苗植株的抗热性,土壤内生长了21天的植株转移到38℃的光照培养箱处理3天,然后统计花的存活率。另外把土壤内生长了16天植株的莲座离体叶片在38℃的环境中处理7小时,然后在22℃恢复5天后统计叶片的绿化率。
112.种子的收集、干燥和贮存:
113.当拟南芥或白菜种子逐渐成熟,长角果由绿变黄,最后成褐色时,及时收获种子以避免种系混杂,采集的种子放在单独的纸袋中,在30℃烘箱中干燥保存。
114.8、载体构建
115.基因过表达载体构建:
116.以拟南芥基因组dna为模板,用atmir398a-s/a,atmir398b-s/a,atmir398c-s/a,atnat398b-s/a,atnat398c-s/a,atcsd1-s/a这些引物对进行扩增。随后用相应的限制性内切酶进行酶切,连入pcambia1301载体中,测序正确后保存备用。
117.以白菜基因组dna为模板,用brpnat398b-2-s/a引物对扩增,随后用相应的限制性内切酶酶切,连入pcambia1301-paa6-taa6载体中,测序正确后保存备用。
118.人工mirna载体构建:
119.以实验室保存的rs300质粒为模板,利用引物amirna-a,amirna-b,nat398bi mir1-s,nat398bii mir1-a,nat398biii mir1*s,nat398biv mir1*a,nat398ci mir2-s,nat398cii mir2-a,nat398ciii mir2*s,nat398civ mir2*a进行扩增。
120.具体扩增方法为:
[0121][0122]
扩增出的片段d用合适的酶酶切之后连入pcambia1301载体中,测序正确后保存备用。
[0123]
crispr/cas9载体的构建:
[0124]
为了敲除基因,把crispr-mir398a-s/a,crispr-nat398b-s/a基因对退火配对后连接进入酶切后的crispr/cas9中间载体,测序正确后,酶切质粒并把片段连接进入pcambia1301载体中,测序正确后保存备用。
[0125]
表达模式载体的构建:
[0126]
以拟南芥基因组dna为模板,用pmir398a-s/a,pmir398b-s/a,pmir398c-s/a,pnat398b-s/a,pnat398c-s/a,pcsd1-s/a这些引物对进行扩增,然后用相应的限制性内切酶酶切,连入pbi101.1载体中,测序正确后,保存备用。
[0127]
9、植物遗传转化和转基因筛选
[0128]
拟南芥植物遗传转化和转基因筛选:种植于人工培养间的约一个半月的拟南芥剪苔,当植物重新抽出的苔长至8-12cm,花苞多且无果荚时转化。转化前一天在盆中浇水,但不要残留积水。在转化前首先把要转化的农杆菌划rgk平板,28℃复苏,然后挑取单菌落至20ml lb(rgk抗性)中,28℃摇菌过夜。第二天将菌液以1:100的比例转接到200ml lb(kan抗性)中,28℃过夜培养。然后对摇好的菌液用500ml的离心瓶,4℃,5000rpm离心10min。弃去上清,沉淀重悬于同等体积的转化液中。转化液的简易配比是每升转化液中500μl silwet77,50g的蔗糖。然后将重悬后的菌液倒入转化用的烧杯。将待转化的拟南芥的花絮浸于转化液中30s。在托盘中垫保鲜膜,花盆平放在盘中,上面也用保鲜膜覆盖花序,并用报纸包裹,避光保持一天。第二天将花盆竖立,光照。等种子收获烘干后,将种子灭菌平铺于加有相应抗性的ms培养基上,4℃春化三天后,放于光照培养间,等两周后将抗性苗移栽于土中。取植物材料提取dna,用特定引物来pcr鉴定,再经两代的筛选和鉴定得到转基因的纯合系,再进一步分析。
[0129]
白菜植物遗传转化和转基因筛选:参考拟南芥植物遗传转化和转基因筛选,把摇好的农杆菌重悬到1/2倍体积的转化液中,利用真空渗入法(bai等,2013)转化进入提前剥蕾的白菜野生型株系bre中。收取的大量种子经过两个月后熟后通过潮霉素筛选方法筛选,避光三到四天后,放在光照条件下生长,一周后筛选出下胚轴伸长并且生长状态良好的转基因植株幼苗移栽进入土壤中。
[0130]
烟草瞬时转化实验:挑起单个农杆菌菌落,接种到3ml lb液体培养基(含抗生素)在200rpm,28℃摇床培养过夜。当od600值在0.8-1.2时,将上述过夜培养菌液在常温,10000rpm下离心2min,收集菌体。用双蒸水重新悬浮沉淀的农杆菌,调节浓度od600至0.5-1.0。当共转菌株时,在室温下按照同等的量混合两种菌液。一般选用4-5叶期烟草植株,注射前要充分吸水,然后用1ml的无针头的注射器吸取悬浮有农杆菌的菌液从烟叶背面注入叶片内,做上标记,将处理过的烟草放回培养室,照常管理。三天后取rna材料,用于进一步研究。
[0131]
10、race实验
[0132]
为了确定转录本全长或者断点位置,本发明人利用smarter race 5/3’试剂盒(clontech)去扩增rna的5’和3’端。
[0133]
11、转录速率实验
[0134]
根据目的基因的序列,在第一个外显子位置设计一条正向引物,在第一个内含子位置设计两条反向引物,利用位置偏后的反向引物进行特异性引物反转录,然后利用另外两条引物进行qrt-pcr检测。
[0135]
12、植物srna测序
[0136]
取15天的拟南芥幼苗(两个生物学重复),利用trizol法提取总rna并且用dnase处理,并用酚抽提,然后在药明康德公司进行srna测序。
[0137]
13、dab染色
[0138]
为了检测h2o2的积累量,本发明人把土壤内生长了19天的拟南芥植株转移到38℃的光照培养箱处理0小时或者1小时,然后取莲座叶片在dab染色液(1mg/ml的dab溶解于ph7.5的tris-hcl)染色。室温避光摇晃19个小时,然后用70%的乙醇漂洗多遍,直至叶片叶绿素完全褪去,然后拍照。
[0139]
14、rna降解实验
[0140]
把两周的拟南芥野生型,p35s::nat398b和p35s::nat398c植株,用100μg/ml放线菌素d(sigma-aldrich)溶液处理,分别在0小时,2小时,8小时的时间点取样,然后提取植株的rna并用qrt-pcr检测基因的表达量。
[0141]
15、引物信息
[0142]
[0143]
[0144][0145]
16、植物中mir398基因及其反义基因
[0146]
[0147][0148]
17、crispr/cas9敲除atmir398基因序列
[0149][0150]
实施例1、白菜和拟南芥mirna的顺式天然反义转录本
[0151]
1、白菜和拟南芥mirna顺式天然反义转录本的发现
[0152]
为了寻找是否有更多的mirna基因有相对应的顺式天然反义转录本,本发明人对结球白菜bre全基因组和转录组测序数据以及白菜数据库(http://brassicadb.org/brad/)综合分析,结果发现,至少有22个cis-nats对应于mirnas的前体(表1)。
[0153]
拟南芥作为重要的模式植物,与白菜有较近的亲缘关系,两者均属于十字花科。为了寻找在拟南芥中是否也同样存在mirna基因有对应的顺式天然反义转录本,本发明人通过对拟南芥转录组测序结果以及网络数据库(http://www.ncbi.nlm.nih.gov/projects/mapview/)的综合分析,发现25个cis-nats对应于mirnas的前体(表1),并且其中部分mirna基因在白菜中的同源基因也具有顺式天然反义转录本。
[0154]
表1、拟南芥和白菜中mirna基因及其顺式天然反义转录本
[0155][0156][0157]
2、白菜中brpmir398的顺式天然反义转录本
[0158]
通过分析,本发明人从白菜核基因组和叶绿体基因组中鉴定了多个参与热胁迫响应的mirnas,包括大量新的mirnas和部分保守的mirnas。研究表明,46℃高温处理1小时诱导白菜brpmir398a和brpmir398b的表达量分下调别3和10倍,其靶基因brpcsd1的表达量则上调了6倍。在白菜中,编码brpmir398的基因有四个,分别是brpmir398a-1,brpmir398a-2,brpmir398b-1和brpmir398b-2,其中brpmir398b-1和brpmir398b-2有对应的反义基因,分别为bra006261(brpnat398b-1),bra008752(brpnat398b-2),两者均是可编码蛋白的基因,其中前者编码一个具有rna结合活性的多核糖核苷酸核苷酸转移酶(polyribonucleotide nucleotidyltransferase),后者编码一个乙酰氨基葡萄糖转移酶(acetylglucosaminyltransferase)。分析白菜转录组数据发现,brpmir398b-1的转录本与它的反义基因brpnat398b-1的转录本在3’端部分互补配对,而brpmir398b-2的转录本与它的反义基因brpnat398b-2的转录本几乎完全互补配对(图1a)。
[0159]
3、拟南芥中atmir398的顺式天然反义转录本
[0160]
白菜brpmir398和拟南芥mir398的序列非常保守。在拟南芥基因组中atmir398基因有三个拷贝,分别是atmir398a(at2g03445),atmir398b(at5g14545)和atmir398c(at5g14565)(图1b),其中成熟的mir398b与mir398c序列完全一致,但是与成熟的mir398a在3’端最后一个碱基有差异。通过分析转录组数据和拟南芥数据库,本发明人发现atmir398b和atmir398c有cis-nats(atnat398b和atnat398c),而atmir398a没有cis-nat。基因功能预测的结果显示,拟南芥atnat398b和atnat398c是编码蛋白的基因,其中atnat398b基因编码一个功能未知蛋白,属于乙酰氨基葡萄糖转移酶家族(acetylglucosaminyltransferase);atnat398c基因编码一个具有高亲和能力的硝酸根转运蛋白2.7(high affinity nitrate transporter2.7,atnrt2.7)。其中atnat398b是白菜中brpnat398b-2的同源基因,它们核酸序列上有74.3%的相似性,在氨基酸序列上有84.4%的相似性。为了确定拟南芥中atmir398b和atmir398c以及atnat398b和atnat398c的转录本长度,本发明人采取了cdna末端快速扩增技术(race)去克隆基因转录本的5’和3’端序列,并从而获得全长的转录本长度,在基因特异性引物对扩增之后,pcr产物建库,然后至少挑25个单克隆测序并比对序列。通过对结果分析,确定每个基因转录本的端点序列。结果表明,atmir398b,atmir398c,atnat398b和atnat398c基因的最长的转录本长度分别是692,1941,1772和1917nt(图1b和图2)。通过序列分析,发现atmir398b产生的pre-mir398b完全与nat398b的3’非编码区互补配对,而pri-mir398b除了5’端部分序列,其余绝大部分与反义转录本互补配对,而atmir398c编码产生的pri-mir398c的茎环区与atnat398c的转录本无互补配对区,然而pri-mir398c的3’端与atnat398c的转录本互补配对(图2)。
[0161]
实施例2、拟南芥atmir398基因及其反义基因的表达模式
[0162]
拟南芥atmir398基因家族中包含atmir398a,atmir398b和atmir398c,有研究报道atmir398a不表达。但是,本发明人的基因表达量检测与srna测序实验结果显示在正常生长状态下,拟南芥幼苗中atmir398a是表达的,只是它的表达量与atmir398b和atmir398c基因的表达量相比较低(图3和表2)。
[0163]
表2、srna测序检测拟南芥mir398含量
[0164][0165]
为了探究mir398基因和它们的反义基因的表达模式,本发明人构建了pmir398a::gus,pmir398b::gus,pmir398c::gus,pnat398b::gus和pnat398c::gus载体并把它们通过浸花法转入拟南芥野生型col-0植株中。潮霉素筛选获得转基因后代,利用t3代纯合植株的幼苗进行染色,酒精洗涤后发现下胚轴染色较深,而叶端染色很浅,其它部位没有染色,表明pmir398a::gus在幼苗期主要表达在下胚轴以及子叶和真叶的叶端;而pmir398b::gus在幼苗期是泛在性表达的,并且在维管束组织中表达量最高,同时pnat398b::gus在幼苗期也是泛在性表达,并且在维管束组织中表达量最高(图4a)。pmir398c::gus也是泛在性表达,并且在维管束组织中表达量最高,然而pnat398c::gus却只在子叶和下胚轴中表达(图4b)。这个结果表示,atmir398b和atnat398b在拟南芥幼苗期是泛在性共表达的,然而atmir398c和atnat398c仅在子叶和下胚轴中共表达。
[0166]
本发明人也构建了p35s::nat398b-gfp和p35s::nat398c-gfp植株,通过荧光显微观察植株根尖发现,p35s::nat398b-gfp植株的gfp定位在细胞膜,而p35s::nat398c-gfp植株的gfp定位在细胞膜和液泡膜。
[0167]
实施例3、过表达atmir398b和atmir398c基因抑制了mir398的形成为了获得过表达atmir398基因的拟南芥转基因植株,本发明人构建了用烟草花叶病毒35s启动子启动的atmir398a,atmir398b和atmir398c的载体,并把它们分别通过浸花法转化进拟南芥col-0生态型中。潮霉素筛选获得转基因后代,并通过连续播种与筛选获得t3代过表达纯合转基因株系。在获得的过表达atmir398a的纯合转基因株系中,利用northern杂交实验发现成熟的mir398的积累量增加,并且mir398靶标基因atcsd1的表达量下降(图5e和f)。然而本发明人挑选多个atmir398b和atmir398c的过表达纯合株系,northern blot结果显示,成熟的mir398的表达量在转基因植株中要比野生型植株中少,并且对应的靶标基因atcsd1的表达量上调(图5a-d)。随后本发明人利用荧光定量pcr(qrt-pcr)检测atmir398b和atmir398c的前体表达量,结果显示atmir398b和atmir398c的前体表达量在转基因植株中的确比野生型中高(图5b和d)。
[0168]
为了检测本发明人构建的p35s::mir398a,p35s::mir398b和p35s::mir398c载体能否正常产生成熟的mir398,本发明人把这些载体分别瞬时转化进烟草叶片,三天后提取相应的叶片rna进行srna qrt-pcr分析。结果显示在转化了的烟草叶片中,成熟的mir398a或mir398b/c的表达量均显著性地高于野生型烟草叶片(图5g),这些结果显示出本发明人构建的p35s::mir398a,p35s::mir398b和p35s::mir398c过表达载体在烟草中均正常产生成熟的mir398。那么在拟南芥atmir398b和atmir398c的转基因植株中出现的现象可能暗示出拟南芥体内的一些内部机制阻止了mir398形成的过程。因为有反义基因的atmir398b和atmir398c出现了这种现象,而不存在反义基因的atmir398a则正常产生成熟的mir398a,所以本发明人猜测这种内部机制可能跟拟南芥体内atmir398b/c的反义基因有关。
[0169]
实施例4、atnat398b和atnat398c抑制mir398的生物合成
[0170]
4.1减少atnat398b和atnat398c增加pri-mir398b/c的表达
[0171]
为了检测atnat398b和atnat398c是否调控atmir398b和atmir398c,本发明人利用实验室已有的人工mirna载体来构建p35s::amir-nat398b和p35s::amir-nat398c载体,这些载体是在mir319a骨架的基础上,把成熟mirna和mirna star的区域替换为人工设计的srna序列。再把构建的载体转化进入拟南芥中,在后代中筛选出阳性苗并传代到t3代,把幼苗的rna提取出来,进行分析检测。发现在转基因植株p35s::amir-nat398b中,atnat398b的表达量显著性降低,而pri-mir398b的表达量则显著性增加(图6a),说明atnat398b负调控atmir398b的表达。同理,在转基因植株p35s::amir-nat398c中,atnat398c的表达量显著性降低,而pri-mir398c的表达量显著性增加(图6b),说明atnat398c负调控atmir398c的表达。因此本发明人发现atnat398b/c分别负调控它们的正义基因atmir398b/c的表达。
[0172]
4.2过表达atnat398b和atnat398c抑制pri-mir398b/c的表达
[0173]
本发明人从拟南芥种质资源库购买了一个atnat398b的t-dna插入突变体salk_033232,t-dna插入到了atnat398b的5’非编码区,导致atnat398b的表达量比野生型增加了二十多倍,说明这个突变体是功能增强型突变体,本发明人把它命名为nat398b-d(图6c)。在该突变体中本发明人检测了pri-mir398b的表达量,结果表明它的表达量降低,并且atcsd1的表达上升(图6d)。
[0174]
接下来本发明人过表达了atnat398b和atnat398c基因,即构建了用烟草花叶病毒35s启动子启动的atnat398b和atnat398c的载体,并把它们分别通过浸花法转化进拟南芥col-0生态型中,抗生素筛选获得转基因后代。在获得的过表达atnat398b的纯合转基因株系中,qrt-pcr分析发现atnat398b的表达量显著增加,而正义基因atmir398b的表达量却降低了,同时northern杂交实验发现mir398的积累量降低(图7a),而mir398靶标基因atcsd1的表达量增加(图7b)。这个结果暗示出atnat398b负调控pri-mir398b的表达和mir398的生物合成。综合上述结果,本发明人得出一个结论,即atnat398b负调控pri-mir398b的表达和mir398的生物合成。本发明人分析了过表达atnat398c转基因株系,结果显示在这些植株中,当atnat398c过表达倍数比野生型增加时,它的正义基因pri-mir398c的表达量会显著性低于野生型,northern杂交实验也显示成熟mir398的量降低,而它的靶标基因atcsd1的表达量也相对应地增加(图7c和d)。这个结果暗示出与atnat398b负调控pri-mir398b的表达和mir398的生物合成类似,atnat398c也负调控它的正义基因pri-mir398c的表达和mir398的生物合成。
[0175]
实施例5、atnat398b/c不影响正义基因的转录
[0176]
为了解atnat398b/c基因抑制它们相应正义基因表达量的机理,本发明人检测了野生型和过表达植株中rna聚合酶ii在atmir398b或atmir398c启动子上的积累量。
[0177]
本发明人首先检测了野生型和p35s::nat398b植株中rna聚合酶ii在atmir398b启动子上的积累量。通过chip实验,本发明人发现在野生型和p35s::nat398b植株中rna聚合酶ii在atmir398b启动子上的积累量差异不显著(图8)。同理,本发明人也检测出在野生型和p35s::nat398c植株中rna聚合酶ii结合在atmir398c启动子上的量也没有显著差异(图8)。这个结果显示atnat398b和atnat398c并不是通过调控rna聚合酶ii结合在启动子上的量来调控正义基因的表达。
[0178]
实施例6、atnat398b/c与pri-mir398b/c形成双链结构
[0179]
前人的研究表明当正反义转录本有互补配对区的存在时,很容易就形成rna:rna
结构,因此本发明人猜测在转录后水平,atnat398b/c转录本可能与pri-mir398b/c形成双链结构。
[0180]
为了证实这种猜想,本发明人进行了rna酶保护试验。本发明人提取拟南芥野生型植株的rna(为了防止二级结构被破坏,不在65℃中溶解rna,而是在4℃溶解),随后在实验组加入rnase a t,对照组加入等量的水,最终抽提获取rna并全部用特异性引物进行反转录,再利用定位在互补区或者非互补区的引物对来进行qrt-pcr检测,最后比较实验组与对照组的区别。结果显示当引物对位于pri-mir398b和nat398b互补配对区时,被保护的rna量要显著性高于位于非互补配对区的rna以及阴对照actin2(图9)。同理,当引物对位于pri-mir398c和atnat398c互补配对区时,被保护的rna量也要显著性高于位于非互补配对区的rna以及阴对照actin2(图9)。这些结果表明pri-mir398b和pri-mir398c能够分别和它们的顺式天然反义转录本在互补配对区形成双链rna结构。
[0181]
实施例7、atnat398b/c影响pri-mir398b/c的稳定性
[0182]
7.1过表达atnat398b/c降低了pri-mir398b/c的稳定性
[0183]
之前有报道称双链rna的形成影响rna的稳定性,所以本发明人猜测atnat398b/c可能会影响它们正义基因转录本的稳定性。为了回答这个疑问,本发明人首先利用瞬时表达体系去检测在存在或者不存在atnat398b基因的时候atmir398b基因在烟草叶片中的表达量。为了能在烟草叶片中稳定、大量地表达atnat398b基因和atmir398b基因,本发明人构建了以烟草花叶病毒35s启动子启动的atnat398b和atmir398b基因的载体。正常条件下,p35s::nat398b和p35s::mir398b基因的载体在烟草中均可大量表达相应的基因,但是当把p35s::nat398b或空载分别和p35s::mir398b的菌液同时注射进烟草叶片中,相同的时间点取样后提取rna,进行qrt-pcr分析,结果表明注射含有p35s::nat398b和p35s::mir398b载体的混合菌液中pri-mir398b的表达量要比注射含空载和p35s::mir398b载体的混合菌液中的表达量低(图10a)。这个实验结果暗示出atnat398b降低pri-mir398b的稳定性。同理,本发明人对p35s::nat398c和p35s::mir398c载体进行类似的瞬时表达实验,结果表明,注射含有p35s::nat398c和p35s::mir398c载体的混合菌液中pri-mir398c的表达量也要比注射含空载和p35s::mir398c基因载体的混合菌液中的表达量低(图10a)。这个实验结果暗示出atnat398c降低pri-mir398c的稳定性。为了排除35s启动子共抑制的影响,本发明人接着构建了pnat398b::nat398b和pnat398c::nat398c载体,它们均是自身启动子驱动基因表达的载体。在烟草叶片中瞬时表达菌液的混合物,发现注射含有pnat398b::nat398b和p35s::mir398b载体的混合菌液中pri-mir398b的表达量要比注射含空载和p35s::mir398b载体的混合菌液中的表达量低(图10a)。同理,注射含有pnat398c::nat398c和p35s::mir398c载体的混合菌液中pri-mir398c的表达量要比注射含空载和p35s::mir398c载体的混合菌液中的表达量低(图10a)。综上所述,烟草中的稳定性检测实验结果表明atnat398b和atnat398c分别降低pri-mir398b和pri-mir398c的稳定性。
[0184]
另外本发明人发现在稳定过表达p35s::nat398b和p35s::mir398b的拟南芥中,atmir398b基因的表达量比仅过表达p35s::mir398b的拟南芥中的表达量低;而同时过表达p35s::nat398c和p35s::mir398c的拟南芥中,atmir398c基因的表达量比仅过表达p35s::mir398c的拟南芥中的表达量低(图10b)。因此,本发明人发现在拟南芥中,atnat398b和atnat398c也分别降低pri-mir398b和pri-mir398c的稳定性。
[0185]
7.2过表达atnat398b/c增加了pri-mir398b/c的降解速率
[0186]
为了进一步验证atnat398b和atnat398c分别降低pri-mir398b和pri-mir398c的稳定性。接下来,本发明人检测了过表达atnat398b和atnat398c植株中pri-mir398b/c的降解速率。
[0187]
本发明人把col-0,p35s::nat398b和p35s::nat398c植株在转录抑制剂放线菌素d(actd)处理一定时间后,取样测量pri-mir398b/c的表达水平。结果显示在actd处理后,p35s::nat398b植株中pri-mir398b的降解速率要高于野生型,而p35s::nat398c植株中pri-mir398c的降解速率要高于野生型,但atgapdh转录本的降解速率在三种植株中无显著差异(图11)。这个结果表明,在拟南芥中,atnat398b和atnat398c分别增加pri-mir398b和pri-mir398c的降解速率。
[0188]
实施例8、过表达atnat398b增加pri-mir398b的5’单链区不正确剪切位点的产生
[0189]
pri-mirna剪切位点的变化可能会影响pre-mirna的形成,并进一步影响成熟的mirna的形成。因为atnat398b负调控它们的正义基因atmir398b的表达和mir398的生物合成,且拟南芥体内atnat398b与pre-mir398b完全互补配对,但是在pri-mir398b的5’单链区部分序列与atnat398b是没有互补配对的。本发明人猜测atnat398b可能会影响pri-mir398b形成成熟mir398的剪切过程。为了验证本发明人的假设,本发明人对野生型,p35s::nat398b和p35s::amir-nat398b转基因植株进行5’race实验。不同于全长race实验用来检测转录本的全长,这次的5’race实验本发明人用来检测pri-mir398b的5’端的断点。为了检测atnat398b基因对pri-mir398b的5’端的断点的影响,本发明人选用的扩增引物位于pri-mir398b的3’端,扩增的片段长度包括整个pre-mir398b。结果显示,在p35s::nat398b植株中,出现在pri-mir398b的5’单链区的断点的数比野生型中的多,而在p35s::amir-nat398b植株中,出现在pri-mir398b的5’单链区的断点数比野生型中的少(图12)。这些结果表明,atnat398b会增加pri-mir398b的5’单链区上剪切位点的产生。
[0190]
另外本发明人试图去了解是否过表达atnat398b影响pri-mir398b的降解。通过对拟南芥幼苗野生型和p35s::nat398b植株进行srna(20-70nt)双端测序,分析得到的测序数据,结果发现了多种可能产生于pri-mir398b的rna片段,分析比较发现,在p35s::nat398b植株中的rna降解片段要远远多于野生型植株(表3.3)。这些结果暗示了在p35s::nat398b转基因植株中,pri-mir398b的加工受到影响。
[0191]
表3 srna测序检测pri-mir398b的降解产物
[0192][0193]
实施例9、过表达nat-sir398降低pri-mir398的水平
[0194]
反义基因通过产生nat-sirna来调控正义基因的表达,那么atnat398是否会通过产生nat-sirna来调控atmir398基因的表达呢?为了回答这个问题,本发明人首先寻找可能产生于atnat398上的nat-sirna。本发明人对拟南芥野生型rna进行srna深度测序,并从测序结果中查找可能的nat-sirna。在拟南芥col-0中,本发明人发现了一些可能的nat-sirna,其中丰度最高的两个21nt的sirna(nat-sir398-1与nat-sir398-2)可能产生于atnat398b,通过srna qrt-pcr分析发现这两个srna在p35s::nat398b植株中均积累表达
(图13a),表明过表达atnat398b促进nat-sir398-1以及nat-sir398-2的表达。
[0195]
为了验证nat-sir398-1是否影响pri-mir398的表达量,本发明人构建了人工过表达nat-sir398-1的载体,该p35s::nat-sir398-1载体是在mir319a骨架的基础上,把成熟mirna的区域替换为nat-sir398-1序列,而mirna star区域也替换为相应序列。把构建的p35s::nat-sir398-1载体转化进野生型拟南芥。在后代中筛选出阳性苗并传代到t3代,提取幼苗rna,进行分析检测。结果表明在p35s::nat-sir398-1转基因植株中,pri-mir398b和pri-mir398c的表达量显著性降低(图13c),表明nat-sir398-1抑制pri-mir398b和pri-mir398c的表达量。
[0196]
为了寻找nat-sir398b-1产生所需要的蛋白组分,本发明人检测了一些srna形成突变体内nat-sir398b-1的表达量。结果显示,在dcl2/3/4三突变体和rdr6单突变体内nat-sir398b-1的表达量低于野生型,而在dcl1,dcl2,dcl3,dcl4和rdr2单突变体内nat-sir398b-1的表达量与野生型差异不大(图13d),表明rdr6有利于nat-sir398b-1的产生,而dcl2,dcl3和dcl4在nat-sir398b-1的产生过程中具有冗余作用。
[0197]
实施例10、atmir398b和atmir398c激活它们的反义基因
[0198]
前人报道有些反义基因与正义基因之间相互调控(zhao等,2018)。本发明人猜测atmir398b和atmir398c也调控它们反义基因的表达。
[0199]
为了检测atmir398b和atmir398c是否调控它们反义基因的表达,本发明人利用构建的p35s::nat-sir398-1转基因植株检测相应反义基因的表达。qrt-pcr结果表明在p35s::nat-sir398-1转基因植株中,pri-mir398b和pri-mir398c的表达量降低的同时也伴随着atnat398b和atnat398c的表达量的降低,这个结果暗示出atmir398b和atmir398c基因正向激活调控它们各自的反义基因(图14a)。另外本发明人在拟南芥突变体库购买了一个t-dna插入突变体salk_038698(图14b)。这个突变体是atmir398c的突变体,且t-dna插入位置是atmir398c的启动子区域,靠近转录起始位置,本发明人将其命名为mir398c。该突变体pri-mir398c和mir398的表达量低于野生型,mir398靶标基因atcsd1的表达量高于野生型,而atnat398c的表达量也低于野生型(图14c和d)。这个结果表明atmir398c基因正向调控它们的反义基因atnat398c。本发明人进一步利用构建的过表达atmir398b和atmir398c的t3代纯合转基因株系检测相应反义基因的表达。qrt-pcr结果显示在过表达atmir398b的转基因植株中,对应的反义基因atnat398b的表达量要比野生型植株中高(图14e)。同理,在过表达atmir398c的转基因植株中,对应的atnat398c的表达量也要比野生型植株中高(图14f)。这个结果表明atmir398b/c会激活atnat398b/c的表达量。
[0200]
为了检测atmir398基因是否是通过转录激活作用来促进反义基因的表达,本发明人首先检测了过表达atmir398植株中atnat398的转录活性。利用链特异性引物反转录后进行qrt-pcr,即在利用第一个内含子位置的引物反转录,再利用第一个外显子位置的一条正向引物和在第一个内含子位置的一条反向引物进行特异性引物扩增,结果表明在过表达atmir398b的纯合株系植株中,atnat398b的pre-mrna表达量要比野生型植株中高(图14e)。同理在过表达atmir398c的纯合株系植株中,atnat398c的pre-mrna的表达量也要比野生型植株中高(图14f)。除了检测这些基因的转录活性,同时本发明人也利用chip实验去检测rna聚合酶ii在atmir398b和atmir398c过表达植株中结合在atnat398b和atnat398c上的量是否变化。结果表明,在过表达atmir398b基因的植株中,rna聚合酶ii结合在atnat398b转
录起始附近位置上的量增加;在过表达atmir398c基因植株中,rna聚合酶ii结合在atnat398c转录起始附近位置上的量也增加(图15),进一步验证atmir398b和atmir398c对它们反义基因的转录激活作用。从以上结果中,本发明人得出结论,即atmir398b和atmir398c分别激活它们反义基因的转录。
[0201]
实施例11、人工mir398不影响atnat398b/c表达
[0202]
人工构建的p35s::mir398b和p35s::mir398c载体在拟南芥中稳定转化不能正常产生成熟的mir398,那么人工mir398载体能不能正常的产生成熟的mir398呢?为了回答这个问题,本发明人构建了一个以mir319a为骨架的人工mir398b/c(amir398b/c)载体。该p35s::amir398载体是在mir319a骨架的基础上,把成熟mirna的区域替换为mir398b/c序列,而mirna star区域也替换为mir398b star序列。再把构建的载体转化进入拟南芥中,在后代中筛选出阳性苗并传代到t3代时,把纯合株系的幼苗的rna提取出来,进行分析检测,发现转基因植株显示出显著减少的靶标基因atcsd1和atcsd2的表达(图16)。这个结果表明在拟南芥中人工mir398载体能正常的产生有功能的mir398,这个结果与过表达atmir398b和atmir398c基因不能产生积累的mir398的现象不一致,说明拟南芥体内这种共抑制现象的确是与它们的基因序列有关的,暗示出反义基因atnat398b和atnat398c在其中的重要作用。
[0203]
那么成熟的mir398能否调控mir398反义基因的表达呢?为了回答这个问题,本发明人在人工mir398的转基因植株中检测了它们反义基因atnat398b和atnat398c的表达量,结果表明atnat398b和atnat398c的表达量与野生型比较没有显著性改变(图16)。这个结果暗示出成熟的mir398不能影响atnat398b和atnat398c的表达。
[0204]
实施例12、atnat398b/c的表达受热抑制
[0205]
mir398是一个在拟南芥非生物胁迫作用上具有重要作用的mirna(guan等,2013;sunkar等,2006)。之前有文章报道,mir398的表达受热激诱导,为了检测atmir398b/c的反义基因是否具有热激响应,本发明人对两周的拟南芥幼苗在38℃环境中处理了0到1小时,然后提取rna,检测相应基因的表达量。基因表达量检测发现atmir398b,atmir398c在热激处理0.5和1小时时,表达量显著性升高(图17b)。northern杂交实验发现成熟的mir398的积累量也显著性增加,并且mir398靶标基因atcsd1的表达量下降(图17a和c)。与atmir398b和atmir398c的表达变化不同,本发明人的实验结果表明atnat398b和atnat398c的表达量在热激处理后是减少的(图17b)。这些结果表明atnat398b和atnat398c是受热激抑制表达的。
[0206]
之前有文章报道,mir398通过调控它的靶标基因atcsd1来调控拟南芥的抗热性,过表达抗mir398调控的atcsd1基因的拟南芥植株对热的敏感性要强于过表达正常的atcsd1基因的拟南芥植株(guan等,2013)。为了检测反义基因atnat398b是否在热激下还会影响atmir398b从而影响atcsd1基因。本发明人利用野生型和p35s::nat398b的纯合株系来检测热激前后相应基因的表达量。本发明人把同批次的拟南芥野生型和p35s::nat398b的纯合株系在38℃环境中处理0.5或1小时,提取rna检测mir398和atcsd1基因的表达量。结果表明,野生型和p35s::nat398b的幼苗在热激处理0.5h和1h后,atcsd1基因的表达量均呈现下降趋势,且在任意时间点上,p35s::nat398b的幼苗中,atcsd1基因的表达量均比野生型中的高;而mir398的表达量在p35s::nat398b幼苗中的表达量比野生型低(图17c和d)。这表示过表达atnat398b的确会影响热激条件下拟南芥幼苗中mir398和靶标基因atcsd1的表达
量。
[0207]
实施例13、mir398和atnat398b/c影响拟南芥h2o2积累
[0208]
13.1提高mir398水平增加拟南芥h2o2积累
[0209]
为了在相关植株中检测h2o2水平,本发明人把土壤内生长了19天的植株转移到38℃的光照培养箱处理1小时,然后取莲座叶片在dab染色液中进行染色。本发明人检测发现与野生型相比,csd1突变体在热激处理前后积累了更多的在h2o2(用3,3-diaminobenzidine染色表示),而p35s::csd1转基因植株则积累了更少的h2o2(图18)。当本发明人检测过表达atmir398转基因植株中h2o2水平时,发现在正常生长条件下,p35s::mir398a植株中积累的h2o2水平会比野生型中略多,然而在热激条件下,p35s::mir398a植株中积累的h2o2水平会显著性多于野生型(图18)。然而,在p35s::mir398b和p35s::mir398c过表达植株中,无论热激还是正常生长条件下,h2o2的积累量均比野生型中的少(图18)。这些实验结果表明改变mir398和atcsd1的表达水平影响植株的活性氧的含量,更多的mir398有利于拟南芥积累更多的h2o2,与之对应的是,更少的atcsd1有利于积累更多的h2o2。
[0210]
13.2提高atnat398b/c水平抑制拟南芥h2o2积累
[0211]
为了检测atnat398b/c是否在热激情况下影响植株的活性氧含量,本发明人对p35s::nat398b/c和p35s::amir-nat398b/c转基因植株进行了dab染色法。结果显示在正常的生长温度下,p35s::nat398b和p35s::nat398c过表达植株中h2o2的含量要略少于野生型;而在高温处理后,p35s::nat398b和p35s::nat398c过表达植株中h2o2的含量要显著少于野生型(图18)。在正常的生长温度下,p35s::amir-nat398b和p35s::amir-nat398c转基因植株中h2o2的含量要略多于野生型,而在高温处理后,p35s::amir-nat398b和p35s::amir-nat398c转基因植株中h2o2的含量要显著多于野生型(图18)。
[0212]
因为atnat398b是编码基因,本发明人试图了解atnat398b蛋白是否具有调控植株h2o2含量的功能。本发明人利用crispr/cas9技术构建了相应载体,转基因后代筛选鉴定出3个纯合crnat398b株系,这些株系都导致atnat398b基因氨基酸编码的提前终止(图19)。正常的atnat398b翻译出的蛋白质含277个氨基酸,而多碱基缺失的crnat398b 1#中atnat398b翻译出的蛋白质含84个氨基酸,多碱基插入的crnat398b 2#中含79个氨基酸,单碱基插入的crnat398b 3#中含86个氨基酸。通过检测crnat398b三个株系中mir398以及pri-mir398b和atcsd1的表达量,本发明人发现crnat398b 1#,2#和3#三个株系中pri-mir398b的表达水平与野生型比较没有明显的差异,crnat398b 2#和3#两个株系中atcsd1的表达水平以及mir398的量与野生型比较没有明显的差异,但是crnat398b 1#中mir398的量比野生型中低,且atcsd1的表达水平比野生型中高(图19)。因为crnat398b 1#中多碱基缺失位点位于atmir398c基因的启动子区域,可能会影响pri-mir398c的表达量从而影响了mir398的量,所以本发明人选择对单碱基插入的crnat398b 3#进行dab染色。实验结果表明在热激前后,crnat398b 3#植株中h2o2的积累量均与野生型中的差异不大(图18),这个结果排除了atnat398b蛋白功能对h2o2含量的影响。
[0213]
实施例14、mir398和atnat398b/c影响拟南芥的抗热性
[0214]
14.1提高mir398水平增加拟南芥的抗热性
[0215]
本发明人首先获得了atcsd1基因突变的csd1突变体,并且构建p35s::csd1植株,后代筛选出的纯合植株,利用qrt-pcr手段检测植株中atcsd1的表达量,发现csd1突变体是
一个功能缺失型突变体,而p35s::csd1植株也成功过表达了atcsd1基因。为了确定植株的抗热性,本发明人把土壤内生长了21天的植株转移到38℃的光照培养箱处理3天,然后统计花的存活率。另外还把土壤内生长了16天植株的离体叶片在38℃的环境中处理7小时,然后在22℃恢复5天,再统计叶片的绿化率。通过统计数据,本发明人发现p35s::csd1植株的花存活率和离体叶片绿化率低于野生型,而csd1突变体的花存活率和离体叶片绿化率高于野生型(图20和图21),表明csd1突变体的抗热性强于野生型,而atcsd1过表达植株的抗热性弱于野生型,这与之前报道的结果一致(guan等,2013)。
[0216]
因为atcsd1是mir398的靶标基因,本发明人因此推测mir398过表达可增加拟南芥的抗热性。为了确定过表达atmir398植株的抗热性,本发明人利用相似的抗热性检测方法,发现p35s::mir398a的抗热性强于野生型,而p35s::mir398b和p35s::mir398c的抗热性弱于野生型(图20),因为p35s::mir398a中mir398的表达量高与野生型,而p35s::mir398b和p35s::mir398c中mir398的表达量低与野生型,所以本发明人的结果表明mir398的积累量增加有利于增强拟南芥植株的抗热性。综上所述,本发明人发现拟南芥通过mir398-csd1的调控通路来正向调节拟南芥植株的抗热性。
[0217]
14.2提高atnat398b/c水平降低拟南芥的抗热性
[0218]
为了检测atnat398b基因和atnat398c基因是否调控植株的抗热性。本发明人进一步检测了p35s::amir-nat398b,p35s::amir-nat398c,p35s::nat398b,p35s::nat398c和crnat398b转基因植株的抗热性。抗热性检测方法与p35s::csd1植株的抗热性检测方法相同,花存活率和离体叶片绿化率统计结果表明p35s::amir-nat398b和p35s::amir-nat398c的植株抗热性强于野生型,而p35s::nat398b和p35s::nat398c的抗热性弱于野生型,crnat398b植株的抗热性与野生型差异不大(图21)。这些结果表明atnat398b和atnat398c可以调控植株的抗热性,暗示出atnat398b和atnat398c基因在平衡植株抗热过程中的作用。
[0219]
实施例15、白菜brpnat398b-2过表达降低了mir398的表达量
[0220]
在白菜中,brpmir398b-1和brpmir398b-2有反义基因brpnat398b-1和brpnat398b-2(yu等,2013)。因为拟南芥中的atnat398b和白菜中brpnat398b-2是同源基因,并且在拟南芥中,atnat398b调控它的正义基因atmir398b的表达。本发明人猜测在白菜中brpnat398b-2调控brpmir398b-2并且间接影响mir398的靶标基因。为了验证这个猜测,本发明人构建了brpnat398b-2过表达载体,该过表达载体不同于拟南芥过表达载体,不是利用烟草花叶病毒35s启动子启动的,而是以番茄中的aa6启动子启动的。本发明人把构建的过表达载体paa6::brpnat398b-2利用真空渗入法(bai等,2013)转化进入白菜野生型株系bre中,收取的大量种子经过两个月后熟后通过潮霉素筛选方法筛选。避光三到四天后,放在光照条件下生长,一周后筛选出下胚轴伸长并且生长状态良好的转基因植株三棵。把幼苗移栽进入土壤中,放入温室中正常生长后取样进行dna和rna检测,确定这三棵转基因植株的确是阳性植株,brpnat398b-2过表达量是野生型的十倍左右。接下来本发明人通过northern blot方法检测出三个转基因株系中成熟mir398的表达量,发现它们的表达量均低于野生型。qrt-pcr分析结果显示在转基因植株中,mir398对应的靶标基因brpcsd1和brpcsd2表达量相应的上升(图22)。这些结果暗示出与拟南芥中存在的现象类似,白菜中的brpnat398b-2基因负调控正义基因brpmir398b-2的表达。
[0221]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
