3d人肝器官模型构建方法、3d人肝器官模型及其应用
技术领域
1.本技术涉及生物组织工程技术领域,例如涉及一种3d人肝器官模型构建方法、3d人肝器官模型及其应用。
背景技术:
2.目前,药物引起的肝损伤是药物临床损耗、预防性警告、上市后退市的主要原因。因此,需要更多预测性好的方法用于评估药物发现过程中的肝毒性风险。通常美国fda和欧洲药品管理局会要求候选新药在临床试验之前,需在啮齿类(如鼠)和非啮齿类(如狗)动物上对药物进行毒性评估。现有数据表明,鼠和狗体内的毒性有效预测率只有人类的71%。通过对靶向器官毒性进行调查比较,发现药物在动物和人临床i期的肝毒性表现一致率很低,这是导致临床肝衰竭和药物损耗的主要原因。考虑到这一挑战的规模及对医疗费用和新治疗法发展带来的负面影响,需要发展更多可预测性强,与人类相关性强的未来可替代动物模型的方法。
3.肝细胞是体内肝毒性损伤的靶标,人原代肝细胞(primary human hepatocytes,phhs)包含药物代谢、转运的重要组成成分,被认为是衡量肝功能的金标准。体外传统的2d平板phh单层培养条件下,phh会快速丧失肝表型、肝代谢功能以及细胞活性,并不适合用于肝毒性测试。与常规2d培养方法比,3d肝细胞培养技术可以增强肝表型、代谢活性、以及细胞培养的稳定性。3d肝细胞培养技术是新兴的可用于评估肝毒性机制、筛选肝毒性药物的工具。现有的3d肝培养技术主要包括基于水凝胶、合成支架的3d培养方法和无基质的3d肝球。
4.在实现本公开实施例的过程中,发现相关技术中至少存在如下问题:人工合成的支架材料通常与体内ecm环境有差异,不够仿生。而现有的主流无基质肝球技术,需要长达一周时间预先成球,且生长不容易控制,在肝球中心区域容易发生细胞缺氧导致细胞坏死。基于体内合成天然水凝胶的3d培养技术是最为仿生的3d培养技术,但是此技术尚未应用于肝毒性药物临床前安全性评价,且现有3d人肝器官模型的肝毒性药物响应的灵敏度需要进一步提高。
技术实现要素:
5.为了对披露的实施例的一些方面有基本的理解,下面给出了简单的概括。所述概括不是泛泛评述,也不是要确定关键/重要组成元素或描绘这些实施例的保护范围,而是作为后面的详细说明的序言。
6.本公开实施例提供一种3d人肝器官模型构建方法、3d人肝器官模型及其应用,以解决现有3d人肝器官模型的肝毒性药物响应的灵敏度需要进一步提高的技术问题。
7.在一些实施例中,所述3d人肝器官模型构建方法,包括以下步骤:
8.将人原代肝脏细胞或其与肝脏非实质细胞的混合细胞、或人肝癌细胞系配制成单细胞悬液;
9.将所述单细胞悬液与基质材料混合,得混合细胞悬液;
10.将所述混合细胞悬液接种于3d器官芯片的培养微孔中,然后置于37℃条件下培养,得到成胶3d器官芯片;其中,每个培养微孔中,混合细胞悬液的接种体积为6~10μl,人原代肝脏细胞或其与肝脏非实质细胞的混合细胞的接种细胞个数为2500~25000个,人肝癌细胞系的接种细胞个数为500~10000个;
11.向成胶3d器官芯片的储液孔内加入培养基,再置于37℃条件下培养,得到3d人肝器官模型。
12.在一些实施例中,所述3d人肝器官模型,采用前述的3d人肝器官模型构建方法构建获得。
13.在一些实施例中,所述前述的3d人肝器官模型用于肝毒性药物筛选的应用。
14.本公开实施例提供的3d人肝器官模型构建方法、3d人肝器官模型及其应用,可以实现以下技术效果:
15.本公开实施例的3d人肝器官模型构建方法,通过调控每个培养微孔中的混合细胞悬液的接种体积以及接种的细胞数量,使构建得到的3d人肝器官模型中的细胞呈聚団生长,细胞的球状更饱满,伸出的伪足更多更长。对肝器官模型的肝功能进行表征,结果显示该3d人肝器官模型更加仿生。且构建得到的3d人肝器官模型对肝毒性药物的响应敏感度显著增强,与其他2d人肝器官模型比,已报道有肝毒性药物的肝毒性损伤效应更强,与动物模型相比,该3d人肝器官模型可以有效消除种属差异带来的筛选差异。因此,该3d人肝脏器官模型可以体外检测出更多有肝毒性损伤的药物,且与临床报道更为接近。
16.以上的总体描述和下文中的描述仅是示例性和解释性的,不用于限制本技术。
附图说明
17.一个或多个实施例通过与之对应的附图进行示例性说明,这些示例性说明和附图并不构成对实施例的限定,附图中具有相同参考数字标号的元件示为类似的元件,附图不构成比例限制,并且其中:
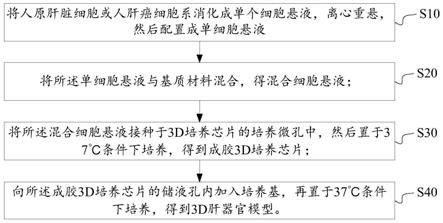
18.图1是本公开实施例提供的一种3d人肝器官模型构建方法的框图;
19.图2是本公开实施例提供的构建得到的一种3d人肝器官模型的细胞形态图;
20.图3是对比例1构建得到的一种2d人肝器官对比模型的细胞形态图;
21.图4是本公开实施例提供的构建得到的一种3d人肝器官模型的细胞生长表征曲线图;
22.图5是对比例1构建得到的一种2d人肝器官对比模型的细胞生长表征曲线图;
23.图6是本公开实施例提供的构建得到的一种3d人肝器官模型和对比例1构建得到的一种2d人肝器官对比模型的白蛋白分泌检测结果对比柱状图;
24.图7是本公开实施例提供的构建得到的一种3d人肝器官模型和对比例1构建得到的一种2d人肝器官对比模型的代谢酶的mrna定量表征图;
25.图8是本公开实施例提供的构建得到的一种3d人肝器官模型和对比例1构建得到的一种2d人肝器官对比模型的肝毒性药物筛选结果图;
26.图9是本公开实施例提供的构建得到的另一种3d人肝器官模型的细胞形态图;
27.图10是是本公开实施例提供的构建得到的另一种3d人肝器官模型的细胞形态图;
28.图11是对比例2构建得到的另一种2d人肝器官对比模型的细胞形态图;
29.图12是对比例3构建得到的一种3d人肝器官对比模型的细胞形态图;
30.图13是本公开实施例提供的构建得到的另一种3d人肝器官模型和对比例2构建得到的一种2d人肝器官对比模型以及对比例3构建得到的3d人肝器官对比模型的细胞生长表征曲线图;
31.图14是本公开实施例提供的构建得到的另一种3d人肝器官模型和对比例2构建得到的一种2d人肝器官对比模型的白蛋白分泌检测结果对比柱状图;
32.图15是本公开实施例提供的构建得到的另一种3d人肝器官模型和对比例2构建得到的一种2d人肝器官对比模型的肝毒性药物筛选结果图;
33.图16是本公开实施例的3d人肝器官模型构建方法采用的一种3d器官芯片的结构示意图;
34.图17是图16所示的3d器官芯片的阶梯剖视结构示意图;
35.附图标记:
36.10、储液层;100、盛液槽;101、间隙;102、边框;11、储液通孔;20、3d培养层;21、培养微孔;30、底板层。
具体实施方式
37.为了能够更加详尽地了解本公开实施例的特点与技术内容,下面结合附图对本公开实施例的实现进行详细阐述,所附附图仅供参考说明之用,并非用来限定本公开实施例。在以下的技术描述中,为方便解释起见,通过多个细节以提供对所披露实施例的充分理解。然而,在没有这些细节的情况下,一个或多个实施例仍然可以实施。在其它情况下,为简化附图,熟知的结构和装置可以简化展示。
38.需要说明的是,在不冲突的情况下,本公开实施例中的实施例及实施例中的特征可以相互组合。
39.结合图1所示,本公开实施例提供一种3d人肝器官模型构建方法,包括以下步骤:
40.s10、将人原代肝脏细胞或其与肝脏非实质细胞的混合细胞、或人肝癌细胞系配制成单细胞悬液;
41.s20、将步骤s10配制的单细胞悬液与基质材料混合,得混合细胞悬液;
42.s30、将步骤s20得到的混合细胞悬液接种于3d器官芯片的培养微孔中,然后置于37℃条件下培养,得到成胶3d器官芯片;其中,每个培养微孔中,混合细胞悬液的接种体积为6~10μl,人原代肝脏细胞的接种细胞个数为2500~25000个,人肝癌细胞系的接种细胞个数为500~10000个;
43.s40、向成胶3d器官芯片的储液孔内加入培养基,再置于37℃条件下培养,得到3d人肝器官模型。
44.本公开实施例的3d人肝器官模型构建方法,通过调控每个培养微孔中的混合细胞悬液的接种体积以及接种的细胞数量,使构建得到的3d人肝器官模型中的细胞呈聚団生长,细胞的球状更饱满,伸出的伪足更多更长。对肝器官模型的肝功能进行表征,结果显示该3d人肝器官模型更加仿生。且构建得到的3d人肝器官模型对肝毒性药物的响应敏感度显著增强,与其他2d人肝器官模型比,已报道有肝毒性药物的肝毒性损伤效应更强,与动物模
型相比,该3d人肝器官模型可以有效消除种属差异带来的筛选差异。因此,该3d人肝脏器官模型可以体外检测出更多有肝毒性损伤的药物,且与临床报道更为接近。
45.本公开实施例构建得到的3d人肝器官模型系统可实现三维仿生肝器官和高通量肝毒性药物筛选相结合的体外模型,用于体外肝毒性化合物筛选及相关研究。该肝器官模型,在白蛋白表达、尿素分泌等肝功能指标上有了显著提高,主要代谢酶的mrna表达也显著增强,对肝毒性药物的响应更加敏感。
46.本公开实施例中,采用的3d器官芯片中,培养孔包括连通且同轴设置的培养微孔和储液孔,储液孔的孔径大于培养微孔的孔径。
47.本公开实施例中,采用人原代肝脏细胞、或人原代肝脏细胞与其他肝脏非实质细胞的混合细胞、或人肝癌细胞系作为模型细胞进行构建肝器官模型,可以通过现有扩增方法扩增获得,也可以采购得到。
48.可选地,人原代肝脏细胞与肝脏非实质细胞的混合细胞中,按照体内真实比例进行混合。可选地,肝脏非实质细胞为kuffer细胞、血管内皮细胞、星型细胞中的一种或几种。
49.本公开实施例的步骤s10中,单细胞悬液的配制方法采用现有常规手段即可。单细胞悬液的密度可依据步骤s20的混合细胞悬液中单细胞悬液与基质材料的混合比例,以及步骤s30中每个培养微孔中的接种体积和接种细胞个数等因素确定。
50.在一些实施例中,步骤s10中,将人原代肝脏细胞或其与肝脏非实质细胞的混合细胞消化成单个细胞悬液,离心重悬,然后配制成密度为4.45~44.5
×
106cell/ml的单细胞悬液。可选地,配制成密度为5~30
×
106cell/ml的单细胞悬液。可选地,配制成密度为6~20
×
106cell/ml的单细胞悬液。可选地,配制成密度为7~10
×
106cell/ml的单细胞悬液。
51.可选地,步骤s10中,将人原代肝脏细胞或其与肝脏非实质细胞的混合细胞消化成单个细胞悬液,离心重悬,然后配制成密度为8.9
×
106cell/ml的单细胞悬液。
52.在一些实施例中,步骤s10中,将人肝癌细胞系hepg2消化成单个细胞悬液,离心重悬,然后配制成密度为0.89~8.9
×
106cell/ml的单细胞悬液。可选地,配制成密度为1~8
×
106cell/ml的单细胞悬液。可选地,配制成密度为2~6
×
106cell/ml的单细胞悬液。可选地,配制成密度为3~4
×
106cell/ml的单细胞悬液。
53.可选地,将人肝癌细胞系hepg2消化成单个细胞悬液,离心重悬,然后配制成密度为3.56
×
106cell/ml的单细胞悬液。
54.在一些实施例中,步骤s10中,利用0.25(vt.)%胰酶将2d培养的处于生长期人肝癌细胞系消化成单个细胞悬液。
55.在一些实施例中,步骤s10中,复苏一支液氮保存的人原代肝脏细胞,将人原代肝脏细胞稀释成单个细胞悬液。
56.在一些实施例中,步骤s20中,混合细胞悬液的ph值为6.5~7.5。可选地,混合细胞悬液的ph值为6.5~6.7。通过控制基质材料的ph值来调节混合细胞悬液的ph值至合适范围内。
57.在一些实施例中,步骤s20中,基质材料包括但不限于胶原、基质胶和天然来源的水凝胶中一种或几种;当基质材料采用几种时,混合比例不限定。
58.可选地,天然来源的水凝胶包括但不限于琼脂、壳聚糖、海藻酸盐、明胶、纤粘蛋白、层粘连蛋白等。
59.可选地,基质材料为包括胶原和基质胶的混合基质材料;其中,胶原和基质胶的体积比为1﹕0.5~2。可选地,胶原和基质胶的体积比为1﹕0.8~1。
60.在一些实施例中,步骤s20中,混合细胞悬液的制备方法为:向基质材料中加入碱性溶液,将基质材料的ph值调节至6.5~7.5,然后将单细胞悬液与基质材料混合,即得混合细胞悬液。
61.可选地,碱性溶液可以采用naoh、nahco3、naoh和nahco3中一种或多种的混合液。
62.可选地,单细胞悬液与基质材料的混合体积比为5.6﹕2.4,其中基质材料的的浓度为5mg/ml。
63.在一些实施例中,步骤s30中,每个培养微孔中,混合细胞悬液的接种体积为6~9μl。可选地,每个培养微孔中,混合细胞悬液的接种体积为7~8μl。
64.在一些实施例中,步骤s30中,每个培养微孔中,人原代肝脏细胞的接种细胞个数为5000~15000个。可选地,人原代肝脏细胞的接种细胞个数为8000~12000个。
65.在一些实施例中,步骤s30中,每个培养微孔中,人肝癌细胞系的接种细胞个数为500~5000个。可选地,人肝癌细胞系的接种细胞个数为500~3000个。
66.在一些实施例中,步骤s40中,向成胶3d器官芯片的储液孔内加入培养基之后,还包括:向成胶3d器官芯片的防蒸发结构中加入缓冲液。增加3d器官芯片的湿度,降低蒸发程度,减少细胞培养基消耗,提高构建的肝器官模型的性能。
67.本公开实施例中,采用的3d器官芯片中,在培养孔包括连通且同轴设置的培养微孔和储液孔,储液孔的孔径大于培养微孔的孔径。培养芯片上还设置有防蒸发结构,例如,如图16和图17所示的一种3d器官芯片中所示的间隙101即为防蒸发结构,即在培养孔区域周围设置的凹槽,作为一种防蒸发通道,在防蒸发通道内填充缓冲液即可。如图16和图17所示,一种3d器官芯片,包括顺次层状设置的储液层10、3d培养层20和底板层30。储液层10,具有多个储液通孔11,储液通孔11用于储存培养液;3d培养层20,具有多个培养微孔21,培养微孔21用于3d细胞培养;储液通孔11与培养微孔21一一对应。储液通孔11为储液柱孔,在通孔储液区的周围的储液层上围设边框102,形成盛液槽100。通孔储液区与边框102的内侧壁(即,盛液槽的内周壁)之间设置间隙101。间隙101呈环形,该间隙101可以作为溶液通道,为pbs缓冲液提供通道,用于增加整个孔板的湿度,降低蒸发程度。本公开实施例可采用的3d器官芯片具体可以参考公告号为cn209989412u的专利名称为一种3d高通量器官微芯片的实用新型专利中公开的内容。
68.可选地,缓冲液采用pbs缓冲液(磷酸盐缓冲溶液)。
69.本公开实施例还提供了一种3d人肝器官模型,采用前述的3d人肝器官模型构建方法构建获得。
70.本公开实施例还提供了一种3d人肝器官模型用于肝毒性药物筛选的应用。
71.本公开实施例中,在肝毒性药物筛选中,药物包括尼法唑酮、舒尼替尼、他莫昔芬、氯普鲁马嗪、波生坦、罗格列酮、辛伐他汀、塞来昔布、四环素、格拉非宁、舒林酸、阿米替林、维拉帕米、甲苯磺丁脲和扑热息痛。
72.下面给出具体实施例以说明本公开实施例的3d人肝器官模型构建方法。
73.实施例1
74.一种3d人肝器官模型构建方法,包括以下步骤:
75.s11、用0.25(vt.)%胰酶将2d培养的处于生长期的人肝癌细胞系hepg2消化成单个细胞悬液,离心重悬,然后配制成密度为3.35~8.9
×
106cell/ml的单细胞悬液;
76.s21、在1.5ml ep管中,按照单细胞悬液与所述基质材料的体积比为5.6﹕2.4的比例,加入单细胞悬液和基质材料,移液枪吹打混和均匀,得混合细胞悬液;其中,基质材料为胶原和基质胶的混合基质材料,胶原和基质胶的体积比为1﹕1,且胶原的浓度为2.5mg/ml,基质胶的浓度为5mg/ml。
77.s31、用移液排枪,将混合细胞悬液快速高通量转移接种于3d器官芯片的培养微孔中,然后置于细胞培养箱中,37℃条件下培养10min,保证胶原可以很好地成胶,取出,得到成胶3d器官芯片;其中,每个培养微孔中,混合细胞悬液的接种体积为8μl,人肝癌细胞系的接种细胞个数为2000~10000个。
78.s41、向步骤s31得到的成胶3d器官芯片的储液孔内加入培养基,再向成胶3d器官芯片的防蒸发通道中加入pbs缓冲液。再置于37℃条件下培养,得到3d人肝器官模型。
79.本实施例1中,构建得到3d人肝器官模型ⅰ。其中,依据步骤s31中,每个培养微孔中接种细胞个数的不同,构建得到不同的3d人肝器官模型ⅰ。
80.3d人肝器官模型
ⅰ-
1,通过步骤s31中每个培养微孔中的细胞个数为2000个构建得到的。
81.3d人肝器官模型
ⅰ-
2,通过步骤s31中每个培养微孔中的细胞个数为3000个构建得到的。
82.3d人肝器官模型
ⅰ-
3,通过步骤s31中每个培养微孔中的细胞个数为5000个构建得到的。
83.本实施例1中,对3d人肝器官模型ⅰ进行f-actin and nuclear染色表征。如图2所示的3d人肝器官模型
ⅰ-
1的细胞形态图,可见,3d人肝器官模型ⅰ中肝细胞在3d平台上呈球状生长,并伸长伪足。如图4所示的3d人肝器官模型ⅰ的细胞生长表征曲线图,可见,在3d人肝器官模型ⅰ上,细胞可稳定生长并保持活力长达12天,适合进行慢性毒性筛选。其中,图4中,“—
■
—”为3d人肝器官模型
ⅰ-
1的细胞生长曲线,“—
▲
—”为3d人肝器官模型
ⅰ-
2的细胞生长曲线,“—
▼
—”为3d人肝器官模型
ⅰ-
3的细胞生长曲线。
84.本实施例1中,对3d人肝器官模型ⅰ进行肝功能表征。其中,分别对培养5天和7天的3d人肝器官模型
ⅰ-
1进行白蛋白分泌检测,如图6所示。其中灰色柱为本实施例1的3d人肝器官模型
ⅰ-
1;黑色柱为对比例1的2d肝器官对比模型ⅰ。结果表明与2d肝模型相比,5天时的3d模型
ⅰ-
1的白蛋白分泌量是2d对比模型ⅰ的2.2倍,7天时的3d模型
ⅰ-
1的白蛋白分泌量是2d对比模型ⅰ的1.8倍,3d肝模型的白蛋白分泌量呈显著性增加(p<0.005)。
85.如图7所示,培养7天的3d人肝器官模型
ⅰ-
1相对于对比例1的2d对比模型ⅰ的代谢酶的mrna定量表征图。定量肝模型细胞系表达酶的mrna(相同批次细胞,2d平板消化的细胞悬液一部分用于2d提mrna,一部分接种形成3d肝脏器官模型,3d-2000细胞数种植7天之后提mrna),结果表明与2d肝模型相比,3d肝模型上的多数代谢酶mrna表达量呈明显增加,增加量可高达100倍。
86.如图8所示,为本实施例1的3d人肝器官模型
ⅰ-
1(图中灰色柱)和对比例1的2d肝器官对比模型ⅰ(图中黑色柱)的肝毒性药物筛选结果图。其中,药物编号1-15代表的药物依次为:尼法唑酮、舒尼替尼、他莫昔芬、氯普鲁马嗪、波生坦、罗格列酮、辛伐他汀、塞来昔布、四
环素、格拉非宁、舒林酸、阿米替林、维拉帕米,甲苯磺丁脲和扑热息痛。肝毒性药物筛选结果表明:与2d细胞系肝器官对比模型药物筛选结果相比,在3d细胞系肝器官脏模型上,有更多的肝毒性药物(如编号5、6、8、12、13)可以被检测出更强的肝毒性抑制。总体上,本实施例1构建的3d人肝器官模型,对肝毒性药物的响应敏感度呈显著增强。可知,编号5、6、8、12、13的药物为临床上认定为肝毒性低的药物,可见,本实施例1的3d人肝器官模型ⅰ的肝毒性药物筛选结果具有很强的临床指导意义。
87.实施例2
88.一种3d人肝器官模型构建方法,包括以下步骤:
89.s12、复苏一支液氮保存的人原代肝脏细胞,将人原代肝脏细胞稀释成单个细胞悬液,离心重悬,然后配制成密度为4.45~44.5
×
106cell/ml的单细胞悬液。
90.s22、在1.5ml ep管中,按照单细胞悬液与所述基质材料的体积比为5.6﹕2.4的比例,加入单细胞悬液和基质材料,移液枪吹打混和均匀,得混合细胞悬液;其中,基质材料为胶原和基质胶的混合基质材料,胶原和基质胶的体积比为1﹕1,且胶原的浓度为2.5mg/ml,基质胶的浓度为5mg/ml。
91.s32、用移液排枪,将混合细胞悬液快速高通量转移接种于3d器官芯片的培养微孔中,然后置于细胞培养箱中,37℃条件下培养10min,保证胶原可以很好地成胶,取出,得到成胶3d器官芯片;其中,每个培养微孔中,混合细胞悬液的接种体积为8μl,人原代肝脏细胞的接种细胞个数为2500~25000个。
92.s42、向步骤s32得到的成胶3d器官芯片的储液孔内加入培养基,再向成胶3d器官芯片的防蒸发通道中加入pbs缓冲液。再置于37℃条件下培养,得到3d人肝器官模型。
93.本实施例2构建得到3d人肝器官模型ⅱ。其中,依据步骤s32中,每个培养微孔中接种细胞个数的不同,构建得到不同的3d人肝器官模型ⅱ。
94.3d人肝器官模型
ⅱ-
1,通过步骤s32中每个培养微孔中接种细胞个数为3000个构建得到的。
95.3d人肝器官模型
ⅱ-
2,通过步骤s32中每个培养微孔中接种细胞个数为5000个构建得到的。
96.3d人肝器官模型
ⅱ-
3,通过步骤s32中每个培养微孔中接种细胞个数为15000个构建得到的。
97.3d人肝器官模型
ⅱ-
4,通过步骤s32中每个培养微孔中接种细胞个数为25000个构建得到的。
98.本实施例2中,对3d人肝器官模型ⅱ进行f-actin and nuclear染色表征。如图9所示的3d人肝器官模型
ⅱ-
2的细胞形态图,以及如图10所示的3d人肝器官模型
ⅱ-
4的细胞形态图,可见,3d人肝器官模型ⅱ中肝细胞在3d平台上呈球状生长,并伸长伪足。
99.如图13中“—
●
—”所示的3d人肝器官模型
ⅱ-
2的细胞生长表征曲线,可见,在3d人肝器官模型
ⅱ-
2上,细胞可稳定生长并保持活力长达15天,适合进行慢性毒性筛选。图13中“—
■
—”所示的3d人肝器官模型
ⅱ-
4的细胞生长表征曲线,可见,在3d人肝器官模型
ⅱ-
4上,细胞可稳定生长并保持活力长达12天,也适合进行慢性毒性筛选。而图13中“—
▼
—”所示的对比例2的2d人肝器官对比模型ⅱ的细胞生长表征曲线,在2d人肝器官对比模型ⅱ上,表明细胞最长只能生长5天,活力会进入下降状态,且在2d人肝器官对比模型ⅱ上的整
体活力明显低于在3d人肝器官模型
ⅱ-
2和模型
ⅱ-
4上的活力。图13中“—
▲
—”所示的对比例3的3d人肝器官对比模型ⅲ的细胞生长表征曲线,虽然一直呈活力上升状态,但是其整体活力明显低于本实施例2的3d人肝器官模型
ⅱ-
2和模型
ⅱ-
4,可知,在3d人肝器官模型中,单个细胞活性随接种细胞数增加而有所降低。
100.本实施例2中,对3d人肝器官模型ⅱ进行肝功能表征。其中,分别对培养12天和18天的3d人肝器官模型
ⅱ-
2进行白蛋白分泌检测,如图14所示。其中灰色柱为本实施例2的3d人肝器官模型
ⅱ-
2;黑色柱为对比例2的2d肝器官对比模型ⅱ。结果表明与2d对比模型ⅱ相比,12天时的3d模型
ⅱ-
2的白蛋白分泌量是2d对比模型ⅱ的12倍,18天时的3d模型
ⅱ-
2的白蛋白分泌量是2d对比模型ⅱ的6倍,呈显著性增加(p<0.005)。
101.如图15所示,为本实施例2的3d人肝器官模型
ⅱ-
2(图中灰色柱)和对比例2的2d人肝器官对比模型ⅱ(图中黑色柱)的肝毒性药物筛选结果图。其中,药物编号1-15代表的药物依次为:尼法唑酮、舒尼替尼、他莫昔芬、氯普鲁马嗪、波生坦、罗格列酮、辛伐他汀、塞来昔布、四环素、格拉非宁、舒林酸、阿米替林、维拉帕米,甲苯磺丁脲和扑热息痛。肝毒性药物筛选结果表明:与2d细胞系肝器官对比模型药物筛选结果相比,在3d细胞系肝器官脏模型上,有更多的肝毒性药物(如编号5、6、7、9、10、13、15)可以被检测出更强的肝毒性抑制。总体上,本实施例2构建的3d人肝器官模型,对肝毒性药物的响应敏感度呈显著增强。可知,编号5、6、7、9、10、13和15的药物为临床上认定为肝毒性低的药物,可见,本实施例2的3d人肝器官模型ⅱ的肝毒性药物筛选结果具有很强的临床指导意义。
102.下面提供一些对比例,以与本公开实施例的实施例进行对比分析。
103.对比例1
104.一种2d肝器官模型构建方法,包括以下步骤:
105.s11
′
、用0.25(vt.)%胰酶将2d培养的处于生长期的人肝癌细胞系hepg2消化成单个细胞悬液,离心重悬,然后配制成密度为0.18~1.34
×
106cell/ml的单细胞悬液。
106.s21
′
、按照单细胞悬液与培养基体的体积比为5.6﹕94.4的比例,将单细胞悬液与培养基体混合,得混合细胞悬液;培养基体采用1640培养基。
107.s31
′
、将所述混合细胞悬液接种于96孔板(100μl/孔)中,每孔中接种细胞个数为2000~7500个;然后置于37℃条件下培养,得到2d人肝器官模型。
108.对比例1构建得到2d人肝器官对比模型ⅰ。其中,依据步骤s31
′
中,每个培养微孔中的接种细胞个数的不同,构建得到不同的2d人肝器官对比模型ⅰ。2d人肝器官对比模型
ⅰ-
1,每个培养微孔中的细胞个数为2000个构建得到的。2d人肝器官对比模型
ⅰ-
2,每个培养微孔中的细胞个数为5000个构建得到的。2d人肝器官对比模型
ⅰ-
3,每个培养微孔中的细胞个数为7500个构建得到的。
109.本对比例1中,对2d人肝器官对比模型ⅰ进行f-actin and nuclear染色表征。如图3所示的2d人肝器官对比模型
ⅰ-
1的细胞形态图,可见,2d肝器官对比模型ⅰ中肝细胞呈单层铺展贴壁生长。如图5所示的2d人肝器官对比模型ⅰ的细胞生长表征曲线图,可见,在2d人肝器官对比模型ⅰ上,表明细胞最长只能生长6天,活力会进入下降状态。其中,图5中,“—
●
—”为2d对比模型
ⅰ-
1的细胞生长曲线,“—
■
—”为2d对比模型
ⅰ-
2的细胞生长曲线,“—
▲
—”为2d对比模型
ⅰ-
3的细胞生长曲线。
110.对比例2
111.一种2d肝器官模型构建方法,包括以下步骤:
112.s12
′
、复苏一支液氮保存的人原代肝脏细胞,将人原代肝脏细胞消化成单个细胞悬液,离心重悬,然后配制成密度为1.78
×
106cell/ml的单细胞悬液。
113.s22
′
、按照单细胞悬液与培养基体的体积比为50﹕50的比例,将单细胞悬液与培养基体混合,得混合细胞悬液;培养基体采用配套的原代肝脏细胞培养基。
114.s32
′
、将所述混合细胞悬液接种于96孔板中,每孔中接种细胞个数为50000个;然后置于37℃条件下培养,得到2d原代肝脏模型。
115.对比例2构建得到2d人肝器官对比模型ⅱ。
116.本对比例2中,对2d人肝器官对比模型ⅱ进行f-actin and nuclear染色表征。如图11所示的2d人肝器官对比模型ⅱ的细胞形态图,可见,2d人肝器官对比模型ⅱ中肝细胞呈单层铺展贴壁生长。
117.对比例3
118.一种3d人肝器官对比模型构建方法,包括以下步骤:
119.s13
′
、复苏一支液氮保存的人原代肝脏细胞,将人原代肝脏细胞消化成单个细胞悬液,离心重悬,然后配制成密度为7.14
×
106cell/ml的单细胞悬液。
120.s23
′
、在1.5ml ep管中,按照单细胞悬液与所述基质材料的体积比为5.6﹕2.4的比例,加入单细胞悬液和基质材料,移液枪吹打混和均匀,得混合细胞悬液;其中,基质材料为胶原和基质胶的混合基质材料,胶原和基质胶的体积比为1﹕1,且胶原的浓度为2.5mg/ml,基质胶的浓度为5mg/ml。
121.s33
′
、用移液排枪,将混合细胞悬液快速高通量转移接种于3d器官芯片的培养微孔中,然后置于细胞培养箱中,37℃条件下培养10min,保证胶原可以很好地成胶,取出,得到成胶3d器官芯片;其中,每个培养微孔中的细胞个数为35000~40000个;
122.s43
′
、向成胶3d器官芯片的储液孔内加入培养基,再向成胶3d器官芯片的防蒸发液通道中加入pbs缓冲液。再置于37℃条件下培养,得到3d人肝器官模型。
123.对比例3构建得到3d人肝器官对比模型ⅲ。
124.本对比例3中,对3d人肝器官对比模型ⅲ进行f-actin and nuclear染色表征。如图12所示的3d人肝器官对比模型ⅲ的细胞形态图,可见,几乎看不到细胞的伪足,仿生性变差。
125.本公开实施例中,实施例2中的人原代肝脏细胞可以采用人原代肝脏细胞与肝脏非实质细胞的混合细胞代替,获得的3d人肝器官模型,其各项检测结果同实施例2相似,在此不再赘述。
126.本公开实施例中,对肝器官模型进行的检测采用如下技术手段进行:
127.1、肝模型细胞增殖能力表征:用细胞atp表征试剂盒cell titer 3d glo对细胞的活性及增殖状态进行表征,对同一批次构建的肝模型每天进行检测定量,连续表征7天。
128.2、肝功能定量:本部分采用商品化的试剂盒,对构建好的2d、3d人肝器官模型进行肝功能白蛋白、代谢酶表达的mrna进行定量表征。
129.3、肝毒性药物筛选:将提前溶解于dmso的15种待测试肝毒性药物,按照测试浓度,用合适培养基配制,将上述构建培养4days的3d肝细胞系器官模型,以及培养24h的2d肝细胞系器官模型培养基全部移除,加入包含100μm肝毒性药物的细胞培养基100μl,2d器官模
型继续培养24-72h,3d肝毒性器官模型继续培养3-8days。3d人肝器官模型长时间给药测试中,单次给药100μm,如需重复给药,中间换药,保持浓度。每个3d人肝器官模型和2d肝器官模型都需要设置空白组、阴性对照组和阳性对照组,每组设置6个副孔。
130.4、药敏结果检测:本3d肝毒性药物筛选系统可以使用现有的药敏检测手段进行表征,细胞代谢能力评价体系,如加入cell titer blue,比较细胞代谢能力,对药物作用效果进行评价。药物孵育完成之后,移除带有药物的培养基,加入cell titer blue原液:完全培养基=1:5的混合液100μl,37℃下孵育3h,检测波长:560em/590ex nm。如加入cell titer 3d glo对3d肝模型的atp进行评价,进而对药物作用效果进行评价。药物孵育完成之后,移除带有药物的培养基,加入cell titer 3d glo原液:完全培养基=1:1的混合液100μl,常温孵育0.5h,采用luminescence模式进行检测。如高内涵成像技术对活死细胞的数量进行成像表征,以及对细胞线粒体活性、膜电位进行表征对肝毒性药物进行评价。本实施案例适用于,但不限于上述表征方法。
131.本公开实施例中,本肝器官芯片药物筛选系统可以使用现有的atp、代谢能力检测手段对药物作用后的肝细胞活性进行表征,也可以使用线粒体膜电位试剂盒或者线粒体活性氧自由基试剂盒对细胞线粒体功能进行表征,也可以使用肝功能表征试剂盒如白蛋白、α-gst对模型的肝功能进行表征。因此,可以使用单参数以及多参数对药物的肝毒性作用结果进行表征。
132.以上描述和附图充分地示出了本公开的实施例,以使本领域的技术人员能够实践它们。其他实施例可以包括结构的以及其他的改变。实施例仅代表可能的变化。除非明确要求,否则单独的部件和功能是可选的,并且操作的顺序可以变化。一些实施例的部分和特征可以被包括在或替换其他实施例的部分和特征。本公开的实施例并不局限于上面已经描述并在附图中示出的结构,并且可以在不脱离其范围进行各种修改和改变。本公开的范围仅由所附的权利要求来限制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。