细胞周期蛋白依赖性激酶的抑制剂
相关申请的交叉引用
1.本技术要求2019年7月17日提交的第62/875,168号美国临时申请的权益,该美国临时申请通过引用并入本技术的公开内容中。
背景技术:
2.细胞周期蛋白依赖性激酶(cdk)是一类多功能酶,其修饰参与细胞周期进程的各种蛋白质底物。具体而言,cdk通过将磷酸基团从atp转移到其底物中的特定氨基酸段上而对其底物进行磷酸化。cdk的失调与包括癌症在内的许多人类疾病的病因有关。
技术实现要素:
3.本文提供了细胞周期蛋白依赖性激酶(cdk)的抑制剂,包含所述化合物的药物组合物,以及使用所述化合物治疗疾病的方法。
4.一个实施方案提供了一种化合物或其药学上可接受的盐或溶剂化物,其具有式(i)的结构:其中,环a是任选取代的选自吡啶、吡嗪、嘧啶、喹啉、异喹啉、喹唑啉、吡唑并吡啶、吡唑并嘧啶、噻吩并嘧啶、噻吩并吡啶、吡啶并吡啶、吡啶并嘧啶或三氮烯的杂芳基;w选自具有以下结构的基团:
t是1或2;u是0、1或2;r1、r2和r3各自独立地选自氢、任选取代的c1-c4烷基或任选取代的杂环基(烷基);r4是氢或任选取代的c1-c4烷基,或任选地,如果r3是任选取代的c1-c4烷基且r4是任选取代的c1-c4烷基,则r3和r4连接在一起形成环;r5选自氢、-cn、-nh2、卤素、任选取代的c1-c4烷基、任选取代的c1-c4烷氧基或任选取代的c1-c4氨基烷基;r6选自氢、-cn、-nh2、卤素、任选取代的c1-c4烷基、任选取代的c1-c4烷氧基或任选取代的c1-c4氨基烷基;x为n或c-h;y为n或c-l1-r
11
;z为n或c-l2-r7;l1和l2各自独立地是键、-o-或-n(r8)-;r7选自氢、-cn、卤素、任选取代的c1-c4烷基、任选取代的c3-c7碳环基、任选取代的碳环基(烷基)、任选取代的杂环基、任选取代的杂环基(烷基);r8为氢或任选取代的c1-c4烷基;r9选自氢或任选取代的c1-c4烷基;r
10
选自氢或任选取代的c1-c4烷基;且r
11
选自氢、-cn、卤素、-nh2、任选取代的c1-c4烷基、任选取代的c3-c7碳环基、任选取代的碳环基(烷基)、任选取代的杂环基或任选取代的杂环基(烷基)。
5.一个实施方案提供了一种药物组合物,其包含式(i)化合物或其药学上可接受的盐或溶剂化物,以及至少一种药学上可接受的赋形剂。
6.一个实施方案提供了一种治疗有需要的患者的疾病或病症的方法,其包括向所述患者施用式(i)化合物或其药学上可接受的盐或溶剂化物。另一个实施方案提供了所述方法,其中所述疾病或病症是癌症。
7.一个实施方案提供了一种治疗有需要的患者的癌症的方法,其包括向所述患者施用一种药物组合物,该组合物包含式(i)化合物或其药学上可接受的盐或溶剂化物,以及至少一种药学上可接受的赋形剂。援引并入
8.本说明书中提到的所有出版物、专利和专利申请均为了此处所述的具体目的而通过引用并入本文。
具体实施方式
9.如在本文中和在所附权利要求书中所用的,单数形式“一种”、“一个”和“所述”包括复数指代物,除非上下文另有明确说明。因此,例如,提及“一种药剂”包括多种这样的药剂,而提及“所述细胞”包括提及一种或多种细胞(或多个细胞)和本领域技术人员已知的其等同物,等等。当本文针对物理性质如分子量或化学性质如化学式使用范围时,旨在包括本文中范围和具体实施方案的所有组合和子组合。当提及数字或数值范围时使用的术语“约”是指所提及的数字或数值范围为在实验可变性范围内(或者在统计实验误差范围内)的近似值,因此在一些情况下,该数字或数值范围将在所述数字或数值范围的1%至15%之间变
化。术语“包含”(以及相关的术语,如“包括”或“具有”或“含有”)并非旨在排除,在其他某些实施方案中,例如,本文描述的任何物质组成、组合物、方法或过程等的实施方案“由所述特征组成”或“基本上由所述特征组成”。定义
10.如在本说明书及所附权利要求书中所使用的,除非指出意思相反,否则下列术语具有以下所述的含义。
[0011]“氨基”指-nh2基团。
[0012]“氰基”是指-cn基团。
[0013]“硝基”是指-no2基团。
[0014]“氧杂”是指-o-基团。
[0015]“氧代”是指=o基团。
[0016]“硫代”是指=s基团。
[0017]“亚氨基”是指=n-h基团。
[0018]“肟基”是指=n-oh基团。
[0019]“肼基”是指=n-nh2基团。
[0020]“烷基”是指仅由碳原子和氢原子组成、不含不饱和度、具有1-15个碳原子(例如,c
1-c
15
烷基)的直链或支链的烃链基团。在某些实施方案中,烷基包含1至13个碳原子(例如,c
1-c
13
烷基)。在某些实施方案中,烷基包含1-8个碳原子(例如,c
1-c8烷基)。在其他实施方案中,烷基包含1至5个碳原子(例如,c
1-c5烷基)。在其他实施方案中,烷基包含1至4个碳原子(例如,c
1-c4烷基)。在其他实施方案中,烷基包含1至3个碳原子(例如,c
1-c3烷基)。在其他实施方案中,烷基包含1至2个碳原子(例如,c
1-c2烷基)。在其他实施方案中,烷基包含1个碳原子(例如,c1烷基)。在其他实施方案中,烷基包含5至15个碳原子(例如,c
5-c
15
烷基)。在其他实施方案中,烷基包含5至8个碳原子(例如,c
5-c8烷基)。在其他实施方案中,烷基包含2至5碳原子(例如,c
2-c5烷基)。在其他实施方案中,烷基包含3至5个碳原子(例如,c
3-c5烷基)。在其他实施方案中,所述烷基选自甲基、乙基、1-丙基(正丙基)、1-甲基乙基(异丙基)、1-丁基(正丁基)、1,1-甲基丙基(仲丁基)、2-甲基丙基(异丁基)、1,1-二甲基乙基(叔丁基)、1-戊基(正戊基)。烷基通过单键与分子的其余部分连接。除非在说明书中另有明确规定,否则烷基任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0021]“烷氧基”是指式-o-烷基的通过氧原子键合的基团,其中烷基为如上定义的烷基链。
[0022]“烯基”是指仅由碳原子和氢原子组成、含有至少一个碳-碳双键且具有2-12个碳原子的直链或支链的烃链基团。在某些实施方案中,烯基包含2至8个碳原子。在其他实施方案中,烯基包含2至4个碳原子。该烯基通过单键与分子的其余部分连接,例如,乙烯基、丙-1-烯基(即烯丙基)、丁-1-烯基、戊-1-烯基、戊-1,4-二烯基等。除非在说明书中另有明确规定,否则烯基任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0023]“炔基”是指仅由碳原子和氢原子组成、含有至少一个碳-碳三键、具有2-12个碳原子的直链或支链的烃链基团。在某些实施方案中,炔基包含2至8个碳原子。在其他实施方案中,炔基包含2至6个碳原子。在其他实施方案中,炔基包含2至4个碳原子。炔基通过单键与分子的其余部分连接,例如,乙炔基、丙炔基、丁炔基、戊炔基、己炔基等。除非在说明书中另有明确规定,否则炔基任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0024]“亚烷基”或“亚烷基链”指连接分子的其余部分与基团的直链或支链二价烃链,其仅由碳和氢组成,不包含不饱和度并具有1-12个碳原子,例如,亚甲基、亚乙基、亚丙基、亚正丁基等。亚烷基链通过单键与分子的其余部分连接并通过单键与基团连接。亚烷基链与分子的其余部分以及与基团的连接点是通过亚烷基链中的一个碳或通过链内的任意两个碳。在某些实施方案中,亚烷基包含1至8个碳原子(例如,c
1-c8亚烷基)。在其他实施方案中,亚烷基包含1至5个碳原子(例如,c
1-c5亚烷基)。在其他实施方案中,亚烷基包含1至4个碳原子(例如,c
1-c4亚烷基)。在其他实施方案中,亚烷基包含1至3个碳原子(例如,c
1-c3亚烷基)。在其他实施方案中,亚烷基包含1至2个碳原子(例如,c
1-c2亚烷基)。在其他实施方案中,亚烷基包含1个碳原子(例如,c1亚烷基)。在其他实施方案中,亚烷基包含5至8个碳原子(例如,c
5-c8亚烷基)。在其他实施方案中,亚烷基包含2至5个碳原子(例如,c
2-c5亚烷基)。在其他实施方案中,亚烷基包含3至5个碳原子(例如,c
3-c5亚烷基)。除非在说明书中另有明
确规定,否则亚烷基链任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0025]“亚烯基”或“亚烯基链”是指将分子的其余部分与基团连接的直链或支链二价烃链,其仅由碳和氢组成,含有至少一个碳-碳双键,并且具有2至12个碳原子。亚烯基链通过单键连接至分子的其余部分,并且通过单键连接至基团。在某些实施方案中,亚烯基包含2至8个碳原子(例如,c
2-c8亚烯基)。在其他实施方案中,亚烯基包含2至5个碳原子(例如,c
2-c5亚烯基)。在其他实施方案中,亚烯基包含2至4个碳原子(例如,c
2-c4亚烯基)。在其他实施方案中,亚烯基包含2至3个碳原子(例如,c
2-c3亚烯基)。在其他实施方案中,亚烯基包含2个碳原子(例如,c2亚烯基)。在其他实施方案中,亚烯基包含5至8个碳原子(例如,c
5-c8亚烯基)。在其他实施方案中,亚烯基包含3至5个碳原子(例如,c
3-c5亚烯基)。除非在说明书中另有明确规定,否则亚烯基链任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0026]“亚炔基”或“亚炔基链”是指将分子的其余部分与基团连接的直链或支链二价烃链,其仅由碳和氢组成,含有至少一个碳-碳三键,并且具有2至12个碳原子。亚炔基链通过单键连接至分子的其余部分,并且通过单键连接至基团。在某些实施方案中,亚炔基包含2至8个碳原子(例如,c
2-c8亚炔基)。在其他实施方案中,亚炔基包含2至5个碳原子(例如,c
2-c5亚炔基)。在其他实施方案中,亚炔基包含2至4个碳原子(例如,c
2-c4亚炔基)。在其他实施方案中,亚炔基包含2至3个碳原子(例如,c
2-c3亚炔基)。在其他实施方案中,亚炔基包含2个碳原子(例如,c2亚炔基)。在其他实施方案中,亚炔基包含5至8个碳原子(例如,c
5-c8亚炔基)。在其他实施方案中,亚炔基包含3至5个碳原子(例如,c
3-c5亚炔基)。除非在说明书中另有明确规定,否则亚炔基链任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s
(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0027]“氨基烷基”是指-n(烷基)2基团,其中每个“烷基”独立地如上所定义,例如,二甲基氨基((ch3)2n-)、乙基(甲基)氨基(c2h5n(ch3)-、(2-氨基乙基)(甲基)氨基(h2n-ch2ch2n(ch3)-)、(2-(二甲基氨基)乙基)(甲基)氨基(ch3)2n-ch2ch2n(ch3)-)等。在一些实施方案中,氨基烷基基团的烷基部分如以上针对烷基所述任选地被取代。
[0028]“芳基”是指通过从环碳原子上去除氢原子而由芳族单环或多环烃环体系衍生的基团。芳族单环或多环烃环体系仅包含氢和来自5-18个碳原子的碳,其中该环系中的至少一个环是完全不饱和的,即,其根据休克尔(h
ü
ckel)理论包含环状、离域的(4n 2)π-电子体系。衍生出芳基的环系包括但不限于诸如苯、芴、茚满、茚、四氢化萘和萘等基团。除非在说明书中另有明确说明,否则术语“芳基”或前缀“芳”(如在“芳烷基”中)意在包括任选地被一个或多个独立地选自以下的取代基所取代的芳基基团:烷基、烯基、炔基、卤代、氟烷基、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、环烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、环烷基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代),每个rb独立地为直接键或直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上述取代基中的每一个为未取代的。
[0029]“芳烷基”是指式-r
c-芳基的基团,其中rc为如上文所定义的亚烷基链,例如,亚甲基、亚乙基等。芳烷基基团的亚烷基链部分如上文针对亚烷基链所述任选地被取代。芳烷基基团的芳基部分如上文针对芳基所述任选地被取代。
[0030]“芳烯基”是指式-r
d-芳基的基团,其中rd为如上文所定义的亚烯基链。芳烯基基团的芳基部分如上文针对芳基所述任选地被取代。芳烯基基团的亚烯基链部分如上文针对亚烯基所述任选地被取代。
[0031]“芳炔基”是指式-r
e-芳基的基团,其中re为如上文所定义的亚炔基链。芳炔基基团的芳基部分如上文针对芳基所述任选地被取代。芳炔基基团的亚炔基链部分如上文针对亚
炔基链所述任选地被取代。
[0032]“芳烷氧基”是指式-o-r
c-芳基的通过氧原子键合的基团,其中rc为如上文所定义的亚烷基链,例如,亚甲基、亚乙基等。芳烷基的亚烷基链部分如上文针对亚烷基链所述任选地被取代。芳烷基基团的芳基部分如上文针对芳基所述任选地被取代。
[0033]“碳环基”是指仅由碳和氢原子组成的稳定的非芳族单环或多环烃基团,其包括稠环或桥环体系,具有3至15个碳原子。在某些实施方案中,碳环基包含3至10个碳原子。在其他实施方案中,碳环基包含5至7个碳原子。该碳环基通过单键与分子的其余部分连接。碳环基是饱和的(即仅包含单一c-c键)或不饱和的(即含有一个或多个双键或三键)。完全饱和的碳环基基团还被称为“环烷基”。单环环烷基的实例包括,例如,环丙基、环丁基、环戊基、环己基、环庚基和环辛基。不饱和的碳环基还被称为“环烯基”。单环环烯基的实例包括,例如,环戊烯基、环己烯基、环庚烯基和环辛烯基。多环碳环基基团包括,例如,金刚烷基、降冰片基(即,双环[2.2.1]庚烷基)、降冰片烯基、十氢萘基、7,7-二甲基-双环[2.2.1]庚烷基等。除非在说明书中另有明确说明,否则术语“碳环基”意在包括任选地被一个或多个独立地选自以下的取代基所取代的碳环基基团:烷基、烯基、炔基、卤代、氟烷基、氧代、硫代、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、环烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、环烷基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代),每个rb独立地为直接键或直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上述取代基中的每一个为未取代的。
[0034]“碳环基烷基”是指式-r
c-碳环基的基团,其中rc为如上文所定义的亚烷基链。亚烷基链和碳环基基团如上文所述任选地被取代。
[0035]“碳环基炔基”是指式-r
c-碳环基的基团,其中rc为如上文所定义的亚炔基链。亚炔基链和碳环基基团如上文所述任选地被取代。
[0036]“碳环基烷氧基”是指式-o-r
c-碳环基的通过氧原子键合的基团,其中rc为如上所定义的亚烷基链。亚烷基链和碳环基基团如上文所述任选地被取代。
[0037]
如本文所用的,“羧酸生物电子等排体”是指表现出与羧酸部分类似的物理、生物和/或化学性质的官能团或部分。羧酸生物电子等排体的实例包括但不限于:
等。
[0038]“卤代”或“卤素”是指溴代、氯代、氟代或碘代取代基。
[0039]“氟烷基”是指被一个或多个如上定义的氟代基团取代的如上定义的烷基基团,例如,三氟甲基、二氟甲基、氟甲基、2,2,2-三氟乙基、1-氟甲基-2-氟乙基等。在一些实施方案中,氟烷基的烷基部分如以上针对烷基所述任选地被取代。
[0040]“杂环基”是指稳定的3至18元非芳族环基团,其包含2至12个碳原子和1至6个选自氮、氧和硫的杂原子。除非在说明书中另有明确说明,否则杂环基基团是单环、双环、三环或四环的环系,其任选地包括稠环或桥环体系。杂环基基团中的杂原子任选地被氧化。如果存在一个或多个氮原子,其任选地被季铵化。杂环基是部分或完全饱和的。杂环基通过环中的任何原子连接至分子的其余部分。这类杂环基基团的实例包括但不限于二氧戊环基、噻吩基[1,3]二噻烷基、十氢异喹啉基、咪唑啉基、咪唑烷基、异噻唑烷基、异噁唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、2-氧代哌嗪基、2-氧代哌啶基、2-氧代吡咯烷基、噁唑烷基、哌啶基、哌嗪基、4-哌啶酮基、吡咯烷基、吡唑烷基、奎宁环基、噻唑烷基、四氢呋喃基、三噻烷基、四氢吡喃基、硫代吗啉基、硫杂吗啉基、1-氧代-硫代吗啉基和1,1-二氧代-硫代吗啉基。除非在说明书中另有明确说明,否则术语“杂环基”意在包括任选地被一个或多个选自以下的取代基所取代的如上定义的杂环基基团:烷基、烯基、炔基、卤代、氟烷基、氧代、硫代、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、环烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、环烷基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代),每个rb独立地为直接键或直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上述取代基中的每一个为未取代的。
[0041]“n-杂环基”或“n-连接的杂环基”是指含有至少一个氮的如上定义的杂环基基团,并且其中杂环基基团与分子的其余部分的连接点是通过杂环基基团中的氮原子。n-杂环基基团如上文针对杂环基基团所述任选地被取代。这样的n-杂环基基团的实例包括但不限于1-吗啉基、1-哌啶基、1-哌嗪基、1-吡咯烷基、吡唑烷基、咪唑啉基和咪唑烷基。
[0042]“c-杂环基”或“c-连接的杂环基”是指含有至少一个杂原子的如上定义的杂环基基团,并且其中杂环基基团与分子的其余部分的连接点是通过杂环基基团中的碳原子。c-杂环基基团如上文针对杂环基基团所述任选地被取代。这样的c-杂环基基团的实例包括但
不限于2-吗啉基、2-或3-或4-哌啶基、2-哌嗪基、2-或3-吡咯烷基等。
[0043]“杂环基烷基”是指式-r
c-杂环基的基团,其中rc为如上所定义的亚烷基链。如果杂环基为含氮的杂环基,则该杂环基任选地在该氮原子处连接至烷基基团。杂环基烷基基团的亚烷基链如上文针对亚烷基链所述任选地被取代。杂环基烷基基团的杂环基部分如上文针对杂环基所述任选地被取代。
[0044]“杂环基烷氧基”是指式-o-r
c-杂环基的通过氧原子键合的基团,其中rc为如上所定义的亚烷基链。如果杂环基为含氮的杂环基,则该杂环基任选地在该氮原子处连接至烷基基团。杂环基烷氧基基团的亚烷基链如上文针对亚烷基链所述任选地被取代。杂环基烷氧基基团的杂环基部分如上文针对杂环基所述任选地被取代。
[0045]“杂芳基”是指由包含2至17个碳原子以及1至6个选自氮、氧和硫的杂原子的3至18元芳环基团衍生的基团。如本文所用的,杂芳基基团是单环、双环、三环或四环环系,其中该环系中的至少一个环是完全不饱和的,即,其根据休克尔理论包含环状、离域的(4n 2)π
–
电子体系。杂芳基包括稠合或桥连的环系。杂芳基基团中的杂原子任选地被氧化。如果存在一个或多个氮原子,其任选地被季铵化。杂芳基通过环中的任何原子与分子的其余部分连接。杂芳基的实例包括但不限于氮杂基、吖啶基、苯并咪唑基、苯并吲哚基、1,3-苯并二氧戊环基、苯并呋喃基、苯并噁唑基、苯并[d]噻唑基、苯并噻二唑基、苯并[b][1,4]二氧杂基、苯并[b][1,4]噁嗪基、1,4-苯并二噁烷基、苯并萘并呋喃基(benzonaphthofuranyl)、苯并噁唑基、苯并二氧戊环基、苯并二噁英基(benzodioxinyl)、苯并吡喃基、苯并吡喃酮基(benzopyranonyl)、苯并呋喃基、苯并呋喃酮基(benzofuranonyl)、苯并噻吩基(benzothienyl)(benzothiophenyl)、苯并噻吩并[3,2-d]嘧啶基、苯并三唑基、苯并[4,6]咪唑并[1,2-a]吡啶基、咔唑基、噌啉基、环戊并[d]嘧啶基、6,7-二氢-5h-环戊并[4,5]噻吩并[2,3-d]嘧啶基、5,6-二氢苯并[h]喹唑啉基、5,6-二氢苯并[h]噌啉基、6,7-二氢-5h-苯并[6,7]环庚并[1,2-c]哒嗪基、二苯并呋喃基、二苯并噻吩基、呋喃基、呋喃酮基、呋喃并[3,2-c]吡啶基、5,6,7,8,9,10-六氢环辛并[d]嘧啶基、5,6,7,8,9,10-六氢环辛并[d]哒嗪基、5,6,7,8,9,10-六氢环辛并[d]吡啶基、异噻唑基、咪唑基、吲唑基、吲哚基、吲唑基、异吲哚基、吲哚啉基、异吲哚啉基、异喹啉基、吲嗪基、异噁唑基、5,8-甲桥-5,6,7,8-四氢喹唑啉基、萘啶基、1,6-萘啶酮基(1,6-naphthyridinonyl)、噁二唑基、2-氧代氮杂基、噁唑基、环氧乙烷基、5,6,6a,7,8,9,10,10a-八氢苯并[h]喹唑啉基、1-苯基-1h-吡咯基、吩嗪基、吩噻嗪基、吩噁嗪基、酞嗪基、蝶啶基、嘌呤基、吡咯基、吡唑基、吡唑并[3,4-d]嘧啶基、吡啶基、吡啶并[3,2-d]嘧啶基、吡啶并[3,4-d]嘧啶基、吡嗪基、嘧啶基、哒嗪基、吡咯基、喹唑啉基、喹喔啉基、喹啉基、异喹啉基、四氢喹啉基、5,6,7,8-四氢喹唑啉基、5,6,7,8-四氢苯并[4,5]噻吩并[2,3-d]嘧啶基、6,7,8,9-四氢-5h-环庚并[4,5]噻吩并[2,3-d]嘧啶基、5,6,7,8-四氢吡啶并[4,5-c]哒嗪基、噻唑基、噻二唑基、三唑基、四唑基、三嗪基、噻吩并[2,3-d]嘧啶基、噻吩并[3,2-d]嘧啶基、噻吩并[2,3-c]吡啶基和噻吩基(thiophenyl)(即噻吩基(thienyl))。除非在说明书中另有明确说明,否则术语“杂芳基”意在包括任选地被一个或多个选自以下的取代基所取代的如上所定义的杂芳基基团:烷基、烯基、炔基、卤代、氟烷基、卤代烯基、卤代炔基、氧代、硫代、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代
的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、环烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、环烷基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代),每个rb独立地为直接键或直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上述取代基中的每一个为未取代的。
[0046]“n-杂芳基”是指含有至少一个氮的如上定义的杂芳基基团,并且其中该杂芳基基团与分子的其余部分的连接点是通过该杂芳基基团中的氮原子。n-杂芳基基团如上文针对杂芳基基团所述任选地被取代。
[0047]“c-杂芳基”是指如上所定义的杂芳基,其中该杂芳基基团与分子的其余部分的连接点是通过该杂芳基基团中的碳原子。c-杂芳基基团如上文针对杂芳基基团所述任选地被取代。
[0048]“杂芳基烷基”是指式
–rc-杂芳基的基团,其中rc为如上所定义的亚烷基链。如果杂芳基为含氮的杂芳基,则该杂芳基任选地在该氮原子处与烷基基团连接。杂芳基烷基基团的亚烷基链如上文针对亚烷基链所定义的任选地被取代。杂芳基烷基基团的杂芳基部分如上文针对杂芳基所定义的任选地被取代。
[0049]“杂芳基烷氧基”是指式
–
o-r
c-杂芳基的通过氧原子键合的基团,其中rc为如上所定义的亚烷基链。如果杂芳基为含氮杂芳基,则该杂芳基任选地在氮原子处与烷基连接。杂芳基烷氧基基团的亚烷基链如上文针对亚烷基链所述任选地被取代。杂芳基烷氧基基团的杂芳基部分如上文针对杂芳基所定义的任选地被取代。
[0050]
在一些实施方案中,本文公开的化合物含有一个或多个不对称中心,因此产生了对映异构体、非对映异构体以及根据绝对立体化学被定义为(r)-或(s)-的其他立体异构形式。除非另有说明,否则本公开意在涉及本文公开的化合物的所有立体异构形式。当本文所述的化合物含有烯烃双键时,除非另有说明,否则本公开意在同时包括e和z几何异构体(例如,顺式或反式)。同样,还意在包括所有可能的异构体,以及其外消旋形式和光学纯形式,和所有互变异构形式。术语“几何异构体”是指烯烃双键的e或z几何异构体(例如顺式或反式)。术语“位置异构体”是指围绕中心环的结构异构体,如围绕苯环的邻位、间位和对位异构体。
[0051]“互变异构体”是指这样的分子,其中质子从分子的一个原子移动到同一分子的另一原子是可能的。在某些实施方案中,本文提供的化合物作为互变异构体存在。在可能发生互变异构的情形下,将存在互变异构体的化学平衡。互变异构体的确切比例取决于若干因素,包括物理状态、温度、溶剂和ph。互变异构平衡的一些实例包括:
[0052]
在一些实施方案中,本文公开的化合物以不同的富集同位素形式使用,例如,富含2h、3h、
11
c、
13
c和/或
14
c含量的形式。在一个特定实施方案中,所述化合物在至少一个位置处被氘化。这类氘化形式可通过美国专利5,846,514和6,334,997所述的程序制备。如美国专利5,846,514和6,334,997所述,氘化可改善代谢稳定性和/或功效,从而增加药物的作用持续时间。
[0053]
除非另有说明,否则本文所示的结构旨在包括仅在是否存在一个或多个同位素富集的原子方面不同的化合物。例如,除了氢被氘或氚替代或者碳被
13
c-或
14
c-富集的碳替代之外具有本结构的化合物也在本公开的范围内。
[0054]
本公开的化合物任选地在构成此类化合物的一个或多个原子处含有非天然比例的原子同位素。例如,可使用同位素如氘(2h)、氚(3h)、碘-125(
125
i)或碳-14(
14
c)标记化合物。用2h、
11
c、
13
c、
14
c、
15
c、
12
n、
13
n、
15
n、
16
n、
16
o、
17
o、
14
f、
15
f、
16
f、
17
f、
18
f、
33
s、
34
s、
35
s、
36
s、
35
cl、
37
cl、
79
br、
81
br、
125
i进行的同位素取代均在预期之内。在一些实施方案中,考虑用
18
f进行同位素取代。本发明化合物的所有同位素变化,无论是否为放射性的,均包括在本发明的范围内。
[0055]
在某些实施方案中,本文公开的化合物的一些或全部1h原子被2h原子替代。含氘化合物的合成方法是本领域已知的,仅作为非限制性实例,包括以下合成方法。
[0056]
使用各种方法来合成氘取代的化合物,所述方法例如描述于:dean,dennis c.编.recent advances in the synthesis and applications of radiolabeled compounds for drug discovery and development.[curr.,pharm.des.,2000;6(10)]2000,第110页;george w.;varma,rajender s.the synthesis of radiolabeled compounds via organometallic intermediates,tetrahedron,1989,45(21),6601-21;以及evans,e.anthony.synthesis of radiolabeled compounds,j.radioanal.chem.,1981,64(1-2),9-32。
[0057]
氘化起始材料容易获得,并且经受本文所述的合成方法以提供含氘化合物的合成。大量的含氘试剂和结构单元可以从化学供应商如aldrich chemical co.商购获得。
[0058]
适用于亲核取代反应的氘转移试剂如碘甲烷-d3(cd3i)易于获得,并且可用于在亲核取代反应条件下将氘取代的碳原子转移至反应底物。仅举例而言,cd3i的使用在以下的反应方案中示出。
[0059]
使用氘转移试剂如氘化铝锂(liald4)在还原条件下将氘转移至反应底物。仅举例而言,liald4的使用在以下的反应方案中示出。
[0060]
仅举例而言,如以下的反应方案所示,使用氘气和钯催化剂来还原不饱和的碳-碳键,并进行芳基碳-卤素键的还原性取代。
[0061]
在一个实施方案中,本文公开的化合物含有一个氘原子。在另一个实施方案中,本文公开的化合物含有两个氘原子。在另一个实施方案中,本文公开的化合物含有三个氘原子。在另一个实施方案中,本文公开的化合物含有四个氘原子。在另一个实施方案中,本文公开的化合物含有五个氘原子。在另一个实施方案中,本文公开的化合物含有六个氘原子。在另一个实施方案中,本文公开的化合物含有多于六个氘原子。在另一个实施方案中,本文公开的化合物完全被氘原子取代,并且不含不可交换的1h氢原子。在一个实施方案中,氘并入的水平由使用氘化合成结构单元作为起始材料的合成方法决定。
[0062]“药学上可接受的盐”包括酸加成盐和碱加成盐。任一种本文所述的细胞周期蛋白依赖性激酶(cdk)抑制剂化合物的药学上可接受的盐均意在包括任何和所有药学上合适的盐形式。本文所述化合物的优选的药学上可接受的盐是药学上可接受的酸加成盐和药学上可接受的碱加成盐。
[0063]“药学上可接受的酸加成盐”是指保留了游离碱的生物有效性和性质的那些盐,其在生物学上或其他方面不是不合需要的,并且其是用诸如盐酸、氢溴酸、硫酸、硝酸、磷酸、氢碘酸、氢氟酸、亚磷酸等无机酸形成的。还包括用如下有机酸形成的盐:诸如脂肪族单羧酸和二羧酸、苯基取代的链烷酸、羟基链烷酸、链烷二酸、芳族酸、脂肪族和芳族磺酸等,并且包括例如乙酸、三氟乙酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。因此,示
例性的盐包括硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、硝酸盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐、氯化物、溴化物、碘化物、乙酸盐、三氟乙酸盐、丙酸盐、辛酸盐、异丁酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、扁桃酸盐、苯甲酸盐、氯苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、邻苯二甲酸盐、苯磺酸盐、甲苯磺酸盐、苯乙酸盐、柠檬酸盐、乳酸盐、苹果酸盐、酒石酸盐、甲磺酸盐等。还涉及氨基酸的盐如精氨酸盐、葡糖酸盐和半乳糖醛酸盐(参见,例如,berge s.m.等人,"pharmaceutical salts,"journal of pharmaceutical science,66:1-19(1997))。在一些实施方案中,碱性化合物的酸加成盐通过按照熟练技术人员熟悉的方法和技术使其游离碱形式与足量的所需酸接触以产生盐而制备。
[0064]“药学上可接受的碱加成盐”是指保留了游离酸的生物有效性和性质的那些盐,其在生物学上或其他方面不是不合需要的。这些盐是通过向游离酸中加入无机碱或有机碱而制备的。在一些实施方案中,药学上可接受的碱加成盐用金属或胺如碱金属和碱土金属或有机胺形成。源于有机碱的盐包括但不限于钠盐、钾盐、锂盐、铵盐、钙盐、镁盐、铁盐、锌盐、铜盐、锰盐、铝盐等。源于有机碱的盐包括但不限于下列有机碱的盐:伯胺、仲胺和叔胺,取代的胺(包括天然存在的取代的胺),环胺和碱离子交换树脂,例如,异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、二乙醇胺、2-二甲基氨基乙醇、2-二乙基氨基乙醇、二环己基胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、n,n-二苄基乙二胺、氯普鲁卡因、海巴明(hydrabamine)、胆碱、甜菜碱、乙二胺、亚乙基二苯胺、n-甲基葡糖胺、葡糖胺、甲基葡糖胺、可可碱(theobromine)、嘌呤、哌嗪、哌啶、n-乙基哌啶、聚胺树脂等。参见berge等人,同上。
[0065]“药学上可接受的溶剂化物”是指作为溶剂加成形式的物质的组成物。在一些实施方案中,溶剂化物含有化学计量或非化学计量的量的溶剂,并且在与药学上可接受的溶剂如水、乙醇等制备的过程中形成。当溶剂为水时形成水合物,或者当溶剂为醇时形成醇化物。本文所述化合物的溶剂化物在本文所述的工艺中方便地制备或形成。本文提供的化合物任选地以非溶剂化形式以及溶剂化形式存在。术语“对象”或“患者”包括哺乳动物。哺乳动物的实例包括但不限于哺乳动物类的任何成员:人类、非人类灵长类动物(如黑猩猩)以及其他猿类和猴类;农场动物,如牛、马、羊、山羊、猪;家畜,如兔子、狗和猫;实验动物,包括啮齿动物,如大鼠、小鼠和豚鼠等。在一个方面中,哺乳动物是人。
[0066]
如本文所用的,“治疗”或“处理”或“减轻”或“改善”可互换使用。这些术语是指获得有益的或期望的结果(包括但不限于治疗益处和/或预防益处)的途径。所谓“治疗益处”是指所治疗的潜在病症的消除或改善。另外,治疗益处也可以如下实现:一种或多种与该潜在病症相关的生理学症状得到根除或改善,使得在患者中观察到起色,虽然该患者仍受该潜在病症的折磨。对于预防益处,在一些实施方案中,将所述组合物施用于处于发生特定疾病的风险中的患者,或报告疾病的一种或多种生理学症状的患者,即便尚未作出该疾病的诊断。细胞周期蛋白依赖性激酶
[0067]
细胞周期蛋白依赖性激酶(cdk)是丝氨酸/苏氨酸蛋白激酶家族,其已知在细胞周期调节、代谢、基因转录、rna加工和dna修复过程中起作用,每种cdk起着不同的作用(malumbres,m.,2014,genome biol.15(6),122-132;lim等人,2013,development 140,
rep.14,320-331)。影响蛋白激酶结构域的cdk13突变与先天性心脏病、发育迟缓和智力障碍有关(hamilton等人,2017,j.med.genet.55(1),28-38)。已知cdk13与剪接因子srsf1相互作用,并调节hiv mrna的选择性剪接(berro等人,2008,j.virol.82,7155-7166)。
[0076]
cdk抑制化合物在文献中已有描述。参见,例如:gao等人,2018,cell chem.biol.25(2),135-142;wo2017/044858;wo2016/210296;wo2016/201370;ficarro等人,2016,anal.chem.88(24),12248-12254;wo2016/160617;zhang等人,2016,nature chem.biol.12(10),876-884;wo2016/105528;wo2015/058126;和wo2015/058163。其他实例包括:wo2015/124941;ali等人,2009,cancer res.69(15),6208-6215;wo2016/193939;bajrami等人,2014,cancer res.74(1),287-297;li等人,2017,cancer res.77(14),3834
–
3845;cayrol等人,2017,nature commun.8:14290,1
–
11;johnson等人,2016,cell reports 17(9),2367-2381;kalan等人,2017,cell reports 21(2),467-481;christensen等人,2014,cancer cell 26(6),909-922;iniguez等人,2018,cancer cell 33(2),202-216;mertins等人,2016,nature534(7605),55
–
62;nagaraja等人,2017,cancer cell 31(5),635-652;naidoo等人,2017,mol.cancer ther.17(1),306-315;paculova等人,2017,cell div.12:7,1-10;和evan等人,2017,clin.cancer res.23(7),1647-1655。基于cdk在细胞周期调节、代谢、基因转录、rna加工和dna修复过程中的作用,认为改变cdk活性的化合物可用于治疗或预防各种病症,包括癌症。在一些实施方案中,本文描述了细胞周期蛋白依赖性激酶(cdk)的小分子抑制剂。在一些实施方案中,本文描述了包含细胞周期蛋白依赖性激酶(cdk)的小分子抑制剂的药物组合物。在其他实施方案中,细胞周期蛋白依赖性激酶(cdk)的小分子抑制剂用于治疗或预防有需要的对象的疾病或病况。
[0077]
在一些实施方案中,本文所述的杂芳族cdk抑制化合物用于治疗或预防有需要的对象的癌症。在一些实施方案中,包含本文所述的杂芳族cdk抑制化合物的药物组合物用于治疗或预防有需要的对象的癌症。在一些实施方案中,本文公开了一种治疗癌症的方法,其包括向有需要的对象施用治疗有效量的本文所述的杂芳族cdk抑制化合物。在一些实施方案中,本文公开了一种治疗癌症的方法,其包括向有需要的对象施用治疗有效量的包含本文所述的杂芳族cdk抑制化合物的药物组合物。在一些实施方案中,本文公开了一种治疗癌症的方法,其包括向先前已被诊断出患有癌症的对象施用治疗有效量的本文所述的杂芳族cdk抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk7、cdk9、cdk12和cdk13抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk7抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk9抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk12抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk13抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk7和cdk9抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk7和cdk12抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk7和cdk13抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk9和cdk12抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk9和cdk13抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk12和cdk13抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk7、cdk9和cdk12抑制化合物。
[0078]
在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk7、cdk9和cdk13抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk7、cdk12和cdk13抑制化合物。在一些实施方案中,杂芳族cdk抑制化合物为杂芳族cdk9、cdk12和cdk13抑制化合物。杂芳族cdk抑制化合物
[0079]
在一个方面,本文提供了杂芳族cdk抑制化合物。
[0080]
一个实施方案提供了一种化合物或其药学上可接受的盐或溶剂化物,其具有式(i)的结构:其中,环a是任选取代的选自吡啶、吡嗪、嘧啶、喹啉、异喹啉、喹唑啉、吡唑并吡啶、吡唑并嘧啶、噻吩并嘧啶、噻吩并吡啶、吡啶并吡啶、吡啶并嘧啶或三氮烯的杂芳基;w选自具有以下结构的基团:t是1或2;u是0、1或2;r1、r2和r3各自独立地选自氢、任选取代的c1-c4烷基或任选取代的杂环基(烷基);r4是氢或任选取代的c1-c4烷基,或任选地,如果r3是任选取代的c1-c4烷基且r4是任选取代的c1-c4烷基,则r3和r4连接在一起形成环;r5选自氢、-cn、-nh2、卤素、选取代的c1-c4烷基、任选取代的c1-c4烷氧基或任选取代的c1-c4氨基烷基;r6选自氢、-cn、-nh2、卤素、任选取代的c1-c4烷基、任选取代的c1-c4烷氧基或任选取代的c1-c4氨基烷基;x为n或c-h;
y为n或c-l1-r
11
;z为n或c-l2-r7;l1和l2各自独立地是键、-o-或-n(r8)-;r7选自氢、-cn、卤素、任选取代的c1-c4烷基、任选取代的c3-c7碳环基、任选取代的碳环基(烷基)、任选取代的杂环基、任选取代的杂环基(烷基);r8为氢或任选取代的c1-c4烷基;r9选自氢或任选取代的c1-c4烷基;r
10
选自氢或任选取代的c1-c4烷基;且r
11
选自氢、-cn、卤素、-nh2、任选取代的c1-c4烷基、任选取代的c3-c7碳环基、任选取代的碳环基(烷基)、任选取代的杂环基或任选取代的杂环基(烷基)。
[0081]
一个实施方案提供了一种式(i)化合物或其药学上可接受的盐或溶剂化物,其具有式(ia)的结构:其中,环a是任选取代的选自吡啶、吡嗪、嘧啶、喹啉、异喹啉、喹唑啉、吡唑并吡啶、吡唑并嘧啶、噻吩并嘧啶、噻吩并吡啶、吡啶并吡啶或吡啶并嘧啶的杂芳基;w选自具有以下结构的基团:t是1或2;u是0、1或2;r1、r2和r3各自独立地地选自氢、任选取代的c1-c4烷基或任选取代的杂环基(烷基);r4是氢或任选取代的c1-c4烷基,或任选地,如果r3是任选取代的c1-c4烷基且r4是
任选取代的c1-c4烷基,则r3和r4连接在一起形成环;r5选自氢、-cn、-nh2、卤素、任选取代的c1-c4烷基、任选取代的c1-c4烷氧基或任选取代的c1-c4氨基烷基;r6选自氢、-cn、-nh2、卤素、任选取代的c1-c4烷基、任选取代的c1-c4烷氧基或任选取代的c1-c4氨基烷基;x为n或c-h;y为n或c-l1-r
11
;z为n或c-l2-r7;l1和l2各自独立地地是键、-o-或-n(r8)-;r7选自氢、-cn、卤素、任选取代的c1-c4烷基、任选取代的c3-c7碳环基、任选取代的碳环基(烷基)、任选取代的杂环基、任选取代的杂环基(烷基);r8是氢或任选取代的c1-c4烷基;r9选自氢或任选取代的c1-c4烷基;r
10
选自氢或任选取代的c1-c4烷基;且r
11
选自氢、-cn、卤素、-nh2、任选取代的c1-c4烷基、任选取代的c3-c7碳环基、任选取代的碳环基(烷基)、任选取代的杂环基或任选取代的杂环基(烷基)。
[0082]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中w选自:
[0083]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中w选自:
[0084]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中w选自:
[0085]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中w选自:
[0086]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中w为:
[0087]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中w为:
[0088]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r2是氢。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r3是氢。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r2和r3是氢。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r1是氢。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r1是任选取代的c1-c4烷基。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r1是任选取代的c1-c2烷基。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r1是任选取代的c1烷基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中所述c1烷基被任选取代的氨基取代。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中任选取代的氨基为二甲基氨基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r1是-ch
2-n(me)2。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r1是任选取代的杂环基烷基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中所述任选取代的杂环基烷基包括任选取代的c1烷基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中所述任选取代的杂环基烷基包括任选取代的n-连接的杂环基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中,任选取代的n-连接的杂环基是n-连接的吡咯烷或哌啶。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r4是氢。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r4是任选取代的c1-c4烷基。
[0089]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r5是氢。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r6是氢。
[0090]
另一个实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中x为n。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中x为c-h。
[0091]
另一实施方案提供式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中y为n。
[0092]
另一实施方案提供式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中y为c-l1-r
11
。另一实施方案提供该化合物或其药学上可接受的盐或溶剂化物,其中l1是键。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中l1为-o-。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中l1为-nh-。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中l1为-n(r8)-,且r8是任选取代的c1-c4烷基。
[0093]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r
11
是氢。另一实施方案提供了式(i)的化合物或其药学上可接受的盐或溶剂化物,其中r
11
是任选取代的c1-c4烷基。另一实施方案提供了式(i)的化合物或其药学上可接受的盐或溶剂化物,其中r
11
是任选取代的杂环基。
[0094]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中z为n。
[0095]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中z为c-l2-r7。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中l2是键。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中l2为-o-。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中l2为-nh-。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中l2为-n(r8)-,且r8是任选取代的c1-c4烷基。
[0096]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r7是氢。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r7是任选取代的c1-c4烷基。另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中r7是任选取代的杂环基。
[0097]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的吡啶。
[0098]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的吡嗪。
[0099]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的嘧啶。
[0100]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的嘧啶-2-基。
[0101]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的喹啉。
[0102]
另一实施方案提供了式(i或(ia))的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的异喹啉。
[0103]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的喹唑啉。
[0104]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的喹唑啉-2-基。
[0105]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的吡唑并吡啶。
[0106]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的吡唑并嘧啶。
[0107]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的噻吩并嘧啶。
[0108]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的噻吩并[3,2-d]嘧啶-2-基。
[0109]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的噻吩并吡啶。
[0110]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的噻吩并[3,2-d]吡啶。
[0111]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的吡啶并吡啶。
[0112]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的吡啶并嘧啶。
[0113]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的吡啶并[3,4-d]嘧啶-2-基。
[0114]
另一实施方案提供了式(i)的化合物或其药学上可接受的盐或溶剂化物,其中环a是任选取代的三氮烯。
[0115]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a被选自氢、-cn、卤素、任选取代的c1-c4烷基、任选取代的c1-c6烯基、任选取代的c1-c6炔基、任选取代的c3-c7碳环基、任选取代的碳环基(烷基)、任选取代的杂环基、任选取代的杂环基(烷基)、任选取代的c1-c4烷氧基、任选取代的c6芳氧基、-nh2、-oh或任选取代的c1-c4氨基烷基的取代基任选地取代。
[0116]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a选自:其中,r
15
选自氢、卤素、-cn、任选取代的烷基、任选取代的氟烷基、任选取代的烷氧基、任选取代的环烷基、任选取代的杂环基、任选取代的环烷基烷基、任选取代的环烷基-o-、任选取代的芳基、任选取代的芳烷基、任选取代的芳氧基、任选取代的芳烷基氧基、任选取代的
so2r
21
、-n(r
22
)so2r
21
、-so2n(r
22
)2、
–
n(r
22
)so2n(r
22
)2、-con(r
22
)2、-n(r
22
)co2r
21
、-n(r
22
)con(r
22
)2、-n(r
22
)cor
21
、-oc(o)n(r
22
)2、-oso2n(r
22
)2或-n(r
22
)so3r
21
。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
16
选自氢、卤素、-cn和任选取代的烷基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
16
是氢。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
16
选自任选取代的烷基、任选取代的烯基或任选取代的炔基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
16
选自任选取代的炔基。
[0119]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a为:
[0120]
另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
15
选自氢、卤素、-cn和任选取代的烷基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
15
是氢。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
16
选自氢、卤素、-cn、任选取代的烷基、任选取代的氟烷基、任选取代的烷氧基、任选取代的环烷基、任选取代的杂环基、任选取代的环烷基烷基、任选取代的环烷基-o-、任选取代的芳基、任选取代的芳烷基、任选取代的杂芳基、任选取代的杂芳烷基、任选取代的芳氧基、任选取代的芳烷基氧基、任选取代的杂芳氧基、任选取代的杂芳烷基氧基、-or
22
、-n(r
22
)2、-so2r
21
、-n(r
22
)so2r
21
、-so2n(r
22
)2、
–
n(r
22
)so2n(r
22
)2、-con(r
22
)2、-n(r
22
)co2r
21
、-n(r
22
)con(r
22
)2、-n(r
22
)cor
21
、-oc(o)n(r
22
)2、-oso2n(r
22
)2或-n(r
22
)so3r
21
。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
16
选自氢、卤素、-cn和任选取代的烷基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
16
是氢。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
16
选自任选取代的烷基、任选取代的烯基或任选取代的炔基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
16
选自任选取代的炔基。
[0121]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a为:且r
16
不是氢。
[0122]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a为:且r
16
是卤素。
[0123]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,
其中环a为:且r
16
选自任选取代的烷基、任选取代的烯基或任选取代的炔基。
[0124]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a为:r
15
是氢,r
16
选自任选取代的炔基,且r
17
是氢或任选取代的烷氧基。
[0125]
另一实施方案提供了式(i)或(ia)的化合物或其药学上可接受的盐或溶剂化物,其中环a为:r
15
是氢,r
16
选自卤素、-cn、任选取代的烷基、任选取代的氟烷基、任选取代的烯基、任选取代的炔基,且r
17
是氢或任选取代的烷氧基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
17
是氢。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
18
选自氢、卤素、-cn和任选取代的烷基。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
18
是氢。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
15
和r
16
是氢。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
17
和r
18
是氢。另一实施方案提供了该化合物或其药学上可接受的盐或溶剂化物,其中r
15
和r
17
是氢。
[0126]
在一些实施方案中,本文所述的式(i)或(ia)的杂芳族cdk抑制化合物具有表1提供的结构。表1
化合物的制备
[0127]
在本文所述的反应中使用的化合物根据本领域技术人员已知的有机合成技术,从可商购获得的化学品和/或从化学文献中描述的化合物开始进行制备。“可商购获得的化学品”从标准商业来源获得,该商业来源包括acros organics(pittsburgh,pa)、aldrich chemical(milwaukee,wi,包括sigma chemical和fluka)、apin chemicals ltd.(milton park,uk)、avocado research(lancashire,u.k.)、bdh inc.(toronto,canada)、bionet(cornwall,u.k.)、chemservice inc.(west chester,pa)、crescent chemical co.(hauppauge,ny)、eastman organic chemicals,eastman kodak company(rochester,ny)、fisher scientific co.(pittsburgh,pa)、fisons chemicals(leicestershire,uk)、frontier scientific(logan,ut)、icn biomedicals,inc.(costa mesa,ca)、key organics(cornwall,u.k.)、lancaster synthesis(windham,nh)、maybridge chemical co.ltd.(cornwall,u.k.)、parish chemical co.(orem,ut)、pfaltz&bauer,inc.(waterbury,cn)、polyorganix(houston,tx)、pierce chemical co.(rockford,il)、riedel de haen ag(hanover,germany)、spectrum quality product,inc.(new brunswick,nj)、tci america(portland,or)、trans world chemicals,inc.(rockville,
md)和wako chemicals usa,inc.(richmond,va)。
[0128]
详述了在本文所述化合物的制备中有用的反应物的合成或对描述该制备的文章提供参考的合适的参考书籍和论文包括,例如,"synthetic organic chemistry",john wiley&sons,inc.,new york;s.r.sandler等人,"organic functional group preparations,"第2版,academic press,new york,1983;h.o.house,"modern synthetic reactions",第2版,w.a.benjamin,inc.menlo park,calif.1972;t.l.gilchrist,"heterocyclic chemistry",第2版,john wiley&sons,new york,1992;j.march,"advanced organic chemistry:reactions,mechanisms and structure",第4版,wiley interscience,new york,1992。详述了在本文所述化合物的制备中有用的反应物的合成或对描述该制备的文章提供参考的其他合适的参考书籍和论文包括,例如,fuhrhop,j.和penzlin g."organic synthesis:concepts,methods,starting materials",第二次修订增补版(second,revised and enlarged edition)(1994)john wiley&sons isbn:3-527-29074-5;hoffman,r.v."organic chemistry,an intermediate text"(1996)oxford university press,isbn0-19-509618-5;larock,r.c."comprehensive organic transformations:a guide to functional group preparations"第2版(1999)wiley-vch,isbn:0-471-19031-4;march,j."advanced organic chemistry:reactions,mechanisms,and structure"第4版(1992)john wiley&sons,isbn:0-471-60180-2;otera,j.(编著)"modern carbonyl chemistry"(2000)wiley-vch,isbn:3-527-29871-1;patai,s."patai's 1992guide to the chemistry of functional groups"(1992)interscience isbn:0-471-93022-9;solomons,t.w.g."organic chemistry"第7版(2000)john wiley&sons,isbn:0-471-19095-0;stowell,j.c.,"intermediate organic chemistry"第2版(1993)wiley-interscience,isbn:0-471-57456-2;"industrial organic chemicals:starting materials and intermediates:an ullmann's encyclopedia"(1999)john wiley&sons,isbn:3-527-29645-x,8卷;"organic reactions"(1942-2000)john wiley&sons,超过55卷;以及"chemistry of functional groups"john wiley&sons,73卷。
[0129]
特定的和类似的反应物任选地通过由美国化学学会(american chemical society)的化学文摘服务处(chemical abstract service)编制的已知化学品索引来确定,该索引可从大多数公共图书馆和大学图书馆以及通过在线数据库(联系美国化学学会,washington,d.c.获得更多细节)获得。目录中的已知但不可商购获得的化学品任选地由定制化学合成室(house)制备,其中许多标准化学供应室(例如,上文列出的那些)提供定制合成服务。可用于制备和选择本文所述杂芳族cdk抑制化合物的药用盐的参考文献是p.h.stahl和c.g.wermuth"handbook of pharmaceutical salts",verlag helvetica chimica acta,zurich,2002。细胞周期蛋白依赖性激酶的修饰
[0130]
一个实施方案提供了一种抑制cdk酶的方法,其包括使该酶与式(i)或(ia)化合物或表1中公开的化合物接触。另一个实施方案提供了所述方法,其中所述cdk酶是cdk12。
[0131]
一个实施方案提供了一种修饰的cdk12多肽,其中未修饰的cdk12的活性位点半胱氨酸已被具有式(x)结构的取代基修饰:
其中,环a是任选取代的6元含氮单环杂芳基,或9元或10元含氮的双环杂芳基;r1、r2和r3各自独立地选自氢、任选取代的c1-c4烷基或任选取代的杂环基(烷基);r4是氢或任选取代的c1-c4烷基,或任选地,如果r3是任选取代的c1-c4烷基且r4是任选取代的c1-c4烷基,则r3和r4连接在一起形成环;r5选自氢、-cn、-nh2、卤素、任选取代的c1-c4烷基、任选取代的c1-c4烷氧基或任选取代的c1-c4氨基烷基;r6选自氢、-cn、-nh2、卤素、任选取代的c1-c4烷基、任选取代的c1-c4烷氧基或任选取代的c1-c4氨基烷基;x为n或c-h;y为n或c-l1-r
11
;z为n或c-l2-r7;l1和l2各自独立地地是键、-o-或-n(r8)-;r7选自氢、-cn、卤素、任选取代的c1-c4烷基、任选取代的c3-c7碳环基、任选取代的碳环基(烷基)、任选取代的杂环基、任选取代的杂环基(烷基);r8是氢或任选取代的c1-c4烷基;r9选自氢或任选取代的c1-c4烷基;r
10
选自氢或任选取代的c1-c4烷基;并且r
11
选自氢、-cn、卤素、-nh2、任选取代的c1-c4烷基、任选取代的c3-c7碳环基、任选取代的碳环基(烷基)、任选取代的杂环基或任选取代的杂环基(烷基)。
[0132]
在一些实施方案中,式(x)的环a选自吡啶、吡嗪、嘧啶或哒嗪。
[0133]
在一些实施方案中,式(x)的环a选自喹啉、异喹啉、喹唑啉、吡唑并吡啶、吡唑并嘧啶、噻吩并嘧啶、噻吩并吡啶、吡啶并吡啶或吡啶并嘧啶。
[0134]
在一些实施方案中,式(x)的r2为氢。
[0135]
在一些实施方案中,式(x)的r3为氢。
[0136]
在一些实施方案中,式(x)的r2和r3为氢。
[0137]
在一些实施方案中,式(x)的r1为氢。
[0138]
在一些实施方案中,式(x)的r1为任选取代的c1-c4烷基。
[0139]
在一些实施方案中,式(x)的r1为任选取代的c1-c2烷基。
[0140]
在一些实施方案中,式(x)的r1为任选取代的c1烷基。在一些实施方案中,该c1烷基被任选取代的氨基所取代。在一些实施方案中,该任选取代的氨基为二甲基氨基。
[0141]
在一些实施方案中,式(x)的r1为
–
ch
2-n(me)2。
[0142]
在一些实施方案中,式(x)的r1为任选取代的杂环基烷基。在一些实施方案中,该任选取代的杂环基烷基包含任选取代的c1烷基。在一些实施方案中,该任选取代的杂环基烷基包含任选取代的n-连接的杂环基。在一些实施方案中,该任选取代的n-连接的杂环基为n-连接的吡咯烷或哌啶。
[0143]
在一些实施方案中,式(x)的r4为氢。
[0144]
在一些实施方案中,式(x)的r4为任选取代的c1-c4烷基。
[0145]
在一些实施方案中,式(x)的r5是氢。
[0146]
在一些实施方案中,式(x)的r6是氢。
[0147]
在一些实施方案中,式(x)的x为n。
[0148]
在一些实施方案中,式(x)的x为c-h。
[0149]
在一些实施方案中,式(x)的y为n。
[0150]
在一些实施方案中,式(x)的y为c-l1-r
11
。
[0151]
在一些实施方案中,式(x)的l1为键。
[0152]
在一些实施方案中,式(x)的l1为-o-。
[0153]
在一些实施方案中,式(x)的l1为-nh-。
[0154]
在一些实施方案中,式(x)的l1为-n(r8)-,且r8是任选取代的c1-c4烷基。
[0155]
在一些实施方案中,式(x)的r
11
是氢。
[0156]
在一些实施方案中,式(x)的r
11
是任选取代的c1-c4烷基。
[0157]
在一些实施方案中,式(x)的r
11
是任选取代的杂环基。
[0158]
在一些实施方案中,式(x)的z为n。
[0159]
在一些实施方案中,式(x)的z为c-l2-r7。
[0160]
在一些实施方案中,式(x)的l2是键。
[0161]
在一些实施方案中,式(x)的l2为-o-。
[0162]
在一些实施方案中,式(x)的l2为-nh-。
[0163]
在一些实施方案中,式(x)的l2为-n(r8)-,并且r8是任选取代的c1-c4烷基。
[0164]
在一些实施方案中,式(x)的r7为氢。
[0165]
在一些实施方案中,式(x)的r7是任选取代的c1-c4烷基。
[0166]
在一些实施方案中,式(x)的r7是任选取代的杂环基。
[0167]
另一个实施方案提供了修饰的cdk12多肽,其中未修饰的cdk12多肽是同工型1(智人)。
[0168]
另一个实施方案提供了修饰的cdk12多肽,其中未修饰的cdk12多肽是同工型2(智人)。
[0169]
另一个实施方案提供了修饰的cdk12多肽,其中未修饰的cdk12多肽是同工型1(智人)变体。另一个实施方案提供了修饰的cdk12多肽,其中未修饰的cdk12多肽是同工型1(智人)变体i1131v。另一个实施方案提供了修饰的cdk12多肽,其中未修饰的cdk12多肽是同工型1(智人)变体l1189q。另一个实施方案提供了修饰的cdk12多肽,其中未修饰的cdk12多肽是同工型1(智人)变体t1195m。
[0170]
另一个实施方案提供了修饰的cdk12多肽,其中未修饰的cdk12多肽是选自表2或
表3中提供的seqid的seqid。表2.cdk12序列
表3.变体cdk12序列
药物组合物
[0171]
在某些实施方案中,本文所述的杂芳族cdk抑制化合物作为纯化学品施用。在其他实施方案中,本文所述的杂芳族cdk抑制化合物与药学上合适的或可接受的载体(本文中也为药学上合适的(或可接受的)赋形剂,生理学上合适的(或可接受的)赋形剂,或生理学上合适的(或可接受的)载体)组合,该载体是基于选定的施用途径和例如在remington:the science and practice of pharmacy(gennaro,第21版.mack pub.co.,easton,pa(2005))中描述的标准药学实践而选择的。
[0172]
本文提供了一种药物组合物,其包含至少一种本文所述的杂芳族cdk抑制化合物或其立体异构体、药学上可接受的盐、水合物或溶剂化物,以及一种或多种药学上可接受的载体。如果该载体(或赋形剂)与该组合物的其他成分相容并且对该组合物的接受者(即,对象或患者)无害,则该载体(或赋形剂)是可接受的或合适的。
[0173]
一个实施方案提供了一种药物组合物,其包含药学上可接受的赋形剂和式(i)或(ia)化合物或表1中公开的化合物或其药学上可接受的盐或溶剂化物。
[0174]
一个实施方案提供了一种制备药物组合物的方法,其包括将式(i)或(ia)化合物或其药学上可接受的盐或溶剂化物与药学上可接受的载体混合。
[0175]
在某些实施方案中,式(i)或(ia)描述的杂芳族cdk抑制化合物或表1中公开的化合物是基本上纯的,因为其含有少于约5%,或少于约1%,或少于约0.1%的其他有机小分子,如例如在合成方法的一个或多个步骤中产生的未反应的中间体或合成副产物。
[0176]
合适的口服剂型包括,例如,片剂、丸剂、囊剂,或硬或软明胶、甲基纤维素或在消化道中易于溶解的另一合适材料的胶囊。在一些实施方案中,使用合适的无毒性固体载体,其包括例如药物级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、蔗糖、碳酸镁等。(参见,例如,remington:the science and practice of pharmacy(gennaro,第21版.mack pub.co.,easton,pa(2005))。
[0177]
在一些实施方案中,将式(i)或(ia)描述的杂芳族cdk抑制化合物或表1中公开的化合物或其药学上可接受的盐或溶剂化物配制成用于通过注射施用。在一些情况下,该注射制剂是水性制剂。在一些情况下,该注射制剂是非水性制剂。在一些情况下,该注射制剂是基于诸如芝麻油等油的制剂。
[0178]
包含至少一种本文所述的杂芳族cdk抑制化合物的组合物的剂量根据对象或患者(例如,人)的状况而不同。在一些实施方案中,这类因素包括总体健康状况、年龄和其他因素。
[0179]
药物组合物以适合于待治疗(或预防)的疾病的方式施用。适当的剂量和合适的施用持续时间和频率将取决于诸如患者的状况、患者疾病的类型和严重程度、活性成分的特定形式和施用方法等因素。通常,适当的剂量和治疗方案以足以提供治疗和/或预防益处(例如,改善的临床结果,例如更频繁的完全或部分缓解,或更长的无病和/或总体存活期,或症状严重程度的减轻)的量提供组合物。通常使用实验模型和/或临床试验确定最佳剂量。最佳剂量取决于患者的身体质量、体重或血容量。
[0180]
口服剂量一般在约1.0mg至约1000mg的范围内,每天一至四次或更多次。治疗方法
[0181]
一个实施方案提供了式(i)或(ia)化合物或表1中公开的化合物或其药学上可接受的盐或溶剂化物,其用于治疗人或动物体的方法中。
[0182]
一个实施方案提供了式(i)或(ia)化合物或表1中公开的化合物或其药学上可接受的盐或溶剂化物,其用于治疗癌症、赘生性疾病或过度增殖性病症的方法中。
[0183]
一个实施方案提供了式(i)或(ia)化合物或表1中公开的化合物或其药学上可接受的盐或溶剂化物在制备用于治疗癌症或赘生性疾病的药物中的用途。
[0184]
在一些实施方案中,本文描述了一种治疗有需要的患者的癌症的方法,其包括向所述患者施用式(i)或(ia)化合物或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文描述了一种治疗有需要的患者的癌症的方法,其包括向所述患者施用表1中公开的化合物或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文还描述了一种治疗有需要的患者的癌症的方法,其包括向所述患者施用包含式(i)或(ia)化合物或其药学上可接受的盐或溶剂化物和药学上可接受的赋形剂的药物组合物。在一些实施方案中,本文还描述了一种治疗有需要的患者的癌症的方法,其包括向所述患者施用包含表1中公开的化合物或其药学上可接受的盐或溶剂化物和药学上可接受的赋形剂的药物组合物。在一些实施方案中,该癌症是乳腺癌、结直肠癌、卵巢癌、胰腺癌、前列腺癌或肺癌。
[0185]
本文提供了所述方法,其中所述药物组合物经口服施用。本文提供了所述方法,其中所述药物组合物通过注射施用。
[0186]
根据本公开,其他实施方案和用途对于本领域技术人员将是明显的。提供以下实施例仅仅是为了说明各实施方案,而不应解释为以任何方式限制本发明。
实施例i.化学合成
[0187]
在一些实施方案中,本文公开的杂芳族cdk抑制化合物按照以下实施例来合成。如以下所用的,在本发明的整篇说明书中,除非另有说明,否则下列缩写应理解为具有以下含义:℃
ꢀꢀꢀ
摄氏度δh
ꢀꢀ
从四甲基硅烷向低磁场以百万分率计的化学位移dcm
ꢀꢀ
二氯甲烷(ch2cl2)dmf
ꢀꢀ
二甲基甲酰胺dmso 二甲基亚砜ea
ꢀꢀꢀ
乙酸乙酯esi
ꢀꢀ
电喷雾电离et
ꢀꢀꢀ
乙基g
ꢀꢀꢀꢀ
克h
ꢀꢀꢀꢀ
小时hplc 高效液相色谱法hz
ꢀꢀꢀ
赫兹j
ꢀꢀꢀꢀ
耦合常数(在nmr光谱中)lcms 液相色谱质谱法μ
ꢀꢀꢀ
微m
ꢀꢀꢀꢀ
多重峰(光谱);米;毫m
ꢀꢀꢀꢀ
摩尔m
母分子离子me
ꢀꢀꢀ
甲基mhz
ꢀꢀ
兆赫兹min
ꢀꢀ
分钟mol
ꢀꢀ
摩尔;分子(以mol wt计)ml
ꢀꢀꢀ
毫升ms
ꢀꢀꢀ
质谱法nm
ꢀꢀꢀ
纳米nmr
ꢀꢀ
核磁共振ph
ꢀꢀꢀ
酸碱度;水溶液的酸性或碱性的量度pe
ꢀꢀꢀ
石油醚rt
ꢀꢀꢀ
室温s
ꢀꢀꢀꢀ
单峰(光谱)t
ꢀꢀꢀꢀ
三重峰(光谱)t
ꢀꢀꢀꢀ
温度tfa
ꢀꢀ
三氟乙酸thf
ꢀꢀ
四氢呋喃
实施例1:(r)-n-(4-(3-((5-氯嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的合成步骤1:(r)-叔丁基(1-(7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0188]
将4-氯-7-硝基喹唑啉(4.0g,19.0mmol)、(r)-叔丁基吡咯烷-3-基氨基甲酸酯(5.3g,28.5mml)和tea(7.4ml,57.0mmol)在i-proh(60ml)中的混合物在80℃下搅拌16小时。将混合物冷却并浓缩。将得到的固体用acn(50ml)稀释,并在室温(rt)搅拌20min。将反应过滤并用acn(20ml)洗涤,得到[1-(7-硝基-喹唑啉-4-基)-吡咯烷-3-基]-氨基甲酸叔丁酯(5.0g,73%),为黄色固体。针对c
17h21
n5o4的[m h]计算值,360.2;实测值,360.2。步骤2:(r)-叔丁基(1-(7-氨基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0189]
将(r)-叔丁基(1-(7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(5.0g,13.9mmol)和pd/c(800mg)在meoh(80ml)中的混合物在室温在h2气囊气氛下搅拌4小时。将反应混合物过滤并浓缩。经硅胶色谱法(dcm/甲醇=20/1)纯化所得固体得到(r)-叔丁基(1-(7-氨基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(24.2g,91%),为白色固体。针对c
17h23
n5o2的[m h]计算值,330.2;实测值,330.1。步骤3:(r)-叔丁基(1-(7-丙烯酰胺基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0190]
在0℃在氮气气氛下搅拌(r)-叔丁基(1-(7-氨基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.00g,3.03mmol)和diea(2.49ml,15.15mmol)在dcm(40ml)中的混合物。滴加丙烯
酰氯(0.22ml,2.72mmol)在dcm(5ml)中的溶液,将混合物升温至室温,并搅拌3小时。将混合物浓缩,进行制备型hplc得到(r)-叔丁基(1-(7-丙烯酰胺基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(220mg,19%),为白色固体。针对c
20h25
n5o3的[m h]计算值,384.2;实测值,384.1。步骤4:(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0191]
向(r)-叔丁基(1-(7-丙烯酰胺基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(220mg,0.57mmol)的dcm(20ml)溶液中加入tfa(1ml),在室温下搅拌2小时。将混合物浓缩得到(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的tfa盐(162mg,粗品),为绿色液体。针对c
15h17
n5o的[m h]计算值,284.1;实测值,284.1。步骤5:(r)-n-(4-(3-((5-氯嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0192]
将(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的tfa盐(150mg,0.53mmol)、2,5-二氯嘧啶(118mg,0.79mmol)和diea(205mg,1.59mmol)在dmso(10ml)中的混合物在60℃在氮气气氛下搅拌24小时。将反应混合物浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-氯嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(15.9mg,7.6%),为白色固体。1h nmr(400mhz,dmso-d6):2.10-2.14(m,1h),2.25-2.29(m,1h),3.83-4.22(m,4h),4.45-4.49(m,1h),5.83-5.87(m,1h),6.32-6.58(m,1h),6.47-6.56(m,1h),7.63-7.67(m,1h),7.90-7.92(m,1h),8.17-8.25(m,2h),8.40(s,3h),10.54(s,1h)。针对c
19h18
cln7o的[m h]计算值,396.1;实测值,396.1。实施例2:(r)-n-(4-(3-((5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的合成步骤1:(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0193]
在室温下向(r)-叔丁基(1-(7-丙烯酰胺基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(600mg,0.78mmol)的二氯甲烷(10ml)溶液中,加入tfa(2ml)。在室温下搅拌反应混合物3h。将反应混合物浓缩得到(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(tfa盐)(600mg,粗品),为黄色油状物。针对c
15h17
n5o的[m h]计算值,284.1;实测值,284.1。步骤2:(r)-n-(4-(3-((5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的合成
[0194]
将(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(tfa盐)(100mg,0.26mmol)、2-氯-5-(三氟甲基)嘧啶(72mg,0.38mmol)和diea(166mg,1.30mmol)在dmso(6ml)中的混合物在微波中在氮气气氛下加热至80℃,持续30分钟。将反应混合物冷却,并用dcm(10ml
×
3)萃取。将合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。经制备型hplc纯化残余物得到(r)-n-(4-(3-((5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(tfa盐)(64.1mg,59%),为白色固体。1h nmr(400mhz,dmso-d6):δ2.11-2.40(m,2h),4.06-4.59(m,4h),4.66(s,1h),5.91(dd,j=2.0,10.0hz,1h),6.36-6.54(m,2h),7.70(d,j=9.2hz,1h),8.40-8.51(m,3h),8.68-8.78(m,3h),10.97(s,1h)。针对c
20h18
f3n7o的[m h]计算值,430.2;实测值,430.1。实施例3:(r)-n-(4-(3-((5-氯-4-乙氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的合成
步骤1:(r)-5-氯-4-乙氧基-n-(1-(7-硝基喹唑啉-4-基)吡咯烷-3-基)嘧啶-2-胺
[0195]
将4-氯-7-硝基喹唑啉(2.0g,9.5mmol)、(r)-5-氯-4-乙氧基-n-(吡咯烷-3-基)嘧啶-2-胺盐酸盐(2.9g,10.5ml)和tea(5.8g,57.2mmol)在iproh(50ml)中的混合物在80℃下搅拌6小时。将反应混合物冷却并浓缩。将残余物经硅胶色谱法(pe/ea=1/1)纯化得到(r)-5-氯-4-乙氧基-n-(1-(7-硝基喹唑啉-4-基)吡咯烷-3-基)嘧啶-2-胺(2.6g,66%),为黄色固体。针对c
18h18
cln7o3的[m h]计算值,416.1;实测值,416.1。步骤2:(r)-4-(3-((5-氯-4-乙氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-胺
[0196]
在40℃下将(r)-5-氯-4-乙氧基-n-(1-(7-硝基喹唑啉-4-基)吡咯烷-3-基)嘧啶-2-胺(2.6g,6.3mmol)、zn(4.1g,62.7mmol)和nh4cl(6.7g,125.3mmol)在甲醇(meoh)/thf/h2o(100ml/50ml/50ml)中的混合物搅拌过夜。将反应混合物过滤并浓缩。将残余物经硅胶色谱法(dcm/甲醇=10/1)纯化得到(r)-4-(3-((5-氯-4-乙氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-胺(2.3g,97%),为红色油状物。针对c
18h20
cln7o的[m h]计算值,386.1;实测值,386.1。步骤3:(r)-n-(4-(3-((5-氯-4-乙氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0197]
在氮气气氛下在0℃下将(r)-4-(3-((5-氯-4-乙氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-胺(300mg,0.77mmol)的二甲基甲酰胺溶液(10ml)进行搅拌。然后滴加吡啶(369mg,4.67mmol),随后滴加丙烯酰氯(140mg,1.55mmol)。然后在35℃下搅拌反应混合物3小时。将反应混合物浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-氯-4-乙氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(10.5mg,3%),为白色固体。1h nmr(400mhz,dmso-d6):1.30-1.34(m,3h),2.07-2.12(m,1h),2.22-2.26(m,1h),3.82-3.93(m,2h),4.01-4.06(m,1h),4.17-4.19(m,1h),4.39-4.46(m,3h),5.81-5.84(m,1h),6.30-6.35(m,1h),6.45-6.52(m,1h),7.60-7.63(m,1h),7.68-7.72(m,1h),8.13-8.15(m,2h),8.21-8.23(m,1h),8.38(s,1h),10.49(s,1h)。针对c
21h22
cln7o2的[m h]计算值,440.2;实测值,440.2。实施例4:(r)-n-(4-(3-((5-氯-4-甲氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺步骤1:4-氯喹唑啉-7-胺
[0198]
在室温下将4-氯-7-硝基喹唑啉(1.2g,5.7mmol)、na2s2o4(4.0g,22.9mmol)和甲基三辛基氯化铵(tomac)(1.1g,2.7mmol)在thf/h2o(36ml/12ml)中的混合物搅拌40min。将有机层分离,经na2so4干燥,过滤并浓缩得到4-氯喹唑啉-7-胺(1.7g,粗品),为黄色油状物。针对c8h6cln3的[m h]计算值,180.0;实测值,180.0。步骤2:n-(4-氯喹唑啉-7-基)丙烯酰胺
[0199]
在0℃在氮气氛下将4-氯喹唑啉-7-胺(1.70g,2.86mmol)和diea(1.10g,8.5mmol)在thf(50ml)中的混合物进行搅拌。滴加丙烯酰氯在thf中的溶液(2.86ml,1.0mmol/l,2.86mmol)。将反应混合物升温至室温,搅拌3小时。将反应混合物浓缩得到n-(4-氯喹唑啉-7-基)丙烯酰胺(1.82g,粗品),为黄色固体。针对c
11
h8cln3o的[m h]计算值,234.0;实测值,234.0。步骤3:(r)-n-(4-(3-((5-氯-4-甲氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0200]
在40℃在氮气气氛下将n-(4-氯喹唑啉-7-基)丙烯酰胺(180mg,0.76mmol)、(r)-5-氯-4-甲氧基-n-(吡咯烷-3-基)嘧啶-2-胺盐酸盐(244mg,0.92mml)和diea(995mg,7.7mmol)在dmso(10ml)中的混合物搅拌1.5小时。将反应混合物浓缩。将反应混合物通过制备型hplc纯化得到(r)-n-(4-(3-((5-氯-4-甲氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(10.7mg,3%),为白色固体。1h nmr(400mhz,dmso-d6):2.08-2.12(m,1h),2.23-2.26(m,1h),3.82-3.91(m,5h),4.02-4.07(m,1h),4.18(m,1h),4.45-4.49(m,1h),5.81-5.84(m,1h),6.30-6.35(m,1h),6.45-6.52(m,1h),7.61-7.64(m,1h),7.74-7.76(m,1h),8.14-8.15(m,2h),8.21-8.23(m,1h),8.38(s,1h),10.49(s,1h)。针对c
20h20
cln7o2的[m h]计算值,426.1;实测值,426.1。实施例5:(r)-n-(4-(3-((5-溴-4-甲氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺步骤1:(r)-叔丁基3-((5-溴-4-甲氧基嘧啶-2-基)氨基)吡咯烷-1-甲酸酯
[0201]
在140℃在氮气气氛下将5-溴-2-氯-4-甲氧基嘧啶(2.0g,8.9mmol)、(r)-叔丁基3-氨基吡咯烷-1-甲酸酯(2.5g,13.4mml)和k2co3(2.5g,11.9mmol)在dmso(50ml)中的混合物搅拌4小时。将混合物冷却至室温,倒入200ml h2o中,用dcm(50ml*3)萃取。将合并的有机层经na2so4干燥,过滤并浓缩。将残余物经硅胶色谱法(pe/ea=5/1)纯化得到(r)-叔丁基3-((5-溴-4-甲氧基嘧啶-2-基)氨基)吡咯烷-1-甲酸酯(804mg,24%),为白色固体。针对c
14h21
brn4o3的[m h]计算值,373.1;实测值,373.1。步骤2:(r)-5-溴-4-甲氧基-n-(吡咯烷-3-基)嘧啶-2-胺盐酸盐
[0202]
在室温下将(r)-叔丁基3-((5-溴-4-甲氧基嘧啶-2-基)氨基)吡咯烷-1-甲酸酯(804mg,2.16mmol)在ea/hcl(10ml,1.0m)中的溶液搅拌1小时。将混合物浓缩获得(r)-5-溴-4-甲氧基-n-(吡咯烷-3-基)嘧啶-2-胺盐酸盐(809mg,粗品),为白色固体。针对c9h
13
brn4o的[m h]计算值,273.0;实测值,273.0。步骤3:(r)-n-(4-(3-((5-溴-4-甲氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0203]
在40℃下在氮气气氛下将n-(4-氯喹唑啉-7-基)丙烯酰胺(400mg,1.71mmol)、(r)-5-溴-4-甲氧基-n-(吡咯烷-3-基)嘧啶-2-胺盐酸盐(530mg,1.71ml)和diea(2.21g,17.16mmol)在dmso(8ml)中的混合物搅拌1.5小时。将反应混合物浓缩。将残余物通过制备型hplc纯化得到(r)-n-(4-(3-((5-溴-4-甲氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(11.2mg,1%),为白色固体。1h nmr(400mhz,dmso-d6):2.08-2.13(m,1h),2.23-2.26(m,1h),3.83-3.90(m,5h),4.02-4.07(m,1h),4.16-4.20(m,1h),4.45-4.49(m,1h),5.81-5.84(m,1h),6.30-6.35(m,1h),6.45-6.52(m,1h),7.61-7.64(m,1h),7.76(s,1h),8.14-8.15(m,1h),8.21-8.23(m,2h),8.39(s,1h),10.49(s,1h)。针对c
20h20
brn7o2的[m h]计算值,470.1;实测值,470.1。实施例6:(r)-n-(4-(3-((4-氨基-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的合成
步骤1:(r)-叔丁基3-((4-氨基-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-甲酸酯
[0204]
将2-氯-5-(三氟甲基)嘧啶-4-胺(400mg,2.0mmol)、(r)-叔丁基3-氨基吡咯烷-1-甲酸酯(755mg,4.0mmol)和k2co3(552mg,4.0mmol)在dmso(10ml)中的混合物在微波下加热至170℃,持续2小时。将混合物冷却至室温,倒入50ml h2o中并用ea(50ml*3)萃取。将合并有机相经na2so4干燥,过滤并浓缩。用硅胶色谱法(pe/ea=1/10-1/5)对残余物进行纯化得到(r)-叔丁基3-((4-氨基-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-甲酸酯(500mg,72%),为白色固体。针对c
14h20
f3n5o2的[m h]计算值,348.2;实测值,348.2。步骤2:(r)-n2-(吡咯烷-3-基)-5-(三氟甲基)嘧啶-2,4-二胺盐酸盐
[0205]
在室温下将(r)-叔丁基3-((4-氨基-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-甲酸酯(500mg,1.4mmol)在hcl/ea(10ml,2.0m)中的混合物搅拌2小时。将混合物浓缩得到(r)-n2-(吡咯烷-3-基)-5-(三氟甲基)嘧啶-2,4-二胺盐酸盐(395mg,100%),为白色固体。针对c9h
12
f3n5的[m h]计算值,248.1;实测值,248.1。步骤3:(r)-n-(4-(3-((4-氨基-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0206]
在室温下将n-(4-氯喹唑啉-7-基)丙烯酰胺(311mg,1.3mmol)、(r)-n2-(吡咯烷-3-基)-5-(三氟甲基)嘧啶-2,4-二胺盐酸盐(395mg,1.6mmol)和diea(168mg,1.3mmol)在dmso(10ml)中的混合物搅拌1h。将该混合物用h2o(10ml)稀释,用ea(10ml*3)萃取。将合并的有机层经na2so4干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((4-氨基-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(13.9mg,2.4%),
为白色固体。1h nmr(400mhz,dmso-d6):δ2.05-2.25(m,2h),3.78-3.94(m,2h),4.01-4.15(m,2h),4.47-4.49(m,1h),5.82(dd,j=8.0,12.0hz,1h),6.30-6.35(m,1h),6.45-6.52(m,1h),6.70-6.83(m,2h),7.43-7.64(m,2h),8.06(br s,1h),8.14-8.22(m,2h),8.38(s,1h),10.47(s,1h)。针对c
20h19
f3n8o的[m h]计算值,445.2;实测值,445.2。实施例7:n-{4-[3-(5-氯-4-苯氧基-嘧啶-2-基氨基)-吡咯烷-1-基]-喹唑啉-7-基}-丙烯酰胺的合成步骤1:2,5-二氯-4-苯氧基嘧啶
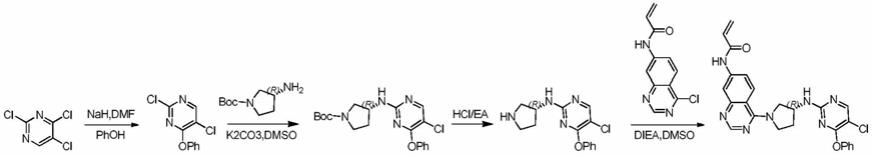
[0207]
在0℃下在n2下向2,4,5-三氯嘧啶(1.0g,5.5mmol)在二甲基甲酰胺(20ml)中的混合物中,加入nah(220mg,60%,5.49mmol)。将混合物在0℃搅拌15分钟,然后加入phoh(516mg,5.49mmol)。在室温下搅拌反应3小时。将混合物用h2o(5ml)淬灭,并用ea(30ml)萃取。将有机相经na2so4干燥,过滤并浓缩。用硅胶色谱法(pe/ea=1/10)对残余物进行纯化得到2,5-二氯-4-苯氧基嘧啶(1.2g,92%),为白色固体。针对c
10
h6cl2n2o的[m h]计算值,241.0;实测值,241.0。步骤2:(r)-叔丁基3-((5-氯-4-苯氧基嘧啶-2-基)氨基)吡咯烷-1-甲酸酯
[0208]
将2,5-二氯-4-苯氧基嘧啶(1.2g,5.0mmol)、3-氨基-吡咯烷-1-甲酸叔丁基酯(1.4g,7.5mmol)和k2co3(1.4g,10.0mmol)在dmso(25ml)中的混合物加热至140℃,持续4小时。将混合物冷却并浓缩。用硅胶色谱法(pe/ea=1/10-1/3)对残余物进行纯化得到(r)-叔丁基3-((5-氯-4-苯氧基嘧啶-2-基)氨基)吡咯烷-1-甲酸酯(1.2g,62%),为无色油状物。针对c
19h23
cln4o3的[m h]计算值,391.0;实测值,391.0。步骤3:(r)-5-氯-4-苯氧基-n-(吡咯烷-3-基)嘧啶-2-胺
[0209]
在室温下将(r)-叔丁基3-((5-氯-4-苯氧基嘧啶-2-基)氨基)吡咯烷-1-甲酸酯(300mg,0.77mmol)在hcl/ea(10ml,1.0m)中的混合物搅拌2小时。将混合物浓缩得到(r)-5-氯-4-苯氧基-n-(吡咯烷-3-基)嘧啶-2-胺(250mg,100%),为黄色固体。针对c
14h15
cln4o的[m h]计算值,291.0;实测值,291.0。
步骤4:(r)-n-(4-(3-((5-氯-4-苯氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0210]
将n-(4-氯喹唑啉-7-基)丙烯酰胺(179mg,0.76mmol)、(r)-5-氯-4-苯氧基-n-(吡咯烷-3-基)嘧啶-2-胺(250mg,0.76mmol)和diea(198mg,1.51mmol)在dmso(10ml)中的混合物加热至40℃,持续1小时。向反应混合物加入h2o(5ml)。然后将混合物过滤。滤饼通过制备型hplc纯化得到(r)-n-(4-(3-((5-氯-4-苯氧基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(4.4mg,12%),为白色固体。1hnmr(400mhz,cdcl3):δ1.97-2.07(m,2h),3.78-4.01(m,5h),5.81-5.84(m,1h),6.30-6.35(m,1h),6.46-6.52(m,1h),7.21-7.53(m,7h),8.15(s,2h),8.32-8.36(m,2h),10.50(s,1h)。针对c
25h22
cln7o2的[m h]计算值488.0;实测值,488.0。实施例8:(r)-n-(4-(3-((6-氟喹唑啉-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0211]
在氮气气氛下将(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(tfa盐)(100mg,0.26mmol)、2-氯-6-氟喹唑啉(69mg,0.38mmol)和diea(166mg,1.30mmol)在dmso(6ml)中的混合物在微波下加热至140℃,持续30min。将混合物冷却至室温,用水(20ml)稀释,用dcm(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((6-氟喹唑啉-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(tfa盐)(34.1mg,32%),为黄色固体。1hnmr(400mhz,dmso-d6):δ2.11-2.40(m,2h),4.06-4.95(m,4h),5.90(d,j=11.2hz,1h),6.36-6.54(m,2h),7.58-7.68(m,4h),7.95(s,1h),8.37-8.51(m,2h),8.78(s,1h),9.17(s,1h),10.96(s,1h),14.25(br s,1h)。针对c
23h20
fn7o的[m h]计算值,430.1;实测值,430.1。实施例9:(r)-n-(4-(3-((5-氯-4-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0212]
将(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺三氟乙酸盐(75mg,0.18mmol)、2,5-二氯-4-(三氟甲基)嘧啶(61mg,0.28mml)和diea(123mg,0.9mmol)在dmso(3ml)中的混合物在140℃在微波中加热,持续40分钟。经浓缩后,混合物通过制备型hplc纯化得到(r)-n-(4-(3-((5-氯-4-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(14.5mg,16%),为白色固体。1h nmr(400mhz,dmso-d6):2.09-2.14(m,1h),2.25-2.30(m,1h),3.85-3.88(m,2h),3.94-3.95(m,1h),4.06-4.08(m,1h),4.16-4.20(m,1h),4.50(s,1h),5.81-5.84(m,1h),6.30-6.35(m,1h),6.45-6.52(m,1h),7.61-7.64(m,1h),8.14-8.22(m,1h),8.39(s,1h),8.51(m,1h),8.71(m,1h),10.48(s,1h)。针对c
20h17
clf3n7o的[m h]计算值,464.1;实测值,464.1。实施例10:(r)-n-(4-(3-((5-环丙基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺步骤1:(r)-叔丁基3-((5-环丙基嘧啶-2-基)氨基)吡咯烷-1-甲酸酯
[0213]
在室温下,向2-氯-5-环丙基嘧啶(500mg,3.25mmol)和(r)-叔丁基3-氨基吡咯烷-1-甲酸酯(906mg,4.87mmol)在dmso(10ml)中的溶液中加入k2co3(894mg,6.48mmol)。将混合物在微波下在170℃搅拌2.5小时。将混合物冷却,用水(20ml)稀释,用dcm(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。经柱(pe/ea=3/1)纯化残余物得到(r)-叔丁基3-((5-环丙基嘧啶-2-基)氨基)吡咯烷-1-甲酸酯(170mg,17%),为黄色油状物。针对c
16h24
n4o2的[m h]计算值,305.2;实测值,305.2。步骤2:(r)-5-环丙基-n-(吡咯烷-3-基)嘧啶-2-胺(hcl盐)
[0214]
在室温下将(r)-叔丁基3-((5-环丙基嘧啶-2-基)氨基)吡咯烷-1-甲酸酯(170mg,
0.56mmol)在hcl/ea(5ml,1.0m)中的混合物搅拌2h。将反应混合物浓缩得到(r)-5-环丙基-n-(吡咯烷-3-基)嘧啶-2-胺(hcl盐)(120mg,89%),为黄色固体。针对c
11h16
n4的[m h]计算值,205.1;实测值,205.1。步骤3:(r)-n-(4-(3-((5-环丙基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0215]
在40℃下将n-(4-氯喹唑啉-7-基)丙烯酰胺(270mg,1.16mmol)、(r)-5-环丙基-n-(吡咯烷-3-基)嘧啶-2-胺(hcl盐)(120mg,0.58mml)和diea(347mg,2.89mmol)在dmso(4ml)中的混合物搅拌1h。用水(20ml)稀释混合物,用dcm和thf(dcm:thf=1:1,10ml*3)萃取。用盐水(20ml)洗涤合并的有机层,经na2so4干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-环丙基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(17.5mg,7.5%),为白色固体。1h nmr(400mhz,dmso-d6):0.64-0.68(m,2h),0.82-0.86(m,2h),1.71-1.76(m,1h),2.07-2.10(m,1h),2.22-2.25(m,1h),3.81-4.18(m,4h),4.45-4.46(m,1h),5.83(dd,j=10.0,1.6hz,1h),6.30-6.35(m,1h),6.47-6.54(m,1h),7.35(d,j=6.4hz,1h),7.63(dd,j=2.0,9.6hz,1h),8.11-8.24(m,4h),8.41(s,1h),10.48(s,1h)。针对c
22h23
n7o的[m h]计算值,402.2;实测值,402.2。实施例11:(r)-n-(4-(3-(噻吩并[3,2-d]嘧啶-2-基氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0216]
在氮气气氛下将(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(tfa盐)(100mg,0.26mmol)、2-氯噻吩并[3,2-d]嘧啶(65mg,0.38mmol)和diea(166mg,1.30mmol)在dmso(3ml)中的混合物在微波下加热至170℃,持续1.5h。将混合物冷却,用水(20ml)稀释,并用dcm(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-(噻吩并[3,2-d]嘧啶-2-基氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(3.9mg,3.8%),为白色固体。1h nmr(400mhz,dmso-d6):δ2.03-2.20(m,1h),2.28-2.32(m,1h),3.90-4.11(m,4h),4.58-4.59(m,1h),5.83(dd,j=2.0,10.4hz,1h),6.31-6.35(m,1h),6.48-6.54(m,1h),7.23(d,j=5.2hz,1h),7.54(d,j=6.0hz,1h),7.66(dd,j=2.0,9.2hz,1h),8.20-8.28(m,3h),8.45(s,1h),9.01(s,1h),
10.62(s,1h)。针对c
21h19
n7os的[m h]计算值,418.1;实测值,418.1。实施例12:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0217]
将(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺三氟乙酸盐(75mg,0.18mmol)、2-氯嘧啶-5-甲腈(39mg,0.28mmol)和diea(123mg,0.9mmol)在dmso(3ml)中的混合物在微波下在140℃反应1h。将反应混合物冷却并浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(18.9mg,26%),为白色固体。1h nmr(400mhz,dmso-d6):2.10-2.13(m,1h),2.26-2.29(m,1h),3.85-3.87(m,1h),3.95-3.96(m,1h),4.05-4.08(m,1h),4.16-4.20(m,1h),4.57-4.59(m,1h),5.81-5.84(m,1h),6.30-6.35(m,1h),6.46-6.52(m,1h),7.62-7.65(m,1h),8.15-8.16(m,1h),8.20-8.23(m,1h),8.39-8.41(m,1h),8.69-8.71(m,2h),8.78-8.79(m,1h),10.51(s,1h)。针对c
20h18
n8o的[m h]计算值,387.2;实测值,387.2。实施例13:(r)-n-(4-(3-(喹唑啉-2-基氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0218]
将(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(tfa盐)(44mg,0.16mmol)、2-氯喹唑啉(38mg,0.24mmol)和diea(60mg,0.47mmol)在dmso(3ml)中的混合物在微波下加热至140℃,持续1h。将混合物用水(20ml)稀释,用dcm(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-(喹唑啉-2-基氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(6.4mg,10%),为白色固体。1hnmr(400mhz,dmso-d6):δ2.16-2.19(m,1h),2.30-2.33(m,1h),3.89-4.25(m,4h),4.64-4.66(m,1h),5.82(dd,j=2.0,10.0hz,1h),6.30-6.35(m,1h),6.45-6.52(m,1h),7.26(t,j=7.2hz,1h),7.49-7.52(m,1h),7.62(dd,j=2.0,9.2hz,1h),7.69-7.73(m,1h),7.74-7.84(m,2h),8.16(d,j=2.0hz,1h),8.25(d,j=9.2hz,1h),8.40(s,1h),9.15(s,1h),10.49(s,1h)。针对c
23h21
n7o的[m h]计算值,412.1;实测值,412.1。实施例14:(r)-n-(4-(3-((5-氯-4-(甲基氨基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
甲酸酯
[0221]
在室温下向2-氯-n-甲基-5-(三氟甲基)嘧啶-4-胺(760mg,3.59mmol)和(r)-叔丁基3-氨基吡咯烷-1-甲酸酯(1.34g,7.18mmol)在dmso(20ml)中的溶液中加入k2co3(992mg,7.18mmol)。将混合物在微波下在170℃下搅拌1.5小时。将混合物在真空中浓缩。用硅胶色谱法(pe/ea=10/1-5/1)对残余物进行纯化,得到(r)-叔丁基3-((4-(甲基氨基)-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-甲酸酯(958mg,73.7%),为白色固体。针对c
15h22
f3n5o2的[m h]计算值,362;实测值,362。步骤3:(r)-n4-甲基-n2-(吡咯烷-3-基)-5-(三氟甲基)嘧啶-2,4-二胺盐酸盐
[0222]
在室温下向(r)-叔丁基3-氨基吡咯烷-1-甲酸酯(958mg,2.65mmol)在乙酸乙酯(etoac)(2ml)中的冷却溶液中加入hcl(15.0ml,在乙酸乙酯中为2m,30.0mmol),将混合物在室温下搅拌1小时。浓缩混合物得到(r)-n4-甲基-n2-(吡咯烷-3-基)-5-(三氟甲基)嘧啶-2,4-二胺盐酸盐(789mg,粗品),为白色固体。针对c
10h14
f3n5的[m h]计算值,262;实测值,262。步骤4:(r)-n-(4-(3-((4-(甲基氨基)-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0223]
向(r)-n4-甲基-n2-(吡咯烷-3-基)-5-(三氟甲基)嘧啶-2,4-二胺盐酸盐(789mg,2.65mmol)在dmso(20ml)中的溶液中加入diea(3.43g,26.5mmol)和n-(4-氯喹唑啉-7-基)丙烯酰胺(618mg,2.65mmol)。将混合物在40℃下搅拌30分钟。将混合物用水(50ml)稀释,并用thf(50ml*3)萃取。将合并的有机层经na2so4干燥、过滤并移除。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((4-(甲基氨基)-5-(三氟甲基)嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(28mg,2.3%),为白色固体。1hnmr(400mhz,dmso-d6):δ2.11(s,1h),2.25(s,1h),2.87-2.95(m,3h),3.84-3.93(m,2h),4.02-4.08(m,1h),4.19(s,1h),4.54(s,1h),5.83(dd,j=2.0,12.0hz,1h),6.33(dd,j=1.6,18.8hz,1h),6.49(dd,j=10.0,27.0hz,1h),6.86-6.92(m,1h),7.57-7.70(m,
2h),8.04-8.08(m,1h),8.14(d,j=2.0hz,1h),8.22(d,j=9.2hz,1h),8.39(s,1h),10.47(s,1h)。针对c
21h21
f3n8o的[m h]计算值,459;实测值,459。实施例16:(r)-n-(4-(3-(吡啶并[3,4-d]嘧啶-2-基氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0224]
将(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(tfa盐)(44mg,0.15mmol)、2-氯吡啶并[3,4-d]嘧啶(31mg,0.18mmol)和diea(97mg,0.75mmol)在dmso(3ml)中的混合物在微波下加热至140℃,持续30分钟。将混合物用水(20ml)稀释,并用dcm(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-(吡啶并[3,4-d]嘧啶-2-基氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(3.7mg,6.0%),为白色固体。1h nmr(400mhz,dmso-d6):δ2.18-2.32(m,1h),2.32-2.35(m,1h),3.91-4.00(m,2h),4.10-4.13(m,1h),4.23-4.28(m,1h),4.67-4.69(m,1h),5.82(dd,j=2.0,10.0hz,1h),6.30-6.35(m,1h),6.45-6.52(m,1h),7.63(dd,j=2.4,9.2hz,1h),7.72(dd,j=0.8,5.2hz,1h),8.15(d,j=2.4hz,1h),8.23-8.26(m,2h),8.35(d,j=5.2hz,1h),8.40(s,1h),8.96(s,1h),9.31(s,1h),10.47(s,1h)。针对c
22h20
n8o的[m h]计算值c
22h20
n8o,413.1;实测值,413.1。实施例17:(r)-n-(4-(3-((5-氯嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲氧基喹唑啉-7-基)丙烯酰胺步骤1:7-硝基喹唑啉-2,4(1h,3h)-二酮
[0225]
将2-氨基-4-硝基苯甲酸(10.0g,55.0mmol)和尿素(33.0g,55.0mmol)的混合物加
热到160℃,持续6h。然后将反应混合物冷却到100℃,加入水(60ml)。将溶液搅拌5min,滤出形成的沉淀物,用冷水洗涤,并进一步悬浮在0.5n naoh(50ml)中。将混合物回流5min。然后将反应混合物冷却至室温并过滤。将滤液用浓盐酸调节至ph=2。滤出粗产物,用甲醇/h2o=1:1(100ml)洗涤,真空干燥得到7-硝基喹唑啉-2,4(1h,3h)-二酮(10.4g,91%),为黄色固体。针对c8h5n3o4的计算值,208.0;实测值,208.0。步骤2:2,4-二氯-7-硝基喹唑啉
[0226]
在室温下向7-硝基喹唑啉-2,4(1h,3h)-二酮(3.0g,14.4mmol)在三氯氧磷(20ml)中的混合物中缓慢加入diea(3.7g,28.9mmol)。将反应混合物加热至140℃,持续3h。然后将反应混合物冷却和在真空中浓缩。经柱色谱法(pe:ea=5:1)纯化残余物得到2,4-二氯-7-硝基喹唑啉(2.5g,71%),为黄色固体。1hnmr(400mhz,cdcl3):δ8.48-8.49(m,2h),8.86(s,1h)。步骤3:(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0227]
在室温下向2,4-二氯-7-硝基喹唑啉(2.5g,10.3mmol)和(r)-叔丁基吡咯烷-3-基氨基甲酸酯(1.9g,10.3mmol)在ipa(40ml)中的混合物中,加入tea(3.1g,30.9mmol)。将反应混合物加热至80℃,过夜。将反应混合物冷却和在真空中浓缩。经柱色谱法(pe:ea=3:1)纯化残余物得到(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.0g,50%),为黄色固体。针对c
17h20
cln5o4的[m h]计算值,394.1;实测值,394.1。步骤4:(r)-叔丁基(1-(2-甲氧基-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0228]
向(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.0g,5.0mmol)在dmf(15ml)中的溶液中加入甲醇钠(meona)(270mg,5.0mmol)在甲醇(5ml)中的溶液。将反应混合物加热到80℃,持续3h。将反应混合物冷却和在真空中浓缩。经柱(pe:ea=5:1)纯化残余物得到(r)-叔丁基(1-(2-甲氧基-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.5g,77%),为黄色固体。针对c
18h23
n5o5的[m h]计算值,390.1;实测值,390.1。步骤5:(r)-叔丁基(1-(7-氨基-2-甲氧基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0229]
在1atm h2下在室温将(r)-叔丁基(1-(2-甲氧基-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.5g,3.8mmol)和pd/c(300mg,20%)在甲醇(30ml)中的溶液搅拌过夜。将反应混合物过滤并浓缩得到(r)-叔丁基(1-(7-氨基-2-甲氧基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.0g,72%),为黄色固体。针对c
18h25
n5o3的[m h]计算值,360.2;实测值,360.2。步骤6:(r)-叔丁基(1-(7-丙烯酰胺基-2-甲氧基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0230]
在0℃下向(r)-叔丁基(1-(7-氨基-2-甲氧基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.0g,3.0mmol)和diea(1.9g,15mmol)在dcm(20ml)中的溶液中加入丙烯酰氯(317mg,3.5mmol)在dcm(0.5ml)中的溶液。然后将混合物在n2下缓慢升温到室温,并搅拌过夜。将混合物用水(20ml)稀释,用dcm(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。经柱色谱法(dcm:甲醇=20:1)纯化残余物得到(r)-叔丁基(1-(7-丙烯酰胺基-2-甲氧基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(450mg,37.5%),为棕色固体。针对c
21h27
n5o4的[m h]计算值,414.2;实测值,414.2。步骤7:(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲氧基喹唑啉-7-基)丙烯酰胺(tfa盐)
[0231]
在室温下将(r)-叔丁基(1-(7-丙烯酰胺基-2-甲氧基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(200mg,0.48mmol)和tfa(1ml)在dcm(10ml)中的溶液搅拌3h。在真空中浓缩反应混合物,得到(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲氧基喹唑啉-7-基)丙烯酰胺(tfa盐)
(200mg,粗品),为黄色固体。针对c
16h19
n5o2的[m h]计算值,314.1;实测值,314.1。步骤8:(r)-n-(4-(3-((5-氯嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲氧基喹唑啉-7-基)丙烯酰胺(tfa盐)
[0232]
将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲氧基喹唑啉-7-基)丙烯酰胺(tfa盐)(200mg,0.48mmol)、2,5-二氯嘧啶(71mg,0.48mmol)和diea(309mg,2.4mmol)在dmso(10ml)中的混合物加热到60℃,过夜。冷却反应混合物,用水(20ml)稀释,并用dcm(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-氯嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲氧基喹唑啉-7-基)丙烯酰胺(tfa盐)(15.0mg,7.0%),为黄色固体。1hnmr(400mhz,dmso-d6):δ2.07-2.40(m,2h),4.04-4.10(m,6h),4.56(m,1h),5.89(dd,j=10.0,1.6hz,1h),6.34-6.38(m,1h),6.45-6.52(m,1h),7.55(d,j=8.4hz,1h),7.92(d,j=2.0hz,1h),8.26-8.41(m,4h),10.84(s,1h),13.61(br s,1h)。针对c
20h20
cln7o2的[m h]计算值,426.1;实测值,426.1实施例18:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺步骤1:(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0233]
将1-氯异喹啉-6-胺(355mg,1.99mmol)、(r)-叔丁基吡咯烷-3-基氨基甲酸酯(1.11g,5.98mml)和k2co3(413mg,2.99mmol)在dmso(5ml)中的混合物在微波下在180℃下搅
拌5小时。将混合物冷却,倒入50ml h2o中,并用ea(50ml*3)萃取。将合并的有机层经na2so4干燥,过滤并浓缩。经硅胶色谱法(pe/ea=1/1)纯化残余物得到(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(360mg,55%),为白色固体。针对c
18h24
n4o2的[m h]计算值,329.1;实测值,329.1。步骤2:(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0234]
在0℃下在氮气气氛下将(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(320mg,0.98mmol)和diea(629mg,4.88mmol)在dmf(10ml)中的混合物搅拌。滴加丙烯酰氯(88mg,0.98mmol)在dmf(1ml)中的溶液,并将混合物升温至室温,持续1小时。将混合物倒入50mlh2o中,用ea(50ml*3)萃取。将合并的有机层经na2so4干燥,过滤并浓缩。经硅胶色谱法(pe/ea=2/1)纯化残余物得到(r)-叔丁基(1-(6-丙烯酰胺基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(220mg,59%),为黄色固体。针对c
21h26
n4o3的[m h]计算值,383.4;实测值,383.4。步骤3:(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0235]
在室温下将(r)-叔丁基(1-(6-丙烯酰胺基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(220mg,0.58mmol)和tfa(1ml)在dcm(10ml)中的溶液搅拌2h。在真空中浓缩反应混合物得到(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(tfa盐)(190mg,粗品),为黄色油状物。针对c
16h18
n4o的[m h]计算值,283.1;实测值,283.1。步骤4:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺
[0236]
在60℃下将(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(120mg,
0.30mmol)、2,5-二氯-4-乙氧基嘧啶(58mg,0.30mml)和diea(194mg,1.51mmol)在dmso(3ml)中的混合物搅拌16小时。将反应混合物冷却并浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(60.3mg,47%),为灰色固体。1h nmr(400mhz,dmso-d6):2.03-2.06(m,1h),2.21-2.22(m,1h),3.69-3.73(m,1h),3.81-3.83(m,1h),3.92-3.94(m,1h),4.03-4.07(m,1h),4.39-4.40(m,1h),5.80-5.83(m,1h),6.29-6.34(m,1h),6.46-6.53(m,1h),6.95-6.96(m,1h),7.55-7.58(m,1h),7.80-7.82(m,1h),7.86(d,j=5.6hz,1h),8.17-8.20(m,2h),8.40(s,2h),10.41(s,1h)。针对c
20h19
brn6o2的[m h]计算值,440.1;实测值,440.1。实施例19:(r)-n-(1-(3-((5-氯-4-乙氧基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺
[0237]
在微波条件下在150℃下将(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(50mg,0.13mmol)、2,5-二氯-4-乙氧基嘧啶(24mg,0.13mml)和diea(81mg,0.63mmol)在dmso(3ml)中的混合物搅拌30分钟。将反应混合物冷却并浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-氯-4-乙氧基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(10.6mg,19%),为白色固体。1h nmr(400mhz,dmso-d6):1.23-1.33(m,3h),2.03-2.08(m,1h),2.22-2.24(m,1h),3.70-3.74(m,1h),3.81-3.83(m,1h),3.90-3.91(m,1h),3.92-3.94(m,1h),4.06-4.08(m,1h),4.16-4.20(m,1h),4.50(s,1h),5.81-5.84(dd,j=10.4,2.0,1h),6.30-6.35(m,1h),6.47-6.54(m,1h),6.96-6.98(m,1h),7.56-7.59(m,1h),7.68(br s,1h),8.13(m,1h),8.20-8.22(m,1h),10.44(s,1h)。针对c
22h23
cln6o2的[m h]计算值,439.9;实测值,439.9。实施例20:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-吗啉代喹唑啉-7-基)丙烯酰胺
步骤1:(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0238]
在室温下向2,4-二氯-7-硝基喹唑啉(3.0g,12.3mmol)和(r)-叔丁基吡咯烷-3-基氨基甲酸酯(2.3g,12.3mmol)在dcm(50ml)中的混合物中加入diea(4.76g,36.9mmol),搅拌2小时。将混合物用水(100ml)洗涤并浓缩。经硅胶色谱法(pe:ea=1.5:1)纯化残余物得到(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(4.8g,99%),为黄色固体。针对c
17h20
cln5o4的[m h]计算值,394.1;实测值,394.1。步骤2:(r)-叔丁基(1-(2-吗啉代-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0239]
在90℃下将(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.2g,3.0mmol)、吗啉(313mg,3.6mmol)和diea(1.16g,9.0mmol)在nmp(10ml)中的溶液搅拌3小时。将混合物冷却,用乙酸乙酯(200ml)稀释,用水(100ml*3)和盐水(50ml)洗涤,经na2so4干燥,过滤并在真空中浓缩以得到(r)-叔丁基(1-(2-吗啉代-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.3g,98%),为红色固体。针对c
21h28
n6o5的[m h]计算值,445.2;实测值,445.2。步骤3:(r)-叔丁基(1-(7-氨基-2-吗啉代喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0240]
在80℃下将(r)-叔丁基(1-(2-吗啉代-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.33g,3.0mmol)与nh4cl(1.6g,30.0mmol)在甲醇(30ml)和水(10ml)中的混合物搅拌2小时。然后加入zn(1.6g,30.0mmol)。将混合物在80℃搅拌2小时。将混合物冷却,过滤并浓缩。经柱色谱法(dcm:甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(7-氨基-2-吗啉代喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(800mg,65%),为红色固体。针对c
21h30
n6o3的[m h]计算值,415.2;实测值,415.2。步骤4:(r)-叔丁基(1-(7-丙烯酰胺基-2-吗啉代喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0241]
向(r)-叔丁基(1-(7-氨基-2-吗啉代喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.0g,2.41mmol)在dcm(10ml)中的溶液中加入diea(622mg,4.82mmol)和丙烯酰氯(219mg,2.41mmol)。将混合物在室温下搅拌2小时。将混合物用水(10ml)洗涤,并用dcm(40ml)萃取。将有机层浓缩。经柱色谱法(dcm:ea:thf=4:1:0.5)纯化残余物得到(r)-叔丁基(1-(7-丙烯酰胺基-2-吗啉代喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(800mg,71%),为红色固体。针对c
24h32
n6o4的[m h]计算值,469.2;实测值,469.2。步骤5:(r)-n-(4-(3-氨基吡咯烷-1-基)-2-吗啉代喹唑啉-7-基)丙烯酰胺
[0242]
在室温下将(r)-叔丁基(1-(7-丙烯酰胺基-2-吗啉代喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(200mg,0.43mmol)和tfa(1.5ml)在dcm(6ml)中的溶液搅拌1h。在真空中浓缩反应混合物得到(r)-n-(4-(3-氨基吡咯烷-1-基)-2-吗啉代喹唑啉-7-基)丙烯酰胺(tfa盐)(157mg,100%),为红色油状物。针对c
19h24
n6o2的[m h]计算值,369.2;实测值,369.2。
步骤6:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-吗啉代喹唑啉-7-基)丙烯酰胺
[0243]
将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-吗啉代喹唑啉-7-基)丙烯酰胺(tfa盐)(157mg,0.43mmol)、5-溴-2-氯嘧啶(82mg,0.43mmol)和diea(278mg,2.15mmol)在dmso(3ml)中的混合物加热至60℃,过夜。冷却反应混合物,用水(20ml)稀释,用dcm(40ml)萃取。用水(50ml*3)和盐水(20ml)洗涤有机层,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-吗啉代喹唑啉-7-基)丙烯酰胺(64.2mg,28%),为白色固体。1h nmr(400mhz,dmso-d6):δ2.03-2.07(m,1h),2.20-2.22(m,1h),3.64-3.81(m,8h),3.77-3.81(m,1h),3.86-3.91(m,1h),4.01-4.13(m,2h),4.43-4.45(m,1h),5.79(dd,j=2.0,10.0hz,1h),6.27-6.32(m,1h),6.43-6.50(m,1h),7.21(dd,j=2.4,9.2hz,1h),7.83-7.87(m,2h),7.98(d,j=9.2hz,1h),8.13(s,1h),8.42(s,2h),10.27(s,1h)。针对c
23h25
brn8o2的[m h]计算值,525.1;实测值,525.1。实施例21:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)丙烯酰胺的合成步骤1:(r)-叔丁基(1-(2-甲基-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0244]
在微波下在115℃下将(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)
氨基甲酸酯(500mg,1.26mmol)、2,4,6-三甲基-1,3,5,2,4,6-三氧杂三硼杂环己烷(trioxatriborinane)(540mg,1.90mmol)、pd(dppf)2cl2(103mg,0.12mmol)和k2co3(520mg,3.80mmol)在1,4-二噁烷(6ml)中的混合物搅拌2小时。经减压除去溶剂,用dcm(30ml)稀释残余物,然后用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。用(1:1,石油醚:乙酸乙酯)柱色谱法纯化残余物得到(r)-叔丁基(1-(2-甲基-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(200mg,42.2%),为黄色固体。针对c
18h23
n5o4的[m h]计算值,374.0;实测值,374.0。步骤2:(r)-叔丁基(1-(7-氨基-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0245]
向(r)-叔丁基(1-(2-甲基-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.4g,3.8mmol)在乙醇(50ml)中的混合物中加入pd/c(0.8g)。在室温在氢气气氛下将反应搅拌3小时。将混合物过滤并浓缩得到(r)-叔丁基(1-(7-氨基-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.2g,粗品),为灰白色固体。针对c
18h25
n5o2的[m h]计算值,344.3;实测值,344.3。步骤3:(r)-叔丁基(1-(7-丙烯酰胺基-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0246]
在0℃下将丙烯酰氯(0.27ml,3.41mmol)缓慢加入(r)-叔丁基(1-(7-氨基-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.3g,3.78mmol)和diea(1.67ml,11.3mmol)在dcm(80ml)中的混合物中。将混合物在室温下搅拌3h。将反应混合物浓缩。通过制备型hplc纯化残余物得到(r)-叔丁基(1-(7-丙烯酰胺基-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(12mg,9.2%),为白色固体。[m h]计算值398.4;实测值,398.4。步骤4:(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)丙烯酰胺
[0247]
在室温下将tfa(0.2ml)加入(r)-叔丁基(1-(7-丙烯酰胺基-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(135mg,0.34mmol)在二氯甲烷(3ml)中的溶液中。将混合物于室温搅拌3h。将反应混合物浓缩获得(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)
丙烯酰胺的tfa盐(200mg,粗品),为棕色液体。[m h]计算值298.2;实测值,298.3。步骤5:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)丙烯酰胺
[0248]
在氮气气氛下在100℃下将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)丙烯酰胺(100mg,0.33mmol)、5-溴-2-氯嘧啶(104mg,0.53mml)和diea(0.55ml,3.36mmol)在dmso(10ml)中的混合物搅拌4小时。将反应混合物冷却并浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)丙烯酰胺(10.3mg,8.3%),为白色固体。1hnmr(400mhz,dmso-d6):2.07(m,1h),2.02(m,1h),2.41(s,3h),3.82-4.03(m,4h),4.421-4.44(m,1h),5.81(dd,j=2.0,10.0hz,1h),6.29-6.34(m,1h),6.45-6.52(m,1h),7.55(dd,j=2.4,9.2hz,1h),7.84(d,j=6.0hz,1h),8.048(d,j=2.4hz,1h),8.15(d,j=9.6hz,1h),8.42(s,2h),10.42(s,1h)。[m h]计算值455.3;实测值,455.3。实施例22:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-吗啉代喹唑啉-7-基)丙烯酰胺的合成
[0249]
将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-吗啉代喹唑啉-7-基)丙烯酰胺(tfa盐)(146mg,0.4mmol)、2-氯嘧啶-5-甲腈(55mg,0.4mmol)和diea(258mg,2.0mmol)在dmso(2ml)中的混合物加热至70℃,持续2小时。将残余物冷却,用水(20ml)稀释,并用dcm(30ml*2)萃取。将合并的有机层用水(30ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。用制备型-hplc纯化残余物得到(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-吗啉代喹唑啉-7-基)丙烯酰胺(41.4mg,22%),为黄色固体。1h nmr(400mhz,dmso-d6):δ2.07-2.11(m,1h),2.23-2.28(m,1h),3.64-3.71(m,8h),3.79-3.83(m,1h),3.89-3.93(m,1h),4.02-4.05(m,1h),4.11-4.15(m,1h),4.55-4.59(m,1h),5.79(dd,j=10.0,2.0hz,1h),6.27-6.32(m,1h),6.44-6.50(m,1h),7.22(dd,j=2.0,8.8hz,1h),7.86(d,j=2.0hz,1h),7.97(d,j=9.2hz,1h),8.14(s,1h),8.65-8.69(m,2h),8.77(d,j=2.4hz,1h),10.26(s,1h)。针对c
24h25
n9o2的[m h]计算值,472.2;实测值,472.2。
实施例23:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)丙烯酰胺步骤1:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)丙烯酰胺
[0250]
将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)丙烯酰胺(139mg,0.36mmol)、5-溴-2-氯嘧啶(75mg,0.36mmol)和diea(232mg,26.00mmol)在dmso(2ml)中的混合物加热至60℃,过夜。冷却反应混合物,用水(10ml)稀释,并用dcm(10ml*2)萃取。将合并的有机层用水(10ml*2)和盐水(10ml)洗涤,经na2so4干燥,过滤并真空浓缩。残余物通过制备型hplc纯化,得到(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)丙烯酰胺(2.5mg,1%),为白色固体。1h nmr(400mhz,dmso-d6):δ1.23-1.29(m,1h),1.44-1.46(m,1h),2.00-2.07(m,3h),2.19-2.24(m,2h),2.38-2.41(m,2h),3.73-4.12(m,8h),4.39-4.42(m,1h),5.79(dd,j=2.0,10.0hz,1h),6.26-6.31(m,1h),6.43-6.47(m,1h),7.19(dd,j=2.4,9.2hz,1h),7.82-7.83(m,2h),7.96(d,j=9.2hz,1h),8.42(s,2h),10.24(s,1h)。针对c
24h28
brn9o的[m h]ms计算值,538.2;实测值,538.2。实施例24:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)丙烯酰胺
步骤1:(r)-叔丁基(1-(2-(4-甲基哌嗪-1-基)-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0251]
在90℃下将(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(10.0g,25.4mmol)、1-甲基哌嗪(2.6g,26.0mmol)和diea(6.6g,50.8mmol)在nmp(100ml)中的溶液搅拌3小时。将反应混合物冷却,用乙酸乙酯(200ml*2)萃取。将合并的有机层用水(100ml*3)和盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并在减压下浓缩。经硅胶柱色谱法(dcm:甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(2-(4-甲基哌嗪-1-基)-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(9.0g,77%),为红色固体。针对c
22h31
n7o4的[m h]ms计算值458.2;实测值,458.2。步骤2:(r)-叔丁基(1-(7-氨基-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0252]
在80℃下将(r)-叔丁基(1-(2-(4-甲基哌嗪-1-基)-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(9.0g,19.7mmol)与nh4cl(10.4g,197.0mmol)在甲醇(90ml)和水(30ml)中的混合物搅拌2小时。然后加入zn(12.8g,197.0mmol)。将混合物在80℃下搅拌2小时。将
混合物冷却,过滤并浓缩。经柱(dcm:甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(7-氨基-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(6.7g,79%),为红色固体。针对c
22h33
n7o2的[m h]ms计算值428.3;实测值,428.3。步骤3:(r)-叔丁基(1-(7-丙烯酰胺基-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0253]
在0℃向(r)-叔丁基(1-(7-氨基-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(6.7g,15.6mmol)在dcm(50ml)中的溶液中加入diea(8.0ml,46.8mmol)和丙烯酰氯(1.4g,15.6mmol)。将反应混合物在室温下搅拌2小时。用水(50ml)稀释混合物,并用dcm(50ml*2)萃取。将合并的有机层浓缩。经柱(dcm:甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(7-丙烯酰胺基-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.2g,29%),为黄色固体。针对c
25h35
n7o3的[m h]ms计算值482.3;实测值,482.3。步骤4:(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)丙烯酰胺tfa盐
[0254]
将(r)-叔丁基(1-(7-丙烯酰胺基-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.2g,5.6mmol)和tfa(6ml)在dcm(20ml)中的溶液在室温下搅拌1h。经真空浓缩反应混合物得到(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)丙烯酰胺的tfa盐(1.74g),为黄色油状物。针对c
20h27
n7o的[m h]ms计算值382.2;实测值,382.2。步骤5:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)丙烯酰胺hccoh盐
[0255]
将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)丙烯酰胺的tfa盐(2.0g,5.2mmol)、2-氯嘧啶-5-甲腈(729mg,5.2mmol)和diea(4.6ml,26.0mmol)在dmso(20ml)中的混合物加热至30℃,持续2h。冷却反应混合物,用水(40ml)稀释,并用dcm(40ml*2)萃取。将合并的有机层用水(50ml*2)和盐水(50ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)丙烯酰胺的hcooh盐(295.0mg,12%),为黄色固体。1h nmr(400mhz,dmso-d6):δ2.03-2.10(m,1h),2.20-2.27(m,1h),2.53-2.57(m,3h),2.67-2.81(m,4h),3.80-4.15(m,8h),4.57-4.59(m,1h),5.79(dd,j=2.0,10.0hz,1h),6.27-6.32(m,1h),6.43-6.50(m,1h),7.22(dd,j=2.4,9.2hz,1h),7.95-8.02(m,2h),8.13(s,1h),8.65-8.70(m,2h),8.78(s,1h),10.31(s,1h)。针对c
25h28n10
o的[m h]ms计算值,485.2;实测值,485.2。实施例25:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺步骤1:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺hcooh盐
[0256]
将(r)-n-(4-(3-氨基吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(tfa盐)(170mg,0.60mmol)、5-溴-2-氯嘧啶(116mg,0.60mmol)和diea(0.5ml,3.0mmol)在dmso(10ml)中的
混合物加热至60℃,持续2天。经冷却反应混合物,用水(20ml)稀释,并用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物后得到(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的hcooh盐(29.8mg,11%),为白色固体。1h nmr(400mhz,dmso-d6):δ2.03-2.10(m,1h),2.20-2.27(m,1h),3.82-3.85(m,1h),3.91-3.97(m,1h),4.03-4.10(m,1h),4.15-4.19(m,1h),4.43-4.47(m,1h),5.83(dd,j=2.4,10.2hz,1h),6.30-6.35(m,1h),6.45-6.52(m,1h),7.63(dd,j=2.4,9.2hz,1h),7.87(d,j=6.0hz,1h),8.13-8.16(m,2h),8.22(d,j=9.2hz,1h),8.38-8.42(m,3h),10.47(s,1h)。针对c
19h18
brn7o的[m h]ms计算值,440.1;实测值,440.0。实施例26:(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺步骤1:(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺hcooh盐
[0257]
在40℃下将(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(160mg,0.56mmol)、2-氯嘧啶-5-甲腈(79mg,0.56mml)和diea(365mg,2.83mmol)在dmso(10ml)中的混合物搅拌1h。冷却反应混合物,用水(20ml)稀释,用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺的hcooh盐(165.8mg,76.7%),为黄色固体。1h nmr(400mhz,dmso-d6):δ2.06-2.09(m,1h),2.23-2.26(m,1h),3.72-3.75(m,1h),3.82-3.85(m,1h),3.94-3.96(m,1h),4.05-4.09(m,1h),4.51-4.54(m,1h),5.81(dd,j=2.0,10.4hz,1h),6.29-6.33(m,1h),6.46-6.52(m,1h),6.98(d,j=5.6hz,1h),7.58(dd,j=2.0,9.2hz,1h),7.87(d,j=5.6hz,1h),8.13-8.20(m,3h),8.67-8.76(m,3h),10.42(s,1h),12.61(br s,1h)。针对c
21h19
n7o的[m h]ms计算值,386.2;实测值,386.2。实施例27:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺
步骤1:(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0258]
在微波中在160℃下将1-氯异喹啉-6-胺(500mg,2.8mmol)、(r)-叔丁基吡咯烷-3-基氨基甲酸酯(1.0g,5.6mml)和k2co3(580mg,4.2mmol)在dmso(10ml)中的混合物搅拌1h。冷却反应混合物,用水(20ml)稀释,并用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。经硅胶柱色谱法(pe:ea=0:1)纯化残余物得到(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.4g,39%),为黄色固体。针对c
18h24
n4o2的[m h]ms计算值,329.2;实测值,329.2。步骤2:(r)-叔丁基(1-(6-(甲基氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0259]
向(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(500mg,1.5mmol)在甲醇(20ml)中的溶液中加入hcho(183mg,在水中为30%,6.0mmol)。将反应混合物在室温下搅拌1h。然后加入nabh3cn(144mg,12.0mmol)。将混合物在60℃下搅拌过夜。将混合物冷却,用2n hcl溶剂(5ml)稀释,并用ea(20ml*2)萃取。将合并的有机层浓缩。经硅胶柱色谱法(pe:ea=0:1)纯化残余物得到(r)-叔丁基(1-(6-(甲基氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(300mg,53%),为黄色固体。针对c19h26n4o2的[m h]ms计算值,343.2;实测值,343.2。步骤3:(r)-叔丁基(1-(6-(n-甲基丙烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0260]
在0℃在氮气气氛下向(r)-叔丁基(1-(6-(甲基氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(250mg,0.72mmol)和diea(283mg,2.21mmol)在dcm(20ml)中的混合物缓慢加入丙烯酰氯(73mg,0.80mmol)。将混合物在室温搅拌过夜。将混合物浓缩并经硅胶柱色谱法(pe:ea=0:1)纯化得到(r)-叔丁基(1-(6-(n-甲基丙烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(200mg,58%),为黄色油状物。针对c22h28n4o3的[m h]ms计算值,397.2;实测值,397.2。步骤4:(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺tfa盐
[0261]
将(r)-叔丁基(1-(6-(n-甲基丙烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(200mg,0.50mmol)和tfa(5ml)在dcm(5ml)中的溶液在室温下搅拌2小时。将混合物浓缩得到(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺的tfa盐(148mg),为棕色油状物。针对c
17h20
n4o的[m h]ms计算值,297.2;实测值,297.2。步骤5:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺
[0262]
将(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺(100mg,0.34mmol)、5-溴-2-氯嘧啶(98mg,0.51mmol)和diea(132mg,0.90mmol)在dmso(10ml)中的混合物在微波中在80℃下搅拌1h。冷却反应混合物,用水(20ml)稀释,并用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物,得到(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺(27.5mg,12%),为白色固体。1h nmr(400mhz,dmso-d6):δ2.04-2.07(m,1h),2.21-2.25(m,1h),3.33(s,3h),3.71-3.75(m,1h),3.83-3.85(m,1h),3.95-3.98(m,1h),4.06-4.11(m,1h),4.40-4.42(m,1h),5.59(dd,j=3.2,9.6hz,1h),6.15-6.18(m,2h),7.04(d,j=5.6hz,1h),7.36(dd,j=2.0,9.2hz,1h),7.64(d,j=2.0hz,1h),7.82(d,j=6.4hz,1h),7.95(d,j=5.6hz,1h),8.28(d,j=8.8hz,1h),8.40(s,2h)。针
对c
21h21
brn6o的[m h]ms计算值,453.1;实测值,453.2。实施例28:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺步骤1:(r,e)-叔丁基(1-(6-(丁-2-烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0263]
在0℃在氮气气氛下向(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(600mg,1.83mmol)和diea(708mg,5.48mmol)在dcm(30ml)中的混合物缓慢加入(e)-丁-2-烯酰氯(190mg,1.83mmol)。将混合物在室温搅拌过夜。将混合物浓缩并经硅胶柱色谱法(dcm:甲醇=20:1)纯化得到(r,e)-叔丁基(1-(6-(丁-2-烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(280mg,38.6%),为黄色固体。针对c22h28n4o3的[m h]ms计算值,397.2;实测值,397.2。步骤2:(r,e)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)-丁-2-烯酰胺tfa盐
[0264]
将(r,e)-叔丁基(1-(6-(丁-2-烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(280mg,0.71mmol)和tfa(10ml)在dcm(10ml)中的溶液在室温下搅拌2小时。将混合物浓缩得到(r,e)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丁-2-烯酰胺的tfa盐(210mg),为棕色油状物。针对c
17h20
n4o的[m h]ms计算值,297.2;实测值,297.2。步骤3:(r,e)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丁-2-烯酰胺hcooh盐
[0265]
将(r,e)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丁-2-烯酰胺(150mg,0.51mmol)、5-溴-2-氯嘧啶(98mg,0.51mmol)和diea(327mg,2.53mmol)在dmso(10ml)中的混合物在微波中在80℃下搅拌1h。冷却反应混合物,用水(20ml)稀释,并用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r,e)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丁-2-烯酰胺的hcooh盐(27.5mg,12%),为白色固体。1h nmr(400mhz,dmso-d6):δ1.89(dd,j=1.2,7.2hz,3h),2.02-2.05(m,1h),2.21-2.23(m,1h),3.68-3.72(m,1h),3.79-3.82(m,1h),3.91-3.93(m,1h),4.02-4.17(m,1h),4.38-4.40(m,1h),6.18(dd,j=1.6,15.2hz,1h),6.83-6.88(m,1h),6.94(d,j=6.0hz,1h),7.52-7.55(m,1h),7.82-7.85(m,2h),8.13-8.17(m,3h),8.40(s,2h),10.23(s,1h),12.78(br s,1h)。针对c
21h21
brn6o的[m h]ms计算值,453.1;实测值,453.2。实施例29:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺步骤1:(r)-叔丁基(1-(7-硝基-2-(吡咯烷-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0266]
将(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.5g,
3.8mmol)、吡咯烷(409mg,5.7mmol)和diea(1.5g,11.4mmol)在dmso(30ml)中的溶液在90℃下搅拌2小时。用水(70ml)稀释混合物并用乙酸乙酯(50ml*2)萃取。将合并的有机层用水(50ml*3)和盐水(50ml)洗涤,经无水硫酸钠干燥,过滤并减压浓缩。通过硅胶柱色谱法(pe/ea=2/1)纯化残余物,得到(r)-叔丁基(1-(7-硝基-2-(吡咯烷-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.6g,98%),为黄色固体。针对c
21h28
n6o4的[m h]ms计算值,429.2;实测值,429.2。步骤2:(r)-叔丁基(1-(7-氨基-2-(吡咯烷-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0267]
将(r)-叔丁基(1-(7-硝基-2-(吡咯烷-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.6g,3.7mmol)与nh4cl(1.9g,37.0mmol)在甲醇(40ml)和水(8ml)中的混合物在80℃下搅拌2小时。然后加入zn(2.4g,37.0mmol)。将混合物在80℃搅拌2小时。将混合物冷却,过滤并浓缩。经柱(dcm:甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(7-氨基-2-(吡咯烷-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.5g,98%),为黄色固体。针对c
21h30
n6o2的[m h]ms计算值,399.2;实测值,399.2。步骤3:(r)-叔丁基(1-(7-丙烯酰胺基-2-(吡咯烷-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0268]
在0℃下向(r)-叔丁基(1-(7-氨基-2-(吡咯烷-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.4g,3.5mmol)在dcm(40ml)中的溶液中加入diea(1.4g,10.5mmol)和丙烯酰氯(317mg,3.5mmol)。将混合物在室温下搅拌2小时。用水(50ml)洗涤混合物,并用dcm(50ml*2)萃取。将合并的有机层浓缩。经柱(dcm:甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(7-丙烯酰胺基-2-(吡咯烷-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(600mg,40%),为黄色固体。针对c
24h32
n6o3的[m h]ms计算值,453.3;实测值,453.3。步骤4:(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺tfa盐
[0269]
将(r)-叔丁基(1-(7-丙烯酰胺基-2-(吡咯烷-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(600mg,1.3mmol)和tfa(10ml)在dcm(10ml)中的溶液在室温下搅拌1h。将反应混合物真空浓缩,得到(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的tfa盐(467mg),为黄色固体。针对c
19h24
n6o的[m h]ms计算值,353.2;实测值,353.2。步骤5:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺hcooh盐
[0270]
将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(tfa盐)(367mg,1.04mmol)、2-氯嘧啶-5-甲腈(217mg,1.60mmol)和diea(402mg,3.12mmol)在dmso(15ml)中的混合物加热至30℃,持续2h。冷却反应混合物,用水(20ml)稀释,并用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的hcooh盐(328.5mg,54%),为白色固体。1hnmr(400mhz,dmso-d6):δ1.88-1.91(m,4h),2.05-2.09(m,1h),2.23-2.27(m,1h),3.50-3.53(m,4h),3.80-3.84(m,1h),3.89-3.92(m,1h),4.02-4.05(m,1h),4.11-4.15(m,1h),4.55-4.57(m,1h),5.79(dd,j=1.6,10.0hz,1h),6.27-6.32(m,1h),6.43-6.50(m,1h),7.15(dd,j=2.0,9.2hz,1h),7.89-7.96(m,2h),8.16(s,1h),8.65-8.69(m,2h),8.78(d,j=2.4hz,1h),10.23(s,1h)。针对c
24h25
n9o的[m h]ms计算值,456.2;实测值,456.2。实施例30:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)丙烯酰胺
[0271]
将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)丙烯酰胺(165mg,0.55mmol)、2-氯嘧啶-5-甲腈(62mg,0.44mml)和diea(0.46ml,2.77mmol)在dmso(10ml)中的混合物在40℃在氮气气氛下搅拌2小时。冷却反应混合物,用水(20ml)稀释,用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)丙烯酰胺(58.5mg,26.3%),为白色固体。1hnmr(400mhz,dmso-d6):2.07-2.10(m,1h),2.26-2.28(m,1h),2.41(s,3h),3.82-3.85(m,1h),3.87-3.94(m,1h),4.04-4.07(m,1h),4.14-4.19(m,1h),4.55-4.57(m,1h),5.82(dd,j=1.6,10.0hz,1h),6.29-6.34(m,1h),6.45-6.52(m,1h),7.56(dd,j=2.4,8.2hz,1h),8.05(d,j=2.0hz,1h),8.16(d,j=9.2hz,1h),8.67-8.69(m,2h),8.79(d,j=2.8hz,1h),10.44(s,1h)。针对c
21h20
n8o的[m h]ms计算值,401.2;实测值,401.2。实施例31:(r)-n-(2-氨基-4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺步骤1:(r)-叔丁基(1-(2-(2,4-二甲氧基苄基)氨基)-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0272]
将(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.1g,
5.6mmol)、dmbnh2(1.4g,8.4mml)和diea(3.6g,27.9mmol)在dmso(20ml)中的混合物在90℃在氮气气氛下搅拌过夜。冷却反应混合物,用水(50ml)稀释,并用dcm(50ml*2)萃取。将合并的有机层用水(50ml*2)和盐水(50ml)洗涤,经na2so4干燥,过滤并真空浓缩。通过硅胶柱色谱法(pe:ea=2:1)纯化残余物得到(r)-叔丁基(1-(2-(2,4-二甲氧基苄基)氨基)-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.3g,78%),为红色固体。针对c
26h32
n6o6的[m h]ms计算值,525.2;实测值,525.2。步骤2:(r)-叔丁基(1-(7-氨基-2-((2,4-二甲氧基苄基)氨基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0273]
将(r)-叔丁基(1-(2-((2,4-二甲氧基苄基)氨基)-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.3g,4.4mmol)与nh4cl(2.4g,44.0mmol)在甲醇(40ml)和水(8ml)中的混合物在80℃下搅拌2小时。然后加入zn(2.4g,44.0mmol)。将混合物在80℃搅拌2小时。将混合物冷却,过滤并浓缩。经硅胶柱色谱法(dcm:meoh=10:1)纯化残余物得到(r)-叔丁基(1-(7-氨基-2-((2,4-二甲氧基苄基)氨基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.2g,100%),为黄色固体。针对c
26h34
n6o4的[m h]ms计算值,495.3;实测值,495.3。步骤3:(r)-4-(3-氨基吡咯烷-1-基)喹唑啉-2,7-二胺
[0274]
将(r)-叔丁基(1-(7-氨基-2-((2,4-二甲氧基苄基)氨基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.0g,4.0mmol)和tfa(8ml)在dcm(20ml)中的溶液在室温下搅拌1h。将反应混合物真空浓缩得到(r)-4-(3-氨基吡咯烷-1-基)喹唑啉-2,7-二胺的tfa盐(987mg),为黑色油状物。针对c
12h16
n6的[m h]ms计算值,245.1;实测值,245.1。步骤4:(r)-2-((1-(2,7-二氨基喹唑啉-4-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈
[0275]
将(r)-4-(3-氨基吡咯烷-1-基)喹唑啉-2,7-二胺(1.0g,4.1mmol)、2-氯嘧啶-5-甲腈(510mg,4.1mmol)和diea(1.6g,12.3mmol)在thf(20ml)中的混合物在30℃在氮气气氛下搅拌2小时。浓缩残余物并经硅胶柱色谱法(dcm:甲醇=10:1)纯化得到(r)-2-((1-(2,7-二氨基喹唑啉-4-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈(1.2g,85%),为黄色油状物。针对c
17h17
n9的[m h]ms计算值,348.2;实测值,348.2。步骤5:(r)-n-(2-氨基-4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0276]
在0℃下向(r)-2-((1-(2,7-二氨基喹唑啉-4-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈(600mg,1.7mmol)在丙酮(8ml)和h2o(4ml)中的溶液中加入k2co3(716mg,5.2mmol)和丙烯酰氯(155mg,1.7mmol)。将混合物在0℃下搅拌1h。对混合物进行浓缩并通过制备型hplc纯化,得到(r)-n-(2-氨基-4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺的hcooh盐(24.3mg,4%),为白色固体。1h nmr(400mhz,dmso-d6):2.07-2.11(m,1h),2.23-2.28(m,1h),3.71-3.81(m,1h),3.87-3.93(m,1h),4.00-4.05(m,1h),4.10-4.15(m,1h),4.52-4.56(m,1h),5.78(dd,j=2.0,10.0hz,1h),6.27-6.31(m,1h),6.43-6.50(m,3h),7.29(d,j=8.8hz,1h),7.73(s,1h),7.97(d,j=9.2hz,1h),8.26(s,1h),8.67-8.69(m,2h),8.78(s,1h),10.33(s,1h)。针对c
20h19
n9o的[m h]ms计算值,402.2;实测值,402.1。实施例32:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(2,2,2-三氟乙氧基)喹唑啉-7-基)丙烯酰胺
步骤1:(r)-叔丁基(1-(7-硝基-2-(2,2,2-三氟乙氧基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0277]
将(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(5.0g,12.7mmol)、2,2,2-三氟乙醇(1.5g,15.3mml)和k2co3(2.6g,19.0mmol)在dma(40ml)中的混合物在110℃在氮气气氛下搅拌过夜。冷却反应混合物,用水(100ml)稀释,并用dcm(100ml*2)萃取。将合并的有机层用水(100ml*2)和盐水(100ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。经硅胶柱色谱法(pe:ea=2:1)纯化残余物得到(r)-叔丁基(1-(7-硝基-2-(2,2,2-三氟乙氧基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(4.0g,69%),为红色固体。针对c
19h22
f3n5o5的[m h]ms计算值,458.2;实测值,458.2。步骤2:(r)-叔丁基(1-(7-氨基-2-(2,2,2-三氟乙氧基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0278]
将(r)-叔丁基(1-(7-硝基-2-(2,2,2-三氟乙氧基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(3.5g,7.7mmol)与nh4cl(4.0g,77.0mmol)在甲醇(40ml)和水(8ml)中的混合物在80℃搅拌2小时。然后加入zn(5.0g,77.0mmol)。将混合物在80℃下搅拌2小时。将混合物冷却,过滤并浓缩。经硅胶柱色谱法(dcm:甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(7-氨基-2-(2,2,2-三氟乙氧基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(800mg,25%),为黄色
固体。针对c
19h24
f3n5o3的[m h]ms计算值,428.2;实测值,428.2。步骤3:(r)-叔丁基(1-(7-丙烯酰胺基-2-(2,2,2-三氟乙氧基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0279]
在0℃向(r)-叔丁基(1-(7-氨基-2-(2,2,2-三氟乙氧基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(427mg,1.0mmol)在dmf(20ml)中的溶液中加入diea(387mg,3.0mmol)和丙烯酰氯(90mg,1.0mmol)。将混合物在室温下搅拌5h。将混合物浓缩并经硅胶柱色谱法纯化得到(r)-叔丁基(1-(7-丙烯酰胺基-2-(2,2,2-三氟乙氧基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(280mg,58%),为黄色固体。针对c
22h26
f3n5o4的[m h]ms计算值,482.2;实测值,482.2。步骤4:(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(2,2,2-三氟乙氧基)喹唑啉-7-基)丙烯酰胺tfa盐
[0280]
将(r)-叔丁基(1-(7-丙烯酰胺基-2-(2,2,2-三氟乙氧基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(280mg,0.58mmol)和tfa(10ml)在dcm(10ml)中的溶液在室温下搅拌1h。经真空浓缩反应混合物,得到(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(2,2,2-三氟乙氧基)喹唑啉-7-基)丙烯酰胺的tfa盐(222mg),为黄色固体。针对c
17h18
f3n5o2的[m h]ms计算值,382.1;实测值,382.1。步骤5:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(2,2,2-三氟乙氧基)喹唑啉-7-基)丙烯酰胺
[0281]
将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(2,2,2-三氟乙氧基)喹唑啉-7-基)丙烯酰胺(222mg,0.58mmol)、2-氯嘧啶-5-甲腈(121mg,1.87mmol)和diea(224mg,1.74mmol)在dmso(10ml)中的溶液在30℃下搅拌2h。将反应混合物用水(20ml)稀释,并用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(2,2,2-三氟乙氧基)喹唑啉-7-基)丙烯酰胺(97.7mg,35%),为黄色固体。1hnmr(400mhz,dmso-d6):2.09-2.13(m,1h),2.26-2.31(m,1h),3.85-3.88(m,1h),3.89-3.96(m,1h),4.00-4.06(m,1h),4.10-4.19(m,1h),4.57-4.61(m,1h),4.98-5.01(m,2h),5.82(dd,j=1.6,10.0hz,1h),6.30-6.34(m,1h),6.44-6.51(m,1h),7.47(dd,j=2.4,9.2hz,1h),8.06(d,j=2.0hz,1h),8.18(d,j=9.2hz,1h),8.67-8.69(m,2h),8.78(d,j=2.4hz,1h),10.44(s,1h)。针对c
22h19
f3n8o2的[m h]ms计算值,485.2;实测值,485.1。实施例33:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丁-2-炔酰胺步骤1:丁-2-炔酰氯
[0282]
在0℃向丁-2-炔酸(697mg,8.3mmol)和dmf(1滴)在dcm(5ml)中的溶液中加入(cocl)2(1.05g,8.3mmol)。将反应混合物在0℃搅拌1h。然后将反应混合物浓缩,得到粗的丁-2-炔酰氯(700mg,100%)。步骤2:(r)-叔丁基(1-(6-(丁-2-炔酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸
酯
[0283]
在0℃向(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(680mg,2.1mmol)和diea(1.06g,8.29mmol)在dcm(10ml)中的溶液中加入丁-2-炔酰氯(700mg)。将混合物在0℃搅拌30分钟。用水(20ml)稀释反应混合物,并用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤,在真空中浓缩,并经硅胶柱色谱法(dcm:甲醇=10:1)纯化获得(r)-叔丁基(1-(6-(丁-2-炔酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(2.3g,100%),为棕色油状物。针对c
22h26
n4o3的[m h]ms计算值,395.2;实测值,395.2。步骤3:(r)-n-(1-(3-氨基吡咯烷-1基)异喹啉-6-基)丁-2-炔酰胺
[0284]
将(r)-叔丁基(1-(6-(丁-2-炔酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(2.0g,2.1mmol)和tfa(9ml)在dcm(9ml)中的溶液在室温下搅拌1h。在真空浓缩反应混合物,并通过硅胶柱色谱法(dcm:甲醇=4:1)纯化得到(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丁-2-炔酰胺(477mg,61%),为棕色固体。针对c
17h18
n4o的[m h]ms计算值,295.1;实测值,295.1。步骤4:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丁-2-炔酰胺
[0285]
在微波下在80℃下将(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丁-2-炔酰胺(400mg,1.36mmol)、5-溴-2-氯嘧啶(523mg,2.71mmol)和diea(877mg,6.80mmol)在dmso(5ml)中的溶液搅拌2h。将反应混合物用水(20ml)稀释,并用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-2-炔酰胺(98.9mg,16.2%),为白色固体。1hnmr(400mhz,dmso-d6):2.03-2.07(m,4h),2.21-2.32(m,1h),3.67-3.71(m,1h),3.77-3.83(m,1h),3.88-3.92(m,1h),4.03-4.06(m,
1h),4.36-4.40(m,1h),6.94(d,j=5.6hz,1h),7.50(d,j=8.8hz,1h),7.81-7.68(m,2h),8.08(s,1h),8.13-8.16(m,1h),8.40(s,2h),10.89(s,1h)。针对c
21h19
brn6o的[m h]ms计算值,452.2;实测值,452.1。实施例34:(r)-n-(4-(3-((1-乙基-1h-吡唑并[4,3-c]吡啶-6-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺
[0286]
将n-(4-氯喹唑啉-7-基)丙烯酰胺(180mg,0.77mmol)、(r)-1-乙基-n-(吡咯烷-3-基)-1h-吡唑并[4,3-c]吡啶-6-胺的hcl盐(247mg,0.97mmol)和diea(1.3ml,7.72mmol)在dmso(10ml)中的溶液在40℃在n2下搅拌2h。冷却反应混合物,用水(20ml)稀释,并用ea(20ml*2)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并在减压下浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((1-乙基-1h-吡唑并[4,3-c]吡啶-6-基)氨基)吡咯烷-1-基)喹唑啉-7-基)丙烯酰胺(38.4mg,11.5%)。1h nmr(400mhz,dmso-d6):1.33(t,j=7.2hz,3h),2.07-2.12(m,1h),2.29-2.33(m,1h),3.80-3.84(m,1h),3.95-3.97(m,1h),4.06-4.09(m,1h),4.21-4.28(m,3h),4.44-4.45(m,1h),5.83(dd,j=10.0,1.6hz,1h),6.30-6.35(m,1h),6.43-6.52(m,2h),6.75(d,j=6.0hz,1h),7.62(dd,j=9.2,2.0hz,1h),7.96(s,1h),8.15(d,j=2.4hz,1h),8.24(d,j=8.8hz,1h),8.40(s,1h),8.59(s,1h),10.48(s,1h)。针对c
23h24
n8o的[m h]ms计算值,429.2;实测值:429.1。实施例35:(r,e)-n-(4-(3-((5-氯-4-(吡唑并[1,5-a]吡啶-3-基)嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)-4-(二甲基氨基)丁-2-烯酰胺步骤1:3-碘代吡唑并[1,5-a]吡啶
[0287]
将吡唑并[1,5-a]吡啶(900mg,7.63mmol)和nis(2.1g,9.15mmol)在dmf(20ml)中的溶液在室温下搅拌16h。用水(50ml)稀释反应混合物,并用ea(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。经硅胶柱色谱法纯化残余物得到3-碘代吡唑并[1,5-a]吡啶(1.75g,87.5%),为白色固体。针对c7h5in2的
(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)-4-(二甲基氨基)丁-2-烯酰胺(500mg,1.41mmol)和k2co3(777mg,5.63mmol)在dmso(10ml)中的溶液在100℃下搅拌4h。冷却反应混合物,用水(20ml)稀释,并用dcm(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。通过制备型hplc纯化残余物得到(r,e)-n-(4-(3-((5-氯-4-(吡唑并[1,5-a]吡啶-3-基)嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)-4-(二甲基氨基)丁-2-烯酰胺(18.7mg,2.2%),为白色固体。1h nmr(400mhz,dmso-d6):1.95-2.00(m,1h),2.02-2.19(m,7h),2.41(s,3h),3.08(d,j=4.8hz,2h),3.80-3.91(m,2h),4.03-4.22(m,2h),4.50-4.57(m,1h),6.30-6.34(m,1h),6.77-6.83(m,1h),7.13-7.15(m,1h),7.52-7.54(m,2h),7.80(d,j=5.2hz,1h),8.04(s,1h),8.18(d,j=9.2hz,1h),8.37(s,1h),8.87-8.95(m,3h),10.36(s,1h)。针对c
30h31
cln
10
o的[m h]ms计算值,583.2;实测值,583.2。实施例36:(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺的合成步骤1:(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0291]
在微波条件下在160℃下将1-氯异喹啉-6-胺(1.5g,8.4mmol)、(r)-叔丁基吡咯烷-3-基氨基甲酸酯(3.0g,16.8mmol)和k2co3(1.7g,12.6mmol)在dmso(15ml)中的溶液搅拌5小时。冷却反应混合物,用水(100ml)稀释,并用ea(50ml*2)萃取。将合并的萃取物用水(100ml*2)和盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并通过fcc(pe/ea=1:1)纯化得到(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.4g,39%),为黄色固体。针对c
18h24
n4o2的[m h]计算值,329.2;实测值,329.2。步骤2:(r)-叔丁基(1-(6-(甲基氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0292]
在冰浴中向(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
(656mg,2.00mmol)在甲醇(40ml)中的混合物中,加入hcho(649mg,在h2o为37%,4.00mmol)。搅拌30min后,在0℃下将nabh3cn(992mg,15.74mmol)加入混合物中。然后将反应混合物在60℃搅拌15h。将反应混合物浓缩。向残余物中加入dcm(20ml),并用0.5n hcl(10ml)洗涤,然后经na2so4干燥有机萃取物,过滤并浓缩。通过fcc(dcm/甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(6-(甲基氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(439mg,59%),为白色固体。针对c
19h26
n4o2的[m h]计算值,343.2;实测值,343.2。步骤3:(r)-叔丁基(1-(6-(n-甲基丙烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0293]
在0℃向(r)-叔丁基(1-(6-(甲基氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(430mg,1.25mmol)和diea(484mg,3.75mmol)在dcm(20ml)中的溶液中加入丙烯酰氯(124mg,1.38mmol)。将反应混合物在室温下搅拌3h。浓缩混合物并通过fcc(pe/ea=1:1)纯化,得到(r)-叔丁基(1-(6-(n-甲基丙烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(300mg,61%),为黄色固体。针对c
22h28
n4o3的[m h]计算值,397.2;实测值,397.2。步骤4:(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺tfa盐
[0294]
将(r)-叔丁基(1-(6-(n-甲基丙烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(300mg,0.76mmol)在tfa/dcm(5ml/10ml)中的溶液在室温下搅拌2h。将混合物浓缩得到(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺的tfa盐(224mg,100%),为黄色固体。针对c
17h20
n4o的[m h]计算值,297.2;实测值,297.2。步骤5:(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺
[0295]
将(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺的tfa盐(224mg,0.57mmol)、2-氯嘧啶-5-甲腈(158mg,1.13mmol)和diea(294mg,2.28mmol)在dmso
(10ml)中的溶液在30℃搅拌2h。将混合物用水(50ml)稀释,并用ea(50ml*2)萃取。将合并的萃取物用水(100ml*2)和盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺(220.4mg,73%),为白色固体。1h nmr(400mhz,dmso-d6):δ2.07-2.09(m,1h),2.25-2.27(m,1h),3.29(s,3h),3.74-3.78(m,1h),3.85-3.87(m,1h),3.97-4.00(m,1h),4.09-4.13(m,1h),4.54-4.56(m,1h),5.58-5.61(m,1h),6.15-6.19(m,2h),7.05(d,j=6.0hz,1h),7.37(dd,j=2.0,8.8hz,1h),7.65(d,j=2.0hz,1h),7.96(d,j=5.6hz,1h),8.28(d,j=9.2hz,1h),8.66-8.69(m,2h),8.76-8.77(s,1h)。针对c
22h21
n7o的[m h]计算值,400.1;实测值,400.1。实施例37:(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-3-吗啉代异喹啉-6-基)丙烯酰胺的合成步骤1:6-硝基异喹啉-1,3(2h,4h)-二酮
[0296]
将2-(羧甲基)-4-硝基苯甲酸(45.0g,200.0mmol)与ch3cooh(500ml)的混合物在110℃下搅拌0.5h。然后将反应混合物冷却到90℃,加入尿素(71.0g,1.42mol)。将反应混合物在110℃下搅拌4h。将溶液冷却到室温,加入h2o(500ml)。将混合物在室温下搅拌0.5h,过滤并浓缩得到6-硝基异喹啉-1,3(2h,4h)-二酮(23.0g,56%),为棕色固体。步骤2:1,3-二氯-6-硝基异喹啉
[0297]
将6-硝基异喹啉-1,3(2h,4h)-二酮(14.0g,67.9mmol)和苯基膦酰二氯(200ml)的混合物在140℃下搅拌4h。向溶液中加入水(200ml),并用ea(200ml*2)萃取。将合并的有机层用盐水(100ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。经柱(pe:ea=10:1)纯化残余物得到1,3-二氯-6-硝基异喹啉(19.0g,70%),为黄色固体。针对c9h4cl2n2o2的[m h]计算值,242.9;实测值,242.9。步骤3:(r)-叔丁基(1-(3-氯-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0298]
在室温向1,3-二氯-6-硝基异喹啉(5.0g,20.6mmol)和(r)-叔丁基吡咯烷-3-基氨基甲酸酯(3.5g,20.6mmol)在dmf(50ml)中的溶液中加入tea(2.1g,20.6mmol)。将混合物在微波下在140℃搅拌2h。向残余物加入水(100ml),并用ea(100ml*2)萃取。将合并的有机层用水(100ml*2)和盐水(100ml*2)洗涤,经na2so4干燥,过滤并在真空中浓缩。经柱(pe:ea=5:1)纯化残余物得到(r)-叔丁基(1-(3-氯-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(4.8g,60%),为棕色固体。针对c
18h21
cln4o4的[m h]计算值,393.1;实测值,393.1。步骤4:(r)-叔丁基(1-(3-吗啉代-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0299]
在微波下在155℃下将(r)-叔丁基(1-(3-氯-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.0g,2.5mmol)和吗啉(7.0ml)在dmso(7.0ml)中的溶液搅拌3h。用水(10ml)稀释反应混合物,并用ea(10ml*2)萃取。将合并的萃取物用水(20ml*2)和盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并在真空中浓缩。经二氧化硅柱(pe:ea=2:1)纯化残余物得到(r)-叔丁基(1-(3-吗啉代-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.1g,97%),为棕色固体。针对c
22h29
n5o5的[m h]计算值,444.2;实测值,444.2。步骤5:(r)-叔丁基(1-(6-氨基-3-吗啉代异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0300]
在室温下向(r)-叔丁基(1-(3-吗啉代-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.1g,2.48mmol)与nh4cl(1.3g,2.48mmol)在乙醇(20ml)和h2o(3ml)中的溶液加入铁屑(1.4g,2.48mmol)。在80℃搅拌反应混合物4h。然后将反应混合物冷却至室温,过滤并在真空中浓缩。经柱(pe:ea=1:1)纯化残余物得到(r)-叔丁基(1-(6-氨基-3-吗啉代异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(400mg,39%),为灰色固体。针对c
22h31
n5o3的[m h]计算值,414.2;实测值,414.2。步骤6:(r)-叔丁基(1-(6-丙烯酰胺基-3-吗啉代异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0301]
在0℃将(r)-叔丁基(1-(6-氨基-3-吗啉代异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(250mg,0.6mmol)和diea(234mg,1.8mmol)在dcm(15ml)中的溶液搅拌10分钟。然后缓慢加入丙烯酰氯(55mg,0.6mmol)。将混合物在室温下搅拌0.5h。用水(10ml)稀释混合物,并用ea(10ml*2)萃取。将合并的有机层用盐水(10ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。经柱(pe:ea=1:1)纯化残余物得到(r)-叔丁基(1-(6-丙烯酰胺基-3-吗啉代异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(120mg,42%),为黄色固体。针对c
25h33
n5o4的[m h]计算值,468.3;实测值,468.3。步骤7:(r)-n-(1-(3-氨基吡咯烷-1-基)-3-吗啉代异喹啉-6-基)丙烯酰胺tfa盐
[0302]
将(r)-叔丁基(1-(6-丙烯酰胺基-3-吗啉代异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(120mg,0.26mmol)和tfa(5ml)在dcm(5ml)中的溶液在室温下搅拌1h。将反应混合物真空浓缩,得到(r)-n-(1-(3-氨基吡咯烷-1-基)-3-吗啉代异喹啉-6-基)丙烯酰胺的tfa盐(80mg,85%),为棕色油状物。针对c
20h25
n5o2的[m h]计算值,368.2;实测值,368.2。步骤8:(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-3-吗啉代异喹啉-6-基)丙烯酰胺
[0303]
在室温向(r)-n-(1-(3-氨基吡咯烷-1-基)-3-吗啉代异喹啉-6-基)丙烯酰胺(80mg,0.22mmol)和2-氯嘧啶-5-甲腈(31mg,0.22mmol)在dmso(3ml)中的溶液中加入diea(141mg,1.09mmol)。将混合物在40℃下搅拌2h。向混合物加入水(10ml),并用ea(10ml*2)萃取。将合并的有机层用盐水(10ml*2)洗涤,经na2so4干燥,过滤并浓缩。通过制备型hplc(0.2%hcooh)纯化残余物得到(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-3-吗啉代异喹啉-6-基)丙烯酰胺的hcooh盐(14.3mg,14%),为黄色固体。1h nmr(400mhz,dmso-d6):δ2.04-2.06(m,1h),2.22-2.24(m,1h),3.48-3.49(m,4h),3.69-3.74(m,5h),3.80-4.05(m,3h),4.51-4.53(m,1h),5.78(dd,j=2.0,11.6hz,1h),6.17(s,1h),6.26-6.30(m,1h),6.44-6.51(m,1h),7.19(dd,j=9.6,11.2hz,1h),7.97-7.99(m,2h),8.64-8.69(m,2h),8.76(d,j=2.4hz,1h),10.23(s,1h)。针对c
25h26
n8o2的[m h]计算值,471.3;实测值,471.3。实施例38:(r,e)-n-(4-(3-((5-氯-4-(1h-吲哚-3-基)嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)-4-(二甲基氨基)丁-2-烯酰胺的合成
步骤1:(r)-叔丁基(1-(2-甲基-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0304]
在0℃下向(r)-叔丁基(1-(2-氯-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(12.0g,30.5mmol)和k2co3(12.7g,91.5mmol)在1,4-二噁烷(100ml)中的溶液加入2,4,6-三甲基-1,3,5,2,4,6-三氧杂三硼杂环己烷(13.0g,45.8mmol)。然后在室温在n2下加入pd(dppf)cl2dcm(2.5g,3.0mmol)。将混合物在140℃下在密封管中搅拌6h。然后将反应混合物冷却到室温,过滤并浓缩。经柱(pe/ea=1:1)纯化残余物得到((r)-叔丁基(1-(2-甲基-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(5.5g,48%),为黄色固体。针对c
18h23
n5o4的[m h]计算值374.1;实测值,374.1。步骤2:(r)-叔丁基(1-(7-氨基-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0305]
将(r)-叔丁基(1-(2-甲基-7-硝基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(3.0g,8.0mmol)和pd/c(1.6g,10%)在乙醇(40ml)中的溶液在室温在h2下搅拌3h。将混合物过滤。将有机层真空浓缩,得到粗的(r)-叔丁基(1-(7-氨基-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.7g),为黄色固体。针对c
18h25
n5o4的[m h]计算值344.2;实测值,344.2。步骤3:(r,e)-叔丁基(1-(7-(4-(二甲基氨基)丁-2-烯酰胺基)-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0306]
在冰浴中向diea(12.0ml,67.6mmol)和(r)-叔丁基(1-(7-氨基-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(5.8g,16.9mmol)在dcm(100ml)中的溶液中加入(e)-4-溴代丁-2-烯酰氯(5.1g,31.4mmol)。将反应混合物在室温下搅拌2h,然后加入二甲胺(37.8ml,在thf中为2.0m,67.6mmol),将反应混合物在室温下搅拌2h。将混合物用h2o(50ml)稀释,并用dcm(50ml*2)萃取。将合并的有机层用盐水(50ml)洗涤,经na2so4干燥,过滤并在真空中浓缩,并经柱(dcm:甲醇=10:1)纯化得到(r,e)-叔丁基(1-(7-(4-(二甲基氨基)丁-2-烯酰胺基)-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(2.5g,33%),为黑色固体。针对c
24h34
n6o3的[m h]计算值,455.3;实测值,455.3。步骤4:(r,e)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)-4-(二甲基氨基)丁-2-烯酰胺
[0307]
将(r,e)-叔丁基(1-(7-(4-(二甲基氨基)丁-2-烯酰胺基)-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(800mg,1.76mmol)和tfa(3ml)在dcm(6ml)中的溶液在室温下搅拌2h。将混合物浓缩得到(r,e)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)-4-(二甲基氨基)丁-2-烯酰胺的tfa盐(1.0g,100%),为灰色固体。针对c
19h26
n6o的[m h]计算值,355.2;实测值,355.2。步骤5:(r,e)-叔丁基3-(5-氯-2-((1-(7-(4-(二甲基氨基)丁-2-烯酰胺基)-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基)嘧啶-4-基)-1h-吲哚-1-甲酸酯
[0308]
在室温向(r,e)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基-7-基)-4-(二甲基氨基)丁-2-烯酰胺(520mg,1.46mmol)和3-(2,5-二氯嘧啶-4-基)-1h-吲哚-1-甲酸叔丁酯(531mg,1.46mmol)在dma(6ml)中的溶液中加入diea(1.56ml,8.79mmol)。将反应混合物在90℃下搅拌10h。将反应混合物冷却并加水(10ml),过滤并浓缩得到(r,e)-叔丁基3-(5-氯-2-((1-(7-(4-(二甲基氨基)丁-2-烯酰胺基)-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基)嘧啶-4-基)-1h-吲哚-1-甲酸酯(600mg,60%),为黄色固体。针对c
36h40
cln9o3的[m h]计算值,682.3;实测值,682.3。步骤6:(r,e)-n-(4-(3-((5-氯-4-(1h-吲哚-3-基)嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)-4-(二甲基氨基)丁-2-烯酰胺hcooh盐
[0309]
将(r,e)-叔丁基3-(5-氯-2-((1-(7-(4-(二甲基氨基)丁-2-烯酰胺基)-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基)-嘧啶-4-基)-1h-吲哚-1-甲酸酯(600mg,0.88mmol)和tfa(1ml)在dcm(3ml)中的溶液在室温搅拌1天。将反应混合物在真空中浓缩。将残余物溶于ea(10ml)中,用diea调节ph至9,真空浓缩。通过制备型hplc(0.1%hcooh)纯化残余物得到(r,e)-n-(4-(3-((5-氯-4-(1h-吲哚-3-基)嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)-4-(二甲基氨基)丁-2-烯酰胺的hcooh盐(2.0mg,0.4%),为黄色固体。1h nmr(400mhz,dmso-d6):δ1.94-2.00(m,2h),2.33(s,6h),2.41(s,3h),3.09-3.11(m,2h),3.92-4.29(m,4h),4.55-4.60(m,1h),6.30-6.34(m,1h),6.76-6.83(m,1h),7.10-7.22(m,2h),7.48-7.64(m,2h),7.65-7.67(m,1h),8.04(s,1h),8.17-8.19(m,3h),8.31(m,1h),8.47(s,1h),10.34(m,1h),11.83-11.85(m,1h)。针对c
31h32
cln9o的[m h]计算值,582.2;实测值,582.2。实施例39:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑
啉-7-基)-n-甲基丙烯酰胺的合成步骤1:(r)-叔丁基(1-(2-甲基-7-(甲基氨基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0310]
在室温下向((r)-叔丁基(1-(7-氨基-2-甲基喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(656mg,2.00mmol)在甲醇(40ml)中的混合物中加入hcho(699mg,在h2o中为37%,23.3mmol)。搅拌30分钟后,在0℃下将nacnbh4(2.89g,46.6mmol)加入混合物中。将反应混合物在60℃下搅拌16h。浓缩混合物。向残余物中加入dcm(20ml),用0.5nhcl(10ml)洗涤,经na2so4干燥,过滤并浓缩。通过fcc(dcm/甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(2-甲基-7-(甲基氨基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(500mg,25%),为灰白色固体。针对c
19h27
n5o2的[m h]计算值,358.2;实测值,358.2。步骤2:(r)-叔丁基(1-(2-甲基-7-(n-甲基丙烯酰胺基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0311]
在0℃下向(r)-叔丁基(1-(2-甲基-7-(甲基氨基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(600mg,1.685mmol)和diea(0.83ml,3.0mmol)在dcm(50ml)中的溶液中加入丙烯酰氯(0.14mg,1.84mmol)。将反应混合物在-50℃下搅拌30分钟。浓缩混合物并通过fcc(dcm/甲醇=20:1)纯化得到(r)-叔丁基(1-(2-甲基-7-(n-甲基丙烯酰胺基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(200mg,28.9%),为灰白色固体。针对c
22h29
n5o3的[m h]计算值,412.2;实测值,412.2。步骤3:(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)-n-甲基丙烯酰胺tfa盐
[0312]
将(r)-叔丁基(1-(2-甲基-7-(n-甲基丙烯酰胺基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(200mg,0.48mmol)在tfa/dcm(1ml/10ml)中的溶液在室温下搅拌3h。将混合物浓缩得到(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)-n-甲基丙烯酰胺的tfa盐(151mg,100%),为黄色固体。针对c
17h21
n5o的[m h]计算值,312.2;实测值,312.2。步骤4:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)-n-甲基丙烯酰胺
[0313]
在30℃下将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)-n-甲基丙烯酰胺的tfa盐(140mg,0.45mmol)、2-氯嘧啶-5-甲腈(93mg,0.67mmol)和diea(0.37ml,2.25mmol)在dmso(5ml)中的溶液搅拌1h。将混合物用水(10ml)稀释,并用ea(10ml*2)萃取。将合并的萃取物用水(10ml*2)和盐水(10ml)洗涤,用无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到产物(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)-n-甲基丙烯酰胺(85.2mg,45.8%),为灰白色固体。1h nmr(400mhz,dmso-d6):δ2.12-2.15(m,1h),2.28-2.31(m,1h),2.45(s,3h),3.29-3.34(m,3h),3.86-3.89(m,1h),3.96-3.98(m,1h),4.08-4.11(m,1h),4.19-4.23(m,1h),4.58-4.61(m,1h),5.60-5.63(m,1h),6.18-6.20(m,2h),7.26(dd,j=2.0,8.0hz,1h),7.46(d,j=2.0hz,1h),8.25(d,j=9.2hz,1h),8.67-8.70(m,2h),8.79(s,1h)。针对c
22h22
n8o的[m h]计算值,415.1;实测值,415.1。实施例40:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)-n-甲基丙烯酰胺的合成
[0314]
在微波中在80℃下将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-甲基喹唑啉-7-基)-n-甲基丙烯酰胺的tfa盐(220mg,0.70mmol)、5-溴-2-氯嘧啶(218mg,1.13mmol)和diea(0.18ml,1.10mmol)在dmso(5ml)中的溶液搅拌2h。将混合物用水(20ml)稀释,并用ea(20ml*2)萃取。将合并的萃取物用水(50ml*2)和盐水(100ml)洗涤,经无水硫酸钠干燥,过
滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-甲基喹唑啉-7-基)-n-甲基丙烯酰胺(47.3mg,14.2%),为灰白色固体。1h nmr(400mhz,dmso-d6):δ2.07-2.09(m,1h),2.10-2.12(m,1h),2.46(s,3h),3.26-3.324(m,3h),3.84-3.88(m,1h),3.96-3.98(m,1h),4.09-4.11(m,1h),4.18-4.21(m,1h),4.45-4.46(m,1h),5.61-5.64(m,1h),6.19-6.21(m,2h),7.33(dd,j=2.0,8.0hz,1h),7.45(d,j=2.4hz,1h)7.87(d,j=8.0hz,1h),8.27(d,j=8.0hz,1h),8.43(s,2h)。针对c21h22brn7o的[m h]计算值,468.1;实测值,468.1。实施例41:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)-n-甲基丙烯酰胺的合成步骤1:(r)-叔丁基(1-(7-(甲基氨基)-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0315]
将(r)-叔丁基(1-(7-氨基-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(6.0g,14.0mmol)和(hcho)n(1.7g,21.0mmol)在甲醇(300ml)中的溶液在室温下搅拌1h。然后加入nabh3cn(2.7g,42.0mmol)。将混合物在40℃下搅拌过夜。将反应混合物除去溶剂。通过制备型hplc纯化残余物得到(r)-叔丁基(1-(7-(甲基氨基)-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(1.3g,21%),为黄色固体。针对c
23h35
n7o2的[m h]计算值,442.3;实测值,442.3。步骤2:(r)-4-(3-氨基吡咯烷-1-基)-n-甲基-2-(4-甲基哌嗪-1-基)喹唑啉-7-胺tfa盐
[0316]
将(r)-叔丁基(1-(7-(甲基氨基)-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(100mg,0.23mmol)和tfa(0.5ml)在dcm(5ml)中的溶液在室温下搅拌2h。将混合物浓缩得到(r)-4-(3-氨基吡咯烷-1-基)-n-甲基-2-(4-甲基哌嗪-1-基)喹唑啉-7-胺的tfa盐(77mg),为黄色油状物。针对c
18h27
n7的[m h]计算值,342.2;实测值,342.2。步骤3:(r)-2
–
((1-(7-(甲基氨基)-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈
[0317]
将(r)-4-(3-氨基吡咯烷-1-基)-n-甲基-2-(4-甲基哌嗪-1-基)喹唑啉-7-胺(77mg,0.22mmol)和2-氯嘧啶-5-甲腈(32mg,0.22mmol)、diea(117mg,0.99mmol)在dmso(5ml)中的溶液在30℃下搅拌2h。将混合物用水(10ml)稀释,并用dcm(10ml*2)萃取。将合并的有机层用h2o(10ml*2)和盐水洗涤,经na2so4干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-2-((1-(7-(甲基氨基)-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈(60mg,60%),为黄色固体。针对c
23h28n10
的[m h]计算值,445.3;实测值,445.3。步骤4:(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)-n-甲基丙烯酰胺
[0318]
将(r)-2-((1-(7-(甲基氨基)-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)
氨基)嘧啶-5-甲腈(250mg,0.56mmol)和diea(218mg,1.69mmol)在dcm(20ml)中的溶液在0℃下搅拌10分钟。然后缓慢加入丙烯酰氯(77mg,0.85mmol)。将混合物在室温下搅拌1h。浓缩残余物并通过制备型hplc纯化得到(r)-n-(4-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)-n-甲基丙烯酰胺(119mg,43%),为黄色固体。1h nmr(400mhz,dmso-d6):δ2.07-2.11(m,1h),2.20-2.33(m,8h),3.29(s,3h),3.75-4.17(m,8h),4.57-4.59(m,1h),5.59(t,j=6.4hz,1h),6.17-6.18(m,2h),6.92(dd,j=1.6,8.8hz,1h),7.11(d,j=2.0hz,1h),8.04(d,j=8.8hz,1h),8.66-8.70(m,2h),8.78(s,1h)。针对c
26h30n10
o的[m h]计算值,499.2;实测值,499.2。实施例42:(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-3-(1-甲基-1,2,3,6-四氢吡啶-4-基)异喹啉-6-基)-n-甲基丙烯酰胺的合成步骤1:(r)-叔丁基(1-(3-(1-甲基-1,2,3,6-四氢吡啶-4-基)-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0319]
在n2下向(r)-叔丁基(1-(3-氯-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(2.5g,6.4mmol)和1-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1,2,3,6-四氢吡啶(1.6g,7.0mmol)在二噁烷(50ml)和h2o(5ml)中的溶液中加入pd(dppf)cl2(466mg,0.64mmol)和cs2co3(4.15g,12.7mmol)。将混合物在105℃下搅拌5h。对残余物进行过滤并浓缩。经柱(pe:ea=10:1)纯化残余物得到(r)-叔丁基(1-(3-(1-甲基-1,2,3,6-四氢吡啶-4-基)-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.8g,62%),为棕色固体。针对c
24h31
n5o4的[m h]计算值,454.2;实测值,454.2。步骤2:(r)-叔丁基(1-(6-氨基-3-(1-甲基-1,2,3,6-四氢吡啶-4-基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0320]
在室温下向(r)-叔丁基(1-(3-(1-甲基-1,2,3,6-四氢吡啶-4-基)-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.8g,3.97mmol)和nh4cl(2.2g,3.97mmol)在乙醇(100ml)和h2o(10ml)中的溶液中加入铁屑(2.2g,3.97mmol)。将混合物在80℃下搅拌4h。将反应混合物进行过滤并浓缩。经柱(dcm:甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(6-氨基-3-(1-甲基-1,2,3,6-四氢吡啶-4-基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.6g,85%),为棕色固体。针对c
24h33
n5o2的[m h]计算值,424.3;实测值,424.3。步骤3:(r)-叔丁基(1-(3-(1-甲基-1,2,3,6-四氢吡啶-4-基)-6-(甲基氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0321]
将(r)-叔丁基(1-(6-氨基-3-(1-甲基-1,2,3,6-四氢吡啶-4-基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.6g,3.78mmol)和hcho(210mg,在水中为30%,7.09mmol)在甲醇(120ml)中的溶液在室温下搅拌1h。然后加入nabh3cn(894mg,14.2mmol)。将混合物在40℃下搅拌过夜。除去反应混合物的溶剂。经二氧化硅柱(pe:ea=10:1)纯化残余物得到(r)-叔丁基(1-(3-(1-甲基-1,2,3,6-四氢吡啶-4-基)-6-(甲基氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.0g,61%),为棕色固体。针对c
25h35
n5o2的[m h]计算值,438.3;实测值,438.3。步骤4:(r)-叔丁基(1-(3-(1-甲基-1,2,3,6-四氢吡啶-4-基)-6-(n-甲基丙烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0322]
将(r)-叔丁基(1-(3-(1-甲基-1,2,3,6-四氢吡啶-4-基)-6-(甲基氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(900mg,2.06mmol)和diea(797mg,6.18mmol)在dcm(50ml)中的溶液在0℃下搅拌10min。然后在0℃下缓慢加入丙烯酰氯(185mg,2.06mmol)。将混合物在室温下搅拌1h。浓缩残余物并经柱(dcm:甲醇=10:1)纯化得到(r)-叔丁基(1-(3-(1-甲基-1,2,3,6-四氢吡啶-4-基)-6-(n-甲基丙烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(600mg,59%),为棕色固体。针对c
28h37
n5o3的[m h]计算值,492.3;实测值,492.3。步骤5:(r)-n-(1-(3-氨基吡咯烷-1-基)-3-(1-甲基-1,2,3,6-四氢吡啶-4-基)异喹啉-6-基)-n-甲基丙烯酰胺tfa盐
[0323]
将(r)-叔丁基(1-(3-(1-甲基-1,2,3,6-四氢吡啶-4-基)-6-(n-甲基丙烯酰胺基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(600mg,1.22mmol)和tfa(100ml)在dcm(100ml)中的溶液在室温下搅拌1h。将混合物浓缩获得(r)-n-(1-(3-氨基吡咯烷-1-基)-3-(1-甲基-1,2,3,6-四氢吡啶-4-基)异喹啉-6-基)-n-甲基丙烯酰胺的tfa盐(450mg,94%),为棕色油状物。针对c
23h29
n5o2的[m h]计算值,392.2;实测值,392.2。步骤6:(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-3-(1-甲基-1,2,3,6-四氢吡啶-4-基)异喹啉-6-基)-n-甲基丙烯酰胺hcooh盐
[0324]
将(r)-n-(1-(3-氨基吡咯烷-1-基)-3-(1-甲基-1,2,3,6-四氢吡啶-4-基)异喹啉-6-基)-n-甲基丙烯酰胺(150mg,0.38mmol)和2-氯嘧啶-5-甲腈(54mg,0.38mmol)和diea(247mg,1.92mmol)在dmso(5ml)中的溶液在40℃下搅拌1h。用水(15ml)稀释混合物,并用dcm(15ml*2)萃取。将合并的有机层用h2o(15ml*2)和盐水洗涤,经na2so4干燥,过滤并浓缩。通过制备型hplc(0.2%hcooh)纯化残余物得到(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)-3-(1-甲基-1,2,3,6-四氢吡啶-4-基)异喹啉-6-基)-n-甲基丙烯酰胺的hcooh盐(47.3mg,25%),为棕色固体。1h nmr(400mhz,dmso-d6):δ2.08-2.11(m,1h),2.20-2.24(m,1h),2.40(s,3h),2.60-2.73(m,4h),3.22-3.32(m,5h),3.80-3.84(m,1h),3.88-3.93(m,1h),3.99-4.06(m,1h),4.15-4.18(m,1h),4.52-4.60(m,1h),5.60-5.66(m,1h),6.15-6.23(m,2h),6.85(s,1h),7.11(s,1h),7.28-7.33(m,1h),7.64(s,1h),8.15(s,1h),8.27-8.29(m,1h),8.63-8.80(m,3h)。针对c
28h30
n8o的[m h]计算值,495.3;实测值,495.3。实施例43:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)-n-甲基丙烯酰胺的合成步骤1:(r)-叔丁基(1-(7-(n-甲基丙烯酰胺基)-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯
[0325]
将(r)-叔丁基(1-(7-(甲基氨基)-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(400mg,0.91mmol)和diea(235mg,1.81mmol)在dcm(15ml)中的溶液在0℃下搅拌10分钟。然后缓慢加入丙烯酰氯(100mg,1.09mmol)。将混合物在0℃-室温下搅拌过夜。向反应混合物加入水(20ml),并用ea(20ml*2)萃取。将合并的有机层用盐水(15ml*2)洗涤,
经na2so4干燥,过滤并浓缩得到(r)-叔丁基(1-(7-(n-甲基丙烯酰胺基)-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(440mg,98%),为黄色固体。针对c
26h37
n7o3的[m h]计算值,496.3;实测值,496.3。步骤2:(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)-n-甲基丙烯酰胺tfa盐
[0326]
将(r)-叔丁基(1-(7-(n-甲基丙烯酰胺基)-2-(4-甲基哌嗪-1-基)喹唑啉-4-基)吡咯烷-3-基)氨基甲酸酯(440mg,0.69mmol)和tfa(2ml)在dcm(10ml)中的溶液在室温下搅拌2h。将混合物浓缩得到(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)-n-甲基丙烯酰胺的粗tfa盐(440mg),为黄色油状物。针对c
21h29
n7o的[m h]计算值,395.2;实测值,395.2。步骤3:(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)-n-甲基丙烯酰胺
[0327]
在微波下在70℃下将(r)-n-(4-(3-氨基吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)-n-甲基丙烯酰胺(200mg,0.51mmol)和5-溴-2-氯嘧啶(147mg,0.76mmol)、diea(130mg,1.02mmol)在dmso(5ml)中的溶液搅拌2h。用水(15ml)稀释混合物,并用ea(15ml*2)萃取。将合并的有机层用盐水(15ml)洗涤,经na2so4干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-2-(4-甲基哌嗪-1-基)喹唑啉-7-基)-n-甲基丙烯酰胺(15.1mg,5.4%),为白色固体。1h nmr(400mhz,cd3od):δ2.07-2.21(m,1h),2.32-2.40(m,4h),2.51-2.53(m,4h),3.40(s,3h),3.87-3.91(m,5h),3.99-4.05(m,1h),4.10-4.14(m,1h),4.23-4.27(m,1h),4.57-4.59(m,1h),5.62(dd,j=3.2,9.6hz,1h),6.26-6.34(m,2h),6.98(dd,j=2.0,8.4hz,1h),7.24(d,j=2.4hz,1h),8.16(d,j=9.2hz,1h),8.36(s,2h)。针对c
25h30
brn9o的[m h]计算值,552.2;实测值,552.2。实施例44:(r)-n-(1-(3-((5-乙炔基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺
步骤1:6-硝基异喹啉-1,3(2h,4h)-二酮
[0328]
将2-(羧甲基)-4-硝基苯甲酸(45.0g,200.0mmol)与ch3cooh(500ml)的混合物在110℃下搅拌0.5h。然后将反应混合物冷却到90℃,加入尿素(71.0g,1.42mol)。将反应混合物在110℃下搅拌4h。将溶液冷却到室温并加入h2o(500ml)。将混合物在室温下搅拌0.5h,过滤并浓缩得到6-硝基异喹啉-1,3(2h,4h)-二酮(23.0g,56%),为棕色固体。步骤2:1,3-二氯-6-硝基异喹啉
[0329]
将6-硝基异喹啉-1,3(2h,4h)-二酮(14.0g,67.9mmol)和苯基膦酰二氯(200ml)的混合物在140℃下搅拌4h。冷却反应混合物,加入水(200ml),并用ea(200ml*2)萃取。将合并的有机层用盐水(100ml)洗涤,经na2so4干燥,过滤并在真空中浓缩。经柱(pe:ea=10:1)纯
化残余物得到1,3-二氯-6-硝基异喹啉(19.0g,70%),为黄色固体。针对c9h4cl2n2o2的[m h]计算值,242.9;实测值,242.9。步骤3:(r)-叔丁基(1-(3-氯-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0330]
在室温下向1,3-二氯-6-硝基异喹啉(5.0g,20.6mmol)和(r)-叔丁基吡咯烷-3-基氨基甲酸酯(3.5g,20.6mmol)在dmf(50ml)中的溶液中加入tea(2.1g,20.6mmol)。将反应混合物在微波下在140℃下搅拌2h。冷却反应混合物,加入水(100ml),并用ea(100ml*2)萃取。将合并的有机层用水(100ml*2)和盐水(100ml2)洗涤,经na2so4干燥,过滤并在真空中浓缩。经柱(pe:ea=5:1)纯化残余物得到(r)-叔丁基(1-(3-氯-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(4.8g,60%),为棕色固体。针对c
18h21
cln4o4的[m h]计算值,393.1;实测值,393.1。步骤4:(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0331]
在室温向(r)-叔丁基(1-(3-氯-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(5.0g,12.8mmol)在乙醇(150ml)中的溶液中加入pd/c(500mg,5%)。在氢气气氛下在室温下搅拌反应混合物过夜。对反应混合物进行过滤。将滤液浓缩得到粗产物(3.8g,90%),为黄色固体。针对c
18h24
n4o2的[m h]ms计算值,329.4;实测值:329.4。步骤5:(r)-叔丁基(1-(6-((2,4-二甲氧基苄基)氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0332]
在室温下向(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(330mg,1.0mmol)在dce(50ml)中的溶液中加入2,4-二甲氧基苯甲醛(184mg,1.1mmol)和nabh(oac)3(640mg,3.0mmol)。在室温下搅拌反应混合物过夜。用碳酸氢钠水溶液(50ml)淬灭残余物,并用ea(20ml*2)萃取。将合并的有机层用水(20ml*2)和盐水(20ml*2)洗涤,经na2so4干燥,过滤并在真空中浓缩。经柱(pe:ea=1:1)纯化残余物得到(r)-叔丁基(1-(6-((2,4-二甲氧基苄基)氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(200mg,42%),为黄色固体。针对c
27h34
n4o4的[m h]计算值,479.2;实测值,479.2。步骤6:(r)-叔丁基(1-(6-((2,4-二甲氧基苄基)(甲基)氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0333]
在室温下向(r)-叔丁基(1-(6-((2,4-二甲氧基苄基)氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(200mg,0.42mmol)在甲醇(5ml)中的溶液中加入乙醛(720mg,8.3mmol)和nabhcn(105mg,1.7mmol)。将反应混合物回流过夜。将反应混合物冷却,加水(20ml)淬灭,用ea(10ml*2)萃取。将合并的有机层用水(10ml*2)和盐水(10ml*2)洗涤,经na2so4干燥,过滤并在真空中浓缩。用c18柱(acn/h2o=40%-90%)纯化残余物得到(r)-叔丁基(1-(6-((2,4-二甲氧基苄基)(甲基)氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(100mg,50%),为黄色固体。针对c
28h36
n4o4的[m h]计算值,493.3;实测值,493.3。步骤7:(r)-1-(6-(甲基氨基)萘-1-基)吡咯烷-3-胺
[0334]
向(r)-叔丁基(1-(6-((2,4-二甲氧基苄基)(甲基)氨基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(200mg,0.41mmol)在dcm(5ml)中的溶液中加入tfa(1ml),将混合物在室温搅拌2h。然后除去反应混合物的溶剂,得到(r)-1-(6-(甲基氨基)萘-1-基)吡咯烷-3-胺的粗品(200mg),为黄色油状物。步骤8:(r)-n-甲基-1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-胺
[0335]
在室温下将粗品(r)-1-(6-(甲基氨基)萘-1-基)吡咯烷-3-胺(200mg)在dmso(5ml)中溶解。并加入diea(210mg,1.6mmol)。在室温下搅拌混合物10min。然后加入2-氯-5-((三甲基甲硅烷基)乙炔基)嘧啶(85mg,0.41mmol)。将混合物在40℃下搅拌过夜。向反应混合物加入水(20ml),并用ea(10ml*2)萃取。将合并的有机层用水(10ml*2)和盐水(10ml*2)洗涤,经na2so4干燥,过滤并在真空中浓缩。经柱(dcm:甲醇=20:1)纯化残余物得到(r)-n-甲基-1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-胺(140mg,82%),为黄色油状物。针对c
23h28
n6si的[m h]计算值,417.2;实测值,417.2。步骤9:(r)-n-甲基-n-(1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺
[0336]
在室温下向(r)-n-甲基-1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-胺(140mg,0.34mmol)在dcm(5ml)中的溶液中加入diea(90mg,0.68mmol)。然后在冰浴中滴加丙烯酰氯(30mg,0.34mmol)。将反应混合物在室温下搅拌2h。用氯化铵水溶液(20ml)淬灭混合物,并用ea(10ml*2)萃取。将合并的有机层用水(10ml*2)和盐水(10ml*2)洗涤,经na2so4干燥,过滤并在真空中浓缩,得到(r)-n-甲基-n-(1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺粗品(100mg,63%),为黄色固体。针对c
26h30
n6osi的[m h]计算值,471.2;实测值,471.2。步骤10:(r)-n-(1-(3-((5-乙炔基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺
[0337]
在冰浴中向(r)-n-甲基-n-(1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(100mg,0.21mmol)在甲醇(5ml)中的溶液中加入k2co3(30mg,0.21mmol)。将反应混合物在室温下搅拌10min。向反应混合物加入h2o(20ml),并用ea(10ml*2)萃取。将合并的有机层用水(10ml*2)和盐水(10ml*2)洗涤,经na2so4干燥,过滤并在真空中浓缩得到残余物,将残余物用c18柱(acn/h2o=10%-80%)进行纯化,得到(r)-n-(1-(3-((5-乙炔基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)-n-甲基丙烯酰胺(20.2mg,23%),为白色固体。1h nmr(400mhz,cd3od):δ2.18-2.21(m,1h),2.37-2.40(m,1h),3.45(s,3h),3.64(s,1h),3.80-3.84(m,1h),3.94-3.97(m,1h),4.05-4.08(m,1h),4.19-4.24(m,1h),4.62-4.66(m,1h),6.63(dd,j=2.0,10.4hz,1h),6.31-6.36(m,2h),7.08(d,j=6.0hz,1h),7.38(dd,j=2.4,8.8hz,1h),7.63(d,j=2.4hz,1h),7.95(d,j=5.6hz,1h),8.40-8.43(m,3h)。针对c
23h22
n6o的[m h]ms计算值,399.1;实测值:399.1。实施例45:(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐
步骤1:6-硝基-2,3-二氢酞嗪-1,4-二酮在室温下向5-硝基异吲哚啉-1,3-二酮(50.0g,0.26mol)在乙醇(500ml)中的溶液中加入水合肼(52.0g,1.04mol)。然后将反应混合物回流5h。冷却至室温后,将反应混合物倒入水(300ml)中,滤出固体并用水(50ml*3)洗涤。将滤饼干燥得到6-硝基-2,3-二氢酞嗪-1,4-二酮(43.0g,80%),为黄色固体。针对c8h5n3o4的[m h]ms计算值,208.0;实测值:208.0。步骤2:1,4-二氯-6-硝基酞嗪
[0338]
在室温下向6-硝基-2,3-二氢酞嗪-1,4-二酮(5.0g,24.1mmol)在pocl3(40ml)中的溶液中加入diea(6.23g,48.3mmol),将反应混合物回流3h。将反应混合物冷却到室温并浓缩。将残余物溶于dcm(100ml)中,用饱和nahco3(50ml*2)和盐水(50ml)洗涤,经无水硫酸钠干燥,过滤并浓缩得到1,4-二氯-6-硝基酞嗪(5.0g,85%),为橙色固体。针对c8h3cl2n3o2的[m h]ms计算值,243.9;实测值:243.9。步骤3:4-(氮杂环丁烷-1-基)-1-氯-6-硝基酞嗪
[0339]
在室温下向1,4-二氯-6-硝基酞嗪(5.0g,0.024mol)在dmso(50ml)中的溶液中加入氮杂环丁烷盐酸盐(2.2g,0.024mol)和k2co3(10.0g,0.072mol)。然后将反应混合物在80℃下搅拌12h。将反应液冷却至室温,用水(150ml)稀释,并用ea(80ml*3)萃取。将合并的有机层用盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。经硅胶柱色谱法(pe:ea=2:1)纯化残余物得到4-(氮杂环丁烷-1-基)-1-氯-6-硝基酞嗪(0.9g,16.6%),为红色固体。针对c
11
h9cln4o2的[m h]ms计算值,265.1;实测值:265.1。步骤4:(r)-叔丁基(1-(4-(氮杂环丁烷-1-基)-6-硝基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯
[0340]
在室温在n2气氛下,向4-(氮杂环丁烷-1-基)-1-氯-6-硝基酞嗪(1.3g,4.9mmol)和(r)-叔丁基吡咯烷-3-基氨基甲酸酯(3.67g,19.7mmol)在甲苯(50ml)中的溶液中加入binap(123mg,0.2mmol)、pd2(dba)3(57mg,0.06mmol)和t-buona(950mg,9.8mmol)。然后将反应混合物在80℃下搅拌2h。将反应混合物冷却至室温并过滤。浓缩滤液并经硅胶柱色谱法(pe:ea=1:1)纯化得到(r)-叔丁基(1-(4-(氮杂环丁烷-1-基)-6-硝基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(400mg,20%),为黄色固体。针对c
20h26
n6o4的[m h]ms计算值,415.2;实测值:415.2。步骤5:(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺
[0341]
在室温下向(r)-叔丁基(1-(4-(氮杂环丁烷-1-基)-6-硝基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(400mg,0.97mmol)在乙醇(30ml)和h2o(10ml)中的溶液中加入fe(540mg,9.70mmol)和nh4cl(525mg,9.70mmol)。然后将反应混合物回流3h。冷却至室温后,将反应混
合物过滤并浓缩滤液。用饱和nahco3调节残余物的ph至8,并用ea(20ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩得到(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺(300mg,80%),为黄色固体。针对c
20h28
n6o2的[m h]ms计算值,385.2;实测值:385.2。步骤6:(r)-叔丁基(1-(6-丙烯酰胺基-4-(氮杂环丁烷-1-基)酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯
[0342]
在0℃向(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-酞嗪-6-基)丙烯酰胺(300mg,0.78mmol)在dcm(15ml)中的溶液中,加入丙烯酰氯(105mg,1.17mmol)和diea(305mg,2.34mmol)。然后将混合物升温至室温并搅拌1h。用饱和nh4cl(50ml)对反应混合物进行淬灭。浓缩分离的有机层并通过c18柱(acn:h2o=5%-40%)纯化得到(r)-叔丁基(1-(6-丙烯酰胺基-4-(氮杂环丁烷-1-基)酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(80mg,24%),为黄色油状物。针对c
23h30
n6o3的[m h]ms计算值,439.2;实测值:439.2。步骤7:(r)-n-(1-(3-氨基吡咯烷-1-基)-4-(氮杂环丁烷-1-基)酞嗪-6-基)丙烯酰胺2,2,2-三氟乙酸盐
[0343]
在室温下向(r)-叔丁基(1-(6-丙烯酰胺基-4-(氮杂环丁烷-1-基)酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(80mg,0.18mmol)在dcm(5ml)中的溶液中加入tfa(1ml)。将反应混合物在室温下搅拌1h。将反应混合物浓缩得到(r)-n-(1-(3-氨基吡咯烷-1-基)-4-(氮杂环丁烷-1-基)酞嗪-6-基)丙烯酰胺2,2,2-三氟乙酸盐(80mg,100%),为黄色油状物。针对c
18h22
n6o的[m h]计算值,339.2;实测值,339.2。步骤8:(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐
[0344]
在室温下向(r)-n-(1-(3-氨基吡咯烷-1-基)-4-(氮杂环丁烷-1-基)酞嗪-6-基)丙烯酰胺2,2,2-三氟乙酸盐(75mg,0.22mmol)在dma(3ml)中的溶液中加入2-氯嘧啶-5-甲腈(15mg,0.11mmol)和diea(85mg,0.66mmol)。然后将混合物在室温下搅拌40min。用水(10ml)淬灭反应混合物,并用ea(10ml*3)萃取。将合并的有机层用盐水(10ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐(19mg,19%),为黄色固体。1h nmr(400mhz,dmso-d6):δ2.04-2.10(m,3h),2.22-2.32(m,1h),3.49-3.89(m,6h),4.08-4.10(m,1h),4.50-4.54(m,1h),5.85-5.88(m,1h),6.36(dd,j=2.0,16.8hz,1h),6.50(dd,j=10.0,16.8hz,1h),8.12-8.18(m,2h),8.37(s,1h),8.64-8.76(m,3h),8.92(s,1h),11.06(s,1h)。针对c
23h23
n9o的[m h]ms计算值,442.2;实测值:442.2。实施例46:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-3-(1-甲基哌啶-4-基)异喹啉-6-基)-n-甲基丙烯酰胺的合成步骤1:(r)-叔丁基(1-(3-(1-甲基-1,2,3,6-四氢吡啶-4-基)-6-硝基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
3-基)氨基甲酸酯(4.0g,9.4mmol)和diea(3.0g,23.5mmol)在dcm(100ml)中的溶液中加入丙烯酰氯(1.0g,11.3mmol)。然后将反应混合物升温至室温,搅拌2h。将混合物用饱和nh4cl(30ml)淬灭。分离的有机层经无水硫酸钠干燥,过滤并在减压下浓缩。经硅胶柱色谱法(dcm/甲醇=10/1)纯化残余物得到(r)-叔丁基(1-(6-丙烯酰胺基-3-(1-甲基哌啶-4-基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.5g,32%),为白色固体。针对c
27h37
n5o3的[m h]ms计算值,480.3;实测值:480.3。步骤4:(r)-n-(1-(3-氨基吡咯烷-1-基)-3-(1-甲基哌啶-4-基)异喹啉-6-基)丙烯酰胺
[0348]
在室温下向(r)-叔丁基(1-(6-丙烯酰胺基-3-(1-甲基哌啶-4-基)异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.40g,2.92mmol)在dcm(15ml)中的溶液中加入tfa(5ml)。将反应混合物在室温下搅拌2h。浓缩反应混合物,将残余物用饱和nahco3调节ph为9。将混合物过滤,将滤液浓缩得到残余物,经c18柱(acn:h2o=5%-40%)纯化残余物,得到(r)-n-(1-(3-氨基吡咯烷-1-基)-3-(1-甲基哌啶-4-基)异喹啉-6-基)丙烯酰胺(600mg,55%),为白色固体。针对c
22h29
n5o的[m h]计算值,380.2;实测值,380.2。步骤5:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-3-(1-甲基哌啶-4-基)异喹啉-6-基)丙烯酰胺
[0349]
在室温下向(r)-n-(1-(3-氨基吡咯烷-1-基)-3-(1-甲基哌啶-4-基)异喹啉-6-基)丙烯酰胺(370mg,0.98mmol)在2-甲基丙-1-醇(10ml)中的溶液中加入5-溴-2-氯嘧啶(284mg,1.46mmol)和diea(380mg,2.94mmol)。然后将混合物在90℃下搅拌过夜。将反应混合物冷却到室温并浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-3-(1-甲基哌啶-4-基)异喹啉-6-基)丙烯酰胺(50mg,10%),为黄色固体。针对c
26h30
brn7o的[m h]ms计算值,536.2;实测值:536.2。步骤6:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-3-(1-甲基哌啶-4-基)异喹啉-6-基)-n-甲基丙烯酰胺
[0350]
在0℃在氮气气氛下向(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-3-(1-甲基哌啶-4-基)异喹啉-6-基)丙烯酰胺(40mg,0.074mmol)在无水n,n-二甲基甲酰胺(3ml)中的搅拌溶液中分批加入60重量%在矿物油中的氢化钠(36mg,0.089mmol)。将反应混合物升温至室温,在室温搅拌10min。然后加入ch3i(13mg,0.089mmol),在室温搅拌2h。将反应混合物用水淬灭后,用dcm(10ml*3)萃取。将合并的有机层用盐水(10ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)-3-(1-甲基哌啶-4-基)异喹啉-6-基)-n-甲基丙烯酰胺(3.2mg,7.8%),为白色固体。1h nmr(400mhz,cd3od):δ1.99-2.07(m,5h),2.22-2.25(m,1h),2.58(s,3h),2.68-2.75(m,3h),3.21-3.31(m,5h),3.70-3.74(m,1h),3.86-3.95(m,2h),4.05-4.08(m,1h),4.42-4.45(m,1h),5.49(dd,j=2.0,11.6hz,1h),6.17-6.22(m,2h),6.83(s,1h),7.18(dd,j=2.0,8.8hz,1h),7.44(d,j=2.0hz,1h),8.21-8.23(m,3h)。针对c
27h32
brn7o的[m h]ms计算值,550.2;实测值:550.2。实施例47:(r)-n-(1-(3-((6-乙炔基-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺步骤1:(r)-叔丁基(1-(6-丙烯酰胺基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯
[0351]
在0℃下向(r)-叔丁基(1-(6-氨基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(2.0g,6.1mmol)和diea(2.0g,15.2mmol)在dcm(50ml)中的溶液中加入丙烯酰氯(607mg,6.7mmol)。然后将反应混合物升温至室温并搅拌0.5h。将混合物用饱和nh4cl(30ml)淬灭。分离的有机层经无水硫酸钠干燥,过滤并在减压下浓缩。经硅胶柱色谱法(pe/ea=1/1)纯化残余物得到(r)-叔丁基(1-(6-丙烯酰胺基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.8g,77%),为白色固体。针对c
21h26
n4o3的[m h]ms计算值,383.2;实测值:383.2。步骤2:(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丙烯酰胺2,2,2-三氟乙酸盐
[0352]
向(r)-叔丁基(1-(6-丙烯酰胺基异喹啉-1-基)吡咯烷-3-基)氨基甲酸酯(1.8g,4.7mmol)在dcm(60ml)中的溶液中加入tfa(4ml)。将反应混合物在室温下搅拌2h。将反应混合物浓缩得到(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丙烯酰胺2,2,2-三氟乙酸盐(1.7g,100%),为棕色油状物。针对c
16h18
n4o的[m h]计算值,283.2;实测值,283.2。步骤3:6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪-3-胺
[0353]
在室温下向6-溴-1,2,4-三嗪-3-胺(2.00g,11.49mmol)和cui(654mg,3.45mmol)和pd(pph3)2cl2(805mg,1.14mmol)在thf(20ml)和tea(50ml)中的混合物中加入乙炔基三甲基硅烷(4.50g,45.91mmol)。在90℃在氮气气氛下搅拌反应混合物16h。冷却至室温后,除去溶剂得到残余物,将残余物经快速柱色谱法(flash)(pe/ea=1/3)纯化得到6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪-3-胺(1.60g,72%),为灰白色固体。针对c8h
12
n4si的[m h]ms计算值,193.1;实测值:193.1。步骤4:3-氯-6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪
[0354]
在室温下向6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪-3-胺(1.6g,8.33mmol)和
2-甲基-2-硝基丙烷(1.5g,12.49mmol)在acn(50ml)中的溶液中加入cucl2(1.3g,9.9mmol)。将反应混合物在60℃下搅拌2h。冷却至室温后,将混合物过滤,将滤液浓缩得到残余物。将残余物溶于ea(50ml)中,用h2o(15ml)和盐水(15ml)冲洗。有机层经无水硫酸钠干燥,过滤并减压浓缩。经硅胶柱色谱法(pe/ea=1/1)纯化残余物得到3-氯-6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪(0.75g,42%),为灰白色固体。针对c8h
10
cln3si的[m h]ms计算值,212.0;实测值:212.0。步骤5:(r)-n-(1-(3-((6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺
[0355]
在室温下向(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丙烯酰胺2,2,2-三氟乙酸盐(1.0g,3.54mmol)在dmso(15ml)中的溶液中加入3-氯-6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪(650mg,2.19mmol)和diea(1.8g,14.2mmol)。然后将混合物在50℃下搅拌2h。将反应混合物冷却,用水(15ml)淬灭,并用ea(10ml*3)萃取。将合并的有机层用盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。经硅胶柱色谱法(100%ea)纯化残余物得到(r)-n-(1-(3-((6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(1.0g,62%),为黄色固体。针对c
24h27
n7osi的[m h]ms计算值,458.2;实测值:458.2。步骤6:(r)-n-(1-(3-((6-乙炔基-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺
[0356]
向(r)-n-(1-(3-((6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(500mg,1.1mmol)在thf(20ml)中的溶液中加入tbaf在thf中的溶液(1.6ml,1.0m,1.6mol)。然后将反应混合物在室温下搅拌0.5h。将反应混合物用水(30ml)淬灭,并用ea(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。经硅胶柱色谱法(pe/ea=1/1)纯化残余物得到(r)-n-(1-(3-((6-乙炔基-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(222.9mg,52.9%),为黄色固体。1h nmr(400mhz,dmso-d6):δ2.08-2.12(m,1h),2.27-2.30(m,1h),3.32-4.10(m,4h),4.64(s,2h),5.81(dd,j=2.0,10.0hz,1h),6.32(dd,j=2.0,16.8hz,1h),6.50(dd,j=
10.0,16.8hz,1h),6.97(d,j=5.6hz,1h),7.58(dd,j=2.0,9.2hz,1h),7.88(d,j=5.6hz,1h),8.20-8.21(m,2h),8.42(br s,2h),10.42(s,1h)。针对c
21h19
n7o的[m h]ms计算值,386.2;实测值:386.2。实施例48:(r)-n-(1-(3-((5-乙炔基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺步骤1:(r)-n-(1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺
[0357]
在室温下向(r)-n-(1-(3-氨基吡咯烷-1-基)异喹啉-6-基)丙烯酰胺2,2,2-三氟乙酸盐(500mg,1.77mmol)在dmso(15ml)中的溶液中加入2-氯-5-((三甲基甲硅烷基)乙炔基)嘧啶(483mg,2.30mmol)和diea(915mg,7.09mmol)。然后将混合物在50℃下搅拌2h。将反应混合物冷却,用水(15ml)淬灭,并用ea(10ml*3)萃取。将合并的有机层用盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。经硅胶柱色谱法(pe/ea=1/1)纯化残余物得到(r)-n-(1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(380mg,39%),为黄色固体。针对c
25h28
n6osi的[m h]ms计算值,457.2;实测值:457.2。步骤2:(r)-n-(1-(3-((5-((乙炔基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺
[0358]
向(r)-n-(1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(180mg,0.40mmol)在thf(10ml)中的溶液中加入tbaf在thf中的溶液(0.50ml,0.50mmol)。然后在室温搅拌混合物2h。将反应混合物用水(30ml)淬灭,并用ea(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-((乙炔基嘧啶-2-基)氨基)吡咯烷-1-基)异喹啉-6-基)丙烯酰胺(165.5mg,57.7%),为白色固体。1h nmr(400mhz,dmso-d6):δ2.02-2.07(m,1h),2.22-2.26(m,1h),3.70-3.74(m,1h),3.82-3.86(m,1h),3.91-3.95(m,1h),
4.04-4.08(m,1h),4.25(s,1h),4.45-4.50(m,1h),5.81(dd,j=2.0,10.0hz,1h),6.31(dd,j=2.0,17.2hz,1h),6.48(dd,j=10.0,16.8hz,1h),6.96(d,j=5.6hz,1h),7.57(dd,j=2.0,9.2hz,1h),7.87(d,j=5.6hz,1h),8.01(d,j=6.4hz,1h),8.20-8.21(m,2h),8.43(br s,2h),10.41(s,1h)。针对c
22h20
n6o的[m h]ms计算值,385.2;实测值:385.2。实施例49:(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺步骤1:3-羟基-5-硝基异苯并呋喃-1(3h)-酮
[0359]
在室温下向2-溴-5-硝基苯甲醛(10.0g,43.5mmol)在acn(300ml)中的溶液中加入4,5-双(二苯基膦)-9,9-二甲基氧杂蒽(xantphos)(2.5g,4.35mmol)、pd(oac)2(500mg,2.18mmol)、tea(30ml)和h2o(40ml)。然后在80℃在co气氛下搅拌反应混合物过夜。将反应混合物冷却至室温并过滤。浓缩滤液并经c18柱(acn:h2o=5%-40%)纯化,得到3-羟基-5-硝基异苯并呋喃-1(3h)-酮(7.5g,88%),为黄色固体。针对c8h5no5的[m h]ms计算值,196.0;实测值:196.1。步骤2:6-硝基酞嗪-1-酚
[0360]
在室温下向3-羟基-5-硝基异苯并呋喃-1(3h)-酮(7.0g,35.9mmol)在乙醇(100ml)中的溶液中加入水合肼(3.6g,71.8mmol)。然后将混合物回流3h。冷却至室温后,浓缩反应混合物,将残余物倒入水(100ml)中,滤出固体并用水(10ml*3)洗涤。将滤饼干燥,得到6-硝基酞嗪-1-酚(4.0g,58%),为黄色固体。针对c8h5n3o3的[m h]ms计算值,192.0;实测值:192.0。步骤3:1-氯-6-硝基酞嗪
[0361]
将6-硝基酞嗪-1-酚(3.0g,15.7mmol)在pocl3(30ml)中的溶液在120℃下搅拌3h。将混合物冷却到室温并浓缩。将残余物用冰水(30ml)淬灭,并用ea(10ml*3)萃取。合并的有机层经无水硫酸钠干燥,过滤并浓缩得到1-氯-6-硝基酞嗪(2.8g,85%),为橙色固体。针对c8h4cln3o2的[m h]ms计算值,210.0;实测值:210.0。步骤4:(r)-叔丁基(1-(6-硝基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯
[0362]
在室温下,向1-氯-6-硝基酞嗪(2.8g,13.3mmol)在dmso(20ml)中的溶液中加入(r)-叔丁基吡咯烷-3-基氨基甲酸酯(2.5g,13.3mmol)和diea(3.4g,26.6mmol)。然后在60℃搅拌混合物过夜。将反应混合物冷却至室温,用水(60ml)稀释,并用ea(30ml*3)萃取。将合并的有机层用盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。经硅胶柱色谱法(pe:ea=1:1至dcm:甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(6-硝基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(3.0g,62%),为黄色固体。针对c
17h21
n5o4的[m h]ms计算值,360.2;实测值:360.2。步骤5:(r)-叔丁基(1-(6-氨基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯
[0363]
在室温下向(r)-叔丁基(1-(6-氨基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(2.8g,7.8mmol)在dcm(100ml)和甲醇(100ml)中的溶液中加入10重量%钯/炭(280mg)。将混合物在室温在氢气气氛下搅拌过夜。对反应混合物进行过滤。浓缩滤液。经硅胶柱色谱法(dcm:甲醇=10:1)纯化残余物得到(r)-叔丁基(1-(6-氨基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(1.6g,64%),为黄色固体。针对c
17h23
n5o2的[m h]ms计算值,330.2;实测值:330.2。步骤6:(r)-叔丁基(1-(6-丙烯酰胺基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯
[0364]
在0℃下向(r)-叔丁基(1-(6-氨基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(600mg,1.82mmol)在dma(10ml)中的溶液中加入丙烯酰氯(250mg,2.73mmol)和k2co3(503mg,3.35mmol)。然后将混合物升温到室温并在室温搅拌过夜。将反应混合物用水(30ml)淬灭,
并用ea(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-叔丁基(1-(6-丙烯酰胺基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(100mg,14%),为黄色固体。针对c
20h25
n5o3的[m h]ms计算值,384.2;实测值:384.2。步骤7:(r)-n-(1-(3-氨基吡咯烷-1-基)酞嗪-6-基)丙烯酰胺2,2,2-三氟乙酸盐
[0365]
向(r)-叔丁基(1-(6-丙烯酰胺基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(40mg,0.10mmol)在dcm(5ml)中的溶液中加入tfa(2ml)。将反应混合物在室温下搅拌1h。将反应混合物浓缩得到(r)-n-(1-(3-氨基吡咯烷-1-基)酞嗪-6-基)丙烯酰胺2,2,2-三氟乙酸盐(40mg,100%),为黄色油状物。针对c
15h17
n5o的[m h]计算值,284.2;实测值,284.2。步骤8:(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐
[0366]
在室温下向(r)-n-(1-(3-氨基吡咯烷-1-基)酞嗪-6-基)丙烯酰胺2,2,2-三氟乙酸盐(100mg,0.20mmol)在dmso(5ml)中的溶液加入2-氯嘧啶-5-甲腈(28mg,0.20mmol)和diea(80mg,0.60mmol)。然后将混合物在室温下搅拌3h。将反应混合物用水(15ml)淬灭,并用ea(10ml*3)萃取。将合并的有机层用盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐(8.8mg,9%),为黄色固体。1h nmr(400mhz,dmso-d6):δ2.11-2.14(m,1h),2.28-2.32(m,1h),3.81-3.83(m,1h),3.87-3.93(m,1h),4.00-4.05(m,1h),4.13-4.18(m,1h),4.57-4.61(m,1h),5.85(dd,j=1.6,10.0hz,1h),6.35(dd,j=2.0,16.8hz,1h),6.50(dd,j=10.0,16.8hz,1h),7.89(dd,j=2.4,9.2hz,1h),8.16(s,1h),8.26(d,j=9.2hz,1h),8.38(d,j=2.0hz,1h),8.68-8.78(m,3h),8.92(s,1h),10.65(s,1h)。针对c
20h18
n8o的[m h]ms计算值,387.2;实测值:387.2。实施例50:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺
步骤1:(r)-5-溴-n-(1-(6-硝基酞嗪-1-基)吡咯烷-3-基)嘧啶-2-胺
[0367]
在室温下向1-氯-6-硝基酞嗪(210mg,1.0mmol)在dmso(5ml)中的溶液中加入(r)-5-溴-n-(吡咯烷-3-基)嘧啶-2-胺(242mg,1.0mmol)和diea(390mg,3.0mmol)。然后在70℃下将混合物搅拌过夜。将反应混合物冷却至室温,用水(15ml)稀释,并用ea(10ml*3)萃取。将合并的有机层用盐水(10ml)洗涤,经无水硫酸钠干燥,过滤并浓缩得到((r)-5-溴-n-(1-(6-硝基酞嗪-1-基)吡咯烷-3-基)嘧啶-2-胺(350mg,84%),为黄色固体。针对c
16h14
brn7o2的[m h]ms计算值,416.2;实测值:416.2。步骤2:(r)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-胺
[0368]
在室温条件下向((r)-5-溴-n-(1-(6-硝基酞嗪-1-基)吡咯烷-3-基)嘧啶-2-胺(200mg,0.48mmol)在乙醇(15ml)和h2o(5ml)中的溶液中加入fe(270mg,4.80mmol)和nh4cl(270mg,5.00mmol)。然后将反应混合物回流3h。冷却至室温后,将反应混合物过滤并浓缩滤液。将残余物用饱和nahco3调至ph 8,并用ea(20ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。经c18柱(acn:h2o=5%-40%)纯化残余物得到(r)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-胺(70mg,38%),为黄色固体。针对c
16h16
brn7的[m h]ms计算值,386.2;实测值:386.2。步骤3:(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐
[0369]
在0℃下向(r)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-胺(300mg,0.78mmol)在dma(10ml)中的溶液中加入丙烯酰氯(141mg,1.55mmol)和k2co3(225mg,1.55mmol)。然后将混合物升温到室温,搅拌过夜。将反应混合物用水(30ml)淬灭,并用ea(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐(37.6mg,11%),为白色固体。1h nmr(400mhz,dmso-d6):δ2.06-2.11(m,1h),2.24-2.29(m,1h),3.78-3.80(m,1h),3.86-3.92(m,1h),3.99-4.04(m,1h),4.11-4.16(m,1h),4.43-4.48(m,1h),5.85(dd,j=1.6,10.0hz,1h),6.35(dd,j=1.6,12.8hz,1h),6.50(dd,j=10.4,17.2hz,1h),7.85-7.90(m,2h),8.18(s,1h),8.26(d,j=9.2hz,1h),8.36-8.41(m,3h),8.91(s,1h),10.66(s,1h)。针对c
19h18
brn7o的[m h]ms计算值,440.1;实测值:440.1。实施例51:(r)-n-(1-(3-((5-乙炔基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺步骤1:(r)-1-(6-硝基酞嗪-1-基)吡咯烷-3-胺2,2,2-三氟乙酸盐
[0370]
向(r)-叔丁基(1-(6-硝基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(100mg,0.28mmol)在dcm(5ml)中的溶液中加入tfa(1ml)。将反应混合物在室温下搅拌1h。将反应混合物浓缩得到(r)-1-(6-硝基酞嗪-1-基)吡咯烷-3-胺2,2,2-三氟乙酸盐(100mg,100%),为黄色油状物。针对c
12h13
n5o2的[m h]计算值,260.1;实测值,260.2。
步骤2:(r)-n-(1-(6-硝基酞嗪-1-基)吡咯烷-3-基)-5-((三甲基甲硅烷基)乙炔基)嘧啶-2-胺
[0371]
在室温下向(r)-1-(6-硝基酞嗪-1-基)吡咯烷-3-胺2,2,2-三氟乙酸盐(100mg,0.27mmol)在dmso(5ml)中的溶液中加入2-氯-5-((三甲基甲硅烷基)乙炔基)嘧啶(65mg,0.30mmol)和diea(145mg,1.1mmol)。然后将混合物在40℃下搅拌过夜。用水(15ml)淬灭反应混合物,并用ea(10ml*3)萃取。将合并的有机层用盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。经硅胶柱色谱法(pe:ea=1:1)纯化残余物得到(r)-n-(1-(6-硝基酞嗪-1-基)吡咯烷-3-基)-5-((三甲基甲硅烷基)乙炔基)嘧啶-2-胺(50mg,42%),为黄色固体。针对c
21h23
n7o2si的[m h]ms计算值,434.2;实测值:434.2。步骤3:(r)-1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-胺
[0372]
在室温下向(r)-n-(1-(6-硝基酞嗪-1-基)吡咯烷-3-基)-5-((三甲基甲硅烷基)乙炔基)嘧啶-2-胺(270mg,0.62mmol)在乙醇(30ml)和h2o(10ml)中的溶液中加入fe(350mg,6.2mmol)和nh4cl(350mg,6.5mmol)。然后将混合物回流3h。冷却至室温后,将反应混合物过滤,将滤液浓缩。用饱和nahco3调节残余物的ph为8,并用ea(20ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩得到(r)-1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-胺(240mg,96%),为黄色固体。针对c
21h25
n7si的[m h]ms计算值,404.2;实测值:404.2。步骤4:(r)-n-(1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺
[0373]
在0℃下向(r)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-胺(240mg,0.59mmol)在dma(10ml)中的溶液中加入丙烯酰氯(108mg,1.20mmol)和k2co3(165mg,1.20mmol)。然后将混合物升温到室温,搅拌过夜。将反应混合物用水(30ml)淬灭,并用ea(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过
制备型hplc纯化残余物得到(r)-n-(1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺(20mg,7.5%),为黄色固体。针对c
24h27
n7osi的[m h]ms计算值,458.2;实测值:458.2。步骤5:(r)-n-(1-(3-((5-乙炔基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐
[0374]
向(r)-n-(1-(3-((5-((三甲基甲硅烷基)乙炔基)嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺(30mg,0.066mmol)在thf(10ml)中的溶液中加入tbaf在thf中的溶液(0.07ml,0.07mmol)。然后将混合物在室温下搅拌2h。将反应混合物用水(30ml)淬灭,并用ea(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(1-(3-((5-乙炔基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐(12.3mg,50%),为黄色固体。1h nmr(400mhz,dmso-d6):δ2.07-2.12(m,1h),2.25-2.30(m,1h),3.78-3.82(m,1h),3.87-3.93(m,1h),4.00-4.04(m,1h),4.12-4.16(m,1h),4.51-4.55(m,1h),5.85(dd,j=2.0,10.0hz,1h),6.35(dd,j=2.0,17.2hz,1h),6.50(dd,j=10.0,16.8hz,1h),7.89(dd,j=2.0,9.2hz,1h),8.05(d,j=6.4hz,1h),8.15(s,1h),8.26(d,j=9.2hz,1h),8.37-8.44(m,3h),8.91(s,1h),10.65(s,1h)。针对c
21h19
n7o的[m h]ms计算值,386.2;实测值:386.2。实施例52:(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺的合成步骤1:(r)-1-(4-(氮杂环丁烷-1-基)-6-硝基酞嗪-1-基)吡咯烷-3-胺盐酸盐
5-溴嘧啶-2-胺(240mg,0.51mmol)在乙醇(30ml)和h2o(10ml)中的溶液中加入fe(285mg,5.1mmol)和nh4cl(275mg,5.1mmol)。然后将混合物回流5h。冷却至室温后,将反应混合物过滤,将滤液浓缩。用饱和nahco3调节残余物的ph为8,并用ea(20ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩得到(r)-4-(氮杂环丁烷-1-基)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-胺(200mg,89%),为黄色固体。针对c
19h21
brn8的[m h]ms计算值,441.1;实测值:441.1。步骤4:(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐
[0378]
在0℃下向(r)-4-(氮杂环丁烷-1-基)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-胺(200mg,0.45mmol)在dma(5ml)中的溶液中加入丙烯酰氯(83mg,0.91mmol)和k2co3(126mg,0.91mmol)。然后将混合物升温至室温,搅拌2h。将反应混合物过滤,通过制备型hplc纯化滤液得到(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((5-溴嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐(88.5mg,39%),为黄色固体。1h nmr(400mhz,cd3od):δ2.14-2.19(m,1h),2.31-2.40(m,3h),3.67-3.72(m,3h),3.80-3.84(m,1h),3.93-3.97(m,1h),4.06-4.10(m,1h),4.35(t,j=5.6hz,2h),4.56(t,j=4.2hz,1h),5.93(t,j=5.6hz,1h),6.53(d,j=6.0hz,2h),8.01(dd,j=2.0,9.2hz,1h),8.36-8.40(m,3h),8.51(s,1h),8.90(d,j=2.4hz,1h)。针对c22h23brn8o的[m h]ms计算值,495.1;实测值:495.1。实施例53:(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((6-乙炔基-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺步骤1:(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺
[0379]
在室温下向(r)-n-(1-(3-氨基吡咯烷-1-基)-4-(氮杂环丁烷-1-基)酞嗪-6-基)丙烯酰胺2,2,2-三氟乙酸盐(80mg,0.18mmol)在dmso(5ml)中的溶液中加入3-氯-6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪(37mg,0.18mmol)和diea(70mg,0.54mmol)。然后将混合物在40℃下搅拌3h。用水(15ml)淬灭反应混合物,并用ea(10ml*3)萃取。将合并的有机层用盐水(100ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺(17mg,18%),为黄色固体。针对c
26h31
n9osi的[m h]ms计算值,514.2;实测值:514.2。步骤2:(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((6-乙炔基-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐
[0380]
向(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((6-((三甲基甲硅烷基)乙炔基)-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺(17mg,0.033mmol)在thf(5ml)中的溶液中加入tbaf在thf中的溶液(0.05ml,0.05mmol)。然后将混合物在室温下搅拌2h。用水(15ml)淬灭反应混合物,并用ea(5ml*3)萃取。将合并的有机层用盐水(10ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物得到(r)-n-(4-(氮杂环丁烷-1-基)-1-(3-((6-乙炔基-1,2,4-三嗪-3-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺甲酸盐(9.5mg,65%),为黄色固体。1h nmr(400mhz,cd3od):δ2.25-2.28(m,1h),2.44-2.49(m,1h),2.55-2.63(m,2h),3.77-3.89(m,2h),3.87-4.01(m,1h),4.03(s,1h),4.06-4.18(m,1h),4.57(t,j=8.0hz,4h),4.74(br s,1h),5.90(dd,j=4.8,7.2hz,1h),6.49-6.51(m,2h),7.96(dd,j=2.4,8.8hz,1h),8.38-8.48(m,2h),8.92(s,1h),8.93(s,1h)。针对c
23h23
n9o的[m h]ms计算值,442.2;实测值:442.2。实施例54:(r)-n-(4-(3-氰基氮杂环丁烷-1-基)-1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺
步骤1:1-(4-氯-7-硝基酞嗪-1-基)氮杂环丁烷-3-甲腈
[0381]
在室温下向1,4-二氯-6-硝基酞嗪(6.0g,24.5mmol)在dmso(40ml)中的溶液中加入氮杂环丁烷-3-甲腈盐酸盐(2.9g,24.5mmol)和k2co3(10.1g,73.7mmol)。然后将混合物在室温搅拌16h。将反应混合物冷却至室温,用水(100ml)稀释,并用ea(50ml*3)萃取。将合并的有机层用盐水(50ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过硅胶柱色谱法(pe:ea=1:1)纯化残余物得到1-(4-氯-7-硝基酞嗪-1-基)氮杂环丁烷-3-甲腈(2.9g,26%),为棕色固体。针对c
12
h8cln5o2的[m h]ms计算值,290.0;实测值:290.0。步骤2:(r)-叔丁基(1-(4-(3-氰基氮杂环丁烷-1-基)-6-硝基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯
[0382]
在室温在n2气氛下向1-(4-氯-7-硝基酞嗪-1-基)氮杂环丁烷-3-甲腈(2.7g,9.3mmol)和(r)-叔丁基吡咯烷-3-基氨基甲酸酯(6.9g,37.2mmol)在甲苯(100ml)中的溶液中加入binap(463mg,0.74mmol)、pd2(dba)3(214mg,0.37mmol)和t-buona(1.79mg,18.62mmol)。然后在80℃搅拌混合物12h。将反应混合物冷却至室温并过滤。浓缩滤液并经硅胶柱色谱法(pe:ea=1:1)纯化,得到(r)-叔丁基(1-(4-(3-氰基氮杂环丁烷-1-基)-6-硝基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(0.6g,14%),为棕色固体。针对c
21h25
n7o4的[m h]ms计算值,440.2;实测值:440.2。步骤3:(r)-1-(4-(3-氨基吡咯烷-1-基)-7-硝基酞嗪-1-基)氮杂环丁烷-3-甲腈2,2,2-三氟乙酸盐
[0383]
向(r)-叔丁基(1-(4-(3-氰基氮杂环丁烷-1-基)-6-硝基酞嗪-1-基)吡咯烷-3-基)氨基甲酸酯(500mg,1.14mmol)在dcm(5ml)中的溶液中加入tfa(2.5ml)。将反应混合物在室温下搅拌2h。将反应混合物浓缩得到(r)-1-(4-(3-氨基吡咯烷-1-基)-7-硝基酞嗪-1-基)氮杂环丁烷-3-甲腈2,2,2-三氟乙酸盐(386mg,粗品),为棕色油状物。针对c
16h17
n7o2的[m h]计算值,340.1;实测值,340.1。步骤4:(r)-2-((1-(4-(3-氰基氮杂环丁烷-1-基)-6-硝基酞嗪-1-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈
[0384]
在室温下向(r)-1-(4-(3-氨基吡咯烷-1-基)-7-硝基酞嗪-1-基)氮杂环丁烷-3-甲腈2,2,2-三氟乙酸盐(386mg,1.14mmol)在dmso(10ml)中的溶液中加入2-氯嘧啶-5-甲腈(174mg,1.25mmol)和diea(734g,5.69mmol)。然后将混合物在室温下搅拌2h。用水(15ml)淬灭反应混合物,并用ea(10ml*3)萃取。将合并的有机层用盐水(10ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过硅胶柱色谱法(pe:ea=1:1)纯化残余物得到(r)-2-((1-(4-(3-氰基氮杂环丁烷-1-基)-6-硝基酞嗪-1-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈(251mg,50%),为棕色固体。针对c
21h18n10
o2的[m h]ms计算值,443.2;实测值:443.2。步骤5:(r)-2-((1-(6-氨基-4-(3-氰基氮杂环丁烷-1-基)酞嗪-1-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈
[0385]
在室温下向(r)-2-((1-(4-(3-氰基氮杂环丁烷-1-基)-6-硝基酞嗪-1-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈(250mg,0.57mmol)在乙醇(15ml)和h2o(15ml)中的溶液中加入fe(216mg,5.66mmol)和nh4cl(202mg,5.66mmol)。然后将混合物在60℃下搅拌2h。冷却至室温后,将反应混合物过滤,将滤液浓缩。用饱和nahco3水溶液将残余物的ph调至8,并用ea(20ml*3)萃取。将合并的有机层用盐水(10ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。经硅胶柱色谱法(dcm:甲醇=20:1)纯化残余物得到(r)-2-((1-(6-氨基-4-(3-氰基氮杂环丁烷-1-基)酞嗪-1-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈(200mg,61%),为白色固体。针对c
21h20n10
的[m h]ms计算值,413.2;实测值:413.2。步骤6:(r)-n-(4-(3-氰基氮杂环丁烷-1-基)-1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺
[0386]
在0℃下向(r)-2-((1-(6-氨基-4-(3-氰基氮杂环丁烷-1-基)酞嗪-1-基)吡咯烷-3-基)氨基)嘧啶-5-甲腈(150mg,0.36mmol)在dma(5ml)中的溶液中加入丙烯酰氯(65mg,0.72mmol)和k2co3(100mg,0.72mmol)。将混合物升温至室温,搅拌30min。将反应混合物用水(30ml)淬灭,并用dcm(10ml*3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型hplc纯化残余物,得到(r)-n-(4-(3-氰基氮杂环丁烷-1-基)-1-(3-((5-氰基嘧啶-2-基)氨基)吡咯烷-1-基)酞嗪-6-基)丙烯酰胺(79.2mg,46%),为灰白色固体。1h nmr(400mhz,dmso-d6):δ2.04-2.09(m,1h),2.25-2.30(m,1h),3.62-4.01(m,5h),4.29-4.34(m,2h),4.44-4.57(m,3h),5.87(dd,j=2.0,10.0hz,1h),6.37(dd,j=1.6,16.8hz,1h),6.49(dd,j=10.0,16.8hz,1h),7.96(dd,j=2.0,9.2hz,1h),8.20(d,j=9.2hz,1h),8.43(d,j=2.0hz,1h),8.66-8.76(m,3h),10.69(s,1h)。针对c
24h22n10
o的[m h]ms计算值,467.2;实测值:467.2。ii.生物学评价实施例1
–
测定条件2(含巯基的条件)
[0387]
目的:使用蛋白激酶确定测试化合物的ic
50
谱。通过以单份测试每种化合物的10个浓度(1x10-04
m、3x10-05
m、1x10-05
m、3x10-06
m、1x10-06
m、3x10-07
m、1x10-07
m、3x10-08
m、1x10-08
m和3x10-09
m)来测量ic
50
值。
[0388]
测试化合物:化合物以预先称重的粉末在小瓶中提供。通过加入dmso将化合物溶解至1x10-02
m。将100μl每种所得储备溶液转移到四个96孔“母板”的第2列中。
[0389]
在测试之前,使用100%dmso作为溶剂,对母板第2列中的1x10-02
m储备溶液进行系列半对数稀释。这产生了10个不同的浓度,第12列中的稀释终点为3x10-07
m/100%dmso。在第1列和第7列填充100%dmso作为对照。随后,用96通道移液器将系列稀释的复制板的每个孔中的2x10μl移入两个相同的组的“化合物稀释板”中。
[0390]
在该过程中,将90μl h2o加入至一组化合物稀释板的每个孔中。为了最大程度地减少潜在的沉淀,仅在将化合物溶液转移到测定板中之前几分钟,将h2o加入到每个板中。充分摇动每个板,得到“化合物稀释板/10%dmso”。
[0391]
对于该测定,将来自化合物稀释板/10%dmso的每孔的5μl溶液转移到测定板中。该测定的最终体积为50μl。所有化合物均以10个最终测定浓度在1x10-04
m至3x10-09
m的范围内进行单份测试。在所有情况下,反应混合物中的最终dmso浓度均为1%。
[0392]
重组蛋白激酶:所有蛋白激酶均在sf9昆虫细胞或大肠杆菌中表达为重组gst融合蛋白或his标记的蛋白质,为全长或酶活性片段。所有激酶均从人cdna产生,并通过gsh亲和
色谱法或固定化金属纯化。在纯化过程中,从许多激酶中去除亲和标签。通过sds-page/考马斯染色检查蛋白激酶的纯度,通过质谱法核实身份。
[0393]
蛋白激酶测定:使用放射性测量蛋白激酶测定(activity assay)测量激酶活性。所有激酶测定均在来自perkinelmer(boston,ma,usa)的96孔flashplates
tm
中进行,反应体积为50μl。按以下顺序通过四个步骤将反应混合物移液:
·
20μl测定缓冲液(标准缓冲液)
·
5μl atp溶液(在h2o中)
·
5μl测试化合物(在10%dmso中)
·
20μl酶/底物混合物
[0394]
所有蛋白激酶的测定均含有70mm hepes-naoh ph 7.5,3mm mgcl2,3mm mncl2,3μm原钒酸钠,1.2mm dtt,50μg/ml peg
20000
,atp(可变浓度,对应于相应激酶的表观atp-km),[γ-33
p]-atp(每孔约9x10
05
cpm),蛋白激酶,和底物。
[0395]
每孔使用以下量的酶和底物:*最大摩尔酶测定浓度,表示酶制品仅含有100%活性酶
[0396]
将反应混合物在30℃下温育60分钟。用50μl 2%(v/v)h3po4终止反应,抽吸板,并用200μl 0.9%(w/v)nacl洗涤两次。用微板闪烁计数器(microbeta,wallac)确定
33
pi的掺入。所有测定均使用beckmancoulter/sagian
tm
core system进行。
[0397]
原始数据的评价:将每个测定板(n=8)的第1列中的计数的中值定义为“低对照”。该值反映了在不存在蛋白激酶但存在底物的情况下放射性与板的非特异性结合。将每个测定板(n=8)的第7列中的计数的中值作为“高对照”,即在不存在任何抑制剂的情况下的完全活性。高对照与低对照之间的差值被视为100%活性。
[0398]
作为数据评价的一部分,将特定板的低对照值从相应板的高对照值以及所有80个“化合物值”中减去。使用以下公式计算特定板的每个孔的残余活性(以%计):残余活性(%)=100x[(化合物的cpm
–
低对照)/(高对照
–
低对照)]
[0399]
使用quattro workflow v3.1.1(quattro research gmbh,munich,德国)计算每个浓度的残余活性和化合物ic
50
值。ic
50
测定的拟合模型为“s形响应(可变斜率)”,参数“顶部”固定为100%,“底部”固定为0%。使用的拟合方法是最小二乘拟合。
[0400]
结果:表1汇总了所有化合物的ic
50
值。该表显示所有计算出的ic
50
值,以及相应曲线的hill斜率。所有在测试浓度范围以外的ic
50
值(《3x10-09
m;》1x10-04
m)被标记为灰色。高于-0.4的hill斜率表明该曲线不是s形,非常平坦,或者不是下降的。实施例2
–
测定条件1(无巯基的条件)
[0401]
在定制的无巯基测定中使用蛋白激酶确定化合物的ic
50
谱。通过针对每种目的激酶以单份测试每种测试化合物的10个浓度(1x10-05
m至3x10-10
m)来测量ic
50
值。在测试之前,使用100%dmso作为溶剂,对母板第2列中的1x10-03
m储备溶液进行系列半对数稀释。这产生了10个不同的浓度,第12列中的稀释终点为3x10-08
m/100%dmso。在第1列和第7列填充100%dmso作为对照。随后,用96通道移液器将系列稀释的复制板的每个孔中的2x10微升移入两个相同的组的“化合物稀释板”中。所有板均为了自动标识和跟踪目的进行条形码化。通过以单份测试每种化合物的10个浓度(1x10-05
m至3x10-10
m)来测量ic
50
值。在溶解在dmso中之前,所有化合物均以粉末形式储存。溶解的化合物以1x10-02
m/100%dmso储备溶液的形式储存。在测定过程之前,将90微升h2o加入至一组化合物稀释板的每个孔中。为了最大程度地减少潜在的沉淀,仅在将化合物溶液转移到测定板中之前几分钟,将h2o加入到每个板中。充分摇动每个板,得到最终具有10%dmso的化合物稀释板。对于每个测定,将来自化合物稀释板/10%dmso的每孔的5微升溶液转移到测定板中。该测定的最终体积为50μl。所有化合物均以10个最终测定浓度在1x10-05
m至3x10-10
m的范围内进行单份测试。在所有情况下,反应混合物中的最终dmso浓度均为1%。使用放射性测量蛋白激酶测定(activity assay)测量蛋白激酶的激酶活性。所有激酶测定均在来自perkinelmer(boston,ma,usa)的96孔flashplatestm中进行,反应体积为50微升。按以下顺序通过四个步骤将反应混合物移液:20微升测定缓冲液(标准缓冲液)
·
5微升atp溶液(在h2o中)
·
5微升测试化合物(在10%dmso中)
·
20微升酶/底物混合物。蛋白激酶的每个测定均含有70mm hepes-naoh ph 7.5,3mm mgcl2,3mm mncl2,3μm原钒酸钠,1mm tcep,50μg/ml peg20000,atp(对应于激酶的表观atp-km,参见表a),[γ-33p]-atp(每孔约6x10xe5 cpm),其中根据所讨论的激酶,以预定的量使用蛋白激酶和相关底物。对于所有被标记为“无巯基”的实验,所有谷胱甘肽均从蛋白质制品交换,以便从测定中去除,并且最终缓冲液条件不包含含巯基的试剂。这样做是为了不干扰目的蛋白质中的关键半胱氨酸。
[0402]
对于数据分析,将每个测定板(n=8)的第1列中的计数的中值定义为“低对照”。该值反映了在不存在蛋白激酶但存在底物的情况下放射性与板的非特异性结合。将每个测定板(n=8)的第7列中的计数的中值作为“高对照”,即在不存在任何抑制剂的情况下的完全活性。高对照与低对照之间的差值被视为100%活性。作为数据评价的一部分,将特定板的低对照值从相应板的高对照值以及所有80个“化合物值”中减去。使用以下公式计算特定板的每个孔的残余活性(以%计):残余活性(%)=100x[(化合物的cpm
–
低对照)/(高对照
–
低对照)]
[0403]
使用quattro workflow v3.1.1(quattro research gmbh,munich,德国;www.quattro-research.com)计算每个浓度的残余活性和化合物ic
50
值。ic
50
测定的拟合模型为“s形响应(可变斜率)”,其中参数“顶部”固定为100%,“底部”固定为0%。使用的拟合方法是最小二乘拟合。作为测定质量的参数,使用每个测定板(n=8)的低和高对照的z
′‑
因子(zhang等人,j.biomol.screen.2:67-73,1999)。测定板的重复的proqinase标准是z
′‑
因子低于0.4(iversen等人,j.biomol.screen.3:247-252,2006)。
[0404]
表1公开的示例性化合物的代表性数据在以下表4中给出:表4
注:生化测定ic
50
数据在以下范围内给出:a:≤0.10μm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
c:》1.0μm至≤10μmb:》0.10μm至≤1.0μm
ꢀꢀ
d:》10μm至《30μm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
e:》30μm至《100μmiii.药物剂型的制备实施例1:口服胶囊
[0405]
活性成分是表1的化合物或其药学上可接受的盐。通过将1-1000mg活性成分与淀粉或其他合适的粉末掺合物混合来制备用于口服施用的胶囊。将该混合物掺入适于口服施用的口服剂量单位如硬明胶胶囊中。实施例2:用于注射的溶液
[0406]
活性成分是表1的化合物或其药学上可接受的盐,并且配制为在芝麻油中浓度为50mg-eq/ml的溶液。本文所述的实施例和实施方案仅用于说明性目的,并且对本领域技术人员而言为提示性的各种修改或变化都将包含在本技术的精神和范围以及所附权利要求书的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。