1.本发明属于医药技术领域,更具体的说涉及一种液质联用测定血浆中匹伐他汀浓度的方法。
背景技术:
2.匹伐他汀(pitavastatin,pit)对羟甲戊二酰辅酶a(hmg-coa)还原酶有强力拮抗抑制作用,能够高效抑制人肝细胞hepg2中生成胆固醇的过程,从而阻碍胆固醇的合成。匹伐他汀能在超低浓度下诱导低密度脂蛋白(ldl)受体mrna的合成,使其数量增加,导致ldl受体密度增大,从而促进ldl的清除,使血浆ldl浓度及血浆总甘油三酯浓度降低,有效治疗高胆固醇血症。匹伐他汀结构中含有羟基羧酸结构,在体内体外均能缩水成环形成匹伐他汀内脂结构。由于匹伐他汀和匹伐他汀内脂在体内外易于互相转化,故对于匹伐他汀血药浓度的准确测定产生影响。为了减弱两者在血样采集、储存和样品预处理过程中产生的羟基羧酸型与内脂型结构的相互转化,要求在血样在采集储存及预处理等过程中操作简单快速易于控制,如控制ph值和控制温度等。
3.目前现有技术检测人血浆中的匹伐他汀的分析方法主要为固相萃取和液液萃取法,多采用非同位素内标,无法保证待测物与内标洗脱方式的一致性,且未评估羟基羧酸和内脂的相互转换,有成本高,耗时长,操作过程难控制等缺点。为满足临床生物样品分析的需求,需开发更简单、可靠、省时的人血浆中匹伐他汀浓度测定的方法,本发明建立了一种快速、灵敏度高、条件可控的高效液相串联质谱法测定人血浆中匹伐他汀浓度的方法。
技术实现要素:
4.本发明的目的在于提供一种液质联用测定血浆中匹伐他汀浓度的方法,人血浆样品以氘代匹伐他汀为内标,加入沉淀剂进行蛋白沉淀,取上清液加稀释剂,预处理后,经高效液相色谱-串联质谱检测其浓度,检测速度快,精度高,灵敏度好。
5.本发明技术方案一种液质联用测定血浆中匹伐他汀浓度的方法,人血浆样品经预处理后经高效液相色谱-串联质谱检测其浓度,具体包括以下步骤:
6.(1)血浆样品预处理:
7.室温黄光条件下,以edta-k2为抗凝剂,以匹伐他汀-d4为内标;在96孔板的孔中加入100μl样品,加入50μl浓度为20.000ng/ml的内标匹伐他汀-d4工作溶液,混匀后每一个样品孔中加入400μl乙腈,封板,混匀5min,样品在4℃,2623g离心10min;取离心后上清液150μl至另一96孔收集板中,加入150μl含有50%乙腈和0.005%乙酸的溶液,封板,混匀;样品在4℃,2623g离心10min,获得测试样品,待进样;
8.(2)试样测定:
9.室温黄光条件下,取5μl测试样品注入高效液相色谱串联质谱仪中,检测样品中的匹伐他汀和内标匹伐他汀-d4的色谱峰,并据此计算人血浆样品中的匹伐他汀浓度。
10.优选地,步骤(2)中:液相色谱条件为:
11.色谱柱:welchultimatexb-c
18
,柱规格为2.1
×
150mm,5μm;色谱柱温:40℃;流动相a:水/乙酸的体积百分比为100/0.05;流动相b:乙酸/乙腈的体积百分比为0.01/100;洗针液:水/乙腈/乙酸的体积百分比为20/80/0.05;自动进样器温度为4℃;梯度洗脱,流速为0.5ml/min,进样量为5μl,分析时间5.5min;
12.质谱条件为:
13.离子源为电喷雾离子源,接口电压为4000.00v,接口温度为300℃,dl温度230℃,加热块温度为400℃,cid气为230kpa;匹伐他汀和匹伐他汀-d4的碰撞能量分别为-29v和-30v,正离子方式检测;扫描方式为多重反应监测。
14.优选地,步骤(1)中,洗脱程序为:
[0015][0016]
优选地,步骤(2)中:采用内标法,以匹伐他汀和内标匹伐他汀-d4的峰面积比值带入标准曲线方程计算所述血浆样品中的匹伐他汀的浓度。
[0017]
优选地,标准曲线方程的建立包括以下步骤:
[0018]
取190μl空白血浆置于聚丙烯管中,以工作液的形式分别添加10μl浓度分别为4.000ng/ml、8.000ng/ml、40.000ng/ml、160.000ng/ml、320.000ng/ml、640.000ng/ml、1280.000ng/ml、1600.000ng/ml的匹伐他汀工作溶液,再以体积比为1:1加入稳定剂(0.1mol/l乙酸钠缓冲液)至标样1、标样2、标样3、标样4、标样5、标样6、标样7、标样8中,混匀后分别取100μl标样1、标样2、标样3、标样4、标样5、标样6、标样7、标样8、零浓度样本加入50μl的20.000ng/ml的内标匹伐他汀-d4溶液,向双空白样本中加入50μl的体积分数为50%的甲醇水溶液,混匀后每一个样品孔中加入400μl乙腈,封板,混匀5min,样品在4℃,2623g离心10min;取离心后上清液150μl至另一96孔收集板中,加入150μl含有50%乙腈和0.005%乙酸的溶液,封板,混匀;样品在4℃,2623g离心10min,获得标准样品,待进样;
[0019]
分别取5μl标准样品注入高效液相色谱串联质谱仪中,检测样品中的匹伐他汀和内标匹伐他汀-d4的色谱峰,并据此得到标准曲线,以用于回算所述血浆样品中的匹伐他汀的浓度。
[0020]
优选地,质量控制的建立包括以下步骤:
[0021]
配制匹伐他汀和匹伐他汀内脂浓度均为4.000ng/ml、12.000ng/ml、60.000ng/ml、600.000ng/ml、1200.000ng/ml的质控样品工作液;取380μl空白血浆置于聚丙烯管中,分别添加质控工作液20μl,再以体积比为1:1加入稳定剂(0.1mol/l乙酸钠缓冲液),混匀后分别取质控样品100μl加入50μl的20.000ng/ml的内标匹伐他汀-d4溶液,混匀后每一个样品孔中加入400μl乙腈,封板,混匀5min,样品在4℃,2623g离心10min;取离心后上清液150μl至另一96孔收集板中,加入150μl含有50%乙腈和0.005%乙酸的溶液,封板,混匀;样品在4℃,2623g离心10min,获得标准样品,待进样;
[0022]
分别取5μl标准样品注入高效液相色谱串联质谱仪中,检测质控样品中的匹伐他
汀和内标匹伐他汀-d4的色谱峰,并根据标准曲线回算出质控样品测定浓度。
[0023]
本发明技术方案的一种液质联用测定血浆中匹伐他汀浓度的方法的有益效果是:
[0024]
1、以匹伐他汀-d4为内标,使用同位素内标,保证待测物与内标洗脱的一致性;以edta-k2为抗凝剂,增加血样的稳定性,方式便捷可控;添加乙酸钠缓冲液的稳定剂,增加血样的稳定性,方式便捷可控;
[0025]
2、预处理方法较简便,适用于高通量测定;
[0026]
3、专属性强:在本技术方案所用的色谱条件下,匹伐他汀保留时间为2.71min左右,内标匹伐他汀-d4保留时间在2.71min左右;匹伐他汀和内标匹伐他汀-d4的峰形良好,无杂峰明显干扰测定,基线平稳;
[0027]
4、灵敏度高:血浆最低定量限为0.200ng/ml,能准确测定血浆中匹伐他汀的浓度,灵敏度高,特异性强;
[0028]
5、本发明方法快速、准确、灵敏度高、特异性强为匹伐他汀的血药浓度测定提供依据。本方法的血浆标准曲线线性范围为0.200~80.000ng/ml。
附图说明
[0029]
图1为液质联用测定血浆中匹伐他汀浓度的方法中匹伐他汀的产物离子扫描质谱图;
[0030]
图2为液质联用测定血浆中匹伐他汀浓度的方法中匹伐他汀-d4的产物离子扫描质谱图;
[0031]
图3为人空白血浆的lc-ms/ms图;
[0032]
图4为人空白血浆加入匹伐他汀和匹伐他汀-d4的lc-ms/ms图;
[0033]
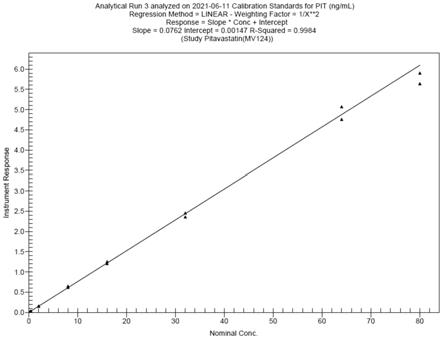
图5为lc-ms/ms法测得的匹伐他汀在人血浆中的标准曲线图。
具体实施方式
[0034]
为便于本领域技术人员理解本发明技术方案,现结合说明书附图对本发明技术方案做进一步的说明。
[0035]
本发明技术方案一种液质联用测定血浆中匹伐他汀浓度的方法,也称人血浆中匹伐他汀浓度的lc-ms/ms检测方法,简称lc-ms/ms检测方法,人血浆样品经预处理后经高效液相色谱-串联质谱检测其浓度,具体包括以下步骤:
[0036]
(1)血浆样品预处理:
[0037]
室温黄光条件下,以edta-k2为抗凝剂,以匹伐他汀-d4为内标。在96孔板的孔中加入100μl样品,加入50μl浓度为20.000ng/ml的内标匹伐他汀-d4工作溶液,混匀后每一个样品孔中加入400μl乙腈,封板,混匀5min。样品在4℃,2623g离心10min;取离心后上清液150μl至另一96孔收集板中,加入150μl含有50%乙腈和0.005%乙酸的溶液,封板,混匀。样品在4℃,2623g离心10min,获得测试样品,待进样。
[0038]
(2)试样测定:
[0039]
室温黄光条件下,取5μl测试样品注入高效液相色谱串联质谱仪中。检测样品中的匹伐他汀和内标匹伐他汀-d4的色谱峰,并据此计算人血浆样品中的匹伐他汀浓度。
[0040]
上述步骤(2)中:液相色谱条件为:
[0041]
色谱柱:welchultimatexb-c
18
,柱规格为2.1
×
150mm,5μm。色谱柱温:40℃。流动相a:水/乙酸的体积百分比为100/0.05。流动相b:乙酸/乙腈的体积百分比为0.01/100。洗针液:水/乙腈/乙酸的体积百分比为20/80/0.05。自动进样器温度为4℃。梯度洗脱,流速为0.5ml/min,进样量为5μl,分析时间5.5min。
[0042]
质谱条件为:
[0043]
离子源为电喷雾离子源,接口电压为4000.00v,接口温度为300℃,dl温度230℃,加热块温度为400℃,cid气为230kpa。匹伐他汀和匹伐他汀-d4的碰撞能量分别为-29v和-30v,正离子方式检测;扫描方式为多重反应监测。
[0044]
上述步骤(1)中,洗脱程序为:
[0045][0046]
上述步骤(2)中:采用内标法,以匹伐他汀和内标匹伐他汀-d4的峰面积比值带入标准曲线方程计算所述血浆样品中的匹伐他汀的浓度。
[0047]
本技术方案中,标准曲线方程的建立包括以下步骤:
[0048]
取190μl空白血浆置于聚丙烯管中,以工作液的形式分别添加10μl浓度分别为4.000ng/ml、8.000ng/ml、40.000ng/ml、160.000ng/ml、320.000ng/ml、640.000ng/ml、1280.000ng/ml、1600.000ng/ml的匹伐他汀工作溶液,再以体积比为1:1加入稳定剂(0.1mol/l乙酸钠缓冲液)至标样1、标样2、标样3、标样4、标样5、标样6、标样7、标样8中,混匀后分别取100μl标样1、标样2、标样3、标样4、标样5、标样6、标样7、标样8、零浓度样本加入50μl的20.000ng/ml的内标匹伐他汀-d4溶液,向双空白样本中加入50μl的体积分数为50%的甲醇水溶液,混匀后每一个样品孔中加入400μl乙腈,封板,混匀5min,样品在4℃,2623g离心10min;取离心后上清液150μl至另一96孔收集板中,加入150μl50%乙腈(含0.005%乙酸)(即加入150μl含有50%乙腈和0.005%乙酸的溶液,溶液为水溶液),封板,混匀;样品在4℃,2623g离心10min,获得标准样品,待进样。分别取5μl标准样品注入高效液相色谱串联质谱仪中,检测样品中的匹伐他汀和内标匹伐他汀-d4的色谱峰,并据此得到标准曲线,以用于回算所述血浆样品中的匹伐他汀的浓度。
[0049]
本技术方案中,质量控制的建立包括以下步骤:
[0050]
配制匹伐他汀和匹伐他汀内脂浓度均为4.000ng/ml、12.000ng/ml、60.000ng/ml、600.000ng/ml、1200.000ng/ml的质控样品工作液;取380μl空白血浆置于聚丙烯管中,分别添加质控工作液20μl,再以体积比为1:1加入稳定剂(0.1mol/l乙酸钠缓冲液),混匀后分别取质控样品100μl加入50μl的20.000ng/ml的内标匹伐他汀-d4溶液,混匀后每一个样品孔中加入400μl乙腈,封板,混匀5min,样品在4℃,2623g离心10min;取离心后上清液150μl至另一96孔收集板中,加入150μl50%乙腈(含0.005%乙酸),封板,混匀;样品在4℃,2623g离心10min,获得标准样品,待进样。分别取5μl标准样品注入高效液相色谱串联质谱仪中,检测质控样品中的匹伐他汀和内标匹伐他汀-d4的色谱峰,并根据标准曲线回算出质控样品
测定浓度。
[0051]
基于上述技术方案,下面对液质联用测定血浆中匹伐他汀浓度的方法公开具体的实验步骤。实验过程均需在室温黄光条件下进行。
[0052]
一、实验材料与分析设备
[0053]
匹伐他汀钙(分析物):中国食品药品检定研究院或相同、更高等级的标准品。匹伐他汀-d4钠盐(内标):tlcpharmaceuticalstandardsltd或相同、更高等级的标准品。匹伐他汀内脂:tlcpharmaceuticalstandardsltd或相同、更高等级的标准品。使用试剂见下表1,使用分析设备见下表2。
[0054]
表1试剂明细
[0055][0056]
表2使用设备明细
[0057][0058]
二、液质条件
[0059]
1、液相色谱条件
[0060]
色谱柱:welchultimatexb-c
18
,柱规格为2.1
×
150mm,5μm;色谱柱温:40℃;流动相a:水/乙酸的体积百分比为100/0.05;流动相b:乙酸/乙腈的体积百分比为0.01/100;洗针液:水/乙腈/乙酸的体积百分比为20/80/0.05;自动进样器温度为4℃;梯度洗脱,流速为0.5ml/min,进样量为5μl,分析时间5.5min;匹伐他汀和匹伐他汀-d4预期保留时间约在2.71min。具体的梯度洗脱程序见表3。
[0061]
表3梯度洗脱程序
[0062]
[0063]
2、质谱条件:
[0064]
离子源为电喷雾离子源,接口电压为4000.00v,接口温度为300℃,dl温度230℃,加热块温度为400℃,cid气为230kpa。匹伐他汀和匹伐他汀-d4的碰撞能量分别为-29v和-30v,正离子方式检测;扫描方式为多重反应监测。用于定量分析的离子反应分别为:匹伐他汀:m/z422.1
→
290.1和匹伐他汀-d4:m/z426.2
→
294.2。
[0065]
三、实验过程
[0066]
1、匹伐他汀标准曲线工作溶液的配制
[0067]
匹伐他汀标准曲线工作溶液的配制:精密称取适量的匹伐他汀标准品,经质量校正系数校正后,将其溶于纯甲醇中,得到最终浓度为1.000mg/ml的储备液。再以50%乙腈(含0.005%乙酸)依次稀释配制匹伐他汀工作溶液,具体稀释浓度见下表4。表4中,ss表示储备液,ws表示工作液。匹伐他汀标准曲线工作溶液在棕色玻璃瓶中配制并存储于-20℃条件下,体积可视需要依比例增加或减少。
[0068]
表4匹伐他汀工作溶液配制浓度
[0069][0070]
2、匹伐他汀质量控制工作溶液的配制
[0071]
匹伐他汀工作溶液的配制:精密称取适量的匹伐他汀标准品,经质量校正系数校正后,将其溶于纯甲醇中,得到最终浓度为1.000mg/ml的储备液。精密称取适量的匹伐他汀内脂标准品,经质量校正系数校正后,将其溶于纯甲醇中,得到最终浓度为0.500mg/ml的储备液。再以50%乙腈(含0.005%乙酸)依次稀释配制匹伐他汀工作溶液,具体稀释浓度见下表5。
[0072]
表5中,a表示匹伐他汀简称pit,b表示匹伐他汀内酯简称hpi,mph为匹伐他汀和匹伐他汀内脂的混合溶液,ss表示储备液,ws表示工作液。匹伐他汀工作溶液在棕色玻璃瓶中配制并存储于-20℃条件下,体积可视需要依比例增加或减少。
[0073]
表5匹伐他汀质量控制工作溶液配制浓度
[0074][0075]
3、匹伐他汀-d4内标工作溶液的配制
[0076]
匹伐他汀-d4内标工作溶液的配制:取匹伐他汀-d4标准品一支,经质量校正系数校正后,将其溶于纯甲醇中,得到最终浓度为0.500mg/ml的储备液。再以体积分数为50%的甲醇水溶液溶稀释配制20.000ng/ml内标匹伐他汀-d4工作溶液,具体稀释浓度见下表6。
[0077]
匹伐他汀-d4简称d4pit,匹伐他汀-d4内标工作溶液在棕色玻璃瓶中配制并存储于-20℃条件下,体积可视需要依比例增加或减少。
[0078]
表6匹伐他汀-d3工作溶液配制浓度
[0079][0080]
4、线性实验
[0081]
将空白血浆于室温环境解冻;转移190μl的空白血浆8份至聚丙烯管中(每一个标准曲线样本),分别精密加入不同浓度的匹伐他汀工作溶液10μl制备每一个样本并混匀,按照1∶1体积比加入稳定剂0.1mol/l乙酸钠缓冲液,配成不同浓度的含药血浆,按“血浆样品预处理”操作。计算匹伐他汀峰面积as和内标匹伐他汀-d4峰面积ai的比值y(y=as/ai),以峰面积比值y对血药浓度x作回归计算。以平均比值y对血药浓度x做回归计算,按该方法测得的匹伐他汀的血药浓度的最低定量限为:0.200ng/ml。lc-ms/ms法测得的匹伐他汀在人血浆中的标准曲线参数如表7。
[0082]
表7 lc-ms/ms法测得的匹伐他汀在人血浆中的标准曲线
[0083][0084]
5、准确度和精密度
[0085]
将空白血浆于室温环境解冻;转移适当体积的空白血浆至聚丙烯管中,并添加匹伐他汀质量控制工作溶液制备5种不同浓度的含药血浆质控样品(lloq、lqc、m1qc、m2qc、hqc)及一条随行标准曲线,按“血浆样品预处理”操作。在至少两天,至少在三个分析批中完成,计算匹伐他汀峰面积as和内标匹伐他汀-d4峰面积ai的比值y,代入当天的标准曲线中求得实测浓度,由实测浓度计算批内与批间精密度,实测浓度与加入浓度的比值即为准确度,结果见表8。结果表明,匹伐他汀血浆样品批内、批间精密度、准确度小于
±
15%符合要求。
[0086]
依每一分析批所需,可以选择分装足够的体积至己标示的聚丙烯管中并储存于-70℃条件下。体积可视需要依比例增加或减少。
[0087]
表8 lc-ms/ms法测定血浆中匹伐他汀的批内、批间精度和准确度
[0088][0089]
6、选择性
[0090]
六个不同空白血浆样品分别来源不同健康人体,将六个不同空白血浆样品于同一分析批依样本制备步骤制备及分析,来评价不同空白血浆对匹伐他汀分析物及内标匹伐他汀-d4的干扰。
[0091]
六个不同来源空白健康人体血浆样本制备分析后,在符合匹伐他汀保留时间处的干扰峰响应均低于对应基质定量下限样本匹伐他汀响应的20.0%。在符合内标匹伐他汀-d4保留时间处的干扰峰响应均低于对应基质的定量下限样本的内标匹伐他汀-d4响应的5.0%。结果表明该分析方法对匹伐他汀的分析具有专属性和选择性。具体见表9。
[0092]
表9六个不同来源空白健康人体血浆的干扰性数据对比表
[0093]
表9中,当“无显著峰值可以被积分(或没有峰)”或“峰面积的保留时间不符合样本中分析物或内标物的保留时间”,该区域峰面积认为是零。
[0094]
从表9可以看出,不同人体的空白血浆对匹伐他汀的检测结果没有造成干扰。因此,该方法可以用于检测不同人体血浆中的匹伐他汀浓度。
[0095]
7、稀释可靠性
[0096]
考察样品稀释2倍可靠性的样品制备方法:取浓度为1.000mg/ml的匹伐他汀储备液和浓度为0.500mg/ml匹伐他汀内脂储备液,以50%乙腈(含0.005%乙酸)为稀释剂配制匹伐他汀和匹伐他汀内脂浓度均为2400.000ng/ml的工作溶液。
[0097]
将空白血浆于室温环境解冻,转移380μl的空白血浆至聚丙烯管中,并添加20μl上述工作溶液制备含药血浆稀释质控样品(浓度为2400.000ng/ml),涡旋混匀,再以体积比为1∶1加入稳定剂0.1mol/l乙酸钠缓冲液,制成高于定量上限的样品,随后取100μl该样品于新聚丙烯管中,加100μl空白血浆稀释2倍,得到稀释2倍样品(浓度为60.000ng/ml)。然后按“血浆样品预处理”操作,平行处理6次。结果见表10。
[0098]
表10稀释可靠性考察结果
[0099][0100]
8、回收率
[0101]
提取回收率是指通过比较处理过的加标样品中待测物/内标响应和处理过的空白基质中加入待测物/内标的响应值来确定。配制lqc、m2qc、hqc3个浓度水平,每个浓度水平6个重复的样品。接受标准为每个浓度水平的样品的待测物和所有浓度水平的内标:正常提取样品的峰面积、提取基质后样品的峰面积、各浓度水平的样品的回收率的cv%≤15.0%。匹伐他汀和匹伐他汀-d4均满足接受标准,结果见表11和表12。
[0102]
表11待测物提取回收率
[0103][0104]
表12内标回收率
[0105][0106]
9、稳定性
[0107]
(1)冻融稳定性
[0108]
样品制备方法与质控样品的配制相同,配制结束后分别放置于-70℃冰箱或-20℃冰箱进行存储,再取出于室温条件下放置融解,各冻融5次,每组平行6份,然后按“血浆样品预处理”操作,取5μl测试样品注入高效液相色谱串联质谱仪中,结果见表13和表14。
[0109]
高/低浓度样品在-70℃下冻融5次的条件下测量浓度与标示值的偏差在
±
15%范围内,高/低浓度样品在-20℃下冻融5次的条件下测量浓度与标示值的偏差也在
±
15%范围内,说明样品在-70℃或-20℃冰箱中冻融处理5次是稳定的。
[0110]
表13
ꢀ‑
70℃与室温间冻融5次的稳定性考察结果
[0111][0112]
表14
ꢀ‑
20℃与室温间冻融5次的稳定性考察结果
[0113][0114]
(2)长期稳定性
[0115]
样品制备方法与质控样品的配制相同,配制结束后分别放置于-70℃冰箱进行存储36天后,再取出于室温条件下放置融解,每组平行6份,然后按“血浆样品预处理”操作,取5μl测试样品注入高效液相色谱串联质谱仪中,结果见表15。
[0116]
高/低浓度样品在-70℃下存储36天后,测量浓度与标示值的平均准确度偏差在
±
15%范围内,说明样品在-70℃冰箱中存储36天是稳定的。
[0117]
表15
ꢀ‑
70℃长期存储稳定性考察结果
[0118][0119]
10、人血浆样品检测
[0120]
将室温下解冻的样品或新配制的样品,涡旋混匀。在96孔板的孔中加入100μl样品(标准曲线,质控样品,系统适用性样品或待测生物样品,对于双空白样品或者零点样品,加入100μl的空白样品);对于双空白样品或uloq without is样品,加入50μl50%甲醇溶液,对于其他样品加入50μl内标工作液,涡旋混匀;每一个样品孔中加入400μl乙腈,封板,混匀5min;样品在4℃,2623g离心10min;取离心后上清液150μl至另一96孔收集板中,加入150μl50%乙腈(含0.005%乙酸),封板,混匀;样品在4℃,2623g离心10min,待进样。
[0121]
四、小结
[0122]
综上所述,本发明提供了一种预处理方法简便的血浆中匹伐他汀浓度的测定方法,采用简单的蛋白沉淀处理,适用于常规测定;由上述分析可知,在本实验所采用的色谱条件下,匹伐他汀保留时间为2.71min左右,内标匹伐他汀-d4保留时间在2.71min左右,匹伐他汀和内标匹伐他汀-d4的峰形良好,无明显杂峰干扰测定,基线平稳。本方法的血浆标准曲线线性范围为0.200~80.000ng/ml,批内和批间精密度cv%均小于
±
15%;本方法具有较高的特异性、稳定性好、方便可控能准确测定血浆中的匹伐他汀的浓度,灵敏度较高,血浆最低定量限为0.200ng/ml;同时,本发明方法准确、重现性好,为匹伐他汀的血药浓度测定提供依据。
[0123]
本发明技术方案在上面结合附图对发明进行了示例性描述,显然本发明具体实现并不受上述方式的限制,只要采用了本发明的方法构思和技术方案进行的各种非实质性改进,或未经改进将发明的构思和技术方案直接应用于其它场合的,均在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。