含有brd4抑制剂治疗钙化性主动脉瓣膜疾病的药物
技术领域
1.本发明涉及生物医药技术领域,具体为含有brd4抑制剂治疗钙化性主动脉瓣膜疾病的药物。
背景技术:
2.心脏瓣膜钙化病变在组织学上是不可逆的,严重危害人类健康。瓣膜置换术是目前临床上治疗chvd唯一有效的手段,但存在风险高、并发症多、后期满意度低等缺点。因此,预防和延缓chvd的发生发展显得尤为重要。迄今为止,临床上未见有安全有效的药物用以预防和抑制瓣膜钙化。虽然他汀类药物和血管紧张素转化酶(ace)抑制剂一直寄予厚望,但大量临床试验均证实,两种药物均不能有效减慢该疾病的进展。因此,寻找相关药物干预瓣膜钙化,对延缓和抑制瓣膜的发生发展具有重要的临床价值和意义。
3.瓣膜间质细胞在机械、脂蛋白、炎症应激等持续刺激下可转化为成骨样细胞,其特征是表达成骨细胞和软骨细胞分化相关的转录因子(runx2、 osterix和sox9)和矿化调节蛋白(alp碱性磷酸酶、osteopontin骨桥蛋白、 osteocalcin骨钙素、osteonectin骨连接蛋白、collagenase i和ii型、bonemorphogenic proteins骨形态发生蛋白),引起成骨性磷酸钙盐在瓣膜沉积,最终导致瓣膜钙化。因此,瓣膜间质细胞在cavd病理变化过程中起关键作用,对深入剖析该疾病发生和发展过程中的细胞-分子生物学机制至关重要。
4.jq1是一种bet bromodomain抑制剂,作用于brd4,结合到bet家族的所有溴结构域,而不结合到bet家族以外的溴结构域,brd4全称为 bromodomain-containing protein 4,即溴结构域蛋白4,属于bet家族成员, bet溴结构域(bromodomain and extra-terminal domain)包含四种蛋白,即brd2、brd3、brd4和brdt。bet具有保守的模块化结构:包括两段n-末端串联brd效应模块(bd1和bd2),一段额外的末端基团(et),几组保守的区域(a, b,seed区域)和c-末端区域(ctm)。化合物apabetalone(rvx-208),来自于一种植物多酚-白藜芦醇的衍生物。该化合物最初由resverlogix研发。该化合物显示出对brd4 bd2更强的抑制活性(对brd4bd2的kd为135nm,对brd4 bd1的kd为1142nm)。这种选择性可能是由于化合物的苯环能够与bd2的 his433形成π-π堆积作用,而bd1中对应的氨基酸为半胱氨酸。apabetalone (rvx-208)能够有效降低高血脂糖尿病患者的血脂,用于治疗前驱糖尿病的研究处于临床二期,用于治疗动脉粥样硬化、急性冠脉综合症(acs),文献报导 brd4能通过增加runx2表达增加成骨样分化,而现如今jq1抑制om诱导瓣膜间质细胞成骨样分化的讲究尚未得到报告。
技术实现要素:
5.本发明的目的是研究jq1是否可以减弱人瓣膜间质细胞(hvic)的钙化, jq1处理om诱导的hvic细胞,使用cck8分析和茜素红s染色评估hvic的增殖能力和钙化程度,qrt-pcr,western印迹和免疫荧光染色检测hvic中与钙化相关的标记基因(runx2和alp)的表达情况,证明bdr4抑制剂于该领域疾病和药物中具有效果,而提出的含有brd4抑制剂治疗钙
化性主动脉瓣膜疾病的药物。
6.含有brd4抑制剂治疗钙化性主动脉瓣膜疾病的药物,包括brd4抑制剂,且所述brd4抑制剂为jq1抑制剂。
7.含有brd4抑制剂治疗钙化性主动脉瓣膜疾病的药物的应用,所述钙化性主动脉瓣膜疾病为心脏瓣膜钙化病变。
8.本研究旨在研究jq1是否可以减弱人瓣膜间质细胞(hvic)的钙化,jq1 处理om诱导的hvic细胞,使用cck8分析和茜素红s染色评估hvic的增殖能力和钙化程度,qrt-pcr,western印迹和免疫荧光染色检测hvic中与钙化相关的标记基因(runx2和alp)的表达情况。
附图说明
9.图1为本发明中jq1处理hvic的细胞活力和钙化水平示意图;
10.图2为本发明中对om诱导的hvic中钙相关基因/蛋白质表达的影响示意图;
11.图3为本发明中沉默brd4抑制om诱导的瓣膜间质细胞成骨样分化示意图。
具体实施方式
12.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
13.实施例一:
14.1、材料和方法
15.1.1、人原代瓣膜间质细胞的提取与培养
16.(1)、将第一部分收集正常主动脉瓣膜放入15ml的离心管,用4℃冰盒中转运到超净工作台中,倒掉培养基,将瓣膜转移入无菌六孔板中,用含双抗的无菌pbs反复冲洗6次。
17.(2)、将瓣膜小心移入一个15ml无菌离心管中,加入(2mg/ml)i 型胶原酶溶液10ml,置于37℃,5%的co2培养箱中10h,每隔2个小时摇晃一下,待瓣膜组织分解成絮状、分散完全时即可。
18.(3)、500g离心5分钟,弃上清,底部沉淀即为消化好的原代细胞。
19.(4)、加入4ml含10%fbs的培养基溶液,充分混匀,在将细胞悬液加入无菌培养瓶中,轻轻摇晃使之平铺均匀,放入37℃,5%co2培养箱中。
20.(5)、在2-3天后,观察细胞均已贴壁,更换培养基,待细胞增殖生长达培养瓶面积的80-90%时,再传代。
21.(6)、传代:弃去培养基,在培养瓶中加入胰酶1ml显微镜下消化30s,弃去胰酶,加入6ml完全培养基。用无菌吸管吹打培养瓶底部,使贴壁细胞脱落成均匀的细胞悬液并移入两个培养瓶中,按每个t25培养瓶3ml溶液的比例,转移至培养箱中继续培养。
22.(7)、原代细胞分裂增殖能力是有限的,从接种到下一次传代一般需要5-7天左右,按1:2传代。传代至第6-7代以后,其细胞停止分裂增殖、细胞活性变差,不能满足实验需求,故而选取3-5代细胞进行相关实验检测。
23.1.2、cck8检测
24.本实施例采用cck8检测试剂盒。实验操作简述如下:
25.(1)、取104个vics细胞悬液加入到96孔培养板中。
26.(2)、在培养基中按照0um,1um,2um,5um,10um,20um等不同浓度加入mcl刺激vics 24h后加cck-8试剂。
27.(3)、继续培养,过0.5-1h,从培养箱中取出培养板,观察颜色发生明显变化,用酶标仪进行测定,并记录下反应时间。
28.1.3、活/死细胞染色(calceinam
·
pi)
29.(1)、取104个vics细胞悬液加入到96孔培养板中,在培养基中按照0um,1um,2um,5um,10um,20um不同浓度加入mcl刺激vics 24h。
30.(2)、取出溶液a、溶液b,室温平衡30分钟,取5μl溶液b加至10ml的pbs溶液中。
31.(3)、取5μl溶液a加入到上述10ml的pi溶液中,涡旋混匀,此溶液为染色工作液(2μm钙黄素am;8μmpi)。
32.(4)、洗涤细胞,去除培养基中的活性酯酶。加入200ul的染色工作液,室温孵育30min。
33.(5)、荧光显微镜下观察检测。
34.1.4、细胞茜素红染色
35.(1)、钙化培养基的制备:本部分按照含2%fbs、10mmβ-甘油磷酸 50ug/ml维生素c、100nm地塞米松、高糖培养基配制成骨分化培养基 (osteogenicmedium,om),作为钙化诱导培养基。
36.(2)、选取3-5代的瓣膜间质细胞,按上述的方法培养并消化细胞,接种于12孔板中,每孔加入1ml完全培养基,置入培养箱中培养48h。
37.(3)、当细胞完全贴壁并生长至80-90%左右时,将完全培养基更换为含2%fbs的培养基继续培养8h,调整细胞周期,使细胞停止分裂增殖,维持在静止期,便于更好地接受后续干预。
38.(4)、将用om培养基更换2%fbs的培养基,加入对应干预后,每隔三天换新鲜培养基,连续培养2周。
39.(5)、移去12孔板中培养基,用pbs清洗5次,加入1ml4%多聚甲醛溶液,固定10min。
40.(6)、移去4%中性多聚甲醛溶液,用双蒸水清洗5次,加入800ul 的茜素红染液,室温,孵育30min。
41.(7)、用移液枪吸去茜素红染液,加入2ml双蒸水,在室温摇床上洗涤5次,每次3min,采集图像。
42.1.5、小干扰rna(sirna)转染人瓣膜间质细胞
43.(1)、将瓣膜间质细胞接种于六孔板后,待生长至70-80%左右时用于转染。
44.(2)、配制lipo3000稀释液,将150ul opti-mem 150ul培养基加入ep管中,加入7ul lipo3000和7ul sirna scramble或者目标基因sirna,枪头轻轻吹打5遍,得到每孔300ul的转染复合体,使其充分混合,室温静置15min。
45.(3)、吸出完全培养基,加入1.7ml新鲜完全培养基,再加入相应的转染复合体,摇晃混匀。
46.(4)、在37℃的co2培养箱中,培养8h后更换完全培养基,48h 后可提取蛋白或细胞干预,可根据wb结果,选取最佳sirna转染浓度。
47.1.6、人主动脉瓣膜间质细胞钙定量检测
48.本实验采用检测试剂盒calciumc-testwako,参考步骤简述如下:
49.(1)、用tbs洗涤待测孔板中培养2周的细胞,再用0.6n hcl加入到12孔板中24h,收集含有钙离子hcl上清。
50.(2)、按照说明书检测钙含量,用tbs轻柔洗涤后,用含0.1%sds 的0.1n naoh溶液裂解六孔板底所剩细胞,提取总蛋白。
51.(3)、用bsa试剂盒测定蛋白质浓度,将所得钙含量比蛋白质含量作标准化。
52.1.7实时荧光定量聚合酶链式反应(real-time pcr)
53.(1)、对于组织样品,将装有研磨好的组织样品的ep管中加入适量的trizol试剂,反复振荡使其充分裂解;对于细胞样品,用预冷的pbs清洗六孔板中的细胞3次,加入1ml trizol试剂,反复吹打收集细胞至1.5mlep管中。
54.(2)、再加入200ul氯仿,震荡30秒,室温静置15min待其分层,4℃、10000rpm,离心10min。
55.(3)、吸取上层水相至无rna酶的ep管中,一般吸取0.5ml,并加入0.5ml预冷的异丙醇,上下颠倒ep管,使其充混匀于冰盒上静置15 分钟后,4℃,12000rpm,离心15min。
56.(4)、离心结束后可观察到底部的rna沉淀,小心弃去上清,并加入预冷的75%乙醇1ml,4℃,1000rpm,离心5min。
57.(5)、弃去上清,加入无水乙醇1ml,4℃,1000rpm,离心5min。
58.(6)、将沉淀置于室温风吹晾干30分钟后,用适量depc水(约20ul左右)溶解晾干后的rna样品。
59.(7)、测rna浓度:取2ul样品进行点板,以无rnase水作空白对照,用酶标仪测rna浓度及od 260/280值,od260/280值在1.8-2.0视为纯度较高,样品可于-80℃长期保存。
60.8.逆转录
61.逆转录试剂盒配制体系如下:
62.试剂成分剂量rna1ug5x hiscript iii qrt supermixadd to 20μlrnase-free ddh2oadd to 20μl
63.用基因扩增仪进行逆转录反应,37度15分钟,85度5秒,4度维持,获得cdna产物可立即用于qpcr反应或-20度保存。
64.9.qrt-pcr
65.将逆转录获得的cdna用无rna酶水稀释一定比例后,使用诺唯赞 qpcr试剂盒配置如下反应体系:
[0066][0067]
abi定量qpcr仪将混匀的反应体系按下列条件进行反应
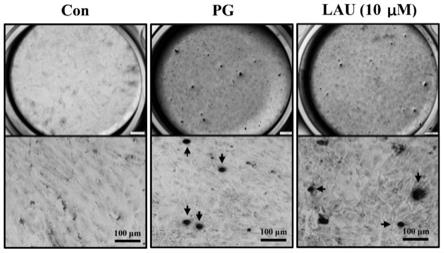
[0068]
第一步 预变性reps:195℃30s第二步 循环反应reps:4095℃10s
ꢀꢀ
60℃30s第三步 溶解曲线reps:195℃15s
ꢀꢀ
60℃60s
ꢀꢀ
95℃15s
[0069]
采用两步法pcr反应程序,计算出ct数值,以gapdh为内参,再计算出2
‑△△
ct值。设计引物如下:
[0070]
homo runx2 fggcgggtaacgatgaaaatthomo runx2 rgaggcggtcagagaacaaactahomo alp fgacaaactggggcctgagatahomo alp rctgacttccctgctttcttgghomo gapdh ftcaagaaggtggtgaagcagghomo gapdh rtcaaaggtggaggagtgggt
[0071]
2、结果
[0072]
本研究旨在研究jq1是否可以减弱人瓣膜间质细胞(hvic)的钙化,jq1 处理om诱导的hvic细胞,使用cck8分析和茜素红s染色评估hvic的增殖能力和钙化程度。qrt-pcr,western印迹和免疫荧光染色检测hvic中与钙化相关的标记基因(runx2和alp)的表达情况。
[0073]
2.1、brd4抑制剂在体外减弱om诱导的人瓣膜间质细胞(hvic)的成骨分化。
[0074]
为了观察jq1对瓣膜间质细胞的细胞毒性和找出最佳的药物浓度,将不同药物浓度mcl(0、1、5、10、20um)干预vics 24h,使用普通白光拍照、活死细胞染色和cck8检测。
[0075]
如图1所示:普通白光拍照、活死细胞染色定性,可以发现用20u mjq1 干预vics 24h后,引起少量细胞死亡,但mcl浓度达到50um后,明显引起细胞死亡,用jq1处理细胞24h、72h后,结果显示,超过50μm浓度的jq1 处理细胞时,jq1对hvic表现出明显的毒性作用,因此,10μm jq1用于后续实验。
[0076]
om诱导培养vic 21天后,茜素红s对细胞进行染色以观察细胞的钙化程度,与对照组相比,om组与om jq1组的茜素红s染色均呈阳性,且具有差异,与om组相比,jq1处理组显著减弱细胞的钙化程度,半定量统计结果显示jq1 om组比om组减。
[0077]
图1为jq1处理hvic的细胞活力和钙化水平。
[0078]
(a)不同浓度jq1干预vics 24h后细胞形态和活死细胞染色,绿色代表活细胞,红色代表死细胞(10x);
[0079]
(b)不同浓度jq1干预vics 24h、72h后cck8检测;
[0080]
(c)细胞的茜素红s染色:对照(正常培养基),om(成骨培养基),om jq1(10um),当分别与对照和om相比,***p<0.001被认为是显着差异,n=3;om组与om jq1组相比###p<0.01,n=3。
[0081]
2.2、brd4抑制剂om诱导的成骨特异性标志物的表达
[0082]
首先检测了处理hvic 24h和48h时成骨特异基因runx2和alpl 的基因表达,结果显示,与对照组相比,om显着上调了alp和runx2的表达 (*p《0.05),而jq1显著逆转om对alp和runx2的上调作用,且具有统计学意义(#p《0.05)(图2a和2b),此外,用蛋白印记实验检测了处理 48h时runx2和alp的蛋白表达水平,趋势与基因结果保持一致(图2c和 2d)。碱性磷酸酶染色进一步验证了上述结果,jq1抑制了om诱导的hvic中 alp表达的增加(图2e和2f)。
[0083]
图2为jq1对om诱导的hvic中钙相关基因/蛋白质表达的影响。
[0084]
(a和b)10μm jq1处理细胞24和48小时,qrt-pcr检测alpl,runx2的mrna表达水平,**p<0.001,***p<0.001被认为是om与对照相比具有显著差异,#p<0.05#,##p<0.01被认为是om jq1与om相比具有显著差异,n=3。
[0085]
(c)10μm jq1处理细胞48小时,蛋白印迹检测alpl,runx2的蛋白水平。
[0086]
(d、e)半定量分析,*p<0.05被认为是om与对照相比具有显著差异,#p<0.05被认为是om jq1与om相比具有显著差异,n=3。
[0087]
(f)碱性磷酸酶染色检测alpl表达水平。
[0088]
(g)半定量统计荧光强度,***p<0.001被认为是om与对照相比具有显著差异,###p<0.01被认为om jq1与om相比具有显著差异,n=3。
[0089]
2.3、上述已经验证jq1抑制剂能减轻om诱导的瓣膜间质细胞成骨样分化,因此brd4是中间的关键分子。
[0090]
为进一步确定brd4在om诱导的瓣膜间质细胞成骨样分化的作用,用小干扰rna(sirna)沉默brd4,接着分为以下五组:control、si-scramble om组、si-brd4-1 om组、si-brd4-2 om组、si-brd4-3 om组,干预48h 后,进行wb检测成骨分化相关蛋白表达情况,如图3-2a-与control组相比, si-scramble om组上调vics成骨分化蛋白runx2、alp、brd4表达,具有统计学意义;与si-scramble om组相比,si-brd4-1 om组、si-brd4-2 om 组、si-brd4-3 om组下调vics成骨分化蛋白runx2及alp、brd4表达,具有统计学差异。
[0091]
图3为沉默brd4抑制om诱导的瓣膜间质细胞成骨样分化。
[0092]
a:为五组干预vics 48h,runx2、alp、brd4蛋白条带图;
[0093]
b:a中alp表达统计图;
[0094]
c:a中runx2表达统计图;
[0095]
d:a中runx2表达统计图(*表示p《0.05,**表示p《0.01,***表示p《0.001,n=3)。
[0096]
本研究发现沉默brd4能抑制om诱导瓣膜间质细胞成骨样分化,具有一定的临床转化意义,为钙化性主动脉瓣膜病的治疗提供新的潜在靶点和思路,相关讲究国内外尚未报道。
[0097]
需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
[0098]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。