1.本发明涉及羊肚菌活性物质的制备以及其用途,具体来说,是关于以羊肚菌活性物质减缓肌肉萎缩、促进肌肉质量、肌握力及肌耐力,或制备改善肌少症的医药组合物的用途。
背景技术:
2.骨骼肌减少症,简称肌少症(sarcopenia),是指随着年龄增长,骨骼肌肉质量与力量流失并降低身体活动能力的一个现象。一般而言,肌肉在30岁以后,每年会自然流失0.5%-1%,75岁后约减少40%,到了90岁时肌肉则减少50%。在美国及部分欧洲地区的研究显示,肌少症盛行率在60-70岁的长者约为5-13%,80岁以上则约为11-50%。在中国台湾的研究则显示,65岁以上的长者肌少症盛行率约为3.9-7.3%。
3.肌肉除了运动的功能之外,同时还有免疫和内分泌等功能,因此罹患肌少症可能造成疾病发生率提高、生活质量降低、甚至死亡,然而目前却没有有效治疗肌少症的方法。
4.羊肚菌(morchella)是世界著名的大型食用真菌,其子实体的上半部表面具不规则的皱褶,形如羊肚而得名。羊肚菌味道鲜美,营养丰富,所含的营养成分,和牛乳、鱼肉相当。不仅含有丰富的蛋白质,碳水化合物外,还含有多种微量元素和19种胺基酸。该菌具有益肠胃,助消化和化痰理气的功效,可用于治疗脾胃虚弱,消化不良,痰多气短等症。
5.目前尚未有羊肚菌可用来改善肌少症,或增加肌肉质量、肌握力及肌耐力的相关研究。
技术实现要素:
6.本发明提供一种羊肚菌活性物质的制备方法,是对羊肚菌菌丝体以特定方式萃取,并发现该萃取出的活性物质具有新颖的用途。
7.根据本发明一实施例,提供一种羊肚菌活性物质的用途,其是用于制备改善肌少症的医药组合物,所述羊肚菌活性物质的制备方法包括下列步骤:
8.(a)取一羊肚菌菌丝体于平板培养基上,于15-30℃的温度下培养1-2周;
9.(b)将步骤(a)培养后的所述羊肚菌菌丝体接种至烧瓶内,于15-30℃、ph 2-6的环境培养4-7天;以及
10.(c)将步骤(b)培养后的所述羊肚菌菌丝体接种于一发酵槽内,于15-30℃、ph 2-6的环境下搅拌培养6-10天,形成含有所述羊肚菌活性物质的一羊肚菌菌丝体发酵液。
11.根据本发明另一实施例,提供一种羊肚菌活性物质的用途,其是用于增加肌肉质量、肌握力及/或肌耐力,所述羊肚菌活性物质的制备方法包括下列步骤:
12.(a)取一羊肚菌菌丝体于平板培养基上,于15-30℃的温度下培养1-2周;
13.(b)将步骤(a)培养后的所述羊肚菌菌丝体接种至烧瓶内,于15-30℃、ph 2-6的环境培养4-7天;以及
14.(c)将步骤(b)培养后的所述羊肚菌菌丝体接种于一发酵槽内,于15-30℃、ph 2-6
的环境下搅拌培养6-10天,形成含有所述羊肚菌活性物质的一羊肚菌菌丝体发酵液。
15.一实施例中,上述羊肚菌菌丝体选自美味羊肚菌(morchella esculenta)、粗柄羊肚菌(morchella crassipes)、黑脉羊肚菌(morchella angusticeps)、尖顶羊肚菌(morchella conica)、高羊肚菌(morchella elata)、小羊肚菌(morchella deliciosa)、或上述的组合。
16.一实施例中,上述羊肚菌菌丝体活性物质的制备方法还包括步骤(d):将步骤(c)的所述羊肚菌菌丝体发酵液冷冻干燥后磨粉,形成含有所述羊肚菌活性物质的一羊肚菌菌丝体冻干粉。
17.一实施例中,上述羊肚菌菌丝体活性物质的制备方法还包括步骤(e):将所述羊肚菌菌丝体冻干粉以至少一溶剂萃取,形成含有所述羊肚菌活性物质的一羊肚菌菌丝体萃取液。
18.一实施例中,上述溶剂为纯水及/或乙醇。
19.一实施例中,上述羊肚菌菌丝体活性物质的制备方法还包括步骤(f):将所述羊肚菌菌丝体萃取液干燥,以获得所述羊肚菌活性物质。
20.一实施例中,上述肌少症的症状包括肌肉萎缩、肌肉质量下降、肌握力下降及/或肌耐力下降。
21.为使本发明上述及其他方面更为清楚易懂,下文特举实施例,配合所附图式进行详细说明。
附图说明
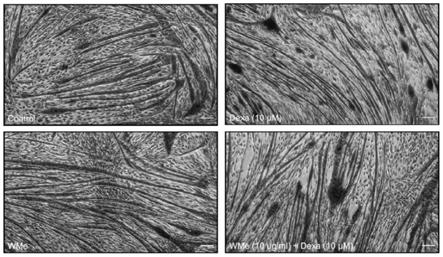
22.图1为羊肚菌菌丝体水萃物能恢复糖皮质激素-地塞米松(dexamethasone)诱导小鼠骨骼肌细胞c2c12肌肉的萎缩。
23.图2为羊肚菌菌丝体醇萃物能恢复糖皮质激素-地塞米松(dexamethasone)诱导小鼠骨骼肌细胞c2c12肌肉的萎缩。
具体实施方式
24.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
25.实施例一羊肚菌菌丝体培养
26.本实施例使用的羊肚菌是来自中国台湾财团法人食品工业发展研究所的生物资源研究中心(bcrc),羊肚菌菌种为美味羊肚菌(morchella esculenta),寄存编号为bcrc-36352。上述菌种为该研究所公开贩卖,故为公众所能够获得。不过,本发明所用的羊肚菌并不限于上述美味羊肚菌,还可选自粗柄羊肚菌(morchella crassipes)、黑脉羊肚菌(morchella angusticeps)、尖顶羊肚菌(morchella conica)、高羊肚菌(morchella elata)、小羊肚菌(morchella deliciosa)或上述菌种的组合。在其他实施例中,亦可选用其他种类的羊肚菌,本发明并不对此限制。
27.(1)平板培养:将羊肚菌菌丝体接种于平板上,于15-30℃下培养1-2周(本实施例中,是于25℃下培养7天)。平板培养基的成分可包含马铃薯糊精培养基(potato dextrose agar,pda)、碳源及氮源,并无特别限制。
28.(2)烧瓶培养:刮取平板培养完成后的菌丝体接种于烧瓶中,并以15-30℃、ph 2-6及转速110-150rpm的条件震荡培养4-7天(本实施例中,于25℃、ph 5、转速120rpm之下震荡培养7天)。此震荡培养是以下表1所示的培养基进行培养。
29.表1培养基配方
30.成分本实施例使用含量(重量%)较佳含量范围(重量%)综合性碳氮源21-3醣类21-4酵母抽出物0.30.1-1蛋白胨0.30.1-1无机盐类0.10.01-0.5
31.上述培养基配方中,综合性碳氮源可选自谷类(如:麦粉)或豆类(如:黄豆粉、绿豆粉、大豆粉、肉桂粉等);醣类可为葡萄糖、果糖、麦芽糖、蔗糖等;无机盐类可为硫酸镁、磷酸氢二钾、磷酸二氢钾、硫酸铁等。特别说明的是,表1培养基配方仅为其中一种范例,使用时成分可依需求调整,或搭配市售培养基使用,并无特别限制。
32.(3)发酵槽培养:将(2)中烧瓶培养的菌丝体接种于发酵槽内,以15-30℃、槽压0.5-1.0kg/cm2、ph 2-6及搅拌速度50-150rpm条件下,以0.1-1.5vvm的通气速率培养6-10天,形成一羊肚菌菌丝体发酵液(本实施例中,是在25℃、槽压0.5kg/cm2、ph 5,搅拌速度80rpm及1.0vvm(空气)的条件下,培养14天),即得羊肚菌菌丝体发酵液。发酵槽培养使用的培养基可与步骤(2)烧瓶培养使用的培养基相同。此羊肚菌菌丝体发酵液内即含本发明的羊肚菌菌丝体活性物质。羊肚菌菌丝体发酵液可进一步通过冷冻干燥步骤制备为羊肚菌菌丝体发酵液冻干粉。于本实施例中,100l的羊肚菌菌丝体发酵液可制得约3kg冻干粉。
33.(4)萃取物制备:使用纯水或醇类作为溶剂,对(3)的冻干粉进行萃取。
34.水萃物:先取羊肚菌菌丝体发酵液冻干粉200g,加入20倍体积蒸馏水溶解,以温度100℃加热30分钟,待冷却后经冷冻干燥法进行干燥,得羊肚菌菌丝体水萃物。
35.醇萃物:将羊肚菌菌丝体发酵液冻干粉200g加入20倍重量的乙醇,以超声震荡1小时,离心后取上清液,将上清液经减压浓缩得羊肚菌菌丝体发酵液醇萃物。
36.经由萃取步骤,可取得含较高浓度的羊肚菌活性物质。羊肚菌活性物质的态样包含羊肚菌菌丝体发酵液(菌丝体与澄清液/上清液)、发酵液冻干粉、水萃物、醇萃物、水萃物及醇萃物的混合物、水萃物或醇萃物冻干粉或其他剂型。以下实施例二中,是以水及醇萃物作为羊肚菌活性物质态样来进行肌肉萎缩现象的改善实验;实施例三中,则将水萃取物及乙醇萃取物充分混合以获得“萃取混合物”,作为喂食试验的羊肚菌活性物质。一实施例中,水萃取物及乙醇萃取物的混合比例为重量比1:1。
37.实施例二羊肚菌活性物质(水萃物及醇萃物)改善肌肉萎缩现象
38.目前已有实验利用地塞米松(dexamethasone)诱导小鼠骨骼肌细胞c2c12肌肉萎缩模式。可参照chen-yuan chiu,rong-sen yang,meei-ling sheu,ding-cheng chan,ting-hua yang,keh-sung tsai,chih-kang chiang,shing-hwa liu(2016),advanced glycation end-products induce skeletal muscle atrophy and dysfunction in diabetic mice via a rage-mediated,ampk-down-regulated,j pathol,2016feb;238(3):470-82此篇论文,其利用人工合成的糖皮质激素-地塞米松(dexamethasone)使已分化
的c2c12萎缩,建立肌肉萎缩的模式,透过观察细胞型态及检测肌肉束直径大小,作为肌肉萎缩严重程度的依据。本实验依此方法,以已分化的小鼠骨骼肌肉细胞c2c12对地塞米松进行h&e(hematoxylin and eosin)染色,评估羊肚菌菌丝体活性物质对肌肉萎缩现象的改善结果,实验方法如下:
39.(1)收集小鼠骨骼肌肉细胞c2c12细胞,调整细胞悬浮液浓度,以1
×
105–2×
105细胞密度植种于6孔盘内,给予细胞生长培养基(dmem,10%fetal bovine serum);
40.(2)将(1)的6孔盘置于37℃、5%co2培养箱培养两天后,在显微镜下观察,当细胞长至70%满,即可加入分化培养基(dmem,2%horse serum)进行诱导,每两天更换一次新鲜分化培养基,分化过程共七天。
41.(3)在细胞分化第七天,约90%的细胞形成肌管后,加入1μm地塞米松及实施例一所获得的单一剂量的羊肚菌菌丝体水萃物(10μg/ml)或醇萃物(1μg/ml)。将羊肚菌菌丝体萃取物溶解于二甲基亚石枫(dimethyl sulfoxide,dmso)中,检测时dmso的浓度不超过0.1%以避免其毒性影响细胞生长;对照组处理0.1%dmso,单一浓度进行3重复,结果置于37℃、5%co2培养箱培养24小时,并进行后续检测实验;
42.(4)当肌管发生萎缩,其宽度会明显减少。利用倒立式显微镜,以40x放大的视野下,每一重复取60个细胞,使用image-pro plus software计算其肌管宽度可判断肌肉萎缩的程度。
43.(5)各试验3重复,数值以平均值mean
±
sd(standard deviation)表示。统计方式使用成对t检定(paired t test)分析各项百分比,以p值小于0.05判定为显著差异。
44.(6)羊肚菌菌丝体水萃物(wme)的实验结果如图1及下表2所示。图片中为深红色处为肌管,经过地塞米松处理后的c2c12肌管(右上),相较于没有发生萎缩现象的对照组(control,左上)组别,其肌管直径明显缩小(30.39μm
→
19.98μm),证明此模式确实会造成肌肉萎缩。而加入羊肚菌菌丝体水萃物可显著恢复肌肉直径(右下,19.98μm
→
29.37μm)。不过,单纯以羊肚菌菌丝体水萃物处理(左下)对肌肉质量并无显著影响。
45.表2羊肚菌菌丝体水萃物测试结果
46.组别肌管直径(μm)对照组(control)30.39
±
4.52地塞米松(dex)19.98
±
6.42#dex wme29.37
±
7.36*wme30.90
±
5.92*
47.(n=60)
48.#表示与对照组(control)统计上具显著差异(p《0.05)
49.*表示与负对照组(dex)统计上具显著差异(p《0.05)
50.(7)羊肚菌菌丝体醇萃物(乙醇,eme)的实验结果如图2及下表3所示。经过地塞米松处理后的c2c12肌管(右上),相较于没有发生萎缩现象的对照组(control,左上)组别,其肌管直径明显缩小。而加入羊肚菌醇萃物的组别可显著恢复肌肉直径(19.98
→
30.70,右下)。单纯以羊肚菌菌丝体醇萃物处理对肌肉质量亦无显著影响(左下)。
51.表3羊肚菌菌丝体醇萃物测试结果
52.组别肌管直径(μm)
对照组(control)30.39
±
4.52地塞米松(dex)19.98
±
6.42#dex eme30.70
±
6.24*eme28.80
±
6.34*
53.(n=60)
54.#表示与对照组(control)统计上具显著差异(p《0.05)
55.*表示与负对照组(dex)统计上具显著差异(p《0.05)
56.上述实验证实本发明羊肚菌活性物质具有改善肌肉萎缩的作用。其可与药学上可接受的载剂、赋形剂、稀释剂或辅剂结合,制备医药组合物,亦可作为食品添加剂之用。
57.实施例三羊肚菌活性物质(水/醇萃取混合物)增加肌肉质量、肌握力及肌耐力
58.目前已有实验以cast immobilization(im,利用固定式机械机构固定小鼠后肢,使其萎缩)方式诱导小鼠骨骼肌肉萎缩,可参照peter bialek,carl morris,jascha parkington,michael st.andre,jane owens,paul yaworsky,howard seeherman,and scott a.jelinsky,distinct protein degradation profiles are induced by different disuse models of skeletal muscle atrophy,physiological genomics,2011oct;43(19):1075-1086此篇论文。本实验中亦采相同方式,以cast immobilization(im)方式诱导小鼠骨骼肌肉萎缩,待im诱导达7天后,卸除im,先测定肌握力测试,再测定肌耐力测试以定速18-20m/min直至30min(根据电击次数)。试验结束再进行牺牲,取其后肢骨骼肌肉并称重记录,评估羊肚菌菌丝体萃取混合物对增加肌肉质量、肌握力及肌耐力的结果。
59.(1)利用c57bl/6j小鼠进行动物实验,分为对照组(sham group)、im组、羊肚菌菌丝体萃取混合物组,每组小鼠各6只。对照组及im组小鼠喂食等体积的二次纯水(ddh2o),试验物质喂食剂量(即羊肚菌菌丝体的水/醇萃取混合物)浓度为500mg/kg,试验物质采用胃管经口喂食,其使用体积10ml/kg b.w./次,试验物质于投药前现配,每日喂食后持续观察,记录体重、摄食与饮水重量。
60.(2)小鼠经cast immobilization(im)方式进行诱导肌少症病症并同时给予羊肚菌菌丝体水/醇萃取混合物达第14天,进行小鼠肌握力及肌耐力测试(根据电击次数)。试验结束再进行牺牲,取其后肢骨骼肌肉并称重记录。
61.试验结果均以mean
±
sd表示,并使用graphpad prism(version 8.0)进行实验数据统计分析。统计方法以单因子变异数分析(one-way anova)及dunnett's test事后检定(post-hoc)分析判定组间差异。若统计结果p值小于0.05(p《0.05)时,则判定两组间具有显著差异。
62.小鼠肌握力实验结果如下表4所示。肌握力试验是测量小鼠的最大抓握力,数值越高越佳。在第14天,im组较sham组的肌握力减少,而羊肚菌菌丝体水/醇萃取混合物组较im组的肌握力显著提升。
63.表4羊肚菌菌丝体萃取混合物肌握力测试结果
64.组别肌握力(force)对照组(sham)154.38
±
21.28cast immobilization(im)106.67
±
22.79#
im 羊肚菌菌丝体水/醇萃取混合物118.43
±
24.94*
65.小鼠肌耐力实验结果如下表5所示,电击次数越多耐力越差。在第14天,经im处理过的负对照组肌耐力显著下降,电击次数较高(3.00
→
500.83)。使用羊肚菌菌丝体水/醇萃取混合物组较im组的电击次数显著下降(500.83
→
78.50)。
66.表5羊肚菌菌丝体萃取混合物肌耐力(电击次数)测试结果
67.组别肌耐力(电击次数)对照组(sham)3.00
±
2.28cast immobilization(im)500.83
±
257.37#im 羊肚菌菌丝体萃取混合物78.50
±
135.18*
68.(n=6)
69.#表示与对照组(sham)统计上具显著差异(p《0.05)
70.*表示与负对照组(im)统计上具显著差异(p《0.05)
71.牺牲小鼠取其后肢骨骼肌肉后,测量重量结果如下表6所示,im的腓肠肌(gastrocnemius muscle)重量较对照组(sham组)皆降低,而羊肚菌菌丝体水/醇萃取混合物组较im组的腓肠肌重量具有增加趋势。由此可证,本发明的羊肚菌菌丝体水/醇萃取混合物能够增加肌肉重量。
72.表6羊肚菌菌丝体萃取混合物腓肠肌重量测试结果
73.组别腓肠肌重量(mg/g bw)对照组(sham)5.485
±
0.234cast immobilization(im)4.895
±
0.384#im 羊肚菌菌丝体萃取混合物5.124
±
0.385*
74.(n=6)
75.#表示与对照组(sham)统计上具显著差异(p《0.05)
76.*表示与负对照组(im)统计上具显著差异(p《0.05)
77.实施例四组合物制备
78.上述实验证实本发明的羊肚菌活性物质(水/醇萃取混合物)具有增加肌肉质量、肌握力及肌耐力的作用,而开发出羊肚菌于医药领域中的另一新颖用途。据此,为使羊肚菌的活性物质得以具体应用,制造一种包含羊肚菌的活性物质的组合物,并以一有效量施予一个体来达到治愈效果。
79.上述“有效量”是指一使用量,其足以使上述改善肌少症及/或增加肌肉质量、肌握力及/或肌耐力的效果产生。基于活体外细胞培养实验,上述有效量定义为“μg/ml”,其是基于每一个培养中所用的细胞培养液的总体积。基于动物模型实验,上述有效量定义为“g/60kg body weight/day”。此外,经由活体外细胞培养实验所得到的有效量数据可经下列计算公式而转换为一合理的供动物使用的有效量:
80.一般来说(reagan-shaw et al.,2008),1“μg/ml”单位(基于活体外细胞培养实验所得的有效量)可等同于1“mg/kg body weight/day”单位(基于老鼠模型实验所得的有效量),并且,基于已知老鼠的新陈代谢率是人类的六倍,可进一步求得人类的有效剂量。
81.因此,若基于活体外细胞培养实验求得有效量为500μg/ml,则于老鼠中使用的有效量可计为500mg/kg body weight/day(即,0.5g/kg body weight/day)。进一步地,参酌
上述新陈代谢率的差异,供人类使用的有效量则可计为5g/60kg body weight/day。
82.根据上述段落中所记载的试验结果,基于小鼠实验经验证的有效量为500mg/kg body weight/day,因此供人类使用的合理的有效剂量应为2.4g/60kg body weight/day。
83.一实施例中,组合物中所含的羊肚菌的活性物质的有效量为500mg/60kg-10g/60kg body weight/day。
84.该组合物进一步包含添加剂。在一较佳的实施态样中,该添加剂可为赋型剂、防腐剂、稀释剂、填充剂、吸收促进剂、甜味剂、或其组合。该赋型剂可选自柠檬酸钠、碳酸钙、磷酸钙或其组合。该防腐剂可延长医药组合物的储藏期限,例如苯甲醇、对羟基苯甲酸(parabens)。稀释剂可选自水、乙醇、丙二醇、甘油或其组合。填充剂可选自乳糖、牛乳糖、高分子量举乙二醇或其组合。吸收促进剂可选自二甲基亚砜(dmso)、月桂氮卓酮、丙二醇、甘油、聚乙二醇或其组合。甜味剂可选自安塞甜(acesulfame k)、阿斯巴甜(aspartame)、糖精(saccharin)、三氯蔗糖/蔗糖素(sucralose)、纽甜(neotame)或其组合。除上述所列举的添加剂以外,在不影响羊肚菌的活性物质的医药效果前提下,可依需求选用适合的其他添加剂。
85.该组合物于医药领域中可开发为不同商品。在一较佳实施态样中,该组合物为一药品、饲料、饮料、营养补充品、乳制品、食品或保健食品。
86.该组合物可根据受施予者的需要,而采用不同形态。在一较佳实施态样中,该组合物的形态为粉剂、锭剂、造粒、栓剂、微胶囊、安瓶(ampoule/ampule)、液剂喷剂或塞剂。
87.本发明的组合物可使用于动物或是人类。在不影响羊肚菌的活性物质发挥效果的前提下,包含羊肚菌的活性物质的组合物可制为任何药物型态,并根据药物型态以适用的途径施予该动物或人类。
88.组合物1:取水萃取物(20wt%)作为羊肚菌活性物质,与作为防腐剂的苯甲醇(8wt%)、作为稀释剂的甘油(7wt%)充分混合,并溶于纯水(65wt%)中,以制得液体剂型的本发明的医药组合物,上述wt%是指各成分占组合物总重的比例。存放于4℃备用。
89.组合物2:取乙醇萃取物(15wt%)作为羊肚菌活性物质,与作为防腐剂的苯甲醇(5wt%)、作为稀释剂的甘油(10wt%)充分混合,并溶于纯水(70wt%)中,以制得液体剂型的本发明的医药组合物,上述wt%是指各成分占组合物总重的比例。存放于4℃备用。
90.虽然本发明已用实施例提供如上,然其并非用以限制本发明。本领域的通常知识者,于参酌以上教示后,当能对上述实施例的内容进行适当修改,而仍然能达到本发明所主张的功效。因此,本发明的保护范围应以其权利要求范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
