1.本发明属于医药领域,具体涉及黄书葵花提取物在改善和/或调节与糖尿病肾病相关的肠道微生物中的应用。
背景技术:
2.肠道菌群对人体有着非常重要的作用,它被视为人体又一“隐藏的器官”,携带着人体“第二基因”,因此人体也被形容成一个“超级生物体”。一个成年人的肠道内大概有10
14
个细菌,约占自身细胞的10倍,重量近乎肝脏的重量。人体基因组大致有2.3万个基因,而肠道菌群基因组大概有3.3百万个基因,是人体基因组的150倍。胃肠道中不同部位生理状况不同导致细菌的组成也有一定差异,大肠尤其结肠部位最适宜微生物生存,微生物系统密度最高,活菌数量多达10
12-10
14
。研究表明,人体的健康不仅与自身的基因组有关,还与肠道内环境微生物有密不可分的联系,肠道菌群通过与宿主间的相互作用调控肠道稳态,各种原因导致的肠道稳态失衡将会影响人体的健康,导致各种疾病的产生。
3.近年来,肾-肠轴在慢性肾病(chronic kidney disease,ckd)与肠道菌群的相关机制研究中备受关注。肠道菌群的主要生理功能包括:(1)营养作用,菌群可以将宿主摄入的营养物质代谢为利于宿主吸收的物质;(2)生物拮抗作用,有益微生物能够抑制致病菌的生长繁殖并能防止其对肠道上皮细胞粘附和破坏;(3)代谢作用,有益微生物的代谢产物短链脂肪酸能够抑制致病菌的生长,刺激肠上皮细胞增殖和肾保护作用等。但是某些因素,如环境、饮食、病毒感染、使用抗生素及年龄增加都能造成肠道菌群紊乱。研究证实肠道菌群失调与肥胖、心血管疾病、糖尿病、炎症性肠炎、多发性硬化、过敏性疾病等许多疾病有关,多项研究表明肠道菌群失调与糖尿病及糖尿病肾病的发生有关,紊乱的菌群可能通过破坏肠道上皮细胞屏障,导致肠道通透性增加,致病菌易位和内毒素积聚等引发机体炎症反应,也可能通过影响脂质代谢和短链脂肪代谢等加速糖尿病肾病进程。另外也有研究表明糖尿病患者肾脏损伤不能排泄代谢废物使得其进入肠道,肠道中利用代谢废物的有害菌群大量增殖,导致菌群失调,同时菌群产生的有毒代谢产物如氨,硫酸吲哚酚也与肾脏损害和糖尿病进展有关。某些有毒代谢物还能够损伤肠粘膜破坏肠上皮屏障,使得有毒代谢产物转移到血液中,促进全身炎性反应加速糖尿病肾病的进程。因此,肠道菌群失调与糖尿病肾病存在紧密的关系。
4.黄蜀葵花为锦葵科秋葵属植物黄蜀葵abelmoschusmanihot(l.)medic的干燥花,其性味甘、寒、滑,无毒,具有清热利湿、消炎解毒之功效,内服主治五淋、水肿,外用治疗痈疽肿毒,汤水烫伤。现代药理学研究其总黄酮提取物具有抗炎、保护心脑缺血损伤和心脑缺氧损伤作用,临床用于治疗慢性肾炎、糖尿病肾病、口腔溃疡和烧伤等。cn103610712b公开了一种黄书葵花提取物在制备防治炎性肠病药物中的应用,cn1994337b公开了一种黄蜀葵花总提取物用于制备治疗肾炎药物,cn109481480a公开了一种黄蜀葵花提取物在制备防治抗生素滥用引发的肠道菌群失调药物中的应用,但其仅公开了黄蜀葵花提取物对抗生素滥用引起的肠道菌群的失调的影响情况:其中门水平上,抗生素处理导致firmicutes菌门相
对丰度降低,而黄蜀葵花提取物治疗后firmicutes菌门相对丰度升高;抗生素处理导致bacteroidetes菌门相对丰度升高,而黄蜀葵花提取物治疗后bacteroidetes菌门相对丰度降低;属水平上,抗生素处理导致alistipes、lachnospiraceae菌属相对丰度降低,黄蜀葵花提取物治疗后alistipes、lachnospiraceae菌属的相对丰度均回复至正常水平;抗生素处理组bacteroides相对丰度升高,黄蜀葵花提取物治疗后降低至正常水平。而黄蜀葵花提取物对于与糖尿病肾病相关的肠道微生物种类的影响情况还未见有报道。
技术实现要素:
5.针对上述不足,本发明通过研究黄蜀葵花提取物对于与糖尿病肾病相关的肠道微生物的影响,开发出黄蜀葵法提取物在制备改善和/或调节与糖尿病肾病相关的肠道微生物的药物中的新用途。
6.本技术的技术方案如下:
7.一方面,本发明提供了一种黄蜀葵花提取物在制备调节肠道微生物的药物中的应用。
8.具体地,所述的黄蜀葵花提取物含有以重量计为0.2%以上的槲皮素-3-o-刺槐糖苷、0.5%以上的异槲皮苷和0.5%以上的槲皮素-3
’-
o-β-d-葡萄糖苷中的至少一种。
9.进一步地,所述的黄蜀葵花提取物含有以重量计为0.2-1.2%的槲皮素-3-o-刺槐糖苷、0.5-2.0%的异槲皮苷和0.5-2.0%的槲皮素-3
’-
o-β-d-葡萄糖苷中的至少一种。
10.更进一步地,所述的黄蜀葵花提取物含有以重量计为0.4-0.8%的槲皮素-3-o-刺槐糖苷、0.8-1.6%的异槲皮苷和0.8-1.6%的槲皮素-3
’-
o-β-d-葡萄糖苷中的至少一种。
11.具体地,所述的调节肠道微生物选自:
12.拟杆菌门bacteroidetes、变形菌门proteobacteria、厚壁菌门firmicutes、疣微菌门verrucomicrobia、绿弯菌门chloroflexi、放线菌门actinobacteria、patescibacteria、tenericutes中的一种或多种;
13.或选自:丛毛单胞菌科curvibacter、普雷沃氏菌科ucg-001prevotellaceaeucg-001、毛螺菌科lachnospiraceae_uncultured中的一种或多种;
14.或选自:不动杆菌属acinetobacter、慢生根瘤菌属bradyrhizobium、别样杆菌属alistipes、拟杆菌属bacteroides、肠杆菌属enterorhabdus、单胞菌属aeromonas、普氏菌属9prevotella 9、鞘脂菌属sphingobium、链球菌属streptococcus、普氏菌属2prevotella 2、粪杆菌属faecalibacterium、沉积物杆状菌属sediminibacterium、叶杆菌属phyllobacterium、鞘氨醇单胞菌属sphingomonas、脱硫弧菌属desulfovibrio、丁酸弧菌属anaerostipes、气单胞菌属aeromonas、假单胞菌属pseudomonas、muribaculaceae_norank、gastranaerophilales_norank、假单胞菌属pseudomonas、甲基杆菌属methylobacterium、库特氏菌属kurthia、沙雷氏菌属serratia、巨单胞菌属megamonas、丛毛单胞菌属comamonas、乳酸菌属lactobacillus、罗尔斯通菌属ralstonia、嗜胆菌属bilophila、allorhizobium-neorhizobium-pararhizobium-rhizobium、瘤胃梭菌属9ruminiclostridium 9、乳杆菌属lactobaclllus、另枝菌属alistipes、杆菌属geobacillus、lachnospiraceaenk4a136 group、turicibacter、芽孢杆菌属bacillus、艾克曼菌属akkermansia、叶杆菌属phyllobacterium、嗜木聚糖真杆菌属[eubacterium]
xylanophilum group、瘤胃梭菌属5 ruminiclosteidium5、candidatussaccharimonas、gca-900066225中的一种或多种。
[0015]
进一步地,所述的调节肠道微生物选自:
[0016]
拟杆菌门bacteroidetes、厚壁菌门firmicutes、疣微菌门verrucomicrobia、放线菌门actinobacteria、绿弯菌门chloroflexi、变形菌门proteobacteria、patescibacteria、tenericutes中的一种或多种;
[0017]
或选自:普雷沃氏菌科ucg-001prevotellaceae ucg-001、丛毛单胞菌科curvibacter、毛螺菌科lachnospiraceae_uncultured中的一种或多种;
[0018]
或选自:脱硫弧菌属desulfovibrio、muribaculaceae_norank、不动杆菌属acinetobacter、叶杆菌属phyllobacterium、鞘氨醇单胞菌属sphingomonas、链球菌属streptococcus、allorhizobium-neorhizobium-pararhizobium-rhizobium、艾克曼菌属akkermansia、另枝菌属alistipes、杆菌属geobacillus、肠杆菌属enterorhabdus、拟杆菌属bacteroides、gastranaerophilales_norank、嗜木聚糖真杆菌属[eubacterium]xylanophilum group、瘤胃梭菌属9ruminiclostridium 9、lachnospiraceae nk4a136 group、乳杆菌属lactobaclllus、turicibacter、瘤胃梭菌属5 ruminiclosteidium5、气单胞菌属aeromonas、慢生根瘤菌属bradyrhizobium、假单胞菌属pseudomonas、candidatussaccharimonas、gca-900066225中的一种或多种。
[0019]
另一方面,本发明提供了一种黄蜀葵花提取物在制备调节糖尿病性肾病患者的肠道微生物的药物中的应用。
[0020]
又一方面,本发明提供了一种黄蜀葵花提取物在制备治疗糖尿病性肾病的药物中的应用。
[0021]
又一方面,本发明提供了一种植物提取物在制备调节与糖尿病性肾病有关的肠道微生物的药物中的应用。
[0022]
具体地,所述的植物提取物含有以重量计为0.2%以上的槲皮素-3-o-刺槐糖苷、0.5%以上的异槲皮苷和0.5%以上的槲皮素-3
′-
o-β-d-葡萄糖苷中的至少一种。
[0023]
进一步地,所述的植物提取物含有以重量计为0.2-1.2%的槲皮素-3-o-刺槐糖苷、0.5-2.0%的异槲皮苷和0.5-2.0%的槲皮素-3
′-
o-β-d-葡萄糖苷中的至少一种。
[0024]
更进一步地,所述的植物提取物含有以重量计为0.4-0.8%的槲皮素-3-o-刺槐糖苷、0.8-1.6%的异槲皮苷和0.8-1.6%的槲皮素-3
′-
o-β-d-葡萄糖苷中的至少一种。
[0025]
具体地,所述的植物提取物提取自木槿属植物和/或锦葵科植物。
[0026]
进一步地,所述的植物为黄葵、黄蜀葵、金花葵、葡萄叶木槿、羊角豆、磨盘草中的一种或多种,优选为所属植物的全株、花冠、根、茎、叶和果实中的一种或多种;优选为所属植物的花冠。
[0027]
更进一步地,所述的植物提取物为黄蜀葵花提取物。
[0028]
具体地,所述的植物提取物为溶剂提取物,优选为乙醇提取物,所述乙醇可以为无水乙醇,也可以为含水乙醇,优选为50-100%乙醇回流的提取物,进一步优选为80-100%乙醇回流提取的提取物。
[0029]
具体地,所述的黄蜀葵花提取物的制备包括如下步骤:黄蜀葵花用乙醇加热提取,提取液经浓缩、调节ph、静置后,浓缩,真空干燥,得黄蜀葵花提取物。
[0030]
优选为取黄蜀葵花,加15-20倍量80-100%的乙醇,加热提取1-3次,每次0.5-2h,过滤,合并滤液回收乙醇,浓缩滤液至比重1.10-1.35,调节ph至5.6-6.4,0-10℃静置24-60小时,除去上层的油层后,浓缩,真空干燥,得黄蜀葵花提取物。
[0031]
进一步优选为取黄蜀葵花,加16-19倍量95-100%的乙醇,在温度高于80℃下提取1-2次,每次1h,过滤,合并滤液回收乙醇,浓缩滤液至比重1.15-1.30,调节ph至5.8-6.2,0-5℃静置30-52小时,除去上层的油层后,浓缩,真空干燥,得黄蜀葵花提取物。
[0032]
进一步优选为取黄蜀葵花,加18倍量95-100%的乙醇,回流提取1次,每次1h,过滤,合并滤液回收乙醇,浓缩滤液至比重1.18-1.22,调节ph至6.0,0-5℃静置34-48小时,除去上层的油层后,浓缩,真空干燥,得黄蜀葵花提取物。
[0033]
具体地,所述的干燥方式为薄层快速干燥或真空干燥,优选真空干燥。
[0034]
又一方面,本发明提供了所述的植物提取物在制备调节肠道微生物的药物中的用途。
[0035]
又一方面,本发明提供了所述的植物提取物在制备调节糖尿病性肾病患者的肠道微生物的药物中的用途。
[0036]
又一方面,本发明提供了所述的植物提取物在制备治疗糖尿病性肾病的药物中的用途。
[0037]
具体地,所述的植物提取物给予患者的给药剂量为4-400mg/kg,优选为8-200mg/kg,优选为14-160mg/kg,优选为16-80mg/kg。
[0038]
具体地,所述的植物提取物给予患者的给药频次为一日一次至三次。
[0039]
具体地,所述的植物提取物给予患者的给药频次为一日三次,每次30mg/kg。
[0040]
又一方面,本发明提供了一种中药组合物在改善和/或调节与糖尿病肾病相关的肠道微生物的应用。
[0041]
具体地,所述的中药组合物包括所述的植物提取物。
[0042]
具体地,所述的中药组合物还包括药学上可接受的佐剂,所述的佐剂包括但不限于:稀释剂、赋形剂、填充剂、润湿剂、崩解剂、矫味剂和粘合剂。
[0043]
具体地,所述的中药组合物可制备成颗粒剂、片剂、胶囊剂或口服液制剂。
[0044]
与现有技术相比,本发明的积极和有益效果在于:
[0045]
(1)本发明提供的黄蜀葵花提取物能够有效降低糖尿病小鼠餐后血糖、饮水、食量、尿量、24h尿微量白蛋白排泄率、及肾体比等与糖尿病肾病有关的生化指标,为慢性肾病和糖尿病肾病等疾病的治疗和预防提供了新的思路。
[0046]
(2)本发明开拓性地提供了黄蜀葵花提取物在改善和/或调节与糖尿病肾病相关的肠道微生物的应用。对于糖尿病肾病,黄蜀葵花提取物剂量给药后能够不同程度地升高小肠十二指肠、回肠、结肠中不同的有益菌的相对丰度,降低能够导致炎症反应或破坏肠道屏障的有害菌的相对丰度,有效改善和/或调节肠道菌群,进而通过肠道菌群的作用有效预防或治疗慢性肾病和糖尿病肾病等疾病。
[0047]
(3)拓展了黄蜀葵花提取物的用途。
附图说明
[0048]
图1为餐后血糖检测结果。其中,1a为高剂量给药后餐后血糖检测结果,1b为低剂
量给药后餐后血糖检测结果。
[0049]
图2为高剂量给药后饮水、食量、尿量检测结果。其中,2a为高剂量给药后饮水检测结果,2b为高剂量给药后食量检测结果,2c为高剂量给药后尿量检测结果。
[0050]
图3为低剂量给药后饮水、食量、尿量检测结果。其中,3a为低剂量给药后饮水检测结果,3b为低剂量给药后食量检测结果,3c为低剂量给药后尿量检测结果。
[0051]
图4为24h尿微量白蛋白排泄率检测结果。其中,4a为高剂量给药后24h尿微量白蛋白排泄率检测结果,4b为低剂量给药后24h尿微量白蛋白排泄率检测结果。
[0052]
图5为肾脏重量与体重比(肾体比)检测结果。其中,5a为高剂量给药后肾脏重量与体重比(肾体比)检测结果,5b为高剂量给药后肾脏重量与体重比(肾体比)检测结果。
[0053]
图6为低剂量给药后小肠a段(十二指肠)在门水平上分析差异图。
[0054]
图7为低剂量给药后小肠a段(十二指肠)在属水平上分析差异图。
[0055]
图8为低剂量给药后小肠b段(回肠)在门水平上分析差异图。
[0056]
图9为低剂量给药后小肠b段(回肠)在属水平上分析差异图。
[0057]
图10为低剂量给药后小肠c段(结肠)在门水平上分析差异图。
[0058]
图11为低剂量给药后小肠c段(结肠)在属水平上分析差异图。
[0059]
图12为高剂量给药后小肠a段(十二指肠)在门水平上分析差异图。
[0060]
图13为高剂量给药后小肠a段(十二指肠)在属水平上分析差异图。
[0061]
图14为高剂量给药后小肠b段(回肠)在门水平上分析差异图。
[0062]
图15为高剂量给药后小肠b段(回肠)在属水平上分析差异图。
[0063]
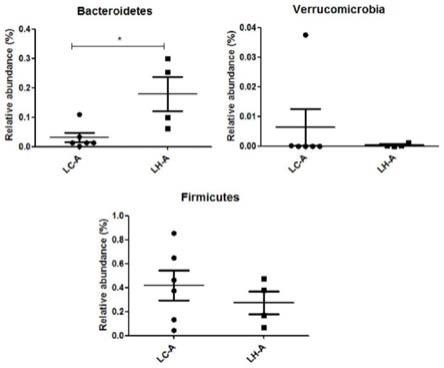
图16为高剂量给药后小肠c段(结肠)在门水平上的分析差异图。
[0064]
图17为高剂量给药后小肠c段(结肠)在属水平上的分析差异图。
具体实施方式
[0065]
下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0066]
本发明实施例中涉及的化合物的结构为:
[0067]
槲皮素-3-o-刺槐糖苷:
[0068][0069]
异槲皮苷:
[0070][0071]
槲皮素-3
′-
o-β-d-葡萄糖苷:
[0072][0073]
实施例1黄蜀葵花提取物的制备
[0074]
取黄蜀葵花的花冠2000g,加18倍量的无水乙醇,加热回流1小时,滤过,滤液减压回收乙醇,浓缩,浓缩滤液至比重1.20,调节ph至6.0,在0-5℃静置48小时,除去上层的油层,浓缩后缓慢加入真空带式干燥机内,100℃下干燥,粉碎,装入洁净双层塑料袋中,即得黄蜀葵花提取物。其中,含有槲皮素-3-o-刺槐糖苷(6.0mg/g),异槲皮苷(12.1mg/g),槲皮素-3
′-
o-β-d-葡萄糖苷(12.7mg/g)。
[0075]
实施例2黄蜀葵花提取物的制备
[0076]
取药材黄蜀葵花3000g,黄蜀葵花用19倍95%的乙醇,回流提取2次,每次1小时,过滤,合并滤液回收乙醇,浓缩滤液至比重1.18-1.28,调ph值5.8-6.2,浓缩液在0-5℃静置40-48小时,去除冷藏液的油层,浓缩后缓慢加入真空带式干燥机内,80-100℃下干燥,粉碎,装入洁净双层塑料袋中,即得黄蜀葵花提取物。其中,该黄蜀葵花提取物含有槲皮素-3-o-刺槐糖苷(5.6mg/g),异槲皮苷(10.1mg/g),槲皮素-3
′-
o-β-d-葡萄糖苷(13.8mg/g)。
[0077]
实验例
[0078]
1实验材料
[0079]
1.1实验动物
[0080]
100只雌性nod/ltj小鼠(11-12周龄),购于北京华阜康生物科技股份有限公司,许可证号:scxk(京)2014-0004。在中国药科大学药学动物实验中心的spf环境中饲养,给与充足的无菌饮水和无菌普通饲料,并保持12h光照和12h黑夜交替。
[0081]
1.2药品
[0082]
实施例1的黄蜀葵花提取物。
[0083]
2实验方法
[0084]
2.1实验分组及给药
[0085]
nod小鼠饲养一周适应新环境后,所有小鼠每周测一次餐后血糖和体重,若连续两
天血糖》11.1mmol/l,则为糖尿病建模成功。根据血糖水平和体重相似的原则,将22周龄后发病的nod小鼠分为(1)低剂量黄蜀葵花提取物给药组lh、(2)发病低剂量对照组lc、(3)高剂量黄蜀葵花提取物给药组hh、(4)发病高剂量对照组hc、(5)未发病ln组。每组给药方式如下:
[0086]
(1)低剂量黄蜀葵花提取物给药组lh:给药为黄蜀葵花提取物,给药剂量为1.08g黄蜀葵花提取物/kg体重/天,连续给药4-5周,给药方式为灌胃;
[0087]
(2)发病低剂量对照组lc:超纯水灌胃;
[0088]
(3)高剂量黄蜀葵花提取物给药组hh:给药为黄蜀葵花提取物,给药剂量为2.4g黄蜀葵花提取物/kg体重/天,给药方式为:灌胃;
[0089]
(4)发病高剂量对照组hc:超纯水灌胃;
[0090]
(5)未发病ln组:超纯水灌胃。
[0091]
2.2生化指标的测定
[0092]
2.2.1餐后血糖测定
[0093]
给药前及给药后每周测一次餐后血糖和体重,采取尾静脉取血,使用血糖仪和血糖试纸,按说明书操作测定餐后血糖。
[0094]
2.2.2饮水、尿量、食量等基本情况测定
[0095]
给药前及给药后每周收集一次24h尿液,并记录饮水量ml,饮食量g,产尿量ml等基本情况。
[0096]
2.2.3 24h尿微量白蛋白排泄率测定
[0097]
取适量尿液样本,按照尿微量白蛋白试剂盒说明书操作,测定各组24h尿微量白蛋白的含量,按照计算公式计算24h尿微量白蛋白排泄率(uaer)。
[0098]
uaer=尿微量白蛋白浓度ng/ml*24h尿量(ml)
[0099]
2.2.4肾脏重量与体重测定
[0100]
扑杀之前称取动物体重并称取左右两个肾脏重量,用于计算肾体比。
[0101]
2.3样本的采集
[0102]
给药4-5周后,扑杀动物,扑杀前称重。采用外科双结扎法分别取十二指肠、回肠、结肠,每段大概两厘米。所有样本都放入冻存管于液氮保存5-60分钟,然后转-80℃保存用于肠道菌群检测。
[0103]
2.4肠道菌群测序
[0104]
2.4.1基因组dna抽提
[0105]
使用ctab/sds方法提取样本中的总基因组dna,在1%琼脂糖凝胶上监测dna浓度和纯度。根据浓度,使用无菌水将dna稀释至1ng/μl。
[0106]
2.4.2pcr扩增与纯化
[0107]
按照表1的反应体系对16srrna基因的v3-v4可变区进行pcr扩增,通用引物为341f(5
’-
cctaygggrbgcascag-3’)和806r(5
’-
ggactacnngggtatctaat-3’)。
[0108]
表1 16sr rna v3-v4区扩增反应体系
[0109][0110][0111]
pcr反应参数:95℃初始变性5分钟;95℃变性30秒,55℃退火30秒,72℃延伸45秒,27个循环;最后70℃10分钟。
[0112]
每个样本重复三次,将同一样本pcr产物混合后采用2%琼脂糖凝胶电泳检测,对目的条带进行切割,按照凝胶回收试剂盒的操作方法切胶回收pcr扩增产物。
[0113]
2.4.3荧光定量
[0114]
参照电泳初步定量结果,将pcr产物用quantifluor
tm-st蓝色荧光定量,进行检测定量之后按照每个样本的测序量要求,进行相应比例的混合。
[0115]
2.4.4测序文库准备与测序
[0116]
根据说明书使用nebultratmdnaliabrary prep kit对测序文库进行准备,使用qubit@2.0荧光仪和安捷伦生物分析仪2100系统对文库进行质检。最后在illuminamiseq平台对文库进行测序,得到200-450bp双端序列。
[0117]
2.4.5生物信息学分析
[0118]
illumina pe250测序得到的序列经过初筛和优化得到高质量的序列后,用生物信息学方法对高质量序列进行分析:1)otu(operational taxonomic units,可操作分类单元)聚类分析:借助usearch软件对所得序列按97%的相似度进行归类和划分,选择每个otu中丰度最高的序列作为代表序列,将代表序列与数据库模板序列进行对比,获得每个otu所对应的分类学信息;2)alpha多样性分析:根据所得的otu进行微生物丰度和多样性的分析,包括体现群落丰富度chao1指数(the chao1estimator)、表明群落的多样性的shannon指数(shannon diversity index)和simpson指数(the simpson index)以及稀释曲线检测测序深度是否符合要求;3)pca分析(principal component analysis,主成分分析):分析各组样本之间的相似性大小;4)分类学组成分析:根据otu划分和分类地位鉴定结果,可以获得每个样本在门、纲、目、科、属、种不同分类水平的组成和丰度分布,并进行聚类;5)lefse差异分析:分析各组间有显著性差异的物种。
[0119]
2.5数据统计分析
[0120]
所有数据采用graphpad prism 5.0和spss23.0软件进行做图与统计分析,组间显著性比较采用t检验,p<0.05具有统计学意义上的显著性差异。
[0121]
3实验结果
[0122]
3.1生化指标结果
[0123]
3.1.1餐后血糖结果
[0124]
如图1a所示,hc组发病后血糖一直升高,在第二周后呈下降趋势,hh组给药后餐后血糖一直呈上升趋势,与hc组无差异。如图1b所示,lc组发病后血糖呈上升趋势,而lh组给药后血糖一直处于较平稳的状态,为增加。因此,低剂量给药对高血糖小鼠有良好的降血糖作用,但高剂量给药并没有降血糖作用。
[0125]
3.1.2饮水、食量、尿量结果
[0126]
如图2a所示,hc组发病后饮水量不断增加,虽然在第三周时有所下降,但与0week相比,饮水量仍有所增加,hh组发病后饮水量一直呈增加趋势,与hc组无差异。如图2b所示,hc组发病后食量增加,虽然在第三周有所下降,但第四周又恢复增加的趋势,hh组发病后食量一直呈增加的趋势,与hc组无差异。如图2c所示,hc组发病后的尿量与hh组基本相同,两者无差异。
[0127]
如图3a所示,lc组发病后饮水量增加,但lh组饮水量未增加,一直处于一个平稳的状态。如图3b所示,lc组发病后食量一直在增加,第四周时猛然下降,可能与小鼠发病时间长,状态较差有关,而lh组食量较lc组相比,食量均较低。如图3c所示,lc组发病后尿量一直在增加,但lh组尿量一直处于一个较为平稳的状态。因此,低剂量对高血糖小鼠“三多一少”的症状有良好的改善作用,而高剂量并没有。
[0128]
3.1.3 24h尿微量白蛋白排泄率测定
[0129]
如图4a所示,hc组发病后uaer 1week较0week相比有所增加,但2-4week并没有增加,hh组发病后uaer增加,且均比hc组高。如图4b所示,lc组发病后uaer一直增加,而lh组在第二周开始uaer开始降低,均低于lc组。因此,低剂量有降低uaer的作用,而高剂量并没有。
[0130]
3.1.4肾脏重量与体重比(肾体比)
[0131]
如图5a所示,hc组发病后左右两个肾脏的肾体比均增加,hh组与hc组相比无差异。如图5b所示,lc组发病后左右两个肾脏的肾体比均增加,lh组给药后肾体比降低到正常水平。因此,低剂量能改善肾脏的肿大,而高剂量没有此作用。
[0132]
3.2肠道菌群测序结果
[0133]
3.2.1低剂量给药肠道菌群测序结果
[0134]
其中,a代表十二指肠,b代表回肠,c代表结肠。
[0135]
十二指肠中门、属水平上菌群相对丰度差异分析分别见图6和图7。由图6知,在门水平上给药后,十二指肠中拟杆菌门(bacteroidetes)相对丰度增加;厚壁菌门(firmicutes)和疣微菌门(verrucomicrobia)相对丰度降低。在属水平上分析由图7可知,给药后十二指肠中muribaculaceae_norank相对丰度增加,allorhizobium-neorhizobium-pararhizobium-rhizobium、脱硫弧菌属(desulfovibrio)相对丰度增加;不动杆菌属(acinetobacter)、叶杆菌(phyllobacterium)、鞘氨醇单胞菌(sphingomonas)、链球菌属(streptococcus)相对丰度降低。
[0136]
回肠中门、属水平上菌群相对丰度差异分析分别见图8和图9。由图8可知,在门水平上给药后,回肠中放线菌门(actinobacteria)、拟杆菌门(bacteroidetes)相对丰度增加;疣微菌门(verrucomicrobia)的相对丰度降低。在属水平上分析由图9可知,给药后回肠中艾克曼菌(akkermansia)、另枝菌属(alistipes)、杆菌属(geobacillus)、叶杆菌属
(phyllobacterium)、鞘氨醇单胞菌(sphingomonas)相对丰度降低;脱硫弧菌属(desulfovibrio)、肠杆菌属(enterorhabdus)、muribaculaceae_norank相对丰度增加。
[0137]
结肠中门、属水平上菌群相对丰度差异分析分别见图10和图11。由图10可知,在门水平上给药后,拟杆菌门(bacteroidetes)、疣微菌门(verrucomicrobia)的相对丰度有所降低;放线菌门(actinobacteria)和厚壁菌门(firmicutes)相对丰度有所增加。在属水平上分析由图11可知,给药后艾克曼菌(akkermansia)、拟杆菌属(bacteroides)、gastranaerophilales_norank、普雷沃氏菌科ucg-001(prevotellaceae ucg-001)、嗜木聚糖真杆菌([eubacterium]xylanophilum group)、瘤胃梭菌属9(ruminiclostridium 9)的相对丰度有所降低;脱硫弧菌属(desulfovibrio)、lachnospiraceae nk4a136 group、肠杆菌属(enterorhabdus)、乳杆菌属(lactobaclllus)、turicibacter的相对丰度有所升高。
[0138]
3.2.2高剂量给药肠道菌群测序结果
[0139]
十二指肠中门、属水平上菌群相对丰度差异分析分别见图12和图13。由图12可知,在门水平上高剂量给药后,十二指肠中放线菌门(actinobacteria)、拟杆菌门(bacteroidetes)、绿弯菌门(chloroflexi)相对丰度降低。其在属水平上的分析,由图13可知高剂量给药后,十二指肠中不动杆菌属(acinetobacter)、气单胞菌属(aeromonas)、慢生根瘤菌属(bradyrhizobium)、丛毛单胞菌科(curvibacter)、假单胞菌属(pseudomonas)、鞘氨醇单胞菌(sphingomonas)、muribaculaceae_norank相对丰度均降低。
[0140]
回肠中门、属水平上菌群相对丰度差异分析分别见图14和图15。由图14可知,在门水平上高剂量给药后,回肠中拟杆菌门(bacteroidetes)相对丰度降低,变形菌门(proteobacteria)相对丰度升高。在属水平上的分析由图15可知高剂量给药后,回肠中不动杆菌属(acinetobacter)、鞘氨醇单胞菌(sphingomonas)相对丰度增加。
[0141]
结肠中在门、属水平上菌群相对丰度差异分析分别见图16和图17。由图16可知,在门水平上,高剂量c组中拟杆菌门(bacteroidetes)和patescibacteria的相对丰度较高剂量n组低,但是给药后拟杆菌门(bacteroidetes)的相对丰度并没有改变,patescibacteria的相对丰度有所增加,高剂量c组中的厚壁菌门(firmicutes)、变形菌门(proteobacteria)以及tenericutes的相对丰度均高于高剂量n组,给药后仅有厚壁菌门(firmicutes)略有降低。放线菌门(actinobacteria)在三组中的相对丰度基本相同。由图17知,在属水平上高剂量c组中毛螺菌科(lachnospiraceae_uncultured)、ruminiclosteidium5、ruminiclosteidium9相对丰度高于高剂量n组,给药后其相对丰度所有降低;高剂量c组中candidatussaccharimonas、gca-900066225相对丰度低于hn组,给药后略有增加。
[0142]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
