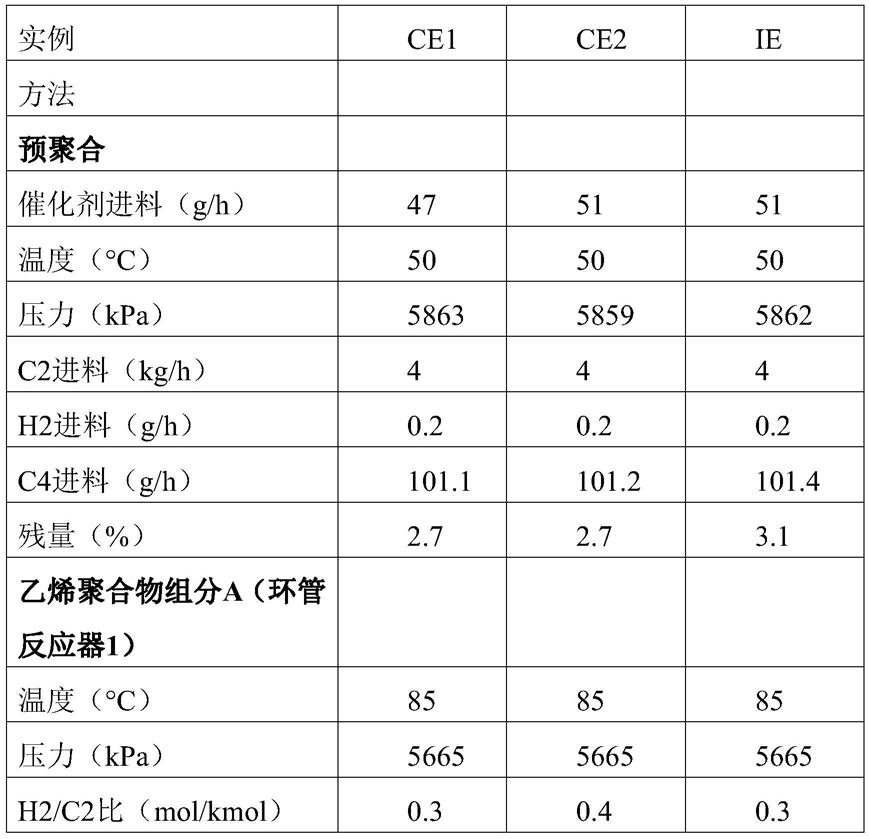
内切型菊糖酶endoinu及其制备方法、以及其应用
技术领域
1.本发明涉及生物工程技术领域,特别涉及一种内切型菊糖酶endoinu及其制备方法、以及其应用。
背景技术:
2.低聚果糖是一种天然甜味物质。甜度为蔗糖的0.3-0.6倍。它既保持了蔗糖的纯正甜味性质,又比蔗糖甜味清爽。低聚果糖是一种具有调节肠道菌群,增殖双歧杆菌,促进钙的吸收,调节血脂,调节免疫,抗龋齿等保健功能的新型甜味剂,被誉为最具潜力的新一代食品添加剂和益生元类物质。近年来,随着消费水平的提高以及消费观念的变化,居民对富含低聚果糖的食品的需求越来越大。目前,低聚果糖已在乳制品、乳酸菌饮料、固体饮料、糖果、饼干、面包、果冻、冷饮等多种食品中广泛应用。
3.菊糖(又称菊粉)是植物中的储备性多糖,是仅次于淀粉的第二大可食用性糖类。包菊科、桔梗科、龙胆科、百合科、禾木科等植物均富含菊糖,其中以菊芋和菊苣含量高。菊糖是由β-d-呋喃果糖和吡喃菊糖残基聚合而成,菊糖中果聚糖的平均聚合度为60。
4.目前,以菊糖为原料,采用内切型菊糖酶水解菊粉制备低聚果糖是低聚果糖生产中最绿色的工艺之一,为世界各国特别是欧美广泛采用。具体地,内切型菊糖酶以菊糖(聚合度dp=2~100)为原料,从菊糖分子的内部将高聚合度的菊糖分子水解切割,从而生产低聚果糖(dp=3~9)。菊糖酶在植物和微生物中均有分布,但从自然中获得的微生物生产出的菊糖酶的活性较低,从而限制了菊糖酶的工业化应用。
技术实现要素:
5.本发明的主要目的是提出一种内切型菊糖酶endoinu及其制备方法、以及其应用,旨在解决现有内切型菊糖酶的活性低的问题。
6.为实现上述目的,本发明提出一种内切型菊糖酶endoinu,所述内切型菊糖酶endoinu的氨基酸序列如seq id no:2所示。
7.此外,本发明还提出一种内切型菊糖酶基因,用于编码如上所述的内切型菊糖酶endoinu。
8.可选地,所述内切型菊糖酶基因的核苷酸序列如seq id no:1所示。
9.此外,本发明还提出一种重组表达载体,所述重组表达载体包括如上所述的内切型菊糖酶基因。
10.此外,本发明还提出一种重组菌株,所述重组菌株包括如上所述的内切型菊糖酶基因。
11.可选地,所述重组菌株的宿主细胞包括大肠杆菌、芽孢杆菌、曲霉菌和酵母菌中的任意一种。
12.可选地,所述酵母菌包括乳酸克鲁维酵母。
13.此外,本发明还提出一种内切型菊糖酶endoinu的制备方法,培养如上所述的重组
no:2所示。
29.本发明提出的内切型菊糖酶endoinu,是基于侯选菊糖酶蛋白序列数据库,在探究蛋白质超家族中的序列-结构-功能之间的关系的基础上,找出新的菊粉酶功能及其催化的酶促反应水解菊糖的典型序列,在trrosetta、alpha fold2的辅助下设计,获得序列底物/产物催化效率提高的新型食品用酶。
30.在本实施例中,是以黑曲霉(aspergillus niger)菊糖酶a(inua,genbank accession number:ab012771)为出发材料,通过人工的设计改造,对黑曲霉菊糖酶a进行定点突变,具体改造过程包括:将第128位的酪氨酸突变为苯丙氨酸(y128f),第298位的天冬氨酸突变为酪氨酸(d298y),从而得到了改造后的内切型菊糖酶endoinu的氨基酸序列。通过将黑曲霉菊糖酶a围绕活性中心的两个重要氨基酸进行了理性突变,大幅度增加了菊糖酶对底物的亲和力和活性,使得到的内切型菊糖酶endoinu具有高活性,能在发酵领域应用以高效率、高产量地生产出高纯度的低聚果糖,从而能适用于低聚果糖的工业化生产。
31.本发明还提出一种内切型菊糖酶基因,本发明不限制所述内切型菊糖酶基因具体的核苷酸序列,只要其能编码出内切型菊糖酶endoinu即可。
32.基于表达宿主的进化信息、表达宿主对密码子的偏好性、酶分子的进化信息和酶基因的序列信息等,基于gene designer等完成对酶基因密码子全新设计与优化;优化适配性宿主细胞。在一优选实施例中,人工合成的所述内切型菊糖酶基因的核苷酸序列如seq id no:1所示,将其命名为内切型菊糖酶基因endoinu,包括该内切型菊糖酶基因endoinu的重组菌株经诱导表达后,能获得更高产量的内切型菊糖酶endoinu,且该内切型菊糖酶endoinu具有高活性。
33.可以理解的是,定点突变技术以及人工合成基因的技术为本领域常规的方法,具体操作步骤为本领域技术人员所公知,在此不做赘述。其中,原始黑曲霉(aspergillus niger)菊糖酶a的氨基酸序列如seqid no:3所示,原始黑曲霉(aspergillus niger)菊糖酶a基因的核苷酸序列如seq id no:4所示。
34.本发明还提出一种重组表达载体,所述重组表达载体包括如上所述的内切型菊糖酶基因endoinu。可以理解的是,所述重组表达载体还包括其他功能单位,在内切型菊糖酶endoinu的氨基酸序列和内切型菊糖酶基因endoinu的核苷酸序列确定的情况下,可以选择合适的表达载体或其他功能单位。其中,所述表达载体可以为适于在细菌、酵母、真菌等宿主中表达的载体。在一优选实施例中,所述表达载体为毕赤酵母表达载体和乳酸克鲁维表达载体中的任意一种。更优地,所述表达载体为乳酸克鲁维表达载体。
35.在一优选实施例中,所述重组表达载体由以下步骤制得:
36.步骤s10、将内切型菊糖酶基因endoinu用限制性内切酶nde i/ecor i双酶切,得到具有粘性末端的endoinu片段;
37.步骤s11、将克鲁维酵母表达载体pgklac同样采用限制性内切酶nde i/ecor i双酶切,得到具有粘性末端的载体pgklac片段;
38.步骤s12、将所述具有粘性末端的endoinu片段和所述具有粘性末端的载体pgklac片段连接,获得菊糖酶重组表达载体,将其命名为pgklac-endoinu。
39.可以理解的是,所述重组载体包括用于驱动所述内切型菊糖酶基因endoinu表达的启动子。所述启动子的类型可以是强表达型启动子、组织特异性启动或诱导型启动子,可
根据实际情况选择相应的启动子来进行驱动表达。在一优选实施例中,所述启动子为乳糖诱导型启动子。
40.较优地,所述内切型菊糖酶基因endoinu还包括了信号肽序列,该信号肽序列位于启动子的下游与所述内切型菊糖酶基因endoinu的上游之间,用于引导菊糖酶的跨膜转移,可根据实际情况选择相应的信号肽序列来进行引导。在一更优选的实施例中,所述信号肽序列为alpha因子。
41.本发明还提出一种重组菌株,所述重组菌株包括如上所述的内切型菊糖酶基因endoinu,所述重组菌株的表达产物为氨基酸序列如seq id no:2内切型菊糖酶endoinu。
42.其中,所述重组菌株的宿主细胞包括大肠杆菌、芽孢杆菌、曲霉菌和酵母菌中的任意一种。优选地,所述重组菌株的宿主细胞为酵母菌中的乳酸克鲁维酵母,如此,所述重组菌株生产内切型菊糖酶endoinu的产量进一步提高。
43.在一实施例中,所述重组菌株由以下步骤制得:
44.步骤s21、将内切型菊糖酶基因endoinu用限制性内切酶nde i/ecor i双酶切,得到具有粘性末端的endoinu片段;
45.步骤s22、将克鲁维酵母表达载体pgklac同样采用限制性内切酶nde i/ecor i双酶切,得到具有粘性末端的载体pgklac片段;
46.步骤s23、将所述具有粘性末端的endoinu片段和所述具有粘性末端的载体pgklac片段连接,获得菊糖酶重组表达载体pgklac-endoinu;
47.步骤s24、将所述重组表达载体pgklac-endoinu线性化,然后通过电脉冲法将线性化后的重组表达载体pgklac-endoinu导入宿主细胞,获得重组菌株。
48.本发明还提出一种如上所述的内切型菊糖酶endoinu的制备方法,所述制备方法包括:培养如上所述的重组菌株,得到内切型菊糖酶endoinu。具体地,通过发酵培养经步骤s24制得的重组菌株,在培养基中以乳糖为组分,诱导内切型菊糖酶endoinu的表达;从培养物(发酵上清液)中提纯获得内切型菊糖酶endoinu。需要说明的是,在一些实施例中,也可以不经过提取处理,直接将发酵上清液视为内切型菊糖酶endoinu产物。
49.此外,本发明还提出一种如上所述的内切型菊糖酶endoinu在制备低聚果糖中的应用。在一具体实施例中,采用所述内切型菊糖酶endoinu与菊糖接触,通过所述内切型菊糖酶endoinu对菊糖的水解作用得到低聚果糖。较优地,所述内切型菊糖酶endoinu对菊糖的水解参数为:ph 5.0,温度50℃,菊粉浓度为15%,菊糖酶/菊粉比为5000u/g(即酶活力单位与底物质量比为5000u/g),水解时间为4小时。
50.进一步地,所述内切型菊糖酶endoinu是由内切型菊糖酶基因endoinu编码得到的。由于人工设计合成的所述内切型菊糖酶基因endoinu具有高产量、高活性的特点,因此,与传统的低聚果糖的制备方法相比,本发明提供的获得低聚果糖的方法更高效,能适用于低聚果糖的工业化生产。
51.以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
52.实施例1内切型菊糖酶endoinu的获得
53.以黑曲霉(aspergillus niger)菊糖酶a(inua,genbank accession number:ab012771)为出发材料,所述黑曲霉菊糖酶a的氨基酸序列如seq id no:4所示,所述黑曲霉
菊糖酶a的核苷酸序列如seq id no:3所示,对其出发材料的酶序列特点进行统计分析,构建酶的隐马尔科夫模型;通过隐马尔科夫模型来检索数据库中的潜在候选的突变位点;探究蛋白质超家族中的序列-结构-功能之间的关系,找出新的菊糖酶功能及其催化的酶促反应水解菊粉的典型序列;基于蛋白质结构的分析,以及大规模数据统计以及深度学习的思路,在trrosetta、alpha fold2的辅助下设计,获得序列底物/产物催化效率提高的内切型菊糖酶endoinu。其改造过程为:在黑曲霉菊糖酶a(seq id no:3)的基础上,将其围绕活性中心的两个重要氨基酸进行理性突变,具体为:将第128位的酪氨酸突变为苯丙氨酸(y128f),第298位的天冬氨酸突变为酪氨酸(d298y),得到了改造后的内切型菊糖酶endoinu,所述内切型菊糖酶endoinu的氨基酸序列如seq id no:2所示,通过上述改造优化,大幅度提高了其对底物的亲和力和活性,从而得到了高活性的内切型菊糖酶endoinu。可以理解的是。核苷酸序列(seq id no:3)中最后的tga为终止密码子。
54.图1为所述出发材料黑曲霉菊糖酶a的三维结构,图1中标示出了突变位点tyr128和asp298所在的位置、以及突变位点与活性中心的位置关系。
55.图2为内切型菊糖酶endoinu的活性中心的三维结构,由图2可以看出,突变后的phe128和tyr298所在的位置、以及它们与底物菊粉(即菊糖)的相互关系。其中,第128位的酪氨酸为底物菊糖分子进入活性中心的作用氨基酸;第298位的天冬氨酸为产物低聚果糖离开菊糖酶的作用氨基酸。
56.实施例2内切型菊糖酶基因endoinu的获得
57.基于表达宿主的进化信息、表达宿主对密码子的偏好性、酶分子的进化信息和酶基因的序列信息等,基于gene designer等完成对酶基因密码子全新设计与优化;优化适配性宿主细胞。通过人工优化、设计、合成并获得了高活性、高产量的内切型菊糖酶基因endoinu,所述内切型菊糖酶基因endoinu的核苷酸序列如seq id no:1所示。可以理解的是。核苷酸序列(seq id no:1)中最后的taa为终止密码子。
58.图3为所述内切型菊糖酶基因endoinu的核苷酸序列与已知菊糖酶的核苷酸序列的比对结果。由图3可以看出,与出发基因黑曲霉(aspergillus niger)菊糖酶a(inua,genbank:ab012771)、aspergillus lacticoffeatus(genbank:xm 025595800)、aspergillus fichu(genbank:aj006951)、aspergillus welwitschiae(genbank:xm 026774703)等已知的菊糖酶基因具有明显的序列差异性,因此,本发明提供的内切型菊糖酶基因endoinu的核苷酸序列具有明显的新颖性。
59.实施例3重组表达载体的构建
60.(1)在实施例2合成内切型菊糖酶基因endoinu(seq id no:1)引入nde i和ecor i酶切位点,然后用限制性内切酶nde i/ecor i双酶切,得到具有粘性末端的endoinu片段;
61.(2)将克鲁维酵母表达载体pgklac同样采用限制性内切酶nde i/ecor i双酶切,得到具有粘性末端的载体pgklac片段;
62.(3)将所述具有粘性末端的endoinu片段和所述具有粘性末端的载体pgklac片段在t4连接酶的作用下于16℃过夜,获得菊糖酶重组表达载体,将其命名为pgklac-endoinu。
63.(4)出发材料黑曲霉菊糖酶a(inua)重组表达载体采用与上述步骤(1)、(2)和(3)相同的方式构建,并命名为重组表达载体pgklac-inua。
64.其中,步骤(1)和步骤(2)中的酶切体系为:10xbuffer 2μl,ddh2o14.5μl,质粒
dna3μl,限制性内切酶各0.5μl,总体积20μl。
65.图4为所述重组表达载体pgklac-endoinu的图谱。
66.图5为所述重组表达载体pgklac-endoinu的酶切检验结果图(其中,泳道1为质粒pgklac经nde i/ecor i双酶切后的结果,泳道2为重组表达载体pgklac-endoinu经nde i/ecor i双酶切后的结果),由图5可以看出,本发明成功构建了重组表达载体pgklac-endoinu。
67.实施例4重组菌株的构建
68.(1)采用限制性内切酶切割2μg实施例2构建的重组表达载体pgklac-endoinu以将其线性化;将10μl线性化浓缩后的重组表达载体pgklac-endoinu加入90μl乳酸克鲁维酵母感受态中,轻轻混匀后转入预冷的电转杯中,冰浴5min;用电转仪进行电击,电击参数为v=1500v,pc=200ω,c=25μf;待电击结束后,迅速向电转杯中加入1ml营养液轻轻吹打混匀后转入1.5ml无菌离心管中,置于28℃培养箱培养2h;取100~200μl菌液涂布于含有乙酰胺的平板中,置于28℃培养箱培养2~3d,待长出单菌落;经划线纯化后,得到含内切型菊糖酶基因endoinu的重组菌株。
69.(2)出发材料黑曲霉菊糖酶a(inua)基因的重组菌株采用与上述步骤(1)相同的方式构建,得到含出发菊糖酶inua基因的重组菌株。
70.实施例5内切型菊糖酶endoinu的制备
71.将实施例4步骤(1)和步骤(2)制得的重组菌株分别接种于装有30ml ypgal培养基(每1000ml含在酵母粉20g,蛋白胨20g,乳糖20g)的250ml容量瓶中,28℃、200r/min恒温振荡培养约48h;当od
600
约为30~40时,5000rpm离心5min收集上清液,得到含菊糖酶的发酵液。期间,于不同的时间点(第12、24、36和第48h,接种时作为发酵起始点第0h)取发酵液,在5000rpm下,离心5min,取上清液。
72.将上述取得的各发酵上清液电泳,其电泳结果如图6所示(其中,图6a为含出发菊糖酶inua基因的重组菌株的表达结果,6b为含内切型菊糖酶基因endoinu的重组菌株的表达结果)。由图6可以看出,经人工设计优化后,内切型菊糖酶endoinu的产量明显优于出发基因inua。
73.检测上述取得的各发酵上清液的酶活力,其结果如图7所示。由图7可以看出,含出发菊糖酶inua基因的重组菌株的表达产物菊糖酶inu的活性较低,在发酵48h后,酶活性仅为1200u/ml,而经设计优化后的内切型菊糖酶基因endoinu构建的重组菌株的表达产物内切型菊糖酶endoinu的酶活上升明显,在发酵48h后,酶活性达到了17200u/ml,也即,改造后的内切型菊糖酶基因endoinu相比于原始出发材料,酶活提高了13.3倍。
74.也即,优化得到的内切型菊糖酶基因endoinu构建的重组菌株经发酵培养后,能够获得高产量、高活性的内切型菊糖酶endoinu。
75.实施例5低聚果糖的制备
76.将实施例4中含内切型菊糖酶基因endoinu构建的重组菌株培养得到的内切型菊糖酶endoinu接触菊糖,通过对菊糖的水解作用得到低聚果糖。
77.具体操作为:将菊糖和内切型菊糖酶endoinu接触,在ph 5.0,温度50℃,菊糖浓度为15%,酶/菊粉比为5000u/g(即酶活力单位与底物质量比为5000u/g)的条件下,水解4小时,然后通过hplc检查产物,以检测菊糖被水解的情况,其检测结果如图8所示。
78.由图8可以看出,菊糖经内切型菊糖酶endoinu水解后产生低聚果糖的主要成分为二聚糖至六聚糖,单糖的含量少于5%;且产物中低聚果糖的主要成分二糖、三糖、四糖和五糖含量达95%以上,属于高品质的低聚果糖产品。也即,在4小时水解后,具有不同链长的果糖聚合物的混合物完全水解,并且产物仅含有两种组分,果糖回收率为95%,而其他物质葡萄糖至多为5%。
79.以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。