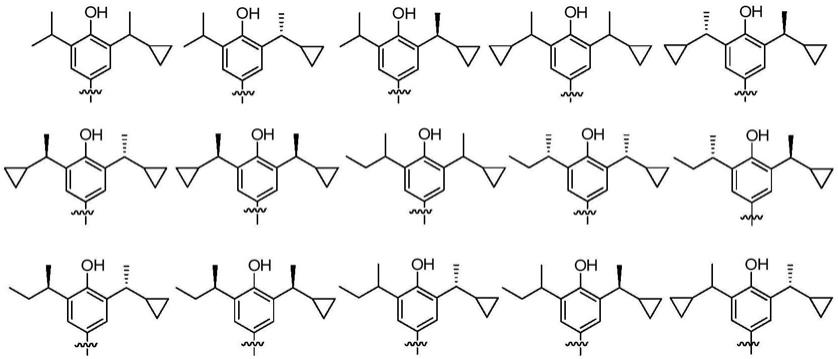
1.本发明涉及一种通式(i)所示的苯双酚衍生物或其立体异构体、药学上可接受的盐或前药,其制备方法、药物组合物以及本发明化合物在中枢神经领域的用途。
背景技术:
2.gaba
a
受体是中枢神经系统中主要的抑制性神经递质受体。gaba
a
受体由跨膜多肽亚基的五聚体构成,19种不同的亚基组成了多种不同的gaba
a
受体亚型。gaba
a
受体涉及麻醉、镇静、抑郁、焦虑、癫痫、记忆障碍、药物依赖等多种疾病的发病机制和诊断治疗。因此,gaba
a
受体是药理学和临床上重要的药物作用靶点。丙泊酚及其衍生物即是一类重要的以gaba
a
为靶点的化合物。
3.丙泊酚适用于诱导和维持全身麻醉,也用于加强监护病人接受机械通气时的镇静等。丙泊酚已成功用于清醒患者的伴随局部或区域性麻醉的镇静剂,也在引起清醒患者的不适的诊断中如结肠镜检查或透视成像中作为镇静剂。也用作儿童的诊断成像或放射疗法。而且丙泊酚与咪达唑仑或其它镇静剂相比,具有类似或更好的镇静效果(cn200680025438;drugs 50,1995,636),它具有更快的恢复和类似或更低的遗忘效果,特别是短期镇静。
4.丙泊酚在临床也用于治疗难治性癫痫持续状态。常用于治疗难治性癫痫持续状态的药物包括咪达唑仑、丙泊酚、大剂量硫喷妥钠等,但临床研究证实静脉持续输注丙泊酚是目前治疗难治性癫痫持续状态的较好的方法。沈冶军等人(中外医学研究,2015,(13)34,30
‑
31)报道了丙泊酚治疗癫痫持续状态疗效观察中,丙泊酚与咪达唑仑相比,丙泊酚治疗癫痫持续状态效果显著,平均控制时间更短,疗效迅速、气管插管率低,值得临床推广使用。熊伟茗等人(第三军医大学学报,2013,15期)研究表明小剂量静推丙泊酚对幕上肿瘤伴癫痫发作患者病灶周围皮层癫痫波有激化作用,可辅助定位致痫灶,指导术中致痫灶的有效处理,有利于提高晚期癫痫控制率。
5.丙泊酚体内代谢产物少,有明显的降低颅内压、脑代谢和抗氧化等作用,能显著改善神经功能缺损,对于脑保护具有较好的作用。文献报道丙泊酚靶控输注在心脏手术患者中使用安全有效,能维持患者血流动力学稳定,其脑保护作用得到了越来越多的证实,并且其作用机制的研究也取得了一定进展(journal of ningxia medical university,34(7)
‑
2012
‑
750)。王宁等(《临床神经病学杂志》2002年06期)研究异丙酚治疗老年脑出血术后患者的疗效结果表明术后第7天异丙酚组的临床神经功能缺损程度评分明显低于对照组,异丙酚有助于老年脑出血术后患者的脑保护。陈煜等人(中华麻醉学杂志,(22)10
‑
2002
‑
603)也报道了在婴幼儿先天性心脏病心内直视手术中,异丙酚用于深低温停循环期间对缺血再灌注损伤有保护作用。
6.由此对丙泊酚及其类似物的进一步研究具有临床上的重要意义。
7.本领域需要进一步开发结构新颖、药效好、安全的gaba
a
受体激动剂,提供更多更优的药物选择途径,以便更好地促进镇静催眠、脑保护,治疗和/或预防焦虑、恶心、呕吐、偏
头痛、惊厥、癫痫、神经变性疾病等中枢神经系统相关的疾病。
技术实现要素:
8.本发明涉及一种通式(i)化合物或者其立体异构体、药学上可接受的盐或前药,
[0009][0010]
其中
[0011]
b选自
[0012]
r1和r2各自独立的选自c1‑4烷基或c3‑6环烷基;
[0013]
r3、r4、r5和r6各自独立的选自c1‑4烷基或c3‑6环烷基;
[0014]
n选自1或2。
[0015]
优选地,在本发明的通式(i)化合物或者其立体异构体、药学上可接受的盐或前药中,
[0016]
r1选自c1‑4烷基或c3‑4环烷基,优选甲基或乙基;r2选自c1‑4烷基或c3‑4环烷基,优选甲基、乙基或环丙基;
[0017]
r3、r4、r5和r6各自独立的选自甲基、乙基或环丙基。
[0018]
优选地,在本发明的通式(i)化合物或者其立体异构体、药学上可接受的盐或前药中,
[0019]
r1选自c1‑4烷基或c3‑4环烷基,优选甲基或乙基;r2选自c1‑4烷基或c3‑4环烷基,优选甲基、乙基或环丙基;
[0020]
b选自如下结构之一:
[0021][0022]
优选地,在本发明的通式(i)化合物或者其立体异构体、药学上可接受的盐或前药中,
[0023]
r1选自c1‑4烷基或c3‑4环烷基,优选甲基或乙基;r2选自c1‑4烷基或c3‑4环烷基,优选甲基、乙基或环丙基;
[0024]
b选自如下结构之一:
[0025][0026]
优选地,在本发明的通式(i)化合物或者其立体异构体、药学上可接受的盐或前药中,该化合物选自如下结构之一:
[0027][0028]
本发明还涉及一种通式(ii)化合物或者其立体异构体、药学上可接受的盐或前药,
[0029][0030]
其中
[0031]
r7和r8各自独立的选自c1‑4烷基或c3‑6环烷基;
[0032]
r9、r
10
、r
11
和r
12
各自独立的选自c1‑4烷基或c3‑6环烷基;
[0033]
m选自1或2。
[0034]
优选地,在本发明的通式(ii)化合物或者其立体异构体、药学上可接受的盐或前药中,
[0035]
r7选自甲基或乙基;r8选自甲基、乙基或环丙基;
[0036]
r9、r
10
、r
11
和r
12
各自独立的选自甲基、乙基或环丙基。
[0037]
本发明还涉及一种药物组合物,所述的药物组合物包括通式(i)化合物或其立体异构体、药学上可接受的盐或者前药,和一种或者多种药学上可接受的载体和/或赋形剂。
[0038]
本发明还涉及本发明的通式(i)化合物或者其立体异构体、药学上可接受的盐或前药或者本发明所述的药物组合物在制备促进动物或者人类的镇静催眠、脑保护、治疗和/或预防焦虑、抑郁、失眠、恶心、呕吐、偏头痛、精神分裂、惊厥或者癫痫的药物中的用途。
[0039]
除非有相反的陈述,在说明书和权利要求书中使用的术语具有下述含义。
[0040]
本发明所述基团和化合物中所涉及的碳、氢、氧、硫、氮或f、cl、br、i均包括它们的同位素情况,其中本发明所述基团和化合物中所涉及的碳、氢、氧、硫或氮任选进一步被一个或多个它们对应的同位素所替代,其中碳的同位素包括
12
c、
13
c和
14
c,氢的同位素包括氕(h)、氘(d,又叫重氢)、氚(t,又叫超重氢),氧的同位素包括
16
o、
17
o和
18
o,硫的同位素包括
32
s、
33
s、
34
s和
36
s,氮的同位素包括
14
n和
15
n,氟的同位素包括
17
f和
19
f,氯的同位素包括
35
cl和
37
cl,溴的同位素包括
79
br和
81
br。
[0041]“药学上可接受的盐”或者“其药学上可接受的盐”是指使本发明化合物保持游离酸或者游离碱的生物有效性和特性,且所述的游离酸通过与无毒的无机碱或者有机碱,所述的游离碱通过与无毒的无机酸或者有机酸反应获得的盐。
[0042]“药物组合物”是指一种或多种本发明所述化合物、其药学上可接受的盐或前药和其它化学组分形成的混合物,其中,“其它化学组分”是指药学上可接受的载体、赋形剂和/或一种或多种其它治疗剂。
[0043]“载体”是指不会对生物体产生明显刺激且不会消除所给予化合物的生物活性和特性的材料。
[0044]“赋形剂”是指加入到药物组合物中以促进化合物给药的惰性物质。非限制性实施例包括碳酸钙、磷酸钙、糖、淀粉、纤维素衍生物(包括微晶纤维素)、明胶、植物油、聚乙二醇类、稀释剂、成粒剂、润滑剂、粘合剂和崩解剂。
[0045]“前药”是指可经体内代谢转化为具有生物活性的本发明化合物的化合物。本发明的前药通过修饰本发明化合物中的酚基团来制备,该修饰可以通过常规的操作或者在体内被除去,而得到具有生物活性的本发明化合物。当本发明的前药被施予哺乳动物个体时,前药被割裂形成游离的羟基。
[0046]“动物”是指哺乳动物,例如人、陪伴动物、动物园动物和家畜,优选人、马或者犬。
[0047]“立体异构体”是指由分子中原子在空间上排列方式不同所产生的异构体,包括顺反异构体、对映异构体和构象异构体。
[0048]“任选”或“任选地”或“选择性的”或“选择性地”是指随后所述的事件或状况可以但未必发生,该描述包括其中发生该事件或状况的情况及其中未发生该事件或状况的情况。例如,“选择性地被烷基取代的杂环基”是指该烷基可以但未必存在,该描述包括其中杂环基被烷基取代的情况,及其中杂环基未被烷基取代的情况。
[0049]
ed
50
(半数有效量):通过测试导致50%小鼠翻正反射丧失需要的剂量。
[0050]
ed
95
(95%有效量):通过测试导致95%小鼠翻正反射丧失需要的剂量。
[0051]
ld
50
(半数致死量):通过测试导致50%小鼠死亡需要的剂量。
[0052]
ld5(5%致死量):通过测试导致5%小鼠死亡需要的剂量。
[0053]
solutol hs
‑
15:聚乙二醇(peg)十二羟基硬脂酸锂。
具体实施方式
[0054]
以下通过具体实施例详细说明本发明的实施过程和产生的有益效果,旨在帮助阅读者更好地理解本发明的实质和特点,不作为对本案可实施范围的限定。
[0055]
化合物的结构是通过核磁共振(nmr)或(和)质谱(ms)来确定的。nmr位移(δ)以10
‑6(ppm)的单位给出。nmr的测定是用(brukeravance iii 400和brukeravance 300)核磁仪,测定溶剂为氘代二甲基亚砜(dmso
‑
d6),氘代氯仿(cdcl3),氘代甲醇(cd3od),氘代乙腈(cd3cn),内标为四甲基硅烷(tms)。
[0056]
ms的测定用agilent 6120b(esi)和agilent 6120b(apci)。
[0057]
hplc的测定使用安捷伦1260dad高压液相色谱仪(zorbax sb
‑
c18100
×
4.6mm)。
[0058]
薄层层析硅胶板使用烟台黄海hsgf254或青岛gf254硅胶板,薄层色谱法(tlc)使用的硅胶板采用的规格是0.15mm~0.20mm,薄层层析分离纯化产品采用的规格是0.4mm~0.5mm。
[0059]
柱层析一般使用烟台黄海硅胶200~300目硅胶为载体。
[0060]
本发明的己知的起始原料可以采用或按照本领域已知的方法来合成,或可购买于泰坦科技、安耐吉化学、上海德默、成都科龙化工、韶远化学科技、百灵威科技等公司。
[0061]
本发明硅胶柱层析所示比例为体积比。
[0062]
简写说明:
[0063]
pd(dppf)cl2:[1,1
′‑
双(二苯基膦)二茂铁]二氯化钯(ii)。
[0064]
实施例1
[0065]2‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
[3
‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑5‑
异丙基
‑
苯基]
‑6‑
异丙基
‑
苯酚(1)
[0066]2‑
[(1r)
‑1‑
cyclopropylethyl]
‑4‑
[3
‑
[(1r)
‑1‑
cyclopropylethyl]
‑4‑
hydroxy
‑5‑
isopropyl
‑
phenyl]
‑6‑
isopropyl
‑
phenol(1)
[0067]
[0068][0069]
第一步:(4e)
‑2‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
[3
‑
[(1r)
‑1‑
环丙基乙基]
‑5‑
异丙基
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑6‑
异丙基
‑
环己
‑
2,5
‑
二烯
‑1‑
酮(1b)
[0070]
(4e)
‑2‑
[(1r)
‑1‑
cyclopropylethyl]
‑4‑
[3
‑
[(1r)
‑1‑
cyclopropylethyl]
‑5‑
isopropyl
‑4‑
oxo
‑
cyclohexa
‑
2,5
‑
dien
‑1‑
ylidene]
‑6‑
isopropyl
‑
cyclohexa
‑
2,5
‑
dien
‑1‑
one(1b)
[0071][0072]
250ml三口瓶中,加入2
‑
[(1r)
‑1‑
环丙基乙基]
‑6‑
异丙基苯酚(1a)(5.0g,24.47mmol)和50ml乙醚,搅拌均匀,冷却到0℃分批加入氧化银(6.81g,29.37mmol),自然回到室温反应5小时,反应完毕后,反应液直接过滤,滤饼用乙醚(20ml
×
3)洗涤,合并滤液,浓缩得到黄色固体产物(4e)
‑2‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
[3
‑
[(1r)
‑1‑
环丙基乙基]
‑5‑
异丙基
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑6‑
异丙基
‑
环己
‑
2,5
‑
二烯
‑1‑
酮(1b)(4.2g粗品),直接用于下一步。
[0073]
第二步:2
‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
[3
‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑5‑
异丙基
‑
苯基]
‑6‑
异丙基
‑
苯酚(1)
[0074]2‑
[(1r)
‑1‑
cyclopropylethyl]
‑4‑
[3
‑
[(1r)
‑1‑
cyclopropylethyl]
‑4‑
hydroxy
‑5‑
isopropyl
‑
phenyl]
‑6‑
isopropyl
‑
phenol(1)
[0075][0076]
250ml三口瓶中,加入(4e)
‑2‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
[3
‑
[(1r)
‑1‑
环丙基乙
基]
‑5‑
异丙基
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑6‑
异丙基
‑
环己
‑
2,5
‑
二烯
‑1‑
酮(1b)(4.2g,10.38mmol),25ml乙醇,25ml四氢呋喃,搅拌均匀,冷却到0℃分批加入固体硼氢化钠(1.18g,31.14mmol),自然回到室温反应5小时。将反应液慢慢倒入100ml饱和氯化铵水溶液中淬灭,用乙酸乙酯(40ml
×
3)萃取,合并有机相用饱和食盐水(100ml
×
2)洗涤,无水硫酸钠干燥,过滤,将滤液减压浓缩至30ml体积拌硅胶,硅胶柱层析纯化(乙酸乙酯:石油醚=1:10)得产物2
‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
[3
‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑5‑
异丙基
‑
苯基]
‑6‑
异丙基
‑
苯酚(1)(3.2g,产率75.8%)
[0077]
ms:405.4[m
‑
1]
‑
;
[0078]1hnmr:(400mhz,cdcl3):δ7.26(d,2h),7.21(d,2h),4.93(s,2h),3.24
‑
3.17(m,2h),3.56
‑
3.52(m,2h),1.34
‑
1.31(m,18h),1.13
‑
1.09(m,2h),0.63
‑
0.56(m.2h),0.53
‑
0.46(m,2h),0.30
‑
0.20(m,4h)。
[0079]
实施例2
[0080]4‑
[3,5
‑
双[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑
苯基]
‑
2,6
‑
双[(1r)
‑1‑
环丙基乙基]苯酚(2)
[0081]4‑
[3,5
‑
bis[(1r)
‑1‑
cyclopropylethyl]
‑4‑
hydroxy
‑
phenyl]
‑
2,6
‑
bis[(1r)
‑1‑
cyclopropylethyl]phenol(2)
[0082][0083][0084]
将原料2,6
‑
二((r)
‑1‑
环丙基乙基)苯酚(2a)(0.5g,2.17mmol),碘苯二乙酯(pida)(0.175g,0.543mmol)溶于3ml氯仿,40℃反应1小时,停止反应,浓缩后硅胶柱层析(石油醚:乙酸乙酯=100:1)得4
‑
[3,5
‑
双[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑
苯基]
‑
2,6
‑
双[(1r)
‑1‑
环丙基乙基]苯酚(2),黄色液体(0.43g,产率40%)。
[0085]
lc
‑
ms:457.2[m
‑
1]
‑
;
[0086]1hnmr:(400mhz,cdcl3):δ7.282(4h,s),5.098(2h,s),2.558
‑
2.442(4h,m),1.346(12h,d),1.145
‑
1.072(4h,m),0.617
‑
0.556(4h,m),0.518
‑
0.458(4h,m),0.273
‑
0.194(8h,m)。
[0087]
实施例3
[0088]4‑
[3,5
‑
二[(1r)
‑1‑
环丙基乙基]
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑
2,6
‑
二[(1r)
‑
1
‑
环丙基乙基]环己
‑
2,5
‑
二烯
‑1‑
酮(3)
[0089]4‑
[3,5
‑
bis[(1r)
‑1‑
cyclopropylethyl]
‑4‑
oxo
‑
cyclohexa
‑
2,5
‑
dien
‑1‑
ylidene]
‑
2,6
‑
bis[(1r)
‑1‑
cyclopropylethyl]cyclohexa
‑
2,5
‑
dien
‑1‑
one(3)
[0090][0091]
方法一:100ml三口瓶中,加入2,6
‑
二((r)
‑1‑
环丙基乙基)苯酚(2a)(0.46g,2.0mmol)和20ml甲醇,搅拌均匀,加入3ml双氧水(30%)然后滴加碘的甲醇溶液(0.25g碘溶于10ml甲醇),升温至35℃反应4小时完毕。反应完毕后向反应瓶中滴加10ml 2%的亚硫酸氢钠溶液,过滤,石油醚(20ml
×
2)萃取,合并有机相,水(30ml
×
1)洗涤,无水硫酸钠干燥。减压浓缩得粗品,柱层析纯化(石油醚:乙酸乙酯=50:1),得到棕色固体产物4
‑
[3,5
‑
二[(1r)
‑1‑
环丙基乙基]
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑
2,6
‑
二[(1r)
‑1‑
环丙基乙基]环己
‑
2,5
‑
二烯
‑1‑
酮(3)(0.09g,产率9.07%)。
[0092]
方法二:将2,6
‑
二((r)
‑1‑
环丙基乙基)苯酚(2a)(0.46g,2.0mmol)溶于乙酸乙酯(10ml),加入碳酸银(0.55g,2.0mmol),室温搅拌18h,过滤不溶物,滤液减压浓缩得棕褐色固体,用正己烷洗涤(20ml),收集棕色固体产物4
‑
[3,5
‑
二[(1r)
‑1‑
环丙基乙基]
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑
2,6
‑
二[(1r)
‑1‑
环丙基乙基]环己
‑
2,5
‑
二烯
‑1‑
酮(3)(0.21g,产率45%)。
[0093]
方法三:50ml单口瓶中,加入2,6
‑
二((r)
‑1‑
环丙基乙基)苯酚(2a)(0.46g,2.0mmol)和20ml二氯甲烷,然后分批加入2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌(ddq,0.91g,4.0mmol),加完后室温反应1h,反应液旋干后直接柱层析纯化(石油醚:乙酸乙酯=50:1),得到棕色固体产物4
‑
[3,5
‑
二[(1r)
‑1‑
环丙基乙基]
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑
2,6
‑
二[(1r)
‑1‑
环丙基乙基]环己
‑
2,5
‑
二烯
‑1‑
酮(3)(0.400g,产率88%)。
[0094]
方法四:100ml单口瓶中,加入2,6
‑
二((r)
‑1‑
环丙基乙基)苯酚(2a)(0.3g,1.30mmol)和10ml水,加入六水三氯化铁(0.39g,1.43mmol),加完后加热到90℃反应4小时,反应液用乙酸乙酯(10ml
×
3)萃取,有机相合并浓缩,柱层析纯化(石油醚:乙酸乙酯=50:1),得到棕色固体产物34
‑
[3,5
‑
二[(1r)
‑1‑
环丙基乙基]
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑
2,6
‑
二[(1r)
‑1‑
环丙基乙基]环己
‑
2,5
‑
二烯
‑1‑
酮(3)(0.1g,产率33.3%)。
[0095]1hnmr(400mhz,cdcl3):δ7.88
‑
7.86(m,4h),δ2.42
‑
2.34(m,4h),δ1.27(d,6h),δ1.26(d,6h),δ0.99
‑
0.90(m,4h),δ0.64
‑
0.58(m,4h),δ0.48
‑
0.41(m,4h),δ0.30
‑
0.24(m,4h),δ0.21
‑
0.15(m,4h).
[0096]
实施例4
[0097]4‑
[3,5
‑
双[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑
苯基]
‑
2,6
‑
双[(1r)
‑1‑
环丙基乙基]苯酚(2)
[0098]4‑
[3,5
‑
bis[(1r)
‑1‑
cyclopropylethyl]
‑4‑
hydroxy
‑
phenyl]
‑
2,6
‑
bis[(1r)
‑1‑
cyclopropylethyl]phenol(2)
[0099][0100]
第一步:4
‑
[3,5
‑
二[(1r)
‑1‑
环丙基乙基]
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑
2,6
‑
二[(1r)
‑1‑
环丙基乙基]环己
‑
2,5
‑
二烯
‑1‑
酮(3)
[0101]4‑
[3,5
‑
bis[(1r)
‑1‑
cyclopropylethyl]
‑4‑
oxo
‑
cyclohexa
‑
2,5
‑
dien
‑1‑
ylidene]
‑
2,6
‑
bis[(1r)
‑1‑
cyclopropylethyl]cyclohexa
‑
2,5
‑
dien
‑1‑
one(3)
[0102][0103]
100ml三口瓶中,加入2,6
‑
二((r)
‑1‑
环丙基乙基)苯酚(2a)(1.0g,
[0104]
4.34mmol)和10ml四氢呋喃,搅拌均匀,分批加入氧化银(1.2g,5.21mmol),加完后加热到70℃反应5小时,反应完毕后,反应液直接过滤,滤饼用四氢呋喃冲洗3次(20ml
×
3),滤液合并浓缩到小体积后拌硅胶,过柱纯化(石油醚:乙酸乙酯=50:1),得到黄色固体产物4
‑
[3,5
‑
二[(1r)
‑1‑
环丙基乙基]
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑
2,6
‑
二[(1r)
‑1‑
环丙基乙基]环己
‑
2,5
‑
二烯
‑1‑
酮(3)(0.4g,产率40.4%)。
[0105]1hnmr(400mhz,cdcl3):δ7.88
‑
7.86(m,4h),δ2.42
‑
2.34(m,4h),δ1.27(d,6h),δ
1.26(d,6h),δ0.99
‑
0.90(m,4h),δ0.64
‑
0.58(m,4h),δ0.48
‑
0.41(m,4h),δ0.30
‑
0.24(m,4h),δ0.21
‑
0.15(m,4h).
[0106]
第二步:4
‑
[3,5
‑
双[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑
苯基]
‑
2,6
‑
双[(1r)
‑1‑
环丙基乙基]苯酚(2)
[0107]4‑
[3,5
‑
bis[(1r)
‑1‑
cyclopropylethyl]
‑4‑
hydroxy
‑
phenyl]
‑
2,6
‑
bis[(1r)
‑1‑
cyclopropylethyl]phenol(2)
[0108][0109]
100ml三口瓶中,加入4
‑
[3,5
‑
二[(1r)
‑1‑
环丙基乙基]
‑4‑
氧
‑
环己
‑
2,5
‑
二烯
‑1‑
烯基]
‑
2,6
‑
二[(1r)
‑1‑
环丙基乙基]环己
‑
2,5
‑
二烯
‑1‑
酮(3)(0.4g,0.988mmol),10ml乙醇,10ml四氢呋喃,搅拌均匀,冷却到0℃分批加入固体硼氢化钠(0.112g,2.97mmol),加完后自然回到室温反应1h,反应完毕后,将反应液慢慢倒入100ml饱和氯化铵水溶液中淬灭,用乙酸乙酯(40ml
×
3)萃取,合并有机相用饱和食盐水(100ml
×
2)反洗,无水硫酸钠干燥,过滤,将滤液减压浓缩成至30ml体积拌硅胶,上柱纯化(乙酸乙酯:石油醚=1:10)得产物4
‑
[3,5
‑
双[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑
苯基]
‑
2,6
‑
双[(1r)
‑1‑
环丙基乙基]苯酚(2)(0.26g,64.68%)
[0110]
ms:457.4[m
‑
1]
‑
;
[0111]1hnmr:(400mhz,cdcl3):δ7.282(4h,s),5.098(2h,s),2.558
‑
2.442(4h,m),1.346(12h,d),1.145
‑
1.072(4h,m),0.617
‑
0.556(4h,m),0.518
‑
0.458(4h,m),0.273
‑
0.194(8h,m).
[0112]
实施例5
[0113]4‑
[3
‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑5‑
异丙基
‑
苯基]
‑
2,6
‑
二异丙基
‑
苯酚(4)
[0114]4‑
[3
‑
[(1r)
‑1‑
cyclopropylethyl]
‑4‑
hydroxy
‑5‑
isopropyl
‑
phenyl]
‑
2,6
‑
diisopropyl
‑
phenol(4)
[0115][0116]
第一步:4
‑
溴
‑
2,6
‑
二异丙基苯酚(4b)
[0117]4‑
bromo
‑
2,6
‑
diisopropyl
‑
phenol(4b)
[0118][0119]
250ml三口瓶中,加入2,6
‑
二异丙基苯酚(4a)(10.00g,56.09mmol)和二氯甲烷(100ml),搅拌均匀,冷却到0℃,分批加入苄基三甲基三溴化铵(26.25g,67.31mmol),自然升到室温,反应3小时。反应完毕,依次用水(100ml
×
1)、饱和亚硫酸氢钠溶液(50ml
×
1)、饱和碳酸氢钠溶液(100ml
×
1)、饱和氯化钠溶液(100ml
×
1)洗涤,无水硫酸钠干燥,过滤浓缩得4
‑
溴
‑
2,6
‑
二异丙基苯酚(4b)(13.0g,产率90.3%)。
[0120]
ms:255.0[m
‑
1]
‑
;
[0121]1hnmr:(400mhz,cdcl3):δ7.14(s,2h),4.60(brs,1h),3.11(hept,2h),1.24(d,12h).
[0122]
第二步:
[0123]
2,6
‑
二异丙基
‑4‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂戊硼烷
‑2‑
基)苯酚(4c)
[0124]
2,6
‑
diisopropyl
‑4‑
(4,4,5,5
‑
tetramethyl
‑
1,3,2
‑
dioxaborolan
‑2‑
yl)phenol(4c)
[0125][0126]
100ml单口瓶中,加入4
‑
溴
‑
2,6
‑
二异丙基苯酚(4b)(3.00g,11.67mmol)和二氧六环(30ml),依次加入联硼酸频那醇酯(3.85g,15.17mmol)、乙酸钾(1.89g,31.50mmol)、pd(dppf)cl2(0.85g,1.17mmol),氮气保护中,100℃反应6小时。反应完毕,硅藻土过滤,滤液加入水(30ml),用乙酸乙酯(30ml
×
2)萃取,合并有机相,饱和氯化钠溶液(30ml
×
1)洗涤,无水硫酸钠干燥,浓缩,柱层析(石油醚:乙酸乙酯=50:1)得2,6
‑
二异丙基
‑4‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂戊硼烷
‑2‑
基)苯酚(4c)(3.0g,产率85.0%)。
[0127]
ms:303.3[m
‑
1]
‑
;
[0128]1hnmr:(400mhz,cdcl3):δ7.52(s,2h),5.01(s,1h),3.14(hept,2h),1.33(s,12h),1.27(d,12h).
[0129]
第三步:
[0130]4‑
溴
‑2‑
[(1r)
‑1‑
环丙基乙基]
‑6‑
异丙基苯酚(4d)
[0131]4‑
bromo
‑2‑
[(1r)
‑1‑
cyclopropylethyl]
‑6‑
isopropyl
‑
phenol(4d)
[0132][0133]
250ml三口瓶中,加入2
‑
[(1r)
‑1‑
环丙基乙基]
‑6‑
异丙基苯酚(1a)(10.00g,48.95mmol)和二氯甲烷(100ml),搅拌均匀,冷却到0℃分批加入苄基三甲基三溴化铵(22.90g,58.74mmol),自然升到室温,反应3小时。反应完毕,依次用水(100ml
×
1)、饱和亚硫酸氢钠溶液(50ml
×
1)、饱和碳酸氢钠溶液(100ml
×
1)、饱和氯化钠溶液(100ml
×
1)洗涤,无水硫酸钠干燥,浓缩后柱层析(石油醚:乙酸乙酯=100:1)得4
‑
溴
‑2‑
[(1r)
‑1‑
环丙基乙基]
‑6‑
异丙基苯酚(4d)(4.8g,产率35.5%)。
[0134]
ms:281.0[m
‑
1]
‑
;
[0135]1hnmr:(400mhz,cdcl3):δ7.21(d,1h),7.15(d,1h),4.88(s,1h),3.11(hept,1h),2.47
‑
2.40(m,1h),1.27(d,3h),1.24(dd,6h),1.04
‑
0.98(m,1h),0.61
‑
0.55(m,1h),0.52
‑
0.45(m,1h),0.24
‑
0.20(m,1h),0.18
‑
0.13(m,1h).
[0136]
第四步:
[0137]4‑
[3
‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑5‑
异丙基
‑
苯基]
‑
2,6
‑
二异丙基
‑
苯酚(4)
[0138]4‑
[3
‑
[(1r)
‑1‑
cyclopropylethyl]
‑4‑
hydroxy
‑5‑
isopropyl
‑
phenyl]
‑
2,6
‑
diisopropyl
‑
phenol(4)
[0139][0140]
100ml单口瓶中,加入4
‑
溴
‑2‑
[(1r)
‑1‑
环丙基乙基]
‑6‑
异丙基苯酚(4d)
[0141]
(0.10g,0.35mmol)和二氧六环(3ml),依次加入2,6
‑
二异丙基
‑4‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂戊硼烷
‑2‑
基)苯酚(4c)(0.14g,0.46mmol)、碳酸钾(2mol/l,1.1ml)、pd(dppf)cl2(16mg,0.021mmol),氮气保护中,100℃反应6小时。反应完毕,硅藻土过滤,滤液加入水(5ml),用乙酸乙酯(5ml
×
2)萃取,合并有机相,用饱和氯化钠溶液(10ml
×
1)洗涤,无水硫酸钠干燥,浓缩,柱层析(石油醚:乙酸乙酯=50:1)得4
‑
[3
‑
[(1r)
‑1‑
环丙基乙基]
‑4‑
羟基
‑5‑
异丙基
‑
苯基]
‑
2,6
‑
二异丙基
‑
苯酚(4)(0.05g,产率40.0%)。
[0142]
ms:379.3[m
‑
1]
‑
;
[0143]1hnmr:(400mhz,cdcl3):δ7.25(d,1h),7.21
‑
7.20(m,3h),4.96(s,1h),4.78(s,1h),3.23
‑
3.17(m,3h),2.59
‑
2.52(m,1h),1.28
‑
1.23(m,21h),1.18
‑
1.10(m,1h),0.62
‑
0.57(m,1h),0.54
‑
0.49(m,1h),0.30
‑
0.22(m,2h).
[0144]
生物测试
[0145]
戊四氮诱导小鼠急性癫痫试验
[1]
[0146]
1.试验目的
[0147]
通过戊四氮诱导小鼠急性癫痫模型,评价化合物抗癫痫药效。
[0148]
2.试验材料
[0149]
1)试验动物
[0150]
icr小鼠,6
‑
8周龄,18
‑
22g,雌雄各半,共40只,供应商为成都达硕实验动物有限公司,许可证号为scxk(川)2013
‑
182。
[0151]
2)试剂
[0152]
戊四氮,购自sigma
‑
aldrich,批号为mkbx1160v。临用前用生理盐水配制成所需浓度溶液。
[0153]
3)受试药物
[0154]
以化合物1(实施例1)为受试药物,设100mg/kg、50mg/kg和25mg/kg共3个剂量组。临用前准确称取化合物,每个剂量组中依次加入dmso、solutol hs
‑
15和生理盐水作为溶媒,涡旋混匀,配制成所需浓度溶液。dmso和solutol hs
‑
15终浓度分别为5%和10%。静脉给药,给药体积为10ml/kg。
[0155]
3.试验方法
[0156]
试验前一天,动物禁食不禁水。试验当天,动物随机分为4组,分别为化合物1三个剂量组(100mg/kg、50mg/kg、25mg/kg)和仅加入上述溶媒的模型对照组,每组10只,雌雄各半。各组动物先分别静脉给予受试药物溶液或溶媒。静脉给药30min后,腹腔给予戊四氮(85mg/kg)。观察指标釆用racine标准(表1),记录动物的发作级别,动物癫痫发作0
‑
iii级
计做化合物抗癫痫有效,计算有效率。
[0157]
表1.癫痫发作racine标准
[0158]
发作级别表现0级无反应i级节律性嘴抽动或面部抽动ii级点头或甩尾iii级单肢抽动iv级多肢抽动或强直v级全面强直
‑
阵挛发作
[0159]
4.试验结果
[0160][0161]
结论:实验结果表明,本发明化合物1能抑制戊四氮诱导的小鼠急性癫痫发作,其抗癫痫药效呈剂量相关性。
[0162]
参考文献
[0163]
[1]魏伟主编.药理试验方法学(第四版)[m].人民卫生出版社2010:705
‑
707.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。