abhd2基因表达抑制剂、其应用及药物
技术领域
1.本发明涉及生物医药领域,特别涉及abhd2基因表达抑制剂、其应用及 药物。
背景技术:
2.多年来,原发性肝细胞癌(primary hepatocellular carcinoma,以下简称肝癌) 一直危害着人类生命健康,是世界常见的恶性肿瘤之一。肝癌复杂的发病机制 涉及多种过程,如慢性炎症、纤维化和癌基因失调。根据癌症的分期和患者的 情况,有多种治疗肝癌的方法。肝癌主要可通过肝移植、肝切除、射频消融、 经导管动脉化疗栓塞和靶向治疗等手段进行治疗。然而,到目前为止,肝癌患 者五年生存率仍然较低,只有三分之一的患者在经过手术切除、移植或局部消 融治疗后,平均寿命超过了60个月。术后复发和转移的频繁发生使得肝癌患者 死亡率高居不下。多年来,科研工作者一直致力于寻找治疗肝癌的有效方案, 以期改善患者的不良预后。
3.反式激活dna结合蛋白(tardbp),也称为tdp-43,是一种由414个 氨基酸组成的核蛋白。它最初被鉴定为一种能够调节人类免疫缺陷病毒1 (hiv-1)基因表达的dna结合蛋白。后来的研究发现,由tardbp基因编 码的tdp-43是一种高度保守的dna/rna结合蛋白。作为hnrnp家族的成员 之一,tdp-43具有一个典型的hnrnp蛋白结构域:一个折叠良好的n端结构 域(ntd)、一个富含甘氨酸的c端结构域(ctd)和两个高度保守的rna识 别序列(rrm1和rrm2)。在细胞核中,tdp-43能与rna结合,在mrna 转录、剪接、核转运和稳定性等方面发挥重要作用。虽然大部分的tdp-43定 位在细胞核中,但tdp-43也能通过主动或被动运输进入胞质。在细胞质中, tdp-43形成rnp核糖核蛋白颗粒,调节mrna分子的运输,促进非编码rna 如mirna的产生。
4.一直以来,tdp-43因其在神经退行性疾病中的重要作用而被关注。在肌萎 缩侧索硬化症(als)、额颞叶变性(ftld)和阿莫兹海默病(ad)等神经相 关疾病中,tdp-43多表现出异常胞质定位,随后被过度磷酸化、泛素化,进而 裂解产生c端片断,形成泛素阳性-tau阴性包涵体(ftld-u)。该包涵体的形 成是这些神经退行性疾病的特征性改变。由于tdp-43在神经性疾病中的重要 角色,研究者们因此定义了一类新型的神经退行性疾病,称为tdp-43蛋白病。 有趣的是,最近的研究发现tdp-43与恶性肿瘤的发生和发展也有密切关联。 研究表明,tdp-43在乳腺癌、肺癌、黑色素瘤等恶性肿瘤中表达失调。tcga 数据库分析显示tdp-43在乳腺肿瘤的样本表达水平明显高于正常乳腺组织。 tdp-43可以与剪切因子srsf3(富集精氨酸、丝氨酸的剪切因子3)相互作用, 调控下游靶标papr3和numb外显子12的选择性剪切,促进肿瘤的增殖与转 移。在肺癌细胞中,tdp-43可以通过与fasl mrna结合进而增强fasl mrna 的稳定性,介导细胞凋亡,最终发挥抑制肺癌的功能。在前期研究中我们发现, tdp-43在肝癌组织中的表达显著高于癌旁组织。然而,tdp-43在肝癌发生发 展中的潜在作用及相关分子机制,仍然有待揭晓。
技术实现要素:
5.为弥补现有技术的缺陷,本发明提供了abhd2基因表达抑制剂、其应用 及药物。
6.本发明第一个方面,提供abhd2基因表达抑制剂,其特征在于,所述抑 制剂为1)、2)的一种或两种:
7.1)以abhd2基因作为靶标制备或筛选得到的对abhd2基因具有抑制效 果的产品;
8.2)以abhd2基因的上游调控基因作为靶标或筛选得到的对该上游调控基 因具有抑制效果的产品,所述调控基因为tdp-43基因。
9.进一步的,所述产品选自为靶向abhd2基因或tdp-43基因的小干扰rna, 或者为abhd2基因敲除试剂或tdp-43基因的敲除试剂。
10.更进一步的,靶向tdp-43基因的小干扰rna如seq id no.9或seq idno.10所示。
11.更进一步的,靶向abhd2基因的小干扰rna如seq id no.11或seq idno.12所示。
12.本发明第二个方面,提供所述的abhd2基因表达抑制剂在制备治疗肝癌 的药物中的应用。
13.进一步的,所述治疗包括促进肝癌细胞凋亡和抑制肝癌细胞增殖。
14.本发明第三个方面,提供一种治疗肝癌的药物,包括abhd2基因表达抑 制剂,所述治疗肝癌的药物可以是以所述的abhd2基因表达抑制剂作为唯一 有效成分的,也可以是将abhd2基因表达抑制剂与其他抗肝癌药物联合作为 有效成分。
15.本发明具有如下有益效果:
16.在本项研究中,我们发现,tdp-43可通过上调脂代谢相关基因abhd2抑 制肝癌细胞的凋亡进程。分子机制调查显示,tdp-43可与abhd2 mrna 3
′
utr结合并增强abhd2 mrna的稳定性,进而上调abhd2的表达。tdp-43 通过abhd2影响脂代谢过程,进而抑制肝癌细胞凋亡,最终促进了肝癌的发 展进程,而通过下调abhd2或tdp-43的表达,可促进肝癌细胞凋亡和抑制 肝癌细胞增殖。本研究不仅丰富了tdp-43影响恶性肿瘤发展的分子机制,也 为肝癌临床诊断提供新的分子标记物、为精准治疗提供了潜在的靶点。
附图说明
17.图1(a,b)通过细胞克隆形成实验评估敲低tdp-43对smmc-772、1 mhcc97h细胞(a)和huh-7细胞(b)增殖的影响。(c)细胞克隆形成数量 统计图。(d,e)应用流式细胞术检测敲低tdp-43对smmc-7721和mhcc97h细 胞凋亡的影响。(f)细胞凋亡(d,e)定量分析(包括细胞凋亡的早期、晚期及 总凋亡率)。(g)用流式细胞术检测tdp-43过表达对huh-7细胞凋亡的影响(左 图)并进行定量分析(右图)(包括细胞凋亡的早期、晚期及总凋亡率)。 (h)qrt-pcr实验检测tdp-43敲低后hcc细胞中tdp-43,bcl-2,bax,p53基因的表 达情况。gapdh基因作为内源性对照。(i)应用western blot实验检测tdp-43敲 低的smmc-7721和mhcc97h细胞及tdp-43过表达的huh-7细胞中bax,c
‑ꢀ
caspase-3,p53,bcl-2,tdp-43的蛋白水平表达情况。所示数据为平均值
±
sd(n= 3)。*p《0.05.**p《0.01.***p《0.001。
18.图2(a)采用tdp-43稳定敲低的mhcc97h细胞和对照细胞进行裸鼠异 种移植肿瘤,图中所示为剥离后的肿瘤图像。(b)裸鼠肿瘤体积生长曲线(mm3)。 (c)裸鼠肿瘤重量(g)。(d)统计1-6周control组和kd-tdp-43组裸鼠(n=6) 的体重(g)。(e,f)应用免疫组化实验检测敲低tdp-43后裸鼠异种移植物中 ki67、c-caspase3、p53的表达水平变化,并进行定量
分析(f图)。比例尺:50 μm。所示数据为平均值
±
sd(n=3)。(g.h)生存分析显示tdp-43的表达与患 者的总生存率(g图)和无复发生存率(h图)呈负相关。(i)统计肿瘤组织和 瘤旁正常组织中tdp-43的表达水平。所示数据为平均值
±
sd(n=3)。*p《0.05. **p《0.01.***p《0.001。
19.图3(a,b)敲低tdp-43后hcc细胞中相关差异表达基因的集群热图(a) 及相对数量统计图(b)。(c)凋亡基因富集的gsea图。(d)kegg通路富 集数据气泡图。横坐标是rich factor,数值越大表示富集程度越大。q value是 经过多重校验的p value,越红表示q value越小,说明富集越明显。(e)kegg 代谢相关通路基因富集柱状图。(f)敲低tdp-43后hcc细胞中差异表达基因 的火山图。红点,显著上调的基因。绿点,显著下调的基因。灰点,无差异表 达基因。(g)qrt-pcr实验检测敲低tdp-43后hcc细胞中tdp-43,及代谢相 关基因hal,abhd2,alp1,gch1,lclat1,klhl8,cbarp,hpd,pip5kl1, lipg的表达情况。所示数据为平均值
±
sd(n=3)。*p《0.05.**p《0.01。
20.图4(a-c)qrt-pcr实验检测在hcc细胞系中tdp-43对abhd2表达水 平的影响。a)经kd-tdp-43处理或control处理后检测mhcc97h细胞。b) 转染si-tdp-43#1/#2或si-control后检测smmc-7721细胞。c)转染tdp-43过 表达质粒(oe-tdp-43)或空载质粒(vector)后检测huh-7细胞。所示数据 为平均值
±
sd(n=3)。*p《0.05.**p《0.01.***p《0.001.(d)应用western blot 实验检测huh-7与smmc-7721细胞中tdp-43对abhd2表达的影响。(e)应 用免疫组化实验检测敲低tdp-43后裸鼠异种移植物中abhd2的表达水平变 化(左图),并进行定量分析(右图)。比例尺:50μm。***p《0.001.(f)应用 免疫组化实验检测hcc组织芯片中tdp-43与abhd2的表达情况。比例尺:100μm。(g)tdp-43和abhd2在hcc组织芯片中的表达水平热图。数字0、 1、2或3分别代表阴性、弱、中度或强染色。(h)在上述组织芯片中,tdp-43 和abhd2表达水平之间的关联,通过pearson卡方独立检验进行统计分析, χ2=61.41,p《0.0001。
21.图5(a)rip-pcr实验检测smmc-7721细胞中tdp-43与abhd2 mrna 之间的结合。(b,c)qrt-pcr实验检测敲低tdp-43后对abhd2 mrna稳 定性的影响。(d,e)双荧光素酶报告基因实验检测tdp-43过表达或敲低对构建 有abhd2 mrna 3
′
utr的荧光素酶活性的影响。(f)pgl3-control质粒上构 建的abhd2 3
′
utr区野生型(wt)、敲除预测结合位点1型(del-1)、敲除预测 结合位点2型(del-2)示意图。(g)双荧光素酶报告基因实验检测tdp-43过 表达的hek 293t细胞分别转染wt、del-1、del-2质粒后的荧光素酶活性变 化。(h)双荧光素酶报告基因实验检测tdp-43敲低的hek 293t细胞分别转 染wt、del-1、del-2质粒后的荧光素酶活性变化。所示数据为平均值
±
sd(n= 3)。*p《0.05.**p《0.01.***p《0.001。
22.图6(a)检测smmc-7721细胞中abhd2敲低对游离脂肪酸含量的影响。 (b,c)应用流式细胞术检测abhd2敲低对smmc-7721(b)和mhcc97h(c) 细胞凋亡的影响。(d)对b、c凋亡细胞进行定量分析(包括细胞凋亡的早期、 晚期及总凋亡率)。(e)应用western blot实验检测abhd2敲低后smmc-7721 和mhcc97h细胞中abhd2,bax,c-caspase3,p53,bcl-2的蛋白水平表达情况。 所示数据为平均值
±
sd(n=3)。*p《0.05.**p《0.01.***p《0.001。
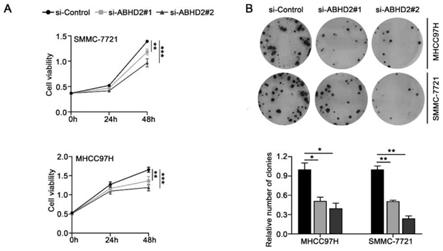
23.图7(a)应用cck8检测abhd2敲低对smmc-7721(上图)和mhcc97h (下图)细胞增殖活性的影响。转染了si-abhd2#1/#2或si-control后分别在0时、24时、48时检测。(b)通过细胞克隆形成实验评估敲低abhd2对 mhcc97h和smmc-7721细胞增殖的影响。相对细胞克隆数
量显示在柱状图 中(下图)。所示数据为平均值
±
sd(n=3)。*p《0.05.**p《0.01.***p《0.001。
24.图8(a)检测干扰tdp-43后过表达abhd2对细胞中游离脂肪酸(ffa) 水平的影响。(b)cck8检测干扰tdp-43后过表达abhd2对smmc-7721细 胞增殖活性对的影响。(c)应用流式细胞术检测干扰tdp-43后过表达abhd2 对smmc-7721(上图)和mhcc97h(下图)细胞凋亡的影响。(d)对c图 凋亡细胞进行定量分析(包括细胞凋亡的早期、晚期及总凋亡率)。(e)应用 qrt-pcr实验检测干扰tdp-43后过表达abhd2对smmc-7721细胞中的 tdp-43,abhd2,bcl-2基因表达水平的影响。(f)应用western blot实验检测 smmc-7721和mhcc97h细胞中abhd2,p53,bcl-2,c-caspase3,tdp-43的蛋 白水平表达情况。所示数据为平均值
±
sd(n=3)。*p《0.05.**p《0.01.***p《 0.001。
25.图9(a)采用如图所示处理的mhcc97h细胞进行裸鼠异种移植肿瘤(n=5) 在第42天的代表图像。(b)裸鼠异种移植肿瘤重量(g)。**p《0.01.***p《0.001. (c)统计1-6周裸鼠的异种移植肿瘤体积。(d)检测control vector组、 kd-tdp-43 vector组、kd-tdp-43 oe-abhd2组裸鼠的异种移植物中ffa 含量。所示数据为平均值
±
sd(n=3)。***p《0.001.(e,f)应用免疫组化实验 检测裸鼠的异种移植瘤中abhd2、tdp-43、ki-67、c-caspase3、p53表达水平, 并进行定量分析(f图)。比例尺:100μm。所示数据为平均值
±
sd(n=3)。*p《 0.05.**p《0.01。
具体实施方式
26.下面结合附图和具体实施例对本发明进行详细说明,但不应理解为本发明 的限制。如未特殊说明,下述实施例中所用的技术手段为本领域技术人员所熟 知的常规手段,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商 业途径得到。
27.实施例1
28.1.材料及方法
29.1.1细胞培养
30.人类肝癌细胞smmc-7721、mhcc97h、huh-7和hek293t细胞系从苏 州北纳创联生物技术有限公司购买,用含10%胎牛血清(gibco)的高糖dmem培 养基(bi)在5%二氧化碳浓度下,37℃培养箱中培养。
31.1.2质粒构建
32.以smmc-7721细胞提取的mrna为模板,通过rt-pcr扩增tdp-43的 编码区序列(cds),扩增时引入酶切位点xhoi和bamhi,随后将该序列和载 体pegfp-c1分别进行双酶切,利用t4 dna连接酶将上述酶切pcr产物与 pegfp-c1载体相连接,最终构建成重组质粒pegfp-tdp-43以用于tdp-43 的外源过表达。采用同样方法,将abhd2 cds克隆至pcmv3载体中,构建 生成pcmv3-abhd2以用于abhd2过表达。利用特异性引物pcr扩增abhd2 的3
′
utr,构建至pgl3-control载体中,生成pgl3-control-abhd2-3
′
utr(wt), 并对两个富含ug序列的位点分别进行删除,构建两个不同的abhd2突变体 (del-1、del-2)。相关引物序列见表1。
33.表1质粒构建相关引物信息
[0034][0035][0036]
1.3转染
[0037]
为了分别敲低和过表达tdp-43及abhd2,根据生产厂家的说明书,我们 分别将特异靶向tdp-43和abhd2的sirnas,tdp-43的真核表达质粒及 abhd2的真核表达质粒,采用lipofectamine 2000试剂(invitrogen)转染入选定 的细胞中。为了构建稳定敲除tdp-43的肝癌细胞,我们用携带 plv-h1-shtdp-43-puro或plv-h1-shrna-scram-puro的慢病毒感染mhcc97h 细胞,再用嘌呤霉素处理,获得tdp-43稳定沉默的细胞株 (mhcc97h-kd-tdp-43)和对照细胞株(mhcc97h-control)。所有sirnas均 由广州锐博生物科技有限公司(ribobio)合成,sirnas序列见表2。
[0038]
表2sirnas序列信息
[0039][0040]
1.3实时荧光定量pcr(qrt-pcr)
[0041]
使用trizol(takara)从相应细胞中提取总rna,并利用easytaq dna聚合 酶反转录试剂盒(trnas)将rna反转为cdna。然后使用sybr green mastermix(thermo fisher scientific)试剂,通过applied biosystems quantstudio 3 real-time pcr系统(thermo fisher scientific)完成qrt-pcr。以内参基因gapdh 的表达量为参照,通过δδct法测定各基因的表达量。本研究中使用的引物均 由武汉金开瑞生物工程有限公司合成,具体序列见表3。
[0042]
表3qrt-pcr涉及引物
[0043][0044]
1.4蛋白质印迹
[0045]
用含有1nmol/l pmsf(碧云天)的ripa缓冲液(碧云天)裂解待处理细胞 提取总蛋白。蛋白质通过sds-page胶(索莱宝)分离,然后转移到pvdf膜 (ge healthcore life sciences)上。用5%脱脂牛奶在室温下孵育2小时后,与一 抗在4℃杂交过夜,然后用辣根过氧化物酶偶联的二抗(hrp,antibody rabbit igg, absin,1:500)在室温孵育1小时。最后,添加增强化学发光液(ecl kit,ncmbiotech)使用image lab仪器(azure biosystems)获得免疫印迹条带。本实验使用 的一抗为tdp-43(abcam,ab190963)、abhd2(4a biotech,4ab082578)、 cleaved-caspase-3(cell signaling,#9664)、p53(proteintech,10442-1-ap)、bax(cellsignaling,#5023)、bcl-2(abcam,ab182858)。
[0046]
1.5cck8实验
[0047]
通过cck8试剂盒(kemix)检测细胞的增殖能力。首先,将肝癌细胞铺至 六孔板,进
行相应的转染处理48h后,用胰蛋白酶消化细胞,再将细胞以每孔 1000个的密度重新铺至九十六孔板中。然后,分别在对应的时间点加入cck-8 试剂,每孔10μl,放置培养箱中培养2h后,用酶标仪测量450nm波长下的吸 光度。
[0048]
1.6集落形成实验
[0049]
将smmc-7721、mhcc97h、huh-7等细胞在二十四孔板中用含10%fbs 的dmem培养24小时后,转染相应的sirna或质粒。转染48小时后,用不 含胎牛血清的dmem重新悬浮细胞,并铺至6孔板中连续培养20天。菌落形 成后,用预冷pbs洗涤两次,再用4%的多聚甲醛固定30分钟,1%的结晶紫 室温染色15分钟。最后再用pbs洗涤三次,自然风干后拍照观察。
[0050]
1.7流式细胞术检测
[0051]
将1*105细胞平铺在六孔板上,进行相应的转染处理48h后,用无edta 胰酶消化收集细胞。然后,将处理过的细胞用预冷pbs洗涤,在结合缓冲液中 重悬,并加入5μl annexin v-fitc和5μlannexin v-pi染色(keygen,biotech)。 1小时内,通过流式细胞仪分析细胞凋亡的百分率,该实验每组设置三个平行 孔。
[0052]
1.9游离脂肪酸(ffa)含量检测
[0053]
为了评估细胞内脂代谢情况,我们将细胞接种于六孔板上,进行相应的转 染后收集细胞,采用游离脂肪酸定量试剂盒(comin)测定游离脂肪酸(ffa)水平。 对于小鼠肿瘤组织脂代谢分析,我们将三组不同处理的小鼠肿瘤作为样本,经 过冰浴研磨后,按相应的试剂盒说明书测定组织内的ffa水平。
[0054]
1.10双荧光素酶报告基因测定
[0055]
将克隆好的abhd2 3
′
utr序列构建至pgl3-control载体(野生型,wt), 并在此基础之上构建获得两个分别删除tdp-43结合位点的 pgl3-control-abhd2 3
′
utr(del-1,del-2)。将相应的报告基因质粒、对照海 肾质粒及相应的sirnas等转染入hek293t细胞中,36小时后,用双荧光素 酶报告基因试剂盒(promega)检测不同处理下的荧光素酶活性。荧光素酶活 性用海肾荧光值进行归一化处理。
[0056]
1.11患者样本
[0057]
肝癌组织芯片购买于中国武汉塞维尔生物公司,编号为no.live c-1401。 该组织芯片包含32例肝癌组织及配对的癌旁组织。32例临床肝癌病例包括不 同分化程度的肝细胞性肝癌、胆管细胞癌、混合型肝细胞癌-胆管细胞癌。
[0058]
1.12动物实验
[0059]
选取6到8周龄的雄性裸鼠,根据国家卫生研究院对实验室动物的护理和 使用指南培养裸鼠。本次动物实验遵循“新乡医学院伦理委员会”的准则。将应 用于裸鼠成瘤实验的各组细胞培养至生长对数期后,收集细胞,对裸鼠进行皮 下肿瘤接种。皮下接种一周后,开始每三天测量一次肿瘤体积,并记录裸鼠体 重。接种七周后,对裸鼠进行安乐死并解剖,检测肿瘤重量,并将肿瘤组织进 行石蜡包埋、提取蛋白、提取rna、检测ffa含量等处理,以便检测并分析 相关增殖和凋亡指标。
[0060]
1.13高通量转录组测序分析(rna-seq)
[0061]
采用mhcc97h-kd-tdp-43和mhcc97h-control为研究对象,每组设置 3个重复,将上述细胞培养至对数期后收集细胞提取rna。测定rna的浓度 和纯度,然后将样本送至华大基因测序公司,进行转录组测序。华大基因负责 后续的文库构建及转录组数据分析。
[0062]
1.14rna蛋白质免疫共沉淀(rip)
[0063]
为了检测tdp-43是否与abhd2 mrna结合,首先,离心收集肝癌细胞, 用rip裂解缓冲液裂解细胞团块。然后,重悬protein a g琼脂糖珠(millipore, 美国),并与tdp-43抗体或对照igg抗体室温孵育1小时,制备结合相应抗体 的琼脂糖珠。将细胞裂解液与制备好的琼脂糖珠4℃孵育过夜。再用nt-2缓冲 液重复清洗6-8次后,加入蛋白酶k缓冲液,55℃水浴30min以去除蛋白质。 最后加入nt-2缓冲液,并用trizol试剂提取免疫沉淀rna进行qrt-pcr分析。
[0064]
1.15活性氧检测(reactive oxygen species,ros)
[0065]
我们使用氧化敏感荧光探针dcfh-da(beyotime,中国)测量细胞内ros 水平的变化。首先,将相应的细胞进行转染处理,转染48h后加入用无血清 dmem稀释的dcfh-da(10μm),放置培养箱20min,然后用无血清dmem 洗涤细胞3次,最后在荧光显微镜下观察荧光信号并分析ros含量。
[0066]
1.16mrna稳定性检测
[0067]
转录抑制剂放线菌素d(actd)溶解于dmso中,负20℃保存。在抑制 转录分析mrna稳定性实验中,首先将相应的细胞进行转染处理。待转染细胞 长至80%融合度时,分别在不同的时间点加入2μg/ml的actd,以使得收取细 胞时各组actd的作用时间分别为0h、2h和4h。随后,提取rna并通过qrt-pcr 分析abhd2的表达变化。
[0068]
1.17免疫组化(ihc)
[0069]
采用石蜡包埋的移植瘤切片用于tdp-43、abhd2、c-caspase3、ki67和 p53染色分析。切片脱蜡再水化后,用edta抗原还原液(ph9.0)在微波炉内进 行抗原修复,中火8分钟至沸,停止加热8分钟保温,再用中低火微波7分钟, 待玻片自然冷却后,用3%h2o2处理。然后,样品在10%的山羊来源的抗兔血 清中室温封闭30分钟,再与相应的一抗4℃孵育过夜。pbs洗涤三次后,与二 抗在37℃烘箱中孵育50分钟。最后,用二氨基联苯胺(dab)(servicebio g1211) 显色,通过苏木精复染后,脱水封片,进行分析。在肝癌芯片免疫组化分析中, 组织切片中tdp-43与abhd2的染色水平分级评判准则如下:显微镜观察时, 随机选取5个不同的视野,评定分为两项参数:阳性染色细胞数和染色强度。 阳性染色细胞数为0%时记为0,1%~30%记为1,31%~65%记为2,66%~100% 记为3;当阴性染色时记为0,低度染色记为1,中度染色时记为2,高度染色 时记为3;最后,将上述两项参数的评分相乘,所得数小于1时,最终分数记 为0;所得数为1、2或者3时,最终分数记为1;所得分数为4或者6时,最 终分数记为2;所得数为9时,最终分数记为3。芯片热图依据上述最终分数进 行绘制并分析。
[0070]
1.18统计分析
[0071]
应用spss 13.0和graph pad prism 6.0等软件进行统计学分析,以标准偏 差mean(
±
sd)为准确定统计学意义,采用student
′
s t检验方法分析,设定p《0.05 为有明显差异。***p《0.001,**p《0.01,*p《0.05。tdp-43的表达水平与病人 总生存率和无复发生存率的相关性分别采用在线分析网站gepia (http://gepia.cancer-pku.cn/)和kaplan-meier plotter (https://kmplot.com/analysis/index.php?cancer=liver_rnaseq&p=service)进行分 析;肝癌组织芯片分析中,根据pearson卡方独立检验方法判定tdp-43与 abhd2在肝癌组织芯片中的表达相关性。
[0072]
2.结果
[0073]
2.1tdp-43在体外促进肝癌细胞增殖,抑制肝癌细胞凋亡
[0074]
为了探索tdp-43在肝癌发生发展中的潜在作用,我们通过集落形成实验 检测了tdp-43对肝癌细胞增殖能力的影响。首先,在两个肝癌细胞系 (mhcc97h和smmc7721)中分别瞬时转入两个不同的sitdp-43(分别标为 sitdp-43#1和sitdp-43#2)以特异性地沉默tdp-43的表达。结果显示,敲低 tdp-43后显著地抑制了mhcc97h和smmc7721细胞的克隆形成能力(图 1-a,c)。相反,在huh-7细胞中特异性地过表达tdp-43可有效地提升其克隆 形成能力(图1-b,c)。随后,我们通过annexin-fitc/pi双染细胞法检测了细 胞的凋亡水平。检测结果显示,在mhcc97h和smmc7721细胞系中敲低 tdp-43,细胞凋亡率明显增加(图1-d-f);然而,在huh-7细胞细胞中,tdp-43 过表达显著地抑制了细胞凋亡率(图1-g)。为了进一步证实tdp-43对细胞凋 亡的影响,我们采用mhcc97h细胞构建了tdp-43稳定敲除细胞系,并通过 qrt-pcr和western blot实验检测了细胞凋亡标记物的mrna和蛋白的表达水 平。从检测结果中可以看到,抑制tdp-43的表达后,抗凋亡因子bcl-2的mrna 和蛋白水平均下调,而促凋亡因子p53和bax的mrna和蛋白水平增加(图 1-h,i)。其中凋亡相关蛋白酶cleaved-caspase3(c-caspase3)的蛋白表达水平 在tdp-43敲低后也明显上调(图1-i)。然而,在过表达tdp-43的huh-7细胞 系中,bcl-2的蛋白表达水平明显增加,p53,bax和c-caspase3的蛋白表达水 平均显著下调(图1-h,i)。上述实验结果表明,tdp-43可以促进肝癌细胞增殖, 抑制肝癌细胞凋亡。
[0075]
2.2tdp-43促进小鼠体内肝癌细胞的增殖,抑制肝癌细胞的凋亡
[0076]
为了进一步验证tdp-43对肝癌细胞增殖和凋亡的影响,我们采用稳定敲 低tdp-43的mhcc97细胞和对照组细胞进行裸鼠肝癌皮下成瘤实验。
[0077]
通过检测裸鼠成瘤体积及瘤重发现,敲低tdp-43组小鼠的肿瘤体积与肿 瘤重量明显低于对照组(图2-a-c)。两组之间的小鼠体重没有明显的差异(图 2-d),表明沉默tdp-43不会引起其他副作用。接着,我们应用免疫组化实验 检测裸鼠肿瘤组织中ki67,c-caspase3,p53的表达水平。ki67被视为细胞增殖分 子标记物,它的表达水平越高,预示着癌细胞的增殖能力越强;免疫组化结果 显示,与对照组相比,tdp-43敲低组ki67表达明显下降,阳性染色率明显减 少;而p53和c-caspase3的表达则明显增强,阳性染色率明显增加(图2-e,f)。 上述实验结果表明tdp-43在肝癌中具有促进细胞增殖,抑制细胞凋亡的作用。 此外,为了进一步验证上述结论,我们应用gepia和kaplan-meier plotter在线 生物数据库分析了tdp-43的表达水平与肝癌病人总生存率和无复发生存率之 间的关系。分析结果显示,tdp-43的表达与肝癌的总生存率和无复发生存率呈 显著负相关(图2-g,h)。同时,geo数据库gse36376的分析结果表明tdp-43 在肝癌组织中的表达水平明显高于癌旁组织(图2-i)。上述分析表明tdp-43 的表达与肝癌的不良预后之间密切相关。
[0078]
2.3脂代谢相关基因abhd2被确定为tdp-43的下游靶基因
[0079]
为了确定tdp-43的下游靶基因,我们进行了高通量转录组测序(rna-seq) 分析,获得了mhcc97h-kd-tdp-43细胞和对照细胞的基因组表达谱。聚类热 图显示出前100个(top100)表达差异最为显著的基因(图3-a)。在敲低tdp-43 后,我们可以看到有1392个基因上调,1418个基因下调(图3-b)。gsea数 据分析显示凋亡这一功能集强烈响应于tdp-43的表达变化(图3-c),说明 tdp-43与细胞凋亡密切相关,这与我们之前的实验结果一致。针
结果表明tdp-43可能与abhd2 3
′
utr区的位点1结合,影响abhd2 mrna 的稳定性,进而调控其表达。
[0085]
2.6脂代谢调控子abhd2抑制肝癌细胞的凋亡。
[0086]
abhd2作为abhd家族成员之一,具有脂肪酶丝氨酸亲核基序gxsxg, 可以参与脂质的代谢过程。为了验证abhd2对脂代谢的作用,我们通过自由 脂肪酸(ffa)试剂盒检测了smmc7721细胞中的ffa水平。结果显示,敲 低abhd2后,肝癌细胞内的ffa含量明显减少,即abhd2可以促进癌细胞 的脂代谢过程(图6-a)。研究表明脂质代谢的改变已逐渐成为癌细胞的一种特 征。而且,作为tdp-43的下游靶基因,我们猜测脂代谢相关基因abhd2是 否对肝癌发生发展也有一定的影响呢?我们首先通过cck8和集落形成实验验 证abhd2是否具有促进肝癌细胞增殖的作用。cck8结果显示,48h后,与对 照组相比,abhd2敲低组中肝癌细胞的活力明显下降(图7-a)。克隆形成实 验结果表明,沉默abhd2可以抑制细胞的集落形成能力(图7-b)。随后,我 们通过流式细胞术检测了abhd2对肝癌细胞凋亡水平的影响。从流式图和统 计柱状图中可以看出,敲低abhd2后,显著地增加了细胞凋亡率(图6-b-d), 由此表明abhd2可以抑制肝癌细胞凋亡。为了进一步验证abhd2对凋亡的 作用,我们利用western blot分别在smmc7721和mhcc97h肝癌细胞中检测 了凋亡相关标记物的表达水平。结果表明,敲低abhd2后,促凋亡蛋白p53, c-caspase3,bax的蛋白表达水平增加,抑凋亡蛋白bcl-2的表达水平下降(图
ꢀ‑
6-e)。因此,我们得出结论:脂代谢相关基因abhd2可以促进肝癌细胞的增 殖,抑制肝癌细胞的凋亡。
[0087]
2.7体外实验证明tdp-43通过abhd2影响脂代谢进而抑制细胞凋亡
[0088]
为了阐明abhd2相关的脂代谢在tdp-43调控的肝癌细胞凋亡中的作用,我 们选取smmc7721和mhcc97h细胞为研究对象,在敲低tdp-43的基础之上重新 过表达abhd2,然后实施了一系列的功能指标检测。首先,我们检测了细胞的 ffa水平并发现敲低tdp-43后,细胞的ffa水平下降;而过表达abhd2可以缓 解tdp-43沉默引起的ffa下调(图8-a)。由此表明,tdp-43可以通过abhd2 影响脂代谢过程。接着,我们进一步验证了abhd2是否能够改善tdp-43沉默引 起的细胞增殖抑制和细胞凋亡促进。cck8结果显示,在smmc7721细胞中,过 表达abhd2可以改善tdp-43敲低所诱发的细胞增殖能力下降(图8-b)。从流 式细胞术结果中可以看出,敲低tdp-43后再过表达abhd2,可以抑制tdp-43 表达下调所诱发的细胞凋亡(图8-c,d)。随后,应用qrt-pcr和western blot 实验,我们检测了凋亡相关蛋白的mrna和蛋白表达水平。结果显示,tdp-43 沉默促进了促凋亡基因p53、c-caspase3的表达并抑制了抗凋亡基因bcl-2的表达 然而,当重新过表达abhd2后,上述现象得到了明显的改善(图8-e,f)。因此 综合上述实验结果可以说明tdp-43通过abhd2调控脂代谢,进而影响肝癌细胞 的增殖和凋亡。
[0089]
2.8体内实验证明tdp-43通过abhd2影响脂代谢进而抑制细胞凋亡
[0090]
为了进一步验证abhd2在tdp-43诱导的肝癌发生发展中的作用,我们 以稳定敲低tdp-43的mhcc97h-kd-tdp-43细胞和其对照细胞 mhcc97h-control为基础,构建了稳定过表达abhd2的细胞系 (kd-tdp-43 oe-abhd2)和相应的对照细胞系(kd-tdp-43 vector、 control vector)。分别收集上述细胞进行裸鼠皮下植瘤,待植瘤一周后开始进 行肿瘤体积检测。42天后实验结束,收集三组小鼠的皮下肿瘤,并对瘤重进行 检测。检测结果显示,相较于对照组(control vector),tdp-43敲低后肿瘤生 长受到了明显的抑制;重新过表达
abhd2后,有效地缓解了tdp-43缺失所 引起的肿瘤生长抑制现象(图8-a-c)。对裸鼠肿瘤组织进行了ffa含量检测, 结果显示,敲低tdp-43后肿瘤组织中ffa含量下降,而在此基础上过表达 abhd2,可以显著上调肿瘤组织中的ffa含量(图8-d)。接着,我们又通过 免疫组化进一步检测了肿瘤组织内tdp-43、abhd2、ki67、p53、c-caspase3 的表达水平。ihc结果显示,与对照组相比,tdp-43缺失引起了增殖标记物 ki67表达下调及凋亡标记物p53和c-caspase3的上调。然而,abhd2过表达 后,有效地缓解了上述现象(图8-e,f)。上述体内实验结果表明,tdp-43能够 通过上调abhd2影响脂代谢通路,进而促进肝癌细胞增殖、抑制肝癌细胞凋 亡。
[0091]
综上,本研究发现了神经疾病相关蛋白tdp-43作为一种新型促癌蛋白, 促进肝癌发展的分子机制。tdp-43作为rna结合蛋白,可以结合脂代谢相关 基因abhd2的mrna 3
′
utr并增强abhd2 mrna稳定性,上调abhd2 的表达水平。tdp-43与abhd 2在临床肝癌病例中的表达水平呈现显著正相 关。在肝癌细胞中,tdp-43通过abhd2激活脂代谢通路,进而抑制细胞凋亡、 促进细胞增殖,最终推动肝癌的恶性发展进程。我们的研究是肝癌研究领域的 创新发现,为阐明rna结合蛋白在基因表达调控过程中扮演的角色提供了新 的理论依据。同时,tdp-43/abhd2可以作为一种潜在的靶点,对于肝癌精准 治疗具有重要的理论指导意义及临床应用价值。
[0092]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基 本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要 求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0093]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发 明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及 其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。