1.本发明涉及医疗器械领域,尤其涉及一种确定药物治疗后的肿瘤靶区轮廓集的系统及存储介质。
背景技术:
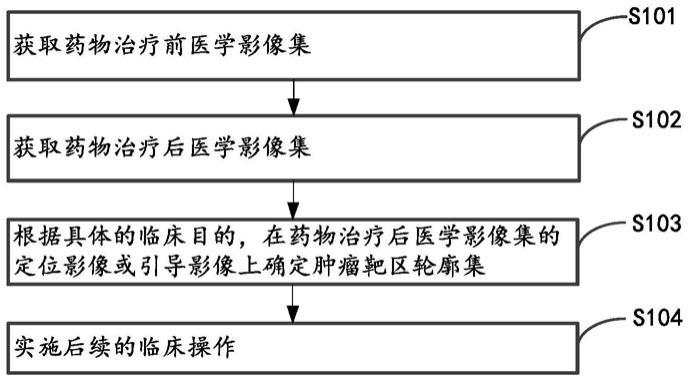
2.图1是相关技术对药物治疗后患者进行肿瘤治疗流程图,如图1所示,步骤包括:
3.步骤s101:获取药物治疗前的医学影像集。
4.步骤s102:获取药物治疗后的医学影像集。
5.步骤s103:根据临床目的,例如常规放射治疗、放射性粒子植入治疗(简称粒子植入治疗)等近距离放疗、消融治疗,或诊断性穿刺活检(以下简称穿刺)等,确定肿瘤靶区轮廓集。
6.例如,临床目的为常规放射治疗,或放射性粒子植入治疗,则需要定位影像,此时在药物治疗后的医学影像集的定位影像上确定肿瘤靶区轮廓集。又例如,临床目的为消融治疗或穿刺活检,则需要引导影像,此时在药物治疗后的医学影像集的引导影像上确定肿瘤靶区轮廓集。
7.其中,该肿瘤靶区指实施临床操作的范围,例如可以指用于常规放疗照射的范围,也可以指凭经验判断的需要近距离放疗、或消融治疗的范围或可能存在癌细胞并施行穿刺(以活检明确病理诊断)的范围。
8.步骤s104:基于肿瘤靶区轮廓集,实施后续的临床操作,例如实施常规放射治疗,近距离放疗、消融治疗,或穿刺等。
9.其中,所述肿瘤靶区可以通过机器以勾画的形式自动确定,也可以由医生凭经验确定。如果患者在治疗(包括常规放射治疗、粒子植入等近距离放疗治疗或者消融治疗等)或穿刺前已经接受化疗、内分泌治疗等药物治疗,那么药物治疗后肿瘤靶区在磁共振图像等医学影像上呈弥散状,肿瘤靶区的轮廓界限很难被清晰准确地识别出来。为克服因药物治疗后的肿瘤靶区图像呈弥散状而无法精确识别出肿瘤靶区轮廓的问题,临床上往往采用以下方式:
10.方式1:根据药物治疗前的影像中的肿瘤的轮廓和位置,通过人工的方式及个人经验在治疗后的图像上确定出治疗后的肿瘤轮廓范围,该方式将导致肿瘤靶区照射范围或者穿刺部位不准确;
11.方式2:在治疗(包括常规放射治疗、粒子植入等近距离放疗治疗或者消融治疗)实施时,将肿瘤靶区拟照射范围扩大至包含该肿瘤靶区的整个解剖部位(即肿瘤所在器官),以防止漏照。比如前列腺癌药物治疗后,一般会以整个前列癌轮廓作为肿瘤靶区拟照射范围,而实际上该照射范围的体积往往要远大于肿瘤靶区体积,并且该照射范围与相关危及器官的距离更近甚至发生重叠。这样会导致两个问题:其一,在设计处方剂量和分次剂量时,考虑到相关危及器官的剂量限值,临床上往往不敢增大该照射范围的处方剂量和分次剂量,导致无法有效地达到根治性放疗的目的;其二,在治疗计划设计时,由于该照射范围
较大,因此很难有效地降低相关危及器官的照射剂量,导致在治疗实施过程中危及器官毒副反应发生概率增加。在穿刺活检实施时,将穿刺范围扩大至整个器官做多点穿刺,这种方式将导致患者出血、感染的风险增多等等。
技术实现要素:
12.本发明实施例提供一种确定药物治疗后的肿瘤靶区轮廓集的系统及存储介质,旨在解决已有技术中肿瘤靶区经药物治疗后难以被准确识别并勾画的问题。
13.本发明实施例提供了一种确定药物治疗后的肿瘤靶区轮廓集的系统,所述系统包括:第一获取模块,用于获取药物治疗前的肿瘤靶区轮廓集以及与所述肿瘤所在器官有关的第一轮廓集;第二获取模块,用于获取药物治疗后的与所述肿瘤所在器官有关的第二轮廓集;形变场确定模块,用于根据所述第一轮廓集和所述第二轮廓集,确定能够将所述第一轮廓集转换为所述第二轮廓集的形变场;靶区轮廓确定模块,用于根据所述形变场和所述药物治疗前的肿瘤靶区轮廓集,确定药物治疗后的肿瘤靶区轮廓集。
14.优选地,所述第一获取模块获取的药物治疗前的与所述肿瘤所在器官有关的第一轮廓集包括药物治疗前的所述器官的亚区的轮廓信息、药物治疗前的所述器官的相邻亚区的组合的轮廓信息中的至少一个;所述第二获取模块获取的药物治疗后的与所述肿瘤所在器官有关的第二轮廓集包括药物治疗后的所述器官的亚区的轮廓信息、药物治疗后的所述器官的相邻亚区的组合的轮廓信息中的至少一个。
15.优选地,所述形变场确定模块,具体用于从所述第一轮廓集中至少选取药物治疗前的所述肿瘤所在亚区的轮廓信息;相应地,从所述第二轮廓集中至少选取药物治疗后的所述肿瘤所在亚区的轮廓信息;利用形变配准模型,对已选取的轮廓信息进行形变配准,得到所述形变场。
16.优选地,所述靶区轮廓确定模块,具体用于利用所述形变场,对所述药物治疗前的肿瘤靶区轮廓集进行转换,得到转换后的肿瘤靶区轮廓集作为药物治疗后的肿瘤靶区轮廓集。
17.优选地,所述系统还包括:输出模块,用于输出所述药物治疗后的肿瘤靶区轮廓集,以便基于输出的药物治疗后的肿瘤靶区轮廓集实施相应的临床操作。
18.本发明实施例提供了一种药物治疗后的肿瘤治疗控制系统,所述系统包括前述的确定药物治疗后的肿瘤靶区轮廓集的系统。
19.本发明实施例提供了一种存储介质,所述存储介质上存储程序,所述程序被处理器执行时实现以下步骤:获取药物治疗前的肿瘤靶区轮廓集以及与所述肿瘤所在器官有关的第一轮廓集;获取药物治疗后的与所述肿瘤所在器官有关的第二轮廓集;根据所述第一轮廓集和所述第二轮廓集,确定能够将所述第一轮廓集转换为所述第二轮廓集的形变场;根据所述形变场和所述药物治疗前的肿瘤靶区轮廓集,确定药物治疗后的肿瘤靶区轮廓集。
20.优选地,所述药物治疗前的与所述肿瘤所在器官有关的第一轮廓集包括药物治疗前的所述器官的亚区的轮廓信息、药物治疗前的所述器官的相邻亚区的组合的轮廓信息中的至少一个;所述药物治疗后的与所述肿瘤所在器官有关的第二轮廓集包括药物治疗后的所述器官的亚区的轮廓信息、药物治疗后的所述器官的相邻亚区的组合的轮廓信息中的至
少一个。
21.优选地,所述程序被处理器执行时实现的根据所述第一轮廓集和所述第二轮廓集,确定能够将所述第一轮廓集转换为所述第二轮廓集的形变场的步骤包括:从所述第一轮廓集中至少选取药物治疗前的所述肿瘤所在亚区的轮廓信息;相应地,从所述第二轮廓集中至少选取药物治疗后的所述肿瘤所在亚区的轮廓信息;利用形变配准模型,对已选取的轮廓信息进行形变配准,得到所述形变场。
22.优选地,所述程序被处理器执行时实现的根据所述形变场和所述药物治疗前的肿瘤靶区轮廓集,确定药物治疗后的肿瘤靶区轮廓集的步骤包括:利用所述形变场,对所述药物治疗前的肿瘤靶区轮廓集进行转换,得到转换后的肿瘤靶区轮廓集作为药物治疗后的肿瘤靶区轮廓集。
23.优选地,所述程序被处理器执行时还实现以下步骤:输出所述药物治疗后的肿瘤靶区轮廓集,以便基于输出的药物治疗后的肿瘤靶区轮廓集实施相应的临床操作。
24.本发明实施例提供的一种确定药物治疗后的肿瘤靶区轮廓集的系统及存储介质,其根据药物治疗前的与所述肿瘤所在器官有关的第一轮廓集和药物治疗后的与所述肿瘤所在器官有关的所述第二轮廓集,确定能够将所述第一轮廓集转换为所述第二轮廓集的形变场,并根据所述形变场和所述药物治疗前的肿瘤靶区轮廓集,确定药物治疗后的肿瘤靶区轮廓集,这样,由药物治疗后的肿瘤靶区轮廓集确定的药物治疗后的肿瘤靶区更准确,在常规放射治疗、近距离放疗、消融治疗,或进行穿刺时不仅临床上能有效的精准定位肿瘤范围,还可降低实施过程中各类副反应的发生概率。
附图说明
25.图1是相关技术对药物治疗后患者进行肿瘤治疗的流程图;
26.图2a是本发明实施例提供的一种确定药物治疗后的肿瘤靶区轮廓集的系统的结构框图;
27.图2b是基于图2a的系统对药物治疗后患者进行肿瘤治疗的流程图;
28.图2c和2d是治疗前mri肿瘤靶区轮廓,利用图2a的系统确定的药物治疗后的肿瘤靶区轮廓,术后病理切片轮廓(金标准)的第一对比图和第二对比图;
29.图3是本发明实施例提供的对药物治疗后患者的常规放射治疗流程图;
30.图4是本发明实施例提供的生成药物治疗后肿瘤靶区轮廓集的流程图;
31.图5a是本发明实施例提供的用于形变配准的原图像和目标图像;
32.图5b是本发明实施例提供的原图像和目标图像之间建立的形变场;
33.图6a、6b、6c分别是内分泌治疗前的小野高清t2wi序列图像,dwi序列图像,adc序列图像;
34.图7a、7b、7c分别是内分泌治疗后的小野高清t2wi序列图像,dwi序列图像,adc序列图像;
35.图8a、8b、8c、8d分别是内分泌治疗前的各个亚区集及肿瘤体积图,内分泌治疗后的各个亚区集体积图,内分泌治疗后的亚区集及形变出的肿瘤轮廓图,内分泌治疗后的亚区集及形变出的肿瘤体积图;
36.图9a、9b、9c分别是内分泌治疗后的带tb轮廓集的小野高清t2wi序列图像,dwi序
列图像,adc序列图像;
37.图10a、10b、10c、10d分别是放疗计划专用的ct图像,拟与ct融合前调整颜色后的mri原始图像、ct与mri的融合图像、与ct配准后的mri图像。
具体实施方式
38.应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
39.在后续的描述中,使用用于表示元件的诸如“模块”、“部件”或“单元”的后缀仅为了有利于本发明的说明,其本身没有特有的意义。因此,“模块”、“部件”或“单元”可以混合地使用。
40.本发明提出一种生成药物治疗后肿瘤靶区轮廓集的系统,该系统可以利用药物治疗前后肿瘤所在器官的轮廓、所述器官各亚区的轮廓、各亚区组合的轮廓,建立药物治疗前后轮廓之间的转换关系,进而利用该转换关系处理药物治疗前肿瘤靶区轮廓集,得到药物治疗后肿瘤靶区轮廓集,解决了肿瘤靶区经药物治疗后难以被准确识别并勾画的问题。
41.图2a是本发明实施例提供的一种确定药物治疗后的肿瘤靶区轮廓集的系统的结构框图,如图2a所示,所述系统可以包括:第一获取模块10,第二获取模块20,形变场确定模块30,靶区轮廓确定模块40。
42.所述第一获取模块10,用于获取药物治疗前的肿瘤靶区轮廓集以及与所述肿瘤所在器官有关的第一轮廓集。
43.所述第一轮廓集可以包括药物治疗前的所述器官的亚区的轮廓信息和药物治疗前的所述器官的相邻亚区的组合的轮廓信息中的至少一个。具体实施时,可以根据需要获取药物治疗前的轮廓信息,本发明对此不做限制,例如,如果肿瘤分布在某个亚区,则可以仅获取肿瘤所在亚区的轮廓信息,也可以获取所述器官的每个亚区的轮廓信息,如果亚区轮廓不清,难以辨别,则可以获取相邻亚区的组合的轮廓信息,以得到可辨别的轮廓为准。
44.另外,所述第一轮廓集还可以包括与肿瘤所在器官的解剖结构相关的其他组织或器官的轮廓信息,例如与前列腺解剖结构密切相关的精囊腺的轮廓信息。
45.所述第二获取模块20,用于获取药物治疗后的与所述肿瘤所在器官有关的第二轮廓集。
46.所述第二轮廓集可以包括药物治疗后的所述器官的亚区的轮廓信息、药物治疗后的所述器官的相邻亚区的组合的轮廓信息中的至少一个。具体实施时,可以根据需要获取药物治疗后的轮廓信息,本发明对此不做限制,例如,如果肿瘤分布在某个亚区,则可以仅获取肿瘤所在亚区的轮廓信息,也可以获取所述器官的每个亚区的轮廓信息,如果亚区轮廓不清,难以辨别,则可以获取相邻亚区的组合的轮廓信息,以得到可辨别的轮廓为准。
47.所述形变场确定模块30,用于根据所述第一轮廓集和所述第二轮廓集,确定能够将所述第一轮廓集转换为所述第二轮廓集的形变场。具体地说,所述形变场确定模块30从所述第一轮廓集中至少选取药物治疗前的所述肿瘤所在亚区的轮廓信息;相应地,从所述第二轮廓集中至少选取药物治疗后的所述肿瘤所在亚区的轮廓信息;利用形变配准模型,对已选取的轮廓信息进行形变配准,得到所述形变场。
48.假设一肿瘤生长在器官的亚区内,所述形变场确定模块30分别从所述第一轮廓集和所述第二轮廓集中选取药物治疗前的所述肿瘤所在亚区的轮廓信息和药物治疗后的所
述肿瘤所在亚区的轮廓信息,并利用形变配准模型,对药物治疗前后的所述肿瘤所在亚区的轮廓信息进行形变配准,得到能够将药物治疗前的所述肿瘤所在亚区的轮廓信息转换为药物治疗后的所述肿瘤所在亚区的轮廓信息的形变场。
49.假设一肿瘤生长在器官的相邻亚区内,所述形变场确定模块30分别从所述第一轮廓集和所述第二轮廓集中选取药物治疗前的所述肿瘤所在相邻亚区组合的轮廓信息和药物治疗后的所述肿瘤所在亚区组合的轮廓信息,并利用形变配准模型,对药物治疗前后的所述肿瘤所在亚区组合的轮廓信息进行形变配准,得到能够将药物治疗前的所述肿瘤所在亚区组合的轮廓信息转换为药物治疗后的所述肿瘤所在亚区组合的轮廓信息的形变场。
50.需要指出的是,所述形变场确定模块30形变配准所采用的轮廓信息必须包括肿瘤所在亚区的轮廓信息或肿瘤所在亚区组合的轮廓信息,其他亚区的轮廓信息或其他亚区组合的轮廓信息选用与否由医生视情况而定,例如,必要时,所述形变场确定模块30可以利用形变配准模型,对所述第一轮廓集和所述第二轮廓集中的所有轮廓信息进行形变配准,得到形变场。
51.所述靶区轮廓确定模块40,用于根据所述形变场和所述药物治疗前的肿瘤靶区轮廓集,确定药物治疗后的肿瘤靶区轮廓集。具体地说,所述靶区轮廓确定模块,具体用于利用所述形变场,对所述药物治疗前的肿瘤靶区轮廓集进行转换,得到转换后的肿瘤靶区轮廓集作为药物治疗后的肿瘤靶区轮廓集。
52.所述系统还可以包括:输出模块50,该输出模块50用于输出所述药物治疗后的肿瘤靶区轮廓集,以便基于输出的药物治疗后的肿瘤靶区轮廓集实施相应的临床操作,例如实施常规放疗,近距离放疗,消融治疗,或穿刺。
53.图2b是基于图2a的系统对药物治疗后患者进行肿瘤治疗的流程图,如图2b所示,步骤可以包括:
54.步骤s201:获取药物治疗前的医学影像集、药物治疗前的肿瘤靶区轮廓集以及与所述肿瘤所在器官有关的第一轮廓集。
55.步骤s202:获取药物治疗后的医学影像集、药物治疗后的与所述肿瘤所在器官有关的第二轮廓集。
56.步骤s203:根据所述第一轮廓集和所述第二轮廓集,确定能够将所述第一轮廓集转换为所述第二轮廓集的形变场。
57.步骤s204:根据所述形变场和所述药物治疗前的肿瘤靶区轮廓集,在药物治疗后医学影像集的定位影像或引导影像上确定药物治疗后的肿瘤靶区轮廓集。
58.步骤s205:输出所述药物治疗后的肿瘤靶区轮廓集,以用于实施后续的临床操作。
59.上述步骤s201-s205可分别由图2a所示的第一获取模块10,第二获取模块20,形变场确定模块30,靶区轮廓确定模块40及输出模块50实现。
60.图2c和2d是治疗前mri肿瘤靶区轮廓,利用图2a的系统确定的药物治疗后的肿瘤靶区轮廓,术后病理切片轮廓(金标准)的第一对比图和第二对比图,如图2c和图2d所示,ta是药物治疗前的肿瘤靶区轮廓,tb是本发明确定的药物治疗后的肿瘤靶区轮廓。可以看出,tb与术后病理切片轮廓(金标准)相似度高,说明本发明确定并勾画的药物治疗后的肿瘤靶区准确度高。相对于已有技术人工勾画的肿瘤轮廓或将肿瘤靶区拟照射范围扩大至包括该肿瘤靶区的整个解剖部位,本发明确定的药物治疗后的肿瘤靶区轮廓集更准确,使得在临
床操作时(包括常规放射治疗、近距离放疗、消融治疗,或穿刺)不仅临床上能有效的精准定位肿瘤范围,还可降低实施过程中各类副反应的发生概率。
61.本发明实施例还提供了一种药物治疗后的肿瘤治疗控制系统,所述系统可以包括前述的确定药物治疗后的肿瘤靶区轮廓集的系统。
62.需要指出的是,该肿瘤治疗控制系统可以是常规放疗控制系统,也可以是肿瘤靶向穿刺、射频消融术、粒子植入等近距离放疗等涉及的其他肿瘤治疗控制系统。例如,所述药物治疗后的肿瘤治疗控制系统是药物治疗后的常规放疗控制系统,其利用前述的确定药物治疗后的肿瘤靶区轮廓集的系统确定药物治疗后的呈弥散状的肿瘤的轮廓,进而在常规放射治疗时既能保证对肿瘤的处方剂量,又能降低对危及器官的照射剂量。又例如,所述药物治疗后的肿瘤治疗控制系统是药物治疗后的肿瘤靶向穿刺有关的系统,其利用前述的确定药物治疗后的肿瘤靶区轮廓集的系统确定药物治疗后的呈弥散状的肿瘤的轮廓,从而在肿瘤穿刺活检时,精准导航到肿瘤部位,使得穿刺范围小,或者穿刺点少,精准并且减轻了患者创伤。
63.下面以常规放疗为例,结合图3至图10d对本发明进行详细说明。
64.图3是本发明实施例提供的对药物治疗后患者的常规放射治疗流程图,与图1的已有技术比较,本实施例可生成药物治疗后的肿瘤靶区轮廓集,如图3所示,步骤包括:
65.步骤s201:获取图像及相关临床数据。
66.获取药物治疗前的医学影像集、药物治疗后的医学影像集以及相关临床数据。其中,药物治疗后医学影像集包含至少一套用于勾画轮廓和计划设计的定位影像,相关临床数据包括如年龄、病史、病理报告、影像报告及检验报告等。
67.步骤s202:设计治疗方案。
68.根据步骤s201获取的图像及相关临床数据,设计治疗方案。所述治疗方案一般包括肿瘤靶区拟照射范围、处方剂量、分次剂量、剂量限值等。
69.本实施例中,对于治疗方案中的肿瘤靶区拟照射范围,将设计为药物治疗后的肿瘤靶区轮廓,而非包含该肿瘤靶区的整个解剖部位。如对于前列腺癌,治疗区域就不再是包含该肿瘤靶区的整个解剖部位,而是内分泌治疗后的肿瘤轮廓。该照射范围的体积往往较小,并且更远离相关的危及器官,这样将带来两方面的临床获益:其一,在设计处方剂量和分次剂量时,由于照射范围距离相关危及器官更远,因此临床上有机会增大该照射范围的处方剂量和分次剂量,以便有效地实施高剂量、根治性放疗;其二,在治疗计划设计时,由于该照射范围较小,因此有机会有效地降低相关危及器官的照射剂量,从而减小治疗实施过程中危及器官毒副反应发生的概率。
70.步骤s203:生成药物治疗后的肿瘤靶区轮廓集。
71.根据步骤s203设计的肿瘤靶区拟照射范围,在药物治疗后的医学影像集的定位影像上确定肿瘤靶区轮廓。
72.步骤s204:勾画危及器官或正常组织轮廓。
73.根据步骤s203设计的肿瘤靶区拟照射范围,在药物治疗后的医学影像集的定位影像上勾画危及器官(0rgan at risk,oar)轮廓集。一般而言,oar指的是各个相关危及器官或称周围正常组织的轮廓,比如前列腺癌放疗时,oar一般包括直肠、膀胱、小肠、股骨头等。
74.步骤s205:设计治疗计划。
75.与已有方案相同,即根据上述步骤中的治疗方案和轮廓,利用放射治疗计划系统,设计治疗计划并生成放射治疗机器可识别的计划执行文件。
76.步骤s206:治疗实施。
77.与已有方案相同,即利用上述步骤生成的计划执行文件,在放射治疗机器上实施放射治疗。
78.图4是本发明实施例提供的生成药物治疗后肿瘤靶区轮廓集的流程图,如图4所示,涉及输入模块、处理模块和输出模块,其中,所述输入模块可实现如图2的第一获取模块10和第二获取模块20的功能,所述处理模块可实现图2的形变场确定模块30和靶区轮廓确定模块40的功能,所述输出模块可实现图2的输出模块50的功能。
79.一、输入模块
80.所述输入模块输入以下内容:
81.(1)药物治疗前的医学影像集ia及基于该影像集勾画的用于形变配准的亚区轮廓集pa(包含n个轮廓,p
a,1
、p
a,2
、
……
、p
a,n
)和肿瘤靶区轮廓集ta(包含m个轮廓,t
a,1
、t
a,2
、
……
、t
a,m
)。
82.药物治疗前医学影像集ia是指,患者进行药物治疗前采集的医学影像的集合,根据肿瘤部位和类别选择使用ct影像、磁共振影像、核医学影像或超声影像中的至少一种,如前列腺癌则选择磁共振图像,如有需要,其余图像则可作为勾画轮廓时的参考。这些影像可以是二维影像、三维影像或四维影像,以三维影像为例,如果将影像上的每一个像素点视为矩阵中的一个元素,则此三维影像在数学上可以被视为一个三维矩阵,该矩阵中某层某行某列的元素数值与三维影像中所对应的某层某行某列的像素值相等。
83.用于形变配准的亚区轮廓集pa是指在所述处理模块形变配准中要用到的各个轮廓,共包含n个亚区轮廓,记为pa1、pa,2、
……
、pa,n。这个轮廓集的覆盖范围必须要包含肿瘤靶区轮廓集ta,即从三维体积上看,肿瘤靶区轮廓集ta构成的几何体是亚区轮廓集pa构成的几何体的一个子集。以前列腺癌为例,肿瘤靶区一定位于前列腺结构中,因此,这里需要勾画的用于形变配准的亚区轮廓集可以包括前列腺解剖结构的五个亚区:外周带(pz)、移行带(tz)、中央带(cz)、前纤维基质带(afs),以及中央的尿道(us),如某些亚区不太容易辨别,也可以是相邻的组合,如tz cz,同时也可以包括与前列腺解剖结构密切相关的精囊腺(sv)。
84.在药物治疗前,医生可以凭借临床知识在上述医学影像集上将肿瘤靶区界限识别出来。所述的肿瘤靶区可能是一个独立的靶区,也可能是多个分散的靶区,因此需要勾画出肿瘤靶区轮廓集ta,共包含m个肿瘤靶区轮廓,记为t
a,1
、t
a,2
、
……
、t
a,m
。其中,勾画轮廓,在数学上的意义为,将影像三维矩阵中的某些元素赋予相同的标签,该标签与所要勾画的轮廓相对应,这样,三维影像上与这些矩阵元素对应的像素点也具有相同的标签,而这些像素点在三维影像上就会组成一个具有三维体积的几何结构体,将这个几何结构体称之为轮廓,而这个操作过程称为勾画轮廓。
85.(2)药物治疗后的医学影像集ib及基于该影像集勾画的用于形变配准的亚区轮廓集pb(包含n个轮廓,p
b,1
、p
b,2
、
……
、p
b,n
)。
86.药物治疗后的医学影像集ib是指,患者进行药物治疗后采集的医学影像的集合,包括但不限于ct影像、磁共振影像、核医学影像、超声影像等。
87.用于形变配准的亚区轮廓集pb是指在后续形变配准中要用到的各个轮廓,共包含n个亚区轮廓,记为p
b,1
、p
b,2
、
……
、p
b,n
,并且这n个轮廓与pa中的n个轮廓p
a,1
、p
a,2
、
……
、p
a,n
是一一对应的。以前列腺癌为例,如果pa包含外周带(pz)、移行带(tz)、中央带(cz)、前纤维基质带(afs)、中央的尿道(us)和精囊腺(sv),或者相邻的组合,如tz cz,那么pb也要包含外周带(pz)、移行带(tz)、中央带(cz)、前纤维基质带(afs)、中央的尿道(us)和精囊腺(sv),或者是相邻的组合,如tz cz。
88.由于药物治疗后的肿瘤靶区在药物治疗后医学影像集上呈弥散状,其轮廓边界难以通过现有的临床医学知识直接从医学影像上识别出来,因此本发明实施例通过建立pa与pb的映射关系,将pa的子集ta映射到药物治疗后医学影像集上,从而生成药物治疗后的肿瘤靶区轮廓集tb。
89.(3)形变配准模型m的参数集c(包含k个参数,c1、c2、
……
、ck)。
90.形变配准模型m可以采用已有模型,为已知技术。形变配准模型m的参数集c为与所选取的模型m相对应的参数集合,同样为已知技术。以demons形变配准模型为例,其参数包括但不限于迭代层级数目、最大迭代次数、扩散速度系数、相似度指标等。
91.二、处理模块
92.所述处理模块执行以下步骤:
93.步骤1:使用具有预设的参数集c的形变配准模型m,对轮廓集pa与轮廓集pb进行形变配准,得到形变场d。
94.预设的参数集c是与选取的形变配准模型相关的,以demons形变配准模型为例,其参数包括但不限于迭代层级数目、最大迭代次数、扩散速度系数、相似度指标等。对于模型参数具体的赋值,可以采用默认值,也可以采用本领域的常见技术为参数赋值,比如针对不同病例通过人工尝试、迭代搜索的方法寻找合适的参数值,或者利用人工智能的方法训练得到针对某一病种的参数值。
95.形变配准是利用图像中的某些特征(如标记点坐标、像素值等),通过优化算法,为原图像和目标图像之间建立一种映射关系,通过这个映射关系,可以得到一个原图像的映射图像,并且该映射图像与目标图像的相似程度很高,满足优化算法预先设定的相似度指标。这个映射关系通常被称为形变场,所述映射的过程被称为配准,由于图像之间通常存在形状上的差异,因此常被称为形变配准。一般来说,形变场符合仿射变换(affine transformation),是一种二维/三维坐标之间的线性变换,可以通过一系列子变换的复合叠加来实现,包括:平移(translation)、缩放(scale)、翻转(flip)、旋转(rotation)和剪切(shear)。从数学上讲,形变配准就是通过优化搜索算法得到一个仿射变换矩阵,将该矩阵作用于原图像后可以得到与目标图像相似程度很高的配准后图像。显然,原图像中的任何子图像区域都可以通过该形变场,得到形变配准后的子图像区域,并映射到目标图像上。
96.图5a和图5b为形变配准的一个说明示例。原图像与目标图像分别为不同形状的三角形,现在需要建立一个形变场,使得原图像三角形中的每一个点都可以以仿射变换的方式,映射到目标图像三角形中的每一个对应的点上。这个例子中,该形变场为一个小菱形,通过将这个小菱形作用于原图像上,就会使原图像产生缩小、剪切两种子变换,这两种子变换叠加的效果,就是将原图像三角形映射成了目标图像三角形,这个过程就叫做形变配准。可以看到,通过这个形变场,不仅外部大三角形顶点可以一一映射,并且内部的小三角形顶
点也是可以一一映射的。
97.结合本发明实施例,如果将外部大三角形视为用于形变配准的亚区轮廓集,将内部小三角形视为肿瘤靶区轮廓集,那么就可以通过对亚区轮廓集的形变配准,将药物治疗前医学影像集中的肿瘤靶区轮廓集映射到药物治疗后医学影像集中。
98.步骤2:将形变场d作用于轮廓集ta,得到形变后的轮廓集tb(包含m个轮廓,t
b,1
、t
b,2
、
……
、t
b,m
),作为药物治疗后的肿瘤靶区轮廓集。
99.tb所包含的m个轮廓与ta所包含的m个轮廓是一一对应的,通过形变场d一一映射到影像集ib中。
100.将形变场d作用于轮廓集ta,这里的“作用”是指对ta做一个仿射变换,或者说,做一个矩阵运算,通常为仿射变换矩阵与图像矩阵的乘积。当然,这里所述的“作用”,也是现有形变配准模型中的一部分,即一个正向变换函数,直接应用此函数就可以实现这个上述“作用”的过程。
101.步骤3:将轮廓集tb集成到药物治疗后的医学影像集ib中。
102.药物治疗后的医学影像集包含至少一套用于勾画轮廓和计划设计的定位影像,因而步骤3具体指将轮廓集tb集成到ib中的用于勾画轮廓和计划设计的定位影像上。
103.其中,集成的方法有很多种,本领域常用的方法是将影像集ib存储为dicom格式的文件(dicom是医学领域数据的通用格式),然后利用dicom文件的写入规则或者利用现有的软件或函数,将轮廓集tb写成另一个dicom文件,该文件可以与ib的dicom文件相匹配(要求包括但不限于头文件信息匹配),这样就可以将ib和tb的dicom文件同时导入计划系统或相关放疗软件中,做后续的勾画轮廓和计划设计工作。当然,也可以采用其他已有技术实现“集成”的操作。
104.三、输出模块
105.所述输出模块用于输出包含药物治疗后肿瘤靶区轮廓集tb的药物治疗后医学影像集ib。
106.这里的输出可以是一套相匹配的dicom文件,也可以是直接在计划系统上同时显示影像集ib和轮廓集tb。
107.应用实例:
108.因前列腺解剖包括5个亚区,分别为外周带(pz)、移行带(tz)、中央带(cz)、前纤维基质带(afs),以及中央的尿道(us),分区更加复杂,解决前列腺癌及其各个亚区形变则可涵盖其他解剖相对简单的肿瘤,故本应用实例以前列腺癌为例。
109.将图3的对药物治疗后患者的常规放疗流程应用于前列腺癌时的处理流程可以包括:
110.步骤s301:获取图像及相关临床数据。
111.获取某例前列腺癌患者内分泌治疗前、内分泌治疗后的多参数磁共振(multiparameter magnetic resonance image,mpmri)图像,以及放疗定位时采用的用于勾画轮廓及计划设计的定位ct图像,临床数据。
112.其中,所述多参数磁共振图像包括以下不同的序列:小野高清t2加权(t2wi)序列图像、弥散加权成像(diffusion weighted imaging,dwi)、表观扩散系数(apparent diffusion coefficient,adc)图像。
113.其中,临床数据包括年龄、病理报告、影像报告和肿瘤标志物前列腺特异性抗原(prostate-specific antigen,psa)。
114.步骤s302:设计治疗方案。
115.根据已获取的药物治疗前医学影像集、药物治疗后医学影像集以及相关临床数据,设计治疗方案。所述治疗方案一般包括肿瘤靶区拟照射范围、处方剂量、分次剂量、剂量限值等。例如根据步骤s301中获取的患者的基本资料,确定患者的分期、危险度分级并进行放疗方案设计。假设该患者属于极高危前列腺癌,但年老,身体状态差,因此肿瘤靶区拟给予70gy高剂量照射,前列腺及精囊区给予65gy照射,分次均为25次,以保证即能控制肿瘤,又不至于损伤周围器官。
116.步骤s303:生成内分泌治疗后的前列腺肿瘤靶区轮廓集。
117.步骤s304:勾画危及器官(0rgan at risk,0ar)轮廓。
118.在药物治疗后医学影像集的定位影像上勾画oar,得到oar轮廓集。一般而言,oar指的是各个相关危及器官或称周围正常组织,比如前列腺癌放疗时,oar一般包括直肠、膀胱、小肠、股骨头等,所以勾画oar轮廓包括勾画直肠、膀胱、小肠、股骨头等需要保护的危及器官的轮廓。
119.步骤s305:设计治疗计划。
120.根据治疗方案及肿瘤轮廓,利用放疗专用的治疗计划系统,设计该例患者治疗计划并生成治疗机器可识别的计划执行文件。
121.步骤s306:治疗实施。
122.利用步骤s305生成的计划执行文件,在放射治疗机器上实施放射治疗。
123.下面结合图4详细说明步骤s303生成内分泌治疗后前列腺肿瘤靶区轮廓集的过程,如图4所示,
124.一、输入模块
125.1、输入已勾画的内分泌治疗前的各个轮廓集pa。
126.参考所有序列图像中的信号特点,在t2wi图像上勾画前列腺内的不同亚区集,包括外周带(pz)、前纤维基质带(afs),假设该患者的移行带(tz)及中央带(cz)不太容易辨别,故勾画tz cz,分别命名为pa,pz;pa,afs;pa,tz cz。
127.2、输入已勾画的肿瘤轮廓集ta。
128.内分泌治疗前的不同亚区轮廓及肿瘤轮廓如图6a、6b、6c所示,其中图6a是内分泌治疗前的小野高清t2wi序列图像,图6b是内分泌治疗前的dwi序列图像,图6c是内分泌治疗前的adc序列图像。
129.3、输入已勾画的内分泌治疗后的轮廓集pb。
130.勾画前列腺内的不同亚区集,包括外周带(pz)、前纤维基质带(afs)、以及移行带(tz) 中央带(cz),分别命名为pb,pz;pb,afs;pb,tz cz。
131.内分泌治疗后的不同亚区轮廓及肿瘤轮廓如图7a、7b、7c所示,其中图7a是内分泌治疗后的小野高清t2wi序列图像,图7b是内分泌治疗后的dwi序列图像,图7c是内分泌治疗后的adc序列图像。
132.4、输入形变配准模型m的参数集。
133.本应用实例的形变配准模型m采用demons形变配准模型,其参数包括迭代层级数
目(设置为3)、最大迭代次数(设置为100)、扩散速度系数(设置为1)、相似度指标(设置为mutual information index,交互式信息指数)。
134.二、处理模块
135.1、将轮廓集pa与轮廓集pb进行形变配准,得到形变场d;
136.2、将形变场d作用于ta,得到内分泌治疗后的肿瘤靶区轮廓集tb;
137.3、将tb集成到内分泌治疗后的mri图像中。
138.三、输出模块
139.包含内分泌治疗后肿瘤靶区轮廓集tb的mri图像,运行前后的图像集在系统中如图8a、8b、8c、8d所示,其中图8a为内分泌治疗前的各个亚区集及肿瘤体积图;图8b为内分泌治疗后的各个亚区集体积图;图8c为内分泌治疗后的亚区集及形变出的肿瘤轮廓图;图8d为内分泌治疗后的亚区集及形变出的肿瘤体积图。
140.将tb轮廓集传送回放射治疗计划系统,带tb轮廓集的mri图像包括图9a、9b、9c分别所示的内分泌治疗后的带tb轮廓集的小野高清t2wi序列图像,dwi序列图像,adc序列图像。
141.该图像可以利用现有的治疗计划系统匹配到计划所用的ct图像上,如图10a、10b、10c、10d所示,分别为放疗计划专用的ct图像,拟与ct融合前调整颜色后的mri原始图像(即,勾画及形变所用的mri图像)、ct与mri的融合图像、与ct配准后的mri图像。
142.以上给出了将确定药物治疗后的肿瘤靶区轮廓集的系统应用于常规放疗时的放疗实施详细过程,由于本发明能够更准确地确定的药物治疗后的肿瘤靶区轮廓集,因此能够保证对肿瘤的处方剂量,降低对危及器官的照射剂量。另外,确定药物治疗后的肿瘤靶区轮廓集的系统还可以应用于粒子植入等近距离放疗、消融治疗、穿刺,以上操作的实施过程比放疗实施过程简单,可以参考放疗实施过程应用。
143.本发明实施例还提供了一种存储介质,所述存储介质上存储程序,所述程序被处理器执行时实现以下步骤:获取药物治疗前的肿瘤靶区轮廓集以及与所述肿瘤所在器官有关的第一轮廓集;获取药物治疗后的与所述肿瘤所在器官有关的第二轮廓集;根据所述第一轮廓集和所述第二轮廓集,确定能够将所述第一轮廓集转换为所述第二轮廓集的形变场;根据所述形变场和所述药物治疗前的肿瘤靶区轮廓集,确定药物治疗后的肿瘤靶区轮廓集。
144.其中,所述第一轮廓集可以包括药物治疗前的所述器官的亚区的轮廓信息和药物治疗前的所述器官的相邻亚区的组合的轮廓信息中的至少一个。具体实施时,可以根据需要获取药物治疗前的轮廓信息,本发明对此不做限制,例如,如果肿瘤分布在某个亚区,则可以仅获取肿瘤所在亚区的轮廓信息,也可以获取所述器官的每个亚区的轮廓信息,如果亚区轮廓不清,难以辨别,则可以获取相邻亚区的组合的轮廓信息,以得到可辨别的轮廓为准。另外,所述第一轮廓集还可以包括与肿瘤所在器官的解剖结构相关的其他组织或器官的轮廓信息,例如与前列腺解剖结构密切相关的精囊腺的轮廓信息。
145.其中,所述第二轮廓集可以包括药物治疗后的所述器官的亚区的轮廓信息、药物治疗后的所述器官的相邻亚区的组合的轮廓信息中的至少一个。具体实施时,可以根据需要获取药物治疗后的轮廓信息,本发明对此不做限制,例如,如果肿瘤分布在某个亚区,则可以仅获取肿瘤所在亚区的轮廓信息,也可以获取所述器官的每个亚区的轮廓信息,如果
亚区轮廓不清,难以辨别,则可以获取相邻亚区的组合的轮廓信息,以得到可辨别的轮廓为准。
146.其中,所述程序被处理器执行时实现的根据所述第一轮廓集和所述第二轮廓集,确定能够将所述第一轮廓集转换为所述第二轮廓集的形变场的步骤包括:从所述第一轮廓集中至少选取药物治疗前的所述肿瘤所在亚区的轮廓信息;相应地,从所述第二轮廓集中至少选取药物治疗后的所述肿瘤所在亚区的轮廓信息;利用形变配准模型,对已选取的轮廓信息进行形变配准,得到所述形变场。例如,如果一肿瘤单独生长在器官的亚区内,可以从所述第一轮廓集和所述第二轮廓集中选取药物治疗前的所述肿瘤所在亚区的轮廓信息和药物治疗后的所述肿瘤所在亚区的轮廓信息,并利用形变配准模型,对药物治疗前后的所述肿瘤所在亚区的轮廓信息进行形变配准,得到能够将药物治疗前的所述肿瘤所在亚区的轮廓信息转换为药物治疗后的所述肿瘤所在亚区的轮廓信息的形变场。又例如,一肿瘤生长在器官的相邻亚区内,可以从所述第一轮廓集和所述第二轮廓集中选取药物治疗前的所述肿瘤所在相邻亚区组合的轮廓信息和药物治疗后的所述肿瘤所在亚区组合的轮廓信息,并利用形变配准模型,对药物治疗前后的所述肿瘤所在亚区组合的轮廓信息进行形变配准,得到能够将药物治疗前的所述肿瘤所在亚区组合的轮廓信息转换为药物治疗后的所述肿瘤所在亚区组合的轮廓信息的形变场。需要指出的是,形变配准所采用的轮廓信息必须包括肿瘤所在亚区的轮廓信息或肿瘤所在亚区组合的轮廓信息,其他亚区的轮廓信息或其他亚区组合的轮廓信息选用与否由医生视情况而定,例如,必要时,所述形变场确定模块30可以利用形变配准模型,对所述第一轮廓集和所述第二轮廓集中的所有轮廓信息进行形变配准,得到形变场。
147.其中,所述程序被处理器执行时实现的根据所述形变场和所述药物治疗前的肿瘤靶区轮廓集,确定药物治疗后的肿瘤靶区轮廓集的步骤包括:利用所述形变场,对所述药物治疗前的肿瘤靶区轮廓集进行转换,得到转换后的肿瘤靶区轮廓集作为药物治疗后的肿瘤靶区轮廓集。
148.所述程序被处理器执行时还实现以下步骤:输出所述药物治疗后的肿瘤靶区轮廓集,以便基于输出的药物治疗后的肿瘤靶区轮廓集实施相应的临床操作,例如实施常规放疗,或粒子植入等近距离放疗,或消融治疗,或穿刺。
149.相对于已有技术人工勾画的肿瘤轮廓或将肿瘤靶区拟照射范围扩大至包括该肿瘤靶区的整个解剖部位,本实施例确定的药物治疗后的肿瘤靶区轮廓集更准确,能够保证对肿瘤的处方剂量,降低对危及器官的照射剂量。
150.其中,上述存储介质可以包括计算机存储介质(或非暂时性介质),如本领域普通技术人员公知的,术语计算机存储介质包括在用于存储信息(诸如计算机可读指令、数据结构、程序模块或其他数据)的任何方法或技术中实施的易失性和非易失性、可移除和不可移除介质。存储介质包括但不限于ram、rom、eeprom、闪存或其他存储器技术、cd-rom、数字多功能盘(dvd)或其他光盘存储、磁盒、磁带、磁盘存储或其他磁存储装置、或者可以用于存储期望的信息并且可以被计算机访问的任何其他的介质。
151.以上参照附图说明了本发明的实施例,并非因此局限本发明的权利范围。本领域技术人员不脱离本发明的范围和实质内所作的任何修改、等同替换和改进,均应在本发明的权利范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。