鉴别地中海贫血
ααα
anti4.2杂合型和hk
αα
杂合型的方法和试剂盒
技术领域
1.本发明属于基因检测技术领域,具体的,涉及一种鉴别地中海贫血αα/αααanti4.2和αα/hkαα基因型的方法和试剂盒。
背景技术:
2.地中海贫血(简称地贫)是一种常见的溶血性单基因遗传病。该病是由于珠蛋白基因的缺陷使血红蛋白中的珠蛋白肽链有一种或几种合成减少或不能合成,致使血红蛋白的组成成分比例失衡,进而导致血红蛋白不稳定,红细胞容易破裂从而引发溶血性贫血。根据缺陷的珠蛋白基因不同,地贫有多种类型,主要类型为α地中海贫血(简称α地贫)和β地中海贫血(简称β地贫)。珠蛋白基因在染色体上以基因簇的形式存在,α珠蛋白基因簇定位于16号染色体16p13.3,α地贫主要由α-珠蛋白基因(hba1、hba2基因)缺失引起,少数由α-珠蛋白基因突变引起。β珠蛋白基因簇定位于11号染色体11p15.3,β地贫主要由β-珠蛋白基因(hbb基因)突变引起,包括点突变及微小插入/缺失,少数的β地贫由β-珠蛋白基因簇上的大片段缺失引起。
3.在我国常见的α地贫缺失类型主要有-α3.7、-α4.2、
‑‑
sea等,它们主要是α珠蛋白基因簇同源序列不等交换的结果。α珠蛋白基因簇上两个高度同源的重复单元中包含x、y和z同源区,同源z区重组交换致使一条染色体缺失3.7kb,另一条染色体则形成α珠蛋白基因αααanti3.7三联体。同源x区重组交换致使一条染色体缺失4.2kb,另一条染色体则形成α珠蛋白基因αααanti4.2三联体。β-地贫分为重型、轻型和中间型3种,其中,当β-地贫杂合子合并α珠蛋白基因三联体时,可加剧珠蛋白失衡的情况,使患者由无临床症状转变为中间型地贫。
4.在αααanti3.7和αααanti4.2基础上进一步发生非平衡交叉可能产生多种复杂基因重复序列。hkαα是由-α3.7型缺失和αααanti4.2三联体不平等交换重排结合而成的一种α-珠蛋白基因簇,同时含有-α3.7和anti4.2片段。虽然hkαα同时含有-α3.7和anti4.2片段,但αα/hkαα血液学表型无明显异常。因hkαα及-α3.7型缺失携带者均存在-α3.7片段,故通过常规gap-pcr法检测,hkαα携带者会被误诊为-α3.7型缺失携带者。
5.对α珠蛋白基因αααanti4.2三联体及hkαα进行检测,对于提早发现地贫异常基因的携带者,指导婚前及产前诊断具有重要的意义。
6.目前检测αααanti4.2三联体和hkαα的技术主要有以下几种。
7.1、琼脂糖凝胶电泳法:设计引物扩增anti4.2片段,通过琼脂糖凝胶电泳,判断是否存在anti4.2片段。因αααanti4.2和hkαα均包含anti4.2片段,因此这个技术不能鉴别αααanti4.2和hkαα。
8.2、巢式pcr:根据目标区域设计两对引物,外引物及内引物。使用外引物扩增获得pcr产物后,以pcr产物作为模板,再使用内引物进行pcr。将外引物及内引物的pcr产物进行琼脂糖凝胶电泳,根据条带有无及大小判断结果。一般使用此方法确认是否存在ααα
anti4.2或hkαα单倍型,但是仅此方法不能确定受检者的基因型,需要结合其他方法如gap-pcr或mlpa进行检测,如此一来,操作繁琐。
9.3、三代测序技术:通过设计引物扩增目标片段后进行建库,获得测序文库后进行三代测序。因为三代测序的长读长优势,可以直接测序鉴别αααanti4.2和hkαα基因型,但是该技术方法需要使用第三代测序仪,仪器昂贵,成本高,因此目前无法大范围推广。
10.现有技术分别存在不能明确基因型、操作繁琐、成本高的缺点。因此需要一种新的技术方法弥补现有技术缺点。
技术实现要素:
11.本发明目的在于提供一种鉴别αα/αααanti4.2和αα/hkαα基因型的检测引物组及其分析方法。
12.在本发明的第一方面,提供了一种多重pcr构建测序文库的检测方法,所述方法包括步骤:
13.s1:第一轮pcr
14.所述第一轮pcr过程中,使用第一引物、第二引物和第三引物对目标序列进行pcr扩增,获得第一轮pcr扩增产物;
15.其中,所述第一引物从5’端到3’端依次包括第一测序标签序列和目标序列特异性的正向引物序列;所述第二引物从5’端到3’端依次包括第二测序标签序列和目标序列特异性的反向引物序列;所述第三引物从5’端到3’端依次包括第一测序接头序列、样本标签序列、和第二测序标签序列;
16.s2:第二轮pcr
17.所述第二轮pcr过程中,使用第四引物和第五引物对所述第一轮pcr扩增产物进行pcr扩增,获得第二轮pcr扩增产物,经纯化后即得所述扩增子文库;
18.其中,所述第四引物从5’端到3’端依次包括第二测序接头序列和第一测序标签序列;所述第五引物为第一测序接头序列。
19.在一优选例中,所述步骤s1中,对多个样本来源的目标序列进行pcr扩增,并且针对不同样本来源的所述第三引物的样本标签序列各不相同,从而实现根据不同的样本标签序列区别不同样本。
20.在另一优选例中,所述步骤s1中,所述第一轮pcr为单重或多重pcr。
21.在另一优选例中,所述步骤s2中,所述第二轮pcr在同一pcr反应体系中进行。
22.在另一优选例中,所述第一轮pcr扩增产物的片段长度与高通量测序读长匹配。
23.在本发明的第二方面,提供了一种鉴别αα/αααanti4.2和αα/hkαα基因型的引物组合物,所述引物设计依据为:
24.αααanti4.2单倍型包含两个hba2基因、1个hba1基因及x1/x2融合而成的anti4.2片段;hkαα单倍型包含一个hba2基因、一个hba2/hba1融合基因及一个anti4.2片段;αα单倍型包含1个hba2基因及1个hba1基因。根据上述hba2和hba1基因reads比例的差异以及anti4.2片段的有无,进而能够达到鉴别αα/αααanti4.2和αα/hkαα基因型的目的(参见附图1-3)。
25.所述组合物包括如下所示的引物:
26.(1)特异性识别hba2、hba1基因的引物
27.设计引物对,所述引物对扩增片段包含hba2基因chr16:223447位置和hba1基因chr6:16:227251-227258位置;
28.(2)特异性识别x1/x2融合而成的anti4.2片段的引物
29.根据x1/x2融合而成的anti4.2片段序列,设计能够特异性结合的引物对。
30.在另一优选例中,所述特异性识别hba2、hba1的引物如下所示:
31.正向引物:gggagcgatctgggtcga(seq id no.1);
32.反向引物:gtgctcacagaagccagg(seq id no.2)。
33.在另一优选例中,所述特异性识别x1/x2融合而成的anti4.2片段的引物如下所示:
34.正向引物:tggtctttgaataaagtctgagt(seq id no.3);
35.反向引物:caccctcactccagccacc(seq id no.4)。
36.在另一优选例中,所述引物组合物中,各正向引物的5’端还包括第一测序标签序列。优选地,所述第一测序标签序列如seq id no.5所示。
37.在另一优选例中,所述引物组合物中,各反向引物的5’端还包括第二测序标签序列。优选地,所述第二测序标签序列如seq id no.6所示。
38.在本发明的第三方面,提供了本发明第二方面所述的引物组所述引物组合物在制备检测地中海贫血具体基因型的试剂盒中的应用。
39.在本发明的第四方面,提供了一种试剂盒,所述试剂盒包含本发明第二方面所述引物组合物。
40.在另一优选例中,所述试剂盒包括seq id no.1-4所示的引物。
41.在另一优选例中,各正向引物的5’端包括第一测序标签序列。
42.在另一优选例中,各反向引物的5’端包括第二测序标签序列。
43.在另一优选例中,所述第一测序标签序列如seq id no.5所示。
44.在另一优选例中,所述第二测序标签序列如seq id no.6所示。
45.在另一优选例中,所述试剂盒包括第一引物对和第二引物对,所述第一引物对包括第一正向引物和第一反向引物;所述第一正向引物的5’端到3’端依次为第一测序标签和seq id no.1所示核酸序列;所述第一反向引物自5’端至3’端依次为第二测序标签和seq id no.2所示核酸序列;
46.所述第二引物对包括第二正向引物和第二反向引物;所述第二正向引物的5’端到3’端依次为第一测序标签和seq id no.3所示核酸序列;所述第二反向引物自5’端至3’端依次为第二测序标签和seq id no.4所示核酸序列。
47.在另一优选例中,所述试剂盒还包括第三引物,所述第三引物的5’端到3’端依次包括第一测序接头序列、样本标签序列、和第二测序标签序列,其中所述样本标签序列被设置为根据不同的样本标签序列区别不同样本。
48.在另一优选例中,所述第一测序接头序列如seq id no.8所示。
49.在另一优选例中,所述第二测序接头序列如seq id no.7所示。
50.在另一优选例中,所述试剂盒包括第一引物对、和第二引物对的混合液。
51.在另一优选例中,所述试剂盒还包括第四引物和第五引物;所述第四引物的5’端
到3’端依次包括第二测序接头序列和第一测序标签序列;所述第五引物为第一测序接头序列。
52.在本发明的第五方面,提供了使用本发明第二、三、四方面所述的引物组合物和/或试剂盒鉴别αα/αααanti4.2和αα/hkαα基因型的方法,所述方法包括步骤:
53.(1)构建x1/x2融合而成的anti4.2片段和hba2、hba1基因扩增子文库。
54.设计引物对,针对hba2基因chr16:223447位置和hba1基因chr6:16:227251-227258位置设计特异性扩增引物,并且筛选扩增效率一致的引物;针对x1/x2融合而成的anti4.2片段的上游及下游设计引物对;
55.使用所述引物对样本核酸进行pcr扩增,获得x1/x2融合而成的anti4.2片段和hba2、hba1基因扩增子文库;
56.(2)测序并根据x1/x2融合而成的anti4.2片段的有无和hba2、hba1基因测序reads比例判断所述地中海贫血具体基因型。
57.在另一优选例中,所述引物对针对hba2基因和hba1基因的扩增效率一致。
58.在另一优选例中,所述步骤(2)中,判断方法如下表所示:
59.基因型anti4.2片段hba2与hba1基因reads比例αα/αα
×
2:2αα/hkαα√2:2αα/αααanti4.2√3:2
60.在另一优选例中,所述引物组合物包括seq id no.1、2、3、4所示的引物。
61.在另一优选例中,各所述正向引物的5’端还包括第一测序标签序列。
62.在另一优选例中,各所述反向引物的5’端还包括第二测序标签序列。
63.在另一优选例中,在引物组中还包含能够鉴别样本标签的第三引物。所述第三引物从5’端到3’端依次包括第一测序接头序列、样本标签序列、和第二测序标签序列。
64.在本发明的第六方面,提供了一种利用本发明第二、三、四、五方面所述引物和/或试剂盒构建鉴别αα/αααanti4.2和αα/hkαα基因型的扩增子文库的方法,所述方法包括如下步骤:
65.s1:第一轮pcr
66.所述第一轮pcr过程中,分别使用能够特异性识别和结合hba2、hba1以及x1/x2融合片段的引物组配制多重pcr反应体系,对目标序列进行pcr扩增,获得第一轮pcr扩增产物;
67.s2:第二轮pcr
68.所述第二轮pcr过程中,使用引物对所述第一轮pcr扩增产物进行pcr扩增,获得第二轮pcr扩增产物,经纯化后即得所述鉴别αα/αααanti4.2和αα/hkαα基因型的扩增子文库。
69.在另一优选例中,所述步骤s2)中引物为正向引物和反向引物,所述正向引物为第一测序接头和第一测序标签组成,反向引物为第二测序接头。
70.本发明具有如下有益效果。
71.1.本发明针对x1/x2融合而成的anti4.2片段、hba2及hba1基因设计引物,通过hba2、hba1的拷贝数变化及有无anti4.2片段,可以鉴别αα/αααanti4.2和αα/hkαα基因型。
72.2.本发明针对hba2和hba1设计了对两者扩增效率一致的特异性引物,所述引物扩
增准确,可直接通过hba2和hba1两者的reads比例确定hba2和hba1的拷贝数比例。
73.3、本发明基于高通量测序技术,通过多重扩增子建库,可以一次检测多个样本,通量高成本低。
附图说明
74.图1为αααanti3.7三联体基因示意图。
75.图2为αααanti4.2三联体基因示意图。
76.图3为hkαα基因示意图。
77.图4为多重pcr检测流程图。
具体实施方式
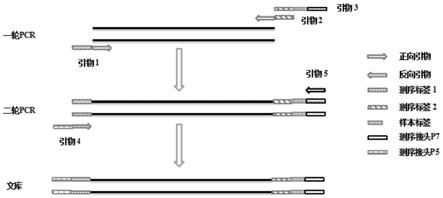
78.本发明人通过广泛而深入的研究,针对现有技术中αααanti4.2和hkαα基因型鉴别困难以及成本高,设计了一种操作简便且结果准确的鉴别方法,并使用所述方法进行基因文库的构建和αα/αααanti4.2和αα/hkαα基因型的鉴别。
79.在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,本发明的范围将仅由所附的权利要求书限制。
80.除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
81.虽然在本发明的实施或测试中可以使用与本发明中所述相似或等价的任何方法和材料,本文在此处例举优选的方法和材料。
82.多重pcr
83.多重pcr(multiplex pcr),又称多重引物pcr或复合pcr,它是在同一pcr反应体系里加上二对以上引物,同时扩增出多个核酸片段的pcr反应,其反应原理,反应试剂和操作过程与一般pcr相同。
84.影响多重pcr反应的因素有很多,比如:
85.(1)反应体系不平衡,反应体系的不平衡导致在前期的几轮反应中某些优势引物及其模板迅速扩增,获得大量的扩增产物,而这些扩增产物同时又是dna聚合酶的良好抑制剂。所以,随着扩增产物的大量出现,聚合酶的聚合能力被越来越强烈的抑制,因此,前期处于劣势的引物及其模板,这时就更加难以反应,最终导致扩增产物量非常之小,以至于无法检测。
86.(2)引物特异性,如果引物与体系中其他非目的基因片段结合力更强,那么目的基因结合引物的能力就会受到竟争,从而导致扩增效率下降。
87.(3)最佳退火温度不一致,将多对引物放置入一个体系中扩增,由于进行pcr反应的退火温度相同,所以要求每一对引物的最佳退火温度接近。
88.(4)引物二聚体,包括引物间的二聚体以及引物自身所形成的发卡结构,还有一类是第三方dna介导的聚体,这些二聚体和非特异引物一样都会干扰引物与目标结合位点的
竟争,影响扩增效率。
89.虽然上述提及了影响扩增效率的几个因素,但更多的因素尚不清楚。到目前为止,还没有一个可以明确预测扩增效率的有效方法。
90.本发明的一个目的在于提供一种鉴别αα/αααanti4.2和αα/hkαα基因型的方法,可以同时检测x1/x2融合而成的anti4.2片段的有无以及hba2、hba1基因reads比进而确定具体的基因型,同时该方法实验操作简便快捷,一次可检测数百个或千个样本,检测通量高成本低,可以弥补现有技术的缺点。
91.具体的,本发明提供了以下技术方案:
92.第一方面,本技术公开涉及3个扩增子的2对引物。如果分开pcr反应一个样本需要进行3个pcr反应,而不同的引物间扩增区域有重叠,如果混合一起pcr,会有交叉反应,干扰检测。因此,为了降低干扰,本发明针对hba2、hba1基因的差异碱基区域设计能够同时扩增两个基因的引物,并且使用多重pcr方法进行扩增,经过上述设计,一个样本仅需2个pcr反应即可捕获目标区域,极大地减少工作量。
93.第二方面,本发明公开了一种利用精心设计的多重pcr引物构建测序文库以及检测αα/αααanti4.2和αα/hkαα基因型的方法。多重pcr产物经纯化后,仅需使用一对引物进行第二轮pcr及一次纯化,即可完成建库,实验操作简便快捷,极大地减少时间成本。
94.本发明在多重pcr中,使用引物1、引物2和引物3,在引物3中加入样本标签(index),因此扩增产物带上了index。同一个样本的扩增产物带上同样的index,不同样本的扩增产物带上不同的index,多重pcr后,将所有样本的扩增产物混合为1管,后续的建库实验由多管操作简化为1管,极大地减少工作量(参见图4)。
95.建库完成后的文库根据高通量测序仪步骤要求进行上机测序。测序完成后,根据样本标签将测序reads归到不同的样本,从而得到单个样本的测序数据。不同的样本标签设计数量可达上万条,而有多少条不同样本标签即可混合多少个样本进行检测。基于高通量测序的特性,可以实现单次检测数百个样本或千个样本,并且单个样本检测成本低。
96.获得单个样本测序数据后,经序列比对分析即可获得样本检测结果。
97.下面结合具体实施例,进一步详陈本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如美国sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
98.实施例
99.1、引物设计及合成
100.本发明在x1/x2融合而成的anti4.2片段的上游及下游设计1对引物,产生1个扩增子,根据hba2和hba1差异碱基,设计1对特异性引物同时扩增hba2和hba1的差异碱基区域,产生2个扩增子。在扩增子正向引物5’端加上测序标签1(rd1)序列即为引物1;扩增子反向引物5’端加上测序标签2(rd2)即为引物2;由测序接头p7、样本标签(index)、rd2序列组合为引物3;引物4由测序接头p5与rd1组成;引物5为测序接头p7序列。引物设计完成后,由生工生物工程(上海)有限公司合成。
101.本发明中的接头序列p5、p7为illumina测序平台的接头序列;rd1、rd2为illumina
测序平台的测序标签,序列如下:
102.p5序列:aatgatacggcgaccaccgagatctacac(seq id no.7);
103.p7序列:caagcagaagacggcatacgagat(seq id no.8);
104.rd1序列:acactctttccctacacgacgctcttccgat(seq id no.5);
105.rd2序列:gtgactggagttcagacgtgtgctcttccgatc(seq id no.6)。
106.表1.引物信息表
[0107][0108]
2、样本dna提取
[0109]
来自血液、唾液和组织等样本dna均可用于扩增。用核酸自动提取仪提取dna后,qubit flurometer 3.0定量,检测一个样本需要dna模板约10~30ng。
[0110]
3、一轮pcr反应
[0111]
采用以下pcr反应体系及pcr程序对获得的每份基因组dna样本做多重pcr扩增。配制16个样本所需扩增子上游引物(引物1)混合池、下游引物(引物2)混合池,其中引物的总终浓度为10μm;16种不同样本标签的引物3终浓度定为10μm。具体反应体系如下:
[0112]
多重pcr反应体系(25μl):
[0113][0114]
将pcr管置于pcr仪中,pcr程序如下:
[0115][0116]
4、一轮pcr产物纯化
[0117]
反应完成后,将16个样本的pcr产物,每管取10μl合并为1管,震荡混匀后取100μl用0.8倍体积的ampure xp beads纯化1次,溶于30μl的te。
[0118]
5、二轮pcr反应
[0119]
添加另一测序接头p5序列,此轮pcr只需两条引物,引物4为测序接头p5序列与rd1组合,引物5为测序接头p7序列。pcr反应50ul体系:
[0120][0121][0122]
将pcr管置于pcr仪中,pcr程序如下:
[0123][0124]
6、二轮pcr产物纯化
[0125]
反应完成后,pcr产物用0.8倍体积的ampure xp beads纯化1次,溶于50μl的te,完成测序用文库构建。
[0126]
7、文库定量、上机测序
[0127]
参考qubit flurometer 3.0说明书,对二轮pcr后的扩增子文库进行准确定量。产
物经文库检测合格后,使用illumina测序平台进行pe150上机测序,步骤严格按照供应商要求进行。
[0128]
8、测序数据信息分析
[0129]
对测序所得数据进行低质量序列以及接头序列过滤后,利用比对软件bwa将其比对到参考基因组(grch37/hg19)上的目标区域及创建的断点相连序列。
[0130]
9、测序结果
[0131]
16个已知基因型样本,检测结果与已知结果100%相符,如表2。以下列出其中3个样本的结果分析,如表3。其中样本s1基因型为αα/hkαα,样本s2基因型为αα/αααanti4.2,样本s3为阴性样本。
[0132]
表2. 16个样本检测结果
[0133]
[0134][0135]
表3.测序结果示例
[0136]
样本anti4.2片段amp1:amp2s1√2:2s2√3:2s3
×
2:2
[0137]
以上结果,amp1为hba2对应扩增子,amp2为hba1对应扩增子。s1样本,基因型为αα/hkαα,amp1和amp2的测序reads深度比约为2:2,并且存在anti4.2片段。s2样本,基因型为αα/αααanti4.2,amp1和amp2的测序reads深度比约为3:2,并且存在anti4.2片段。阴性样本
s3的amp1比amp2比例为2:2,并且不存在anti4.2片段。
[0138]
对比例1
[0139]
本发明人在研究过程中,针对各目标序列筛选了数对甚至数十对pcr引物,最终筛选出了特异性、扩增效率、多重pcr扩增效果能够满足检测需求的引物。
[0140]
例如,针对某一种变异,先设计3-5对引物,每一对引物进行特异性及扩增效果验证,验证方案为每一对引物进行pcr,然后进行琼脂糖凝胶电泳,得到电泳条带,如果条带单一且为目标长度或者条带亮度相对更亮的,判断为更优的引物,同时扩增产物进行sanger测序,验证目标长度条带是否正确。选出其中更优的2-3对引物,检测不同基因型的引物设计多种组合进行多重pcr,再进行ngs测序,通过测序reads数判断扩增效果及引物间是否存在互相干扰的情况。同等样本平均测序深度下,单对引物测序reads数越多,说明测序效果越好,引物扩增效果及引物组合效果越优。不同的引物扩增效果会有差异,测序reads数有差异。经过以上测试的引物,如果效果不理想,再重新设计引物进行测试,直至达到要求。
[0141]
由于需要使用同一对引物进行hba2和hba1的扩增,且需要保证扩增效率一致,以便真实反映hba2和hba1的拷贝数比例。使用-α3.7型缺失阳性样本通过ngs测序验证来选择更优的引物,测序reads数多、hba2与hba1比例符合预期结果且多样本测试hba2与hba1比例稳定的引物为更优的引物。
[0142]
例如,针对hkαα扩增子,本发明人设计的部分典型引物序列如下:
[0143]
对照上游引物3:gggagcgatctgggtcga(seq id no.1)。
[0144]
对照下游引物3:agggtcaccagcaggcag(seq id no.9)。
[0145]
对照上游引物4:ggagcgatctgggtcgag(seq id no.10)。
[0146]
对照下游引物4:ggtatttggaggtcagcacg(seq id no.11)。
[0147]
具体检测步骤、检测条件同以上实施例。使用对照引物3的检测结果如表4所示,检测结果表明该引物对针对hba2和hba1的扩增效率差异较大。使用对照引物4的检测结果如表5所示,检测结果表明该引物对虽然初筛时针对hba2和hba1的扩增效率较为一致,但是在多样本测试中,针对hba2及hba1的扩增稳定性较差,无法用于实际检测。
[0148]
表4.阴性样本对照引物对3测序结果
[0149]
测试样本amp1测序reads数amp2测序reads数y2650932
[0150]
表5.阴性样本对照引物对4测序结果
[0151][0152]
通过上述实施例和对比例可知,针对hba2和hba1碱基差异,设计特定的扩增效率一致的引物对确定待测样品基因型具有重要意义。
[0153]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独
引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。