通过高剪切溶解来分离蜘蛛丝蛋白的方法
1.相关申请的交叉引用
2.本技术要求2019年9月16日提交的美国临时申请号62/901,053的权益,所述临时申请特此以引用的方式整体并入。
3.序列表
4.本技术含有序列表,其已通过efs-web提交并特此以引用的方式整体并入。所述ascii副本创建于2020年9月16日,命名为btt-033wo_sl.txt,并且大小是50,960字节。
背景技术:
5.蜘蛛的丝多肽是大(》150kda,》1000个氨基酸)多肽,其可以分解成三个结构域:n末端非重复结构域(ntd)、重复结构域(rep)和c末端非重复结构域(ctd)。ntd和ctd相对较小(分别为约150、约100个氨基酸),得到了充分研究,并且被认为赋予多肽水稳定性、ph敏感性和聚集时的分子排列。ntd还具有强预测性分泌标签,其在异源表达期间经常被除去。重复区占天然多肽的约90%,并折叠成结晶区和非结晶区,它们分别赋予丝纤维强度和柔韧性。
6.丝多肽有多种来源,包括蜂、蛾、蜘蛛、螨和其他节肢动物。一些生物体制造出具有独特序列、结构元件和力学特性的多种丝纤维。例如,圆网蜘蛛(orb weaving spider)有六种独特类型的腺体,其产生不同的丝多肽序列,这些丝多肽序列聚合成适于配合环境或生命周期生态位(niche)的纤维。纤维以其来源的腺体命名,并且多肽以腺体缩写(例如,“ma”)和蛛丝蛋白(蜘蛛丝心蛋白的简称)的“sp”标记。在圆网蛛中,这些类型包括大壶状腺(masp,也称为拖丝)、小壶状腺(misp)、鞭状腺(flag)、葡萄状腺(acsp)、管状腺(tusp)和梨状腺(pysp)。跨纤维类型、结构域和在不同属和物种的生物体间变异的多肽序列的这种组合导致了大量潜在特性,其可以通过商业生产重组纤维来加以利用。迄今为止,绝大多数以重组丝的工作都集中在大壶状腺蛛丝蛋白(masp)上。
7.目前,重组丝纤维不可商购获得,并且除了少数例外,在大肠杆菌(escherichia coli)和其他革兰氏阴性原核生物以外的微生物中都不产生。迄今所产生的重组丝主要由聚合的短丝序列基序或者原始(native)重复结构域(有时与ntd和/或ctd组合)的片段组成。
8.但是,在一些情况下,重组蜘蛛丝多肽在生产和纯化期间形成不期望的不溶性聚集体。由于它们聚集和形成β-折叠结构的能力,基于丝序列的蛋白质难以溶解。这些蛋白质的溶解常常需要苛刻的针对生物分子的化学条件,诸如高摩尔浓度离散剂溶液。在纯化期间重新溶解肽的方法常常使蛋白质降解,导致产率不佳并且纤维的韧性低且手感差。因此,需要增加丝蛋白的溶解度和回收率的纯化这些多肽的改善方法。
9.本文提供了在化学溶剂化(包括各种离散剂溶液)不足的条件下,通过施加高物理能(诸如由高能流体处理器产生的剪切、冲击和空化)来溶解丝蛋白的方法。
技术实现要素:
10.在一个方面中,本文提供了从宿主细胞分离重组蜘蛛丝蛋白的方法,其包括:提供包含重组蜘蛛丝蛋白的不溶性团块;将不溶性团块添加到包含溶剂的水性溶液中;向包含不溶性团块的水性溶液施加剪切力,从而使重组蜘蛛丝蛋白溶解在水性溶液中。
11.在一些实施方案中,剪切力是通过微流体化(microfluidization)施加的。
12.在一些实施方案中,微流体化产生约6
×
106s-1
至10
×
106s-1
的剪切速率。在一些实施方案中,微流体化产生至少约6
×
106s-1
的剪切速率。在一些实施方案中,微流体化产生至少约10
×
106s-1
的剪切速率。
13.在一些实施方案中,微流体化在20,000psi至30,000psi下进行。在一些实施方案中,微流体化在30,000psi下进行。在一些实施方案中,微流体化在23,000psi下进行。
14.在一些实施方案中,微流体化器(microfluidizer)是m-110p或lm10微流体化器。
15.在一些实施方案中,微流体化器包括g10z相互作用室。在一些实施方案中,微流体化器包括f12y相互作用室。
16.在一些实施方案中,剪切力施加至少两次。在一些实施方案中,剪切力施加三次。在一些实施方案中,剪切力在至少两次施加中是相同的。在一些实施方案中,剪切力在至少两次施加中是不同的。
17.在一些实施方案中,不溶性团块来源于包含宿主细胞的细胞培养物,其中宿主细胞表达重组蜘蛛丝蛋白。
18.在一些实施方案中,所述方法还包括收集来源于细胞培养物的不溶性团块,其中不溶性团块包含重组蜘蛛丝蛋白。
19.在一些实施方案中,溶剂是离散剂。在一些实施方案中,离散剂是尿素、硫氰酸胍(gdnscn)或氯化胍(gdnhcl)。
20.在一些实施方案中,不溶性团块以约5%、10%、15%、20%、25%或30%不溶性团块/溶剂体积添加到水性溶液中。
21.在一些实施方案中,离散剂以0.1-10m的浓度存在于水性溶液中。在一些实施方案中,水性溶液包含约10m尿素、约4m-8mgdnhcl或约3m-6m gdnscn。在一些实施方案中,水性溶液包括不多于(no more than)包含10m尿素的水性溶液、包含8m gdnhcl的水性溶液或包含6m gdnscn的水性溶液的离液活性(chaotropic activity)。
22.在一些实施方案中,离液活性使用琼脂-胶凝测定进行量化。
23.在一些实施方案中,水性溶液包括约15%不溶性部分团块与85%体积的3m gdnscn。在一些实施方案中,水性溶液包括约15%不溶性部分团块与85%体积的4m gdnhcl。在一些实施方案中,水性溶液包括约15%不溶性部分团块与85%体积的10m尿素。
24.在一些实施方案中,不溶性团块在20℃与30℃之间温育。在一些实施方案中,不溶性团块在室温下温育。在一些实施方案中,不溶性团块在不高于30℃下温育。在一些实施方案中,不溶性部分在包含溶剂的水性溶液中温育60至120分钟。
25.在一些实施方案中,不溶性团块包含细胞沉淀。
26.在一些实施方案中,收集来源于细胞沉淀的不溶性团块包括裂解宿主细胞。
27.在一些实施方案中,裂解包括热处理、化学处理、剪切破坏、物理匀化(homogenization)、声处理或化学匀化。
28.在一些实施方案中,收集细胞培养物的不溶性团块还包括离心裂解的细胞以获得第一细胞沉淀。
29.在一些实施方案中,收集不溶性团块还包括:以10:1尿素体积与沉淀质量的比率将所述细胞沉淀与包含4m尿素的溶液一起温育;以及离心包含4m尿素的溶液以获得第二细胞沉淀,之后在包含溶剂的水性溶液中温育第二细胞沉淀。
30.在一些实施方案中,所述方法还包括从水性溶液分离重组蜘蛛丝蛋白,从而产生分离的重组蜘蛛丝蛋白。
31.在一些实施方案中,重组蜘蛛丝蛋白是高度结晶的丝蛋白、高β折叠含量丝蛋白或低溶解度丝蛋白。
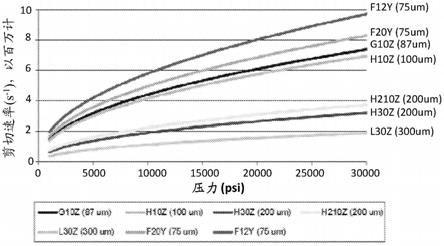
32.在一些实施方案中,重组蜘蛛丝蛋白包括如seq id no:23中所示的差异妩蛛(uloborus diversus)misp蛋白。
33.在一些实施方案中,重组蜘蛛丝蛋白在非离液溶剂中的溶解度阈值低于90%、80%、70%、60%或50%。
34.在一些实施方案中,细胞培养物包含真菌、细菌或酵母细胞。在一些实施方案中,细菌细胞是大肠杆菌。
35.在一些实施方案中,使用elisa测量分离的重组蜘蛛丝蛋白的量。在一些实施方案中,使用尺寸排阻色谱法测量分离的重组蜘蛛丝蛋白的量。
36.在一些实施方案中,分离的重组蜘蛛丝蛋白是全长重组蜘蛛丝蛋白。
37.在一些实施方案中,分离的重组蜘蛛丝蛋白包含至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%全长重组蜘蛛丝蛋白。
38.在一些实施方案中,使用elisa测量全长重组蜘蛛丝蛋白的量。在一些实施方案中,使用尺寸排阻色谱法测量全长重组蜘蛛丝蛋白的量。
39.在一些实施方案中,分离的重组蜘蛛丝蛋白的纯度是5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、45-50%、50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%、90-95%或95-100%。
40.在另一方面中,本文提供了从宿主细胞分离重组蜘蛛丝蛋白的方法,其包括:提供包含重组蜘蛛丝蛋白的不溶性团块;将不溶性团块添加到包含溶剂的水性溶液中,其中水性溶液以最终10m尿素浓度包含15%(重量/体积)不溶性部分;通过微流体化,向包含不溶性团块的水性溶液中施加剪切力,从而使重组蜘蛛丝蛋白溶解在水性溶液中;以及从水性溶液分离重组蜘蛛丝蛋白,从而产生分离的重组蜘蛛丝蛋白。
41.在另一方面中,本文提供了从宿主细胞分离重组蜘蛛丝蛋白的方法,其包括:提供包含重组蜘蛛丝蛋白的不溶性团块;将不溶性团块添加到水性溶液中,其中水性溶液以最终10m尿素浓度包含约15%(重量/体积)不溶性部分;通过微流体化向水性溶液中施加剪切力,从而使重组蜘蛛丝蛋白溶解在水性溶液中,其中剪切力是约10
×
106s-1
;以及从水性溶液分离重组蜘蛛丝蛋白,从而产生分离的重组蜘蛛丝蛋白。
42.在另一方面中,本文提供了组合物,其包含通过本文所公开的方法产生的重组蜘蛛丝蛋白。
43.在一些实施方案中,重组蜘蛛丝包含至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或100%全长重组蜘蛛丝。
44.在另一方面中,本文提供了丝纤维,其包含通过本文所公开的方法产生的重组蜘蛛丝蛋白。
附图说明
45.本文所述的本发明方法和组合物的这些和其他特征、方面和优点将关于以下描述和附图得到更好的理解,在附图中:
46.图1a显示了在各种相互作用室类型中作为压力的函数的计算的剪切速率。图1b显示了在各种单槽相互作用室类型中作为压力的函数的计算的流率。
47.图2显示了10m尿素提取和微流体化处理后,差异妩蛛丝蛋白misp(seq id no:23)的sec曲线图。箭头指在misp蛋白峰。
具体实施方式
48.定义
49.除非另外指明,否则权利要求和说明书中使用的术语如下文所示进行定义。
50.除非本文中另外定义,否则与本文所述的本发明方法和组合物结合使用的科学和技术术语应具有本领域中的普通技术人员通常所理解的含义。另外,除非上下文另外要求,否则单数术语应包括复数,且复数术语应包括单数。通常,与以下结合使用的命名法和以下技术为本领域中众所周知且常用的那些:本文所述的生物化学、酶学、分子与细胞生物学、微生物学、遗传学和多肽与核酸化学以及杂交。
51.除非另外指明,否则本文所述的方法和技术通常是根据本领域中众所周知的常规方法并且如在本说明书中通篇引用和讨论的各种一般和更具体的参考文献中所述来执行的。参见例如sambrook等人,molecular cloning:a laboratory manual,第2版,cold spring harbor laboratory press,cold spring harbor,n.y.(1989);ausubel等人,current protocols in molecular biology,greene publishing associates(1992,以及至2002年的增刊);harlow和lane,antibodies:a laboratory manual,cold spring harbor laboratory press,cold spring harbor,n.y.(1990);taylor和drickamer,introduction to glycobiology,oxford univ.press(2003);worthington enzyme manual,worthington biochemical corp.,freehold,n.j.;handbook of biochemistry:section a proteins,第i卷,crc press(1976);handbook of biochemistry:section a proteins,第ii卷,crc press(1976);essentials of glycobiology,cold spring harbor laboratory press(1999)。
52.本文提及的所有出版物、专利和其他参考文献均以特此引用的方式整体并入本文。
53.除非另外指示,否则以下术语应理解成具有以下含义:
54.术语“体外”是指在与活生物体分开生长,例如在组织培养物中生长的活细胞中发生的过程。
55.术语“体内”是指在活生物体内发生的过程。
56.如本文所用的术语“澄清”是指除去宿主细胞生物质诸如全细胞、裂解的细胞、细胞膜、脂质、细胞器、细胞核、非蜘蛛丝蛋白或任何其他不期望的细胞部分或产物或者细胞
培养物的任何其他不期望的部分的方法。澄清还可以指从部分纯化或分离蜘蛛丝组合物中除去杂质。杂质可包括但不限于非蜘蛛丝蛋白、降解的蜘蛛丝蛋白、大型蛋白质聚集体、纯化和分离过程期间使用的化学品或任何其他不期望的物质。
57.如本文所用的术语“纯度”是指基本上全长的分离的重组蜘蛛丝蛋白作为所有分离的组分的一部分的量,所述分离的组分具有例如部分的或降解的分离的重组蜘蛛丝蛋白、脂质、蛋白质、膜或样品诸如提取样品中的其他分子。全长重组蛋白是已知全长蛋白的长度的至少90-100%。在一些实施方案中,全长重组蜘蛛丝蛋白是已知全长蛋白的长度的至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。
58.本文所用的术语“产率”是指与蜘蛛丝的起始量相比,回收的总蜘蛛丝的量,包括蜘蛛丝蛋白片段和基本上全长的蜘蛛丝。
59.术语“剪切力”是指在平行或切向于主体或团块的表面或平面截面的方向上作用的力。关于流体的术语“剪切速率”是指一层流体越过相邻层时的速度变化率。例如,当两个平行的流体平面以不同的速度移动时,出现剪切速率。
60.术语“可溶性丝蛋白”是指在严格离心后保留在上清液中的蛋白。严格离心的实例是将在50ml锥形离心管中的50ml丝蛋白等分试样样品在室温下以15,000x g离心20min。
61.术语“多核苷酸”或“核酸分子”是指长度为至少10个碱基的核苷酸的聚合形式。所述术语包括dna分子(例如,cdna或基因组dna、或合成dna)和rna分子(例如,mrna或合成rna),以及含有非天然核苷酸类似物、非天然核苷间键或两者的dna或rna的类似物。核酸可以呈任何拓扑构象。例如,核酸可为单链、双链、三链、四链、部分双链、具支链、发夹型、环状或呈挂锁(padlocked)构象。
62.除非另外指示,且作为本文中以通用格式“seq id no:”描述的所有序列的实例,“包含seq id no:1的核酸”是指如下核酸,其至少一部分具有以下序列:(i)序列seq id no:1,或(ii)与seq id no:1互补的序列。两者之间的选择由上下文决定。例如,如果将核酸用作探针,那么两者之间的选择由探针与所需靶标互补的要求决定。
[0063]“分离的”rna、dna或混合聚合物为如下rna、dna或混合聚合物,其与在其天然宿主细胞中自然伴随天然多核苷酸的其他细胞组分,例如与其天然缔合的核糖体、聚合酶和基因组序列基本上分离。
[0064]
术语“重组体”是指如下生物分子(例如基因或多肽),其:(1)已从其天然存在的环境中移出,(2)与在自然界中发现所述基因的多核苷酸的全部或部分不缔合,(3)与在自然界中未与其连接的多核苷酸可操作地连接,或者(4)在自然界中不存在。术语“重组体”可关于克隆的dna分离物、化学合成的多核苷酸类似物或由异源系统生物合成的多核苷酸类似物以及由此类核酸编码的多肽和/或mrna使用。
[0065]
如本文所用,在本文中,如果异源序列与内源核酸序列相邻放置,使得所述内源核酸序列的表达发生改变,那么将生物体基因组中所述内源核酸序列(或所述序列的编码多肽产物)视为“重组体”。在此背景下,异源序列为与内源核酸序列天然不相邻的序列,无论所述异源序列本身为内源的(源自同一宿主细胞或其后代)亦或外源的(源自不同宿主细胞或其后代)。例如,启动子序列可取代(例如,通过同源重组)宿主细胞基因组中的基因的天然启动子,使得所述基因具有经改变的表达模式。所述基因现将变成“重组体”,因为其与自然侧接它的序列中的至少一些序列分离。在一个实施方案中,异源核酸分子不是生物体内
源的。在另一实施方案中,异源核酸分子是通过同源或随机整合来整合到宿主染色体中的质粒或分子。
[0066]
如果核酸含有基因组中的对应核酸中不自然存在的任何修饰,那么所述核酸同样被视为“重组体”。例如,如果内源编码序列含有人工引入(例如通过人为干预引入)的插入、缺失或点突变,那么所述内源编码序列被视为“重组体”。“重组核酸”还包括在异源位点处整合到宿主细胞染色体中的核酸和作为附加体存在的核酸构建体。
[0067]
在核酸序列的语境中,术语“百分比序列同一性”是指在比对最大对应性时,两个序列中残基的比对的定量值。序列同一性比较的长度可以超过至少约9个核苷酸,通常至少约20个核苷酸,更通常至少约24个核苷酸,通常至少约28个核苷酸,更通常至少约32个核苷酸并且优选地至少约36个或更多个核苷酸的区段。本领域中已知有许多不同的算法可用于测量核苷酸序列同一性。例如,可以使用fasta、gap或bestfit对多肽序列进行比较,它们是wisconsin package 10.0版,genetics computer group(gcg),madison,wis中的程序。fasta提供在查询序列与搜索序列之间最佳重叠区域的比对和序列同一性百分比。pearson,methods enzymol.183:63-98(1990)(特此以引用的方式整体并入本文)。例如,核酸序列之间的百分比序列同一性可以如gcg 6.1版(以引入的方式并入本文)中所提供使用fasta以其默认参数(字长6和用于计分矩阵的nopam系数)或使用gap以其默认参数来确定。替代地,可以使用计算机程序blast(altschul等人,j.mol.biol.215:403-410(1990);gish和states,nature genet.3:266-272(1993);madden等人,meth.enzymol.266:131-141(1996);altschul等人,nucleic acids res.25:3389-3402(1997);zhang和madden,genome res.7:649-656(1997)),尤其是blastp或tblastn(altschul等人,nucleic acids res.25:3389-3402(1997))比较序列。
[0068]
在提及核酸或其片段时,术语“基本上的同源性”或“基本上的类似性”指示在与另一核酸(或其互补链)以适当核苷酸插入或缺失进行最佳比对时,如通过如上文所讨论的任何众所周知的序列同一性算法(诸如fasta、blast或gap)所测量,在至少约76%、80%、85%,优选地至少约90%且更优选地至少约95%、96%、97%、98%或99%的核苷酸碱基中有核苷酸序列同一性。
[0069]
核酸(也被称为多核苷酸)可以包括rna、cdna、基因组dna以及上述的合成形式和混合聚合物的有义和反义链。它们可以通过化学或生物化学方式进行修饰,或可以含有非天然或衍生的核苷酸碱基,如本领域的技术人员很容易理解的那样。此类修饰包括例如标签、甲基化、用类似物取代一个或多个天然存在的核苷酸、核苷酸间修饰诸如不带电荷的键联(例如,膦酸甲酯、膦酸三酯、磷酰胺酯、氨基甲酸酯等)、带电荷的键联(例如,硫代磷酸酯、二硫代磷酸酯等)、垂悬(pendent)部分(例如,多肽)、嵌入剂(例如,吖啶、补骨脂素等)、螯合剂、烷化剂和修饰的键联(例如,α异头核酸等)。还包括能够经由氢键合和其他化学相互作用来结合指定序列的合成分子。此类分子在本领域中是已知的,并且包括例如肽键联取代分子主链中的磷酸酯键联的那些分子。其他修饰可以包括例如核糖环含有桥联部分或其他结构的类似物,诸如在“锁”核酸中存在的修饰。
[0070]
当应用于核酸序列时,术语“突变的”意指核酸序列中的核苷酸与参考核酸序列相比可以是插入、缺失或改变的。可以在一个位点进行单一改变(点突变),或者可以在单一位点插入、缺失或改变多个核苷酸。此外,可以在核酸序列内任何数目的位点进行一个或多个
改变。可以通过本领域中已知的任何方法使核酸序列突变,包括但不限于诱变技术,诸如“易错pcr”(用于在dna聚合酶的复制保真度低的条件下进行pcr的过程,使得沿着pcr产物的整个长度获得高点突变率;参见例如leung等人,technique,1:11-15(1989)以及caldwell和joyce,pcr methods applic.2:28-33(1992));以及“寡核苷酸定点诱变”(在任何感兴趣的克隆dna区段中实现产生位点特异性突变的过程;参见例如reidhaar-olson和sauer,science 241:53-57(1988))。
[0071]
如本文所用的术语“载体”旨在指代一核酸分子,其能够运输与其连接的另一核酸。载体的一种类型是“质粒”,其通常指可将其他dna区段连接到其中的环状双链dna环,但还包括线性双链分子,诸如从通过聚合酶链反应(pcr)进行扩增或用限制性酶处理环状质粒而得到的那些。其他载体包括粘粒、细菌人工染色体(bac)和酵母人工染色体(yac)。另一类型的载体是病毒载体,其中其他dna区段可以连接到病毒基因组中(下文将更详细地讨论)。某些载体能够在它们所引入的宿主细胞中进行自主复制(例如,在宿主细胞中发挥作用的具有复制起点的载体)。其他载体可以在进入到宿主细胞后整合到宿主细胞的基因组中,并从而与宿主基因组一起复制。此外,某些优选的载体能够指导它们可操作性地连接的基因的表达。此类载体在本文中称为“重组表达载体”(或简称“表达载体”)。
[0072]
本文所用的术语“表达系统”包括在宿主细胞中表达基因的媒介物或载体,以及使基因稳定整合到宿主染色体中的载体或媒介物。
[0073]“可操作性地连接的”或“可操作地连接的”表达控制序列是指表达控制序列与感兴趣的基因接续以控制感兴趣的基因的键联,以及以反式或在远处作用以控制感兴趣的基因的表达控制序列。
[0074]
本文所用的术语“表达控制序列”是指多核苷酸序列,它们对于影响与其可操作性地连接的编码序列的表达是必要的。表达控制序列是控制核酸序列的转录、转录后事件和翻译的序列。表达控制序列包括适当的转录起始、终止、启动子和增强子序列;有效的rna处理信号,诸如剪接和聚腺苷酸化信号;稳定细胞质mrna的序列;增强翻译效率的序列(例如,核糖体结合位点);增强多肽稳定性的序列;以及当需要时,增强多肽分泌的序列。此类控制序列的性质因宿主生物而不同;在原核生物中,此类控制序列通常包括启动子、核糖体结合位点和转录终止序列。术语“控制序列”旨在至少包括其存在对表达至关重要的所有组分,并且可以包括其存在是有利的其他组分,例如,前导序列和融合配偶体序列。
[0075]
本文所用的术语“启动子”是指rna聚合酶与其结合以起始基因转录的dna区,以及在mrna转录起始位点的5'方向处的位置。
[0076]
如本文所用的术语“重组宿主细胞”(或简称“宿主细胞”)旨在指代其中引入了重组载体的细胞。应当理解,此类术语旨在不仅指代特定受试者细胞,还指代这种细胞的子代。因为在后代中,由于突变或环境影响,可能发生某些修饰,此类子代能实际上不与母体细胞相同,但仍包括在如本文所用的术语“宿主细胞”的范围内。重组宿主细胞可以是在培养物中生长的分离的细胞或细胞系,或者可以是驻留在活组织或生物体中的细胞。
[0077]
术语“多肽”涵盖天然存在和非天然存在的蛋白及其片段、突变体、衍生物和类似物。多肽可为单体或聚合的。另外,多肽可包含多个不同结构域,每个结构域均具有一种或多种不同活性。
[0078]
如本文所用,术语“分子”意指任何化合物,包括但不限于小分子、肽、多肽、糖、核
苷酸、核酸、多核苷酸、脂质等,并且这种化合物可以是天然或合成的。
[0079]
如本文所用的术语“嵌段”或“重复单元”是指天然丝多肽的大于约12个氨基酸的亚序列,其在天然丝多肽序列中重复出现,可能有适度变异,并且充当丝多肽序列中的基本重复单元。嵌段可以但不一定包括非常短的“基序”。如本文所用的“基序”是指在多个嵌段中出现的约2-10个氨基酸的序列。例如,基序可以由氨基酸序列gga、gpg或aaaaa(seq id no:38)组成。多个嵌段的序列是“嵌段共聚物”。
[0080]
如本文所用,术语“重复结构域”是指选自丝多肽中连续的(未被实质性的非重复结构域打断的,不包括已知的丝间隔元件)重复区段的集合的序列。原始丝序列通常含有一个重复结构域。在一些实施方案中,每个丝分子有一个重复结构域。如本文所用的“宏观重复体”(macro-repeat)是包括多于一个嵌段的天然存在的重复氨基酸序列。在一个实施方案中,宏观重复体在重复结构域中重复至少两次。在另一实施方案中,这两次重复是不完美的。本文所用的“准重复体”(quasi-repeat)是包含多于一个嵌段的氨基酸序列,使得在氨基酸序列中嵌段是类似的但不是完全相同的。
[0081]
如本文所用的“重复序列”或“r”是指重复的氨基酸序列。在一个实施方案中,重复序列包括宏观重复体或宏观重复体的片段。在另一实施方案中,重复序列包括嵌段。在另一实施方案中,跨两个重复序列划分单一嵌段。
[0082]
术语“约”指示并涵盖指示的值以及高于和低于所述值的范围。在某些实施方案中,术语“约”指示指定的值
±
10%、
±
5%或
±
1%。在某些实施方案中,在适用时,术语“约”指示指定的值
±
所述值的一个标准偏差。
[0083]
必须注意,除非上下文另外明确规定,否则如说明书和所附权利要求书中所用的,单数形式“一个”、“一种”和“所述”包括多个指代物。
[0084]
本文中提到的范围应理解为范围内所有数值的简略表达,包括所提到的端点。例如,1至50的范围应理解为包括由1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49和50组成的组的任何数字、数字组合或子范围。此外,2-5%的范围包括2%和5%,以及两者之间的任何数字或分数,例如:2.25%、2.5%、2.75%、3%、3.25%、3.5%、3.75%、4%、4.25%、4.5%和4.75%。
[0085]
用于溶解和纯化重组蛋白的方法
[0086]
在细胞培养物中表达的重组蜘蛛丝蛋白必须从细胞组分中纯化出来。在一些情况下,丝蛋白陷在不溶性细胞碎片中,或者形成不溶性丝蛋白聚集体。不溶性丝蛋白难以纯化并且导致重组丝蛋白回收率下降。此外,一些分离的蜘蛛丝蛋白固体物还可以是不溶性的。例如,mbi 18b丝粉的溶解度很低,并且已知一些模型蜘蛛丝诸如差异妩蛛misp是高度不溶性的。在此类情况下,可以将各种方法应用于不溶性团块、聚集体或丝固体物,以释放丝蛋白并使其溶解以供纯化,从而使重组丝蛋白的回收率增加。此外,即使在丝可溶(即,丝蛋白溶解是热力学上有利的)的条件下,溶解速度也可能很慢。这种缓慢的速率可能是由于溶解反应所需的活化能较高,或者丝从细胞碎片颗粒的大量运输是速率限制的。在两种情况下,当丝聚集体不溶解时,或者当丝是可溶的但溶解缓慢时,通过匀化或微流体化施加高物理能过程(诸如高剪切力)可以促进丝蛋白的溶解。高剪切力为溶液增添能量以增加反应速度,从而克服高活化能,或通过打碎细胞颗粒和丝蛋白聚集体,减少了大量运输效果。因此,
以剪切力的形式施加物理能可以增加重组蜘蛛丝蛋白的溶解度,并且因此增加其回收率。
[0087]
本文描述了通过施加高物理能过程诸如剪切力、剪切速率、冲击和空化来溶解、分离和纯化重组蜘蛛丝蛋白的方法。在一些实施方案中,高物理能过程是通过匀化或微流体化施加的。向重组蛋白施加高物理能过程使蛋白质在水性溶液中的溶解增加,从而使重组蛋白的纯化和回收率增加。
[0088]
在一些实施方案中,不溶性团块是细胞沉淀。在一些实施方案中,不溶性团块是细胞裂解物。在一些实施方案中,不溶性团块是分离的蜘蛛丝固体物、团块粉末或挤出物。丝固体物或重组丝固体物是分离的重组蜘蛛丝组分,诸如纤维、挤出物、粉末或沉淀。挤出物是通过喷丝头挤出的挤出重组蜘蛛丝组合物。
[0089]
物理能和剪切力
[0090]
可以向不溶性重组蜘蛛丝蛋白施加物理能,以增加蛋白质的溶解度。物理能是通过施加机械力诸如压缩或收缩、压力、流体流动、冲击、空化、剪切力、剪切速率、剪切应力、拉伸或其任何组合或者本领域中已知的任何其他适当的机械力来转移到不溶性重组蜘蛛丝的动能或机械能。机械能的这种施加增加了重组蛋白在溶液中的溶解度。一般来讲,施加诱导对重组蛋白的受控损伤的动能或机械能的任何方法都可以用于溶解重组蛋白。不溶性重组蛋白的溶解度增加可以通过例如由机械应变或剪切力引起的压力、使重组蛋白或细胞裂解物经受变形、收缩、快速拉伸、快速压缩或高剪切速率的脉冲导致。
[0091]
在一些实施方案中,剪切力包括但不限于剪切速率和其他物理能过程,诸如由高能流体处理器产生的冲击、空化和湍流混合。
[0092]
在一些实施方案中,所施加的物理能是剪切速率、剪切力、空化、冲击、压力、声处理、乳化或本领域中已知的任何其他适当的施加方法。在一些方面中,物理能是通过匀化、微流体化微乳化或弗式压碎来施加。在一些实施方案中,物理能是剪切力。在一些实施方案中,剪切力产生剪切速率。在一些实施方案中,物理能是压力。在一些实施方案中,物理能是通过匀化或微流体化施加的。在一些实施方案中,声处理是超声处理。
[0093]
许多不同的可以施加物理能的仪器可供使用,包括高能流体处理器、微流体化器、弗式压碎器(french press)、高压匀化器、珠磨机、旋转共混机和转子/定子装置。在本文所述的一些实施方案中,重组蛋白可使用微流体化器进行溶解。微流体化器可以从商业来源购买,诸如microfluidics corp(westwood,ma)生产的m110eh、m815、m700、lv1、lm10、lm20、m110y或m110p微流体化器。
[0094]
微流体化器由在其中流由泵驱动的可互换定几何(fixed-geometr y)相互作用室(诸如g10z、h10z、h30z、h210z、l30z、f20y或f12y相互作用室)组成。在y型几何相互作用室中,进入的流被分成两个或更多束流并且在高速下重新组合,以产生急剧升降的速度和压力梯度、剪切、空化和加热。相互作用室内的流体经历高流速和均匀施加的剪切力,导致流体上产生剪切速率。匀化的强度可以通过改变相互作用室的几何形状、改变温度、改变压力或通过仪器多次处理同一材料来改变。与进入的材料的浓度、缓冲液组成以及溶液、乳液或悬浮液的理化性质也存在复杂的相互作用。若干参数可能影响重组蛋白的溶解度,包括压力、毛细管直径、温度、匀化次数和缓冲条件。此外,相互作用室可以具有单一通道(单槽相互作用室)或多于两个通道(多槽互相互作用室)。多槽相互作用室可用于增加通过相互作用室的体积流率,实现更大的样品处理体积。通过小至50μm的通道,微流体化器室内的流体
流率可以达到500m/s。流体移动穿过相互作用室时,压力的变化导致剪切速率的变化。
[0095]
可以使用本领域中已知的任何适当的匀化器或微流体化器。微流体化器和高压匀化器可从多个供应商商购获得,包括microfluidics(westwood ma)、thomas scientific(swedesboro,nj)、cat scientific(paso robles,ca)和thermo fisher scientific。在一些实施方案中,微流体化器包括z型相互作用室。在一些实施方案中,微流体化器包括y型相互作用室。在一些实施方案中,微流体化器是m-110p或lm10微流体化器。
[0096]
微流体化器相互作用室的特定组合所产生的剪切速率以及样品处理的压力可以通过室制造商所提供的信息来确定。在各种单槽微流体化器品牌相互作用室类型中随压力变化的计算剪切速率的实例显示于图1a。在各种单槽微流体化器品牌相互作用室类型中随压力变化的流率显示于图1b。图1a和1b改编自microfluidics
tm
制作的2014年微流体处理器用户指南(2014microfluidics processor user guide)。如图1a所示,两个不同室中相同量的流体压力(例如,f12y室和l30z室,在30,000psi下)导致室产生的剪切速率分别相差几乎一个数量级,10
×
106s-1
相比于2
×
106s-1
。因此,改变流体流动通过不同相互作用室的压力导致不同量的剪切力和剪切速率。并且,剪切速率的量可以通过改变选定相互作用室中的流体压力来改变和优化。
[0097]
向流体或溶液施加剪切力产生流体剪切速率。在一些实施方案中,剪切力通过微流体化器施加。在一些实施方案中,微流体化器产生剪切速率。在一些实施方案中,剪切速率可以是1
×
103s-1
至1
×
109s-1
。剪切速率可以是约1
×
103s-1
、1.5
×
103s-1
、2
×
103s-1
、2.5
×
103s-1
、3
×
103s-1
、3.5
×
103s-1
、4
×
103s-1
、4.5
×
103s-1
、5
×
103s-1
、5.5
×
103s-1
、6
×
103s-1
、6.5
×
103s-1
、7
×
103s-1
、7.5
×
103s-1
、8
×
103s-1
、8.5
×
103s-1
、9
×
103s-1
、9.5
×
103s-1
、1
×
104s-1
、1.5
×
104s-1
、2
×
104s-1
、2.5
×
104s-1
、3
×
104s-1
、3.5
×
104s-1
、4
×
104s-1
、4.5
×
104s-1
、5
×
104s-1
、5.5
×
104s-1
、6
×
104s-1
、6.5
×
104s-1
、7
×
104s-1
、7.5
×
104s-1
、8
×
104s-1
、8.5
×
104s-1
、9
×
104s-1
、9.5
×
104s-1
、1
×
105s-1
、1.5
×
105s-1
、2
×
105s-1
、2.5
×
105s-1
、3
×
105s-1
、3.5
×
105s-1
、4
×
105s-1
、4.5
×
105s-1
、5
×
105s-1
、5.5
×
105s-1
、6
×
105s-1
、6.5
×
105s-1
、7
×
105s-1
、7.5
×
105s-1
、8
×
105s-1
、8.5
×
105s-1
、9
×
105s-1
、9.5
×
105s-1
、1
×
106s-1
、1.5
×
106s-1
、2
×
106s-1
、2.5
×
106s-1
、3
×
106s-1
、3.5
×
106s-1
、4
×
106s-1
、4.5
×
106s-1
、5
×
106s-1
、5.5
×
106s-1
、6
×
106s-1
、6.5
×
106s-1
、7
×
106s-1
、7.5
×
106s-1
、8
×
106s-1
、8.5
×
106s-1
、9
×
106s-1
、9.5
×
106s-1
、1
×
107s-1
、1.5
×
107s-1
、2
×
107s-1
、2.5
×
107s-1
、3
×
107s-1
、3.5
×
107s-1
、4
×
107s-1
、4.5
×
107s-1
、5
×
107s-1
、5.5
×
107s-1
、6
×
107s-1
、6.5
×
107s-1
、7
×
107s-1
、7.5
×
107s-1
、8
×
107s-1
、8.5
×
107s-1
、9
×
107s-1
、9.5
×
107s-1
、1
×
108s-1
、1.5
×
108s-1
、2
×
108s-1
、2.5
×
108s-1
、3
×
108s-1
、3.5
×
108s-1
、4
×
108s-1
、4.5
×
108s-1
、5
×
108s-1
、5.5
×
108s-1
、6
×
108s-1
、6.5
×
108s-1
、7
×
108s-1
、7.5
×
108s-1
、8
×
108s-1
、8.5
×
108s-1
、9
×
108s-1
、9.5
×
108s-1
、1
×
109s-1
。在一些实施方案中,剪切速率是约6.5
×
106s-1
。在一些实施方案中,剪切速率是约9.5
×
106s-1
。
[0098]
压力可以是约500至50,000psi。压力可以是至少约500psi、750psi、1,000psi、2,000psi、3,000psi、4,000psi、5,000psi、10,000psi、15,000psi、20,000psi、25,000psi、20,000psi、25,000psi、40,000psi、45,000psi或50,000psi。压力可以是约500至50,000psi、500至1,000psi、1,000至5,000psi、5,000至10,000psi、7,500至12,000psi、10,000至15,000psi、15,000至20,000psi、15,000-22,000、psi、18,000-25,000psi、18,000-22,000psi、
tris甲烷、ada、hepbs、ches、amp、caps、capso、甘氨酰胺、双甘氨肽或任何其他适当的缓冲液。
[0106]
溶剂(例如,离散剂)可以直接添加到不溶性细胞部分、沉淀或裂解物中,或作为水性缓冲液的组分进行添加。水性缓冲液中溶剂的浓度可以如本领域的技术人员所确定来改变。在一些实施方案中,水性缓冲液中溶剂的浓度可以在0.01-10m、0.01-0.1m、0.1-0.5m、0.5-1m、1-2m、2-3m、3-4m、4-5m、5-6m、6-7m、7-8m、8-9m、9-10m之间或大于10m。在一些实施方案中,水性缓冲液中溶剂的浓度可以是至少约0.1m、0.15m、0.2m、0.25m、0.3m、0.35m、0.4m、0.45m、0.5m、0.55m、0.6m、0.65m、0.7m、0.75m、0.8m、0.85m、0.9m、0.95m、1m、1.5m、2m、2.5m、3m、3.5m、4m、4.5m、5m、5.5m、6m、6.5m、7m、7.5m、8m、8.5m、9m、9.5m或10m或更大。
[0107]
在一些实施方案中,以特定的团块与体积的比率将溶剂添加到不溶性细胞部分、沉淀或裂解物中。在这样的实施方案中,确定总不溶性部分、沉淀或裂解物质量,并添加特定体积的具有一定浓度溶剂或离散剂的溶液。例如,测量细胞沉淀重量,并重新悬浮在包含离散剂的溶液中,使得细胞团块的最终体积为样品总体积的15%(例如,细胞沉淀为0.75mg,并重新悬浮在4.25ml含有0.01-10m离散剂溶液的缓冲溶液中)。在另一实例中,测量细胞沉淀重量,并重新悬浮在等体积的包含溶剂的溶液中,得到50%细胞团块与溶剂体积的比率。
[0108]
在一些实施方案中,细胞团块与溶剂体积的比率可以在1-100%、1-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、45-50%、50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%、90-95%或95-100%细胞团块之间。在一些实施方案中,细胞团块与溶剂体积的比率可以是至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%细胞团块。
[0109]
在一些实施方案中,细胞团块与溶剂体积的比率可以在1-100%、1-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、45-50%、50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%、90-95%或95-100%溶剂体积之间。在一些实施方案中,细胞团块与溶剂体积的比率可以是至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%溶剂体积。
[0110]
在一些实施方案中,包含水性缓冲液和不溶性细胞部分、沉淀或裂解物的溶液中溶剂的最终浓度可以在0.01-10m、0.01-0.1m、0.1-0.5m、0.5-1m、1-2m、2-3m、3-4m、4-5m、5-6m、6-7m、7-8m、8-9m或9-10m之间。在一些实施方案中,包含水性缓冲液和细胞裂解物或沉淀的溶液中溶剂的最终浓度可以是至少约0.1m、0.15m、0.2m、0.25m、0.3m、0.35m、0.4m、0.45m、0.5m、0.55m、0.6m、0.65m、0.7m、0.75m、0.8m、0.85m、0.9m、0.95m、1m、1.5m、2m、2.5m、3m、3.5m、4m、4.5m、5m、5.5m、6m、6.5m、7m、7.5m、8m、8.5m、9m、9.5m或10m。
[0111]
还可以使用其他缓冲液修饰,诸如剪切保护剂、粘度调节剂和/或影响囊泡结构特性的溶质。还可以添加赋形剂以改善匀化或微流体化的效率,诸如膜软化材料和分子拥挤剂(molecular crowding agent)。对缓冲液的其他修饰可以包括特定ph范围和/或盐、有机
溶剂、小分子、去污剂、两性离子、氨基酸、聚合物和/或上述的任何组合的浓度,包括多种浓度。
[0112]
在一些实施方案中,不溶性细胞部分、沉淀或裂解物与包含溶剂的水性溶液一起温育。细胞沉淀或裂解物与溶液一起温育的时间的量可以改变。温育时间可以在1min至超过3小时(180min)、1min至60min、3min至90min、60min至120min、90min至150min或120min至180min之间。温育时间可以是至少1min、5min、10min、15min、20min、30min、45min、60min、75min、90min、105min、120min、135min、150min、165min、180min或更长时间。在一些实施方案中,温育时间是60min。在一些实施方案中,温育时间是75min。在一些实施方案中,温育时间是90min。在一些实施方案中,温育时间是105min。在一些实施方案中,温育时间是120min。
[0113]
不溶性细胞部分、沉淀或裂解物可以与水性溶液一起在5-70℃下温育。在一些实施方案中,不溶性细胞部分、沉淀或裂解物与水性溶液一起在5-10℃、10-20℃、10-15℃、15-20℃、20-30℃、20-22℃、20-25℃、22-27℃、25-27℃、25-20℃、27-30℃、30-40℃、40-50℃、40-45℃、45-50℃、50-60℃、50-55℃、55-60℃、60-70℃、60-65℃或65-70℃下温育。在一些实施方案中,不溶性细胞部分、沉淀或裂解物与水性溶液一起在20-30℃下温育。在一些实施方案中,不溶性细胞部分、沉淀或裂解物与水性溶液一起在25℃下温育。在一些实施方案中,不溶性细胞部分、沉淀或裂解物与水性溶液一起在室温下温育。在一些实施方案中,不溶性细胞部分、沉淀或裂解物与水性溶液一起在不高于30℃下温育。
[0114]
在一些实施方案中,重组蜘蛛丝蛋白在宿主细胞的细胞质中表达。蛋白质的分离需要裂解宿主细胞以释放重组蜘蛛丝蛋白。可以使用任何适当的方法来裂解宿主细胞,包括但不限于热处理、化学处理、剪切破坏、物理匀化、声处理或化学匀化。化学处理包括用已知破坏原核细胞和真核细胞的质膜的化学品或酶温育细胞,诸如去污剂,诸如triton x-100、nonidet p-40、chaps、十二烷基硫酸钠(sds)或其他适当的去污剂。
[0115]
裂解细胞后,包含重组蜘蛛丝蛋白的不溶性部分可以通过离心细胞裂解物来收集,得到不溶性物质的细胞沉淀,其包含重组蜘蛛丝蛋白。使不溶性重组蛋白沉淀的离心速度可由本领域的技术人员确定。在一些实施方案中,离心机速度是100-10,000x g。在一些实施方案中,离心机速度是100x g、200x g、300x g、400x g、500x g、600x g、700x g、800x g、900x g、1000x g、2000x g、3000x g、4000x g、5000x g、6000x g、7000x g、8000x g、9000x g或10,000x g。
[0116]
在一些情况下,不溶性细胞部分或沉淀可以用离散剂重新悬浮或洗涤,诸如尿素溶液,然后再次离心以产生第二细胞沉淀。然后此第二细胞沉淀与水性溶剂溶液一起温育,并施加物理力以使重组蜘蛛丝蛋白溶解。洗涤溶液中离散剂摩尔浓度可以是0.1-10m。在一些实施方案中,离散剂是尿素。在一些实施方案中,离散剂是4m尿素。
[0117]
在一些实施方案中,可以从细胞裂解物或细胞沉淀中除去非蜘蛛丝蛋白的生物或化学杂质。从细胞裂解物或细胞沉淀中除去杂质可以通过过滤、吸收(例如,木炭或固态吸收)、渗析和通过凝聚或使用各种化学品诱导的相分离来完成。在其他实施方案中,相分离可以通过添加cosmotrope和/或用于从溶液中沉淀出蛋白质的化合物来化学诱导。
[0118]
在一些实施方案中,杂质使用过滤、微滤、渗滤和/或超滤(例如,以去离子水)来除去。适用于微滤的膜可以包括0.1um至1um。适用于超滤的膜的非限制性实例包括疏水性膜
(例如,pes、ps、乙酸纤维素),其分子量截留在50kda与800kda、100kda与800kda、200kda与800kda、300kda与800kda、400kda与800kda、500kda与800kda、600kda与800kda、700kda与800kda、100kda与700kda、200kda与700kda、300kda与700kda、400kda与700kda、500kda与700kda、600kda与700kda或500kda与600kda之间。在一些实施方案中,超滤得到呈渗余物的在水中的重组蛋白浆料和包含杂质的渗透物。超滤的合适条件(例如,膜、温度、体积置换)可以用本领域已知的方法来确定,以实现渗透密度最大化。在一些实施方案中,超滤提供了密度在1g/ml与30g/ml之间的渗余物。在一些实施方案中,超滤包括浓缩步骤,其得到浓渗余物,然后是渗滤步骤,其除去杂质并且得到在水中的悬浮蛋白浆料。在一些此类实施方案中,浓渗余物的浓缩系数为与起始体积相比的2倍至12倍体积减小。在一些实施方案中,渗滤提供了3倍至10倍的恒定体积替换。
[0119]
根据实施方案和待除去的杂质类型,除去杂质的方法可能有所不同。从分离的重组蛋白中除去脂质杂质可以通过本领域中已知的方法完成。此类方法的非限制性实例包括吸收到木炭或专门结合脂质的其他吸收介质。从分离的重组蛋白中除去多糖杂质可以通过本领域中已知的方法完成。此类方法的非限制性实例包括用水解多糖的酶进行处理,然后通过超滤来除去产生的小型糖。此类酶的非限制性实例包括葡聚糖酶、裂解酶、甘露聚糖酶和壳多糖酶。
[0120]
量化
[0121]
可以对分离的重组蜘蛛丝蛋白进行测量或量化,以评估分离的蛋白的回收率(产率)和纯度。可以使用任何适当的方法来测量或量化分离的全长重组蛋白和重组蛋白片段的量,包括但不限于尺寸排阻色谱法(sec)、酶联免疫吸附测定(elisa)、sds-elisa、蛋白质印迹(免疫印迹)、高效液相色谱法(hplc)、sec-hplc、液相色谱-质谱法(lc-ms)或快速蛋白液相色谱法(fplc)、或本领域已知的任何其他适当的方法、或其任何组合。在一个实施方案中,使用蛋白质印迹测量全长重组蜘蛛丝蛋白和重组蛋白片段的量。在另一实施方案中,使用酶联免疫吸附测定(elisa)测量全长重组蜘蛛丝蛋白和重组蛋白片段的量。在另一实施方案中,使用尺寸排阻色谱法(sec)测量全长重组蜘蛛丝蛋白和重组蛋白片段的量。
[0122]
在一些实施方案中,分离的重组蜘蛛丝蛋白是至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.9%或至少100%全长重组蜘蛛丝蛋白,如通过适当的方法所测量。
[0123]
在一些实施方案中,分离的重组蜘蛛丝蛋白的纯度是5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、45-50%、50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%、90-95%或95-100%。在一些实施方案中,分离的重组蜘蛛丝蛋白的纯度是至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.9%或少100%。
[0124]
在一些实施方案中,与起始不溶性材料相比,分离的重组蜘蛛丝蛋白的纯度增加。例如,在起始不溶性材料是不溶性或溶解性差的分离的重组蜘蛛丝蛋白或丝粉末的情况下,分离的重组蜘蛛丝蛋白的纯度可以通过本文所述的溶解和分离方法来增加。在一些实
施方案中,与起始材料的纯度相比,分离的重组蜘蛛丝蛋白的纯度增加1-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、45-50%、50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%、90-95%或95-100%。在一些实施方案中,与起始材料的纯度相比,分离的重组蜘蛛丝蛋白的纯度增加至少1%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少100%。在一些实施方案中,不溶性材料的纯度是0-99%、1-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、45-50%、50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%、90-95%或95-99.9%。在一些实施方案中,不溶性材料的纯度是至少1%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%、至少99.5%或至少99.9%。
[0125]
在一些实施方案中,分离的重组蜘蛛丝蛋白包含至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%全长重组蜘蛛丝蛋白。
[0126]
重组蜘蛛丝组合物
[0127]
以引用的方式并入本文的美国专利9,963,554“methods and compositions for synthesizing improved silk fibers”公开了合成嵌段共聚物的组合物、用于其生产的重组微生物以及包含这些蛋白质的合成纤维。以引用的方式并入本文的2019年4月4日公布的美国专利公布2019/0100740“modified strains for the production of recombinant silk”公开了工程化巴斯德毕赤酵母(pichia pastoris)细胞,其被选择或遗传工程化成减少酵母细胞所表达的重组蛋白的降解,以及培养酵母细胞以用于生产可用的化合物的方法。本领域的技术人员还可以在大肠杆菌中产生合成嵌段共聚物和包含这些蛋白质的合成纤维。
[0128]
已鉴定若干种类型的天然蜘蛛丝。据信,每种天然纺丝类型的力学性质与所述丝的分子组成紧密相关。参见例如,garb,j.e.等人,untangling spider silk evolution with spidroin terminal domains,bmc evol.biol.,10:243(2010);bittencourt,d.等人,protein families,natural history and biotechnological aspects of spider silk,genet.mol.res.,11:3(2012);rising,a.等人,spider silk proteins:recent advances in recombinant production,structure-function relationships and biomedical applications,cell.mol.life sci.,68:2,第169-184页(2011);以及humenik,m.等人,spider silk:understanding the structure-function relationship of a natural fiber,prog.mol.biol.transl.sci.,103,第131-85页(2011)。例如:
[0129]
葡萄状腺(acsp)丝倾向于具有高韧性,这是适当高强度与适当高延展性结合的结果。acsp丝的特征在于大嵌段(“整体重复”)尺寸,其常常掺有聚丝氨酸和gpx的基序。管状腺(tusp或圆柱形)丝倾向于具有大直径,具有适度强度和高延展性。tusp丝之特征在于其聚丝氨酸和聚苏氨酸含量,以及聚丙氨酸短束。大壶状腺(masp)丝倾向于具有高强度和适度延展性。masp丝可为两个亚型之一:masp1和masp2。masp1丝的延展性通常小于masp2丝,且特征在于聚丙氨酸、gx和ggx基序。masp2丝的特征在于聚丙氨酸、ggx和gpx基序。小壶状腺(misp)丝倾向于具有适度强度和适度延展性。misp丝的特征在于ggx、ga和poly a基序,
no:40)相同,且与ggsga(seq id no:41)相同;其全部彼此都为环状排列。针对给定丝序列选择的特定排列可能尤其由方便性(通常以g开始)决定。从ncbi数据库获得的丝序列可以划分为嵌段和非重复区域。
[0135]
表1:嵌段序列的样品
[0136]
[0137]
[0138]
[0139]
[0140]
[0141][0142]
根据某些实施方案,来自嵌段和/或宏观重复结构域的纤维形成嵌段共聚物多肽描述于国际公开号wo/2015/042164(以引用的方式并入)中。按照结构域(n末端结构域、重复结构域和c末端结构域)对自蛋白质数据库(例如genbank)或透过从头测序获得的天然丝序列进行分解。出于合成和组装成纤维的目的而选择的n末端结构域和c末端结构域序列包括天然氨基酸序列信息和本文所述的其他修饰。重复结构域被分解成重复序列,所述重复序列含有代表性嵌段,所述嵌段根据丝的类型,通常为1至8个,所述嵌段捕获关键性氨基酸信息,同时将编码氨基酸的dna的尺寸减小成容易合成的片段。在一些实施方案中,适当形成的嵌段共聚物多肽包含至少一个含有至少1个重复序列的重复结构域,且视情况侧接n末端结构域和/或c末端结构域。
[0143]
在一些实施方案中,重复结构域包含至少一个重复序列。在一些实施方案中,重复序列为150至300个氨基酸残基。在一些实施方案中,重复序列包含多个嵌段。在一些实施方案中,重复序列包含多个宏观重复体。在一些实施方案中,嵌段或宏观重复体被分割成多个重复序列。
[0144]
在一些实施方案中,重复序列以甘氨酸开始,且不能以苯丙氨酸(f)、酪氨酸(y)、色氨酸(w)、半胱氨酸(c)、组氨酸(h)、天冬酰胺(n)、甲硫氨酸(m)或天冬氨酸(d)结束,以满足dna组装要求。在一些实施方案中,一些重复序列与天然序列相比可以改变。在一些实施方案中,可例如通过向多肽的c末端添加丝氨酸(以避免终止于f、y、w、c、h、n、m或d)来改变重复序列。在一些实施方案中,可通过在不完全嵌段中填充自另一个嵌段的同源序列来修饰重复序列。在一些实施方案中,可通过重排嵌段或宏观重复体的顺序来修饰重复序列。
[0145]
在一些实施方案中,可以选择非重复性n末端结构域和c末端结构域用于合成。在一些实施方案中,n末端结构域可以通过去除,例如,如通过signalp(peterson,t.n.等人,signalp 4.0:discriminating signal peptides from transmembrane regions,nat.methods,8:10,第785-786页(2011)所鉴定的前导信号序列来获得。
[0146]
在一些实施方案中,n末端结构域、重复序列或c末端结构域序列可以来自漏斗网蜘蛛(agelenopsis aperta)、aliatypus gulosus、哥斯大黎加斑马脚(aphonopelma seemanni)、短牙蛛种as217、短牙蛛种as220、十字园蛛(araneus diadematus)、猫脸蜘蛛、大腹圆蛛(araneus ventricosus)、悦目金蛛(argiope amoena)、银色金蛛(argiope argentata)、横纹金蛛(argiope bruennichi)、三带金蛛、atypoides riversi、巴西黄斑粉趾(avicularia juruensis)、加州陷门蛛(bothriocyrtum californicum)、食人魔脸蜘蛛、灰色迪格蛛(diguetia canities)、黑捕鱼蛛、euagrus chisoseus、苗圃网络蜘蛛、乳突棘旗蛛(gasteracantha mammosa)、hypochilus thorelli、kukulcania hibernalis、黑寡妇蜘蛛、megahexura fulva、metepeira grandiosa、金圆网蛛(nephila antipodiana)、棒络
新妇蛛、络新妇蛛、马达加斯加新妇(nephila madagascariensis)、斑络新妇(nephila pilipes)、nephilengys cruentata、帕拉威夏双条纹蛛(parawixia bistriata)、绿色猞猁蜘蛛(peucetia viridans)、原始肉食蛛、印度华丽雨林蛛(poecilotheria regalis)、长爪绿色突光蝴蛛或差异妩蛛。
[0147]
在一些实施方案中,丝多肽核苷酸编码序列可以与α交配因子核苷酸编码序列操作性地连接。在一些实施方案中,丝多肽核苷酸编码序列可以与另一种内源或异源分泌信号编码序列操作性地连接。在一些实施方案中,丝多肽核苷酸编码序列可以与3x flag核苷酸编码序列操作性地连接。在一些实施方案中,丝多肽核苷酸编码序列与其他亲和标记诸如6至8个his残基(seq id no:42)核苷酸编码序列操作性地连接。
[0148]
分泌信号
[0149]
从细胞分泌的蛋白的量在不同蛋白之间有显著不同,并且部分取决于与蛋白在新生状态下可操作地连接的分泌信号。本领域中已知有许多分泌信号,并且一些常用于生产分泌重组蛋白。其中突出的是酿酒酵母(saccharomyces cerevisiae)的α-交配因子(αmf)的分泌信号,它由n端19个氨基酸的信号肽(在本文还称为pre-αmf(sc))和70个氨基酸的前导肽(在本文还称为pro-αmf(sc))组成。已证明,将pro-αmf(sc)纳入到酿酒酵母的αmf的分泌信号中(在本文中还称为pre-αmf(sc)/pro-αmf(sc))对于实现蛋白的高分泌产率至关重要。将pro-αmf(sc)或其功能变体添加到除pre-αmf(sc)以外的信号肽中也用作实现重组蛋白分泌的手段,但显示出不同程度的有效性,增加了某些重组宿主细胞中某些重组蛋白的分泌,但对于其他重组蛋白没有影响或减少了分泌。
[0150]
如美国申请15/724,196中所述,使用多种不同的分泌信号可以改善重组蛋白的分泌产率。与包括多个编码可操作地连接至仅一个分泌信号(例如,pre-αmf(sc)/pro-αmf(sc))的重组蛋白的多核苷酸序列的重组宿主细胞相比,包括相同数目的编码可操作地连接至至少2种不同的分泌信号的重组蛋白的多核苷酸序列的重组宿主细胞产生较高分泌产率的重组蛋白。不受理论的束缚,使用至少2种不同的分泌信号可以使重组宿主细胞参与不同的细胞分泌途径,以实现重组蛋白的有效分泌,并因此防止任何一个分泌途径的过度饱和。
[0151]
不同的分泌信号中的至少一者包括可选自表2或表3的信号肽或者是与选自表2或表3的信号肽具有至少80%氨基酸序列同一性的功能变体。在一些实施方案中,功能变体是选自表2或表3的包括一个或两个取代氨基酸的信号肽。在一些此类实施方案中,功能变体与选自表2或表3的信号肽具有至少85%、至少90%、至少95%或至少99%氨基酸序列同一性。在一些实施方案中,信号肽介导新生重组蛋白在翻译后易位至er中(即,蛋白合成先于异位,使得新生重组蛋白在易位至er中之前就存在于胞质溶胶中)。在其他实施方案中,信号肽介导新生重组蛋白以共同翻译的方式易位至er中(即,蛋白合成和易位至er中同时发生)。使用介导共翻译易位至er中的信号肽的优势在于,可以防止容易快速折叠的重组蛋白呈现阻碍易位至er中并因此阻碍分泌的构象。
[0152]
表2-分泌信号
[0153][0154]
表3-重组分泌信号
[0155][0156][0157]
表达载体
[0158]
鉴于本领域已知的技术,本文所述的表达载体可以按照本说明书的教导来生产。序列,例如载体序列或编码转基因的序列,可商购自诸如integrated dna technologies,coralville,ia或dna 2.0,menlo park,ca的公司。本文所举例说明的是指导嵌合丝多肽高水平表达的表达载体。
[0159]
本文所述的多核苷酸的另一标准来源是从生物体(例如,细菌)、细胞或选定组织中分离出来的多核苷酸。来自选定来源的核酸可以通过标准程序进行分离,其通常包括连续苯酚和苯酚/氯仿提取,然后进行乙醇沉淀。沉淀后,多核苷酸可以用将核酸分子切割成片段的限制性核酸内切酶处理。选定大小的片段可以通过许多技术进行分离,包括琼脂糖
或聚丙烯酰胺凝胶电泳或脉冲场凝胶电泳(care等人(1984)nuc.acid res.12:5647-5664;chu等人(1986)science 234:1582;smith等人(1987)methods in enzymology 151:461),以为克隆提供适当大小的起始材料。
[0160]
获得表达载体或构建体的核苷酸组分的另一方法是pcr。pcr的一般程序教导于macpherson等人,pcr:a practical approach,(irl press,oxford university press,(1991))。每个应用反应的pcr条件可以凭经验确定。许多参数影响反应的成功。在这些参数中有退火温度和时间、延伸时间、mg2 和atp浓度、ph值以及引物、模板和脱氧核糖核苷酸的相对浓度。示例性引物描述于以下实施例中。扩增后,所得片段可通过琼脂糖凝胶电泳检测,然后用溴化乙锭染色和紫外线照射进行可视化。
[0161]
用于获得多核苷酸的另一方法是通过酶消化。例如,核苷酸序列可以通过用合适的识别限制性酶消化适当的载体来产生。限制性裂解的片段可以通过使用标准技术,在四种脱氧核苷酸三磷酸(dntp)的存在下,用大肠杆菌dna聚合酶i(klenow)的大片段进行处理来钝末端化。
[0162]
使用本领域众所周知的方法,将多核苷酸插入到合适的主链中,例如质粒。例如,在合适的条件下,插入序列和载体dna可以与限制性酶接触,以在每个分子上产生互补或平末端,这些末端可以彼此配对并与连接酶连接。替代地,可以将合成核酸接头连接到多核苷酸的末端。这些合成接头可以包含与载体dna中特定限制性位点对应的核酸序列。其他手段在本领域中是已知的且可用的。组分多核苷酸可以使用多种来源。
[0163]
在一些实施方案中,将含有r、n或c序列的表达载体转化到宿主生物体中以进行表达和/或分泌。在一些实施方案中,表达载体包括分泌信号。在一些实施方案中,表达载体包括终止信号。在一些实施方案中,表达载体被设计成整合到宿主细胞基因组中,并包括:与靶基因组同源的区域、启动子、分泌信号、标签(例如,flag标签)、终止/polya信号、毕赤酵母的可选择标记、大肠杆菌的可选择标记、大肠杆菌的复制起点以及释放感兴趣的片段的限制位点。
[0164]
本发明的载体可还包括靶向序列,其引导蜘蛛丝蛋白编码序列整合至宿主细胞基因组的特定位置。此类靶向序列的非限制性实例包括与宿主细胞基因组中存在的核苷酸序列相同的核苷酸序列。在一些实施方案中,靶向序列与宿主细胞基因组中的重复元件相同。在一些实施方案中,靶向序列与宿主细胞基因组中的转座元件相同。
[0165]
在一些实施方案中,本文提供了重组宿主细胞,其包含本文所述的载体。在一些实施方案中,载体被稳定整合在重组宿主细胞基因组(例如,染色体)内,例如通过同源重组或靶向整合进行。基因组整合的合适位点的非限制性实例包括酿酒酵母基因组中的ty1基因座、巴斯德毕赤酵母基因组中的rdna和hsp82基因座以及拷贝散布在整个重组宿主细胞基因组中的转座元件。在其他实施方案中,载体不是稳定整合在重组宿主细胞基因组内,而是在染色体外。
[0166]
宿主细胞转化体
[0167]
提供了用表达蜘蛛丝多肽的核酸分子或载体转化的宿主细胞,以及其后代。这些细胞也可以携带在载体上的核酸序列,这些载体可以但不一定是游离复制载体。在其他实施方案中,核酸已被整合到宿主细胞的基因组中。
[0168]
在一些实施方案中,实现大规模生产嵌段共聚物多肽的微生物或宿主细胞包括以
下的组合:1)生产大(》50kda)多肽的能力,2)对大规模污染物(诸如病毒和细菌污染)的抗性,以及3)现有的用于生长和处理生物的技术秘诀是大规模(1-2000m3)生物反应器。
[0169]
在一些实施方案中,宿主细胞在细胞内表达重组蜘蛛丝蛋白,并且所述蛋白质留在宿主细胞中。在一些实施方案中,宿主细胞在细胞内表达重组蜘蛛丝蛋白,并且所述蛋白被分泌。
[0170]
多种宿主生物可以被工程化/转化成包含嵌段共聚物多肽表达系统。表达重组丝多肽的生物体包括植物、藻类、酵母、真菌、革兰氏阳性和革兰氏阴性细菌。在一些实施方案中,宿主生物是解腺嘌呤阿氏酵母(arxula adeninivorans)、棘孢曲霉(aspergillus aculeatus)、泡盛曲霉(aspergillus awamori)、无花果曲霉(aspergillus ficuum)、烟曲霉(aspergillus fumigatus)、日本曲霉(aspergillus japonicus)、构巢曲霉(aspergillus nidulans)、黑曲霉(aspergillus niger)、米曲霉(aspergillusoryzae)、酱油曲霉(aspergillus sojae)、塔宾曲霉(aspergillus tubigensis)、嗜碱芽孢杆菌(bacillus alkalophilus)、解淀粉芽孢杆菌(bacillusamyloliquefaciens)、炭疽杆菌(bacillus anthracis)、短芽孢杆菌(bacillus brevis)、环状芽孢杆菌(bacillus circulans)、凝结芽孢杆菌(bacillus coagulans)、灿烂芽孢杆菌(bacillus lautus)、迟缓芽孢杆菌(bacilluslentus)、地衣芽孢杆菌(bacillus licheniformis)、甲醇芽孢杆菌(bacillus methanolicus)、嗜热芽胞杆菌(bacillus stearothermophilus)、枯草芽孢杆菌(bacillus subtilis)、苏云金芽孢杆菌(bacillus thuringiensis)、博伊丁假丝酵母(candida boidinii)、拉克淖金孢子菌(chrysosporiumlucknowense)、大肠杆菌、禾谷镰孢菌(fusarium graminearum)、金黃色镰孢菌(fusarium venenatum)、乳酸克鲁维酵母(kluyveromyces lactis)、马克斯克鲁维酵母(kluyveromyces marxianus)、嗜热毁丝霉(myceliopthora thermophila)、粗壮脉纹孢菌(neurospora crassa)、ogataeapolymorpha、卡门培尔青霉(penicillium camemberti)、变灰青霉(penicillium canescens)、产黄青霉(penicillium chrysogenum)、埃默森青霉(penicillium emersonii)、绳状青霉(penicillium funiculosum)、灰玫瑰青霉(penicillium griseoroseum)、产紫青霉(penicillium purpurogenum)、娄地青霉(penicillium roqueforti)、黄孢原毛平革菌(phanerochaete chrysosporium)、安格斯毕赤酵母(pichia angusta)、甲醇毕赤酵母(pichia methanolica)、巴斯德毕赤酵母(pichia(komagataella)pastoris)、多形毕赤酵母(pichia polymorpha)、树干毕赤酵母(pichia stipitis)、米黑根毛霉(rhizomucor miehei)、微小根毛霉(rhizomucor pusillus)、少根根霉(rhizopus arrhizus)、变铅青链霉菌(streptomyces lividans)、酿酒酵母、许旺酵母(schwanniomyces occidentalis)、哈茨木霉(trichoderma harzianum)、里氏木霉(trichoderma reesei)或解脂耶氏酵母(yarrowia lipolytica)。
[0171]
可用作重组宿主细胞的其他菌株是本领域中已知的。应当理解,术语“重组宿主细胞”旨在不仅指代特定受试者细胞,还指代这种细胞的子代。因为在后代中,由于突变或环境影响,可能发生某些修饰,此类子代能实际上不与母体细胞相同,但仍包括在如本文所用的术语“重组宿主细胞”的范围内。
[0172]
工程化宿主细胞系
[0173]
用于重组蛋白生产的广泛使用的微生物是大肠杆菌。然而,在大肠杆菌菌株的培
养期间,重组表达的蛋白可能是不溶性的,导致分离不佳和重组蛋白的产率下降。另一广泛使用的微生物是甲基营养型酵母巴斯德毕赤酵母。巴斯德毕赤酵母生长至高细胞密度,提供严格控制的甲醇诱导型反式基因表达并且在限定的培养基中有效地分泌异源蛋白。然而,在巴斯德毕赤酵母菌株的培养期间,重组表达的蛋白可能在可以收集之前被降解,得到包括重组表达的蛋白的片段的蛋白混合物并且导致全长重组蛋白的产率下降。
[0174]
在一些实施方案中,本文所述的蛋白酶活性降低的修饰菌株重组表达丝状多肽序列。在一些实施方案中,丝状多肽序列为1)通过混合和匹配来源于丝多肽序列的重复结构域所得到的嵌段共聚物多肽组合物,和/或2)大小足够大(约40kda)以通过从工业可放大微生物分泌来形成有用的纤维的嵌段共聚物多肽的重组表达。由丝重复结构域片段工程化的大(约40kda至约100kda)嵌段共聚物多肽(包括来自蜘蛛丝多肽的几乎所有公开的氨基酸序列的序列)可在本文所述的修饰微生物中表达。在一些实施方案中,丝多肽序列被匹配且设计来生产能够形成纤维的高度表达且分泌的多肽。在一些实施方案中,敲除蛋白酶基因或降低宿主修饰菌株中的蛋白酶活性减少丝状多肽的降解。
[0175]
在一些实施方案中,为了减弱巴斯德毕赤酵母中的蛋白酶活性,使编码这些酶的基因失活或突变以减少或消除活性。这可以通过突变或插入基因本身或通过修饰基因调控元件来进行。这可以通过标准酵母遗传学技术来实现。此类技术的实例包括通过双重同源重组进行基因置换,在基因置换中,将待失活的基因侧翼的同源区域克隆在可选择标记基因(诸如抗生素抗性基因或补充酵母菌株的营养缺陷的基因)侧翼的载体中。
[0176]
替代地,同源区域可通过重叠pcr进行pcr扩增并连接至可选择标记基因。随后,通过本领域已知的方法,例如电穿孔,将此类dna片段转化到巴斯德毕赤酵母中。然后转化体在选择性条件下生长,通过标准技术,例如基因组dna的pcr或southern印迹,分析其基因破坏事件。在替代实验中,基因失活可以通过单一同源重组来实现,在这种情况下,例如,将基因orf的5'端克隆在同样含有可选择标记基因的无启动子载体上。通过用仅切割靶基因同源片段中的载体的限制性酶进行消化来将这种载体线性化之后,将这种载体转化到巴斯德毕赤酵母中。通过基因组dna的pcr或southern印迹确认靶基因位点处的整合。以这种方式,在基因组中实现了克隆在载体上的基因片段的复制,得到靶基因基因座的两种拷贝:第一拷贝,在其中orf是不完整的,因此得到缩短、失活的蛋白的表达(如果有的话);以及第二拷贝,其没有驱动转录的启动子。
[0177]
替代地,使用转座子诱变来使靶基因失活。可以通过pcr筛选此类突变体文库的在靶基因中的插入事件。
[0178]
工程化/敲除菌株的功能表型(即,缺陷)可以使用本领域已知的技术来评估。例如,工程化菌株在蛋白酶活性方面的缺陷可以使用本领域已知的各种方法中的任一种来确定,诸如显色蛋白酶底物的水解活性的测定、所选蛋白酶的底物蛋白的带移等。
[0179]
本文所述的蛋白酶活性的减弱可以通过除敲除突变以外的机制来实现。例如,可以经由通过改变核酸序列、将基因置于活性较低的启动子的控制下、下调、表达干扰rna、核糖酶或靶向感兴趣的基因的反义序列或者通过本领域已知的任何其他技术改变氨基酸序列来减弱期望的蛋白酶。在优选的菌株中,通过上文所述的任何方法减弱在pas_chr4_0584(yps1-1)和pas_chr3_1157(yps1-2)处编码的蛋白酶的蛋白酶活性。在一些方面中,描述了甲基营养型酵母菌株,特别是巴斯德毕赤酵母菌株,其中yps1-1和yps1-2基因已经失活。在
一些实施方案中,还可以根据本文所提供的方法将其他蛋白酶编码基因敲除,以进一步降低菌株所表达的期望的蛋白产物的蛋白酶活性。
[0180]
在一些实施方案中,本文所公开的巴斯德毕赤酵母菌株被修饰成表达丝状多肽。制造丝状多肽的优选实施方案的方法提供在wo2015/042164中,特别是第114-134段,其以引用的方式并入本文。其中公开了基于源自诸如来自物种横纹金蛛的masp2的重组蛛丝蛋白片段序列的合成蛋白质性共聚物。描述了丝状多肽,其包括二至二十个重复单元,其中每个重复单元的分子量大于约20kda。在共聚物的每个重复单元内有超过约60个被组织成许多“准重复单元”的氨基酸残基。在一些实施方案中,本公开中描述的多肽的重复单元与masp2拖丝蛋白序列具有至少95%序列同一性。
[0181]
实施例
[0182]
以下是实行本文所述的本发明方法的具体实施方案的实施例。实施例仅出于说明性目的而提供,并且不旨在以任何方式限制本公开的范围。已努力确保所使用的数字(例如,量、温度等)的准确性,但当然应允许一些实验误差和偏差。
[0183]
除非另外指明,否则本文所述的方法的实践将采用本领域技术内的蛋白质化学、生物化学、重组dna技术和药理学的常规方法。此类技术在文献中进行了充分的解释。参见例如t.e.creighton,proteins:structures and molecular properties(w.h.freeman and company,1993);a.l.lehninger,biochemistry(worth publishers,inc.,现行版);sambrook等人,molecular cloning:a laboratory manual(第2版,1989);methods in enzymology(s.colowick和n.kaplan编,academic press,inc.);remington's pharmaceutical sciences,第18版(easton,pennsylvania:mack publishing company,1990);carey和sundberg advanced organic chemistry第3版(plenum press)a卷和b卷(1992)。
[0184]
实施例1:微流体化增加重组丝蛋白的溶解度
[0185]
使用高物理能来在各种水性溶剂条件下使来自不溶性细胞材料的团聚(agglomeration)的模型丝蛋白溶解。
[0186]
模型丝ud misp 64kda是重组表达的64kd蛋白质,其来源于连结至n末端组氨酸六聚物(seq id no:43)的差异妩蛛次壶状腺蛛丝蛋白基因序列(genbank:dq399332.1,seq id no:23)。使用以编码misp蛋白的t7表达载体转化的大肠杆菌c41(de3)(lucigen)表达所述蛋白。使细胞在基本培养基中生长,用异丙基β-d-1-硫代吡喃半乳糖苷(iptg)诱导misp基因表达,并通过匀化进行裂解。通过离心使不溶性细胞裂解物材料沉淀。将(质量)比率10:1的4m尿素溶液与不溶性团块混合1h,并且通过离心回收不溶性级分。所使用的匀化设备产生约0.7
×
106s-1
的剪切速率。然而,已知这种ud misp 64kd模型丝是高度不溶的,并且匀化器产生的剪切速率不足以使ud misp 64kda丝溶解。
[0187]
将含有不溶性丝蛋白的细胞生物质和沉淀以比率15%重量/体积(细胞沉淀质量比溶液体积)重新悬浮在水性缓冲液(50mm tris,ph 7.5)和选定的含有离散剂的溶液中。假设沉淀密度为1g/l,离散剂的最终浓度为10m尿素、4m gdnhcl、8m gdnhcl、3m gdnscn或6m gdnscn。通过在室温下搅拌至少1h以破坏材料的大块团簇来将溶液混合。100ml等分试样以3次通过在30,000psi(表压)下操作的f12y相互作用室(m-110p,microfluidics inc.)进行处理。在处理步骤期间使用水浴来限制样品加热。作为对照,将单独的一组100ml等分
试样在室温下搅拌3h,而不用微流体化器处理。
[0188]
通过在室温下以15,000x g将50ml等分试样离心20min来测定丝蛋白的溶解度,并且分离上清液和细胞沉淀。可溶性丝蛋白被确定为离心后留在上清液中的丝蛋白。通过用50ml在水中的5mgdnscn提取沉淀来测定细胞沉淀中剩余的不溶性丝。通过elisa用抗his6抗体(“his6”公开为seq id no:43)评估两种级分中丝的浓度,并且结果显示在表1中。
[0189]
表1:在水性缓冲液和选定的离散剂溶液中高能处理后模型丝溶解度的增加。通过elisa确定两种级分中丝的浓度。
[0190][0191][0192]
对于所评估的所有条件,微流体化均使可溶性级分中丝的量增加。值得注意的实施例是10m尿素和4m gdnhcl条件,在这两个条件下,对照中可溶的丝(在4m gdnhcl中为6%,或在10m尿素中为0%)是可忽略不计的,但在微流体化处理后,大于75%是可溶的。此外,3m和6m gdnscn缓冲液在微流体化后均产生100%溶解的丝蛋白,而以相同离液浓度的对照处理没有使丝完全溶解。因此,使用微流体化时丝蛋白溶解所需的离散剂浓度降低。
[0193]
还通过尺寸排阻色谱法(sec)证实了可溶性级分中丝蛋白的存在。使用sec hplc比较用10m尿素和微流体化(高能线)提取的蛋白质样品与单独10m尿素(对照线)相比的可
溶性级分(图2)。模型丝蛋白的洗脱时间(misp峰)用纯化的蛋白标准品确定(数据未显示)。用变性流动相(5m gdnscn)运行柱,并且用折射率检测器检测洗脱液。与单独尿素相比,施加微流体化剪切力导致丝蛋白的溶解和回收率显著增加。通过计算一些样品的sec峰%折射率曲线(ru)面积来评估溶解丝蛋白的纯度。所选样品的纯度显示在表2中。
[0194][0195]
实施例2:剪切速率压力优化
[0196]
接下来,改变微流体化的相互作用室大小和压力以评估丝溶解。
[0197]
如实施例1所述制备含有丝蛋白的不溶性细胞生物质,并将其悬浮在尿素中至最终浓度为10m尿素。将样品在两个不同的剪切速率下处理,通过如制造商(microfluidics processor user guide,microfluidics,inc)所述的相互作用室类型和操作压力进行控制。具体地,目标为预测剪切速率6.5
×
106s-1
(g10z相互作用室,23,000psi,icrofluidics inc.lm10)或9.5
×
106s-1
(f12y相互作用室,30,000psi,microfluidics inc.m-110p)。通过实施例1中所述的离心方案测定丝蛋白的溶解。如前所述,通过sec hplc评估可溶性或不溶性级分中丝的浓度:通过sec折射率峰的面积对丝蛋白进行测量,使用牛血清白蛋白标准品以便计算丝浓度。
[0198]
表3显示两次处理后丝的溶解。与以较低速率6.5
×
106s-1
处理的样品相比,剪切速率增加至9.5
×
106s-1
使溶解的丝蛋白的产率增加了40%(使用23,000psi的产率为47%,相比之下使用30,000psi的产率为66%)。因此,较高的剪切速率导致丝蛋白溶解和回收率增加。
[0199]
表3:用10m尿素溶解丝蛋白时改变剪切速率的效果。从sec hplc峰面积估计丝浓度。产率是回收的丝蛋白量,归一化为起始材料中丝蛋白的总量。通过与5m gdnscn一起温育来提取起始材料中丝蛋白的总量。
[0200][0201]
虽然已经参考优选实施方案和各种替代实施方案具体地显示和描述了本发明,但是相关领域的技术人员应理解,在不脱离本发明的精神和范围的情况下,可以在形式和细节上在其中进行各种改变。
[0202]
出于所有目的,在本说明书的正文中引用的所有参考文献、授权专利和专利申请均以引用的方式整体并入本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。