factor receptor for enhanced antitumor activity[j].journal of biological chemistry,2005,280(20):19665-19672.)。两个串联的scfv也可以与人类fc融合产生更类似免疫球蛋白的分子,称为tafv-fc(chen z,xie w,acheampong d o,et al.ahuman igg-like bispecific antibody co-targeting epidermal growth factor receptor and the vascular endothelial growth factor receptor 2for enhanced antitumor activity[j].cancer biology&therapy,2016,17(2):139-150.)。
[0007]
除以上描述的di-diabody和tafv-fc之外,结构对称的四价双特异性抗体还有(不限于)以下几种类型。
[0008]
在天然igg的重链或轻链的n末端或c末端通过多肽接头连接scfv,如此可以形成igg-scfv形式的双特异性抗体(coloma m j,morrison s l.design and production of novel tetravalent bispecific antibodies[j].nature biotechnology,1997,15(2):159.)。
[0009]
在天然抗体的轻链和重链的n末端通过多肽接头分别再接入另一个抗体的vl和vh,如此可以形成dvd-ig形式的双特异性抗体(wu c,ying h,grinnell c,et al.simultaneous targeting of multiple disease mediators by a dual-variable-domain immunoglobulin[j].nature biotechnology,2007,25(11):1290.)。
[0010]
crossmab是一种抗体fab臂的功能区互换的技术,是由罗氏开发的技术平台。该技术解决了同源轻重链正确装配的问题,进一步提高了装配的成功率。基于crossmab的多种形式的双特异性抗体的形式已被公开(klein c,schaefer w,regula j t.the use of crossmab technology for the generation of bi-and multispecific antibodies[c]//mabs.taylor&francis,2016,8(6):1010-1020.)。
[0011]
在天然抗体重链的n末端通过多肽接头连接另一个抗体的轻链,然后vh ch1作为独立的短链与连接到n末端的轻链配对,如此可以形成fit-igg形式的双特异性抗体(us 10266608b2)。
[0012]
igg-tcr通过用t细胞受体(t cell receptors,tcr)的α和β链的恒定区分别替换重链的ch1和轻链的cl来提高相关的重链和轻链的配对效率(wu x,sereno aj,huang f,et al.protein design of igg/tcr chimeras for the co-expression of fab-like moieties within bispecific antibodies[c]//mabs.taylor&francis,2015,7(2):364-376.)。wuxibody在igg-tcr的基础上进行了改进,在α和β链的恒定区之间增加了一个工程化二硫键,进一步提高了相关的重链和轻链配对的效率,以及双特异性抗体分子的稳定性(wo 2019/057122 a1)。
[0013]
最近还报道了一种构建四价双特异性抗体的方法。该方法基于晶体结构对fab的重链和轻链之间的界面进行人工设计,并通过实验方法筛选出一种正交的(orthogonal)fab界面,该正交的fab的重链和轻链能够特异配对而不会与野生型的重链和轻链错配(lewis s m,wu x,pustilnik a,et al.generation of bispecific igg antibodies by structure-based design of an orthogonal fab interface[j].nature biotechnology,2014,32(2):191.;wu x,sereno aj,huang f,et al.fab-based bispecific antibody formats with robust biophysical properties and biological activity[c]//mabs.taylor&francis,2015,7(3):470-482.)。
[0014]
另外,结构不对称的双特异性抗体还可能采用以下几种结构(不限于)。
[0015]
杵臼结构(knob-in-hole,kih)的主要功能是促使双特异性抗体的两条不同重链异二聚化。其结构特点为:组成双特异性抗体的一条重链的ch3区发生突变形成一个突起的“杵”的结构,另一条重链的ch3区发生突变形成一个凹陷的“臼”的结构,杵臼结构设计有利于两种异源抗体重链的正确装配(merchant am,zhu z,yuan j q,et al.an efficient route to human bispecific igg[j].nature biotechnology,1998,16(7):677.)。duetmab通过使用kih技术实现2条不同重链的异二聚化,并通过用工程化二硫键替换ch1-cl界面之间的天然二硫键来提高相关的重链和轻链的配对效率(mazor y,oganesyan v,yang c,et al.improving target cell specificity using a novel monovalent bispecific igg design[c]//mabs.taylor&francis,2015,7(2):377-389.)。
[0016]
另外一种增强不同重链异二聚化的方法为静电转向突变(electrostatic steering mutations)技术,该方法基于具有静电相互作用的带电残基。该方法选择改变了ch3界面中的电荷极性,使得静电匹配的fc结构域因为有利的电荷吸引作用而利于异二聚体形成,而不利的电荷排斥作用则抑制同源二聚化(us 10011858 b2;gunasekaran k,pentony m,shen m,et al.enhancing antibody fc heterodimer formation through electrostatic steering effects applications to bispecific molecules and monovalent igg[j].journal of biological chemistry,2010,285(25):19637-19646.)。
[0017]
共同轻链(common light chain)经常被用于双特异性抗体的构建。共同轻链能够减少重链和轻链错配引起的副产物的产生,增加双特异性抗体的产率(brinkmann u,kontermann re.the making of bispecific antibodies[c]//mabs.taylor&francis,2017,9(2):182-212.)。通常情况下,共同轻链需要通过实验方法筛选出来,一般可以通过杂交瘤或噬菌体展示技术获得。通常情况下,需要对抗a抗体和抗b抗体的抗体库进行高通量筛选,这要求两个抗体库的库容量不能太小(sampei z,igawa t,soeda t,et al.identification and multidimensional optimization of an asymmetric bispecific igg antibody mimicking the function of factor viii cofactor activity[j].plos one,2013,8(2):e57479.;us 9657102 b2)。
[0018]
双特异性抗体正在逐步成为一类新的治疗性抗体,可以用于治疗各种炎性疾病、癌症和其它疾病。虽然最近报道了大量新的双特异性抗体的构造形式,然而,生产双特异性抗体的主要技术难点在于获得正确配对的分子。上述双特异性抗体的形式均存在错配的问题,因此会产生一种或多种错配导致的副产物或者聚集体,从而影响目的双特异性抗体的产率、纯度和理化稳定性,进而影响双特异性抗体在体内的安全性和有效性。
技术实现要素:
[0019]
本发明描述了一种基于共同轻链的结构对称的四价双特异性抗体及其构建方法。通常情况下,双特异性抗体的重链和轻链之间会出现错配,重链和重链之间也会出现错配,正确装配的效率越高错配的程度就越低。在此,本发明用共同轻链解决了重链和轻链之间的错配问题,并将一个抗体的重链可变区vh-b与ch1连接,然后通过肽接头与另一个抗体的重链可变区vh-a连接,再与重链恒定区ch1-ch2-ch3连接,构成一条长重链。长重链和共同轻链的基因在同一细胞内表达时,每条长重链会与两条共同轻链配对,长重链与共同轻链
之间不会出现错配,因为与每条长重链配对的两条轻链是相同的;长重链之间会进行同源二聚化而不是异源二聚化,因此长重链之间也不会有错配问题。本发明的四价双特异性抗体不需要进行fc修饰,制备方法简便,具有与单抗相似甚至更优的生物学活性和理化性质。
[0020]
进一步的,本技术的发明人在对上述四价双特异性抗体长期研究的过程中意外地发现:抗人pd-1抗体mab1-25-hu(609)主要通过重链结合pd-1分子,而对轻链依赖较小。因此,可以将609的重链可变区/重链与其他靶点的抗体的重链可变区/重链和轻链可变区/轻链(作为共同轻链)组合用于构建结合pd-1以及其他靶点的双特异性抗体,可应用于包括但不限于本发明的四价双特异性抗体结构或本领域已知的其他形式的包含共同轻链的双特异性抗体结构。
[0021]
因此,本发明的第一个目的在于提供一种四价双特异性抗体。
[0022]
本发明的第二个目的在于提供一种编码所述四价双特异性抗体的分离的核苷酸。
[0023]
本发明的第三个目的在于提供一种包含所述核苷酸的表达载体。
[0024]
本发明的第四个目的在于提供一种包含所述表达载体的宿主细胞。
[0025]
本发明的第五个目的在于提供一种所述的四价双特异性抗体的制备方法。
[0026]
本发明的第六个目的在于提供一种包含所述的四价双特异性抗体的药物组合物。
[0027]
本发明的第七个目的在于提供所述的四价双特异性抗体或所述的药物组合物在制备治疗癌症、炎性疾病、自体免疫性疾病和其它病症的药物中的用途。
[0028]
本发明的第八个目的在于提供一种四价双特异性抗体的构建方法。
[0029]
本发明的第九个目的在于提供一种包含如seq id no:83所示的氨基酸序列的重链可变区的双特异性抗体。
[0030]
本发明的第十个目的在于提供包含如seq id no:83所示的氨基酸序列的重链可变区用于构建双特异性抗体的用途。
[0031]
为了达到上述目的,本发明提供了以下技术方案:
[0032]
本发明的第一个方面提供了一种四价双特异性抗体,包含:
[0033]
两条多肽链,所述多肽链从n末端到c末端包含vh-b-ch1-肽接头-vh-a-ch1-ch2-ch3,其中,所述vh-a为第一抗体的重链可变区,vh-b为第二抗体的重链可变区,所述ch1为重链恒定区的第一结构域,所述ch2为重链恒定区的第二结构域,所述ch3为重链恒定区的第三结构域,所述第一抗体特异性结合第一抗原,所述第二抗体特异性结合第二抗原;
[0034]
四条共同轻链,所述共同轻链从n末端到c末端包含vl-cl,其中,所述vl为轻链可变区,所述cl为轻链恒定区,所述多肽链的vh-a-ch1和所述多肽链的vh-b-ch1分别与所述共同轻链的vl-cl配对,所述vh-a和所述vl形成第一抗原结合位点,所述vh-b与所述vl形成第二抗原结合位点。
[0035]
本发明的双特异性抗体的结构如图1所示。
[0036]
根据本发明,所述共同轻链通过以下方法筛选获得:
[0037]
将第一抗体和第二抗体的重链和轻链分别交换获得第一抗体的重链与第二抗体的轻链组合以及第二抗体的重链与第一抗体的轻链组合的杂合抗体,如果:
[0038]
(a)第一抗体的重链与第二抗体的轻链组合成的杂合抗体能够特异性结合第一抗原,则选择第二抗体的轻链作为共同轻链;
[0039]
(b)第二抗体的重链与第一抗体的轻链组合成的杂合抗体能够特异性结合第二抗
原,则选择第一抗体的轻链作为共同轻链;
[0040]
(c)第一抗体的重链与第二抗体的轻链组合成的杂合抗体不能特异性结合第一抗原,且第二抗体的重链与第一抗体的轻链组合成的杂合抗体不能特异性结合第二抗原,则将第一抗体的轻链进行回复突变使得第二抗体的重链与第一抗体的突变轻链组合的杂合抗体能够特异性结合第二抗原,然后选择第一抗体的突变轻链作为共同轻链;或
[0041]
(d)第一抗体的重链与第二抗体的轻链组合成的杂合抗体不能特异性结合第一抗原,且第二抗体的重链与第一抗体的轻链组合成的杂合抗体不能特异性结合第二抗原,则将第二抗体的轻链进行回复突变使得第一抗体的重链与第二抗体的突变轻链组合的杂合抗体能够特异性结合第一抗原,然后选择第二抗体的突变轻链作为共同轻链。
[0042]
其中,对于上述(a)和(b)的情形,当杂合抗体能够特异性结合抗原时,作为优选的实施方式,同样可以选择将轻链进行回复突变从而进一步提高杂合抗体与抗原结合的亲和力。
[0043]
因此,进一步的,所述共同轻链通过以下方法筛选获得:
[0044]
将第一抗体和第二抗体的重链和轻链分别交换获得第一抗体的重链与第二抗体的轻链组合以及第二抗体的重链与第一抗体的轻链组合的杂合抗体,如果:
[0045]
(a’)第一抗体的重链与第二抗体的轻链组合成的杂合抗体能够特异性结合第一抗原,则将第二抗体的轻链进行回复突变使得第一抗体的重链与第二抗体的突变轻链组合的杂合抗体结合第一抗原的亲和力优于第一抗体的重链与第二抗体的轻链组合的杂合抗体结合第一抗原的亲和力,然后选择第二抗体的突变轻链作为共同轻链;
[0046]
(b’)第二抗体的重链与第一抗体的轻链组合成的杂合抗体能够特异性结合第二抗原,则将第一抗体的轻链进行回复突变使得第二抗体的重链与第一抗体的突变轻链组合的杂合抗体结合第二抗原的亲和力优于第二抗体的重链与第一抗体的轻链组合的杂合抗体结合第二抗原的亲和力,然后选择第一抗体的突变轻链作为共同轻链。
[0047]
根据本发明,所述肽接头为人工连接子。优选的,所述人工连接子选自由以下组成的组:g、gs、sg、ggs、gsg、sgg、ggg、gggs、sggg、ggggs、ggggsgs、ggggsggs、ggggsggggs、ggggsggggsggggs(seq id no:150)、akttpkleegefsear、akttpkleegefsearv、akttpklgg、sakttpklgg、sakttp、radaap、radaaptvs、radaaaaggpgs、sakttpkleegefsearv、adaap、adaaptvsifpp、tvaap、tvaapsvfifpp、qpkaap、qpkaapsvtlfpp、akttpp、akttppsvtplap、akttapsvyplap、astkgp、astkgpsvfplap、genkveyapalmals、gpakeltplkeakvs、gheaaavmqvqypas等。更优选的,所述人工连接子为ggggsggggsggggs(seq id no:150)。
[0048]
根据本发明,所述多肽链中靠近n末端的ch1结构域和ch1-ch2-ch3可以来自相同或不同亚型的重链恒定区,包括由igg1、igg2、igg3、igg4组成的组的重链恒定区,优选来自igg1或igg4的重链恒定区,优选的,所述igg4包含s228p(根据eu编码)突变。
[0049]
根据本发明,所述cl为κ轻链恒定区或λ轻链恒定区。
[0050]
根据本发明的优选实施例,所述第一抗原和所述第二抗原选自由以下组成的组:vegf/pd-1、pd-1/vegf、tgf-β/pd-1、pd-1/tgf-β、her2/cd47、cd47/her2、her2/cd137、cd137/her2、pd-1/cd137、cd137/pd-1、pd-1/cd40、cd40/pd-1、pd-1/egfr、egfr/pd-1、pd-1/her2、her2/pd-1、pd-1/ctla-4、ctla-4/pd-1、pd-1/lag-3、lag-3/pd-1。
[0051]
根据本发明的优选实施例,所述vh-a或所述vh-b具有如seq id no:83所示的序
列。
[0052]
根据本发明的优选实施例,所述vh-a、所述vh-b和所述vl的序列选自由以下组成的组:seq id no:1、11、15;seq id no:11、1、15;seq id no:20、11、15;seq id no:11、20、15;seq id no:29、41、42;seq id no:41、29、42;seq id no:31、41、42;seq id no:41、31、42;seq id no:53、61、54;seq id no:61、53、54;seq id no:53、77、54;seq id no:77、53、54;seq id no:83、91、92;seq id no:91、83、92;seq id no:83、105、106;seq id no:105、83、106;seq id no:83、113、114;seq id no:113、83、114;seq id no:83、117、118;seq id no:117、83、118;seq id no:83、119、120;seq id no:119、83、120;seq id no:83、121、122;seq id no:121、83、122。
[0053]
根据本发明的优选实施例,所述多肽链和所述共同轻链的序列选自由以下组成的组:seq id no:16、13;seq id no:18、13;seq id no:21、13;seq id no:45、43;seq id no:47、43;seq id no:49、43;seq id no:51、43;seq id no:65、63;seq id no:67、63;seq id no:79、63;seq id no:81、63;seq id no:95、93;seq id no:97、93;seq id no:109、107;seq id no:111、107;seq id no:131、123;seq id no:133、125;seq id no:135、127;seq id no:137、127;seq id no:139、127;seq id no:141、127;seq id no:143、129;seq id no:145、129。
[0054]
本发明的第二个方面提供了一种分离的核苷酸,所述的核苷酸编码所述的四价双特异性抗体。
[0055]
本发明的第三个方面提供了一种表达载体,所述的表达载体含有所述的核苷酸。
[0056]
根据本发明的优选实施例,所述的核苷酸编码所述多肽链和所述共同轻链,所述核苷酸具有选自由以下组成的组的序列:seq id no:17、14;seq id no:19、14;seq id no:22、14;seq id no:46、44;seq id no:48、44;seq id no:50、44;seq id no:52、44;seq id no:66、64;seq id no:68、64;seq id no:80、64;seq id no:82、64;seq id no:96、94;seq id no:98、94;seq id no:110、108;seq id no:112、108;seq id no:132、124;seq id no:134、126;seq id no:136、128;seq id no:138、128;seq id no:140、128;seq id no:142、128;seq id no:144、130;seq id no:146、130。
[0057]
本发明的第四个方面提供了一种宿主细胞,所述的宿主细胞含有所述的表达载体。
[0058]
本发明的第五个方面提供了所述的四价双特异性抗体的制备方法,所述方法包含以下步骤:
[0059]
(a)在表达条件下,培养所述的宿主细胞,从而表达所述的四价双特异性抗体;
[0060]
(b)分离并纯化(a)所述的四价双特异性抗体。
[0061]
本发明的第六个方面提供了一种药物组合物,所述药物组合物含有如上所述的四价双特异性抗体和药学上可接受的载体。
[0062]
本发明的第七个方面提供了所述的四价双特异性抗体或所述的药物组合物在制备治疗癌症和炎性疾病、自体免疫性疾病和其它病症的药物中的用途。本发明还提供了治疗癌症和炎性疾病、自体免疫性疾病和其它病症的方法,包括向有需要的受试者施用所述的四价双特异性抗体或所述的药物组合物。所述癌症包括但不限于:黑素瘤(例如,转移性恶性黑素瘤)、肾癌(例如,透明细胞癌)、前列腺癌(例如,激素难治性前列腺腺癌)、胰腺癌、
乳腺癌、结肠癌、肺癌(例如,非小细胞肺癌)、食道癌、头颈鳞状细胞癌、肝癌、卵巢癌、宫颈癌、甲状腺癌、成胶质细胞瘤、神经胶质瘤、白血病、淋巴瘤及其它赘生性恶性疾病。所述炎性疾病、自体免疫性疾病和其它病症包括但不限于:眼科、纤维化、哮喘、类风湿性关节炎、系统性红斑狼疮、多发性硬化、银屑病、特应性皮炎等。其中,所述受试者包括但不限于人。
[0063]
本发明的第八个方面提供了一种四价双特异性抗体的构建方法,包含以下步骤:
[0064]
(a)将第二抗体的重链可变区vh-b与重链恒定区的第一结构域ch1连接,所述第二抗体特异性结合第二抗原;
[0065]
(b)将(a)通过肽接头与第一抗体的重链可变区vh-a连接,所述第一抗体特异性结合第一抗原;
[0066]
(c)将(b)与重链恒定区ch1-ch2-ch3连接,形成多肽链;
[0067]
(d)将(c)与共同轻链vl-cl分别构建入表达载体中组合表达,从而获得目的四价双特异性抗体;
[0068]
其中,所述ch1为重链恒定区的第一结构域,所述ch2为重链恒定区的第二结构域,所述ch3为重链恒定区的第三结构域,所述vl为轻链可变区,所述cl为轻链恒定区,所述vh-a-ch1和所述vh-b-ch1分别与所述vl-cl配对,所述vh-a与所述vl形成第一抗原结合位点,所述vh-b与所述vl形成第二抗原结合位点。
[0069]
本发明的第九个方面提供了一种双特异性抗体,其中,包含至少两个不同的重链可变区以及至少两条共同轻链,所述共同轻链包含相同的轻链可变区,所述重链可变区与所述轻链可变区形成抗原结合位点,其中,所述重链可变区包含如seq id no:83所示的氨基酸序列。
[0070]
本发明的第十个方面提供了包含如seq id no:83所示的氨基酸序列的重链可变区用于构建双特异性抗体的用途,其中,所述双特异性抗体包含至少两个不同的重链可变区以及至少两条共同轻链,所述共同轻链包含相同的轻链可变区,所述重链可变区与所述轻链可变区形成抗原结合位点。
[0071]
本发明中,术语“抗体(antibody,缩写ab)”和“免疫球蛋白g(immunoglobulin g,缩写igg)”是有相同结构特征的约150000道尔顿的异四聚糖蛋白,其由两条相同的轻链(lc)和两条相同的重链(hc)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型(isotype)的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是恒定区,重链恒定区由三个结构域ch1、ch2、以及ch3构成。每条轻链的一端有可变区(vl),另一端有恒定区,轻链恒定区包括一个结构域cl;轻链的恒定区与重链恒定区的ch1结构域配对,轻链的可变区与重链的可变区配对。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体依赖的细胞介导的细胞毒性作用(adcc,antibody-dependent cell-mediated cytotoxicity)等。重链恒定区包括igg1、igg2、igg3、igg4亚型;轻链恒定区包括κ(kappa)或λ(lambda)。抗体的重链和轻链通过重链的ch1结构域和轻链的cl结构域之间的二硫键共价连接在一起,抗体的两条重链通过铰链区之间形成的多肽间二硫键共价连接在一起。
[0072]
本发明中,术语“双特异性抗体(双抗)”是指能同时特异性结合两种抗原(靶点)或两种表位的抗体分子。
[0073]
本发明中,术语“单克隆抗体(单抗)”指从一类基本均一的群体获得的抗体,即该
群体中包含的单个抗体是相同的,除少数可能存在的天然发生的突变外。单克隆抗体高特异性地针对单个抗原位点。而且,与常规多克隆抗体制剂(通常是具有针对不同抗原决定簇的不同抗体的混合物)不同,各单克隆抗体是针对抗原上的单个决定簇。除了它们的特异性外,单克隆抗体的好处还在于它们可以通过杂交瘤培养来合成,不会被其它免疫球蛋白污染。修饰语“单克隆”表示了抗体的特性,是从基本均一的抗体群中获得的,这不应被解释成需要用任何特殊方法来生产抗体。
[0074]
本发明中,术语“fab”和“fc”是指木瓜蛋白酶可将抗体裂解为两个完全相同的fab段和一个fc段。fab段由抗体的重链的vh和ch1以及轻链的vl和cl结构域组成。fc段即可结晶片段(fragment crystallizable,fc),由抗体的ch2和ch3结构域组成。fc段无抗原结合活性,是抗体与效应分子或细胞相互作用的部位。
[0075]
本发明中,术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于重链可变区和轻链可变区中称为互补决定区(complementarity-determining region,cdr)或超变区中的三个片段中。可变区中较保守的部分称为框架区(frame region,fr)。天然重链和轻链的可变区中各自包含四个fr区,它们大致上呈β-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分β折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nih publ.no.91-3242,卷i,647-669页(1991))。
[0076]
本发明中,术语“鼠源抗体”是指来源于大鼠或小鼠的抗体,优选小鼠。
[0077]
本发明中,术语“人源化抗体”是指其cdr来源于非人物种(优选小鼠)抗体,抗体分子中残余的部分(包括框架区和恒定区)来源于人抗体。此外,框架区残基可被改变以维持结合亲和性。
[0078]
本发明中,术语“特异性结合”和“结合”是指两分子间的非随机的结合反应,如抗体和其所针对的抗原之间的反应。通常,抗体以小于大约10-7
m,例如小于大约10-8
m、10-9
m、10-10
m、10-11
m或更小的平衡解离常数(kd)结合该抗原。本发明中,术语“kd”是指特定抗体-抗原相互作用的平衡解离常数,其用于描述抗体与抗原之间的结合亲和力。平衡解离常数越小,抗体-抗原结合越紧密,抗体与抗原之间的亲和力越高。例如,使用表面等离子体共振术(surface plasmon resonance,缩写spr)在biacore仪中测定抗体与抗原的结合亲和力或使用elisa测定抗体与抗原结合的相对亲和力。
[0079]
本发明中,术语“价”是指抗体分子中存在指定数量的抗原结合位点。优选的,本发明的双特异性抗体具有四个抗原结合位点,是四价的。本发明中,抗原结合位点包含重链可变区(vh)和轻链可变区(vl)。
[0080]
本发明中,术语“表位”是指与抗体特异性结合的多肽决定簇。本发明的表位是抗原中被抗体结合的区域。
[0081]
本发明中,术语“肽接头”是指具有氨基酸序列的肽。本发明的肽接头是天然连接子或人工连接子。优选的,本发明的肽接头是人工连接子。本发明的多肽接头可以选自g、gs、sg、ggs、gsg、sgg、ggg、gggs、sggg、ggggs、ggggsgs、ggggsggs、ggggsggggs、ggggsggggsggggs(seq id no:150)、akttpkleegefsear、akttpkleegefsearv、akttpklgg、sakttpklgg、sakttp、radaap、radaaptvs、radaaaaggpgs、sakttpkleegefsearv、adaap、
adaaptvsifpp、tvaap、tvaapsvfifpp、qpkaap、qpkaapsvtlfpp、akttpp、akttppsvtplap、akttapsvyplap、astkgp、astkgpsvfplap、genkveyapalmals、gpakeltplkeakvs和gheaaavmqvqypas等。接头还可以是在体内可断裂的肽接头、蛋白酶(如mmp)敏感性接头、可以通过还原而断裂的基于二硫键的接头等,参见先前所描述的(fusion protein technologies for biopharmaceuticals:applications andchallenges,由stefan r.schmidt编辑),或本领域已知的任何可断裂的接头。这些可断裂的接头可以用于在体内释放分子顶部的fab,以便提高组织渗透和分布,增强与靶标的结合,减少潜在副作用,以及调节2个不同的fab区的体内功能和半衰期。最优选的,本发明的人工连接子为ggggsggggsggggs(seq id no:150)。
[0082]
本发明中,术语“共同轻链”是指包含相同的轻链可变区和轻链恒定区的轻链,其能够与结合第一抗原的第一抗体的重链配对,形成特异性结合第一抗原的结合位点,也能够与结合第二抗原的第二抗体的重链配对,形成特异性结合第二抗原的结合位点。进一步的,共同轻链的轻链可变区与第一抗体的重链可变区形成第一抗原结合位点,共同轻链的轻链可变区与第二抗体的重链可变区形成第二抗原结合位点。
[0083]
本发明中,术语“表达载体”可以为ptt5,psectag系列,pcgs3系列,pcdna系列载体等,以及其它用于哺乳动物表达系统的载体等,表达载体中包括连接有合适的转录和翻译调节序列的融合dna序列。
[0084]
本发明中,术语“宿主细胞”是指适用于表达上述表达载体的细胞,可以是真核细胞,如哺乳动物或昆虫宿主细胞培养系统均可用于本发明的融合蛋白的表达,cho(中国仓鼠卵巢,chinese hamster ovary),hek293,cos,bhk以及上述细胞的衍生细胞均可适用于本发明。
[0085]
本发明中,术语“药物组合物”是指本发明的双特异性四价抗体可以和药学上可以接受的载体一起组成药物制剂组合物从而更稳定地发挥疗效,这些制剂可以保证本发明公开的双特异性四价抗体的氨基酸核心序列的构象完整性,同时还保护蛋白质的多官能团防止其降解(包括但不限于凝聚、脱氨或氧化)。
[0086]
本发明描述了一种基于共同轻链的结构对称的四价双特异性抗体及其构建方法。本发明制备的双特异性抗体具有与单抗相似甚至更优的生物学活性和理化性质,可以用于治疗各种炎性疾病、癌症和其它疾病。
附图说明
[0087]
图1为本发明的双特异性抗体的结构示意图,其中,vh-a表示第一抗体的重链可变区,vh-b表示第二抗体的重链可变区,vl表示共同轻链的轻链可变区,ch1、ch2和ch3是重链恒定区的三个结构域,cl是共同轻链的轻链恒定区,两条重链之间的线段表示二硫键,重链和轻链之间的线段也表示二硫键,靠近多肽链n末端的ch1和vh-a之间的线段表示人工设计的连接子,靠近多肽链c末端的ch1和ch2之间的线段表示抗体天然的连接子和铰链区(如果重链是人igg4亚型,铰链区会含有s228p点突变)。
[0088]
图2a和图2b为601和20-hu及其杂合抗体的elisa结果。
[0089]
图3a和图3b为20-fab-601-igg4-v94l和601-fab-20-igg4-v94l的elisa结果。
[0090]
图4a和图4b为20-fab-601-igg4-v94l的hplc-sec图谱。
fab-ipilimumab-igg4和ipilimumab-fab-609-igg4的elisa结果。
[0121]
图35为抗pd-1和ctla-4双特异性抗体的功能活性测定结果。
[0122]
图36为抗pd-1和ctla-4双特异性抗体的adcc活性测定结果。
[0123]
图37为抗pd-1和ctla-4双特异性抗体在大鼠体内的药代动力学。
[0124]
图38为抗pd-1和ctla-4双特异性抗体在小鼠体内的抗肿瘤生长曲线。
[0125]
图39a和图39b为609-fab-5e7-igg4和5e7-fab-609-igg4的elisa结果。
[0126]
图40为测定pd-1和lag-3双特异性抗体同时结合两种抗原的能力。
[0127]
图41为抗pd-1和lag-3双特异性抗体的功能活性测定。
[0128]
图42为抗pd-1和lag-3双特异性抗体在小鼠体内的抗肿瘤生长曲线。
[0129]
图43a~图43e为杂合抗体的特异性检验。
[0130]
图44a~图44h为609-fab-cetuximab-igg4、609-fab-pertuzumab-igg4、609-fab-ipilimumab-igg1、ipilimumab-fab-609-igg1、609-fab-ipilimumab-igg4、ipilimumab-fab-609-igg4、609-fab-5e7-igg4和5e7-fab-609-igg4的hplc-sec图谱。
[0131]
图45a和45b为609-fab-ipilimumab-igg1和609-fab-5e7-igg4的hplc-iec图谱。
[0132]
图46a~图46d为609-fab-ipilimumab-igg1和609-fab-5e7-igg4的nr-ce-sds和r-ce-sds的图谱。
具体实施方式
[0133]
以下实施例中使用的表达纯化抗体方法说明如下:将外源基因构建到pcdna3.4(购自thermo fisher scientific)表达载体中,利用pei(polyethylenimine)转染法将表达载体的组合转入hek293f细胞(购自thermo fisher scientific)中以表达抗体,然后用proteina亲和层析纯化抗体。
[0134]
以下实施例中使用的elisa检测方法说明如下:将重组蛋白分别包被酶标板,用含有1%牛血清白蛋白的pbst(pbst为含0.05%tween-20的磷酸盐缓冲液)封闭酶标板。将待测抗体进行梯度稀释,然后转移到上述包被重组蛋白的酶标板中,室温孵育半小时后洗板;加入适当稀释的hrp(horseradish peroxidase)标记的羊抗人抗体(fc或fab-specific,购自sigma),室温孵育半小时后洗板;每孔加入100μl以tmb(3,3
′
,5,5
′‑
tetramethylbenzidine)为底物的显色液,室温孵育1~5min;加50μl终止液(2m h2so4)终止反应;酶标仪(spectramax 190)读取od450,用graphpad prism6进行作图和数据分析,并计算ec50。
[0135]
以下实施例中使用的评估增强混合淋巴细胞反应(mixed lymphocyte reaction,mlr)的能力方法说明如下:用histopaque(购自sigma)从人血液中分离出外周血单个核细胞(peripheral blood mononuclear cell,缩写pbmc),然后将pbmc中的单核细胞通过贴壁法分离出来,然后用il-4(25ng/ml)联合gm-csf(25ng/ml)诱导单核细胞分化成诱导的树突状细胞。七天之后,消化收集上述诱导的树突状细胞。用上述方法从另外供体的血液中分离出pbmc,然后用macs磁铁和cd4 microbeads(购自miltenyi biotec)从中分离cd4
t细胞。将诱导的树突状细胞(104/孔)和分离出的cd4
t细胞(105/孔)按比例混匀后接种到96孔板中,每孔150μl;数小时后,在上述96孔板中加入50μl梯度稀释的抗体;将96孔板置于37℃细胞培养箱中孵育3天。上述实验过程中使用aim-v培养基(thermo fisher scientific)培养
细胞。然后按照标准操作流程检测il-2和ifn-γ的分泌。il-2和ifn-γ的检测使用标准的双抗夹心法(相关检测用的配对抗体购自bd biosciences)。用酶标仪(spectramax 190)读取od450,用graphpad prism6进行作图并计算ec50。
[0136]
以下实施例中使用的理化性质检测方法说明如下:
[0137]
hplc-sec
[0138]
抗体是高分子量蛋白质,具有高度复杂的二级和三级结构。由于翻译后修饰、聚集和降解等变化,抗体在生物化学和生物物理特性方面是异质的。当通过分离技术分析双特异性抗体时,通常会观察到变体、聚集体和降解片段,它们的存在可能会损害安全性和有效性。在生产和存储抗体的过程中容易出现聚集体、降解片段和不完整组装的分子。本发明使用高效液相色谱-尺寸排阻色谱(high-performance liquid chromatography
–
size exclusion chromatography,hplc-sec)检测样品中上述杂质的含量。聚集体的分子量要大于单体,因此相应峰的保留时间较短;降解片段或不完整组装分子的分子量要小于单体,因此相应峰的保留时间较长。hplc-sec所用色谱仪为dionex ultimate 3000;流动相配制方法如下:取适量20mm磷酸二氢钠母液,用20mm磷酸氢二钠调节ph至6.8
±
0.1;进样量:20μg;色谱柱为tsk g3000swxl,规格为7.8
×
300mm 5μm;流速0.5ml/min,洗脱时间30min;柱温25℃,样品室温度10℃;检测波长214nm。
[0139]
hplc-iec
[0140]
许多翻译后修饰(例如n糖基化、c末端赖氨酸残基修饰、n末端谷氨酰胺或谷氨酸环化、天冬酰胺脱酰胺化、天冬氨酸异构化和氨基酸残基氧化等)会直接或间接地引起抗体表面电荷的改变,导致电荷异质性的产生。基于所带电荷可对电荷变体进行分离和分析,常用的分析方法有阳离子交换色谱法(cation exchange chromatography,cex)和阴离子交换色谱法(anionexchange chromatography,aex)。当通过基于色谱法的方法分析时,酸性种类(acidic species)和碱性种类(basic species)基于它们相对于主峰(main peak)的保留时间来定义。酸性种类是早于cex的主峰或晚于aex的主峰洗脱出来的变体,而碱性种类是晚于cex的主峰或早于aex的主峰洗脱出来的变体。酸性种类和碱性种类所对应的峰分别称作酸性峰和碱性峰。在生产和存储抗体的过程中容易产生电荷变体。在此使用高效液相色谱-离子交换色谱(high-performance liquid chromatography-ionexchange chromatography,hplc-iec)分析样品的电荷异质性。hplc-iec所用色谱仪为dionex ultimate 3000;流动相a:20mm pb ph6.3,流动相b:20mm pb 200mm nacl ph6.3,两种流动相混合的比例按照预先设置的程序随时间而改变,流速1.0ml/min;色谱柱:thermo propac
tm wcx-10;柱温30℃,样品室温度10℃;进样量:20μg;检测波长:214nm。
[0141]
ce-sds
[0142]
本发明使用ce-sds(capillary electrophoresis-sodium dodecyl sulfate)分析样品中降解片段或不完整组装的分子的含量。ce分为非还原和还原两种类型,用于前者的样品在变性时不需要用还原剂dtt将分子内的二硫键破坏,而用于后者的样品在变性时需要用还原剂dtt将分子内的二硫键破坏。非还原和还原ce-sds分别记作nr-ce-sds和r-ce-sds。所用毛细管电泳仪为proteomelab
tm pa800 plus(beckman coulter),配备uv 214nm检测器,毛细管型号为bare fused-silica capillary,规格30.7cm
×
50μm,有效长度20.5cm;其它相关试剂购自beckman coulter。仪器关键参数设置如下:毛细管和样品室温
度为20
±
2℃,分离电压为15kv。
[0143]
dsc
[0144]
差示扫描量热法(differential scanning calorimeter,dsc)主要通过在可控的升温或降温过程检测生物分子中的热量变化来反映样品的热稳定性。通过加热,蛋白样品的去折叠会吸收热量,而消除样品池温差所需的补充能量则通过设备记录下来,这些热量变化会在图谱上形成一个峰形,其中蛋白质样品发生去折叠时所对应的峰顶温度作为熔融温度tm。tm是蛋白热稳定性的一个重要指示,tm越高,蛋白的稳定性越好。
[0145]
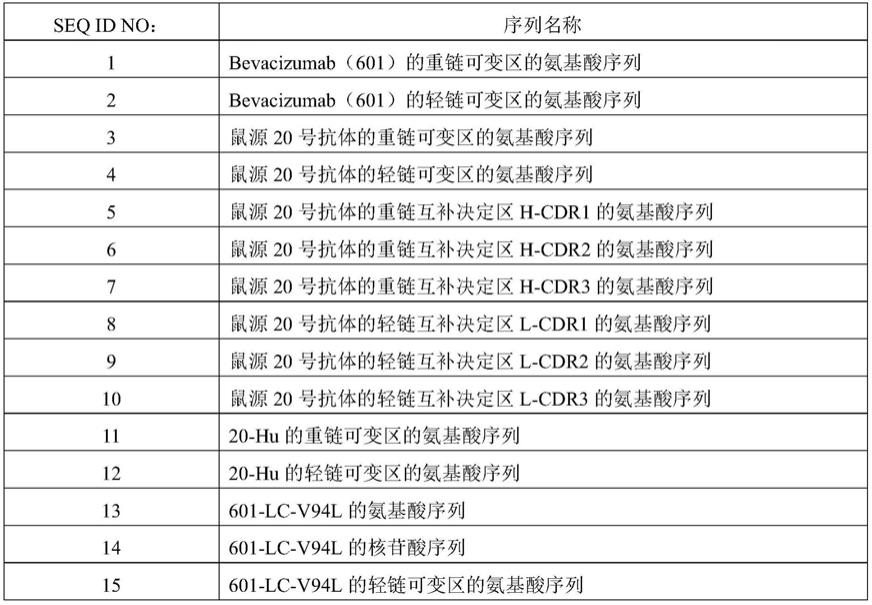
本发明中涉及的序列信息总结在表1中。
[0146]
表1、本发明的抗体的序列信息
[0147]
[0148]
[0149]
[0150]
edition,cold spring harbor laboratory press。
[0153]
实施例1构建抗pd-1和vegf的双特异性抗体
[0154]
实施例1.1序列
[0155]
从公开的文献资料(magdelaine-beuzelin c,kaas q,wehbi v,et al.structure
–
function relationships of the variable domains of monoclonal antibodies approved for cancer treatment[j].critical reviews in oncology/hematology,2007,64(3):210-225.)中获得bevacizumab(后文用601替代)抗体的重链可变区和轻链可变区序列(seq id no:1和2)。由上海生工生物工程有限公司合成编码上述可变区的dna。601的重链可变区(601-vh)和轻链可变区(601-vl)分别与人igg1重链恒定区(seq id no:147)和人kappa轻链恒定区(seq id no:149)相连,构建成全长的601抗体的重链和轻链基因,分别命名为601-hc和601-lc。
[0156]
根据wo2018/137576a1中实施例1-5所述,依据筛选结果,最终挑取20号鼠源抗人pd-1单抗作为先导抗体,并获得其重链可变区核苷酸序列和轻链可变区核苷酸序列,并翻译成氨基酸序列(seq id no:3和4)。
[0157]
对20号抗体的重链可变区和轻链可变区氨基酸序列进行分析,依据kabat规则分别确定20号抗体重链和轻链的抗原互补决定区和框架区。20号抗体重链cdr的氨基酸序列为h-cdr1:nydms(seq id no:5)、h-cdr2:tisggggytyysdsvkg(seq id no:6)和h-cdr3:pyghygfey(seq id no:7),轻链cdr的氨基酸序列为l-cdr1:sasqgisnfls(seq id no:8)、l-cdr2:ytsslhs(seq id no:9)和l-cdr3:qqysnlpwt(seq id no:10)。
[0158]
在https://www.ncbi.nlm.nih.gov/igblast/,将鼠源20号抗体的重链可变区与人igg胚系序列进行同源性比较,选择ighv3-21*01为重链cdr移植模板,将鼠源的20号抗体的重链cdr移植入ighv3-21*01骨架区,并在h-cdr3之后加入wgqgtlvtvss(seq id no:151)作为第四个框架区,获得cdr移植重链可变区序列。同样地,将鼠源20号抗体的轻链可变区与人igg胚系序列同源性比较,选择igkv1-39*01为轻链cdr移植模板,将鼠源20号抗体的轻链cdr移植入igkv1-39*01的骨架区,并在l-cdr3之后加入fgqgtkveik(seq id no:152)作为第四个框架区,获得cdr移植轻链可变区序列。在cdr移植可变区的基础上,对一些框架区的氨基酸位点进行回复突变(回复突变就是将人源框架区的某些氨基酸突变成鼠源框架区同一位置的氨基酸,回复突变的位点一般对维持抗体的结构和/或亲和力是至关重要的)。在进行回复突变时,将氨基酸序列进行kabat编码,位点的位置由kabat码指示。
[0159]
优选的,对于cdr移植重链可变区,根据kabat编码,将第28位的t回复突变为鼠源的v,将第44位的g回复为r,第94位的r回复为s。对于cdr移植轻链可变区,将第43位的a回复为t,第44位的p回复为v,第71位的f回复为y。
[0160]
上述带有回复突变位点的重链可变区和轻链可变区分别定义为人源化的重链可变区和轻链可变区(seq id no:11和12)。由上海生工生物工程有限公司合成编码上述人源化的重链和轻链可变区的dna。将合成的人源化重链可变区与人igg4(铰链区含有s228p点突变)恒定区(seq id no:148)相连,获得全长的人源化重链基因,命名为20-hu-hc;将人源化轻链可变区与人kappa链恒定区(seq id no:149)相连,获得全长的人源化轻链基因,命名为20-hu-lc。
[0161]
上述抗体的重链和轻链基因分别构建到pcdna3.4表达载体中,利用pei转染法将
所得重链和轻链表达载体一起转入hek293f细胞中以表达抗体。hek293f细胞在free style 293expression medium中培养5天后收取细胞上清,利用protein a亲和层析法纯化抗体。20-hu-hc与20-hu-lc组合后获得的抗体命名为20-hu。
[0162]
实施例1.2共同轻链的选择
[0163]
用blast对20-hu轻链可变区与601轻链可变区的氨基酸序列进行对比分析,结果显示,两者之间完全相同的氨基酸占比89%(identities),性质相似的氨基酸占比94%(positives)。
[0164]
将601-hc和601-lc的基因序列分别构建到pcdna3.4表达载体中。将20-hu-hc、20-hu-lc、601-hc和601-lc的表达载体按照下述方式进行组合:20-hu-hc 20-hu-lc、601-hc 601-lc、20-hu-hc 601-lc和601-hc 20-hu-lc,表达纯化抗体,所得的抗体分别命名为20-hu、601、20-hu-hc 601-lc和601-hc 20-hu-lc。
[0165]
elisa检测方法如下:自制带有6*his标签的人pd-1的胞外区蛋白(pd-1的胞外区来源如wo2018/137576a1中所述),将这种重组蛋白记作pd1-his。自制带有6*his标签的人vegf165(序列来自ncbi,accession:aam03108),将这种重组蛋白记作vegf165-his。用pd1-his和vegf165-his分别包被酶标板,包被浓度分别为20ng/孔和10ng/孔。
[0166]
如图2a所示,20-hu和20-hu-hc 601-lc能够有效结合pd1-his,ec50分别是0.2062nm和0.9747nm;而601和601-hc 20-hu-lc不能有效结合pd1-his,无法准确计算出ec50。如图2b所示,601和601-hc 20-hu-lc能够有效结合vegf165-his,ec50为0.4681nm和8.217nm,而20-hu和20-hu-hc 601-lc不能有效结合vegf165-his。
[0167]
与20-hu相比,20-hu-hc 601-lc对pd1-his的相对亲和力明显下降;与601相比,601-hc 20-hu-lc对vegf165-his的相对亲和力也明显下降。在此尝试用回复突变的方式,使20-hu-hc 601-lc对pd1-his的相对亲和力得到增强。分析发现,601轻链可变区和20-hu轻链可变区之间有12个氨基酸残基存在差异,其中28、32、34、46、50、71、93和94位上的氨基酸残基(按照kabat规则编码)对维持抗体的亲和力可能是至关重要的。在此,通过定点诱变,将601-lc上述位置的氨基酸残基分别突变成20-hu-lc对应位置的氨基酸残基,这些带有点突变的601-lc分别记作601-lc-d28g、601-lc-y32f、601-lc-n34s、601-lc-v46l、601-lc-f50y、601-lc-f71y、601-lc-t93n和601-lc-v94l。
[0168]
将上述轻链的基因序列分别构建到pcdna3.4表达载体中。将20-hu-hc与上述带有点突变的601-lc的表达载体分别进行组合,表达纯化抗体,所得的抗体分别命名为20-hu-hc 601-lc-d28g、20-hu-hc 601-lc-y32f、20-hu-hc 601-lc-n34s、20-hu-hc 601-lc-v46l、20-hu-hc 601-lc-f50y、20-hu-hc 601-lc-f71y、20-hu-hc 601-lc-t93n、20-hu-hc 601-lc-v94l。用上述实施例中描述的elisa评估上述抗体结合pd-1的相对亲和力,20-hu-hc 601-lc作为参照。elisa结果显示,上述突变体和20-hu-hc 601-lc的ec50分别为0.4849nm、0.4561nm、0.1751nm、0.5333nm、0.5255nm、1.0345nm、0.4859nm、0.3079nm和0.6251nm;与20-hu-hc 601-lc相比,20-hu-hc 601-lc-n34s和20-hu-hc 601-lc-v94l对pd-1的相对亲和力明显更高;其它突变抗体的相对亲和力与20-hu-hc 601-lc基本相同甚至更低。
[0169]
将601-hc与上述带有点突变的601-lc的表达载体分别进行组合,表达纯化抗体,所得的抗体分别命名为601-hc 601-lc-d28g、601-hc 601-lc-y32f、601-hc 601-lc-n34s、
601-hc 601-lc-v46l、601-hc 601-lc-f50y、601-hc 601-lc-f71y、601-hc 601-lc-t93n、601-hc 601-lc-v94l。用上述实施例中描述的elisa评估上述抗体结合vegf165的相对亲和力,601作为参照。elisa结果显示,上述突变体和601的ec50分别为0.1328nm、0.1254nm、0.2081nm、0.3256nm、0.1400nm、0.1481nm、0.1259nm、0.1243nm和0.1291nm;与601相比,601-hc 601-lc-n34s和601-hc 601-lc-v46l对vegf165的相对亲和力明显降低;其它突变抗体的相对亲和力与601基本相同。
[0170]
综上所述,v94l突变能够增强20-hu-hc 601-lc对pd-1的相对亲和力,同时又不降低601对vegf165的相对亲和力。在此选择601-lc-v94l(seq id no:13和14)作为共同轻链构建双特异性抗体。
[0171]
实施例1.3双特异性抗体的构建
[0172]
将20-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接601的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链基因命名为20-fab-601-igg4(seq id no:16和17)。相似地,将601的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接20-hu的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链基因命名为601-fab-20-igg4(seq id no:18和19)。
[0173]
将上述序列分别构建到pcdna3.4表达载体中,将20-fab-601-igg4和601-fab-20-igg4表达载体分别与601-lc-v94l表达载体组合,表达纯化抗体,所得的抗体分别命名为20-fab-601-igg4-v94l和601-fab-20-igg4-v94l。
[0174]
实施例1.4elisa测定相对亲和力
[0175]
如图3a所示,20-hu-hc 601-lc-v94l、20-fab-601-igg4-v94l和601-fab-20-igg4-v94l能够有效结合pd1-his,ec50分别是0.3314nm、0.4768nm和1.772nm。如图3b所示,601-hc 601-lc-v94l、20-fab-601-igg4-v94l和601-fab-20-igg4-v94l能够有效结合vegf165-his,ec50为0.01872nm、0.05859nm和0.03886nm。20-fab-601-igg4-v94l和601-fab-20-igg4-v94l既能够结合pd-1又能结合vegf,这说明它们是双特异性抗体。
[0176]
实施例1.5biacore测定亲和力
[0177]
在此通过biacore 8k(ge healthcare)检测上述抗体与pd-1或vegf之间的亲和力。在biacore 8k上,使用偶联有proteina/g的芯片分别捕获各种抗体,再将重组蛋白pd1-his或vegf165-his进样,得到结合-解离曲线,用6m盐酸胍再生缓冲液洗脱后重复下一个循环;利用biacore 8k evaluation software对数据进行分析。结果如表2所示。
[0178]
表2-1.对pd-1的结合和解离动力学参数以及平衡解离常数
[0179]
[0180]
表2-2.对vegf的结合和解离动力学参数以及平衡解离常数
[0181][0182]
表2-1显示,20-hu-hc 601-lc-v94l和20-fab-601-igg4-v94l对pd-1的平衡解离常数(kd)十分相近,kd分别是1.59e-09和8.85e-10。表2-2显示,601-hc 601-lc-v94l和20-fab-601-igg4-v94l对vegf165-his的结合常数(kon)和解离常数(koff)十分相近,平衡解离常数(kd)也基本相当,kd分别是7.46e-12和9.26e-12。平衡解离常数(kd)与亲和力高低成反比。
[0183]
实施例1.6物理化学性质的表征
[0184]
实施例1.6.1 hplc-sec
[0185]
图4a表示单抗601-hc 601-lc-v94l的hplc-sec图谱,其中存在2个明显的峰,分别是peak1和peak2,占比分别为0.7%和99.3%。其中peak1的保留时间短于主峰peak2,说明peak1可能是聚集体产生的;图中没有出现可能代表降解片段或不完整组装分子的峰。图4b表示20-fab-601-igg4-v94l的hplc-sec图谱,其中存在两个明显的峰,分别是peak1和peak2,占比分别为0.7%和99.3%。其中peak1的保留时间短于主峰peak2,说明peak1可能是聚集体产生的;图中没有出现可能代表降解片段或不完整组装分子的峰。
[0186]
实施例1.6.2 hplc-iec
[0187]
图5a和5b表示601-hc 601-lc-v94l和20-fab-601-igg4-v94l的hplc-iec图谱,它们的主峰分别占比79.31%和80.64%,该结果表明20-fab-601-igg4-v94l的电荷异质性与601-hc 601-lc-v94l相当。
[0188]
实施例1.6.3 ce-sds
[0189]
图6a和图6b分别表示601-hc 601-lc-v94l的nr-ce-sds和r-ce-sds的图谱,nr-ce-sds图谱中主峰peak9占比97.90%;r-ce-sds图谱中两个主峰peak6(对应轻链)和peak12(对应重链)分别占比30.92%和65.27%,两者峰面积之比为1:2.1。图6c和图6d分别表示20-fab-601-igg4-v94l的nr-ce-sds和r-ce-sds的图谱,nr-ce-sds图谱中主峰peak13占比96.74%;r-ce-sds图谱中两个主峰peak3(对应轻链)和peak12(对应重链)分别占比38.42%和59.74%,两者峰面积之比为2:3.1。nr-ce-sds中,601-hc 601-lc-v94l和20-fab-601-igg4-v94l的主峰占比十分相近;r-ce-sds中,601-hc 601-lc-v94l和20-fab-601-igg4-v94l的轻链和重链的峰面积之比均符合预期。
[0190]
实施例1.6.4 dsc
[0191]
图7a和7b分别表示601-hc 601-lc-v94l和20-fab-601-igg4-v94l的dsc图谱。其中601-hc 601-lc-v94l的tmonset和tm分别为66.46℃和75.37℃,20-fab-601-igg4-v94l的tmonset和tm分别为65.92℃和74.28℃,该结果表明20-fab-601-igg4-v94l的热稳定性与601-hc 601-lc-v94l非常相近。
[0192]
实施例1.7改进型双特异性抗体的构建
[0193]
实施例1.7.1双特异性抗体的构建
[0194]
在美国专利申请us20020032315a1中,相关发明人利用噬菌体展示法对bevacizumab的重链可变区和轻链可变区进行改造,获得了亲和力和中和活性更高的重链可变区氨基酸序列y0313-1(us20020032315a1中的seq id no:114,即本发明中的seq id no:20)。
[0195]
在此用y0313-1置换了20-fab-601-igg4-v94l中的601(bevacizumab)重链可变区。方法如下:将20-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接y0313-1的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链基因命名为20-fab-0313-igg4(seq id no:21和22)。
[0196]
将上述序列构建到pcdna3.4表达载体中,将20-fab-0313-igg4与601-lc-v94l表达载体组合,表达纯化抗体,所得的抗体分别命名为20-fab-0313-igg4-v94l。
[0197]
实施例1.7.2测定对vegf生物活性的中和能力
[0198]
人脐静脉内皮细胞(human umbilical vein endothelial cells,huvec)购自澳赛尔斯(allcells)生物技术有限公司。用脐静脉内皮细胞完全培养基(购自allcells,货号和规格:h-004/500ml)对huvec进行培养和传代。待huvec生长至对数生长期时,用胰酶消化使细胞脱落,离心后用完全培养基重悬细胞,然后按照8000细胞/孔的密度接种于96孔细胞培养板中;24小时后,将96孔板中的完全培养基置换为基础培养基(购自allcells,货号和规格:h-004b/500ml),150μl/孔;在含有400ng/ml重组vegf165(购自acrobiosystems,货号:ve5-h4210)的基础培养中对抗体进行梯度稀释,然后将vegf165和抗体的混合溶液加入96孔板中,50μl/孔;在37℃、5%co2细胞培养箱中继续孵育3天;3天后每孔加入20μl cck-8(dojindo)溶液,在培养箱中继续孵育4小时;用酶标仪读取od450;graphpad prism6进行数据分析,作图并计算ic50。
[0199]
如图8所示,601、20-fab-601-igg4-v94l、601-fab-20-igg4-v94l和20-fab-0313-igg4-v94l均能有效抑制vegf165诱导的huvec细胞增殖,它们的ic50分别为4.422nm、9.039nm、3.84nm和1.632nm。上述结果显示,20-fab-0313-igg4-v94l中和vegf165生物活性的能力最强。
[0200]
实施例1.7.3评估增强mlr的功能活性
[0201]
如图9a和图9b所示,20-humanized(即20-hu)、20-hu-hc 601-lc-v94l和20-fab-0313-igg4-v94l均能有效刺激mlr分泌il-2和ifn-γ,刺激mlr分泌il-2的ec50分别为0.2571nm、0.3703nm和0.7554nm,刺激mlr分泌ifn-γ的ec50分别为0.1426nm、0.247nm和1.036nm。
[0202]
实施例1.7.4测定抗pd-1和vegf双特异性抗体同时结合两种抗原的能力
[0203]
用vegf165(购自acrobiosystems,货号:ve5-h4210)包被微孔板。用含1%牛血清白蛋白的pbst将待测抗体进行梯度稀释,然后转移到上述微孔板中,室温孵育半小时左右;pbst洗板三遍;将生物素化的人pd-1胞外段重组蛋白(购自sino biological,货号:10377-h08h-b)稀释到200ng/ml,转移到微孔板中,室温孵育半小时左右;pbst洗板三遍;将streptavidin-hrp(购自bd biosciences,货号:554066)稀释1000倍,转移到微孔板中,室温孵育半小时左右;pbst洗板三遍;加入tmb显色液(100μl/孔),室温孵育1~5min;加终止
液(50μl/孔),终止显色反应;用酶标仪读取od450;用graphpad prism6进行数据分析和作图,并计算ec50。
[0204]
如图10所示,20-fab-0313-igg4-v94l在结合vegf165之后仍然能够有效地继续结合人pd-1,ec50为0.3293nm。601和20-hu-hc 601-lc-v94l都不能同时结合pd-1和vegf165。
[0205]
实施例1.7.5测定抗pd-1和vegf双特异性抗体在大鼠体内的药代动力学
[0206]
采用sd(sprague-dawley)大鼠(购自浙江维通利华实验动物技术有限公司)进行双特异性抗体的药代动力学研究。每组四只大鼠,体重200g左右,每只通过静脉注射(intravenous injection,i.v.)剂量为1mg的抗体;分别在给药后的特定时间眼眶取血,血液自然凝固后离心取血清。
[0207]
血清中目的抗体浓度的测量方法如下:用双特异性抗体对应的两种相关抗原(vegf165购自acrobiosystems,货号:ve5-h4210;带有6*his标签的人pd-1的胞外区重组蛋白的来源如实施例1.2中所述)分别包被酶标板,然后用含有1%牛血清白蛋白的pbst封闭酶标板。将适当稀释的大鼠血清分别转移到上述包被两种相关抗原的酶标板中;经过1小时的室温孵育之后洗板,然后加入hrp标记的羊抗人(fc-specific)抗体(购自sigma;该抗体经过种属交叉吸附处理,不识别大鼠抗体);经过半小时的室温孵育之后洗板,每孔加入100μl以tmb为底物的显色液,室温孵育1~5min;加50μl终止液(2m h2so4)终止反应;酶标仪读取od450,并用标准曲线将od450换算成抗体血清浓度;用graphpad prism6进行数据分析和作图;用phoenix软件计算抗体药物在大鼠体内的半衰期。
[0208]
如图11所示,计算出20-fab-0313-igg4-v94l的半衰期为16.9天(以pd-1为抗原的检测结果)和17.3天(以vegf165为抗原的检测结果)。上述结果表明,20-fab-0313-igg4-v94l具有良好的药代动力学性质。
[0209]
实施例1.7.6抗pd-1和vegf双特异性抗体在小鼠体内的抗肿瘤作用
[0210]
利用人外周血单个核细胞(pbmc)在nsg小鼠体内重建人源免疫系统,并在此小鼠上建立人肺癌nci-h460皮下移植瘤模型。该小鼠模型同时存在表达人pd-1蛋白的t细胞,以及表达人vegf的人类肿瘤细胞,因此可以用来评价抗pd-1和vegf双特异性抗体的体内抗肿瘤活性。具体实施步骤如下:收集体外培养的人非小细胞肺癌nci-h460细胞(htb-177
tm
),将细胞悬液浓度调整为1
×
108/ml,与matrigel(购自bd biosciences,货号:356234)以等体积混合。体外复苏购买的pbmc(购自allcells,货号:pb005-c),用pbs重悬pbmc细胞,将pbmc悬液浓度调整为1
×
107/ml。将混合好的肿瘤细胞悬液和pbmc悬液以等体积混合。在无菌条件下,接种200μl细胞混合悬液于m-nsg小鼠(购自上海南方模式生物研究中心)右侧上背部皮下。当天将接种混合细胞的小鼠按体重随机分组,每组10只小鼠。各组小鼠药物处理情况如下:对照组,仅注射生理盐水;avastin组,注射10mg/kg的抗vegf阳性对照抗体avastin(由罗氏制药生产);opdivo组,注射10mg/kg的抗pd-1阳性对照抗体opdivo(由百时美施贵宝生产);20-fab-0313-igg4-v94l组,注射16mg/kg的20-fab-0313-igg4-v94l。考虑到双特异性抗体和单克隆抗体的分子量存在差异,本实验中药物剂量按照等物质的量进行设定。随后,按照上述设计好的方案给药,每周给药2次,共给药10次,每周测定肿瘤体积2次。最终,测定的各组肿瘤随时间的生长曲线如图12所示。
[0211]
结果显示,在第31天实验结束时,avastin、opdivo和20-fab-0313-igg4-v94l各组的抑瘤率分别为84.5%、35.8%和96.6%(抑瘤率=(对照组平均体积-实验组平均体积)/
对照组平均体积
×
100%)。与avastin和opdivo相比,20-fab-0313-igg4-v94l能够更加有效地抑制肿瘤生长。
[0212]
实施例2构建抗pd-1和tgf-beta的双特异性抗体
[0213]
实施例2.1序列
[0214]
us5571714a公开了一系列抗tgf-β(transforming growth factor beta)单克隆抗体,其中鼠源单抗1d11.16(后续简称1d11)能够有效结合tgf-β1和-β2。相关发明人已将1d11对应的杂交瘤存储到美国典型培养物保藏中心(hb-9849
tm
)。从us20180244763a1获得鼠源1d11序列。
[0215]
对1d11号抗体的重链可变区和轻链可变区氨基酸序列进行分析,依据kabat规则分别确定1d11号抗体重链和轻链的抗原互补决定区和框架区。1d11号抗体重链cdr的氨基酸序列为h-cdr1:tywmn(seq id no:23)、h-cdr2:qifpasgstnynemfeg(seq id no:24)和h-cdr3:gdgnyaldamdy(seq id no:25),轻链cdr的氨基酸序列为l-cdr1:rasesvdsygnsfmh(seq id no:26)、l-cdr2:lasnles(seq id no:27)和l-cdr3:qqnnedplt(seq id no:28)。
[0216]
在https://www.ncbi.nlm.nih.gov/igblast/,将鼠源1d11号抗体的重链可变区与人igg胚系序列进行同源性比较,选择ighv1-46*01为重链cdr移植模板,将鼠源的1d11号抗体的重链cdr移植入ighv1-46*01骨架区,并在h-cdr3之后加入wgqgtlvtvss(seq id no:151)作为第四个框架区,获得cdr移植重链可变区序列。同样地,将鼠源1d11号抗体的轻链可变区与人igg胚系序列同源性比较,选择igkv7-3*01为轻链cdr移植模板,将鼠源1d11号抗体的轻链cdr移植入igkv7-3*01的骨架区,并在l-cdr3之后加入fgggtkvelk(seq id no:153)作为第四个框架区,获得cdr移植轻链可变区序列。在cdr移植可变区的基础上,对一些框架区的氨基酸位点进行回复突变。在进行回复突变时,将氨基酸序列进行kabat编码,位点的位置由kabat码指示。
[0217]
优选的,对于cdr移植重链可变区,将第28位的t回复为鼠源的i,第30位的t回复为i,第48位的m回复为i,第67位的v回复为a,第69位的m回复为l,第71位的r回复为v,第78位的v回复为a。对于cdr移植轻链可变区,将第81位的n回复为d。
[0218]
上述人源化的重链可变区和轻链可变区(seq id no:29和30)由上海生工生物工程有限公司合成编码上述可变区的dna。将合成的人源化重链可变区与人igg4(铰链区含有s228p点突变)重链恒定区(seq id no:148)相连,获得全长的人源化重链基因,命名为1d11-hu-hc;将人源化轻链可变区与人kappa轻链恒定区(seq id no:149)相连,获得全长的人源化轻链基因,命名为1d11-hu-lc。
[0219]
上述抗体的重链和轻链基因分别构建到pcdna3.4表达载体中,表达纯化抗体。
[0220]
1d11-hu-hc与1d11-hu-lc组合后获得的抗体定义为1d11-hu。
[0221]
us20100136021a1也公开了一系列抗tgf-β抗体,其中单抗mab12.7(后续简称mab127)能够有效结合并中和tgf-β1、tgf-β2和tgf-β3。从us20100136021a1中获得mab127的重链可变区和轻链可变区序列(seq id no:31和32)。
[0222]
由上海生工生物工程有限公司合成编码上述可变区的dna。将合成的重链可变区与人igg4(铰链区含有s228p点突变)重链恒定区(seq id no:148)相连,获得全长的重链基因,命名为mab127-hc;将轻链可变区与人kappa轻链恒定区(seq id no:149)相连,获得全长的轻链基因,命名为mab127-lc。
[0223]
根据wo2018/137576a1中实施例1-5所述,挑取14号鼠源单抗作为先导抗体并获得其重链可变区核苷酸序列和轻链可变区核苷酸序列,并翻译成氨基酸序列(seq id no:33和34)。
[0224]
对14号抗体的重链可变区和轻链可变区氨基酸序列进行分析,依据kabat规则分别确定14号抗体重链和轻链的抗原互补决定区和框架区。14号抗体重链cdr的氨基酸序列为h-cdr1:gytmn(seq id no:35)、h-cdr2:linpyngdtsynqkfkg(seq id no:36)和h-cdr3:wrytmdy(seq id no:37),轻链cdr的氨基酸序列为l-cdr1:rasesvdnygnsfmn(seq id no:38)、l-cdr2:fasnles(seq id no:39)和l-cdr3:qqnneappt(seq id no:40)。
[0225]
在https://www.ncbi.nlm.nih.gov/igblast/,将鼠源14号抗体的重链可变区与人igg胚系序列进行同源性比较,选择ighv1-46*01为重链cdr移植模板,将鼠源的14号抗体的重链cdr移植入ighv1-46*01骨架区,并在h-cdr3之后加入wgqgtlvtvss(seq id no:151)作为第四个框架区,获得cdr移植重链可变区序列。同样地,将鼠源14号抗体的轻链可变区与人igg胚系序列进行同源性比较,选择igkv7-3*01为轻链cdr移植模板,将鼠源14号抗体的轻链cdr移植入igkv7-3*01的骨架区,并在l-cdr3之后加入fgqgtkveik(seq id no:152)作为第四个框架区,获得cdr移植轻链可变区序列。在cdr移植可变区的基础上,对一些框架区的氨基酸位点进行回复突变。在进行回复突变时,将氨基酸序列进行kabat编码,位点的位置由kabat码指示。
[0226]
优选的,对于cdr移植重链可变区,将第28位(kabat编码)的t回复为鼠源的s,第48位的m回复为i,第67位的v回复为a,第69位的m回复为v,第71位的r回复为v,第73位的t回复为k,第78位的v回复为a。对于cdr移植轻链可变区,将第46位的l回复为p,第68位的g回复为r,第81位的n回复为d。
[0227]
上述带有回复突变位点的重链和轻链可变区分别定义为人源化的重链可变区和轻链可变区(seq id no:41和42)。由上海生工生物工程有限公司合成编码上述人源化的重链和轻链可变区的dna。将合成的人源化重链可变区与人igg4(铰链区含有s228p点突变)重链恒定区(seq id no:148)相连,获得全长的人源化重链基因,命名为14-hu-hc;将人源化轻链可变区与人kappa轻链恒定区(seq id no:149)相连,获得全长的人源化轻链基因,命名为14-hu-lc。
[0228]
上述抗体的重链和轻链基因分别构建到pcdna3.4表达载体中,表达纯化抗体。14-hu-hc与14-hu-lc组合后获得的抗体定义为14-hu。
[0229]
实施例2.2共同轻链的选择
[0230]
用blast对14-hu轻链可变区与1d11-hu轻链可变区的氨基酸序列进行对比分析,结果显示,两者之间完全相同的氨基酸占比92%(identities),性质相似的氨基酸占比94%(positives)。
[0231]
将14-hu-hc、14-hu-lc、1d11-hu-hc和1d11-hu-lc的表达载体按照下述方式进行组合:14-hu-hc 14-hu-lc、1d11-hu-hc 1d11-hu-lc、14-hu-hc 1d11-hu-lc和1d11-hu-hc 14-hu-lc,表达纯化抗体,所得的抗体分别命名为14-hu、1d11-hu、14-hu-hc 1d11-hu-lc和1d11-hu-hc 14-hu-lc。
[0232]
elisa检测方法如下:自制带有6*his标签的人pd-1的胞外区蛋白(pd-1胞外区来源如wo2018/137576a1中所述),将这种重组蛋白记作pd1-his并用其包被酶标板(20ng/
孔);用tgf-β1(购自sino biological)包被酶标板(5ng/孔)。
[0233]
如图13a所示,14-hu能够有效结合pd1-his,ec50是0.3924nm;而1d11-hu、14-hu-hc 1d11-hu-lc和1d11-hu-hc 14-hu-lc不能有效结合pd1-his。如图13b所示,1d11-hu能够有效结合tgf-β1,ec50为0.06624nm,1d11-hu-hc 14-hu-lc也能结合tgf-β1,ec50为0.5255nm,而14-hu和14-hu-hc 1d11-hu-lc不能结合tgf-β1。在此选择14-hu-lc(seq id no:43和44)作为共同轻链构建双特异性抗体。
[0234]
用blast对14-hu轻链可变区与mab127轻链可变区的氨基酸序列进行对比分析,结果显示,两者之间完全相同的氨基酸占比75%(identities),性质相似的氨基酸占比83%(positives)。
[0235]
将14-hu-lc、mab127-hc和mab127-lc的表达载体按照下述方式进行组合:mab127-hc mab127-lc和mab127-hc 14-hu-lc,表达纯化抗体,所得的抗体分别命名为mab127和mab127-hc 14-hu-lc。
[0236]
用上述实施例中描述的elisa检测1d11-hu、1d11-hu-hc 14-hu-lc、mab127和mab127-hc 14-hu-lc对tgf-β1的相对亲和力,用graphpad prism6进行作图和数据分析,并计算ec50。
[0237]
如图14所示,1d11-hu、mab127和mab127-hc 14-hu-lc均能够有效结合tgf-β1,ec50分别是0.1338nm、0.04136nm和0.07105nm。与1d11-hu相比,mab127和mab127-hc 14-hu-lc有更低的ec50和更高的平台,因此两者对tgf-β1具有更高的亲和力。在此选择14-hu-lc(seq id no:43和44)作为共同轻链构建双特异性抗体。
[0238]
实施例2.3双特异性抗体的构建
[0239]
将14-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接1d11的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链基因命名为14-fab-1d11-igg4(seq id no:45和46)。相似地,将1d11的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接14-hu的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链基因命名为1d11-fab-14-igg4(seq id no:47和48)。
[0240]
按照上述实施例中描述的方法,将14-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接mab127的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链基因命名为14-fab-127-igg4(seq id no:49和50)。相似地,将mab127的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接14-hu的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链基因命名为127-fab-14-igg4(seq id no:51和52)。
[0241]
将上述序列分别构建到pcdna3.4表达载体中,将14-fab-1d11-igg4、1d11-fab-14-igg4、14-fab-127-igg4和127-fab-14-igg4表达载体分别与14-hu-lc表达载体组合,表
达纯化抗体,所得的抗体分别命名为14-fab-1d11-igg4、1d11-fab-14-igg4、14-fab-127-igg4和127-fab-14-igg4。
[0242]
实施例2.4 elisa测定相对亲和力
[0243]
如图15a所示,14-hu、14-fab-1d11-igg4、1d11-fab-14-igg4、14-fab-127-igg4和127-fab-14-igg4均能够结合pd1-his,ec50分别是0.4321nm、0.4367nm、1.996nm、0.3873nm和3.955nm;与14-fab-1d11-igg4和14-fab-127-igg4相比,1d11-fab-14-igg4和127-fab-14-igg4对pd1-his的相对亲和力更弱,这可能是由空间位阻造成的。如图15b所示,1d11-hu-hc 14-hu-lc、mab127-hc 14-hu-lc、14-fab-1d11-igg4、1d11-fab-14-igg4、14-fab-127-igg4和127-fab-14-igg4均能结合tgf-β1,ec50分别是1.267nm、0.0803nm、0.6985nm、0.3628nm、0.1525nm和0.1083nm。与1d11-hu-hc 14-hu-lc、14-fab-1d11-igg4和1d11-fab-14-igg4相比,mab127-hc 14-hu-lc、14-fab-127-igg4和127-fab-14-igg4对tgf-β1的相对亲和力更强。
[0244]
实施例2.5评估增强mlr的功能活性
[0245]
如图16a和16b所示,14-hu和14-fab-127-igg4均能有效刺激mlr分泌il-2和ifn-γ,刺激mlr分泌il-2的ec50分别为0.1008nm和0.3185nm,刺激mlr分泌ifn-γ的ec50分别为0.04716nm和0.5871nm。另外,实验结果显示,在较高浓度下,与14-hu相比,14-fab-127-igg4能够刺激mlr分泌更多il-2和ifn-γ。
[0246]
实施例2.6测定抗pd-1和tgf-beta双特异性抗体同时结合两种抗原的能力
[0247]
用tgf-β1(购自sino biological,货号:10804-hnac)包被微孔板。用含1%牛血清白蛋白的pbst将待测抗体进行梯度稀释,然后转移到上述微孔板中,室温孵育半小时左右。后续实验步骤与实施例1.7.4相同。
[0248]
如图17所示,14-fab-127-igg4在结合tgf-β1之后仍然能够有效地继续结合人pd-1,ec50为0.2784nm。14-hu和mab127-hc 14-hu-lc都不能同时结合pd-1和tgf-β1。
[0249]
实施例2.7抗pd-1和tgf-beta双特异性抗体在小鼠体内的抗肿瘤作用
[0250]
人pd-1转基因小鼠(种系背景为c57bl/6)和mc38小鼠结直肠癌细胞购自上海南方模式生物研究中心,该转基因小鼠中用人源pd-1基因的胞外段替换了小鼠的同源部分。本发明的双特异性抗体能够识别该转基因小鼠中的pd-1分子,也可以结合小鼠内源的tgf-beta。具体实施步骤如下:将mc38在体外培养,培养基为含有10%血清的dmem(血清和培养基购自gibco);将培养的mc38细胞接种于人pd-1转基因小鼠中,每只小鼠皮下接种2
×
106个细胞;待接种的肿瘤细胞生长至体积接近100mm3时,将小鼠随机分组,每组8只小鼠。各组小鼠药物处理情况如下:对照组,仅注射生理盐水;keytruda组(两个剂量组),注射2mg/kg或10mg/kg的抗pd-1阳性对照抗体keytruda(由默沙东公司生产);14-fab-127-igg4组(两个剂量组),注射3.2mg/kg或16mg/kg的14-fab-127-igg4。考虑到双特异性抗体和单克隆抗体的分子量存在差异,本实验中药物剂量按照等物质的量进行设定。随后,按照上述设计好的方案给药,每周给药2次,共给药6次,每周测定肿瘤体积2次。最终,测定的各组肿瘤随时间的生长曲线如图18所示。
[0251]
结果显示,在第25天实验结束时,keytruda(两个剂量组)和14-fab-127-igg4(两个剂量组)各组的抑瘤率分别为79.2%(2mg/kg)、77.7%(10mg/kg)、85.1%(3.2mg/kg)和100%(16mg/kg)(抑瘤率=(对照组平均体积-实验组平均体积)/对照组平均体积
×
100%)。与keytruda相比,14-fab-127-igg4能够更加有效地抑制肿瘤生长,并且14-fab-127-igg4在高剂量时能够导致所有小鼠的肿瘤完全消退。
[0252]
实施例3构建抗her-2和cd47的双特异性抗体
[0253]
实施例3.1序列
[0254]
19h6-hu是人源化的抗人her2单抗,其重链可变区和轻链可变区序列来自于wo2020/025013a1,人源化的重链可变区和轻链可变区分别命名为19h6-hu-vh和19h6-hu-vl(seq id no:53和54)。
[0255]
由上海生工生物工程有限公司合成编码上述人源化的重链可变区和轻链可变区的dna。将合成的人源化重链可变区与人igg1重链恒定区(seq id no:147)相连,获得全长的人源化重链基因,命名为19h6-hu-hc;将人源化轻链可变区与人kappa链恒定区(seq id no:149)相连,获得全长的人源化轻链基因,命名为19h6-hu-lc。将19h6-hu-hc和19h6-hu-lc基因分别构建到pcdna3.4表达载体中,表达纯化抗体,所得抗体命名为19h6-hu。
[0256]
mabl-2(后文中称为anti-cd47b)是抗人cd47的鼠源单抗,其重链可变区和轻链可变区氨基酸序列来自于us20030108546a中的seq id no:12和seq id no:10。
[0257]
对anti-cd47b抗体的重链可变区和轻链可变区氨基酸序列进行分析,依据kabat规则分别确定anti-cd47b抗体重链和轻链的抗原互补决定区和框架区。anti-cd47b抗体重链cdr的氨基酸序列为h-cdr1:nhvih(seq id no:55)、h-cdr2:yiypyndgtkynekfkd(seq id no:56)和h-cdr3:ggyytydd(seq id no:57),轻链cdr的氨基酸序列为l-cdr1:rssqslvhsngktylh(seq id no:58)、l-cdr2:kvsnrfs(seq id no:59)和l-cdr3:sqsthvpyt(seq id no:60)。
[0258]
在https://www.ncbi.nlm.nih.gov/igblast/,将鼠源anti-cd47b抗体的重链可变区与人igg胚系序列进行同源性比较,选择ighv1-46*01为重链cdr移植模板,将鼠源的anti-cd47b抗体的重链cdr移植入ighv1-46*01骨架区,并在h-cdr3之后加入wgqgtlvtvss(seq id no:151)作为第四个框架区,获得cdr移植重链可变区序列。同样地,将鼠源anti-cd47b抗体的轻链可变区与人igg胚系序列同源性比较,选择igkv2-30*01为轻链cdr移植模板,将鼠源anti-cd47b抗体的轻链cdr移植入igkv2-30*01的骨架区,并在l-cdr3之后加入fgqgtkveik(seq id no:152)作为第四个框架区,获得cdr移植轻链可变区序列。在cdr移植可变区的基础上,对一些框架区的氨基酸位点进行回复突变。在进行突变时,将氨基酸序列进行kabat编码,位点的位置由kabat码指示。
[0259]
优选的,对于cdr移植重链可变区,根据kabat编码,将第30位的t突变为a,将第69位的m突变为l,将第71位的r突变为s,将第73位的t突变为k。对于cdr移植轻链可变区,将第36位的f突变为y,第46位的r突变为l。
[0260]
上述带有突变位点的重链可变区和轻链可变区分别定义为人源化的重链可变区和轻链可变区,分别命名为anti-cd47b-hu-vh和anti-cd47b-hu-vl(seq id no:61和62)。
[0261]
由上海生工生物工程有限公司合成编码上述人源化的重链可变区和轻链可变区的dna。将合成的人源化重链可变区与人igg1重链恒定区(seq id no:147)相连,获得全长的人源化重链基因,命名为anti-cd47b-hu-hc;将人源化轻链可变区与人kappa链恒定区(seq id no:149)相连,获得全长的人源化轻链基因,命名为anti-cd47b-hu-lc。将anti-cd47b-hu-hc和anti-cd47b-hu-lc基因分别构建到pcdna3.4表达载体中,表达纯化抗体,所
得抗体命名为anti-cd47b-hu。
[0262]
实施例3.2共同轻链的选择
[0263]
用blast对19h6-hu轻链可变区与anti-cd47b-hu轻链可变区的氨基酸序列进行对比分析,结果显示,两者之间完全相同的氨基酸占比96%(identities),性质相似的氨基酸占比99%(positives)。
[0264]
将19h6-hu和anti-cd47b-hu的重链和轻链基因按照下述方式进行组合:19h6-hu-hc anti-cd47b-hu-lc和anti-cd47b-hu-hc 19h6-hu-lc,表达纯化抗体,所得的抗体分别命名为19h6-hu-hc anti-cd47b-hu-lc和anti-cd47b-hu-hc 19h6-hu-lc。
[0265]
elisa检测方法如下:带有多聚组氨酸标签的人her-2胞外段的重组蛋白购自acrobiosystems(货号:he2-h5225),带多聚组氨酸标签的人cd47胞外段的重组蛋白购自sino biological(货号:12283-h08h),将这两种重组蛋白名称分别记作her2-ecd-his和cd47-ecd-his。用her2-ecd-his和cd47-ecd-his分别包被酶标板,包被浓度均为10ng/孔。
[0266]
如图19a所示,19h6-hu和19h6-hu-hc anti-cd47b-hu-lc均能够有效结合her2-ecd-his,ec50分别是0.07701nm和0.1388nm;而anti-cd47b-hu和anti-cd47b-hu-hc 19h6-hu-lc不能有效结合her2-ecd-his。如图19b所示,anti-cd47b-hu和anti-cd47b-hu-hc 19h6-hu-lc均能有效结合cd47-ecd-his,ec50分别是0.04276nm和0.0541nm,而19h6-hu和19h6-hu-hc anti-cd47b-hu-lc不能有效结合cd47-ecd-his。在此选择19h6-hu-lc(seq id no:63和64)作为共同轻链构建双特异性抗体。
[0267]
实施例3.3双特异性抗体的构建
[0268]
将anti-cd47b-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接19h6-hu的重链可变区,最后再连接人igg1的重链恒定区(ch1 ch2 ch3),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为cd47b-fab-19h6-igg1(seq id no:65和66)。相似地,将19h6-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接anti-cd47b-hu的重链可变区,最后再连接人igg1的重链恒定区(ch1 ch2 ch3),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为19h6-fab-cd47b-igg1(seq id no:67和68)。
[0269]
将上述序列分别构建到pcdna3.4表达载体中,将cd47b-fab-19h6-igg1和19h6-fab-cd47b-igg1表达载体分别与19h6-hu-lc表达载体组合,表达纯化抗体,所得的抗体分别命名为cd47b-fab-19h6-igg1和19h6-fab-cd47b-igg1(为简明起见,此处只取重链的名字作为抗体的名称)。
[0270]
实施例3.4 elisa测定相对亲和力
[0271]
如图20a所示,19h6-hu、cd47b-fab-19h6-igg1和19h6-fab-cd47b-igg1均能有效结合her2-ecd-his,ec50分别是0.1262nm、0.1057nm和0.1543nm。如图20b所示,anti-cd47b-hu-hc 19h6-hu-lc、cd47b-fab-19h6-igg1和19h6-fab-cd47b-igg1均能有效结合cd47-ecd-his,ec50分别是0.06166nm、0.07817nm和0.1945nm。上述结果显示,cd47b-fab-19h6-igg1和19h6-fab-cd47b-igg1既能够结合her-2又能结合cd47,这说明它们是双特异性抗体。
[0272]
实施例4构建抗her-2和cd137的双特异性抗体
[0273]
实施例4.1序列
[0274]
19h6-hu是人源化的抗人her2单抗,其来源如实施例3.1所述。
[0275]
94号抗体是本公司实验室内部制备的鼠源抗人cd137抗体,制备方法参照wo2018/137576a1中实施例1-5所述,不同之处在于使用人cd137重组蛋白免疫小鼠和使用人cd137重组蛋白对杂交瘤细胞进行elisa筛选,其重链可变区氨基酸序列和轻链可变区氨基酸序列分别如seq id no:69和70所示。
[0276]
对94号抗体的重链可变区和轻链可变区氨基酸序列进行分析,依据kabat规则分别确定94号抗体重链和轻链的抗原互补决定区和框架区。94号抗体重链cdr的氨基酸序列为h-cdr1:sydis(seq id no:71)、h-cdr2:viwtgggtnynsafms(seq id no:72)和h-cdr3:mdy(seq id no:73),轻链cdr的氨基酸序列为l-cdr1:rssqsllhsngntylh(seq id no:74)、l-cdr2:kvsnrfs(seq id no:75)和l-cdr3:sqsthvpwt(seq id no:76)。
[0277]
在https://www.ncbi.nlm.nih.gov/igblast/,将鼠源94号抗体的重链可变区与人igg胚系序列进行同源性比较,选择ighv4-59*01为重链cdr移植模板,将鼠源的94号抗体的重链cdr移植入ighv4-59*01骨架区,并在h-cdr3之后加入wgqgtlvtvss(seq id no:151)作为第四个框架区,获得cdr移植重链可变区序列。同样地,将鼠源94号抗体的轻链可变区与人igg胚系序列同源性比较,选择igkv2-30*01为轻链cdr移植模板,将鼠源anti-cd47b抗体的轻链cdr移植入igkv2-30*01的骨架区,并在l-cdr3之后加入fgqgtkveik(seq id no:152)作为第四个框架区,获得cdr移植轻链可变区序列。在cdr移植可变区的基础上,对一些框架区的氨基酸位点进行回复突变。在进行突变时,将氨基酸序列进行kabat编码,位点的位置由kabat码指示。
[0278]
优选的,对于cdr移植重链可变区,根据kabat编码,将第27位的g突变为f,将第29位的i突变为l,将第48位的i突变为l,将第71位的r突变为s,将第71位的v突变为k,将第73位的t突变为n,将第76位的n突变为s,将第78位的f突变为v,将第93位的a突变为v。对于cdr移植轻链可变区,将第36位的f突变为y,第46位的r突变为l,将第48位的i突变为f,将第87位的y突变为f。
[0279]
上述带有突变位点的重链可变区和轻链可变区分别定义为人源化的重链可变区和轻链可变区,分别命名为94-hu-vh和94-hu-vl(seq id no:77和78)。
[0280]
由上海生工生物工程有限公司合成编码上述人源化的重链可变区和轻链可变区的dna。将合成的人源化重链可变区与人igg1重链恒定区(seq id no:147)相连,获得全长的人源化重链基因,命名为94-hu-hc;将人源化轻链可变区与人kappa链恒定区(seq id no:149)相连,获得全长的人源化轻链基因,命名为94-hu-lc。将94-hu-hc和94-hu-lc基因分别构建到pcdna3.4表达载体中,表达纯化抗体,所得抗体命名为94-hu。
[0281]
实施例4.2共同轻链的选择
[0282]
用blast对19h6-hu轻链可变区与94-hu轻链可变区的氨基酸序列进行对比分析,结果显示,两者之间完全相同的氨基酸占比97%(identities),性质相似的氨基酸占比99%(positives)。
[0283]
将19h6-hu和94-hu的重链和轻链基因按照下述方式进行组合:19h6-hu-hc 94-hu-lc和94-hu-hc 19h6-hu-lc,表达纯化抗体,所得的抗体分别命名为19h6-hu-hc 94-hu-lc和94-hu-hc 19h6-hu-lc。
[0284]
elisa检测方法如下:带有多聚组氨酸标签的人her-2胞外段的重组蛋白购自acrobiosystems(货号:he2-h5225),带fc标签的人cd137胞外段的重组蛋白购自sino biological(货号:10041-h02h),将这两种重组蛋白名称分别记作her2-ecd-his和cd137-ecd-fc。用her2-ecd-his和cd137-ecd-fc分别包被酶标板,包被浓度均为10ng/孔。
[0285]
如图21a所示,19h6-hu和19h6-hu-hc 94-hu-lc均能够有效结合her2-ecd-his,ec50分别是0.1222nm和0.1391nm;而94-hu和94-hu-hc 19h6-hu-lc不能有效结合her2-ecd-his。如图21b所示,94-hu和94-hu-hc 19h6-hu-lc均能有效结合cd137-ecd-fc,ec50分别是0.3913nm和0.634nm,而19h6-hu和19h6-hu-hc 94-hu-lc不能有效结合cd137-ecd-fc。在此选择19h6-hu-lc(seq id no:63和64)作为共同轻链构建双特异性抗体(实际上也可以选择94-hu-lc作为共同轻链构建双特异性抗体)。
[0286]
实施例4.3双特异性抗体的构建
[0287]
将94-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接19h6-hu的重链可变区,最后再连接人igg1的重链恒定区(ch1 ch2 ch3),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为94-fab-19h6-igg1。相似地,将19h6-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接94-hu的重链可变区,最后再连接人igg1的重链恒定区(ch1 ch2 ch3),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为19h6-fab-94-igg1。
[0288]
为降低上述双抗分子的fc段与fcγrs(fc gamma receptors)之间的相互作用,将它们fc段的第234的亮氨酸和235位的亮氨酸都突变为丙氨酸,将该突变标记为lala(参考文献:wang x,mathieu m,brezski r j.igg fc engineering to modulate antibody effector functions[j].protein&cell,2018,9(1):63-73.)。突变后的上述双抗分子的名称分别为94-fab-19h6-igg1-lala(seq id no:79和80)和19h6-fab-94-igg1-lala(seq id no:81和82)。在此,lala突变的目的主要是降低潜在的体内毒性(参考文献:ho s k,xu z,thakur a,et al.epitope and fc-mediated crosslinking,but not high affinity,are critical for antitumor activity of cd137 agonist antibody with reduced liver toxicity[j].molecular cancer therapeutics,2020.pp.1040
–
1051.)。
[0289]
将上述序列分别构建到pcdna3.4表达载体中,将94-fab-19h6-igg1-lala和19h6-fab-94-igg1-lala表达载体分别与19h6-hu-lc表达载体组合,表达纯化抗体,所得的抗体分别命名为94-fab-19h6-igg1-lala和19h6-fab-94-igg1-lala(为简明起见,此处只取重链的名字作为抗体的名称)。
[0290]
实施例4.4 elisa测定相对亲和力
[0291]
如图22a所示,19h6-hu、94-fab-19h6-igg1-lala和19h6-fab-94-igg1-lala均能有效结合her2-ecd-his,ec50分别是0.1933nm、0.1579nm和0.1201nm。如图22b所示,94-hu-hc 19h6-hu-lc和94-fab-19h6-igg1-lala均能有效结合cd137-ecd-fc,ec50分别是0.634nm和0.2411nm;19h6-fab-94-igg1-lala对cd137-ecd-fc的结合较弱,ec50为和27.56nm。上述结果显示,94-fab-19h6-igg1-lala和19h6-fab-94-igg1-lala既能够结合her-2又能结合cd137,这说明它们是双特异性抗体。
[0292]
实施例5构建抗pd-1和cd137的双特异性抗体
[0293]
实施例5.1序列
[0294]
mab1-25-hu(后文中简称为609)是人源化的抗人pd-1单抗,其重链可变区和轻链可变区序列来自于wo2018/137576a1,人源化的重链可变区和轻链可变区(seq id no:83和84)分别与人igg4(s228p)重链恒定区(seq id no:148)和kappa轻链恒定区(seq id no:149)相连,最终获得完整的人源化mab1-25-hu单抗(609)的重链和轻链基因。
[0295]
4b4-1-1(后文中称为anti-cd137)是抗人cd137的鼠源单抗,其重链可变区和轻链可变区氨基酸序列来自于us5928893中的seq id no:10和seq id no:11。
[0296]
对anti-cd137抗体的重链可变区和轻链可变区氨基酸序列进行分析,依据kabat规则分别确定anti-cd137抗体重链和轻链的抗原互补决定区和框架区。anti-cd137抗体重链cdr的氨基酸序列为h-cdr1:sywmh(seq id no:85)、h-cdr2:einpgnghtnynekfks(seq id no:86)和h-cdr3:sfttargfay(seq id no:87),轻链cdr的氨基酸序列为l-cdr1:rasqtisdylh(seq id no:88)、l-cdr2:yasqsis(seq id no:89)和l-cdr3:qdghsfppt(seq id no:90)。
[0297]
在https://www.ncbi.nlm.nih.gov/igblast/,将鼠源anti-cd137抗体的重链可变区与人igg胚系序列进行同源性比较,选择ighv1-46*01为重链cdr移植模板,将鼠源的anti-cd137抗体的重链cdr移植入ighv1-46*01骨架区,并在h-cdr3之后加入wgqgtlvtvss(seq id no:151)作为第四个框架区,获得cdr移植重链可变区序列。同样地,将鼠源anti-cd137抗体的轻链可变区与人igg胚系序列同源性比较,选择igkv6-21*02为轻链cdr移植模板,将鼠源anti-cd137抗体的轻链cdr移植入igkv6-21*02的骨架区,并在l-cdr3之后加入fgqgtkveik(seq id no:152)作为第四个框架区,获得cdr移植轻链可变区序列。在cdr移植可变区的基础上,对一些框架区的氨基酸位点进行回复突变。在进行突变时,将氨基酸序列进行kabat编码,位点的位置由kabat码指示。
[0298]
优选的,对于cdr移植重链可变区,根据kabat编码,将第30位的t突变为s,将第69位的m突变为l,将第71位的r突变为v,将第73位的t突变为k。对于cdr移植轻链可变区,将第4位的l突变为m,将第58位的v突变为i,第69位的t突变为s。
[0299]
上述带有突变位点的重链可变区和轻链可变区分别定义为人源化的重链可变区和轻链可变区,分别命名为anti-cd137-hu-vh和anti-cd137-hu-vl(seq id no:91和92)。
[0300]
由上海生工生物工程有限公司合成编码上述人源化的重链可变区和轻链可变区的dna。将合成的人源化重链可变区与人igg4(s228p)重链恒定区(seq id no:148)相连,获得全长的人源化重链基因,命名为anti-cd137-hu-hc;将人源化轻链可变区与人kappa链恒定区(seq id no:149)相连,获得全长的人源化轻链基因,命名为anti-cd137-hu-lc。将anti-cd137-hu-hc和anti-cd137-hu-lc基因分别构建到pcdna3.4表达载体中,表达纯化抗体,所得抗体命名为anti-cd137-hu。
[0301]
实施例5.2共同轻链的选择
[0302]
用blast对609轻链可变区与anti-cd137-hu轻链可变区的氨基酸序列进行对比分析,结果显示,两者之间完全相同的氨基酸占比73%(identities),性质相似的氨基酸占比88%(positives)。
[0303]
将609和anti-cd137-hu的重链和轻链基因按照下述方式进行组合:609-hc anti-cd137-hu-lc和anti-cd137-hu-hc 609-lc,表达纯化抗体,所得的抗体分别命名为609-hc
anti-cd137-hu-lc和anti-cd137-hu-hc 609-lc。
[0304]
elisa检测方法如下:带有多聚组氨酸标签的人pd-1胞外段的重组蛋白购自sino biological(货号:10377-h08h),带fc标签的人cd137胞外段的重组蛋白购自sino biological(货号:10041-h02h),将这两种重组蛋白名称分别记作pd1-ecd-his和cd137-ecd-fc。用pd1-ecd-his和cd137-ecd-fc分别包被酶标板,包被浓度均为10ng/孔。
[0305]
如图23a所示,609和609-hc anti-cd137-hu-lc均能够有效结合pd1-ecd-his,ec50分别是0.1358nm和0.2067nm;而anti-cd137-hu和anti-cd137-hu-hc 609-lc不能有效结合pd1-ecd-his。如图23b所示,anti-cd137-hu能有效结合cd137-ecd-fc,ec50分别为0.461nm,而609、609-hc anti-cd137-hu-lc和anti-cd137-hu-hc 609-lc不能有效结合cd137-ecd-fc。在此选择anti-cd137-hu-lc(seq id no:93和94)作为共同轻链构建双特异性抗体。
[0306]
实施例5.3双特异性抗体的构建
[0307]
将609的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接anti-cd137-hu的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为609-fab-137-igg4(seq id no:95和96)。相似地,将anti-cd137-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接609的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为137-fab-609-igg4(seq id no:97和98)。
[0308]
将上述序列分别构建到pcdna3.4表达载体中,将609-fab-137-igg4和137-fab-609-igg4表达载体分别与anti-cd137-hu-lc表达载体组合,表达纯化抗体,所得的抗体分别命名为609-fab-137-igg4和137-fab-609-igg4(为简明起见,此处只取重链的名字作为抗体的名称)。
[0309]
实施例5.4 elisa测定相对亲和力
[0310]
如图24a所示,609-hc anti-cd137-hu-lc、609-fab-137-igg4和137-fab-609-igg4均能有效结合pd1-ecd-his,ec50分别是0.2067nm、0.2293nm和1.415nm。如图24b所示,anti-cd137-hu、609-fab-137-igg4和137-fab-609-igg4均能有效结合cd137-ecd-fc,ec50分别是0.461nm、0.3572nm和0.2424nm。上述结果显示,609-fab-137-igg4和137-fab-609-igg4既能够结合pd-1又能结合cd137,这表明它们是双特异性抗体。
[0311]
实施例6构建抗pd-1和cd40的双特异性抗体
[0312]
实施例6.1序列
[0313]
609是人源化的抗人pd-1单抗,其来源如实施例5.1所述。
[0314]
mab2.220(后文中称为anti-cd40)是抗人cd40的鼠源单抗,其重链可变区和轻链可变区氨基酸序列来自于us6312693中的seq id no:2和seq id no:1。
[0315]
对anti-cd40抗体的重链可变区和轻链可变区氨基酸序列进行分析,依据kabat规则分别确定anti-cd40抗体重链和轻链的抗原互补决定区和框架区。anti-cd40抗体重链cdr的氨基酸序列为h-cdr1:ttgmq(seq id no:99)、h-cdr2:winthsgvpkyvedfkg(seq id no:100)和h-cdr3:sgngnydlayfay(seq id no:101),轻链cdr的氨基酸序列为l-cdr1:
rasqsisdylh(seq id no:102)、l-cdr2:yashsis(seq id no:103)和l-cdr3:qhghsfpwt(seq id no:104)。
[0316]
在https://www.ncbi.nlm.nih.gov/igblast/,将鼠源anti-cd40抗体的重链可变区与人igg胚系序列进行同源性比较,选择ighv7-4-1*02为重链cdr移植模板,将鼠源的anti-cd40抗体的重链cdr移植入ighv7-4-1*02骨架区,并在h-cdr3之后加入wgqgtlvtvss(seq id no:151)作为第四个框架区,获得cdr移植重链可变区序列。同样地,将鼠源anti-cd40抗体的轻链可变区与人igg胚系序列同源性比较,选择igkv3-11*01为轻链cdr移植模板,将鼠源anti-cd40抗体的轻链cdr移植入igkv3-11*01的骨架区,并在l-cdr3之后加入fgqgtkveik(seq id no:152)作为第四个框架区,获得cdr移植轻链可变区序列。在cdr移植可变区的基础上,对一些框架区的氨基酸位点进行回复突变。在进行突变时,将氨基酸序列进行kabat编码,位点的位置由kabat码指示。
[0317]
优选的,对于cdr移植重链可变区,根据kabat编码,将第2位的v突变为i,将第28位的t突变为a,将第39位的q突变为e,将第48位的m突变为i,将第76位的s突变为n,将第93位的a突变为v。对于cdr移植轻链可变区,将第43位的a突变为s,将第49位的y突变为k,将第69位的t突变为s。
[0318]
上述带有突变位点的重链可变区和轻链可变区分别定义为人源化的重链可变区和轻链可变区,分别命名为anti-cd40-hu-vh和anti-cd40-hu-vl(seq id no:105和106)。
[0319]
由上海生工生物工程有限公司合成编码上述人源化的重链可变区和轻链可变区的dna。将合成的人源化重链可变区与人igg4(s228p)重链恒定区(seq id no:148)相连,获得全长的人源化重链基因,命名为anti-cd40-hu-hc;将人源化轻链可变区与人kappa链恒定区(seq id no:149)相连,获得全长的人源化轻链基因,命名为anti-cd40-hu-lc。将anti-cd40-hu-hc和anti-cd40-hu-lc基因分别构建到pcdna3.4表达载体中,表达纯化抗体,所得抗体命名为anti-cd40-hu。
[0320]
实施例6.2共同轻链的选择
[0321]
用blast对609轻链可变区与anti-cd40-hu轻链可变区的氨基酸序列进行对比分析,结果显示,两者之间完全相同的氨基酸占比90%(identities),性质相似的氨基酸占比96%(positives)。
[0322]
将609和anti-cd40-hu的重链和轻链基因按照下述方式进行组合:609-hc anti-cd40-hu-lc和anti-cd40-hu-hc 609-lc,表达纯化抗体,所得的抗体分别命名为609-hc anti-cd40-hu-lc和anti-cd40-hu-hc 609-lc。
[0323]
elisa检测方法如下:带有多聚组氨酸标签的人pd-1胞外段的重组蛋白购自sino biological(货号:10377-h08h),带多聚组氨酸标签的人cd40胞外段的重组蛋白购自sino biological(货号:10774-h08h),将这两种重组蛋白名称分别记作pd1-ecd-his和cd40-ecd-his。用pd1-ecd-his和cd40-ecd-his分别包被酶标板,包被浓度均为10ng/孔。
[0324]
如图25a所示,609和609-hc anti-cd40-hu-lc均能够有效结合pd1-ecd-his,ec50分别是0.1263nm和0.1387nm;而anti-cd40-hu和anti-cd40-hu-hc 609-lc不能有效结合pd1-ecd-his。如图25b所示,anti-cd40-hu能有效结合cd40-ecd-his,ec50是0.1104nm,而609、609-hc anti-cd40-hu-lc和anti-cd40-hu-hc 609-lc均不能有效结合cd40-ecd-his。在此选择anti-cd40-hu-lc(seq id no:107和108)作为共同轻链构建双特异性抗体。
[0325]
实施例6.3双特异性抗体的构建
[0326]
将609的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接anti-cd40-hu的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为609-fab-40-igg4(seq id no:109和110)。相似地,将anti-cd40-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接609的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为40-fab-609-igg4(seq id no:111和112)。
[0327]
将上述序列分别构建到pcdna3.4表达载体中,将609-fab-40-igg4和40-fab-609-igg4表达载体分别与anti-cd40-hu-lc表达载体组合,表达纯化抗体,所得的抗体分别命名为609-fab-40-igg4和40-fab-609-igg4(为简明起见,此处只取重链的名字作为抗体的名称)。
[0328]
实施例6.4 elisa测定相对亲和力
[0329]
如图26a所示,609-hc anti-cd40-hu-lc、609-fab-40-igg4和40-fab-609-igg4均能有效结合pd1-ecd-his,ec50分别是0.1387nm、0.1723nm和1.017nm。如图26b所示,anti-cd40-hu、609-fab-40-igg4和40-fab-609-igg4均能有效结合cd40-ecd-his,ec50分别是0.1104nm、0.1047nm和0.09556nm。上述结果显示,609-fab-40-igg4和40-fab-609-igg4既能够结合pd-1又能结合cd40,这表明它们是双特异性抗体。
[0330]
实施例7构建抗pd-1和其它靶点的双特异性抗体
[0331]
实施例7.1序列
[0332]
609是人源化的抗人pd-1单抗,其来源如实施例5.1所述。
[0333]
从公开的文献资料(magdelaine-beuzelin c,kaas q,wehbi v,et al.structure
–
function relationships of the variable domains of monoclonal antibodies approved for cancer treatment[j].critical reviews in oncology/hematology,2007,64(3):210-225.)中获得cetuximab、bevacizumab、trastuzumab、pertuzumab等抗体的重链可变区和轻链可变区氨基酸序列(seq id no:1-2、113-118)。10d1(后文中称为ipilimumab)是抗人ctla-4单抗,其重链可变区和轻链可变区氨基酸序列来自于us20020086014a1中的seq id no:17和seq id no:7(即本发明中的seq id no:119和120)。
[0334]
由上海生工生物工程有限公司合成编码上述重链可变区和轻链可变区的dna。重链可变区和轻链可变区编码序列分别与人igg1重链恒定区(seq id no:147)和人kappa轻链恒定区(seq id no:149)相连,构建成全长的抗体重链和轻链基因。上述抗体的重链基因分别命名为cetuximab-hc、bevacizumab-hc、trastuzumab-hc、pertuzumab-hc和ipilimumab-hc,上述抗体的轻链基因分别命名为cetuximab-lc、bevacizumab-lc、trastuzumab-lc、pertuzumab-lc和ipilimumab-lc。将上述重链和轻链基因分别构建到pcdna3.4表达载体中,将名称对应的重链和轻链基因进行组合,表达纯化抗体,所得抗体分别命名为cetuximab-igg1、bevacizumab-igg1、trastuzumab-igg1、pertuzumab-igg1和ipilimumab-igg1。
[0335]
5e7-hu是人源化的抗人lag-3抗体,其重链可变区和轻链可变区序列来自于pct/cn2020/076023中的seq id no:26和seq id no:28(即本发明中的seq id no:121和122),由上海生工生物工程有限公司合成编码上述人源化的重链可变区和轻链可变区的dna。将合成的人源化重链可变区与人igg4(s228p)重链恒定区(seq id no:148)相连,获得全长的人源化重链基因,命名为5e7-hu-hc;将人源化轻链可变区与人kappa链恒定区(seq id no:149)相连,获得全长的人源化轻链基因,命名为5e7-hu-lc。将5e7-hu-hc和5e7-hu-lc基因分别构建到pcdna3.4表达载体中,表达纯化抗体,所得抗体重新命名为5e7-hu。
[0336]
实施例7.2共同轻链的选择
[0337]
实施例7.2.1检测杂合抗体与抗原结合的亲和力
[0338]
将609的重链和上述抗体的轻链基因分别组合,表达纯化抗体,所得的抗体分别命名为609-hc cetuximab-lc、609-hc bevacizumab-lc、609-hc trastuzumab-lc、609-hc pertuzumab-lc、609-hc ipilimumab-lc和609-hc 5e7-hu-lc。
[0339]
elisa检测方法如下:带有多聚组氨酸标签的人pd-1胞外段的重组蛋白购自sino biological(货号:10377-h08h),将这种重组蛋白名称记作pd1-ecd-his。用pd1-ecd-his包被酶标板,包被浓度均为10ng/孔。如图27所示,opdivo(购自bristol-myers squibb)、609、609-hc cetuximab-lc、609-hc bevacizumab-lc、609-hc pertuzumab-lc、609-hc ipilimumab-lc和609-hc 5e7-hu-lc均能够有效结合pd1-ecd-his,ec50分别是0.2887nm、0.1100nm、0.2424nm、0.1530nm、0.2244nm、0.1547nm和0.1709nm;而609-hc trastuzumab-lc结合pd1-ecd-his的相对亲和力较弱,ec50为0.7219nm。因此,在此可以选择cetuximab-lc(seq id no:123和124)、bevacizumab-lc、pertuzumab-lc(seq id no:125和126)、ipilimumab-lc(seq id no:127和128)和5e7-hu-lc(seq id no:129和130)作为共同轻链构建相应的双特异性抗体。其中,同型对照抗体为不结合pd-1的人igg4抗体。
[0340]
实施例7.2.2检测杂合抗体阻断pd-1/pd-l1相互作用的能力
[0341]
抗体阻断pd-1/pd-l1相互作用的能力的检测方法如下:自制带有人fc标签的人pd-1和pd-l1的胞外区融合蛋白(制备方法如wo2018/137576a1中所述),将这两种重组蛋白分别记作pd1-ecd-hfc和pd-l1-ecd-hfc。用无水dmso将biotin化标记试剂biotin n-hydroxysuccinimide ester(购自sigma,货号/规格:h1759-100mg)配制成100mm的母液;根据pd-l1-ecd-hfc的分子量和浓度计算相应的物质的量浓度;取适当体积的pd-l1-ecd-hfc融合蛋白,计算物质的量之后,分别与biotin n-hydroxysuccinimide ester按照1:20的比例混匀,室温标记1小时;透析之后用紫外分光光度法测定蛋白浓度。用包被缓冲液将人pd-1-ecd-hfc稀释到2μg/ml,用排枪加到96孔elisa酶标板中,100μl/孔,室温孵育4h;用pbst清洗1次,用含1%bsa的pbst封闭,200μl/孔,室温孵育2h;弃封闭液,拍干,于4℃备用。在96孔板中将biotin化的pd-l1-ecd-hfc用pbst 1%bsa(含有1%牛血清白蛋白的pbst溶液)稀释至500ng/ml;用上述稀释好的biotin化融合蛋白分别梯度稀释抗pd-1抗体;将上述稀释好的抗体和biotin化融合蛋白的混合溶液转移到上述用人pd-1-ecd-hfc包被好的elisa板中,室温孵育1小时;pbst洗板3次;加入用pbst 1%bsa以1:1000稀释的streptavidin-hrp(购自bd biosciences),室温孵育45min;pbst洗板3次;加显色液(tmb底物溶液),100μl/孔,室温孵育1~5min;加终止液终止显色反应,50μl/孔;用酶标仪读取od450值;用graphpad prism6进行数据整理分析和作图,计算ic50。
[0342]
如图28所示,opdivo、609、609-hc cetuximab-lc、609-hc bevacizumab-lc、609-hc trastuzumab-lc、609-hc pertuzumab-lc、609-hc ipilimumab-lc和609-hc 5e7-hu-lc均能有效阻断pd-1和pd-l1之间的相互作用,ic50分别为0.05729nm、0.1309nm、0.1199nm、0.1191nm、0.1162nm、0.09876nm、0.1052nm和0.1312nm。其中,同型对照抗体为不结合pd-1的人igg4抗体。
[0343]
实施例7.2.3测定杂合抗体增强混合淋巴细胞反应的能力
[0344]
然后测定上述抗体增强混合淋巴细胞反应的能力。如图29所示,609、609-hc cetuximab-lc、609-hc bevacizumab-lc、609-hc pertuzumab-lc、609-hc ipilimumab-lc和609-hc 5e7-hu-lc均能有效刺激混合淋巴细胞反应分泌il-2,ec50分别为0.08623nm、0.2510nm、0.1211nm、0.5171nm、0.2040nm和0.09101nm。其中,609-hc trastuzumab-lc不能有效刺激混合淋巴细胞反应分泌il-2。同型对照抗体为不结合pd-1的人igg4抗体。
[0345]
实施例7.2.4流式细胞法测定杂合抗体对细胞表面pd-1的结合能力
[0346]
使用流式细胞法测定杂合抗体对细胞表面pd-1的结合能力。表达pd-1的tf-1细胞的建立过程如下:将全长的人pd-1基因(序列来自uniprot,entry:q15116)构建到慢病毒表达载体plvx-puro(购自clontech)中。用lipofectamine 3000(购自thermo fisher scientific,货号:l3000001)将慢病毒包装载体和装载目的基因的plvx-puro转染入hek293ft细胞中(购自thermo fisher scientific,货号:r70007),细胞培养箱中孵育48小时之后收集细胞培养上清,用0.45微米滤膜过滤除去细胞残骸。用上述含有病毒颗粒的上清液感染tf-1细胞(购自atcc,货号crl-2003
tm
),48小时之后用puromycin处理细胞,筛选出稳定表达目的基因的细胞群体。稳定表达pd-1的tf-1细胞株命名为tf1-pd1。
[0347]
流式细胞法检测抗体对细胞结合的方法如下:将tf1-pd1细胞接种到圆底96孔板中(每孔20万个细胞);离心后吸掉上清,加入梯度稀释的抗体,室温孵育半小时左右;细胞用pbs洗涤2遍;离心后吸掉上清,每孔加入以适当稀释的anti-human igg(fc specific)-fitc抗体(购自sigma,货号:f9512),室温孵育半小时左右;细胞用pbs洗涤2遍;吸掉上清后加入fix buffer i(购自bd biosciences)以固定细胞,室温孵育5min;细胞用pbs洗涤2遍,最终用200μl pbs重悬细胞;在流式细胞仪上检测fitc通道的荧光强度;用流式细胞仪自带软件处理实验数据并导出到excel;用graphpad prism6进行数据分析和作图,计算ec50。
[0348]
如图30所示,609、609-hc cetuximab-lc、609-hc bevacizumab-lc、609-hc pertuzumab-lc、609-hc ipilimumab-lc和609-hc 5e7-hu-lc均能有效结合细胞表面的pd-1,ec50分别为0.3761nm、0.577nm、0.5193nm、0.4302nm、0.4773nm和0.3864nm。其中,609-hc trastuzumab-lc对tf1-pd1的结合作用明显弱于其它杂合抗体。同型对照抗体为不结合pd-1的人igg4抗体。
[0349]
实施例7.2.5丙氨酸扫描研究609轻链可变区cdr在609结合pd-1中的作用
[0350]
上述实验结果显示,609的重链与许多其它靶点抗体的轻链组合之后产生的杂合抗体仍然能够有效结合pd-1分子,并且具有阻断pd-1/pd-l1相互作用、刺激混合淋巴细胞反应和结合细胞表面pd-1的能力。在此,用丙氨酸扫描(alanine scanning)研究609轻链可变区cdr在609结合pd-1中的作用。方法如下:将609轻链cdr中的氨基酸分别突变为丙氨酸(cdr中原有的丙氨酸不做改变),然后609重链分别与这些轻链突变体组合后,按照上述实施例中的方法表达并纯化抗体,然后按照上述实施例中的elisa方法,测定上述抗体对pd-1
的相对亲和力。如表3中所示,609-hc 609-lc-r24a中的r24a表示第24位的精氨酸突变为丙氨酸,突变氨基酸的位置由kabat编码指示,其余以此类推。
[0351]
表3、609轻链可变区的丙氨酸扫描结果
[0352]
抗体名称ec50(nm)opdivo0.30546090.0980609-hc 609-lc-r24a0.0967609-hc 609-lc-s26a0.1094609-hc 609-lc-q27a0.1105609-hc 609-lc-s28a0.1059609-hc 609-lc-i29a0.0969609-hc 609-lc-s30a0.1068609-hc 609-lc-n31a0.1148609-hc 609-lc-f32a0.1547609-hc 609-lc-l33a0.1060609-hc 609-lc-h34a0.1112609-hc 609-lc-y50a0.1272609-hc 609-lc-s52a0.1074609-hc 609-lc-q53a0.1103609-hc 609-lc-s54a0.1237609-hc 609-lc-i55a0.1140609-hc 609-lc-s56a0.1240609-hc 609-lc-q89a0.1322609-hc 609-lc-q90a0.1457609-hc 609-lc-s91a0.1334609-hc 609-lc-n92a0.0971609-hc 609-lc-s93a0.1106609-hc 609-lc-w94a0.1045609-hc 609-lc-p95a0.1317609-hc 609-lc-h96a0.1266609-hc 609-lc-t97a0.1143
[0353]
如图31和表3所示,丙氨酸扫描结果显示,轻链cdr氨基酸分别突变为丙氨酸后均没有显著影响抗体对pd-1的结合,这说明609主要通过重链结合pd-1分子,而对轻链依赖较小。
[0354]
实施例7.3抗pd-1和egfr的双特异性抗体的构建
[0355]
将609的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接cetuximab-igg1的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为609-fab-cetuximab-igg4(seq id no:131和132)。
[0356]
将上述序列分别构建到pcdna3.4表达载体中,将609-fab-cetuximab-igg4与cetuximab-lc表达载体组合,表达纯化抗体,所得的抗体命名为609-fab-cetuximab-igg4(为简明起见,此处只取重链的名字作为抗体的名称)。
[0357]
elisa检测方法如下:带有多聚组氨酸标签的人pd-1胞外段的重组蛋白购自sino biological(货号:10377-h08h),带多聚组氨酸标签的人egfr胞外段的重组蛋白购自sino biological(货号:10001-h08h),将这两种重组蛋白名称分别记作pd1-ecd-his和egfr-ecd-his。用pd1-ecd-his和egfr-ecd-his分别包被酶标板,包被浓度均分别为10ng/孔和20ng/孔。
[0358]
如图32a所示,609-hc cetuximab-lc和609-fab-cetuximab-igg4均能有效结合pd1-ecd-his,ec50分别是0.7172nm和0.2616nm。如图32b所示,cetuximab-igg1和609-fab-cetuximab-igg4均能有效结合egfr-ecd-his,ec50分别是0.07609nm和0.09327nm。上述结果显示,609-fab-cetuximab-igg4既能够结合pd-1又能结合egfr,这说明它是双特异性抗体。
[0359]
实施例7.4抗pd-1和her-2的双特异性抗体的构建
[0360]
将609的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接pertuzumab-igg1的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为609-fab-pertuzumab-igg4(seq id no:133和134)。
[0361]
将上述序列分别构建到pcdna3.4表达载体中,将609-fab-pertuzumab-igg4与pertuzumab-lc表达载体组合,表达纯化抗体,所得的抗体命名为609-fab-pertuzumab-igg4(为简明起见,此处只取重链的名字作为抗体的名称)。
[0362]
elisa检测方法如下:带有多聚组氨酸标签的人pd-1胞外段的重组蛋白购自sino biological(货号:10377-h08h),带有多聚组氨酸标签的人her-2胞外段的重组蛋白购自acrobiosystems(货号:he2-h5225),将这两种重组蛋白名称分别记作pd1-ecd-his和her2-ecd-his。用pd1-ecd-his和her2-ecd-his分别包被酶标板,包被浓度均为10ng/孔。
[0363]
如图33a所示,609-hc pertuzumab-lc和609-fab-pertuzumab-igg4均能有效结合pd1-ecd-his,ec50分别是0.1422nm和0.1196nm。如图33b所示,pertuzumab-igg1和609-fab-pertuzumab-igg4均能有效结合her2-ecd-his,ec50分别是0.5352nm和2.616nm。上述结果显示,609-fab-pertuzumab-igg4既能够结合pd-1又能结合her-2,这说明它是双特异性抗体。
[0364]
实施例7.5抗pd-1和ctla-4的双特异性抗体的构建
[0365]
实施例7.5.1双特异性抗体的构建
[0366]
将609的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接ipilimumab-igg1的重链可变区,最后再连接人igg1的重链恒定区(ch1 ch2 ch3),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链基因命名为609-fab-ipilimumab-igg1(seq id no:135和136)。相似地,将ipilimumab-igg1的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接609的重链可变区,最后再连接人igg1的重链恒定
区(ch1 ch2 ch3),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链基因命名为ipilimumab-fab-609-igg1(seq id no:137和138)。
[0367]
将609的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接ipilimumab-igg1的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为609-fab-ipilimumab-igg4(seq id no:139和140)。相似地,将ipilimumab-igg1的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接609的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为ipilimumab-fab-609-igg4(seq id no:141和142)。
[0368]
将上述序列分别构建到pcdna3.4表达载体中,将609-fab-ipilimumab-igg1、ipilimumab-fab-609-igg1、609-fab-ipilimumab-igg4和ipilimumab-fab-609-igg4分别与ipilimumab-lc表达载体组合,表达纯化抗体,所得的抗体分别命名为609-fab-ipilimumab-igg1、ipilimumab-fab-609-igg1、609-fab-ipilimumab-igg4和ipilimumab-fab-609-igg4(为简明起见,此处只取重链的名字作为抗体的名称)。
[0369]
elisa检测方法如下:带有多聚组氨酸标签的人pd-1胞外段的重组蛋白购自sino biological(货号:10377-h08h),带有人fc标签的人ctla-4胞外段的重组蛋白购自sino biological(货号:11159-h31h5),将这两种重组蛋白名称分别记作pd1-ecd-his和ctla4-ecd-fc。用pd1-ecd-his和ctla4-ecd-fc分别包被酶标板,包被浓度均为10ng/孔。
[0370]
如图34a所示,609-hc ipilimumab-lc、609-fab-ipilimumab-igg1、ipilimumab-fab-609-igg1、609-fab-ipilimumab-igg4和ipilimumab-fab-609-igg4均能有效结合pd1-ecd-his,ec50分别是0.2337nm、0.1734nm、0.7954nm、0.2078nm和0.9643nm。如图34b所示,ipilimumab-igg1、609-fab-ipilimumab-igg1、ipilimumab-fab-609-igg1、609-fab-ipilimumab-igg4和ipilimumab-fab-609-igg4均能有效结合ctla4-ecd-fc,ec50分别是0.8354nm、2.123nm、0.3376nm、2.626nm和0.392nm。上述结果显示,609-fab-ipilimumab-igg1、ipilimumab-fab-609-igg1、609-fab-ipilimumab-igg4和ipilimumab-fab-609-igg4既能够结合pd-1又能结合ctla-4,这说明它们是双特异性抗体。
[0371]
实施例7.5.2测定抗pd-1和ctla-4双特异性抗体的功能活性
[0372]
在rpmi1640中加入以下添加剂制成rpmi 1640完全培养基:10%胎牛血清;1%mem non-essential amino acids solution;1%sodium pyruvate;1%hepes;1
‰
2-mercaptoethanol;1%penicillin-streptomycin;1%glutamax(上述添加剂购自thermo fisher scientific)。用上述rpmi 1640完全培养基将新鲜分离的pbmc(购自allcells,货号:pb005-c)洗涤并重悬,加入一定量的超抗原金黄色葡萄球菌肠毒素b(staphylococcal enterotoxin b,seb)。该超抗原为内部制备(seb氨基酸序列来自https://www.uniprot.org/uniprot/p01552),使用大肠杆菌生产。将pbmc细胞悬液接种到圆底96孔细胞培养板中,每孔150μl悬液和20万个细胞;在上述96孔板中加入50μl梯度稀释的抗体;将96孔板置于37℃细胞培养箱中孵育4天。从96孔板中取适量细胞培养上清。然后按照标准操作流程检测il-2分泌。用双抗体夹心法(sandwich elisa)检测上清中的il-2(相关检测
ecd-his和ctla4-ecd-fc的来源如实施例7.5.1中所述)分别包被酶标板。
[0381]
如图37所示,计算出609-fab-ipilimumab-igg1的半衰期为15.2天(以pd-1为抗原的检测结果)和14.6天(以ctla-4为抗原的检测结果)。上述结果表明,609-fab-ipilimumab-igg1具有良好的药代动力学性质。
[0382]
实施例7.5.5抗pd-1和ctla-4双特异性抗体在小鼠体内的抗肿瘤作用
[0383]
人pd-1/ctla-4双转基因小鼠(种系背景为c57bl/6)购自北京百奥赛图科技股份有限公司,mc38小鼠结直肠癌细胞购自广州吉妮欧生物科技有限公司。pd-1/ctla-4双转基因小鼠中用人源pd-1及ctla-4基因的胞外段替换了小鼠的同源部分,因此本发明的双特异性抗体能够识别该转基因小鼠中的pd-1和ctla-4。具体实施步骤如下:将mc38在体外培养,培养基为含有10%血清的dmem(血清和培养基购自gibco);将培养的mc38细胞接种于人pd-1转基因小鼠中,每只小鼠皮下接种2
×
106个细胞;待接种的肿瘤细胞生长至体积接近100mm3时,将小鼠随机分组,每组8只小鼠。各组小鼠药物处理情况如下:对照组,仅注射生理盐水;609组,注射10mg/kg的抗pd-1抗体609;yervoy组,注射10mg/kg的抗ctla-4阳性对照抗体yervoy(由百时美施贵宝生产);609 yervoy组,注射10mg/kg的609和10mg/kg的yervoy;609-fab-ipilimumab-igg1组,注射16mg/kg的609-fab-ipilimumab-igg1。考虑到双特异性抗体和单克隆抗体的分子量存在差异,本实验中药物剂量按照等物质的量进行设定。随后,按照上述设计好的方案给药,每周给药2次,共给药4次,每周测定肿瘤体积2次。最终,测定的各组肿瘤随时间的生长曲线如图38所示。
[0384]
结果显示,在第14天实验结束时,609、yervoy、609 yervoy和609-fab-ipilimumab-igg1各组的抑瘤率分别为48.6%、79.1%、85.9%和92.2%(抑瘤率=(对照组平均体积-实验组平均体积)/对照组平均体积
×
100%)。与609和yervoy单药相比,609-fab-ipilimumab-igg1能够更加有效地抑制肿瘤生长。609-fab-ipilimumab-igg1与609和yervoy联合应用的治疗效果相当。
[0385]
实施例7.6抗pd-1和lag-3的双特异性抗体的构建
[0386]
实施例7.6.1双特异性抗体的构建
[0387]
将609的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接5e7-hu的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为609-fab-5e7-igg4(seq id no:143和144)。相似地,将5e7-hu的重链可变区与人igg4的ch1结构域相连,然后再通过人工连接子(在此使用的连接子是三个串联的ggggs)连接609的重链可变区,最后再连接人igg4的重链恒定区(ch1 ch2 ch3,铰链区含有s228p突变),通过此程序构建成的含有两个重链可变区和两个ch1结构域的长重链命名为5e7-fab-609-igg4(seq id no:145和146)。
[0388]
将上述序列分别构建到pcdna3.4表达载体中,将609-fab-5e7-igg4和5e7-fab-609-igg4分别与5e7-hu-lc表达载体组合,利用上述实施例中描述的方法表达并纯化抗体,所得的抗体分别命名为609-fab-5e7-igg4和5e7-fab-609-igg4(为简明起见,此处只取重链的名字作为抗体的名称)。
[0389]
elisa检测方法如下:带有多聚组氨酸标签的人pd-1胞外段的重组蛋白购自sino biological(货号:10377-h08h),带有多聚组氨酸标签的人lag-3胞外段的重组蛋白购自
sino biological(货号:16498-h08h),将这两种重组蛋白名称分别记作pd1-ecd-his和lag3-ecd-his。用pd1-ecd-his和lag3-ecd-his分别包被酶标板,包被浓度均为10ng/孔。
[0390]
如图39a所示,609-hc 5e7-hu-lc、609-fab-5e7-igg4和5e7-fab-609-igg4均能有效结合pd1-ecd-his,ec50分别是0.1523nm、0.161nm和0.8138nm。如图39b所示,5e7-hu、609-fab-5e7-igg4和5e7-fab-609-igg4均能有效结合lag3-ecd-his,ec50分别是0.1472nm、0.2082nm和0.1529nm。上述结果显示,609-fab-5e7-igg4和5e7-fab-609-igg4既能够结合pd-1又能结合lag-3,这说明它们是双特异性抗体。
[0391]
实施例7.6.2测定抗pd-1和lag-3双特异性抗体同时结合两种抗原的能力
[0392]
用lag3-ecd-his包被微孔板。用含1%牛血清白蛋白的pbst将待测抗体进行梯度稀释,然后转移到上述微孔板中,室温孵育半小时左右。后续实验步骤与实施例1.7.4相同。
[0393]
如图40所示,609-fab-5e7-igg4在结合lag-3之后仍然能够有效地继续结合人pd-1,ec50为0.5294nm。5e7-hu和609-hc 5e7-hu-lc都不能同时结合pd-1和lag-3。
[0394]
实施例7.6.3测定抗pd-1和lag-3双特异性抗体的功能活性
[0395]
在此,按照实施例7.5.2中所述的方法测定抗pd-1和lag-3双特异性抗体的功能活性。
[0396]
表5、抗pd-1和lag-3双特异性抗体的功能活性参数
[0397][0398]
如图41和表5所示,5e7-hu仅能微弱刺激il-2的分泌。609和609-hc 5e7-hu-lc具有相当的ec50和top(高平台),表明这二者具有相近的功能活性。在浓度大于1nm时,609-fab-5e7-igg4刺激il-2分泌的能力明显高于单克隆抗体5e7-hu和609,以及杂合抗体609-hc 5e7-hu-lc,而与5e7-hu和609-hc 5e7-hu-lc联合应用(5e7-hu/609-hc 5e7-hu-lc表示两种抗体以物质的量之比1:1联合应用)的效果近似。
[0399]
实施例7.6.4抗pd-1和lag-3双特异性抗体在小鼠体内的抗肿瘤作用
[0400]
人pd-1/lag-3双转基因小鼠(种系背景为c57bl/6)购自北京百奥赛图科技股份有限公司,mc38小鼠结直肠癌细胞购自广州吉妮欧生物科技有限公司。pd-1/lag-3双转基因小鼠中用人源pd-1及lag-3基因的胞外段替换了小鼠的同源部分,因此本发明的双特异性抗体能够识别该转基因小鼠中的pd-1和lag-3。具体实施步骤如下:将mc38在体外培养,培养基为含有10%血清的dmem(血清和培养基购自gibco);将培养的mc38细胞接种于人pd-1转基因小鼠中,每只小鼠皮下接种2
×
106个细胞;待接种的肿瘤细胞生长至体积接近100mm3时,将小鼠随机分组,每组8只小鼠。各组小鼠药物处理情况如下:对照组,仅注射生理盐水;609组,注射20mg/kg的抗pd-1抗体609;5e7-hu组,注射20mg/kg的抗lag-3抗体5e7-hu;609 5e7-hu组,注射20mg/kg的609和20mg/kg的5e7-hu;609-fab-5e7-igg4组,注射32mg/kg的
609-fab-5e7-igg4。考虑到双特异性抗体和单克隆抗体的分子量存在差异,本实验中药物剂量按照等物质的量进行设定。随后,按照上述设计好的方案给药,每周给药2次,共给药4次,每周测定肿瘤体积2次。最终,测定的各组肿瘤随时间的生长曲线如图42所示。
[0401]
结果显示,在第14天实验结束时,609、5e7-hu、609 5e7-hu和609-fab-5e7-igg4各组的抑瘤率分别为70.8%、13.1%、71.5%和82.8%(抑瘤率=(对照组平均体积-实验组平均体积)/对照组平均体积
×
100%)。与609和5e7-hu单药相比,609-fab-5e7-igg4能够更加有效地抑制肿瘤生长。609和5e7-hu联合没有比609单药的药效更优,因此可以推测,609-fab-5e7-igg4作为抗pd-1和lag-3的双特异性抗体展现出协同效应。
[0402]
实施例7.7检验杂合抗体的特异性
[0403]
elisa检测方法如下:用上述实施例中提到的相关抗原(egfr-ecd-his、vegf165-his、her2-ecd-his、lag3-ecd-his和ctla4-ecd-fc)分别包被酶标板,实验条件如前所述,然后检测609重链与其它靶点抗体轻链的杂合抗体能否识别这些靶点。cetuximab-igg1、601、trastuzumab-igg1、5e7-hu和ipilimumab-igg1等抗体的来源如上述实施例中所述(其中trastuzumab-igg1的可变区来源如实施例7.1中所述,恒定区与ipilimumab-igg1相同,制备方法与其它抗体相同),在此分别作为结合各种抗原的阳性对照抗体。
[0404]
图43a~图43e显示,609重链与其它靶点抗体轻链的杂合抗体不能识别其它靶点,这表明这些杂合抗体具有较好的特异性。
[0405]
实施例7.8 hplc-sec
[0406]
图44a表示609-fab-cetuximab-igg4的hplc-sec图谱,主峰占比99.13%。图44b表示609-fab-pertuzumab-igg4的hplc-sec图谱,主峰占比99.2%。图44c表示609-fab-ipilimumab-igg1的hplc-sec图谱,主峰占比99.3%。图44d表示ipilimumab-fab-609-igg1的hplc-sec图谱,主峰占比99.2%。图44e表示609-fab-ipilimumab-igg4的hplc-sec图谱,主峰占比99.3%。图44f表示ipilimumab-fab-609-igg4的hplc-sec图谱,主峰占比99.1%。图44g表示609-fab-5e7-igg4的hplc-sec图谱,主峰占比99.2%。图44h表示5e7-fab-609-igg4的hplc-sec图谱,主峰占比99.0%。
[0407]
实施例7.9 hplc-iec
[0408]
图45a表示609-fab-ipilimumab-igg1的hplc-iec图谱,主峰占比83.52%。该结果表明,609-fab-ipilimumab-igg1电荷异质性良好。
[0409]
图45b表示609-fab-5e7-igg4的hplc-iec图谱,主峰占比85.43%。该结果表明,609-fab-5e7-igg4电荷异质性良好。
[0410]
实施例7.10 ce-sds
[0411]
图46a和图46b分别表示609-fab-ipilimumab-igg1的nr-ce-sds和r-ce-sds的图谱,nr-ce-sds图谱中主峰peak13占比97.02%;r-ce-sds图谱中两个主峰peak2(对应轻链)和peak12(对应长重链)分别占比39.14%和59.13%,两者峰面积之比为2:3.0。r-ce-sds中,609-fab-ipilimumab-igg1的轻链和长重链的峰面积之比符合预期。
[0412]
图46c和图46d分别表示609-fab-5e7-igg4的nr-ce-sds和r-ce-sds的图谱,nr-ce-sds图谱中主峰peak11占比94.73%;r-ce-sds图谱中两个主峰peak7(对应轻链)和peak16(对应长重链)分别占比38.32%和59.58%,两者峰面积之比为2:3.1。r-ce-sds中,609-fab-5e7-igg4的轻链和长重链的峰面积之比符合预期。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。