1.本发明涉及一种甾体化合物的制备方法。
背景技术:
2.地屈孕酮(dydrogesterone),化学名为9β,10α-孕甾-4,6-二烯-3,20-二酮,是由荷兰雅培公司生产的用于保胎及预防流产以及由于内源性孕酮不足引起的各种疾病,如:痛经、子宫内膜异位症、继发性闭经、月经周期不规则、功能失调性子宫出血、经前期综合征、孕激素缺乏所致先兆性流产或习惯性流产、黄体不足所致不孕症等。目前有达芙通(duphaston地屈孕酮片)和芬吗通(femoston雌二醇片/雌二醇地屈孕酮片复合包装)两种产品在多个国家和地区销售。分子结构式如下:
[0003][0004]
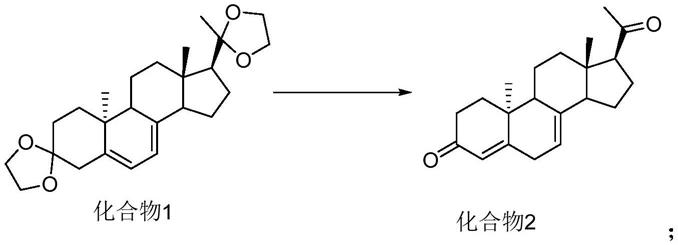
化合物3,化学名:9α,10β-孕甾-4,6-二烯-3,20-二乙二醇缩酮,其可以经过光化学得到化合物1,化合物1脱保护得到化合物2,化合物2经过双键移位等步骤制备地屈孕酮,如下所示:
[0005][0006]
目前由化合物1制备化合物2的方法主要以下报道:
[0007]
报道1:cn107531746a报道了化合物1在乙醇和8.5%硫酸或50%乙酸或二氯甲烷和5%盐酸或95%乙醇和对甲苯磺酸的条件下制备地屈孕酮,反应条件和纯化条件差别比较大,整个技术方案从合成到后处理纯化比较繁琐,得到的化合物2颜色偏深,需要多次纯化才能得到浅黄色固体,影响终产品的外观,不利于质量控制。
[0008]
方法2:cn110818760报道以四氢呋喃、乙腈、丙酮或甲醇为溶剂,在醋酸、三氟乙酸或2n盐酸的作用下,由化合物1制备化合物2,反应结束还要除去溶剂,用乙酸乙酯或二氯甲烷萃取,碳酸氢钠液洗涤,干燥,与丙酮和甲醇混合溶剂或丙酮和异丙醇混合溶剂加热回流后冷却结晶,分离固体即得化合物2,使用多种溶剂,工艺复杂。
[0009]
根据文献报道(cn110818760a,cn102558272 a,cn 103848880a)和我们实际研究结果表明,在化合物3向化合物1转化的光异构化反应中,最终反应液中有大量的化合物3,即使经过多次纯化,在化合物1总会含有一定比例的化合物3。而且随着投料量的增加,化合物3向化合物1的转化率降低,化合物1中化合物3的含量增加。化合物3在脱保护反应过程中会转化为化合物4,化合物4在双键移位的过程中转化为地屈孕酮中的杂质化合物5,化合物
5就是欧洲药典中地屈孕酮的杂质b,具体反应方程式如下所示:
[0010][0011]
若要控制化合物5的含量,就需要在光异构化反应中控制所得化合物1中化合物3的含量,而且,在脱保护反应中控制化合物2中化合物4的含量。而如前所述,降低化合物1中化合物3的含量,需要多次繁琐的纯化,难以实现产业化生产。
[0012]
另外,目前由化合物2合成地屈孕酮的方法主要以下几种报道:
[0013]
报道1:cn110818760a报道化合物1在浓盐酸或饱和氯化氢的甲醇或乙酸乙酯或四氢呋喃溶液制备得到地屈孕酮,收率在80%~85%之间。
[0014]
报道2:文献recueil des travaux chimiques des pays-bas(1961),80:43-46。在双键异构化一步使用了大量的37%氯化氢-异丙醇溶液,而一般工业使用的氯化氢-醇溶液浓度最高为35%,所以在生产过程中需要不断补通氯化氢气体以保证37%的浓度。
[0015]
报道3:cn107531746a报道化合物1在含有钠或钾的碱的作用下制备得到地屈孕酮,反应过程中有大量的化合物1转化不完全,还需要柱层析分离纯化,实际的重量收率最多只有80%左右。
[0016]
发明人在研究双键移位反应时发现,在高浓度酸性条件下,化合物2制备地屈孕酮的过程中还生成了两个二聚物杂质,结构如下:
[0017][0018]
从上述报道可知,目前异构化主要通过酸催化(报道1~2)和碱催化(报道3)才可进行。酸催化的问题在于若要得到高收率,需要饱和的氯化氢溶液(含量约36.5%以上),导致在生产过程中会产生大量的废酸、废气,对环境不友好。碱催化的收率只有80%左右,技术方案中使用大量碱,在排放的时候同样需要使用大量的酸来中和,产生大量废盐水,对环境不友好。综上所述,目前没有高收率的适合工业化生产、环境友好的双键异构化的方法。
[0019]
因此,需要找到一种化合物1制备地屈孕酮的方法,能够:1)兼顾反应和纯化工艺;2)操作简便;3)适合工业化生产、环境友好;4)产物纯度高,杂质含量可控,对于地屈孕酮的产业化和质量可控性产生积极的作用。
技术实现要素:
[0020]
本发明所要解决的技术问题为针对现有技术中由化合物1制备地屈孕酮的工艺存在后处理繁琐,难以实现产业化生产等缺陷,而提出了一种甾体化合物的制备方法。本发明的制备方法能够1)兼顾反应和纯化工艺;2)操作简便;3)纯度高,杂质含量可控,所得的化合物2中的化合物4含量小于0.10%,所得的地屈孕酮中未检出两个二聚物杂质;4)采用更低浓度和用量更少的氯化氢,很大程度降低废酸、废气、废水、废盐的产生,且收率高,对于地屈孕酮的产业化和质量可控性产生积极的作用。
[0021]
本发明提供了一种地屈孕酮的制备方法,其包括如下步骤:在卤代烃溶剂中,在质量分数为20%~35%的氯化氢-醇溶液的存在下,将化合物2进行如下所示的反应得到地屈孕酮即可;
[0022][0023]
在所述的地屈孕酮的制备方法中,所述的卤代烃溶剂可为本领域进行此类反应的常规卤代烃溶剂,优选为二氯甲烷和/或三氯甲烷。所述的卤代烃溶剂的用量可为本领域进行此类反应的常规用量,优选其与所述的化合物1的体积质量比为1.0~60.0ml/g,例如,1.0ml/g、5.0ml/g、25.0ml/g、30.0ml/g或50.0ml/g。
[0024]
在所述的地屈孕酮的制备方法中,所述的氯化氢-醇溶液中的醇优选为甲醇、乙醇和异丙醇中的一种或多种。
[0025]
在所述的地屈孕酮的制备方法中,所述的氯化氢-醇溶液与化合物1的体积质量比优选为0.8~20.0ml/g,例如,1.0ml/g、1.5ml/g、5.0ml/g或15ml/g。
[0026]
在所述的地屈孕酮的制备方法中,所述的质量分数优选为20%~33%,例如,25%、26%、28%、29%、31%或33%。
[0027]
在所述的地屈孕酮的制备方法中,所述的反应的反应温度可为本领域进行此类反应的常规温度,优选为-80℃~80℃,例如,-50℃、-20℃、0℃、15℃或50℃。
[0028]
在所述的地屈孕酮的制备方法中,所述的反应的反应进程可采用本领域中的常规监测方法(例如tlc、hplc或nmr)进行检测,一般以化合物1的含量不再变化时作为反应终点。
[0029]
在所述的地屈孕酮的制备方法中,所述的反应还可包括后处理。所述的后处理优选在反应完成后,用水淬灭反应,浓缩有机相,打浆或重结晶纯化得到地屈孕酮。所述的打浆或重结晶的溶剂优选为乙酸乙酯、乙醇、甲基叔丁基醚、异丙醚中的一种或多种,例如,乙醇和甲基叔丁基醚、乙酸乙酯和异丙醚。
[0030]
所述的地屈孕酮的制备方法,其还可进一步包括如下步骤:
[0031]
(1)在酮类溶剂和水的混合溶剂中,在中等强度酸的作用下,将化合物1进行如下所示的水解反应;
[0032][0033]
(2)待反应完成后,降温至-5℃~30℃,有固体析出,过滤,将得到的固体,与第二溶剂混合,过滤得到化合物2;
[0034]
所述的中等强度酸为对甲苯磺酸、甲酸和乙酸中的一种或多种;
[0035]
所述的第二溶剂为醚类溶剂和/或醇类溶剂。
[0036]
所述的混合溶剂中,所述的酮类溶剂可为本领域进行此类反应的常规酮类溶剂,优选为丙酮和/或丁酮。
[0037]
所述的混合溶剂中,所述的酮类溶剂与水的体积比优选为1.0:2.0~2.0:1.0,例如,1:1或者21:25。
[0038]
所述的混合溶剂的用量可为本领域进行此类反应的常规用量,优选其与化合物1的体积质量比为8.0~20.0ml/g,例如,10ml/g、15.5ml/g或16.7ml/g。
[0039]
所述的中等强度酸的用量可为本领域进行此类反应的常规用量,优选其与化合物1的摩尔比为0.01:1.0~0.1:1.0,例如,0.02:1.0、0.08:1.0或0.056:1.0。
[0040]
所述的对甲苯磺酸优选为一水合对甲苯磺酸。
[0041]
所述的化合物1中可含有化合物3,优选其中化合物3的含量≤20%,例如,0.12%、5.02%、12.15%或19.15。
[0042]
所述的水解反应的反应温度优选为30~80℃,例如,40℃、60℃或80℃。
[0043]
所述的水解反应的反应进程可采用本领域中的常规监测方法(例如tlc、hplc或nmr)进行检测,一般以化合物1的含量不再变化时作为反应终点。
[0044]
所述的降温优选在反应结束后进行。
[0045]
所述的混合优选为向固体中加入第二溶剂。
[0046]
较佳地,所述的混合之后还包括搅拌的操作。
[0047]
所述的第二溶剂与化合物1的体积摩尔比优选为0.8~1.5l/mol,例如,0.93l/mol、1.2l/mol或1.33l/mol。
[0048]
所述的醇类溶剂优选为甲醇、乙醇和异丙醇中的一种或多种。
[0049]
所述的醚类溶剂优选为乙醚、异丙醚和甲基叔丁基醚中的一种或多种。
[0050]
本发明还提供了一种化合物2的制备方法,其包括如下步骤:
[0051]
(1)在酮类溶剂和水的混合溶剂中,在中等强度酸的作用下,将化合物1进行如下所示的水解反应;
[0052][0053]
(2)待反应完成后,降温至-5℃~30℃,有固体析出,过滤,将得到的固体,与第二溶剂混合,过滤得到化合物2;
[0054]
所述的中等强度酸为对甲苯磺酸、甲酸和乙酸中的一种或多种;
[0055]
所述的第二溶剂为醚类溶剂和/或醇类溶剂;
[0056]
所述的水解反应的方法和条件如前所述。
[0057]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0058]
本发明所用试剂和原料均市售可得,其中,化合物1可参考背景技术中的专利制备得到。
[0059]
本发明的积极进步效果在于:
[0060]
1)兼顾反应和纯化工艺;2)操作简便;3)纯度高,杂质含量可控,所得的化合物2中的化合物4含量小于0.10%,所得的地屈孕酮中未检出两个二聚物杂质;4)采用更低浓度和用量更少的氯化氢,很大程度降低废酸、废气、废水、废盐的产生,且收率高,对于地屈孕酮的产业化和质量可控性产生积极的作用。
附图说明
[0061]
图1为化合物2的质谱图。
[0062]
图2为化合物2的1h-nmr谱图。
[0063]
图3为化合物2的
13
c-nmr谱图。
[0064]
图4为化合物2的红外谱图。
[0065]
图5为地屈孕酮的高分辨质谱谱图。
[0066]
图6为地屈孕酮的
13
c-nmr谱图。
[0067]
图7为地屈孕酮的1h-nmr谱图。
[0068]
图8为地屈孕酮的红外谱图。
[0069]
图9为二聚物1的质谱谱图。
[0070]
图10为二聚物1的
13
c-nmr。
[0071]
图11为二聚物1的1h-nmr谱图。
[0072]
图12为二聚物1的红外谱图。
[0073]
图13为二聚物2的质谱谱图。
[0074]
图14为二聚物2的
13
c-nmr。
[0075]
图15为二聚物2的1h-nmr谱图。
[0076]
图16为二聚物2的红外谱图。
具体实施方式
[0077]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0078]
如无特别注明,以下实施例中的百分比为质量浓度。
[0079]
实施例1:化合物2的制备
[0080]
50ml四口瓶中,磁力搅拌和氮气保护下,加入15ml丙酮和15ml水,加入3g(7.5mmol)化合物1,其中化合物3为0.12%,0.03g(0.157mmol)一水合对甲苯磺酸,保温60℃下反应,反应结束,降温至0℃,过滤得到淡黄色粗品,其中化合物4为0.02%,加入7ml异丙醇搅拌,过滤,干燥,得到2.27g白色固体,收率96.8%,纯度99.7%,化合物4未检出。化合物2的质谱图如图1所示,esi-ms(m/z):[m na]
=335.2;1h-nmr谱图如图2所示,
13
c-nmr谱图如图3所示,红外谱图如图4所示。
[0081]
实施例2:化合物2的制备
[0082]
50ml四口瓶中,磁力搅拌和氮气保护下,加入15ml丙酮和15ml水,加入3g(7.5mmol)化合物1,其中化合物3为5.02%,0.03g(0.157mmol)一水合对甲苯磺酸,保温60℃下反应,反应结束,降温至0℃,过滤得到淡黄色粗品,其中化合物4为1.22%,加入7ml异丙醇搅拌,过滤,干燥,得到2.14g白色固体,收率91.6%,纯度99.2%,化合物4为0.03%。
[0083]
实施例3:化合物2的制备
[0084]
50ml四口瓶中,磁力搅拌和氮气保护下,加入21ml丁酮和25ml水,加入3g(7.5mmol)化合物1,其中化合物3为12.15%,0.12g(0.63mmol)一水合对甲苯磺酸,保温80℃下反应,反应结束,降温至-5℃,过滤得到淡黄色粗品,其中化合物4为7.63%,加入10ml甲基叔丁基醚搅拌,过滤,干燥,得到1.95g类白色固体,收率83.5%,纯度99.1%,化合物4为0.06%。
[0085]
实施例4:化合物2的制备
[0086]
50ml四口瓶中,磁力搅拌和氮气保护下,加入25ml丙酮和25ml水,加入3g(7.5mmol)化合物1,其中化合物3为19.15%,0.08g(0.42mmol)一水合对甲苯磺酸,保温40℃下反应,反应结束,降温至20℃,过滤得到淡黄色粗品,其中化合物4为10.63%,加入9ml异丙醚搅拌,过滤,干燥,得到1.83g白色固体,收率78.2%,纯度99.6%,化合物4为0.08%。
[0087]
实施例5 化合物2的制备
[0088]
500l反应釜氮气保护下,加入250l丙酮和250l水,开启搅拌,加入40kg(100mol)化合物1,其中化合物3为18.55%,0.8kg(4.2mol)一水合对甲苯磺酸,保温40℃下反应,反应结束,降温至20℃,过滤得到淡黄色粗品,其中化合物4为9.36%,加入80l异丙醚搅拌,过滤,干燥,得到23.2kg白色固体,收率74.36%,纯度99.5%,化合物4为0.07%。
[0089]
实施例6 化合物2的制备
[0090]
500l反应釜氮气保护下,加入200l丁酮和250l水,开启搅拌加入30kg(75mol)化合物1,其中化合物3为18.55%,1.2kg(6.3mol)一水合对甲苯磺酸,保温80℃下反应,反应结束,降温至-5℃,过滤得到淡黄色粗品,其中化合物4为8.65%,加入100l甲基叔丁基醚搅拌,过滤,干燥,得到18.32kg类白色固体,收率77.9%,纯度99.2%,化合物4为0.07%。
[0091]
实施例7:地屈孕酮的制备
[0092]
1000ml四口瓶中,磁力搅拌和氮气保护下,加入500ml二氯甲烷和10ml 25%氯化氢-异丙醇,保温0℃搅拌,加入10g化合物1,反应结束,倒入水淬灭反应,分层的有机相减压浓缩至干,乙酸乙酯打浆得到地屈孕酮9.5g,收率95%,纯度99.5%。esi-ms(m/z):313.2[m h]
,如图5所示;
13
c-nmr谱图如图6所示;1h-nmr谱图如图7所示;红外谱图如图8所示。
[0093]
实施例8:地屈孕酮的制备
[0094]
1000ml四口瓶中,磁力搅拌和氮气保护下,加入10ml三氯甲烷和100ml 29%氯化氢-甲醇,保温-50℃搅拌,加入10g化合物1,反应结束,倒入水淬灭反应,分层的有机相减压浓缩至干,乙醇重结晶得到地屈孕酮9.3g,收率93%,纯度99.3%。
[0095]
实施例9:地屈孕酮的制备
[0096]
1000ml四口瓶中,磁力搅拌和氮气保护下,加入250ml三氯甲烷和150ml 31%氯化氢-乙醇,保温50℃搅拌,加入10g化合物1,反应结束,倒入水淬灭反应,分层的有机相减压浓缩至干,甲叔醚打浆得到地屈孕酮9g,收率90%,纯度99.7%。
[0097]
实施例10:地屈孕酮的制备
[0098]
500ml四口瓶中,磁力搅拌和氮气保护下,加入300ml二氯甲烷和30ml33%氯化氢-异丙醇,保温15℃搅拌,加入10g化合物1,反应结束,倒入水淬灭反应,分层的有机相减压浓缩至干,乙酸乙酯和异丙醚重结晶得到地屈孕酮9.3g,收率93%,纯度99.6%。
[0099]
实施例11:地屈孕酮的制备
[0100]
250ml四口瓶中,磁力搅拌和氮气保护下,加入50ml三氯甲烷和50ml28%氯化氢-乙醇,保温-20℃搅拌,加入10g化合物1,反应结束,倒入水淬灭反应,分层的有机相减压浓缩至干,乙醇和甲叔醚打浆得到地屈孕酮9.6g,收率96%,纯度99.2%。
[0101]
实施例12 地屈孕酮的制备
[0102]
500l搪玻璃釜氮气保护下,加入300l二氯甲烷和35l 28%氯化氢-异丙醇,开启搅拌,保温5℃搅拌,加入10kg化合物1,反应结束,倒入水淬灭反应,分层的有机相减压浓缩至干,乙酸乙酯重结晶得到地屈孕酮8.9kg,收率89%,纯度99.3%。
[0103]
实施例13 地屈孕酮的制备
[0104]
实施例500l搪玻璃釜氮气保护下,加入300l二氯甲烷和15l 26%氯化氢-乙醇,开启搅拌,保温15℃搅拌,加入10kg化合物1,反应结束,倒入水淬灭反应,分层的有机相减压浓缩至干,乙酸乙酯和异丙醚重结晶得到地屈孕酮9.2kg,收率92%,纯度99.5%。
[0105]
对比例1 化合物2的制备
[0106]
50ml四口瓶中,磁力搅拌和氮气保护下,加入15ml丙酮和5ml水,加入3g(7.5mmol)化合物1,其中化合物3为5.02%,0.03g(0.157mmol)一水合对甲苯磺酸,保温60℃下反应,反应结束,降温至0℃,过滤得到淡黄色粗品,其中化合物4为3.02%,加入7ml异丙醇搅拌,过滤,干燥,得到2.02g白色固体,收率86.3%,纯度98.6%,化合物4为0.55%。
[0107]
对比例2 化合物2的制备
[0108]
50ml四口瓶中,磁力搅拌和氮气保护下,加入15ml乙醇和15ml水,加入3g(7.5mmol)化合物1,其中化合物3为5.02%,0.03g(0.157mmol)一水合对甲苯磺酸,保温60℃下反应,反应结束,降温至0℃,过滤得到淡黄色粗品,其中化合物4为4.30%,加入7ml异丙醇搅拌,过滤,干燥,得到2.10g白色固体,收率89.74%,纯度98.4%,化合物4为0.65%。
[0109]
对比例3 地屈孕酮的制备
[0110]
250ml四口瓶中,磁力搅拌和氮气保护下,5g化合物1溶解于50ml四氢呋喃,再加入10ml浓盐酸,-5℃下搅拌,反应结束后,减压除去溶剂,粗产品溶解于二氯甲烷,碳酸氢钠洗涤,干燥,用乙酸乙酯/正己烷=1:5重结晶,再用异丙醇精制得到地屈孕酮4.1g,纯度79.2%,收率78%。对得到的地屈孕酮进行成分分析,发现其中含有二聚物1(10%)和二聚物2(9.9%)。其中,二聚物1的质谱谱图如图9所示,
13
c-nmr谱图如图10所示,1h-nmr谱图如图11所示,红外谱图如图12所示;二聚物2的质谱谱图如图13所示,
13
c-nmr谱图如图14所示,1h-nmr谱图如图15所示,红外谱图如图16所示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。