1.本发明属于类器官培养领域,具体涉及一种培养肝肿瘤类器官的方法。
背景技术:
2.我国是肝病大国,是世界上病毒性肝炎和肝癌发病率最高、病人最多的国家。据我国恶性肿瘤发病情况、死亡率报告显示,原发性肝癌位居我国恶性肿瘤发病率第四位,死亡率第二位,且我国原发性肝癌发病率占全球1/2。其中,肝细胞癌(hepatocellular carcinoma,hcc)占原发性肝癌的85~90%。化疗和免疫治疗似乎是目前最有效的治疗手段。因此,筛选有效的抗肝癌新药物及为肝癌患者制定个性化医疗方案是临床的迫切需求。
3.建立具有人类肿瘤形态和分子特征的有效稳定的肿瘤模型,对于筛选抗肿瘤药物具有重要意义。近年来,越来越多的肿瘤模型出现,如商业肿瘤细胞系、人源肿瘤细胞系(patient-derived cancer cell lines,pdc)以及人源肿瘤异种移植模型(patient-derived xenografts,pdx)等。其中商业肿瘤细胞系和pdc由于易于操作和培养,逐渐成为肿瘤研究和药物筛选的基础研究模型。然而,由于在体外培养过程中易丧失肿瘤细胞的异质性及其体内特征,因此商业肿瘤细胞系和pdc不能完全地揭示体内的药物反应。pdx保留了原发肿瘤的分子和形态学特征,并揭示原发肿瘤的异质性。然而,pdx移植效率低下和实验周期长,同时来源于缺乏免疫系统的裸鼠,且可能在裸鼠体内发生特异性的肿瘤突变。限制了其在抗肿瘤药物筛选和肿瘤精准治疗中的应用。因此,急需一个更能接近体内特性的肿瘤模型。随着肿瘤类器官技术的出现,满足了这一需求。
4.肿瘤类器官作为一种体外细胞3d培养模型,能高度模拟体内肿瘤组织的结构和功能,并能够表现出细胞与细胞以及细胞与基质之间的相互作用,理想状态下,肿瘤类器官与体内分化的肿瘤组织具有相似的病理生理学特征。人源肿瘤类器官(patient-derived organoids,pdo)保留了个体肿瘤的异质性,通过pdo进行靶向药物的筛选,指导临床用药,在个性化治疗中体现了巨大的价值。肿瘤类器官作为药物筛选模型的稳定性和保真度可分为三个方面:第一,肿瘤类器官在长期的培养过程中,肿瘤类器官保留了原发肿瘤的异质性,其中不同代数的肿瘤类器官对于抗肿瘤药物筛选的结果基本一致。第二,肿瘤类器官进行药物筛选的结果与患者临床用药具有一致的结果,这表明肿瘤类器官对于精准治疗具有巨大的潜在价值。第三,肿瘤类器官在长期的培养过程中,可视作为一种“细胞系”,对同一肿瘤类器官细胞系进行药物筛选,具有一致的药物筛选结果。
5.肿瘤类器官可进行长时间传代,在传代培养过程中不丢失或改变遗传信息。保留了瘤内与瘤外的异质性。目前结直肠癌,非小细胞肺癌,乳腺癌以及胰腺癌肿瘤类器官模型已广泛应用于药物评价、生物标志物鉴定、生物学研究和个性化治疗。在肝脏类器官方面,huch研究团队利用lgr5 干细胞构建肝类器官实现长达6个月体外培养,同时通过肝细胞癌、胆管癌和肝细胞胆管癌等临床样本建立了相应的肿瘤类器官模型,通过组织学、免疫组织化学和基因组学等方法,证实了这些模型能够保持器官位点特异性的组织学和遗传特征。可以看出,肝脏pdo技术的不断发展将为实现肝癌患者个性化治疗提供有力的技术支
撑。
6.目前,肝脏pdo主要的培养方式是huch研究团队利用matrigel在96或者384孔板进行3d包裹式培养,这样的培养方式存在操作繁琐、成本较高、规模小、类器官粒径不一、不在同一平面、不易分析观察等缺点,不能规模化批量生产及使用,为抗肿瘤药物的筛选以及药效评估带来了诸多不便。同时,肝脏pdo首次进行传代的时间为4周左右,通过扩增制备足够数量的pdo用于药物筛选所花费的时间可多达12周。然而,临床新辅助疗法以及术后化疗的时间窗通常为2-3周。
7.因此,寻找一种快速、操作简便、成本低的方法,培养大小均一、生长在同一平面、便于分析观察的肝肿瘤类器官,实现肝肿瘤类器官快速规模化培养具有重要意义。
技术实现要素:
8.本发明的目的是提供一种培养肝肿瘤类器官的方法。
9.本发明提供了一种肝肿瘤类器官培养容器,它是内部底表面带有肝脏细胞外基质印迹块阵列的细胞培养容器;
10.所述底表面未覆盖肝脏细胞外基质的区域被封闭剂封闭;
11.所述肝脏细胞外基质印迹块阵列由直径为50~300μm的圆形阵点组成,每个圆形阵点间的间距为25-500μm。
12.进一步地,所述肝脏细胞外基质印迹块阵列由直径为100μm的圆形阵点组成,每个圆形阵点间的间距为50μm。
13.进一步地,所述肝脏细胞外基质印迹块阵列的面积为1~10cm2;
14.优选地,所述肝脏细胞外基质印迹块阵列的面积为4cm2。
15.进一步地,所述细胞培养容器为培养皿、培养盒、培养板或培养瓶;
16.和/或,所述封闭剂为pluronic f-127;
17.优选地,所述pluronic f-127质量分数为1~5%。
18.进一步地,所述肝脏细胞外基质是猪的肝脏细胞外基质;
19.优选地,所述猪的肝脏细胞外基质的制备方法包括如下步骤:
20.(1)采用triton-sds-triton门静脉灌注法制备猪全肝脏脱细胞化支架;
21.(2)得到的脱细胞化肝脏支架冻干、粉碎后,采用胃蛋白酶酶解而得。
22.优选地,所述triton-sds-triton门静脉灌注法为取新猪肝静脉插管,去除血液后将肝冷冻并解冻,采用1%triton x-100灌注3小时、随后1%十二烷基硫酸钠(sds)灌注6小时,再采用1%triton x-100灌注3小时,最后用pbs灌注2小时平衡脱细胞化肝脏,即得到脱细胞化肝脏支架。灌注时,全程流速为200ml/min。
23.优选地,所述酶解时,粉碎后得到的肝脏胞外基质浓度为10mg/ml;胃蛋白酶与肝脏胞外基质粉末的质量比为1∶10。此外,酶解时ph为2,温度为室温,酶解时间为72小时。
24.进一步地,所述肝脏细胞外基质的浓度为0.05~0.5mg/ml;
25.优选地,所述肝脏细胞外基质的浓度为0.1~0.5mg/ml。
26.上述肝肿瘤类器官培养容器采用pdms微图案印刷技术制备而成:先使用激光蚀刻出具有特定图案的硅片作为模板,倒模获得具有特定尺寸的外凸圆形微图案的微阵列pdms印章,在pdms印章表面涂布肝脏细胞外基质胶,印压于培养容器底表面,获得胞外基质微图
案阵列,再将培养容器剩余部分使用封闭剂封闭,即得肝肿瘤类器官培养容器。
27.本发明还提供了一种肝肿瘤类器官培养方法,包括如下步骤:
28.将肝癌细胞接种于前述的培养容器中,培养4~6h后洗去未贴附细胞,再培养3~5天即得肝肿瘤类器官。
29.进一步地,所述肝癌细胞的接种密度为10
4~
106个/培养容器;
30.和/或,所述肝癌细胞来源于人;
31.优选地,所述肝癌细胞的接种密度为105个/培养容器。
32.本发明还提供了一种肝肿瘤类器官,它是前述方法制备得到的肝肿瘤类器官。
33.本发明还提供了前述的肝肿瘤类器官在构建肝癌模型或药物筛选中的应用。
34.本发明提供了一种肝肿瘤类器官的培养方法,该方法采用特定阵点形状、尺寸、密度的肝脏ecm图案微阵列进行培养,缩短了肝肿瘤类器官体外扩增培养时间,简化了肝肿瘤类器官培养方式,有效改善了现有肿瘤类器官培养操作繁琐,成本较高,小规模,类器官粒径不一和不易分析观察等缺点。有效控制了肝肿瘤类器官的粒径大小与排列,提高了药物筛选的重复性与稳定性。肝脏脱细胞化ecm为肝肿瘤类器官培养提供了肿瘤微环境,有利于维持肿瘤的异质性,模拟体内肝癌组织。使用该肝肿瘤类器官进行药物筛选,具有更高效与安全性,同时pdo可进行个性化治疗,指导临床用药。
35.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
36.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
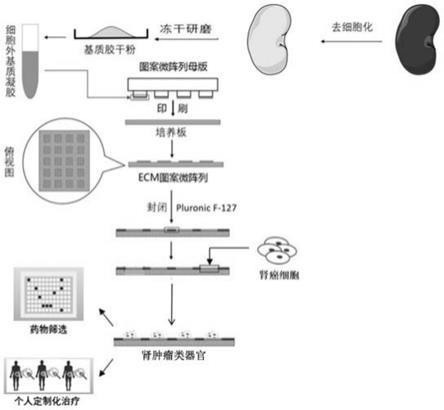
37.图1为本发明肝肿瘤类器官的培养路线。
38.图2为猪全肝脏脱细胞化后的结果:a为脱细胞化后肝脏的大体观;b为脱细胞化后的h&e染色;c为脱细胞化后的电镜图;d为脱细胞化后的天狼星红染色;e为脱细胞化后的i型胶原纤维染色;f为脱细胞化后的iv型胶原纤维染色;g为脱细胞化前后的胶原含量检测;h为脱细胞化前后的葡萄糖胺聚糖(gag)含量检测;*表示与对照组相比p《0.05;标尺=100μm;图中control为未脱细胞化的对照组,dls为脱细胞化的肝脏。
39.图3为肝脏脱细胞化后得到的ecm粉末(左)以及酶解后得到的肝脏脱细胞化ecm凝胶(右)。
40.图4为各阵点形状和尺寸的图案微阵列:a为pdms圆形阵点图案微阵列;b为ecm圆形阵点图案微阵列;c为pdms正方形阵点图案微阵列;d为ecm正方形阵点图案微阵列;a、b、c、d中圆形阵点的直径或正方形阵点的边长从左到右依次为50μm、75μm、100μm、150μm、200μm、300μm;图中标尺:200μm。
41.图5为肝肿瘤类器官培养结果:a为不同直径圆形阵点微阵列培养肝癌细胞,6小时;b为不同直径圆形阵点微阵列培养肝癌细胞,3天;c为不同边长正方形阵点微阵列培养肝癌细胞,6小时;d为不同边长正方形阵点微阵列培养肝癌细胞,3天(标尺:100μm)。
42.图6为不同直径圆形阵点微阵列培养的肝肿瘤类器官fda染色及功能性检测结果:
a为fda染色;b为功能检测(标尺:50μm)。
43.图7为肝肿瘤类器官fda染色及功能性检测:a为紫杉醇;b为表阿霉素;c为双硫仑。
具体实施方式
44.除另有说明外,本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
45.本发明肝肿瘤类器官的培养路线如图1所示,包括如下步骤:
46.(1)肝脏脱细胞化ecm的制备:采用triton-sds-triton门静脉灌注法制备猪全肝脱细胞化支架。得到的脱细胞化肝支架(肝脏细胞外基质)进一步冻干,使用球磨仪粉碎后,再用胃蛋白酶酶解,获得肝脏脱细胞化细胞外基质(ecm)凝胶。
47.(2)采用pdms微图案印刷技术制备图案微阵列母版:使用激光蚀刻出具有特定图案的硅片作为模板,蚀刻精度达到1μm,蚀刻面积最大达到12英寸,倒模获得聚二甲基硅氧烷(polydimethylsiloxane,pdms)印章。将细胞外基质凝胶(称为胞外基质胶或基质胶)涂布于印章表面,然后利用pdms微图案印刷技术,将胞外基质胶图案微阵列铺设在细胞非贴附处理的细胞培养皿的底部,pluronic f-127封闭剩余培养皿底部的空间,使加入的细胞只能贴附在胞外基质胶图案上生长。得到肝脏脱细胞化ecm图案微阵列芯片。
48.(3)肝肿瘤类器官的培养:采用肝脏脱细胞化ecm图案微阵列芯片培养肝肿瘤类器官,缩短其体外扩增培养时间,可有效控制其粒径大小与排列。
49.实施例1、本发明肝肿瘤类器官的培养方法
50.本发明肝肿瘤类器官的培养方法包括如下步骤:
51.(1)猪肝脱细胞化胞外基质胶的制备:取新鲜猪肝脏后,静脉插管,灌注10l灌注液(nacl 8.3g/l,kcl 0.5g/l,hepes 2.4g/l,egta 0.95g/l)去除肝脏中的血液。然后将肝脏冷冻并解冻,采用1%triton x-100灌注3小时、随后1%十二烷基硫酸钠(sds)灌注6小时,再采用1%triton x-100灌注3小时,最后用pbs灌注2小时平衡脱细胞化肝脏,得到脱细胞化肝支架(肝脏细胞外基质)。灌注时,全程流速为200ml/min。然后将脱细胞化肝支架(dlss)切成1
×1×
1cm的立方体进行冻干。进一步经过球磨仪粉碎得到肝脏胞外基质粉末。随后使用胃蛋白酶酶解上述肝脏胞外基质粉末,得到脱细胞化肝脏胞外基质凝胶(胞外基质胶)。酶解时,肝脏胞外基质粉末溶解于水中,浓度为10mg/ml,再加入胃蛋白酶酶解;胃蛋白酶与肝脏胞外基质粉末的质量比为1∶10;酶解时ph为2,温度为室温,酶解时间为72小时。
52.猪肝脱细胞化后呈白色透明状,通过免疫荧光、组化以及酶联免疫吸附剂测定后,发现胞外基质蛋白得到了很好的保留(图2),进一步通过粉碎,酶解得到了脱细胞化肝脏胞外基质凝胶(图3)。
53.(2)使用激光蚀刻出具有特定图案的硅片作为模板,倒模获得pdms印章,制备出具有外凸圆形阵点的图案微阵列(每个圆形阵点的直径为100μm,每个圆形阵点间的间距为50μm,微阵列大小为4cm2)pdms印章。
54.(3)使用pbs调整基质胶浓度,将1ml浓度为100μg/ml的猪肝脏脱细胞化胞外基质胶涂布于pdms印章表面,室温孵育20分钟后洗去多余的基质胶,37℃孵箱中干燥。
55.(4)使pdms印章印压于细胞非贴附培养皿内底表面,给予0.2牛顿力,持续10分钟,待图案在培养皿底表面形成后移去印章。
56.(5)加入质量分数1%的pluronic f-127(普卢兰尼克f-127,一种聚丙二醇与环氧乙烷的加聚物(聚醚))室温孵育2小时,封闭剩余培养皿内底表面的空间,得到对细胞具有粘附作用的“胞外基质图案微阵列”。制作好的微阵列培养皿在使用前,先用pbs清洗3次,保证培养皿基底不能完全干燥,然后再接种细胞。
57.(6)在培养皿中接种人肝癌细胞(hepg2,接种量为1.5
×
105/皿),37℃培养6h后,洗去未贴附细胞,再经过3天培养,即可形成肉眼可见的肝肿瘤类器官。这些肝肿瘤类器官均排列在同一平面上,大小均一,数量可控。
58.人肝癌细胞被限定贴附在“胞外基质图案微阵列”内生长。本步骤所用到的培养基为dmem高糖培养基,含有10%的胎牛血清和1%双抗。
59.以下通过具体试验例证明本发明的有益效果。
60.试验例1、本发明肝肿瘤类器官培养方法中图案微阵列的筛选
61.采用实施例1所述方法制备胞外基质图案微阵列,只是改变图案微阵列中阵点的形状(阵点可以为圆形阵点或正方形阵点)和尺寸(圆形阵点的直径或正方形阵点的边长选自50μm、75μm、100μm、150μm、200μm或300μm),每个阵点间的间距为50μm,微阵列大小为4cm2。各图案微阵列如图4所示。
62.按照实施例1所述方法采用上述胞外基质图案微阵列培养肝肿瘤类器官,图案微阵列在使用前,用pbs清洗1次,保证培养基底不能完全干燥,接种人肝癌细胞(hepg2,接种量为1.5
×
105/皿)。图案微阵列在细胞培养皿底上限制细胞的生长、粘附空间,使细胞被限定贴附在胞外基质胶图案微阵列中的阵点上生长,经过3天培养形成肝肿瘤类器官(图5)。
63.根据肝肿瘤类器官形态,死活功能选择微阵列中阵点的最佳形状和大小。研究发现:
①
使用圆形阵点比使用正方形阵点培养的肝肿瘤类器官具有更好的形态,更利于肿瘤研究(图5);
②
随着圆形阵点直径的增加,培养出的肝肿瘤类器官内部出现死细胞的数量逐渐增加,根据荧光定量pcr分析表明,随着圆形阵点直径增加,肝肿瘤类器官的功能先增加后减弱。最终选择直径为100μm的圆形阵点为培养肝肿瘤类器官图案微阵列的最佳阵点(图6)。
64.试验例2、肝肿瘤类器官微图案芯片药物筛选评价
65.选择实施例1培养的直径为100μm的肝肿瘤类器官,并选择市面上常见的抗肿瘤药物紫杉醇、表阿霉素和双硫仑,利用该肝肿瘤类器官进行药物筛选评价,药物浓度为5-100μg/ml。经过fda染色分析表明:利用本发明培养的肝肿瘤类器官可以有效筛选药物种类、药物剂量和药物作用时间对肝肿瘤的影响。研究发现药物种类、药物剂量和药物作用时间都存在明显的药物敏感差异性,其中表阿霉素的抗肝肿瘤药效最佳(图7)。研究发现,将肝肿瘤类器官大小控制以及排列后,可以更好的分析以及观察药物筛选的结果,本发明肝肿瘤类器官图案微阵列芯片应用于个性化治疗与抗肿瘤药物筛选的潜在价值。
66.经上述试验表明,肝脏脱细胞化ecm凝胶可作为图案微阵列印刷的生物墨汁,且印刷效率高。通过对比微阵列中不同形状和大小阵点对培养的肝肿瘤类器官形态、死活以及功能的情况,筛选出微阵列中最佳的阵点为直径为100μm的圆形阵点。即培养肝肿瘤类器官的最佳图案微阵列为:以直径为100μm的圆形作为阵点,每个圆形阵点间的间距为50μm。
67.接下来,选取了市面常见的三种抗肿瘤药物(紫杉醇,表阿霉素和双硫仑)进行药物筛选评价,实验结果表明本发明培养的肝脏肿瘤类器官可以有效筛选药物种类、药物剂
量和药物作用时间对肝肿瘤的影响。该肝脏肿瘤类器官具有药物种类、药物剂量和药物作用时间的依赖性,其中表阿霉素具有最强的药物敏感性。同时,研究发现通过ecm图案微阵列的方式培养肝肿瘤类器官,更有利于对其观察分析药物反应情况。根据实验室数据结果显示肝肿瘤类器官微图案芯片在个性化药物筛选,指导临床用药,具有巨大的潜在价值。
68.综上,本发明提供了一种肝肿瘤类器官的培养方法,该方法采用特定阵点形状、尺寸、密度的肝脏ecm图案微阵列进行培养,缩短了肝肿瘤类器官体外扩增培养时间,简化了肝肿瘤类器官培养方式,有效改善了现有肿瘤类器官培养操作繁琐,成本较高,小规模,类器官粒径不一和不易分析观察等缺点。有效控制了肝肿瘤类器官的粒径大小与排列,提高了药物筛选的重复性与稳定性。肝脏脱细胞化ecm为肝肿瘤类器官培养提供了肿瘤微环境,有利于维持肿瘤的异质性,模拟体内肝癌组织。使用该肝肿瘤类器官进行药物筛选,具有更高效与安全性,同时pdo可进行个性化治疗,指导临床用药。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。