以p16/ki-67、top2a/mcm2为靶标的宫颈癌检测试剂盒及其判读方法
技术领域
1.本发明属于体外诊断医疗器械技术领域,尤其涉及一种以p16/ki-67、top2a/mcm2为靶标的宫颈癌检测试剂盒及其判读方法。
背景技术:
2.近年来,中国宫颈癌发病和死亡负担严重,且呈上升趋势,宫颈癌筛选被认为是降低宫颈癌发病率和死亡率最有效措施。宫颈癌的发病与人乳头瘤病毒(hpvs)密切相关,hpvs是一种小型双链dna病毒,特异性感染上皮细胞,hpv家族包含约200多种病毒亚型,每种病毒亚型的组织特异性不同,大多数hpv亚型引起的病变为良性,只有少部分hpv亚型为高危亚型,可引起肿瘤。
3.宫颈癌及癌前病变筛查包括三个阶段,分别为子宫颈细胞学筛查(初诊)、阴道镜检(转诊)和子宫颈活检组织病理学(确诊)。
4.其中,子宫颈细胞学筛查需遵循以下两项基本原则:即尽可能减少高级别病变及以上(hsil,高度的鳞状上皮内病变(cinii
))的漏筛和漏检(随访复查和常规筛查)的同时,亦尽可能减少低级别病变及以下(lsil,鳞状上皮低密度病变(cini-))的过度筛查。
5.子宫颈细胞学筛查经历了三个以下阶段的演变:
6.阶段一、
①
采用巴氏涂片法(cps)进行初诊,具体是在宫颈移行带取材、涂片和巴氏染色,在显微镜下观察细胞形态学改变的一种方法,其诊断标准分为五级:巴氏ⅰ级-正常、巴氏ⅱ级-炎症。巴氏ⅲ级-可疑癌;巴氏ⅳ级-高度可疑癌;巴氏
ⅴ
级-癌。这种诊断方法虽然便宜,便于普查,但是由于细胞堆积在一起,不便于观察,准确率低。
②
lbc(液基细胞学检测):用特制的小毛刷沿宫颈表面和宫颈管刷几圈,收集到的细胞经计算处理称为单层排列的细胞,诊断准确率高,对设备和技术的要求较高,价格偏贵。诊断标准大致分为:感染、反应性改变、上皮细胞异常(如不典型鳞状上皮细胞、低度或鳞状上皮内病变、鳞状细胞癌、不典型腺细胞、宫颈腺癌等)。
7.阶段二、病因生物标记物;
8.(1)检测核酸,包括hpv dna和hpv e6/e7 mrna;(2)检测蛋白,包括hpv l1壳蛋白和hpv e6/e7蛋白。hpv的晚期基因区(l)位于hpv dna序列的下游,含有两个开放阅读框架,其中hpv l1编码的hpv l1壳蛋白是hpv的主要衣壳蛋白。
9.阶段三、病变生物标记物;
10.(1)检测核酸:包括dna倍体、人类染色体末端酶rna基因(hterc)和dna甲基化。(2)检测蛋白:包括以p16、ki-67、top2a、mcm2为靶标的免疫细胞化学染色法(immunocytochemistry,icc)。
11.p16基因又名多肿瘤抑癌基因(multiple tumor suppressor 1,mts),其在细胞核和细胞浆中表达的抑癌蛋白p16是细胞周期进展负调节蛋白。当人乳头瘤病毒整合感染宫颈上皮细胞后,引入并激活致癌基因e7,促使致癌蛋白e7表达,抑制prb蛋白(由抑癌基因rb
编码得到)与e2f蛋白结合,促进宫颈上皮细胞增殖。当细胞增殖过度,将激活细胞增殖负反馈调节机制,即通过激活抑癌基因p16,促使抑癌蛋白p16表达,促进prb与e2f蛋白结合,从而抑制宫颈上皮细胞过度增殖。
12.ki-67基因是与细胞增殖相关的基因,其表达因细胞周期时相不同而异,开始表达于细胞周期的g1期,在s期及g2期表达增加,至m期表达达高峰,在细胞有丝分裂后期迅速降解或失去抗原决定簇,g0期不表达。由于其半衰期短,不易受生长因子诱导,可作为评价细胞生长分数的指标。在同一个细胞周期,生理机能正常细胞极少同时表达p16(细胞增殖负向调节蛋白)和ki-67蛋白(细胞增殖指标),如二者同时表达,则提示细胞周期失调。
13.微小染色体维持蛋白(minichromosome maintenance protein,mcm)是真核生物dna复制的主要调控因子之一,mcm2蛋白存在于细胞核,其家族成员mcm2被认为是特异性增殖相关因子。mcm2为细胞周期s期异常的分子标记物,当人乳头瘤病毒整合感染宫颈上皮细胞后,引入并激活致癌基因e6和e7,促使致癌蛋白e6和e7表达,致使宫颈上皮细胞g1期向s期过渡受限。
14.top2a(topoisomerase(dna)ii alpha)基因是细胞周期异常标志物,可单独/联合用于子宫颈及癌前病变筛查。dna拓扑异构酶,可改变dna拓扑状态,细胞异常增殖因子,新型肿瘤预后判定指标。
15.现有免疫细胞化学单染色检测,仅检测细胞是否产生阳性染色,检测不全面。有的判读方法以多个靶标检测后,出现两个以上阳性细胞,作为阳性。会产生大量的假阳性,或漏诊的现象,失去了辅助诊断的意义。有的判定方法过于草率,如多个靶标中,只要出现两个以上靶标染色显示阳性,则判定为高风险,会造成大量的过度筛查。故有必要对于多染的细胞免疫化学染色的判读方法,进一步的规范和确认。
技术实现要素:
16.本发明的目的在于提供一种以p16/ki-67、top2a/mcm2为靶标的宫颈癌检测试剂盒及其判读方法,以至少解决上述技术问题之一。
17.本发明目的之一在于提供:以p16/ki-67、top2a/mcm2为靶标的宫颈癌检测试剂盒,包括试剂:p16/ki-67一抗工作混合液、羊抗鼠/兔二抗工作混合液、top2a/mcm2一抗工作混合液、dab工作混合液、red工作混合液和苏木素。
18.优选地,p16/ki-67一抗工作混合液包括抗体稀释液、p16一抗浓缩液和ki-67一抗浓缩液;top2a/mcm2一抗工作混合液包括抗体稀释液、top2a一抗浓缩液和mcm2一抗浓缩液;dab工作混合液包括dab染色底物、dab染色缓冲液;red工作混合液包括ap-red显色缓冲液、ap-red色原浓缩液。
19.本发明目的之二在于提供:上述宫颈癌检测试剂盒的判读方法,宫颈细胞采样后制备两张子宫颈脱落细胞制片,分别为细胞制片1和细胞制片2;
20.采用p16/ki-67一抗工作混合液、羊抗鼠/兔二抗工作混合液、dab工作混合液、苏木素对细胞制片1进行p16/ki-67免疫组织化学染色;
21.采用top2a/mcm2一抗工作混合液、red工作混合液、羊抗兔二抗工作液、苏木素对细胞制片2进行mcm2免疫组织化学染色;
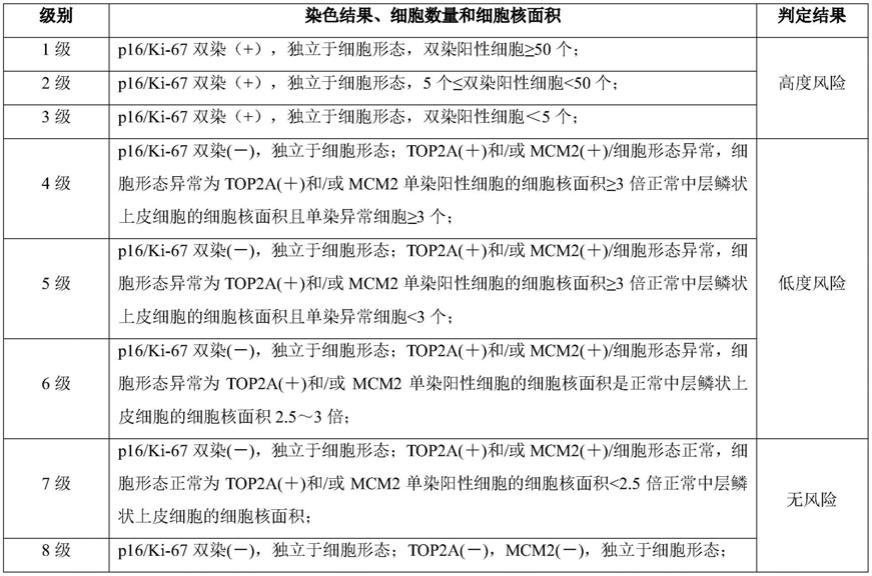
22.结合染色结果、细胞数量和细胞核面积,得出判定结果,具体如下表所示。
[0023][0024]
优选地,配制p16/ki-67一抗工作混合液:首先将抗体稀释液和p16一抗浓缩液混合,再加入到ki-67一抗浓缩液中混匀。
[0025]
优选地,配制top2a/mcm2一抗工作混合液:将抗体稀释液和top2a一抗浓缩液加入到mcm2一抗浓缩液中混匀。
[0026]
优选地,配制羊抗鼠/兔二抗工作混合液:将羊抗鼠二抗工作液加入羊抗兔二抗工作液中混合。
[0027]
优选地,配制dab工作混合液:dab染色底物和dab染色缓冲液混匀得到。
[0028]
优选地,配制red工作混合液:ap-red显色缓冲液和ap-red色原浓缩液混匀得到。
[0029]
优选地,对细胞制片1进行p16/ki-67免疫组织化学染色:首先将p16/ki-67一抗工作混合液添加到细胞制片1上;然后在细胞制片1上再羊抗鼠/兔二抗工作混合液,最后依次添加dab工作混合液、red工作混合液和苏木素进行染色。
[0030]
优选地,对细胞制片2进行top2a/mcm2免疫组织化学染色:首先将top2a/mcm2一抗工作混合液添加到细胞制片2上,然后在细胞制片2上再添加羊抗鼠/兔二抗工作混合液,最后依次添加dab工作混合液、red工作混合液和苏木素进行染色。
[0031]
本发明的原理和有益效果在于:
[0032]
(1)本发明中“p16/ki-67”是指将p16和ki-67作为一组进行免疫组织化学染色,top2a/mcm2作为一组进行免疫组织化学染色。
[0033]
(2)本发明提供的试剂盒通过免疫细胞化学法检测p16、ki-67、top2a和mcm2蛋白表达,进行子宫颈癌及癌前病变风险评估,是一种新型的子宫颈癌及癌前病变筛查方法。高敏感靶标top2a和mcm2可作为新一代子宫颈癌及癌前病变筛查“初筛”指标;高特异靶标p16/ki-67可作为新一代子宫颈癌及癌前病变筛查“分流”指标。通过p16/ki-67双染保证了其特异性(特异性与tct宫颈癌筛查相当),通过top2a和mcm2染色又保证了其敏感性(敏感性与hpv病毒学检查相当),是高特异性和高敏感性兼具的宫颈癌筛查方法。
[0034]
(3)本发明提供的试剂盒判读方法,既结合了客观的子宫颈癌及癌前病变生物标记物指标(p16、ki-67、top2a、mcm2),亦引入了细胞形态学主观判定方法(参考tbs指南对于lsil(鳞状上皮低密度病变)/asc-us(意义不明的不典型鳞状细胞)的形态学判读),染色结果直观,判读简便,不局限于专业细胞病理医生阅片,普通医学背景技术人员经厂家技术质控专员短暂培训即可完成结果判读。也可经人工智能初步判读后再由人工复核,极大程度减轻病理医生日常阅片工作量和工作难度。
[0035]
(4)本发明的判定结果有多项,可以精准地进行iii级风险评估(高度风险、低度风险和无风险),亦可以精准地给予相对应的三层风险管理(阴道镜检、二次分流、常规筛查),可以同时应用于准确初筛和精准分流。故本发明提供了一种ⅲ级风险评估三层风险管理子宫颈细胞学筛查方法,能够同时满足子宫颈癌及癌前病变的精准筛查两项基本要求(不过度筛查,不漏筛漏检)成为可能,能有效增加临床应用判读的灵敏度及准确率,增加阳性预测值,是精准的筛查方法。
[0036]
(5)本发明推出的8级风险分级判读标准,可对应于tbs的五级分类,可实现与传统lbc(液基细胞学检测)的筛查方法同行同级对比相互印证。
附图说明
[0037]
图1为p16/ki-67双染( ),独立于细胞形态,单层细胞的染色结果;独立于细胞形态即不对形态大小进行判读。
[0038]
细胞染色:同一单层细胞,由于p16和ki-67表达量不同,ki-67在细胞核呈现不同的复合染色效果,具体可能呈现出粉红色、红色或红棕色,p16在细胞浆的染色效果呈棕色。
[0039]
图2为p16/ki-67双染( ),独立于细胞形态,细胞簇(典型染色,较易判读染色细胞核和染色细胞浆在同一细胞内)的染色结果。
[0040]
图3为p16/ki-67双染( ),独立于细胞形态,细胞簇(非典型染色),非典型染色即较难判读染色细胞核和染色细胞浆在同一细胞内的染色结果。
[0041]
图4为p16/ki-67双染(-):p16( )/ki-67(-),独立于细胞形态的染色结果。
[0042]
细胞染色:同一单层细胞或者细胞簇,细胞核和/或细胞浆呈棕色(p16)。
[0043]
图5为p16/ki-67双染(-):p16(-)/ki-67( ),独立于细胞形态的染色结果。
[0044]
细胞染色:同一单层细胞或者细胞簇,细胞浆无染色,细胞核呈粉红色(ki-67)。
[0045]
图6为p16/ki-67双染(-):p16(-)/ki-67(-),独立于细胞形态的染色结果。
[0046]
细胞染色:同一单层细胞或者细胞簇,细胞核蓝色,细胞浆无染色。
[0047]
图7为top2a( )和/或mcm2( ),单染阳性细胞核与标尺细胞核面积肉眼对比判读法的染色结果。
[0048]
参见图中红色箭头,mcm2( )细胞:细胞核红色深染,形态各异,大小不一,直径不一。
[0049]
参见图中黄色箭头,异型中层鳞状上皮细胞:细胞核蓝色淡染,形态膨大,大小不一,直径较大。
[0050]
参见图中黑色箭头,正常中层鳞状上皮细胞:细胞核蓝色淡染,形态圆整,大小一致,直径适中。参见图中绿色剪头,正常表层鳞状上皮细胞:细胞核蓝色深染,形态固缩,大小不一,直径较小。
[0051]
图8为mcm2( ),单染阳性细胞核与标尺细胞核面积软件测量对比判读法的染色结果。
[0052]
mcm2( )细胞核面积145.73μm2,标尺细胞核面积56.07μm2,该样本标尺细胞核面积的2.5倍为140.175μm2。
[0053]
图9为top2a( )和/或mcm2( ),单染阳性细胞核面积软件测量阈值判读法的染色结果。
[0054]
mcm2单染阳性细胞核(粉红色)面积132.29μm2,>125μm2(标尺细胞核面积的2.5倍阈值)。
[0055]
top2a单染阳性细胞核(棕色)面积238.8μm2,>150μm2(标尺细胞核面积的3.0倍阈值)。
[0056]
图10为mcm2( );top2a( )和mcm2( ),细胞形态异常的染色结果。
[0057]
细胞染色:同一单层细胞或者细胞簇,细胞浆无染色,细胞核呈棕色(top2a)或粉红色(mcm2)。
[0058]
细胞形态1:采用软件测量阈值判读法,mcm2单染阳性细胞核(粉红色)面积测量为207.17μm2,>150μm2(标尺细胞核面积的3.0倍阈值)。
[0059]
细胞形态2:采用肉眼测量对比判读法,top2a( ),mcm2( )细胞核(红色箭头)面积≥2.5倍标尺细胞核(黑色箭头)面积。正常表层鳞状上皮细胞核(绿色箭头)。
[0060]
图11为mcm2( )/细胞形态正常的染色结果。
[0061]
细胞染色:同一单层细胞或者细胞簇,细胞浆无染色,细胞核呈粉红色(mcm2)。
[0062]
细胞形态1:采用软件测量阈值判读法,top2a单染阳性细胞核(棕色)面积测量为93.31μm2,《125μm2(标尺细胞核面积的2.5倍阈值)。
[0063]
细胞形态2:采用肉眼测量对比判读法,mcm2单染阳性细胞核(红色箭头)面积《2.5倍标尺细胞核(黑色箭头)面积。正常表层鳞状上皮细胞核(绿色箭头)。
[0064]
图12为top2a(-),mcm2(-),独立于细胞形态的染色结果。
[0065]
细胞染色:同一单层细胞或者细胞簇,细胞浆无染色,细胞核呈蓝色。
具体实施方式
[0066]
下面通过具体实施方式进一步详细说明:
[0067]
一、本实施例公开了一种以p16/ki-67、top2a/mcm2为靶标的宫颈癌检测试剂盒。
[0068]
具体成分如下表1所示:
[0069]
表1宫颈癌检测试剂盒成分
[0070][0071][0072]
注:40测试/盒是指每盒可进行40次反应。
[0073]
二、本实施例还公开了上述以p16/ki-67、top2a/mcm2为靶标的宫颈癌检测试剂盒的判读方法。
[0074]
具体包括以下步骤:
[0075]
s1、细胞制片;
[0076]
每份子宫颈细胞采样后均制备两张相同的子宫颈细胞制片,分别为细胞制片1和细胞制片2。
[0077]
s2、修复;
[0078]
(1)将细胞制片放入装有tris-edta抗原修复液(ph8.0)的染色缸中,将染色缸放置加有1/3水位的高压锅中,盖上盖子和加压阀加热,加压阀放气计时,修复90s,自然冷却至室温20~25℃(可根据实际情况采用其他修复方法)。
[0079]
(2)细胞制片流水冲洗3min,pbst漂洗1min
×
2次(手工操作)或者pbst冲洗3次(设备自动操作)(注:如进行手工操作,将装载有细胞制片的载片架,放入盛有pbst的染色缸中,染色缸放置翘板摇床上,翘板速度80转/分,翘板幅度上下20mm,注意载玻片放置方向,使之水波可直接拍击载玻片正面;每批样本清洗前需更换新鲜pbst,每缸漂洗样本不可超过24片),适度甩干,不可干片。
[0080]
s3、灭活;
[0081]
沿细胞边缘,用免疫组化笔划圈,滴加内源性酶阻断剂50μl/片(手工操作)或者50~100μl/片(设备自动操作),室温20~25℃湿盒孵育10min,pbst漂洗1min
×
3次(手工操作)或者pbst冲洗3次(设备自动操作),适度甩干,不可干片。
[0082]
s4、配制试剂;
[0083]
(1)将抗体稀释液和p16一抗浓缩液混合,加入到ki-67一抗浓缩液中,混匀后,配制成p16/ki-67一抗工作混合液,黏贴新标签,注明开封配制时间,2个月内使用有效,2~8
℃避光保存,备用。
[0084]
(2)将抗体稀释液和top2a一抗浓缩液,加入到mcm2一抗浓缩液中,配制成top2a/mcm2一抗工作液,黏贴新标签,注明开封配制时间,2个月内使用有效,2~8℃避光保存,备用。
[0085]
(3)将2ml羊抗鼠二抗工作液,加入到2ml羊抗兔二抗工作液中,配置成羊抗鼠/兔二抗工作混合液,黏贴新标签(注:注明开封配置时间,2个月内使用有效),2~8℃避光保存,备用。
[0086]
(4)根据样本量,取适量dab染色底物和dab染色剂缓冲液混匀,制备dab工作混合液,即配即用,4h内使用完,室温20~25℃避光保存。
[0087]
(5)根据样本量,即配即用,30min内使用完,室温(20~25℃)避光保存(注:red染色底物长期低温保存时,会析出少量结晶物,其不可吹打混匀,需在染色工作混合液配制前,将染色底物和缓冲液室温避光复温静置5min,小心吸取上清,切不可吸取结晶物)。
[0088]
s5、免疫细胞化学染色;
[0089]
(1)对细胞制片1进行p16/ki-67免疫组织化学染色:
[0090]
首先,将p16/ki-67一抗工作混合液添加到切片1上,使p16与宫颈上皮细胞的p16抗原结合,ki-67与宫颈上皮细胞的ki-67抗原结合。
[0091]
然后,在切片1上添加羊抗鼠二抗工作液和羊抗兔二抗工作液,使羊抗鼠二抗与p16一抗结合,羊抗兔二抗与ki-67一抗结合。
[0092]
然后,添加dab工作混合液50μl/片(手工操作)或者50~100μl/片(设备自动操作),室温20~25℃湿盒孵育5~10min,流水冲洗3min(手工操作)或者蒸馏水冲洗4次(设备自动操作),适度甩干,不可干片。
[0093]
然后,添加red工作混合液50μl/片(手工操作)或者50~100μl/片(设备自动操作),室温20~25℃湿盒孵育5~10min,流水冲洗3min(手工操作)或者蒸馏水冲洗4次(设备自动操作),适度甩干,不可干片。
[0094]
染色后,异常细胞的细胞核显红色或者红棕色,细胞浆显棕色。
[0095]
经苏木素复染,正常细胞的细胞核显蓝色,细胞浆无染色。
[0096]
滴加1滴中性快速封片剂,加盖盖玻片,光学显微镜下评估结果。
[0097]
(2)对细胞制片2进行top2a/mcm2免疫组织化学染色。
[0098]
首先,将top2a/mcm2一抗工作混合液添加到切片2上,使top2a与宫颈上皮细胞的top2a抗原结合,mcm2与宫颈上皮细胞的mcm2抗原结合。
[0099]
然后,添加羊抗鼠二抗工作液和羊抗兔二抗工作液,使羊抗鼠二抗与top2a一抗结合,羊抗兔二抗与mcm2一抗结合。
[0100]
然后,添加dab工作混合液,50μl/片(手工操作)或者50~100μl/片(设备自动操作),室温20~25℃湿盒孵育5~10min,流水冲洗3min(手工操作)或者蒸馏水冲洗4次(设备自动操作),适度甩干,不可干片。
[0101]
然后,添加red工作混合液,50μl/片(手工操作)或者50~100μl/片(设备自动操作),室温20~25℃湿盒孵育5~10min,流水冲洗3min(手工操作)或者蒸馏水冲洗4次(设备自动操作),适度甩干,不可干片。
[0102]
染色后,异常细胞的细胞核染成棕色或者红色,其细胞浆不染色或者染成棕色,同
时细胞形态异常(宫颈鳞状上皮内瘤变)。
[0103]
经苏木素复染,正常细胞的细胞核染成蓝色,其细胞浆无染色。滴加1滴中性快速封片剂,加盖盖玻片,光学显微镜下评估结果。
[0104]
s6、结果及判读标准;
[0105]
(1)按照下表2的判读原理进行判读:
[0106]
表2判读原理
[0107][0108]
结合图1-图12进行染色说明:
[0109]
①
图1为p16/ki-67双染( ),独立于细胞形态,单层细胞的染色结果。独立于细胞形态即不对形态大小进行判读。
[0110]
细胞染色:同一单层细胞,由于p16和ki-67表达量不同,ki-67在细胞核呈现不同的复合染色效果,具体可能呈现出粉红色、红色或红棕色,p16在细胞浆的染色效果呈棕色。
[0111]
②
图2为p16/ki-67双染( ),独立于细胞形态,细胞簇(典型染色,较易判读染色细胞核和染色细胞浆在同一细胞内)的染色结果。
[0112]
③
图3为p16/ki-67双染( ),独立于细胞形态,细胞簇(非典型染色),非典型染色即较难判读染色细胞核和染色细胞浆在同一细胞内的染色结果。
[0113]
④
图4为p16/ki-67双染(-):p16( )/ki-67(-),独立于细胞形态的染色结果。
[0114]
细胞染色:同一单层细胞或者细胞簇,细胞核和/或细胞浆呈棕色(p16)。
[0115]
⑤
图5为p16/ki-67双染(-):p16(-)/ki-67( ),独立于细胞形态的染色结果。
[0116]
细胞染色:同一单层细胞或者细胞簇,细胞浆无染色,细胞核呈粉红色(ki-67)。
[0117]
⑥
图6为p16/ki-67双染(-):p16(-)/ki-67(-),独立于细胞形态的染色结果。
[0118]
细胞染色:同一单层细胞或者细胞簇,细胞核蓝色,细胞浆无染色。
[0119]
⑦
图7为top2a( )和/或mcm2( ),单染阳性细胞核与标尺细胞核面积肉眼对比判读法的染色结果。
[0120]
mcm2( )细胞:细胞核红色深染,形态各异,大小不一,直径不一。(红色箭头)
[0121]
异型中层鳞状上皮细胞:细胞核蓝色淡染,形态膨大,大小不一,直径较大。(黄色箭头)
[0122]
正常中层鳞状上皮细胞:细胞核蓝色淡染,形态圆整,大小一致,直径适中。(黑色箭头)
[0123]
正常表层鳞状上皮细胞:细胞核蓝色深染,形态固缩,大小不一,直径较小。(绿色箭头)
[0124]
⑧
图8为top2a( )和/或mcm2( ),单染阳性细胞核与标尺细胞核面积软件测量对比判读法的染色结果。
[0125]
mcm2( )细胞核面积145.73μm2,标尺细胞核面积56.07μm2,该样本标尺细胞核面积的2.5倍为140.175μm2。
[0126]
⑨
图9为top2a( )和/或mcm2( ),单染阳性细胞核面积软件测量阈值判读法的染色结果。
[0127]
mcm2单染阳性细胞核(粉红色)面积132.29μm2,>125μm2(标尺细胞核面积的2.5倍阈值)。
[0128]
top2a单染阳性细胞核(棕色)面积238.8μm2,>150μm2(标尺细胞核面积的3.0倍阈值)。
[0129]
⑩
图10为p16/ki-67双染(-);top2a( )和/或mcm2( ),细胞形态异常的染色结果。
[0130]
细胞染色:同一单层细胞或者细胞簇,细胞浆无染色,细胞核呈棕色(top2a)或粉红色(mcm2)。
[0131]
细胞形态1:采用软件测量阈值判读法,mcm2单染阳性细胞核(粉红色)面积测量为207.17μm2,>150μm2(标尺细胞核面积的3.0倍阈值)。
[0132]
细胞形态2:采用肉眼测量对比判读法,top2a( ),mcm2( )细胞核(红色箭头)面积≥2.5倍标尺细胞核(黑色箭头)面积。正常表层鳞状上皮细胞核(绿色箭头)。
[0133]
图11为p16/ki-67双染(-);top2a( )和/或mcm2( ),细胞形态正常的染色结果。
[0134]
细胞染色:同一单层细胞或者细胞簇,细胞浆无染色,细胞核呈粉红色(mcm2)。
[0135]
细胞形态1:采用软件测量阈值判读法,top2a单染阳性细胞核(棕色)面积测量为93.31μm2,《125μm2(标尺细胞核面积的2.5倍阈值)。
[0136]
细胞形态2:采用肉眼测量对比判读法,mcm2单染阳性细胞核(红色箭头)面积《2.5倍标尺细胞核(黑色箭头)面积。正常表层鳞状上皮细胞核(绿色箭头)。
[0137]
图12为p16/ki-67双染(-);top2a(-),mcm2(-),独立于细胞形态的染色结果。
[0138]
细胞染色:同一单层细胞或者细胞簇,细胞浆无染色,细胞核呈蓝色。
[0139]
(2)根据上述表2,结合染色结果、细胞数量和细胞核面积,给出判读结果和判读建议,具体如下表3所示:
[0140]
表3染色结果,给出判读结果和判读建议
[0141][0142][0143]“低度风险”,存在低级别病变可能性较大,高级别病变可能性较小,临床建议进行二次分流,进行另一种(如宫颈活检)子宫颈细胞学筛查方法检测,进一步筛选出“高度风险”样本。
[0144]
(1)如另一种筛查结果风险分级评估为“高度风险”,如此两项筛查风险叠加将达
到“高度风险”风险评估标准,临床建议“阴道镜检”风险分层管理;
[0145]
(2)如另一种筛查结果风险分级评估为“低度风险”,如此两项筛查风险叠加亦将达到“高度风险”风险评估标准,临床建议“阴道镜检”风险分层管理;
[0146]
(3)如另一种筛查结果风险分级评估为“无风险”,如此两项筛查风险叠加亦为“低度风险”风险评估标准,临床建议一定间隔时间的“随访复查”风险分层管理。
[0147]“无风险”,存在病变可能性较小,临床建议按正常人群给予常规筛查。
[0148]
本实施例所提供的判定方法,能有效增加临床应用判读的灵敏度及准确率,增加阳性预测值。该类筛查方法判定结果有多项,可以精准地进行iii级风险评估(“高度风险”、“低度风险”和“无风险”),亦可以精准地给予相对应的三层风险管理(阴道镜检、二次分流、常规筛查),可以同时应用于准确初筛和精准分流。故ⅲ级风险评估三层风险管理子宫颈细胞学筛查方法,能够同时满足子宫颈癌及癌前病变的精准筛查两项基本要求(不过度筛查,不漏筛漏检)成为可能,是精准筛查方法。
[0149]
三、验证实验
[0150]
为了说明本发明的试剂盒判读方法,在与已有的lbc等检测实验进行比较的情况下,对于子宫颈癌的筛查敏感度,以及特异性上,都有显著提高。降低了筛查的漏检率,并防止了过度筛查的可能,进一步提高了子宫颈癌筛查的有效性。故采用了临床参与样本的科研实验,进行进一步验证。
[0151]
1.样本采集、保存和运输:所有宫颈癌及癌前病变筛查妇女均由医师放置窥器保留子宫颈,采集子宫颈脱落细胞样本,保存于细胞保存液中。室温20~25℃保存不超过3d,然后在2-8℃保存不超过12d,水冰运输不超过3d。
[0152]
2.lbc检测及结果判定:入组宫颈癌及癌前病变筛查妇女由参与医疗机构行lbc检测和初步判定,复核判定由三位资深细胞病理学专家完成。
[0153]
按照子宫颈细胞学bethesda分类系统(tbs)的标准,分为未见上皮内病变或恶性病变(nilm)、未明确诊断意义的不典型鳞状上皮细胞(ascus)、不除外高度病变的不典型鳞状上皮细胞(asc-h)、低级别鳞状上皮内病变(lsil)、高级别鳞状上皮内病变(hsil)。
[0154]
3.p16/ki67 mcm2/top2a icc检测及结果判定
[0155]
3.1验证实验入组宫颈癌及癌前病变筛查妇女lbc残留样本(不可少于原细胞保存液30%),每例样本,分别制作两张子宫颈脱落细胞薄层细胞制片,分别进行p16/ki-67mcm2/top2a icc检测。技术人员进行盲法初步判定,三位资深细胞病理学专家盲法复核判定。
[0156]
3.2 p16 icc判读标准
[0157]
如细胞核和/或细胞浆呈棕色,即结果判读为p16单染( )细胞。如细胞核呈蓝色,细胞浆无染色,即结果判读为p16单染(-)细胞。
[0158]
4.结果
[0159]
宫颈癌及癌前病变筛查妇女,符合入组要求的共304例。其中子宫颈活检组织病理诊断为金标准(ascus
)有风险病例199例,专家一致性判定确认(nilm/hr-hpv阴性)无风险病例105例。
[0160]
全部入组304例统计分析(表4),评估三种新型生物标记物p16、ki-67和mcm2、top2a作为子宫颈癌及癌前病变检测靶标的情况。统计结果显示:mcm2敏感性最高(100%,
100%),特异性最低(17.96%,17.96%);p16特异性最高(82.52%,86.18%),敏感性最低(89.66%,86.21%)。
[0161]
表4 304例入组样本
[0162][0163]
304例入组样本包括ascus 和nilm/hr-hpv阴性,初步判定后和专家复核判定后,p16、ki-67、mcm2及top2a作为子宫颈癌及癌前病变检测靶标的情况。
[0164]
将lbc初步判定为ascus
(子宫颈活检组织病理为金标准)的入组筛查妇女纳入统计范畴,分别进行初步判定后和专家复核判定后,“p16/ki-67 mcm2/top2a icc”通过敏感性、特异性、约登指数、阳性预测值、阴性预测值5种临床指标(表5),进行“阳性”和“阴性”判定标准的临床评价。统计结果显示:“p16/ki-67、mcm2/top2a”阳性和阴性判定准确性均最佳(阳性优,阴性优)。
[0165]
表5 304例入组样本
[0166][0167]
304例入组样本(包括ascus 和nilm/hr-hpv阴性),专家复核判定后,“p16/ki-67 mcm2/top2a icc”子宫颈细胞学筛查方法阳性和阴性判定准确性的临床评价。
[0168]
表6 304例入组样本
[0169][0170]
304例入组样本(包括ascus 和nilm/hr-hpv阴性),初步判定和专家复核判定后,lbc和“p16/ki-67、mcm2/top2a icc”5级风险评估标准的临床评价。
[0171]
与传统的lbc细胞临床结果对比后,验证结果表明(表6):
[0172]
(1)“p16/ki-67 mcm2/top2a icc”具有高敏感性、高阴性预测值、高特异性和高阳性预测值(尤其前者),可以同时进行初筛和分流筛查,并较之lbc筛查可能更为准确,有望作为联合筛查基础方法之一。
[0173]
(2)“p16/ki-67 mcm2/top2a icc”具有高特异性和高阳性预测值,但其敏感性和阴性预测值有待提高,故仅可以用于二次分流筛查。
[0174]
(3)“p16/ki-67 mcm2/top2a icc”的“tns”判定标准能精准的进行宫颈癌及癌前病变筛查。
[0175]
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术人员无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。