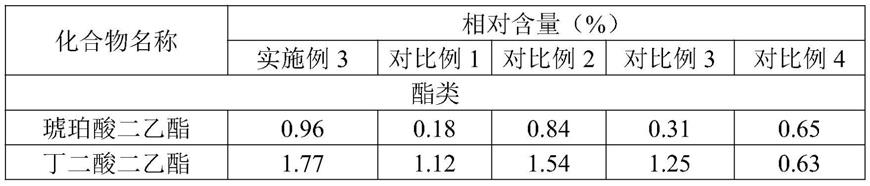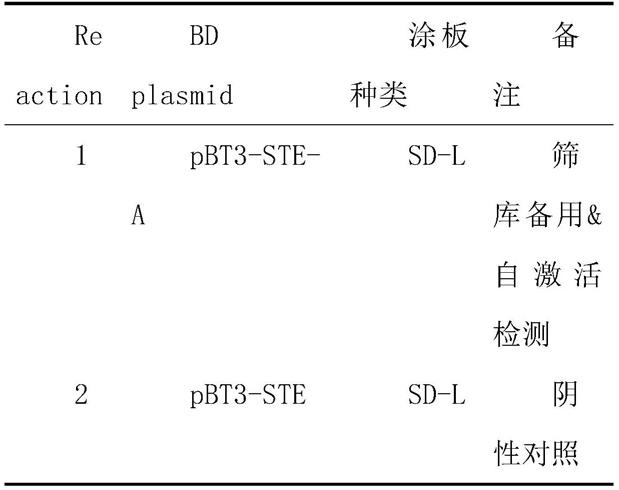
1.本发明涉及膜蛋白实验技术领域,具体为一种基于膜体系-酵母双杂交发现膜蛋白的方法。
背景技术:
2.生物膜所含的蛋白叫膜蛋白,是生物膜功能的主要承担者。根据蛋白分离的难易及在膜中分布的位置,膜蛋白基本可分为三大类:外在膜蛋白或称外周膜蛋白、内在膜蛋白或称整合膜蛋白和脂锚定蛋白,膜蛋白包括糖蛋白,载体蛋白和酶等。通常在膜蛋白外会连接着一些糖类,这些糖相当于会通过糖本身分子结构变化将信号传到细胞内,研究膜蛋白结构的技术包括x射线衍射、核磁共振波谱、电子显微镜、原子力显微镜、红外光谱和圆二色谱等。其中x射线衍射和核磁共振波谱技术是对膜蛋白三维结构进行研究的主要方法。尤其利用固体核磁共振技术可在接近膜蛋白的天然环境的磷脂双分子层中研究膜蛋白的三维结构信息和动力学特征,随着对于膜蛋白研究的深入,实验中研究发现与pbt3-ste-a作用的蛋白不易发现,影响实验的进行现在提出一种基于膜体系-酵母双杂交发现膜蛋白的方法。
技术实现要素:
3.(一)解决的技术问题
4.针对现有技术的不足,本发明提供了一种基于膜体系-酵母双杂交发现膜蛋白的方法,具备以构建好的pbt3-ste-a基因为诱饵,筛选酵母双杂交草膜文库,经过对阳性克隆的多重报告基因检测、dna测序和blast比对分析,确定与pbt3-ste-a相互作用的蛋白的优点,解决了与pbt3-ste-a作用的蛋白不易发现,影响实验进行的问题。
5.(二)技术方案
6.为实现上述目的,本发明提供如下技术方案:一种基于膜体系-酵母双杂交发现膜蛋白的方法,包括以下材料,
7.诱饵克隆:pbt3-ste-a;
8.诱饵载体:pbt3-ste;
9.文库酵母质粒:草膜文库;
10.clontech酵母双杂交系统;
11.培养基;
12.贮备液。
13.优选的,所述培养基包含大肠杆菌培养基、酵母完全培养基与酵母缺陷型筛选培养基,所述大肠杆菌培养基为0.5%yeast extract,1% polypeptone,1%nacl,所述酵母完全培养基为1%yeast extract,2%tryptone, 2%glucose,0.02%adenine。
14.优选的,一种基于膜体系-酵母双杂交发现膜蛋白的方法,操作流程如下:
15.s100、将诱饵质粒转化受体菌nmy51中及其自激活检测;
16.s200、文库筛选;
17.s300、筛库结果;
18.s400、酵母阳性克隆鉴定及测序比对与测序比对结果;
19.s500、酵母阳性克隆回转验证。
20.优选的,所述将诱饵质粒转化受体菌nmy51中及其自激活检测包含有酵母转化、酵母转化方法、自激活检测,且选用30mm 3at进行后续筛库浓度。
21.优选的,所述文库筛选用含有pbt3-ste-a诱饵质粒的nmy51酵母菌株作为受体菌制备感受态,将草膜文库质粒转入其中,涂布于含30mm 3at的 sd-tlh、sd-tlha筛选平板,所述文库筛选采用文库dna转化方法。
22.优选的,所述酵母阳性克隆回转验证是将筛选得到的34个酵母阳性克隆,均能在sd-tl、sd-tlh 30mm 3at、sd-tlha 30mm 3at缺陷性平板上生长。
23.与现有技术相比,本发明提供了一种基于膜体系-酵母双杂交发现膜蛋白的方法,具备以下有益效果:
24.1、该基于膜体系-酵母双杂交发现膜蛋白的方法,通过将诱饵质粒转化受体菌nmy51中及其自激活检测、文库筛选、筛库结果、酵母阳性克隆鉴定及测序比对与测序比对结果、酵母阳性克隆鉴定及测序比对与测序比对结果、酵母阳性克隆回转验证等步骤,通过酵母阳性克隆回转验证将筛选得到的34 个酵母阳性克隆,均能在sd-tl、sd-tlh 30mm 3at、sd-tlha 30mm 3at缺陷性平板上生长,从而得到最终的膜蛋白,解决了与pbt3-ste-a作用的蛋白不易发现的问题。
附图说明
25.图1为本发明自激活检测结果示意图;
26.图2筛库平板上长出的初始阳性转化子示意图;
27.图3为本发明筛库结果示意图;
28.图4为本发明酵母阳性克隆回转验证示意图。
具体实施方式
29.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
30.请参阅图1-4,一种基于膜体系-酵母双杂交发现膜蛋白的方法,包括以下材料,
31.诱饵克隆:pbt3-ste-a;
32.诱饵载体:pbt3-ste;
33.文库酵母质粒:草膜文库;
34.clontech酵母双杂交系统;
35.培养基;
36.贮备液。
37.具体的,所述培养基包含大肠杆菌培养基、酵母完全培养基与酵母缺陷型筛选培
养基,所述大肠杆菌培养基为0.5%yeast extract,1% polypeptone,1%nacl,所述酵母完全培养基为1%yeast extract,2%tryptone, 2%glucose,0.02%adenine。
38.具体的,一种基于膜体系-酵母双杂交发现膜蛋白的方法,操作流程如下:
39.s100、将诱饵质粒转化受体菌nmy51中及其自激活检测;
40.s200、文库筛选;
41.s300、筛库结果;
42.s400、酵母阳性克隆鉴定及测序比对与测序比对结果;
43.s500、酵母阳性克隆回转验证。
44.具体的,所述将诱饵质粒转化受体菌nmy51中及其自激活检测包含有酵母转化、酵母转化方法、自激活检测,且选用30mm 3at进行后续筛库浓度;
45.(1)酵母转化
46.将以下质粒分别转入nmy51中:
[0047][0048]
(2)酵母转化方法
[0049]
从ypda平板挑取nmy51单菌落接种于ypda液体培养基4ml,30℃,225 rpm,振荡培养18-20h(过夜),至od600》1.5;
[0050]
转接ypda液体培养基,培养体积为50ml,使初始od600=0.2,30℃,225 rpm,振荡培养4-5h,至od600=0.6;
[0051]
离心收菌,室温,4000rpm,5min;
[0052]
用20ml无菌水重悬菌体,混匀,离心收菌,室温,4000rpm,5min,弃上清;
[0053]
用5ml 0.1m liac重悬菌体,混匀,离心收菌,室温,4000rpm,5 min,弃上清;
[0054]
用500ul 0.1m liac重悬菌体,混匀,分装至1.5ml离心管,每个50 ul(每个转化),备用;
[0055]
每个1.5ml离心管中依次加入如下试剂,用枪头吹打混匀,或剧烈振荡 1min左右,至完全混匀;
[0056][0057]
30℃水浴孵育,30min;
[0058]
42℃水浴热激,25min;
[0059]
30℃水浴复苏,30min;
[0060]
离心收菌,室温,4000rpm,5min,弃上清;
[0061]
每个转化用200ul无菌水悬浮菌体,尽量温和地混匀,涂布相应的缺陷型筛选平板。
[0062]
30℃恒温培养4天;
[0063]
(3)自激活检测pbt3-ste-a、pbt3-ste转化到nmy51,涂到sd/-leu 平板,30℃恒温培养3-5d。随机挑取6个点用引物进行pcr验证,随机取了三个正确的克隆点板至对应的不同浓度(0、10、20、30、40、50、60、70、 80、90、100mm)3at的缺陷型平板上,30℃恒温培养3天。3at是酵母his3 蛋白合成的竞争性抑制剂,用于抑制his3基因的泄漏表达,详细结果见图1,从图中看出20mm浓度下菌落有轻微生长,而30mm浓度下没有菌生长。
[0064]
具体的,所述文库筛选用含有pbt3-ste-a诱饵质粒的nmy51酵母菌株作为受体菌制备感受态,将草膜文库质粒转入其中,涂布于含30mm 3at的 sd-tlh、sd-tlha筛选平板,所述文库筛选采用文库dna转化方法,文库dna 转化方法见如下:
[0065]
从sd-l平板挑取单菌种接于液体sd-l培养基50ml,30℃,225rpm,振荡培养24h。
[0066]
转接于ypda液体500ml,使初始od600=0.2,30℃,225rpm,振荡培养 4-5h,至od600=0.6。
[0067]
离心收菌,室温,4000rpm,5min。
[0068]
用30ml无菌水重悬菌体,混匀,离心收菌,室温,4000rpm,5min,弃上清。
[0069]
用20ml 0.1m liac重悬菌体,混匀,离心收菌,室温,4000rpm,5 min,弃上清。
[0070]
用10ml 0.1m liac重悬菌体,混匀,离心收菌,室温,4000rpm,5 min,弃上清。
[0071]
向离心管中依次加入如下试剂,用枪头吹打混匀,或剧烈振荡1min左右,至完全混匀。
[0072][0073]
[0074]
30℃水浴孵育,30min。
[0075]
42℃水浴热激,25min。
[0076]
30℃水浴复苏1h。
[0077]
离心收菌,室温,4000rpm,5min,弃上清,用6ml无菌水重悬菌体,尽量温和地混匀,从中取20ul培养物稀释后涂sd-tl平板,用于检测文库转化效率,其余涂30mm 3at的sd-tlh、sd-tlha平板各10块。
[0078]
30℃恒温培养3-7天,观察菌落生长。
[0079]
具体的,将上述30mm 3at的sd-tlh、sd-tlha筛库平板上长出的初始阳性性转化子划线于30mm 3at的sd-tlh、sd-tlha选择平板,30℃恒温培养3-4 天,详细结果见图3,所述酵母阳性克隆回转验证是将筛选得到的34个酵母阳性克隆,均能在sd-tl、sd-tlh 30mm 3at、sd-tlha 30mm 3at缺陷性平板上生长,从而得到最终的膜蛋白。
[0080]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。