1.本发明属于蛋白重组的技术领域,具体涉及一种用于重组蛋白的高糖基化修饰序列及其重组猪促卵泡激素和应用。
背景技术:
2.垂体促卵泡雌激素,又称为促卵泡素(fsh),是一种由垂体前叶分泌的可刺激卵泡发育和成熟,促进精子生成的激素,属于糖蛋白激素家族。猪促卵泡素(pfsh)蛋白大小为35.5kda,两个亚基α和β的一级结构分别包含121和131个氨基酸,其中n端的前24和20个氨基酸序列为信号肽。在同一物种中,糖蛋白激素家族都是由共同的α亚基和激素特异性的β亚基组成的异源二聚体,而β亚基则具有激素特异性,决定激素的特定的生理功能,其生物学活性主要由β亚基决定。fshβ基因在哺乳动物中具有较高的保守性,fshβ同源性在80%以上,猪源fshβ与人源fshβ同源性92%。fsh的β亚基具有两个n-型糖基化位点,其糖基化修饰会影响二硫键的形成,进而影响结构的稳定性,同时糖基化修饰的程度影响fsh的生物学活性。现有研究显示去掉多糖链会降低其刺激细胞产生camp的能力,适度的糖基化修饰能够提高fsh的稳定性及生物学活性。
3.在生殖生理上fsh作用于雌性动物可刺激卵巢生长,增加卵巢重量,刺激卵泡生长发育,fsh对卵巢的作用是通过卵泡的颗粒细胞进行调节的,颗粒细胞表面存在fsh受体。fsh主要应用于辅助生殖领域和畜牧行业,功能主要是在胚胎移植过程中诱导超数排卵,治疗卵巢囊肿及性欲缺乏等。在动物生产上fsh常用于诱导雌性动物的发情和超数排卵,治疗卵巢机能疾病,提高家畜的繁殖力;自然条件下,fsh主要存在于动物垂体和绝经期女性尿液。目前畜牧生产用的fsh主要是从各种家畜的脑垂体组织提取纯化出来的,较常用的是猪垂体fsh。由于fsh与lh的结构相似,且存在结构不均一性,垂体中成分复杂,动物脑垂体组织容易携带病毒,纯化较为困难,限制了fsh的广泛应用。天然激素制剂在具有由于受提取原料的限制生产效率低、杂质不易纯化、易污染外源病毒、提取的半衰期短且活性不稳定等原因。重组fsh能够避免天然激素制剂在应用过程中的不足,体外重组表达fsh为新型激素制剂的生产提供了新的途径。通过基因工程手段及相关分子生物学技术来表达和生产重组fsh蛋白是一种经济、高效的方法。
4.现有的长效性修饰主要为糖基化修饰策略及长效元件的融合表达,不同的糖基化修饰策略及长效元件的选择,表达量、生物活性、半衰期均有不同程度的差别,合适的糖基化修饰策略及长效元件尤为重要。前期的研究主要集中fsh中的原核表达和酵母表达、cho细胞表达,fsh及相关融合蛋白的原核表达生产工艺存在包涵体变复性、难以形成二硫键、需脱内毒素等复杂流程。现有研究中在cho细胞表达中表达量低,生产成本高,难以应用于临床。在毕赤酵母中的表达具有低成本、二硫键形成及糖基化修饰等优势,但表达的fsh蛋白及其类似物活性均不高,表达量低于10mg/l。
技术实现要素:
5.针对上述问题,本发明的目的在于提供一种用于重组蛋白的高糖基化修饰序列及其重组猪促卵泡激素和应用,利用高糖基化序列与fsh的串联表达,通过适度的糖基化修饰及融合蛋白策略显著提高fsh的生物活性及延长半衰期。
6.本发明的技术内容如下:
7.本发明提供了一种用于重组蛋白的高糖基化修饰序列,其氨基酸序列如序列表seq id no.1所示,经毕赤酵母密码子优化后的核酸序列如序列表seq id no.2所示;
8.所述高糖基化修饰序列用于蛋白重组融合,高糖基化修饰序列的数量为1个或以上;
9.所述高糖基化修饰序列位于重组蛋白的一端或两端。
10.本发明还提供了上述高糖基化修饰序列应用于制备重组蛋白,所述重组蛋白应用于哺乳动物的超数排卵。
11.本发明还提供了一种重组猪促卵泡激素,其为猪促卵泡激素的重组蛋白,为高糖基化修饰序列、猪促卵泡激素基因进行重组融合得到,所述高糖基化修饰序列位于猪促卵泡激素基因的一端或两端;
12.所述猪促卵泡激素的氨基酸序列如序列表seq id no.3所示,经毕赤酵母密码子优化后的核酸序列如序列表seq id no.4所示;
13.所述重组猪促卵泡激素包括如序列表seq id no.5~seq id no.7所示的氨基酸序列;
14.所述氨基酸序列毕赤酵母密码子优化后的核酸序列分别如序列表seq id no.8~seq id no.10所示。
15.本发明还提供了一种重组猪促卵泡激素应用于猪的超数排卵。
16.本发明还提供了一种重组猪促卵泡激素的制备方法,包括如下步骤:
17.将上述高糖基化修饰序列与猪促卵泡激素基因连接,在得到的目的基因c端引入标签和终止密码子,上下游引入酶切位点,合成于载体质粒上,双酶切后克隆至表达载体上,采用毕赤酵母甲醇诱导表达系统进行表达、诱导、纯化后得到重组猪促卵泡激素;
18.所述表达载体包括毕赤酵母表达载体ppiczαa、ppiczαb、ppiczαc、pgapzαa、pgapzαb、pgapzαc、ppic9k、ppic9、phil-s1、pyam75p、ppic3、ppic3k、ppic3.5k、phil-d2、paco815、ppicza、ppiczb、ppiczc、pgapza、pgapzb、pgapzc、ppink-hc的一种;
19.所述毕赤酵母甲醇诱导表达系统采用的毕赤酵母宿主菌包括x33、gs115、km71、smd1168、smd1165、smd1163、y-11430、m-g100-3、配套毕赤酵母pichiapink的一种。
20.本发明的有益效果如下:
21.本发明的高糖基化修饰序列,能够实现重组蛋白的高表达量以及高生物活性,利用高糖基化修饰序列与fsh串联表达,并优化串联方式,通过适度的糖基化修饰及融合蛋白策略显著提高fsh的生物活性及延长半衰期,这对重组蛋白的临床应用具有广阔的前景;
22.本发明的重组猪促卵泡激素的制备,利用高效的毕赤酵母甲醇诱导分泌表达系统,利用其具有生长快、易操作、二硫键形成及糖基化修饰等优势,将本发明经优化的高糖基化修饰序列与猪fsh融合得到重组蛋白,对该蛋白进行毕赤酵母密码子优化修饰后进行高效表达,适度的糖基化修饰以及二硫键的形成提高了重组fsh蛋白的生物学活性和蛋白
稳定性,能够高效刺激动物卵巢的增重,具有优异的生物学活性,以及采用his-tag融合于蛋白的c端便于纯化;
23.本发明的高糖基化修饰序列用于重组猪促卵泡激素,解决了现有表达系统及相关生物技术制备的重组fsh蛋白含量低、稳定性差、活性低、生产工艺复杂、纯化制备成本高等问题。
附图说明
24.图1为目的基因的构建示意图;
25.图2为重组菌液的pcr鉴定结果图;
26.图3为重组酵母菌液的pcr鉴定结果图;
27.图4为不同菌株诱导3d上清western blot的测试结果图。
具体实施方式
28.以下通过具体的实施案例以及附图说明对本发明作进一步详细的描述,应理解这些实施例仅用于说明本发明而不用于限制本发明的保护范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本技术所附权利要求所限定。
29.若无特殊说明,本发明的所有原料和试剂均为常规市场的原料、试剂。
30.实施例
31.一种重组猪促卵泡激素及其制备:
32.1)合成基因片段
33.选取了本发明经糖基化优化的n-高糖基化修饰序列(其氨基酸序列如序列表seq id no.1所示),以及现有文献报道的高糖基化修饰序列n0(作为对照组,其氨基酸序列如序列表seq id no.11所示),以及根据猪促卵泡素(pfsh)(genbank上登陆号为np_999040.1)、毕赤酵母表达载体ppiczαa图谱,在目的基因的c端引入组氨酸标签(其氨基酸序列如序列表seq id no.19所示,经密码子优化后的核酸序列如序列表seq id no.20所示)及终止密码子taa,上游引入ecori酶切位点,下游引入xbai酶切位点,目的基因的构建示意图如图1所示;
34.所述表达载体还可以为ppiczαb、ppiczαc、pgapzαa、pgapzαb、pgapzαc、ppic9k、ppic9、phil-s1、pyam75p、ppic3、ppic3k、ppic3.5k、phil-d2、paco815、ppicza、ppiczb、ppiczc、pgapza、pgapzb、pgapzc、ppink-hc的一种。
35.2)构建重组质粒
36.以上序列经毕赤酵母密码子优化后送广州金唯智生物科技有限公司进行全基因合成至puc57质粒上,获得的质粒n1-pfsh-h-puc57、n1-pfsh-n1-h-puc57、2n1-pfsh-n1-h-puc57及对照组n0-pfsh-h-puc57、n0-pfsh-n0-h-puc57、2n0-pfsh-n0-h-puc57经ecori、xbai双酶切后获得的目的片段克隆至经相同双酶切的ppiczαa上,并进行t4连接酶连接及转化感受态dh5α。
37.3)重组阳性转化子的pcr鉴定
38.鉴定引物α-factor和3’aox1由广州金唯智生物科技有限公司合成,所述引物α-factor和3’aox1的序列分别如序列表seq id no.21和序列表seq id no.22所示;
39.pcr鉴定体系及程序如下表所示,pcr产物进行1%的琼脂糖凝胶电泳。
40.表1 pcr鉴定体系
[0041][0042]
表2 pcr鉴定程序
[0043][0044]
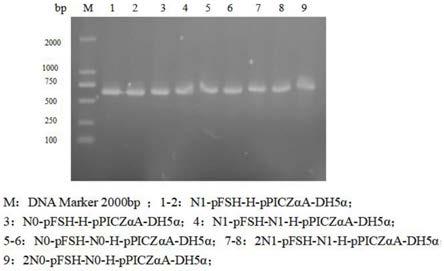
挑取pcr鉴定为阳性菌进行质粒抽提并测序鉴定,如图2所示,pcr鉴定结果显示:各组质粒n1-pfsh-h-ppiczαa-dh5α、n1-pfsh-n1-h-ppiczαa-dh5α、2n1-pfsh-n1-h-ppiczαa-dh5α及对照组n0-pfsh-h-ppiczαa-dh5α、n0-pfsh-n0-h-ppiczαa-dh5α、2n0-pfsh-n0-h-ppiczαa-dh5α均为阳性;
[0045]
质粒测序结果显示各组测序正确,质粒构建成功。
[0046]
4)重组质粒的酶切线性化及纯化回收
[0047]
参考takara公司酶切试验手册,用sac i单酶切各重组质粒,并进行琼脂糖凝胶电泳检测线性化完全。对线性化产物进行纯化回收,纯化回收方法参考试剂盒使用说明书。
[0048]
5)毕赤酵母x33感受态细胞的制备
[0049]
5.1)接种毕赤酵母宿主菌单菌落x33于ypd平板,30℃培养2天;
[0050]
所述毕赤酵母宿主菌还可以为gs115、km71、smd1168、smd1165、smd1163、y-11430、m-g100-3、配套毕赤酵母pichiapink的一种;
[0051]
5.2)挑取平板上的单菌落接种于10mlypd液体培养基中,30℃摇床震荡过夜;
[0052]
5.3)过夜培养后按1%左右的接种量接种到100ml ypd培养基中震荡培养至od值1.2~1.5;
[0053]
5.4)4℃,5000rpm离心5min收集沉淀菌体,用100ml预冷无菌水重悬菌体;
[0054]
5.5)4℃,5000rpm离心10min收集沉淀菌体,用100ml预冷无菌水重悬菌体;
[0055]
5.6)再次4℃,5000rpm离心10min收集沉淀菌体,用100ml预冷无菌水重悬菌体;
[0056]
5.7)20ml,1mol/l山梨醇洗涤1次;
[0057]
5.8)将菌体溶于1ml,1m预冷山梨醇中,不加甘油,-80℃放置几小时,待转化。
[0058]
6)线性化表达质粒电转化毕赤酵母x33感受态细胞
[0059]
6.1)准备好80l的酵母感受态与线性化的质粒1~5μg(冰上预冷15min)混合,迅速放入0.2cm的电击杯中(电击杯冰上预冷灭菌),电击;电转参数为voltage:1500v;capacitance:25μf;resistance:200ω;cuvette(mm):2mm;
[0060]
6.2)电击结束,迅速加入1ml山梨醇(1m),冰上静置15min,随后30℃温箱中静置培养1h。再加入1mlypd液体培养基,30℃,200r/min振荡培养1小时,常温4000r/min离心收集菌体,涂至含有100μg/μl的ypds平板中30℃静置培养3d。
[0061]
7)重组酵母菌的鉴定及高拷贝的筛选
[0062]
用灭菌枪头细挑ypds平板上生长的具有zeocin抗性的单菌落,接种于2ml的ypd液体培养基中(含150μg/ml zeocin),30℃,200r/min振荡培养过夜。
[0063]
采用菌液pcr分析p.pastoris转化子,pcr鉴定体系同表1,pcr鉴定程序表3,pcr产物进行1%琼脂糖凝胶电泳,以鉴定引物能扩增出目的条带的克隆定为阳性转化子。
[0064]
表3重组酵母菌液pcr鉴定程序
[0065][0066]
高拷贝的筛选需结合pcr鉴定中的条带亮度及高抗性ypd平板(200μg/mlzeocin)试验结果。
[0067]
如图3所示的重组菌液pcr鉴定结果:n1-pfsh-h-ppiczαa-x33、n1-pfsh-n1-h-ppiczαa-x33、2n1-pfsh-n1-h-ppiczαa-x33、n0-pfsh-h-ppiczαa-x33、n0-pfsh-n0-h-ppiczαa-x33、2n0-pfsh-n0-h-ppiczαa-x33有阳性重组酵母菌株,电转化x33成功;
[0068]
选取相应菌株进行ypd(含100μg/mlzeocin)平板划线,用于酵母诱导表达。
[0069]
8)高拷贝重组酵母菌的诱导表达
[0070]
8.1)用灭菌枪头细挑ypd平板上生长的具有zeocin抗性的单菌落,挑于20ml的bmgy液体培养基中进行激活培养,30℃,200r/min振荡过夜,至od600=2~6,此时细胞处于对数生长期;
[0071]
8.2)3000r/min室温离心5min收集沉淀,重悬于1ml的bmmy中,用四层干净的纱布外加两层报纸包扎,在250ml的三角锥瓶中振荡培养;
[0072]
8.3)每间隔24h加入100%甲醇至终浓度为1%,进行诱导培养;
[0073]
8.4)培养至96h收集样品,离心,取上清立即作sds-page或置于-80℃保存。
[0074]
9)重组酵母菌诱导表达上清的western blot分析
[0075]
重组酵母菌诱导表达的上清进行western blot分析,设置相应的空质粒ppiczαa-x33对照组,蛋白上样缓冲液为5
×
loading buffer,上样量为12l。
[0076]
结果如图4所示,表明该酵母表达系统能够有效表达n1-pfsh-h、n1-pfsh-n1-h、2n1-pfsh-n1-h,n0-pfsh-h、n0-pfsh-n1-h、2n0-pfsh-n1-h,结合各组分子量大小可知,毕赤酵母表达系统对各组表达的蛋白进行了糖基化修饰;
[0077]
所述重组猪促卵泡激素n1-pfsh-h、n1-pfsh-n1-h、2n1-pfsh-n1-h的氨基酸序列如序列表seq id no.5~seq id no.7所示,经毕赤酵母密码子优化后的核酸序列分别如序列表seq id no.8~seq id no.10所示;
[0078]
所述对照组重组猪促卵泡激素n0-pfsh-h、n0-pfsh-n1-h、2n0-pfsh-n1-h的氨基酸序列如序列表seq id no.13~seq id no.15所示,经毕赤酵母密码子优化后的核酸序列分别如序列表seq id no.16~seq id no.18所示。
[0079]
10)表达产物的纯化回收
[0080]
将相同体积的诱导表达上清的纯化结合his tag进行镍柱亲和层析方法进行蛋白的吸附、洗脱纯化,利用透析法进行咪唑的去除后定容到同一体积测定浓度,比较相同体积下各组样品纯化后浓度,见下表4。
[0081]
表4各组样品纯化后的浓度
[0082][0083]
可见本发明所得的重组促卵泡激素具有较好的表达量。
[0084]
11)生物活性的测定
[0085]
将上述纯化的样品使用去糖基化酶endo h处理后同纯化样品进行活性的测定。测
定方法参照《中华人民共和国药典》2020年版四部通则1216卵泡刺激素生物测定法,本法比较标准品、重组猪促卵泡素样品对幼大鼠卵巢增重的作用,以测定供试品中卵泡刺激素的效价。
[0086]
取健康合格,出生19~23日,或体重36~60g,同一来源的雌性幼大鼠,一次试验所用大鼠的出生日期相差不得超过3日,或体重相差不得超过15g;按体重随机等分成4组,每组8只,每日于大致相同的时间分别给每鼠皮下注入一种浓度的标准品溶液或供试品n1-pfsh-h、n1-pfsh-n1-h、2n1-pfsh-n1-h、n0-pfsh-h、n0-pfsh-n0-h、2n0-pfsh-n0-h及各组供试品去糖基化酶处理后的溶液0.5ml,每日一次,连续注入3次,于最后一次注入24小时后,将动物处死,称重,解剖,摘出卵巢,剥离附着的组织,去除输卵管,用滤纸吸去周围的液体,直接称重(天平精密度0.1mg)并换算成每10g体重的卵巢重,参照生物检定统计法(通则1431)中的量反应平行线测定法计算效价及实验误差。标准品及供试品浓度按高、中、低剂量组(ds3、ds2、ds1)配成3种浓度的标准品溶液,相邻两浓度之比值(r)应相等,且不得大于1:0.5。
[0087]
表5各组纯化后样品的生物活性
[0088][0089]
测定后的各组样品的生物学活性如表5所示,结果表明未经去糖基化酶处理的各组的pfsh活性显著高于去糖基化酶处理组,本发明中n1-pfsh-h、n1-pfsh-n1-h、2n1-pfsh-n1-h组的活性优于对照组n0-pfsh-h、n0-pfsh-n0-h、2n0-pfsh-n0-h。
[0090]
同时n1-pfsh-n1-h组活性优于n1-pfsh-h组优于2n1-pfsh-n1-h组,表明适度的糖基化修饰能显著提高pfsh的生物学活性。
[0091]
12)半衰期的测定
[0092]
将上述纯化的样品使用去糖基化酶endo h处理后同纯化样品进行半衰期的测定。取体重接近的健康成年km小鼠(5只/组),雌雄各半,按10g/kg只剂量颈部皮下注射各组样品,注射体积为200l,注射等体积的pbs为对照。将注射后1h、2h、4h、6h、8h、10h、12h、24h进行眼眶静脉采血,离心分离后获得血清,elisa方法检测相应浓度。利用das药动学软件进行曲线拟合并计算相关参数,结果如下表所示:
[0093]
表6各组样品的半衰期
[0094][0095]
由表6可见,本发明中n1-pfsh-h、n1-pfsh-n1-h、2n1-pfsh-n1-h组的半衰期优于对照组n0-pfsh-h、n0-pfsh-n0-h、2n0-pfsh-n0-h。
[0096]
本发明中的重组fsh蛋白的半衰期显著延长,糖基化修饰的半衰期提高2倍以上,n1-pfsh-n1-h的半衰期优于其他组。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。