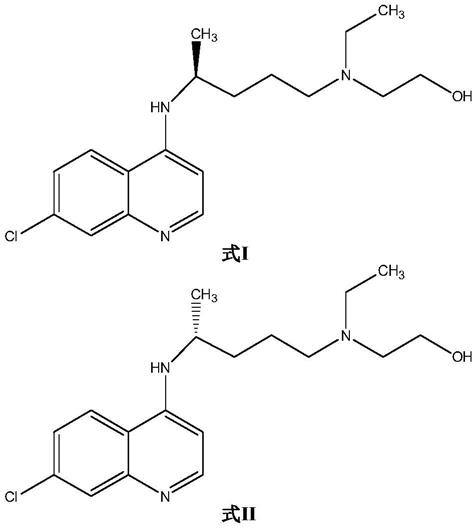
一种dna纯化试剂、其制备方法及dna纯化方法
技术领域
1.本发明涉及dna纯化领域,具体涉及一种dna纯化试剂、其制备方法及dna纯化方法。
背景技术:
2.sanger法测序是根据核苷酸在某一固定的点开始,随机在某一个特定的碱基处终止,并且在每个碱基后面进行荧光标记,产生以a、t、c、g结束的四组不同长度的一系列核苷酸,然后在尿素变性的page胶上电泳进行检测,从而获得可见dna碱基序列的一种方法,该方法广泛应用对细菌的质粒和扩增后产物的测序。
3.整个sanger法测序流程中,需要相对dna进行纯化沉淀,常用的纯化沉淀方法为酒精醋酸钠法。磁珠法通过dna在几千分子量的聚乙二醇及高盐环境下,采用固相载体进行吸附,最后经乙醇洗涤脱附回收的过程。现有的磁珠体系包含:磁珠、聚乙二醇以及盐离子,该体系能将dna沉淀并吸附,该磁珠试剂体系能吸附分子量区域窄小的dna片段,但不能吸附pcr扩增产生的所有片段。
技术实现要素:
4.为解决上述技术问题,本发明提供一种dna纯化试剂、其制备方法及dna纯化方法。
5.本发明采用如下技术方案:
6.一种dna纯化试剂,其不同之处在于,其制备原料包括a组分与b组分;所述a组分包括羧基磁珠;所述b组分包括:体积百分比33%~38%的乙醇、体积百分比为3%~5%的四乙二醇及2.0mol/l~3.0mol/l的nacl;所述a组分与所述b组分的比例为:(1.5~2.5)g:1l。
7.与现有技术相比,本发明采用乙醇与四乙二醇共同吸收体系中的水分子,再配合nacl将dna片段析出,能够特异性结合sanger测序反应中的所有片段,但不结合dntps、ddntps,酶等原料。
8.进一步,所述b组分中还包括6.0mmol/l~6.5mmol/l的edta。
9.采取上述进一步技术方案的有益效果在于:edta的加入通过络合反应去除纯化体系中的盐离子,提高其纯度。
10.上述dna纯化试剂的制备方法,其不同之处在于,包括:
11.步骤s1:取羧基磁珠溶液,去除上清,得到羧基磁珠;
12.步骤s2:将乙醇、四乙二醇及nacl混合后,得到预混合液;
13.步骤s3:将所述羧基磁珠与所述预混合液进行所述dna纯化试剂。
14.进一步,所述步骤s2中,将乙醇、四乙二醇、nacl及edta混合后,得到预混合液。
15.一种dna纯化方法,其不同之处在于,包括:
16.步骤a1:往待纯化的样本中加入上述dna纯化试剂和乙醇,混匀,得待处理混合液;
17.步骤a2:将所述待处理混合液放置在磁力架上进行吸附,弃上清;
18.步骤a3:然后加入乙醇混合均匀后得到待纯化液,将所述待纯化液再次放置在磁
力架上进行吸附,弃上清;
19.步骤a4:重复所述步骤a3 1~3次,回收磁珠。
20.与现有技术相比,本发明的有益效果在于:通过在待纯化dna样品中加入本发明dna纯化试剂与乙醇,能吸附单向pcr扩增产生的所有片段,再通过80%乙醇洗涤,去除反应剩余的所有原料,从而达到纯化的目的。纯化后的产物可直接上3730xl等遗传分析仪进行电泳测序;信号强且均匀,背景噪音极低。
21.进一步,待纯化样本与所述dna纯化试剂的的体积比例为1:(0.8~1.2)。
22.进一步,所述待处理混合液与所述待纯化液中的乙醇体积百分比为40%~50%。
附图说明
23.图1为实施例5的磁珠回收测试图;
24.图2为对比例1a公司的磁珠回收测试图;
25.图3为对比例1b公司的磁珠回收测试图。
具体实施方式
26.下面结合具体实施例对本发明作进一步的详细说明,以使本领域的技术人员更加清楚地理解本发明。
27.以下各实施例,仅用于说明本发明,但不止用来限制本发明的范围。基于本发明中的具体实施例,本领域普通技术人员在没有做出创造性劳动的情况下,所获得的其他所有实施例,都属于本发明的保护范围。
28.在本发明实施例中,若无特殊说明,所有原料组分均为本领域技术人员熟知的市售产品;在本发明实施例中,若未具体指明,所用的技术手段均为本领域技术人员所熟知的常规手段。
29.在本发明实施例中,所使用的原料均为常规市售产品。
30.本发明实施例中,涉及的实验原料说明如下:
31.羧基磁珠溶液:本发明羧基磁珠溶液购于(百迈格生物),规格为300nm,50mg/ml,货号为191116;
32.乙醇溶液:采用80%v/v乙醇溶液,购于(国药集团)500ml无水乙醇;
33.四乙二醇:sigma lot:04818ahv。
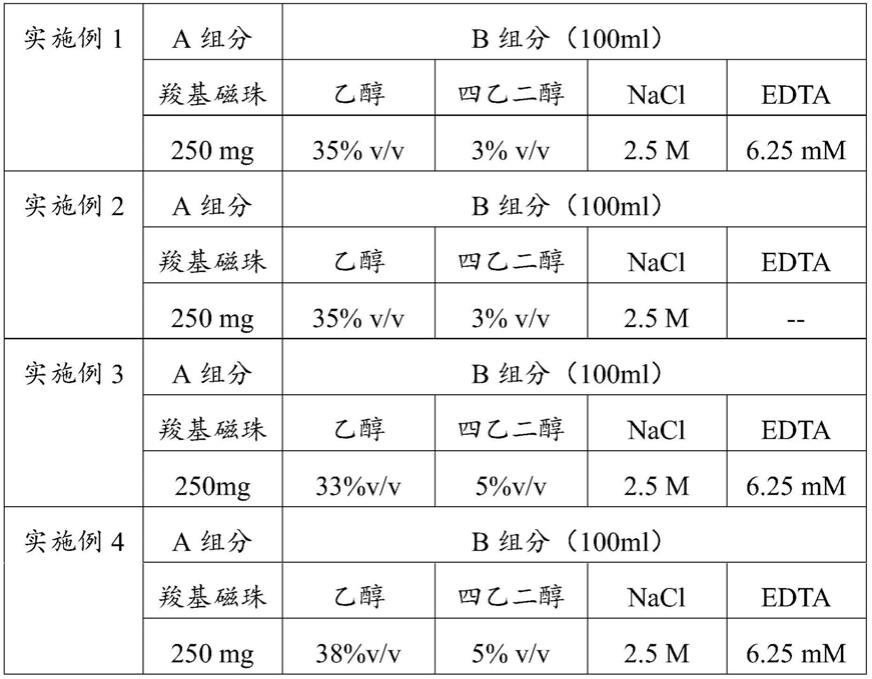
34.实施例1~实施例4
35.实施例1~实施例4提供dna纯化试剂,具体成分及含量如表1所示:
36.表1实施例1~实施例4dna纯化试剂成分及含量
[0037][0038]
实施例1~实施例4的制备方法均采用下列步骤进行制备:
[0039]
步骤s1:取羧基磁珠溶液,吸附去上清,得到a组分;
[0040]
步骤s2:将乙醇溶液,四乙二醇,nacl,edta混合后得到b组分;
[0041]
步骤s3:将a组分与b组分混合后得到dna纯化试剂。
[0042]
实施例5~实施例8
[0043]
实施例5~实施例8提供一种dna的纯化方法,具体操作方法如下:
[0044]
步骤a1:在96孔板中加入5ul测序产物,加入羧基磁珠混合液5ul和乙醇震荡混匀,得待处理混合液;
[0045]
步骤a2:将96孔板放置在磁力架上,吸附30s,去上清;
[0046]
步骤a3:加入乙醇,震荡混匀1min,得到待处理液,将96孔板放置在磁力架上,吸附30s,去上清。
[0047]
重复步骤a3一次后,室温静置5min。
[0048]
步骤a1及步骤a3加入乙醇后,其终浓度一样,具体如表2所示。
[0049]
表2实施例5~实施例8步骤a1与步骤a3的乙醇终浓度
[0050]
实施例dna纯化剂乙醇(%v/v)实施例5实施例145实施例6实施例250实施例7实施例340实施例8实施例440
[0051]
对比例1
[0052]
将市售的mclab lot:l580a59m(简称a公司)磁珠体系与thrmo lot:1706084磁珠体系(简称b公司)参照说明书对dna样品进行纯化。
[0053]
将经实施例5、对比例1及对比例2纯化后的dna磁珠的孔中添加40μl的灭菌水,混匀后离心检测其磁珠回收效率,检测方法为:各取20ul的纯化后样品,进行毛细管电泳检测,回收效率越高,荧光信号值越强。
[0054]
可以看出,每张图的荧光信号值都是由强至弱递次分布,但是实施例相较于a公司以及b公司从整体上而言,x轴对应的每个y轴信号均较强,证明采用实施例5磁珠体系的每个区域片段的dna分子回收量是大于市售磁珠体系的。
[0055]
实施例5、对比例1及对比例2的结果如图1~3所示,各实施例以及对比例的磁珠信号强度如表3所示。
[0056]
表3磁珠检测最强的信号
[0057]
检测对象磁珠信号实施例518000对比例1a公司6000对比例1b公司12000
[0058]
从表3可以看出,采用本发明dna纯化试剂及提取方法,其磁珠信号远远大于市售公司。
[0059]
在此有必要指出的是,以上实施例仅限于对本发明的技术方案做进一步的阐述和说明,并不是对本发明的技术方案的进一步的限制,本发明的方法仅为较佳的实施方案,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。