1.本发明提供一种新型的氟尿嘧啶衍生物以及衍生物在制备抗肿瘤药物中的用途。
技术背景
2.恶性肿瘤是威胁人类健康的常见疾病之一,肿瘤死亡率居于各种疾病前列。目前临床使用的抗肿瘤药物,其毒副作用是困扰肿瘤化疗的突出问题。提高肿瘤治疗效果同时降低药物毒性,是当前治疗肿瘤药物的重要研究课题。
3.氟尿嘧啶,化学名为5-氟-2,4(1h,3h)-嘧啶二酮,又名5-氟尿嘧啶,简称5-fu,化学式为c4h3fn2o2,是一种嘧啶类似物,属于一种抗代谢抗肿瘤药物。尿嘧啶掺入肿瘤组织的速度较其他嘧啶快,根据电子等排的原理,用氟原子取代氢原子得到氟尿嘧啶。由于氟的原子半径和氢的原子半径相近,氟尿嘧啶的体积与尿嘧啶几乎相等,另外c-f键特别稳定,在代谢过程中不易分解,分子水平代替正常代谢物,因而是胸腺嘧啶合成酶(ts)的抑制剂。氟尿嘧啶在体内首先转变成氟尿嘧啶脱氧核苷酸(fudrp),与胸腺嘧啶合成酶结合,再与辅酶5,10-次甲基四氢叶酸作用,导致不能有效地合成胸腺嘧啶脱氧核苷酸(tdrp),使胸腺嘧啶合成酶失活。从而抑制dna的合成,导致肿瘤细胞死亡。
4.氟尿嘧啶口服吸收不完全,生物利用度较低,故需注射给药,静注后可迅速分布到全身各组织,包括脑脊液和肿瘤组织中。氟尿嘧啶抗瘤谱比较广,对绒毛膜上皮癌及恶性葡萄胎有显著疗效,对结肠癌、直肠癌、胃癌和乳腺癌、头颈部癌等有效,是治疗实体肿瘤的首选药物。氟尿嘧啶的疗效虽然较好,但是由于对肿瘤组织和正常组织缺乏选择性,所以毒性较大,可引起严重的消化道反应和骨髓抑制等不良反应。
5.肿瘤微环境是肿瘤细胞赖以生存和发展的复杂环境,由细胞成分和非细胞成分组成。其中细胞成分包括肿瘤细胞本身、炎症细胞、免疫细胞、间充质干细胞、内皮细胞、以及与肿瘤相关的成纤维细胞等;非细胞成分主要包括细胞因子,趋化因子等。细胞成分和非细胞成分共同为肿瘤生长起到支撑的作用。肿瘤细胞由于生长失控、基因表达异常等使肿瘤组织表现出与正常组织显著不同的生理特征,如ph低、还原物质浓度和酶浓度升高、活性氧(reactive oxygen species,ros)和三磷酸腺苷(adenosine-5'-triphosphate,atp)含量增加等。基于肿瘤微环境研究靶向抗肿瘤药物能够提高药物的选择性,降低毒副作用。
6.基于肿瘤特有的微环境对上市药物进行潜伏化设计,生成没有活性的前药。该前药在正常人体血液循环中保持相对稳定,将前药运送到肿瘤部位后,在肿瘤组织特定的微环境下才能快速代谢生成具有抗肿瘤活性的原药,实现药物的靶向性,降低因选择性差引起的毒副作用。
7.低氧是恶性肿瘤发生、发展过程中普遍存在的现象,其产生主要与肿瘤细胞无限制生长、氧耗量增加、血氧供应不足及肿瘤组织血管发育不良等有关。低氧环境下的肿瘤细胞易发生转移,并且能增加对放疗、化疗的抗拒性,从而降低了治疗效果。肿瘤细胞缺氧通常可以导致细胞内的硝基还原酶(nitroreductase)的增加。基于肿瘤组织中高水平的硝基还原酶,在抗肿瘤药物中引入硝基,使其在肿瘤部位被还原成氨基,重排后释放出原药,发
挥抗肿瘤活性。
技术实现要素:
8.本发明所要解决的技术问题是提供一种新型的氟尿嘧啶衍生物以及上述衍生物在制备抗肿瘤药物中的应用。
9.本发明目的的技术方案是:一种新型的氟尿嘧啶衍生物,具有下述通式(i):
[0010][0011]
其中a环和b环同时存在或不同时存在,相同或不同,分别为苯环、取代苯环、杂环、取代杂环,稠杂环、取代稠杂环;所述的取代苯环,其苯环上独立地由一个或两个或三个或四个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;所述的杂环是咪唑、吡啶、呋喃、噻吩、噻唑、哌嗪或哌啶;所述的取代杂环,其杂环上独立地由一个或两个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;所述的稠杂环是喹啉或吲哚;所述的取代稠杂环,其稠杂环上独立地由一个或两个或三个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;
[0012]
r1和r2同时存在或不同时存在,相同或不同,并各自为硝基、亚硝基、氨基、羟胺基;
[0013]
x为ch2、chd、cd2、x1是a环;
[0014]
y为ch2、chd、cd2、y1是b环。
[0015]
作为优选是通式(ii)所示的氟尿嘧啶衍生物:
[0016]
[0017]
其中a环和b环同时存在或不同时存在,相同或不同,分别为苯环、取代苯环、杂环、取代杂环;所述的取代苯环,其苯环上独立地由一个或两个或三个或四个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;所述的杂环是咪唑、吡啶、呋喃、噻吩、噻唑、哌嗪或哌啶;所述的取代杂环,其杂环上独立地由一个或两个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;
[0018]
r1和r2同时存在或不同时存在,相同或不同,并各自为硝基;
[0019]
x为ch2、cd2、x1是a环;
[0020]
y为ch2、cd2、y1是b环。
[0021]
作为优选是通式(iii)所示的氟尿嘧啶衍生物:
[0022][0023]
其中a环和b环同时存在或不同时存在,相同或不同,分别为苯环、杂环;所述的杂环是吡啶、呋喃、噻吩、噻唑;
[0024]
r1和r2同时存在或不同时存在,相同或不同,并各自为硝基;
[0025]
x为ch2、cd2、x1是a环;
[0026]
y为ch2、cd2、y1是b环。
[0027]
优选化合物选自但不限于下列化合物:
[0028]
5-氟-1-(4-硝基苄基)嘧啶-2,4(1h,3h)-二酮;
[0029]
5-氟-3-(4-硝基苄基)嘧啶-2,4(1h,3h)-二酮;
[0030]
5-氟-1,3-二(4-硝基苄基)嘧啶-2,4(1h,3h)-二酮;
[0031]
5-氟-1-((5-硝基呋喃-2-基)甲基)嘧啶-2,4(1h,3h)-二酮;
[0032]
5-氟-3-((5-硝基呋喃-2-基)甲基)嘧啶-2,4(1h,3h)-二酮;
[0033]
5-氟-1,3-二((5-硝基呋喃-2-基)甲基)嘧啶-2,4(1h,3h)-二酮;
[0034]
5-氟-1-((5-硝基噻吩-2-基)甲基)嘧啶-2,4(1h,3h)-二酮;
[0035]
5-氟-3-((5-硝基噻吩-2-基)甲基)嘧啶-2,4(1h,3h)-二酮;
[0036]
5-氟-1,3-bis((5-硝基噻吩-2-基)甲基)嘧啶-2,4(1h,3h)-二酮
[0037]
4-硝基苄基5-氟-2,4-二氧-3,4-二氢嘧啶-1(2h)-羧酸酯;
[0038]
4-硝基苄基-5-氟-2,6-二氧-3,6-二氢嘧啶-1(2h)-羧酸酯;
[0039]
二(4-硝基苄基)-5-氟-2,4-二氢嘧啶-1,3(2h,4h)-二羧酸酯;
[0040]
(5-硝基呋喃-2-基)甲基-5-氟-2,4-二氧-3,4-二氢嘧啶-1(2h)-羧酸酯;
[0041]
(5-硝基呋喃-2-基)甲基-5-氟-2,6-二氧-3,6-二氢嘧啶-1(2h)-羧酸酯;
[0042]
二((5-硝基呋喃-2-基)甲基)-5-氟-2,4-二氧嘧啶-1,3(2h,4h)-二羧酸酯;
[0043]
(5-硝基噻吩-2-基)甲基-5-氟-2,4-二氧-3,4-二氢嘧啶-1(2h)-羧酸酯;
[0044]
(5-硝基噻吩-2-基)甲基-5-氟-2,6-二氧-3,6-二氢嘧啶-1(2h)-羧酸酯;
[0045]
二((5-硝基呋喃-2-基)甲基)-5-氟-2,4-二氧嘧啶-1,3(2h,4h)-二羧酸酯。
[0046]
上述化合物或其盐在制备治疗肿瘤药物中的应用。
[0047]
所述的盐为盐酸盐、磷酸盐、硫酸盐、碳酸盐、硝酸盐、柠檬酸盐、酒石酸盐、马来酸盐、琥珀酸盐、磺酸盐、对甲苯磺酸盐、甲磺酸盐、苯甲酸盐、富马酸盐或钾盐、钠盐、锂盐、钙盐。
[0048]
所述肿瘤为血液肿瘤或恶性实体肿瘤。具体的,肿瘤包括绒毛膜上皮癌、恶性葡萄胎、直肠癌、肺癌、头颈部癌、前列腺癌、乳腺癌、结肠癌、胃癌、胰腺癌、肝癌、食道癌、脑肿瘤、卵巢癌、子宫癌、肾癌、头颈癌、皮肤癌、膀胱癌、外阴癌、睾丸瘤、直肠癌、生殖细胞瘤、恶性淋巴瘤、白血病和多发性骨能瘤,并且甚至更优选的肿瘤可包括绒毛膜上皮癌、恶性葡萄胎、结肠癌、直肠癌、胃癌、乳腺癌和头颈部癌。
[0049]
一种药物组合物,其中含有作为活性成分的通式(i)所示的氟尿嘧啶衍生物或其药学上可接受的盐,以及一种或多种药用载体或赋形剂。
[0050]
所述组合物的剂型为注射剂或者是口服剂型,其中注射剂为溶液型注射剂、混悬型注射剂、乳剂型注射剂、或注射用无菌粉末,口服剂型为片剂、散剂、颗粒剂、胶囊剂、微丸制剂、溶液剂、混悬剂、乳剂、糖浆剂或酏剂。
[0051]
除非另有说明,否则说明书和权利要求书中的术语具有下述含义。
[0052]“药物组合物”表示含有一种或多种本发明通式(i)所述化合物或其可药用的盐、酯,或其前药与其他化学组分的混合物,其他化学组分例如可药用的载体和赋形剂。药物组合物的目的是促进生物体对活性成分的吸收,利于活性成分在生物体内发挥生物活性。
[0053]
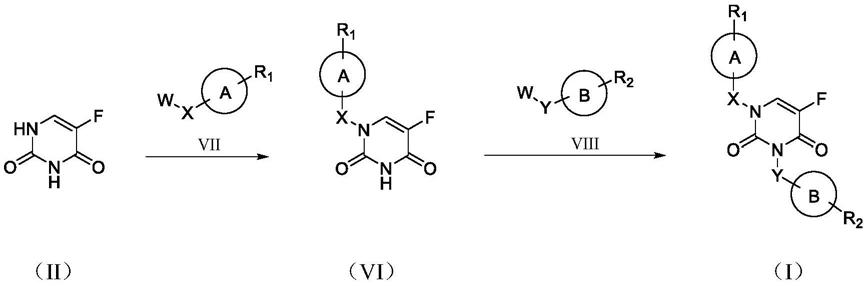
本发明化合物的合成方案如所述方案一和方案二所示:
[0054]
方案一:制备式(i)的化合物:
[0055]
化合物(vi)可以通过将通式(ii)表示的化合物和通式(vii)表示的化合物(分别简称化合物ii和化合物vii)在碱的存在下反应制备,得到的化合物vi进一步在碱存在下与通式(viii)表示的化合物反应,得到化合物(i)。
[0056]
[0057]
其中a环和b环同时存在或不同时存在,相同或不同,分别为苯环、取代苯环、杂环、取代杂环,稠杂环、取代稠杂环;所述的取代苯环,其苯环上独立地由一个或两个或三个或四个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;所述的杂环是咪唑、吡啶、呋喃、噻吩、噻唑、哌嗪或哌啶;所述的取代杂环,其杂环上独立地由一个或两个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;所述的稠杂环是喹啉或吲哚;所述的取代稠杂环,其稠杂环上独立地由一个或两个或三个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;
[0058]
r1和r2同时存在或不同时存在,相同或不同,并各自为硝基、亚硝基、氨基、羟胺基;
[0059]
x为ch2、chd、cd2,x1是a环;
[0060]
y为ch2、chd、cd2,y1是b环。
[0061]
w表示离去基团,可以提及例如cl、br、i、任选卤代的c1-c6烷基磺酰基氧基(例如,甲磺酰基氧基、乙磺酰基氧基、三氯甲磺酰基)、任选具有取代基的的c6-c10芳基磺酰基氧基(例如,苯基磺酰基氧基、对甲苯磺酰基氧基,间-硝基苯磺酰基氧基等)等;
[0062]
作为所述的碱包括无机碱和有机碱,所述的无机碱可以提及例如,碱金属碳酸盐类例如碳酸钠、碳酸钾、碳酸铯等;碱金属碳酸氢盐类,如碳酸氢钾、碳酸氢钠等;碱金属氢氧化物例如氢氧化锂、氢氧化钠、氢氧化钾等;所述的有机碱可以提及例如三乙胺、吡啶、1,8-二氮杂二环十一碳-7-烯、二异丙基乙胺、n,n-二甲基氨基吡啶、正丁基锂、叔丁基钾等。
[0063]
方案二:制备式(i)的化合物:
[0064]
化合物(vi)可以通过将通式(ii)表示的化合物和通式(vii)表示的化合物(分别简称化合物ii和化合物vii)在碱的存在下反应制备,得到的化合物vi进一步在碱存在下与通式(viii)表示的化合物反应,得到化合物(i)。
[0065][0066]
其中a环和b环同时存在或不同时存在,相同或不同,分别为苯环、取代苯环、杂环、取代杂环,稠杂环、取代稠杂环;所述的取代苯环,其苯环上独立地由一个或两个或三个或四个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;所述的杂环是咪唑、吡啶、呋喃、噻吩、噻唑、哌嗪或哌啶;所述的取代杂环,其杂环上独立地由一个或两个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;所述的稠杂环是喹啉或吲哚;所述的取代稠杂环,其稠杂环上独立地由一个或两个或三个氘、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、丙氧基、异丙氧基、卤素、氰基、羟基取代;
[0067]
r1和r2同时存在或不同时存在,相同或不同,并各自为硝基、亚硝基、氨基、羟胺基;
[0068]
x为ch2、cd2、x1是a环;
[0069]
y为ch2、cd2、y1是b环。
[0070]
w表示离去基团,可以提及例如cl、br、i、任选卤代的c1-c6烷基磺酰基氧基(例如,甲磺酰基氧基、乙磺酰基氧基、三氯甲磺酰基)、任选具有取代基的的c6-c10芳基磺酰基氧基(例如,苯基磺酰基氧基、对甲苯磺酰基氧基,间-硝基苯磺酰基氧基等)等;
[0071]
作为所述的碱包括无机碱和有机碱,所述的无机碱可以提及例如,碱金属碳酸盐类例如碳酸钠、碳酸钾、碳酸铯等;碱金属碳酸氢盐类例如碳酸氢钾、碳酸氢钠等;碱金属氢氧化物例如氢氧化锂、氢氧化钠、氢氧化钾等;所述的有机碱可以提及例如三乙胺、吡啶、1,8-二氮杂二环十一碳-7-烯、二异丙基乙胺、n,n-二甲基氨基吡啶、正丁基锂、叔丁基钾等。
具体实施方式
[0072]
下面结合实施例对本发明作进一步说明。需要说明的是,下述实施例仅是用于说明,而并非用于限制本发明。本领域技术人员根据本发明的教导所做出的各种变化均应在本技术权利要求所要求的保护范围之内。
[0073]
实施例1
[0074]
本实施例的氟尿嘧啶衍生物5-氟-1-(4-硝基苄基)嘧啶-2,4(1h,3h)-二酮(编号fu-1)经1步反应合成,反应式如下:
[0075][0076]
将1.0g(7.69mmol)氟尿嘧啶溶于25ml丙酮中,加入碳酸钾2.12g(15.38mmol),冷却至0℃,氮气保护。用注射器缓慢滴10ml丙酮溶解的对硝基溴苄1.66g(7.69mmol)。加完后缓慢升温至50℃,回流12小时。反应结束后,过滤除去碳酸钾,滤液减压浓缩后得粗产品,硅胶柱层析分离,正己烷:乙酸乙酯(1:2)洗脱得白色固体(fu-1)1.20g,产率58.86%。
[0077]
fu-1的核磁共振表征:
[0078]1h nmr(500mhz,dmso-d6)δ11.93(d,j=5.0hz,1h),8.22(d,j=8.8hz,2h),7.60(d,j=8.7hz,2h),4.98(s,2h);
[0079]
13
c nmr(125mhz,dmso)δ158.07,157.87,150.16,147.43,144.69,141.34,139.51,130.62,130.35,128.94,124.16,50.78。
[0080]
实施例2
[0081]
本实施例的氟尿嘧啶衍生物5-氟-1,3-二(4-硝基苄基)嘧啶-2,4(1h,3h)-二酮(编号fu-2)反应合成,反应式如下:
[0082][0083]
将1.0g(7.69mmol)氟尿嘧啶溶于25ml n,n-二甲基甲酰胺中,加入三乙胺2.12g(15.38mmol),冷却至0℃,氮气保护。用注射器缓慢滴10ml n,n-二甲基甲酰胺溶解的对硝基溴苄3.32g(15.38mmol)。加完后缓慢升温至80℃,回流12小时。反应结束后,过滤除去碳酸钾,滤液减压浓缩后得粗产品,硅胶柱层析分离,正己烷:乙酸乙酯(2:1)洗脱得白色固体(fu-2)2.60g,产率84.48%。
[0084]
fu-2的核磁共振表征:
[0085]1h nmr(500mhz,dmso-d6)δ8.44(d,j=6.4hz,1h),8.22(d,j=8.8hz,2h),8.18(d,j=8.8hz,2h),7.62(d,j=8.7hz,2h),7.55(d,j=8.8hz,2h),5.12(s,2h),5.06(s,2h);
[0086]
13
c nmr(125mhz,dmso-d6)δ157.48,157.28,150.27,147.48,147.23,144.63,140.89,139.07,130.62,130.05,129.78,128.98,124.16,124.02,120.37,52.05,44.52。
[0087]
实施例3
[0088]
肿瘤微环境(硝基还原酶)介导的氟尿嘧啶衍生物的降解研究:将氟尿嘧啶衍生物溶于10mmol/ltris缓冲液15ml中,加入适量的硝基还原酶和烟酰胺腺嘌呤二核苷酸或烟酰胺腺嘌呤二核苷酸磷酸,用10mmol/l的tris缓冲液稀释至20ml,用hplc测定加入硝基还原酶缓冲液后100s,200s,300s,400s,500s,600s
……
后氟尿嘧啶和氟尿嘧啶衍生物的浓度,以确定目标化合物在硝基还原酶存在条件下是否能够降解。结果表明化合物fu-1和fu-2在硝基还原酶条件下能够缓慢降解。
[0089]
实施例4
[0090]
细胞毒性实验:收集jeg-3细胞系对数期细胞,调整细胞悬液浓度,每孔加入100ul,铺板使待测细胞调密度1000-10000孔,(边缘孔用无菌pbs填充);5%co2,37℃孵育至细胞单层铺满孔底(96孔平底板),加入浓度梯度的药物,设5-7个浓度梯度,5个复孔,每孔100ul;5%co2,37℃孵育24h,倒置显微镜下观察;每孔加入20ulmtt溶液(5mg/ml,即0.5%mtt),继续培养4h。若药物与mtt能够反应,可先离心后弃去培养液,小心用pbs冲2-3遍后,再加入含mtt的培养液。终止培养,小心吸去孔内培养液;每孔加入150ul二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪od 490nm处测量各孔的吸光值,计算细胞存活率。实验组包括氟尿嘧啶组(组1)、fu-1组(组2)、fu-2组(组3)、fu-1 硝基还原酶组(组4)、fu-2 硝基还原酶组(组5)。结果见表1.
[0091]
表1
[0092][0093]
结果表明,氟尿嘧啶衍生物fu-1和fu-2的细胞毒性降低,在硝基还原酶存在的条件下才表现出明显的细胞毒性。因为肿瘤组织中硝基还原酶浓度较高,所以通式(i)所示的氟尿嘧啶衍生物将降低氟尿嘧啶的毒副作用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
