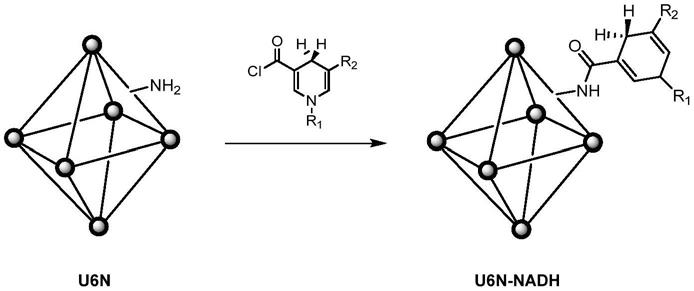
1.本发明涉及使用细胞来产生外泌体的方法。
背景技术:
2.外泌体是细胞分泌到细胞外的一种50~300nm的膜囊结构,通过内涵体的膜凹陷至由内吞作用形成的多泡体的内部而形成,因此在表面含有源自细胞膜的表面蛋白、在内部含有源自细胞质的核酸、蛋白质。近些年,报道了:在各种细胞种类中,蛋白质、核酸的构成得到巧妙控制的内涵体参与附近或远处的细胞之间的信息传递(非专利文献1)。
3.外泌体主要被用作诊断标记物、药物递送载体和生物药物。癌细胞、疾病细胞会分泌反映其病理状态的外泌体,因此可以通过剖析外泌体的特征来诊断疾病(非专利文献2)。负载有药物的外泌体也可以用于靶向接受该外泌体的细胞的药物递送。作为负载药物的方法,有如下方法:使药物结合或摄入到所分泌的外泌体的方法、使细胞质内含有药物的细胞分泌包含药物的外泌体的方法(非专利文献3)。
4.也报道了:外泌体本身可以作为生理活性物质发挥作用。示出了:从培养神经干细胞株中分离的外泌体在体外诱导成纤维细胞的迁移、人脐静脉内皮细胞的分支和神经突生长(专利文献1)。报道了骨髄树突状细胞的外泌体具有免疫调节功能,在小鼠模型中试验了针对感染症、过敏、自身免疫疾病等的治疗效果(非专利文献4和5)。
5.认为外泌体所具有的生理活性受到被外泌体来源细胞控制的核酸、蛋白质的构成的支配。特别是,外泌体所含有的mirna与生理活性的相关性受到注目,专利文献2中记载了:从心肌球细胞(cardiosphere)或心肌来源细胞(cdc)中分离的外泌体包含mir-146a、mir-210、mir-22和mir-24,它们对损伤或患病的心脏组织具有治疗效果。另外,专利文献3中记载了:包含mir-34b、mir-132、mir-137、mir-193a和mir-203中的至少1个以上的mirna的脂质体作为口腔鳞状细胞癌的抑制剂发挥作用。进而,非专利文献6中记载了:mir-26a和mir-26b抑制胃细胞癌的细胞迁移和湿润,非专利文献7中记载了:mir-23b、mir-27b和mir-24优先抑制前列腺癌细胞的细胞迁移和湿润。
6.为了将外泌体用作药物递送载体、生理活性物质,需要建立产生足量的品质均一的外泌体的方法。通常,外泌体可通过以超离心来回收培养细胞分泌到培养系统中的外泌体而获得。在提出了外泌体的利用方法的上述文献等现有技术中,使用了分别适合于回收试验所需外泌体的方法,但它们均未预想开发能以工业规模生产药物水平的外泌体的稳定且高效率的生产方法。
7.专利文献4公开了生产外泌体的方法。该方法的特征在于:通过使前列腺素e受体4(ep4)拮抗剂与干细胞接触,从而诱导外泌体分泌。作为为了以高效率生产具有良好的生理活性的外泌体而构成的细胞培养系统的例子,非专利文献8提出组合了间充质干细胞的3d培养系统和切向流过滤(tff)的系统。
8.如上所述,表征外泌体的核酸、蛋白质、各种信号分子的构成受到外泌体来源细胞的控制,因此可认为在细胞培养中的诱导期、对数生长期、静止期和死亡期的各阶段所产生
的外泌体的品质会发生变化。然而,在考虑以工业规模生产外泌体时,外泌体的特性随着培养时间而发生变化在品质管理上并不优选,要求在已建立的生产系统中能够长期产生品质均一的外泌体。在现有的使用培养细胞的外泌体产生技术中,这样的细胞培养系统的随时间经过所导致的外泌体的品质变化的问题尚未得到充分解决,成为阻碍品质稳定的外泌体的供给、建立工业规模外泌体产生系统的技术壁垒。
9.不限于外泌体,在使用了培养细胞的物质生产中,重要的是建立最适于以高效率稳定地生产期望的物质的细胞培养方法。细胞在生物体内通常以形成三维结构的群体的形式存在。另一方面,在人工环境中培养细胞时,一般使用细胞以单层状附着于培养容器底面的形式进行二维培养的经典的平面培养法、在使细胞分散在液体培养液中的状态下进行培养的悬浮培养法。对平面培养法中使用的细胞而言,粘附性相对较高的细胞是适合的,但即使在使用适合的细胞的情况下,由于培养环境的差异,有时细胞的性质也会发生较大变化。对于悬浮培养法而言,也存在适合的细胞和不适合的细胞。
10.随着对医疗用途中使用的生物体内蛋白质等的需求的增加,使用了细胞培养的生物体内蛋白质等的大量产生受到注目。对于大肠杆菌等悬浮细胞,研究了在大型培养槽中进行大量培养的技术。在使用了大型培养槽的悬浮细胞的大量培养中,需要大量的培养液和搅拌装置。另一方面,使用粘附细胞进行物质产生的研究也随着所使用的细胞的研究进展而受到人们关注。粘附细胞的情况下,经典的平面培养法中,细胞仅以二维方式展开,因此需要较大的培养面积。为了产生大量生物体内蛋白质等,也致力于研究用于以更立体的方式培养大量的细胞的细胞培养载体和生物反应器。
11.作为代表性的细胞培养用载体,作为可以粘附培育细胞的小颗粒的微载体成为广泛的研究对象(专利文献5)。已经研究/开发出了各种微载体,市售者也很多。也有很多被用于制造疫苗、蛋白质,作为也可耐受规模放大的系统而被广泛用作方法论。然而,在微载体培养中,由于需要对微载体充分进行搅拌/扩散而不聚集,因此细胞培养的量有限。而且,例如在进行物质产生时,为了分离载体本身,需要用分选较细的颗粒的过滤器等进行分离等,在方法论方面也需要繁杂的操作。进而,由于剪切力容易引起细胞的剥离,因此搅拌条件也极其有限,完全不适合如大肠杆菌所使用那样的较激烈的流路中的培养条件。
12.作为与微载体培养不同的方法,还发现了利用使用甲基纤维素、结冷胶的三维培养法持续性大量培养球状体形状的细胞的方法。在使用纤维素海绵的生物反应器等中,的确能够培养大量的细胞。然而,系统成为较大的闭锁系统、无法简单地接触到培养环境等,在操作上的限制也较多。
13.为了在简便且面向自动化的系统中、长期高效地在细胞中产生品质均一的外泌体,构建新型系统的必要性日益增高。
14.《聚酰亚胺多孔膜》
15.报道了一种细胞的培养方法,其包括:将细胞应用于聚酰亚胺多孔膜并进行培养(专利文献6)。
16.聚酰亚胺是指重复单元包含酰亚胺键的高分子的统称。芳香族聚酰亚胺是指芳香族化合物借助酰亚胺键直接连接而成的高分子。芳香族聚酰亚胺中,芳香族与芳香族之间借助酰亚胺键而具有共轭结构,因此具有刚直且坚固的分子结构,并且酰亚胺键具有较强的分子间力,因此具有非常高水平的热、机械、化学性质。
17.聚酰亚胺多孔膜在本技术之前已被用于过滤器、低介电常数膜、燃料电池用电解质膜等主要与电池相关的用途中。专利文献7~9尤其记载了具有多个大孔隙的聚酰亚胺多孔膜,其气体等物质的透过性优异、孔隙率高、两个表面的平滑性优异、强度相对较高,虽然孔隙率高,但对于膜厚度方向上的压缩应力的耐力仍然优异。它们均是经由酰胺酸而制作的聚酰亚胺多孔膜。
18.现有技术文献
19.专利文献
20.专利文献1:国际公开第2013/150303号
21.专利文献2:日本特开2019-38840号公报
22.专利文献3:日本特开2009-171876号公报
23.专利文献4:日本特开2018-064550号公报
24.专利文献5:国际公开第2003/054174号
25.专利文献6:国际公开第2015/012415号
26.专利文献7:国际公开第2010/038873号
27.专利文献8:日本特开2011-219585号公报
28.专利文献9:日本特开2011-219586号公报
29.专利文献10:国际公开第2018/021368号
30.非专利文献
31.非专利文献1:j.of extracellular vesicles,2015,4,article:27066
32.非专利文献2:ama oncology,2016,2,p882-889
33.非专利文献3:trends in biotechnology,2017,7,p665-676
34.非专利文献4:transplantation 2003,76:1503-10
35.非专利文献5:am.j.transplant.2006,6:1541-50
36.非专利文献6:int j oncol.2016may;48(5):1837-46
37.非专利文献7:oncotarget.2014;5:7748-7759
38.非专利文献8:molecular therapy vol.26no 12 2018 2838-2847
技术实现要素:
39.发明要解决的问题
40.本发明的目的在于提供:使用细胞长期以高收率持续产生品质均一的外泌体的方法、外泌体产生装置、试剂盒、和它们的应用、以及使用这些所生产的外泌体。
41.用于解决问题的方案
42.本发明人等发现:将聚合物多孔膜收纳于壳体中所构成的模块适于细胞的大量培养和细胞的去除(专利文献10)。发明人等为了解决提供能够简便且高效地使细胞产生外泌体的方法、细胞培养系统及通过细胞培养系统所产生的品质稳定的外泌体这样的上述课题而进行了深入研究,结果发现通过使用上述具备聚合物多孔膜和壳体的模块培养细胞,能够长期地产生具有稳定的产生量和品质的外泌体,以至完成了本发明。
43.令人惊讶的是,通过利用本发明的方法,从而能使培养细胞在几个月内持续性产生品质均一的外泌体。这在长期持续利用已建立的具有期望的性质的外泌体的生产系统的
方面、及能大量制备具有均一的品质的外泌体的方面、以工业规模产生用作生理活性物质的外泌体方面是极其有利的。
44.因此,本发明的一个特征在于,使用具备聚合物多孔膜和壳体的模块培养细胞。
45.对于细胞而言,充分利用聚合物多孔膜所具有的、细胞能通过的大口径连通孔来稳定且三维地生长,成为与平面培养相比包含大量细胞的状态,该连通孔也确保与培养基的接触,由此能够稳定地持续生长。进而,由于聚合物多孔膜所具有的薄膜特性、挠性特性、形状稳定性、自由形态性,可以在较小的单位空间内共存大量的片或层叠大量的膜,而且由于聚合物多孔膜所具有的超耐热性、耐溶剂性,因此能够以多种手段简便且迅速地进行片的灭菌。进而,通过聚合物多孔膜所具有的三维支架结构,也可期待与平面的培养相比平均每个细胞的外泌体产生量提高。
46.虽没有限定,但本发明优选包括以下的方式。
47.1.一种使用细胞来产生外泌体的方法,其包括如下工序:
48.将细胞应用于细胞培养模块并培养细胞的工序;及
49.由细胞产生外泌体的工序,
50.其中,前述细胞培养模块具备:
51.聚合物多孔膜;及
52.具有2个以上的培养基流入流出口且收纳有前述聚合物多孔膜的壳体。
53.2.根据项目1所述的方法,其中,前述聚合物多孔膜是具备具有多个孔的表面层a和表面层b、及夹持于前述表面层a和表面层b之间的大孔隙层的三层结构的聚合物多孔膜,其中,存在于前述表面层a中的孔的平均孔径小于存在于前述表面层b的孔的平均孔径,前述大孔隙层具有与前述表面层a和b结合的隔壁且具有被该隔壁以及前述表面层a和b包围的多个大孔隙,前述表面层a和b中的孔与前述大孔隙连通,
54.其中,在前述壳体内以如下方式进行了收纳:
55.(i)2个以上的独立的前述聚合物多孔膜汇集(日语:集約)、
56.(ii)前述聚合物多孔膜被折叠、
57.(iii)前述聚合物多孔膜卷绕成卷状、和/或,
58.(iv)前述聚合物多孔膜结成绳状。
59.3.根据项目1或2中任一项所述的方法,其中,前述培养基流入流出口的直径大于细胞的直径且小于前述聚合物多孔膜能流出的直径。
60.4.根据项目1~3中任一项所述的方法,其中,前述壳体具有筛网状的结构。
61.5.根据项目1~4中任一项所述的方法,其中,前述壳体由非挠性材料构成。
62.6.根据项目1~5中任一项所述的方法,其中,前述聚合物多孔膜具有平均孔径0.01~100μm的多个细孔。
63.7.根据项目2~6中任一项所述的方法,其中,前述表面层a的平均孔径为0.01~50μm。
64.8.根据项目2~7中任一项所述的方法,其中,前述表面层b的平均孔径为20~100μm。
65.9.根据项目1~8中任一项所述的方法,其中,前述聚合物多孔膜的总膜厚为5~500μm。
66.10.根据项目1~9中任一项所述的方法,其中,前述聚合物多孔膜为聚酰亚胺多孔膜。
67.11.根据项目10所述的方法,其中,前述聚酰亚胺多孔膜为包含由四羧酸二酐和二胺得到的聚酰亚胺的聚酰亚胺多孔膜。
68.12.根据项目10或11中任一项所述的方法,其中,前述聚酰亚胺多孔膜为:将包含由四羧酸二酐和二胺得到的聚酰胺酸溶液和着色前体的聚酰胺酸溶液组合物成型后,以250℃以上进行热处理而得到的经着色的聚酰亚胺多孔膜。
69.13.根据项目1~12中任一项所述的方法,其中,前述培养细胞的工序在静置培养条件下进行。
70.14.根据项目1~12中任一项所述的方法,其中,前述培养细胞的工序在旋转培养或搅拌条件下进行。
71.15.根据项目1~14中任一项所述的方法,其中,前述培养细胞的工序连续地进行。
72.16.根据项目1~15中任一项所述的方法,其中,前述培养细胞的工序在设置于培养箱内的细胞培养装置中进行,其中,前述细胞培养装置包括:培养单元,其收纳负载细胞的前述细胞培养模块且具备培养基供给口和培养基排出口;培养基供给单元,其具备培养基收纳容器、培养基供给管线、及通过培养基供给管线来输送培养基的送液泵,其中,培养基供给管线的第一端部与培养基收纳容器内的培养基接触,培养基供给管线的第二端部通过培养单元的培养基供给口与培养单元内连通。
73.17.根据项目16所述的方法,其中,前述细胞培养装置不具有培养基供给管线、送液泵、空气供给口、空气排出口和透氧膜。
74.18.根据项目1~17中任一项所述的方法,其中,前述细胞选自由多能干细胞、组织干细胞、体细胞、生殖细胞、肉瘤细胞、已建立细胞系的细胞和转化细胞组成的组。
75.19.根据项目1~18中任一项所述的方法,其中,前述细胞选自由人间充质干细胞、成骨细胞、软骨细胞、心肌细胞组成的组。
76.20.根据项目1~19中任一项所述的方法,其中,前述产生外泌体的工序与前述培养细胞的工序的至少一部分是重复的。
77.21.根据项目1~20中任一项所述的方法,其中,前述产生外泌体的工序持续1个月、2个月、3个月或6个月或更长的时间。
78.22.一种外泌体产生装置,用于项目1~21中任一项所述的方法,包括前述细胞培养模块。
79.23.一种试剂盒,用于项目1~21中任一项所述的方法,包括前述细胞培养模块。
80.24.前述细胞培养模块的用于项目1~21中任一项所述的方法的应用。
81.25.一种外泌体,通过包括前述细胞培养模块的项目1~21中任一项所述的方法而得到。
82.发明的效果
83.通过使用收纳于壳体中、经模块化的聚合物多孔膜,从而高效地吸附被悬浮的细胞,能够使用现有的悬浮培养容器等长期稳定地培养细胞。由于能够在适合的条件下长期稳定地连续大量培养细胞,从而能够构建稳定且高效的外泌体生产系统。
附图说明
84.图1示出细胞培养模块的一实施方式。在壳体内收纳有聚合物多孔膜。
85.图2示出细胞培养模块的一实施方式。在壳体内收纳有聚合物多孔膜。
86.图3示出细胞培养模块的一实施方式。(a)在筛网状的壳体内收纳有聚合物多孔膜。(b)示出由筛网状的网和骨架构成的壳体的一实施方式。
87.图4示出在旋转瓶内应用细胞培养模块时组合使用的装置的实施方式。(a)旋转型装置。将应用了细胞培养模块的该装置设置于旋转瓶内,使该旋转型装置本身旋转而使用。(b)固定型装置。将应用了细胞培养模块的该装置设置于旋转瓶的底部。使旋转瓶的搅拌棒在装置中央的空间旋转而使用。
88.图5示出将细胞培养模块应用于挠性袋式培养容器中进行培养的一实施方式。自培养开始(左边)后1小时内培养液的酚红变为黄色(右边)。
89.图6示出振荡培养时使用筛网模块的一实施方式。
90.图7示出使用了聚酰亚胺多孔膜的细胞培养的模型图。
91.图8是示出干热灭菌型虹吸式细胞培养装置(耐热虹吸式反应器)的图。
92.图9是示出虹吸式细胞培养装置的图。
93.图10示出筒型气相培养装置。(a)是示出细胞培养装置的构成的图。(b)是示出载置(a)中的细胞培养装置的细胞培养部的图。
94.图11示出筒型气相培养装置培养装置。基本的构成与图10相同,但各级的培养基排出口逐级地逆时针偏移30度,成为培养基容易被排出的结构。
95.图12示出喷雾和喷淋型培养装置。
96.图13示出气相露出型旋转培养装置。(a)示出气相露出型旋转培养装置的构成。(b)是示出气相露出型旋转培养装置的使用方式的图。
97.图14示出气相露出型旋转培养装置的细胞培养部。(a)是示出该细胞培养部的示意图,(b)是示出该培养部的使用方式的图。(a)静置培养2天后,(b)振荡培养2天后(无筛网)。
98.图15示出一实施方式中的应用了本发明的细胞培养模块的wave型生物反应器的图。(a)示出封入了细胞培养模块的袋,(b)示出细胞向使用了wave25的细胞培养模块中的细胞吸附工序。
99.图16是示出本发明的一实施方式中的细胞培养装置的图。(a)示出细胞培养模块,(b)示出细胞培养部、(c)示出一实施方式中的细胞培养装置。
100.图17是示出一实施方式中的细胞培养装置的图。
101.图18示出使用了培养皿的细胞培养中的外泌体产生试验的结果,(a)示出在培养天数第6天和第13天回收的细胞培养液中包含的平均每天所产生的外泌体数的测定结果,(b)示出培养天数第13天的粒径分布测定的结果。
102.图19示出在150ml圆形存储瓶中使用了模块的细胞培养中的外泌体产生试验的结果,(a)示出至培养天数27天为止的细胞培养液中包含的平均每天所产生的外泌体数的测定结果,(b)示出培养天数第27天的粒径分布测定的结果。
103.图20示出在150ml圆形存储瓶中使用了模块的细胞培养中的外泌体产生试验的结果,(a)示出至培养天数27天为止的细胞培养液中包含的平均每天所产生的外泌体数的测
定结果,(b)示出培养天数第27天的粒径分布测定的结果。
104.图21示出在溢流反应器中使用了模块的细胞培养系统(5%氧气),(a)示出葡萄糖消耗量和乳酸产生量的经时变化,(b)示出细胞培养的形态。
105.图22示出在溢流反应器中使用了模块的细胞培养(5%氧气)中的外泌体产生试验的结果,(a)示出至培养天数85天为止的细胞培养液中包含的平均每天所产生的外泌体数的测定结果,(b)示出培养天数第85天的粒径分布测定的结果。
106.图23示出在溢流反应器中使用了模块的细胞培养系统(普通氧气),(a)示出葡萄糖消耗量和乳酸产生量的经时变化,(b)示出细胞培养的形态。
107.图24示出在溢流反应器中使用了模块的细胞培养(普通氧气)中的外泌体产生试验的结果,(a)示出至培养天数85天为止的细胞培养液中包含的平均每天所产生的外泌体数的测定结果,(b)示出培养天数第85天的粒径分布测定的结果。
108.图25的(a)示出在wave反应器中使用了模块的细胞培养系统中的、将葡萄糖消耗量和乳酸产生量的经时变化。图25的(b)和(c)示出在wave反应器中使用了模块的细胞培养中的外泌体产生试验的结果,(b)示出至培养天数39天为止的细胞培养液中包含的平均每天所产生的外泌体数的测定结果,(c)示出培养天数第39天的粒径分布测定的结果。
109.图26示出比较例1和实施例1~4的培养天数第13天的1细胞的外泌体产生力的比较。
110.图27示出比较例1(培养皿_第6天)和实施例1(培养瓶(5%氧气)_第27天)的平均每个细胞的外泌体产生量的比较。
111.图28示出比较例1(培养皿_第6天)和实施例1(培养瓶(5%氧气)_第27天)的mirna阵列解析的散点图。
112.图29示出hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的散点图。
113.图30示出hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果。
114.图31示出hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果。
115.图32示出比较例1(培养皿_第13天)和实施例1(培养瓶(5%氧气)_第27天)的平均每个细胞的外泌体产生量的比较。
116.图33示出比较例1(培养皿_第13天)和实施例1(培养瓶(5%氧气)_第27天)的mirna阵列解析的散点图。
117.图34示出hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果。
118.图35示出hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果。
119.图36示出hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果。
120.图37示出比较例1(培养皿_第6天)和实施例2(培养瓶(普通氧气)_第27天)的平均每个细胞的外泌体产生量的比较。
121.图38示出比较例1(培养皿_第6天)和实施例2(培养瓶(普通氧气)_第27天)的mirna阵列解析的散点图。
122.图39示出hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果。
123.图40示出hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果。
124.图41示出hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果。
125.图42示出比较例1(培养皿_第13天)和实施例2(培养瓶(普通氧气)_第27天)的平均每个细胞的外泌体产生量的比较。
126.图43示出比较例1(培养皿_第13天)和实施例2(培养瓶(普通氧气)_第27天)的mirna阵列解析的散点图。
127.图44示出hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果。
128.图45示出hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果。
129.图46示出hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果。
130.图47示出比较例1(培养皿_第6天)和实施例3(反应器(5%氧气)_第27天)的平均每个细胞的外泌体产生量的比较。
131.图48示出比较例1(培养皿_第6天)和实施例3(反应器(5%氧气)_第27天)的mirna阵列解析的散点图。
132.图49示出hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果。
133.图50示出hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果。
134.图51示出hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果。
135.图52示出比较例1(培养皿_第13天)和实施例3(反应器(5%氧气)_第27天)的平均每个细胞的外泌体产生量的比较。
136.图53示出比较例1(培养皿_第13天)和实施例3(反应器(5%氧气)_第27天)的mirna阵列解析的散点图。
137.图54示出hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果。
138.图55示出hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果。
139.图56示出hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果。
140.图57示出比较例1(培养皿_第6天)和实施例4(反应器(普通氧气)_第27天)的平均
每个细胞的外泌体产生量的比较。
141.图58示出比较例1(培养皿_第6天)和实施例4(反应器(普通氧气)_第27天)的mirna阵列解析的散点图。
142.图59示出hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果。
143.图60示出hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果。
144.图61示出hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果。
145.图62示出比较例1(培养皿_第13天)和实施例4(反应器(普通氧气)_第27天)的平均每个细胞的外泌体产生量的比较。
146.图63示出比较例1(培养皿_第13天)和实施例4(反应器(普通氧气)_第27天)的mirna阵列解析的散点图。
147.图64示出hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果。
148.图65示出hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果。
149.图66示出hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果。
150.图67是示出乳酸产生量和葡萄糖消耗的经时变化的图。
151.图68是示出5种获得外泌体样品的粒度分布的图。
152.图69示出一实施方式中的通过本发明的方法而得到的外泌体的透射型电子显微镜图像。
153.图70是示出各种反应器中的经时的外泌体产生量的图。
154.图71示出mirna阵列解析的结果(左边:人mirna整体图;右边:mir-21、22、23、24筛选)。
155.图72是示出乳酸产生量和葡萄糖消耗的经时变化的图。
156.图73示出mirna阵列解析的结果(左边:人mirna整体图;右边:mir-21、22、23、24筛选)。
157.图74是示出乳酸产生量和葡萄糖消耗的经时变化的图。
158.图75是示出经模块培养或经小片多孔膜培养的人软骨细胞的细胞密度(左边)和总细胞数的经时变化的图。
159.图76示出mirna阵列解析的结果(左边:人mirna整体图;右边:mir-21、22、23、24筛选)。
160.图77示出实施例5中使用的wave反应器的使用方式。左边:用于wave培养袋的、带排液管的hdpe盖。右边:安装有带排液管的hdpe盖的wave培养袋。
具体实施方式
161.i.产生外泌体的方法
162.本发明涉及使用细胞来产生外泌体的方法。本发明的方法包括:在将聚合物多孔膜收纳于壳体而构成的模块内培养细胞,由细胞产生外泌体。
163.1.细胞
164.本发明的方法中可以利用的细胞的种类只要产生外泌体就没有特别限定。已知在各种细胞中产生外泌体,它们所产生的外泌体谱也根据来源细胞、产生时的条件而不同。因此,本发明中,可以基于各个实施方式对能够以期望的品质和收率产生外泌体的细胞进行适宜选择。
165.在一个方式中,本发明中,作为培养细胞使用多能干细胞。多能干细胞是指:具有能分化为任何组织细胞的能力(分化多能性)的干细胞的统称。并非进行限定,多能干细胞包括胚胎干细胞(es细胞)、诱导多能干细胞(ips细胞)、胚胎生殖干细胞(eg细胞)、生殖干细胞(gs细胞)等。优选为es细胞或ips细胞。ips细胞由于不存在伦理上的问题等原因而特别优选。作为多能干细胞,可以使用公知的任意的多能干细胞,例如可以使用国际公开wo2009/123349(pct/jp2009/057041)中记载的多能干细胞。
166.在一个方式中,本发明中,作为培养细胞使用组织干细胞。组织干细胞是指:能分化的细胞谱系仅限于特定的组织,但具有能分化为多种细胞类型的能力(分化多能性)的干细胞。例如骨髄中的造血干细胞是血细胞的来源,神经干细胞分化为神经细胞。此外还有制造肝脏的肝干细胞、成为皮肤组织的皮肤干细胞等各种种类。组织干细胞优选选自间充质干细胞、肝干细胞、胰腺干细胞、神经干细胞、皮肤干细胞、或造血干细胞。
167.在一个方式中,本发明中,作为培养细胞使用体细胞。体细胞是指:构成多细胞生物的细胞中除生殖细胞以外的细胞。在有性生殖中不会传给下一代。体细胞优选选自肝细胞、胰腺细胞、肌细胞、骨细胞、成骨细胞、破骨细胞、软骨细胞、脂肪细胞、皮肤细胞、成纤维细胞、胰腺细胞、肾细胞、肺细胞;或者,淋巴细胞、红细胞、白细胞、单核细胞、巨噬细胞或巨核细胞之类的血细胞。
168.在一个方式中,本发明中,作为培养细胞使用生殖细胞。生殖细胞是指具有在生殖中将遗传信息传递给下一代的作用的细胞。例如,包括用于有性生殖的配子即卵子、卵细胞、精子、精细胞、用于无性生殖的孢子等。
169.细胞可以选自由肉瘤细胞、已建立细胞系的细胞和转化细胞组成的组。“肉瘤”是指:在骨、软骨、脂肪、肌肉、血液等非上皮性细胞来源的结缔组织细胞中发生的癌,包括软组织肉瘤、恶性骨肿瘤等。肉瘤细胞是源自肉瘤的细胞。“已建立细胞系的细胞”是指:长期在体外维持,具有一定稳定的性质、能进行半永久性传代培养的培养细胞。存在pc12细胞(大鼠肾上腺髓质来源)、cho细胞(中国仓鼠卵巢来源)、hek293细胞(人胚肾来源)、hl-60细胞(人白细胞来源)、hela细胞(人宫颈癌来源)、vero细胞(非洲绿猴肾脏上皮细胞来源)、mdck细胞(狗肾脏肾小管上皮细胞来源)、hepg2细胞(人肝癌来源)等源自包括人在内的各种生物物种的各种组织的细胞株。“转化细胞”是指从细胞外部导入核酸(dna等)而改变了遗传性质的细胞。
170.已知外泌体在干细胞、癌细胞等未分化的细胞中活跃地产生,在有利的情况下,本发明的方法中,作为培养细胞使用干细胞。
171.2.外泌体
172.外泌体在本发明中是指细胞向细胞外分泌的50~300nm的膜囊结构。外泌体所来
源的细胞的种类、产生时的条件会影响外泌体的品质,因此在本发明的方法中,可以适宜选择能够以期望的品质和收率产生外泌体的条件。在有利的情况下,可评价所获得的外泌体是否具备适于其用途的品质,如作为药物递送载体、生理活性物质的应用等。
173.3.细胞培养模块
174.本发明的方法中使用的细胞培养模块具备:
175.聚合物多孔膜;及
176.具有2个以上的培养基流入流出口且收纳有前述聚合物多孔膜的壳体,
177.其中,前述聚合物多孔膜是具备具有多个孔的表面层a和表面层b、及夹持于前述表面层a和表面层b之间的大孔隙层的三层结构的聚合物多孔膜,其中,存在于前述表面层a中的孔的平均孔径小于存在于前述表面层b的孔的平均孔径,前述大孔隙层具有与前述表面层a和b结合的隔壁且具有被该隔壁以及前述表面层a和b包围的多个大孔隙,前述表面层a和b中的孔与前述大孔隙连通,其中,在前述壳体内以如下方式进行了收纳:
178.(i)2个以上的独立的前述聚合物多孔膜汇集、
179.(ii)前述聚合物多孔膜被折叠、
180.(iii)前述聚合物多孔膜卷绕成卷状、和/或,
181.(iv)前述聚合物多孔膜结成绳状。
182.以下,也将该细胞培养模块称为“本发明的细胞培养模块”。需要说明的是,本说明书中,“细胞培养模块”这一记载可以简记为“模块”,即使相互变更也表示相同含义。
183.本说明书中,“细胞培养模块”是指:能用于细胞培养容器、细胞培养装置和细胞培养系统、特别是悬浮培养中使用的细胞培养容器、细胞培养装置和细胞培养系统的细胞培养基材。将细胞培养模块的一些实施方式示于图1~3、和图16的(a)。本发明的细胞培养模块可以通过如图4~6和8~17那样的实施方式而使用。另外,也可以通过后述的实施例所示的方式而使用。
184.本发明的细胞培养模块通过将聚合物多孔膜收纳于壳体中,从而可防止膜状的聚合物多孔膜在壳体内形态连续发生变形。由此,可防止对在聚合物多孔膜内生长的细胞施加应力,能够抑制凋亡等而稳定且大量地培养细胞。
185.本发明的细胞培养模块所具备的壳体具有2个以上的培养基流入流出口,因此细胞培养基可向壳体的内部供给及向外部排出。该壳体的培养基流入流出口的直径优选大于前述细胞的直径以使细胞能够流入壳体的内部。另外,培养基流入流出口的直径优选小于聚合物多孔膜能从该培养基流入流出口流出的直径。小于聚合物多孔膜能流出的直径的直径可以根据收纳于壳体中的聚合物多孔膜的形状、大小进行适宜选择。例如,聚合物多孔膜为带状时,只要小于该聚合物多孔膜的短边的宽度且是该聚合物多孔膜不会流出的适度的直径就没有特别限定。该培养基流入流出口的数量优选尽可能多地设置,以使细胞培养基容易向壳体内外供给和/或排出。优选为5以上、优选为10以上、优选为20以上、优选为50以上、优选为100以上。培养基流入流出口可以在壳体的一部分或全部具有筛网状的结构。另外,该壳体本身可以为筛网状。本发明中,筛网形状的结构是指:例如具有纵格、横格和/或斜格状结构,且以流体能够通过各网孔的程度形成培养基流入流出口,但不限定于此。
186.本发明的细胞培养模块所具备的壳体优选具有不会因通常的培养条件、例如搅拌培养、振荡培养条件下的培养基的活动而发生变形这一程度的强度,优选由非挠性材料形
成。另外,壳体优选由在细胞培养中不会对细胞的生长产生影响的原材料形成。作为这样的材料,例如可列举出聚乙烯、聚丙烯、尼龙、聚酯、聚苯乙烯、聚碳酸酯、聚甲基丙烯酸甲酯、聚对苯二甲酸乙二醇酯等聚合物、不锈钢、钛等金属,但不限定于此。通过使壳体具有一定程度的强度,从而可防止壳体内部的聚合物多孔膜的形状连续地变形,可进一步发挥本发明的效果。在本说明书中,“壳体不变形”是指:在通常的培养环境下所承受的载荷下不发生变形,而不是指绝对不发生变形。
187.本发明的细胞培养模块在前述壳体内以如下方式进行了收纳:
188.(i)2个以上的独立的前述聚合物多孔膜汇集、
189.(ii)前述聚合物多孔膜被折叠、
190.(iii)前述聚合物多孔膜卷绕成卷状、和/或,
191.(iv)前述聚合物多孔膜结成绳状。
192.本说明书中,“2个以上的独立的该聚合物多孔膜汇集并收纳在壳体内”是指:彼此独立的2个以上的聚合物多孔性膜在被壳体包围的一定空间内汇集并被收纳的状态。本发明中,2个以上的独立的该聚合物多孔膜可以是:利用任意的方法将该聚合物多孔膜的至少1个位置与该壳体内的至少1个位置固定,将该聚合物多孔膜固定成在壳体内不移动的状态。另外,2个以上的独立的聚合物多孔膜可以为小片。小片的形状例如可以采用圆形、椭圆形、四边形、三角形、多边形、带状等任意的形状,但优选为大致正方形。本发明中,小片的大小可以是任意的大小,但为大致正方形时,长度可以为任意的长度,例如,可以为80mm以下,优选为50mm以下,更优选为30mm以下,进而更优选为20mm以下,可以为10mm以下。另外,聚合物多孔性膜的小片为大致正方形时,其一边的长度可以以沿着壳体的内壁或短于内壁一边的长度(例如,短0.1mm~1mm左右)的方式形成,使其成为聚合物多孔膜在壳体内不移动的状态。由此,可防止对在聚合物多孔膜内生长的细胞施加应力,抑制凋亡等而能够稳定且大量地培养细胞。需要说明的是,带状的聚合物多孔膜的情况下,如后所述,可以以(ii)前述聚合物多孔膜被折叠、(iii)前述聚合物多孔膜卷绕成卷状、和/或(iv)前述聚合物多孔膜结成绳状的方式收纳于该壳体中。另外,为了将2个以上的独立的聚合物多孔膜汇集地收纳于壳体内,也可以将任意张数的聚合物多孔膜层叠。在此情况下,在聚合物多孔膜与聚合物多孔膜之间可以设置垫板。通过设置垫板,从而能够将培养基高效地供给至所层叠的聚合物多孔膜之间。垫板只要在所层叠的聚合物多孔膜之间形成任意的空间且具有高效地供给培养基的功能就没有特别限定,例如,可以使用具有筛网结构的平面结构体。垫板的材质例如可以使用聚苯乙烯、聚碳酸酯、聚甲基丙烯酸甲酯、聚对苯二甲酸乙二醇酯、不锈钢制的筛网,但不限定于此。存在具有筛网结构的垫板时,只要具有能够将培养基供给至所层叠的聚合物多孔膜之间这一程度的开口即可,可以进行适宜选择。
193.本说明书中,“被折叠的聚合物多孔膜”是指:通过在该壳体内折叠,从而由于与聚合物多孔膜的各面和/或壳体内的表面的摩擦力而处于在壳体内不移动的状态的聚合物多孔膜。在本说明书中,“被折叠”可以是聚合物多孔膜上带有折痕的状态,也可以是不带折痕的状态。
194.本说明书中,“卷绕成卷状的聚合物多孔膜”是指:聚合物多孔膜卷绕成卷状,由于与聚合物多孔膜的各面和/或壳体内的表面的摩擦力而处于在壳体内不移动的状态的聚合物多孔膜。另外,在本发明中,编织成绳状的聚合物多孔膜是指:将例如长条状的多个聚合
物多孔膜利用任意的方法编织成绳状、由于与聚合物多孔膜彼此的摩擦力而彼此不移动的状态的聚合物多孔膜。也可以将(i)将2个以上的独立的前述聚合物多孔膜汇集而成的聚合物多孔膜、(ii)被折叠的聚合物多孔膜、(iii)卷绕成卷状的聚合物多孔膜、和(iv)结成绳状的聚合物多孔膜组合而收纳于壳体内。
195.本说明书中,在细胞培养基中培养该细胞培养模块的情况下,“该聚合物多孔膜在壳体内不移动的状态”是指如下状态:该聚合物多孔膜以不连续发生形态变化的状态被收纳于壳体内。换言之,为如下状态:该聚合物多孔膜本身受到抑制而不会因为流体发生连续波动。由于聚合物多孔膜在壳体内保持不移动的状态,因此可防止对在聚合物多孔膜内生长的细胞施加应力,能够稳定地培养细胞而不会发生由凋亡等所致的细胞死亡。
196.本发明的细胞培养模块只要是培养细胞的培养装置和系统等就可以使用市售者。例如,也可以用于由挠性袋构成培养容器的培养装置中,可以在悬浮于该培养容器内的状态下使用。另外,本发明的细胞培养模块例如可以用于旋转瓶等搅拌培养型容器来进行培养。此外,作为培养容器,可用于敞口容器也可用于封闭容器。从例如细胞培养用的培养盘、烧瓶、塑料袋、试管到大型的罐均可适当利用。包括例如bd falcon公司制的细胞培养皿(cell culture dish)、thermo scientific公司制的nunc细胞工厂等。
197.4.细胞培养模块在细胞培养装置中的应用
198.本说明书中,“细胞培养装置”通常是与细胞培养系统、生物反应器、或反应器含义相同的术语,即使相互替换也具有相同含义。本发明的细胞培养模块可以用于以下示例的细胞培养装置中。另外,也可以用于除以下示例的装置以外的市售的装置中。
199.(1)虹吸式培养装置
200.本发明的细胞培养模块可以用于如图8和9所示的虹吸式培养装置中。虹吸式培养装置是如下细胞培养装置,其特征在于,具备:聚合物多孔膜;收纳有前述聚合物多孔膜的细胞培养部;将前述细胞培养部收纳于内部的储液部、及配置于前述储液部的上部的培养基供给单元;与前述储液部的底部连通的倒u字管;设置于前述倒u字管的另一端的下部的培养基回收单元;及配置于前述培养基回收单元中的培养基排出单元,其中,前述聚合物多孔膜是具备具有多个孔的表面层a和表面层b、及夹持于前述表面层a和表面层b之间的大孔隙层的三层结构的聚合物多孔膜,其中,存在于前述表面层a中的孔的平均孔径小于存在于前述表面层b的孔的平均孔径,前述大孔隙层具有与前述表面层a和b结合的隔壁且具有被该隔壁以及前述表面层a和b包围的多个大孔隙,前述表面层a和b中的孔与前述大孔隙连通,其中,在从前述培养基供给单元向前述储液部中供给的培养基的液面到达前述倒u字管的顶点部时,根据虹吸的原理培养基被间歇地喷出至前述培养基回收单元。在该装置中,可以将聚合物多孔膜替换成细胞培养模块来使用。
201.(2)筒型气相培养装置
202.本发明的细胞培养模块可以用于如图10、图11和图17所示的筒型气相培养装置中。在一个实施方式中,筒型气相培养装置是指:一种细胞培养装置,具备:聚合物多孔膜;及收纳有前述聚合物多孔膜的细胞培养部;配置于前述细胞培养部的上部的培养基供给单元;和,配置于前述细胞培养部的下部的培养基回收单元,其中,前述聚合物多孔膜是具备具有多个孔的表面层a和表面层b、及夹持于前述表面层a和表面层b之间的大孔隙层的三层结构的聚合物多孔膜,其中,存在于前述表面层a中的孔的平均孔径小于存在于前述表面层
b的孔的平均孔径,前述大孔隙层具有与前述表面层a和b结合的隔壁且具有被该隔壁以及前述表面层a和b包围的多个大孔隙,其中,前述细胞培养部具备具有1个以上的培养基排出口的底部、及大致垂直地配置于前述底部的侧部。另外,在一个实施方式中,筒型气相培养装置是指:一种细胞培养装置,具备:聚合物多孔膜;及收纳有前述聚合物多孔膜的细胞培养部;配置于前述细胞培养部的上部的培养基供给单元;配置于前述细胞培养部的下部的培养基回收单元,其中,三层结构的聚合物多孔膜具备:具有多个孔的表面层a和表面层b、及夹持于前述表面层a和表面层b之间的大孔隙层,其中,存在于前述表面层a中的孔的平均孔径小于存在于前述表面层b的孔的平均孔径,前述大孔隙层具有与前述表面层a和b结合的隔壁且具有被该隔壁以及前述表面层a和b包围的多个大孔隙,前述表面层a和b中的孔与前述大孔隙连通,其中,前述培养基回收单元作为收纳前述细胞培养部的外筒的一部分。在该装置中,可以将聚合物多孔膜替换成细胞培养模块而使用。
203.(3)喷雾和喷淋型培养装置
204.本发明的细胞培养模块可以用于如图12所示的喷雾和喷淋型培养装置中。喷雾和喷淋型培养装置是指:一种细胞培养装置,具备:聚合物多孔膜;及载置有前述聚合物多孔膜的聚合物多孔膜载置部;收纳有前述聚合物多孔膜载置部的壳体;配置于前述壳体的内部的液滴化培养基供给部;与前述液滴化培养基供给部连通的培养基供给管线;与前述培养基供给管线连通的培养基贮藏部;及设置于前述培养基供给管线的一部分的泵,其中,前述聚合物多孔膜是具备具有多个孔的表面层a和表面层b、及夹持于前述表面层a和表面层b之间的大孔隙层的三层结构的聚合物多孔膜,其中,存在于前述表面层a中的孔的平均孔径小于存在于前述表面层b的孔的平均孔径,前述大孔隙层具有与前述表面层a和b结合的隔壁且具有被该隔壁以及前述表面层a和b包围的多个大孔隙,前述表面层a和b中的孔与前述大孔隙连通,其中,前述聚合物多孔膜载置部具备狭缝状或筛网状的多个培养基排出口。在该装置中,可以将聚合物多孔膜替换成细胞培养模块而使用。
205.(4)气相露出型旋转培养装置
206.本发明的细胞培养模块可以用于如图13、14和图16所示的旋转培养装置中。气相露出型旋转培养装置为:一种细胞培养装置,其特征在于,具备:聚合物多孔膜;具有前述聚合物多孔膜的细胞培养部;贯通前述细胞培养部的轴;用于使前述轴旋转的旋转马达;及浸渍前述细胞培养部的至少一部分的培养基槽,其中,前述聚合物多孔膜是具备具有多个孔的表面层a和表面层b、及夹持于前述表面层a和表面层b之间的大孔隙层的三层结构的聚合物多孔膜,其中,存在于前述表面层a中的孔的平均孔径小于存在于前述表面层b的孔的平均孔径,前述大孔隙层具有与前述表面层a和b结合的隔壁且具有被该隔壁以及前述表面层a和b包围的多个大孔隙,前述表面层a和b中的孔与前述大孔隙连通,前述细胞培养部以前述轴为中心而旋转,在气相和液相中交替地培养负载于前述聚合物多孔膜上的细胞。在该装置中,可以将聚合物多孔膜替换成细胞培养模块而使用。
207.5.聚合物多孔膜
208.本发明所使用的聚合物多孔膜中的存在于表面层a(以下也称为“a面”或“筛网面”)中的孔的平均孔径没有特别限定,例如为0.01μm以上且小于200μm、0.01~150μm、0.01~100μm、0.01~50μm、0.01μm~40μm、0.01μm~30μm、0.01μm~20μm或0.01μm~15μm,优选为0.01μm~15μm。
209.本发明所使用的聚合物多孔膜中的存在于表面层b(以下也称为“b面”或“大孔面”)中的孔的平均孔径只要大于存在于表面层a中的孔的平均孔径,就没有特别限定,例如超过5μm且为200μm以下、20μm~100μm、30μm~100μm、40μm~100μm、50μm~100μm或60μm~100μm,优选为20μm~100μm。
210.聚合物多孔膜表面的平均孔径可以通过如下方式求出:根据多孔膜表面的扫描型电子显微镜照片,针对200个以上的开孔部测定孔面积,由该孔面积的平均值依据下式(1)计算出孔的形状视为正圆时的平均直径,从而求出。
[0211][0212]
(式中,sa是指孔面积的平均值。)
[0213]
表面层a和b的厚度没有特别限定,例如0.01~50μm,优选为0.01~20μm。
[0214]
聚合物多孔膜的大孔隙层中的大孔隙的膜平面方向的平均孔径没有特别限定,例如为10~500μm,优选为10~100μm,更优选为10~80μm。此外,该大孔隙层中的隔壁的厚度没有特别限定,例如为0.01~50μm,优选为0.01~20μm。在一个实施方式中,该大孔隙层中的至少1个隔壁具有将邻接的大孔隙彼此连通且平均孔径为0.01~100μm、优选为0.01~50μm的1个或多个孔。在另一实施方式中,该大孔隙层中的隔壁不具有孔。
[0215]
本发明所使用的聚合物多孔膜表面的总膜厚没有特别限定,可以为5μm以上、10μm以上、20μm以上或25μm以上,也可以为500μm以下、300μm以下、100μm以下、75μm以下或50μm以下。优选为5~500μm,更优选为25~75μm。
[0216]
本发明所使用的聚合物多孔膜的膜厚的测定可利用接触式的厚度计来进行。
[0217]
本发明所使用的聚合物多孔膜的孔隙率没有特别限定,例如为40%以上且小于95%。
[0218]
本发明中使用的聚合物多孔膜的孔隙率可通过对切成规定大小的多孔膜的膜厚和质量进行测定,并按照下式(2)由单位面积质量来求出。
[0219]
孔隙率(%)=(1-w/(s
×d×
d))
×
100
ꢀꢀꢀ
(2)
[0220]
(式中,s是指多孔膜的面积,d是指总膜厚,w是指测得的质量,d是指聚合物的密度。聚合物为聚酰亚胺时,密度设为1.34g/cm3。)
[0221]
本发明中使用的聚合物多孔膜优选具备具有多个孔的表面层a和表面层b、以及夹持于前述表面层a与表面层b之间的大孔隙层的三层结构的聚合物多孔膜,其中,存在于前述表面层a的孔的平均孔径为0.01μm~15μm,存在于前述表面层b的孔的平均孔径为20μm~100μm,前述大孔隙层具有与前述表面层a和b结合的隔壁、以及被该隔壁及前述表面层a和b包围的多个大孔隙,前述大孔隙层的隔壁以及前述表面层a和b的厚度为0.01~20μm,前述表面层a和b中的孔与大孔隙连通,总膜厚为5~500μm,孔隙率为40%以上且小于95%。在一个实施方式中,大孔隙层中的至少1个隔壁具有将邻接的大孔隙彼此连通且平均孔径为0.01~100μm、优选为0.01~50μm的1个或多个孔。在另一实施方式中,隔壁不具有这样的孔。
[0222]
本发明中使用的聚合物多孔膜优选经灭菌。作为灭菌处理,没有特别限定,可列举出干热灭菌、蒸气灭菌、基于乙醇等消毒剂的灭菌、紫外线或伽马射线等的电磁波灭菌等任意灭菌处理等。
[0223]
本发明所使用的聚合物多孔膜只要具备上述结构上的特征,就没有特别限定,优选为聚酰亚胺多孔膜或聚醚砜(pes)多孔膜。
[0224]
5-1.聚酰亚胺多孔膜
[0225]
聚酰亚胺是指重复单元中包含酰亚胺键的高分子的统称,通常是指芳香族化合物直接借助酰亚胺键连接而成的芳香族聚酰亚胺。芳香族聚酰亚胺中,在芳香族与芳香族之间通过酰亚胺键而具有共轭结构,因此具有刚直且牢固的分子结构,并且,酰亚胺键具有强分子间力,因此具有非常高水平的热性质、机械性质、化学性质。
[0226]
本发明可使用的聚酰亚胺多孔膜优选为(作为主要成分而)包含由四羧酸二酐和二胺得到的聚酰亚胺的聚酰亚胺多孔膜,更优选由通过四羧酸二酐和二胺得到的聚酰亚胺形成的聚酰亚胺多孔膜。“作为主要成分而包含”是指:作为聚酰亚胺多孔膜的构成成分,本质上不含由四羧酸二酐和二胺得到的聚酰亚胺之外的成分,或者虽然可以包含由四羧酸二酐和二胺得到的聚酰亚胺之外的成分,但其是不会对由四羧酸二酐和二胺得到的聚酰亚胺的性质造成影响的附加性成分。
[0227]
在一个实施方式中,本发明可使用的聚酰亚胺多孔膜还包括:通过将包含着色前体以及由四羧酸成分和二胺成分得到的聚酰胺酸溶液的聚酰胺酸溶液组合物成型后,在250℃以上进行热处理而得到的经着色的聚酰亚胺多孔膜。
[0228]
聚酰胺酸是将四羧酸成分与二胺成分进行聚合而得到的。聚酰胺酸是能够通过热酰亚胺化或化学酰亚胺化进行闭环而制成聚酰亚胺的聚酰亚胺前体。
[0229]
对于聚酰胺酸,即使一部分酰胺酸进行了酰亚胺化,只要是不对本发明造成影响的范围,则也可以使用该聚酰胺酸。即,聚酰胺酸可以部分地进行了热酰亚胺化或化学酰亚胺化。
[0230]
将聚酰胺酸进行热酰亚胺化时,根据需要,可以向聚酰胺酸溶液中添加酰亚胺化催化剂、含有机磷的化合物、无机微粒、有机微粒等微粒等。此外,将聚酰胺酸进行化学酰亚胺化时,根据需要,可以向聚酰胺酸溶液中添加化学酰亚胺化剂、脱水剂、无机微粒、有机微粒等微粒等。优选在即使向聚酰胺酸溶液中配混前述成分也不会析出着色前体的条件下进行。
[0231]
本说明书中,“着色前体”是指:通过250℃以上的热处理而一部分或全部碳化并生成着色物的前体。
[0232]
作为在上述聚酰亚胺多孔膜的制造中可使用的着色前体,优选为均匀地溶解或分散于聚酰胺酸溶液或聚酰亚胺溶液,并通过250℃以上、优选260℃以上、进一步优选280℃以上、更优选300℃以上的热处理,优选通过在空气等氧气存在下的250℃以上、优选260℃以上、进一步优选280℃以上、更优选300℃以上的热处理而发生热分解、碳化并生成着色物的着色前体,更优选为生成黑色系着色物的着色前体,更优选为碳系着色前体。
[0233]
着色前体在加热时,乍看像是碳化物,但在组织上包含除碳之外的不同种元素,且包含层结构、芳香族交联结构、含有四面体碳的无序结构的物质。
[0234]
碳系着色前体没有特别限定,可列举出例如石油焦油、石油沥青、煤焦油、煤沥青等焦油或沥青;焦炭、由包含丙烯腈的单体得到的聚合物、二茂铁化合物(二茂铁和二茂铁衍生物)等。这些之中,优选为由包含丙烯腈的单体得到的聚合物和/或二茂铁化合物,作为由包含丙烯腈的单体得到的聚合物,优选为聚丙烯腈。
[0235]
此外,在其它实施方式中,本发明可使用的聚酰亚胺多孔膜还包括:不使用上述着色前体,而是通过将由四羧酸成分和二胺成分得到的聚酰胺酸溶液成型后,进行热处理而得到的聚酰亚胺多孔膜。
[0236]
不使用着色前体地制造的聚酰亚胺多孔膜也可如下制造:例如,将包含特性粘度数值为1.0~3.0的聚酰胺酸3~60质量%和有机极性溶剂40~97质量%的聚酰胺酸溶液流延成膜状,使其浸渍于以水作为必须成分的凝固溶剂或与该凝固溶剂接触,制作聚酰胺酸的多孔膜,其后对该聚酰胺酸的多孔膜进行热处理而进行酰亚胺化。在该方法中,以水为必须成分的凝固溶剂可以是水,或者为5质量%以上且小于100质量%的水与超过0质量%且为95质量%以下的有机极性溶剂的混合液。此外,在上述酰亚胺化后,也可以对所得多孔聚酰亚胺膜的至少单面实施等离子体处理。
[0237]
在上述聚酰亚胺多孔膜的制造中可使用的四羧酸二酐可以使用任意的四羧酸二酐,可根据期望的特性等来适当选择。作为四羧酸二酐的具体例,可列举出均苯四酸二酐、3,3’,4,4
’‑
联苯四羧酸二酐(s-bpda)、2,3,3’,4
’‑
联苯四羧酸二酐(a-bpda)等联苯四羧酸二酐;氧基二邻苯二甲酸二酐、二苯基砜-3,4,3’,4
’‑
四羧酸二酐、双(3,4-二羧基苯基)硫醚二酐、2,2-双(3,4-二羧基苯基)-1,1,1,3,3,3-六氟丙烷二酐、2,3,3’,4
’‑
二苯甲酮四羧酸二酐、3,3’,4,4
’‑
二苯甲酮四羧酸二酐、双(3,4-二羧基苯基)甲烷二酐、2,2-双(3,4-二羧基苯基)丙烷二酐、对亚苯基双(偏苯三酸单酯酸酐)、对亚联苯基双(偏苯三酸单酯酸酐)、间三联苯-3,4,3’,4
’‑
四羧酸二酐、对三联苯-3,4,3’,4
’‑
四羧酸二酐、1,3-双(3,4-二羧基苯氧基)苯二酐、1,4-双(3,4-二羧基苯氧基)苯二酐、1,4-双(3,4-二羧基苯氧基)联苯二酐、2,2-双〔(3,4-二羧基苯氧基)苯基〕丙烷二酐、2,3,6,7-萘四羧酸二酐、1,4,5,8-萘四羧酸二酐、4,4
’‑
(2,2-六氟异丙叉基)二邻苯二甲酸二酐等。此外,还优选使用2,3,3’,4
’‑
二苯基砜四羧酸等芳香族四羧酸。它们可以单独使用,也可以组合使用2种以上。
[0238]
这些之中,特别优选为选自由联苯四羧酸二酐和均苯四酸二酐组成的组中的至少一种芳香族四羧酸二酐。作为联苯四羧酸二酐,可适当地使用3,3’,4,4
’‑
联苯四羧酸二酐。
[0239]
在上述聚酰亚胺多孔膜的制造中可使用的二胺可以使用任意的二胺。作为二胺的具体例,可列举出以下的二胺。
[0240]
1)1,4-二氨基苯(对苯二胺)、1,3-二氨基苯、2,4-二氨基甲苯、2,6-二氨基甲苯等1个苯核的苯二胺;
[0241]
2)4,4
’‑
二氨基二苯基醚、3,4
’‑
二氨基二苯基醚等二氨基二苯基醚;4,4
’‑
二氨基二苯基甲烷、3,3
’‑
二甲基-4,4
’‑
二氨基联苯、2,2
’‑
二甲基-4,4
’‑
二氨基联苯、2,2
’‑
双(三氟甲基)-4,4
’‑
二氨基联苯、3,3
’‑
二甲基-4,4
’‑
二氨基二苯基甲烷、3,3
’‑
二羧基-4,4
’‑
二氨基二苯基甲烷、3,3’,5,5
’‑
四甲基-4,4
’‑
二氨基二苯基甲烷、双(4-氨基苯基)硫醚、4,4
’‑
二氨基苯甲酰苯胺、3,3
’‑
二氯联苯胺、3,3
’‑
二甲基联苯胺、2,2
’‑
二甲基联苯胺、3,3
’‑
二甲氧基联苯胺、2,2
’‑
二甲氧基联苯胺、3,3
’‑
二氨基二苯基醚、3,4
’‑
二氨基二苯基醚、4,4
’‑
二氨基二苯基醚、3,3
’‑
二氨基二苯硫醚、3,4
’‑
二氨基二苯硫醚、4,4
’‑
二氨基二苯硫醚、3,3
’‑
二氨基二苯基砜、3,4
’‑
二氨基二苯基砜、4,4
’‑
二氨基二苯基砜、3,3
’‑
二氨基二苯甲酮、3,3
’‑
二氨基-4,4
’‑
二氯二苯甲酮、3,3
’‑
二氨基-4,4
’‑
二甲氧基二苯甲酮、3,3
’‑
二氨基二苯基甲烷、3,4
’‑
二氨基二苯基甲烷、4,4
’‑
二氨基二苯基甲烷、2,2-双(3-氨基苯基)丙烷、2,2-双(4-氨基苯基)丙烷、2,2-双(3-氨基苯基)-1,1,1,3,3,3-六氟丙烷、2,2-双
(4-氨基苯基)-1,1,1,3,3,3-六氟丙烷、3,3
’‑
二氨基二苯基亚砜、3,4
’‑
二氨基二苯基亚砜、4,4
’‑
二氨基二苯基亚砜等2个苯核的二胺;
[0242]
3)1,3-双(3-氨基苯基)苯、1,3-双(4-氨基苯基)苯、1,4-双(3-氨基苯基)苯、1,4-双(4-氨基苯基)苯、1,3-双(4-氨基苯氧基)苯、1,4-双(3-氨基苯氧基)苯、1,4-双(4-氨基苯氧基)苯、1,3-双(3-氨基苯氧基)-4-三氟甲基苯、3,3
’‑
二氨基-4-(4-苯基)苯氧基二苯甲酮、3,3
’‑
二氨基-4,4
’‑
二(4-苯基苯氧基)二苯甲酮、1,3-双(3-氨基苯硫醚)苯、1,3-双(4-氨基苯硫醚)苯、1,4-双(4-氨基苯硫醚)苯、1,3-双(3-氨基苯基砜)苯、1,3-双(4-氨基苯基砜)苯、1,4-双(4-氨基苯基砜)苯、1,3-双〔2-(4-氨基苯基)异丙基〕苯、1,4-双〔2-(3-氨基苯基)异丙基〕苯、1,4-双〔2-(4-氨基苯基)异丙基〕苯等3个苯核的二胺;
[0243]
4)3,3
’‑
双(3-氨基苯氧基)联苯、3,3
’‑
双(4-氨基苯氧基)联苯、4,4
’‑
双(3-氨基苯氧基)联苯、4,4
’‑
双(4-氨基苯氧基)联苯、双〔3-(3-氨基苯氧基)苯基〕醚、双〔3-(4-氨基苯氧基)苯基〕醚、双〔4-(3-氨基苯氧基)苯基〕醚、双〔4-(4-氨基苯氧基)苯基〕醚、双〔3-(3-氨基苯氧基)苯基〕酮、双〔3-(4-氨基苯氧基)苯基〕酮、双〔4-(3-氨基苯氧基)苯基〕酮、双〔4-(4-氨基苯氧基)苯基〕酮、双〔3-(3-氨基苯氧基)苯基〕硫醚、双〔3-(4-氨基苯氧基)苯基〕硫醚、双〔4-(3-氨基苯氧基)苯基〕硫醚、双〔4-(4-氨基苯氧基)苯基〕硫醚、双〔3-(3-氨基苯氧基)苯基〕砜、双〔3-(4-氨基苯氧基)苯基〕砜、双〔4-(3-氨基苯氧基)苯基〕砜、双〔4-(4-氨基苯氧基)苯基〕砜、双〔3-(3-氨基苯氧基)苯基〕甲烷、双〔3-(4-氨基苯氧基)苯基〕甲烷、双〔4-(3-氨基苯氧基)苯基〕甲烷、双〔4-(4-氨基苯氧基)苯基〕甲烷、2,2-双〔3-(3-氨基苯氧基)苯基〕丙烷、2,2-双〔3-(4-氨基苯氧基)苯基〕丙烷、2,2-双〔4-(3-氨基苯氧基)苯基〕丙烷、2,2-双〔4-(4-氨基苯氧基)苯基〕丙烷、2,2-双〔3-(3-氨基苯氧基)苯基〕-1,1,1,3,3,3-六氟丙烷、2,2-双〔3-(4-氨基苯氧基)苯基〕-1,1,1,3,3,3-六氟丙烷、2,2-双〔4-(3-氨基苯氧基)苯基〕-1,1,1,3,3,3-六氟丙烷、2,2-双〔4-(4-氨基苯氧基)苯基〕-1,1,1,3,3,3-六氟丙烷等4个苯核的二胺。
[0244]
它们可以单独使用,也可以混合使用2种以上。所用的二胺可根据期望的特性等来适当选择。
[0245]
这些之中,优选为芳香族二胺化合物,可适当地使用3,3
’‑
二氨基二苯基醚、3,4
’‑
二氨基二苯基醚、4,4
’‑
二氨基二苯基醚和对苯二胺、1,3-双(3-氨基苯基)苯、1,3-双(4-氨基苯基)苯、1,4-双(3-氨基苯基)苯、1,4-双(4-氨基苯基)苯、1,3-双(4-氨基苯氧基)苯、1,4-双(3-氨基苯氧基)苯。特别优选为选自由苯二胺、二氨基二苯基醚和双(氨基苯氧基)苯组成的组中的至少一种二胺。
[0246]
从耐热性、高温下的尺寸稳定性的观点出发,本发明可使用的聚酰亚胺多孔膜优选由玻璃化转变温度为240℃以上或在300℃以上没有明确的转变温度的、将四羧酸二酐和二胺组合得到的聚酰亚胺来形成。
[0247]
从耐热性、高温下的尺寸稳定性的观点出发,本发明可使用的聚酰亚胺多孔膜优选为由以下的芳香族聚酰亚胺形成的聚酰亚胺多孔膜。
[0248]
(i)由选自由联苯四羧酸单元和均苯四酸单元组成的组中的至少一种四羧酸单元与芳香族二胺单元形成的芳香族聚酰亚胺;
[0249]
(ii)由四羧酸单元与选自由苯二胺单元、二氨基二苯基醚单元和双(氨基苯氧基)苯单元组成的组中的至少一种芳香族二胺单元形成的芳香族聚酰亚胺;和/或
[0250]
(iii)由选自由联苯四羧酸单元和均苯四酸单元组成的组中的至少一种四羧酸单元与选自由苯二胺单元、二氨基二苯基醚单元和双(氨基苯氧基)苯单元组成的组中的至少一种芳香族二胺单元形成的芳香族聚酰亚胺。
[0251]
本发明中使用的聚酰亚胺多孔膜优选具备具有多个孔的表面层a和表面层b、以及夹持于前述表面层a和表面层b之间的大孔隙层的三层结构,其中,存在于前述表面层a的孔的平均孔径为0.01μm~15μm,存在于前述表面层b的孔的平均孔径为20μm~100μm,前述大孔隙层具有与前述表面层a和b结合的隔壁、以及被该隔壁及前述表面层a和b包围的多个大孔隙,前述大孔隙层的隔壁以及前述表面层a和b的厚度为0.01~20μm,前述表面层a和b中的孔与大孔隙连通,总膜厚为5~500μm,孔隙率为40%以上且小于95%。其中,大孔隙层中的至少1个隔壁具有将邻接的大孔隙彼此连通且平均孔径为0.01~100μm、优选为0.01~50μm的1个或多个孔。
[0252]
例如,国际公开第2010/038873号、日本特开2011-219585号公报或日本特开2011-219586号公报中记载的聚酰亚胺多孔膜也可用于本发明。
[0253]
5-2.聚醚砜(pes)多孔膜
[0254]
本发明可使用的pes多孔膜包含聚醚砜,典型而言,实质上由聚醚砜组成。聚醚砜可以利用本领域技术人员公知的方法来合成,可通过例如下述方法等来制造:使二元酚、碱金属化合物和二卤代二苯基化合物在有机极性溶剂中发生缩聚反应的方法;预先合成二元酚的碱金属二盐,并使其与二卤代二苯基化合物在有机极性溶剂中发生缩聚反应的方法。
[0255]
作为碱金属化合物,可列举出碱金属碳酸盐、碱金属氢氧化物、碱金属氢化物、碱金属醇盐等。特别优选为碳酸钠和碳酸钾。
[0256]
作为二元酚化合物,可列举出对苯二酚、邻苯二酚、间苯二酚、4,4
’‑
联苯酚、双(羟基苯基)烷烃类(例如2,2-双(羟基苯基)丙烷和2,2-双(羟基苯基)甲烷)、二羟基二苯基砜类、二羟基二苯基醚类、或者它们的苯环中的至少1个氢被甲基、乙基、丙基等低级烷基、或甲氧基、乙氧基等低级烷氧基取代而得的化合物。作为二元酚化合物,可以将两种以上的上述化合物混合使用。
[0257]
聚醚砜可以为市售品。作为市售品的例子,可列举出sumika excel 7600p、sumika excel 5900p(以上为住友化学株式会社制)等。
[0258]
关于聚醚砜的对数粘度,从良好地形成多孔聚醚砜膜的大孔隙的观点出发,优选为0.5以上、更优选为0.55以上,从多孔聚醚砜膜的制造容易性的观点出发,优选为1.0以下、更优选为0.9以下、进一步优选为0.8以下、特别优选为0.75以下。
[0259]
此外,从耐热性、高温下的尺寸稳定性的观点出发,pes多孔膜或作为其原料的聚醚砜的玻璃化转变温度优选为200℃以上、或观察不到明确的玻璃化转变温度。
[0260]
本发明可使用的pes多孔膜的制造方法没有特别限定,可以通过例如下述方法来制造,所述方法包括如下工序:
[0261]
将包含对数粘度为0.5~1.0的聚醚砜0.3质量%~60质量%和有机极性溶剂40质量%~99.7质量%的聚醚砜溶液流延成膜状,并使其浸渍于以聚醚砜的不良溶剂或非溶剂作为必须成分的凝固溶剂或与该凝固溶剂接触,从而制作具有孔隙的凝固膜的工序;以及
[0262]
对通过前述工序得到的具有孔隙的凝固膜进行热处理而使前述孔隙粗大化,从而得到pes多孔膜的工序,
[0263]
前述热处理包括使前述具有孔隙的凝固膜升温至前述聚醚砜的玻璃化转变温度以上或240℃以上。
[0264]
本发明可使用的pes多孔膜优选具有表面层a、表面层b、以及夹持于前述表面层a与前述表面层b之间的大孔隙层,
[0265]
前述大孔隙层具有与前述表面层a和b结合的隔壁、以及被该隔壁及前述表面层a和b包围且膜平面方向的平均孔径为10μm~500μm的多个大孔隙,
[0266]
前述大孔隙层的隔壁的厚度为0.1μm~50μm,
[0267]
前述表面层a和b各自的厚度为0.1μm~50μm,
[0268]
前述表面层a和b之中,一者具有平均孔径超过5μm且为200μm以下的多个细孔,且另一者具有平均孔径为0.01μm以上且小于200μm的多个细孔,
[0269]
表面层a和表面层b中的一者的表面开口率为15%以上,另一个表面层的表面开口率为10%以上,
[0270]
前述表面层a和前述表面层b的前述细孔与前述大孔隙连通,
[0271]
前述pes多孔膜的总膜厚为5μm~500μm,且孔隙率为50%~95%。
[0272]
6.细胞在细胞培养模块中的应用
[0273]
细胞在细胞培养模块中的应用的具体工序没有特别限定。可以采用本说明书中记载的工序或适于将细胞应用于膜状的载体的任意的方法。并非进行限定,在本发明的方法中,细胞在细胞培养模块中的应用例如包括以下那样的方式。包括:
[0274]
(1)将包含所悬浮的细胞的第1培养基用于细胞培养模块的工序。
[0275]
(2)将前述细胞培养模块维持在能培养细胞的温度,使前述细胞吸附于前述细胞培养模块中的聚合物多孔膜上的工序;及
[0276]
(3)在培养容器中用第2培养基培养吸附有前述细胞的前述细胞培养模块的工序。
[0277]
将使用了细胞培养模块的细胞培养的模型图示于图7。图7是用于辅助理解的图,各要素并非实际尺寸。本发明的细胞的培养方法中,通过将细胞应用于细胞培养模块并进行培养,从而大量的细胞生长在聚合物多孔膜所具有的内部的多面连接多孔部分、表面,因此能够简便地培养大量的细胞。另外,在本发明的细胞的培养方法中,能够比现有的方法大幅减少细胞培养中使用的培养基的量且能够培养大量的细胞。例如,即使在聚合物多孔膜的一部分或整体不与细胞培养基的液相接触的状态下,也能够长期培养大量的细胞。另外,相对于包括细胞存活区域在内的聚合物多孔膜体积的总和,也能够显著减少细胞培养容器中包含的细胞培养基的总体积。
[0278]
本说明书中,将不包含细胞的聚合物多孔膜连同其内部间隙的体积在内在空间中所占的体积称为“表观上聚合物多孔膜体积”(参照图7)。此外,将细胞应用于聚合物多孔膜,在聚合物多孔膜的表面和内部负载有细胞的状态下,将聚合物多孔膜、细胞、和浸润至聚合物多孔膜内部的培养基作为一个整体,将该整体在空间中所占的体积称为“包括细胞存活区域在内的聚合物多孔膜体积”(参照图1)。膜厚25μm的聚合物多孔膜的情况下,包括细胞存活区域在内的聚合物多孔膜体积变为比表观上聚合物多孔膜体积最多大50%左右的值。在本发明的方法中,虽然可以在1个细胞培养容器中收纳多个聚合物多孔膜来进行培养,但在此情况下,有时将负载有细胞的多个聚合物多孔膜各自的、包括细胞存活区域在内的聚合物多孔膜体积的总和简记为“包括细胞存活区域在内的聚合物多孔膜体积的总和”。
[0279]
通过使用前述细胞培养模块,从而在细胞培养容器中包含的细胞培养基的总体积为包括细胞存活区域在内的聚合物多孔膜体积的总和的10000倍或更少的条件下,也能够长期良好地培养细胞。另外,即使在细胞培养容器中包含的细胞培养基的总体积为包括细胞存活区域在内的聚合物多孔膜体积的总和的1000倍或更少的条件下,也能够长期良好地培养细胞。进而,即使在细胞培养容器中包含的细胞培养基的总体积为包括细胞存活区域在内的聚合物多孔膜体积的总和的100倍或更少的条件下,也能够长期良好地培养细胞。此外,即使在细胞培养容器中包含的细胞培养基的总体积为包括细胞存活区域在内的聚合物多孔膜体积的总和的10倍或更少的条件下,也能够长期良好地培养细胞。
[0280]
即,根据本发明,与现有的进行二维培养的细胞培养装置相比,能使进行细胞培养的空间(容器)小型化至极限。另外,希望增加待培养的细胞数时,通过增加所层叠的聚合物多孔膜的张数等简便的操作,能够灵活地增加待细胞培养的体积。只要是本发明中使用的具备聚合物多孔膜的细胞培养装置,就能够将培养细胞的空间(容器)与贮藏细胞培养基的空间(容器)分开,能够根据待培养的细胞数,准备所需量的细胞培养基。贮藏细胞培养基的空间(容器)可以根据目的而大型化或小型化,或者也可以是可更换的容器,没有特别限定。
[0281]
本发明的方法中,例如,对于在使用聚合物多孔膜培养后细胞培养容器中包含的细胞数,以全部细胞均匀地分散在细胞培养容器中包含的细胞培养基计,可以培养至每1毫升培养基达到1.0
×
105个以上、1.0
×
106个以上、2.0
×
106个以上、5.0
×
106个以上、1.0
×
107个以上、2.0
×
107个以上、5.0
×
107个以上、1.0
×
108个以上、2.0
×
108个以上、5.0
×
108个以上、1.0
×
109个以上、2.0
×
109个以上、或5.0
×
109个以上。
[0282]
本说明书中,“培养基”是指:用于培养细胞、特别是动物细胞的细胞培养基。培养基可用作与细胞培养液的同义词。因此本发明中使用的培养基是指液体培养基。培养基的种类可以使用通常使用的培养基,可根据待培养的细胞的种类进行适宜确定。
[0283]
本发明的细胞的培养中,该工序(1)中使用的第1培养基只要是能够培养细胞的培养基就没有特别限定,例如,培养cho细胞的情况下,可以使用irvine scientific公司制造的balancd(商标)cho growth a。
[0284]
本发明的细胞的培养中,该工序(2)的能培养细胞的温度只要是细胞能吸附至聚合物多孔膜上的温度即可,为10℃~45℃、优选为15℃~42℃、更优选为20℃~40℃、进一步优选为25℃~39℃。另外,本发明的细胞的培养方法中,该工序(2)的吸附细胞的时间例如为5分钟~24小时,优选为10分钟~12小时,更优选为15分钟~500分钟。
[0285]
本发明的细胞的培养中,该工序(2)可以边进行振荡和/或搅拌,边使细胞吸附至该细胞培养模块的该聚合物多孔膜上,也可以进行静置而使细胞吸附至该细胞培养模块的该聚合物多孔膜上。进行振荡的方法没有特别限定,例如,可以将包含本发明的细胞培养模块和细胞的培养容器载置于市售的振荡装置上进行振荡。振荡可以连续或间歇地进行,例如,也可以交替地重复振荡和静置,进行适宜调整即可。进行搅拌的方法没有特别限定,例如,可以通过将本发明的细胞培养模块和细胞放入市售的旋转瓶内并使搅拌棒旋转,从而进行搅拌。搅拌可以连续或间歇地进行,例如,也可以交替地重复搅拌和静置,进行适宜调整即可。
[0286]
本发明的细胞的培养中,该工序(3)中使用的第2培养基可选择粘附细胞的培养中使用的培养基,例如可以使用d-mem、e-mem、imdm、ham’s f-12等,但不限定于此。第2培养基
优选不包含抑制细胞粘附于基材上的成分、例如表面活性剂的培养基。所使用的第2培养基可根据细胞的种类进行适宜选择。该工序(3)中,通过在第2培养基中进行培养,从而促进在该工序(2)中吸附于聚合物多孔膜上的细胞粘附于该聚合物多孔性膜内。由此,能够稳定地进行培养而细胞不会从该聚合物多孔膜上脱落。另外,本发明的细胞的培养方法使用具备前述的聚合物多孔膜的细胞培养模块。本发明的细胞的培养方法中使用的细胞培养模块通过将聚合物多孔膜收纳于壳体中,从而防止了膜状的聚合物多孔膜在壳体内形态连续发生变形。由此,可防止对在聚合物多孔膜内生长的细胞施加应力,抑制凋亡等而能够稳定且大量地培养细胞。
[0287]
本发明的细胞的培养中,该工序(3)只要是培养细胞的培养装置和系统等,就可以使用市售者。例如,培养容器可以为挠性袋式培养容器,另外,也可以在搅拌型培养容器、例如旋转瓶等培养容器中进行培养。此外,作为培养容器,可用于敞口容器也可用于封闭容器。从例如细胞培养用的培养盘、烧瓶、塑料袋、试管到大型的罐均可适当利用。包括例如bd falcon公司制的细胞培养皿(cell culture dish)、thermo scientific公司制的nunc细胞工厂等。另外,本发明的细胞的培养方法中,通过使用细胞培养模块,从而对于原本无法进行悬浮培养的细胞而言,也能够在面向悬浮培养的装置中进行在类似悬浮培养的状态下的培养。作为悬浮培养用的装置,例如可以使用corning incorporated制的旋转瓶、旋转培养等。另外,该工序(3)也可以在本说明书中记载的细胞培养装置中实施。
[0288]
本发明的细胞的培养中,该工序(3)也可以使用向包含该细胞培养模块的培养容器中连续地添加培养基并回收那样的连续循环型的装置来执行。
[0289]
本发明的细胞的培养中,该工序(3)中,可以是从设置在包含该细胞培养模块的培养容器外部的细胞培养基供给单元连续或间歇地向细胞培养容器中供给细胞培养基的系统。此时,可以是细胞培养基在细胞培养基供给单元与细胞培养容器之间循环的系统。
[0290]
7.细胞的培养/外泌体产生系统和培养条件
[0291]
本发明的方法中,细胞的培养/外泌体产生系统和培养条件可以根据细胞的种类等进行适宜确定。适于各细胞的培养方法是公知的,本领域技术人员可以使用任意公知的方法来培养适于细胞培养模块的细胞。细胞培养基也可以根据细胞的种类进行适宜制备。
[0292]
本发明的方法中,培养中使用的系统的形状、规模等没有特别限定,从细胞培养用的培养盘、烧瓶、塑料袋、试管到大型的罐均可以适宜利用。例如,包括bd falcon公司制的细胞培养皿、thermo scientific公司制的nunc细胞工厂等。需要说明的是,本发明中通过使用聚酰亚胺多孔膜,从而对于原本无法进行悬浮培养的细胞而言,也能够在面向悬浮培养的装置中进行在类似悬浮培养状态下的培养。作为悬浮培养用的装置,例如可以使用corning incorporated制的旋转瓶、旋转培养等。
[0293]
本发明中,也可以在静置培养条件下培养细胞。通过间歇地更换培养基,从而能够将所产生的外泌体分离。另外,本发明中,也可以在旋转培养或搅拌条件下培养细胞。在旋转培养/旋转瓶中的搅拌培养也是同样的。另外,在这些各方法中,也可以安装连续或间歇的培养基更换系统,以长期培养为目标。
[0294]
本发明中,也可以连续地培养细胞。例如,本发明的方法中的培养也可以使用向细胞培养模块中连续地添加培养基并回收那样的连续循环或开放型的装置,以使聚合物多孔膜暴露在空气中那样的形式来执行。
[0295]
本发明中,细胞的培养也可以在从设置于细胞培养容器外的细胞培养基供给单元连续或间歇地向细胞培养容器中供给细胞培养基的系统中进行。此时,可以是使细胞培养基在细胞培养基供给单元与细胞培养容器之间循环的系统。
[0296]
本发明包括如下方式,所述方式包括将细胞培养装置设置于培养箱内来培养细胞。在从设置于细胞培养容器外的细胞培养基供给单元连续或间歇地向细胞培养容器中供给细胞培养基的系统中进行时,该系统可以是:一种细胞培养装置,可以包括作为细胞培养容器的培养单元和作为细胞培养基供给单元的培养基供给单元,其中,培养单元收纳用于负载细胞的1个或多个细胞培养模块且具备培养基供给口和培养基排出口,培养基供给单元具备:培养基收纳容器、培养基供给管线、及通过培养基供给管线来输送培养基的送液泵,其中,培养基供给管线的第一端部与培养基收纳容器内的培养基接触,培养基供给管线的第二端部通过培养单元的培养基供给口与培养单元内连通。
[0297]
另外,上述细胞培养装置中,培养单元可以是不具备培养基供给管线、送液泵、空气供给口和空气排出口的培养单元,另外,可以是具备培养基供给管线、送液泵、空气供给口和空气排出口的培养单元。培养单元可以不具备空气供给口和空气排出口。进而可以是:上述细胞培养装置中,培养单元进一步具备培养基排出管线,其中,培养基排出管线的第一端部与培养基收纳容器连接,培养基排出管线的第二端部通过培养单元的培养基排出口与培养单元内连通,培养基能够在培养基供给单元和培养单元中循环。
[0298]
8.通过细胞产生外泌体
[0299]
本发明中,通过如上所述培养细胞,从而由细胞产生外泌体。所产生的外泌体可以利用公知的方法回收。由于外泌体由细胞分泌,因此能够从细胞培养基中回收物质。
[0300]
本发明的方法中,细胞培养工序和外泌体产生工序可以是分开或不分开的工序。例如,在将细胞应用于细胞培养模块并开始进行细胞培养的时间点,细胞产生了外泌体,因此在如从培养开始到结束为止从细胞中连续地回收外泌体那样设计生产系统时,成为同时实施细胞培养工序和外泌体产生工序。或者,在细胞培养与外泌体产生之间,例如培养基组成、培养装置的设定等不同的情况下,在细胞培养工序结束后切换成设计为用于产生外泌体的培养条件,因此使两工序分开。
[0301]
本发明的方法中,培养细胞能够长期连续地产生品质均一的外泌体。优选为本发明的方法中,产生外泌体的工序可在1个月、2个月、3个月或6个月或更长的时间内持续。优选为本发明的方法中,在外泌体产生期间,评价细胞所产生的外泌体的分子谱、生理活性。
[0302]
ii.外泌体产生装置
[0303]
本发明还涉及:包含细胞培养模块且用于本发明的方法的通过细胞培养而产生外泌体的装置。在本发明的外泌体产生装置中,细胞培养模块可以被固定而使用,或者也可以悬浮于细胞培养基中,可以置于培养基中,也可以从培养基中暴露出来。
[0304]
作为本发明的细胞培养中的外泌体产生装置,只要包含细胞培养模块就可以采用任意的形态,可以使用公知的细胞培养装置。培养装置的形状、规模等没有特别限定,从培养盘、试管到大型的罐均可以适宜利用。例如,包括bd falcon公司制的细胞培养皿、thermo scientific公司制的nunc细胞工厂等。需要说明的是,本发明中通过使用聚合物多孔膜,从而对于原本无法进行悬浮培养的细胞而言,也能够在面向悬浮培养的装置中进行在类似悬浮培养的状态下的培养。作为悬浮培养用的装置,例如可以使用corning incorporated制
的旋转瓶、旋转培养等。
[0305]
本发明的基于培养细胞的外泌体产生装置也可以是将培养基连续地添加至细胞培养模块上并进行回收那样的连续循环或开放型的装置,以使聚合物多孔膜片暴露在空气中那样的形式执行。
[0306]
本发明的方法中可以进一步设置用于更高浓度地回收细胞所产生的外泌体的单元。例如,通过将半透膜等直接连接到循环式添加培养基上,从而边去除乳酸等不需要的物质,边追加糖类、氨基酸类,能够构建高效的长期的培养法及不需要的物质去除法。
[0307]
iii.试剂盒
[0308]
本发明还涉及:包含细胞培养模块且用于本发明的方法的试剂盒。本发明的试剂盒除了细胞培养模块之外,可以适宜包含细胞培养、外泌体产生、外泌体回收所需的构成要素。例如,包括应用于细胞培养模块的细胞、细胞培养基、连续培养基供给装置、连续培养基循环装置、细胞培养装置、用于确认外泌体产生的评价单元、外泌体回收单元(例如,超离心、超滤、免疫沉淀、色谱等)、试剂盒的处理说明书等。
[0309]
iv.应用
[0310]
本发明还包括细胞培养模块的用于上述的本发明的方法的应用。
[0311]
v.外泌体
[0312]
本发明还包括利用本发明的方法而得到的外泌体。
[0313]
以下,基于实施例对本发明进行详细地说明,但本发明不限定于这些实施例。本领域技术人员可以基于本说明书的记载容易地对本发明进行修饰/变更,这些包括在本发明的技术的范围内。
[0314]
实施例
[0315]
以下的实施例中使用的聚合物多孔膜为聚酰亚胺多孔膜,通过如下方法制备:将包含由作为四羧酸成分的3,3’,4,4
’‑
联苯四羧酸二酐(s-bpda)和作为二胺成分的4,4
’‑
二氨基二苯基醚(oda)得到的聚酰胺酸溶液以及作为着色前体的聚丙烯酰胺的聚酰胺酸溶液组合物成型后,在250℃以上进行热处理,由此制备。所得聚酰亚胺多孔膜具备具有多个孔的表面层a和表面层b、以及夹持于该表面层a和表面层b之间的大孔隙层的三层结构,存在于表面层a的孔的平均孔径为19μm,存在于表面层b的孔的平均孔径为42μm,膜厚为25μm,孔隙率为74%。
[0316]
另外,以下的实施例中使用的模块化聚合物多孔膜(以下的实施例中,称为“模块”。)使用如下操作所得者,在单面具有16个2mm
×
2mm的培养基流入流出口的聚乙烯制的壳体中依次层叠并收纳以下的多孔膜:1.0
×
1.0cm的正方形的聚酰亚胺多孔膜6张;1.0
×
1.0cm的垫板(聚丙烯/聚乙烯、nbc meshtec inc.制、型号:esp10tc);1.0
×
1.0cm的正方形的聚酰亚胺多孔膜6张;1.0
×
1.0cm的垫板(聚丙烯/聚乙烯、nbc meshtec inc.制、型号:esp10tc);1.0
×
1.0cm的正方形的聚酰亚胺多孔膜6张。没有特别记载时,模块是指上述结构。
[0317]
另外,记载中指定为“2型模块”的实施例中,使用如下操作所得者:在单面具有16个2mm
×
2mm的培养基流入流出口的聚乙烯制的壳体中依次层叠并收纳以下的多孔膜:1.0
×
1.0cm的正方形的聚酰亚胺多孔膜4张;1.0
×
1.0cm的垫板(聚丙烯/聚乙烯、nbc meshtec inc.制、型号:esp10tc);1.0
×
1.0cm的正方形的聚酰亚胺多孔膜4张;1.0
×
1.0cm的垫板
(聚丙烯/聚乙烯、nbc meshtec inc.制、型号:esp10tc);1.0
×
1.0cm的正方形的聚酰亚胺多孔膜4张;1.0
×
1.0cm的垫板(聚丙烯/聚乙烯、nbc meshtec inc.制、型号:esp10tc);1.0
×
1.0cm的正方形的聚酰亚胺多孔膜4张;1.0
×
1.0cm的垫板(聚丙烯/聚乙烯、nbc meshtec inc.制、型号:esp10tc);1.0
×
1.0cm的正方形的聚酰亚胺多孔膜4张。
[0318]
比较例1:使用了培养皿的细胞培养法
[0319]
对于在iwaki i型胶原蛋白涂层培养皿中培养的第2代的间充质干细胞(y25 male_451491)使用thermo fisher scientific公司制tryple(商标)select将细胞剥离,悬浮在培养基(kohjin bio公司制无异源培养基;kbm adsc-4)中。将细胞悬浮液(总数;3.0
×
105个细胞)接种在iwaki i型胶原蛋白涂层培养皿60cm2中,在设定在co25%、37℃的co2培养箱内静置约16小时使细胞粘附后,用前述培养基(kbm adsc-4)12ml进行培养基更换。然后,从培养开始起第6天更换培养基,连续进行13天培养。
[0320]
按照后述的“使用了zeta电位/粒径分布测定装置的外泌体量测定”的步骤测定培养天数第6天和第13天回收的细胞培养液中包含的平均每天所产生的外泌体数,将结果示于图18的a,将培养天数第13天的粒径分布测定的结果示于图18的b。
[0321]
实施例1:在corning incorporated制150ml圆形存储瓶中使用了模块的细胞培养法(培养瓶(5%氧气))
[0322]
在放有5个模块的corning incorporated制150ml圆形存储瓶中加入培养基(kohjin bio公司制无异源培养基;kbm adsc-4)50ml后,设置于设定在co25%、o25%、37℃的kuhner公司制培养箱摇床(lab-therm lt-xc)内,以转速100rpm搅拌约1小时,使模块湿润。
[0323]
对于在iwaki i型胶原蛋白涂层培养皿中培养的第2代的间充质干细胞(y25 male_451491)使用thermo fisher scientific公司制tryple(商标)select将细胞剥离,悬浮在前述培养基(kbm adsc-4)中。将相对于模块内部的培养基材聚酰亚胺多孔膜的平均每1cm2面积为2.0
×
104个细胞(总数;1.80
×
106个细胞)的细胞悬浮液加入存储瓶内,边以转速100rpm进行搅拌边用约16小时使细胞吸附于模块上后,用前述培养基(kbm adsc-4)50ml进行培养基更换。在从培养开始起6天后进行培养基更换,之后以每3天或每4天一次的频率进行培养基更换。
[0324]
按照后述的“使用了zeta电位/粒径分布测定装置的外泌体量测定”的步骤测定从培养开始起至培养天数27天为止的细胞培养液中包含的平均每天所产生的外泌体数,将结果示于图19a,将培养天数第27天的粒径分布测定的结果示于图的19b。确认在约1个月的长期连续培养中,也稳定地产生外泌体。
[0325]
实施例2:在corning incorporated制150ml圆形存储瓶中使用了模块的细胞培养法(培养瓶(普通氧气))
[0326]
在设定在co25%、37℃的搭载有n-biotek公司制可加湿摇床的co2培养箱(anicell)内设置corning incorporated制150ml圆形存储瓶,除此以外按照与实施例1(培养瓶(5%氧气))同样的操作进行细胞培养。
[0327]
按照后述的“使用了zeta电位/粒径分布测定装置的外泌体量测定”的步骤测定从培养开始起至培养天数27天为止的细胞培养液中包含的平均每天所产生的外泌体数,将结果示于图20a,将培养天数第27天的粒径分布测定的结果示于图的20b。确认在约1个月的长
chemical corporation制_含谷氨酰胺/酚红湿润24小时以上的模块200个,加入培养基(kohjin bio co.,ltd.制无异源培养基;kbm adsc-4)200ml,设置在ge公司制wave反应器(readytoprocess wave25)中后,在co25%、温度37℃、振动速度15rpm、振动角度9
°
的条件下搅拌约1小时使模块湿润。
[0339]
使用gibco公司制胰蛋白酶-edta(0.05%),酚红将在培养皿中培养的第3代的间充质干细胞(y25 male_18tl262066)剥离,悬浮在培养基(fujifilm wako pure chemical corporation制;dmem)中。在刚接种相对于模块内部的培养基材聚酰亚胺多孔膜的平均每1cm2面积为2.0
×
104个细胞(总数:7.20
×
107个细胞)的细胞悬浮液后,立即追加培养基(kohjin bio公司制无异源培养基;kbm adsc-4)以使ge公司制wave培养袋内的液量成为300ml,在与模块湿润时相同振动条件下吸附细胞约27小时。
[0340]
然后,利用反应器的灌注功能(袋重量管理功能),从ge公司制wave培养袋内经由harvest管泵将细胞培养液以350ml/天的速度排出,将与该排出的培养基相同体积的前述培养基(kbm adsc-4)经由进料管泵输送至ge公司制wave培养袋内。对于回收的培养基,使用roche公司制cedexbio,通过各代谢参数的变化来观察细胞生长行为,观察到长期稳定的细胞的增殖/生长。葡萄糖消耗和乳酸产生量的经时变化示于图25a。
[0341]
按照后述的“使用了zeta电位/粒径分布测定装置的外泌体量测定”的步骤测定回收的细胞培养液中包含的平均每天所产生的外泌体数,将结果示于图25b,将培养天数第39天的粒径分布测定结果示于图25c。确认在约1个月的长期连续培养中,也稳定地产生外泌体。
[0342]
将比较例和实施例中所示的细胞培养天数第13天的各种培养法中的1细胞1天内所产生的外泌体数的比较示于图26。确认:模块培养与培养皿培养相比,平均每个细胞的外泌体产生力非常高。
[0343]
使用了zeta电位/粒径分布测定装置的外泌体量测定
[0344]
对于在比较例1和实施例1~5的培养条件下回收的细胞培养液,使用高速冷却离心机(久保田商事株式会社制、model 6000)在4℃下以30分钟、10000g进行离心分离,去除了碎片(制备液1)。使用通过利用了0.025μm的过滤器(merck公司制、产品名称:mf-微孔膜过滤器、型号:vswp04700)的抽滤去除了微粒的pbs(-)(fujifilm wako pure chemical corporation制、商家代码:166-23555),将“制备液1”稀释成规定的浓度(制备液2)。接着,对于“制备液2”,使用0.2μm的注射器过滤器(sartorius公司制、产品名称:minisart、型号:16534k)去除了200nm以上的颗粒(制备液3)。使用zeta电位/粒径分布测定装置(microtech nichion co.,ltd.制、zeecom zc-3000),基于布朗运动轨迹分析,测定了“制备液3”中包含的颗粒的粒径分布和外泌体级分的颗粒数。
[0345]
在回收要测定外泌体的培养基的时机,使用株式会社同仁化学研究所制的cell counting kit-8测定细胞数,根据下述“式1”计算出1个细胞平均每天所产生的外泌体量,对各细胞培养条件下的细胞的外泌体产生能力进行了比较。
[0346]
式1:
[0347]
颗粒数
×
样品稀释倍率
×
150nm以下的颗粒的比例
×
回收培养基量/总细胞数/培养基储存天数
[0348]
根据下述“式2”测定了各细胞培养条件下的平均每天的外泌体生产量的经时变
化。
[0349]
式2:
[0350]
颗粒数
×
样品稀释率
×
150nm以下的颗粒的比例/培养基储存天数
[0351]
使用了genechip(商标)mirna 4.0阵列的mirna阵列解析
[0352]
对于在比较例1和实施例1~5的培养条件下回收的细胞培养液,使用高速冷却离心机(久保田商事株式会社制、model 6000)在4℃下以30分钟、10000g进行离心分离,去除了碎片。对于得到的上清液8ml,使用总外泌体分离试剂(来自细胞培养基)(thermo fisher scientific公司制、cat.#4478359),利用聚合物沉淀法从上清液中提取外泌体。接着,使用总外泌体rna和蛋白质分离试剂盒(thermo fisher scientific公司制、cat.#4478545)从外泌体提取液中将总rna提取和纯化后,利用nano drop 2000(thermo fisher scientific公司制)测定了总rna溶液的浓度。使用得到的总rna 390ng,通过genechip(商标)mirna 4.0阵列(thermo fisher scientific公司制、cat.#902445)进行人mirna阵列解析。
[0353]
比较例1(培养皿_第6天)和实施例1(培养瓶(5%氧气)_第27天)的外泌体产生量比较和mirna阵列解析
[0354]
将比较例1(培养皿_第6天)和实施例1(培养瓶(5%氧气)_第27天)的平均每个细胞的外泌体产生量的比较示于图27。确认了:与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的培养瓶(5%氧气)培养即使在长期连续稳定培养状态下也是外泌体产生能力高2.8倍的状态。
[0355]
将比较例1(培养皿_第6天)和实施例1(培养瓶(5%氧气)_第27天)的mirna阵列解析的散点图示于图28,将观察到10倍以上的mirna的表达比差异的mirna示于表1。
[0356]
[表1]
[0357]
表1.观察到10倍以上的表达比的差异的mirna
[0358][0359]
将专利文献2中记载的作为对损伤或患病的心脏组织的治疗有效的mirna的hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的散点图示于图29。与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的培养瓶(5%氧气)培养即使在长期连续稳定培养状态下hsa-mir-210-3p也示出4.0倍、hsa-mir-24a-3p也示出17.5倍的高产生量,关于其它mirna,为同等程度的表达量。
[0360]
将专利文献3中记载的作为对抑制口腔鳞状细胞癌有效的mirna的hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果示于图30。与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的培养瓶(5%氧气)培养即使在长期连续稳定培养状态下hsa-mir-193a-5p也示出5.8倍的高产生量,关于其它mirna,为同等程度的表达量。
[0361]
将非专利文献6和非专利文献7中记载的作为对抑制胃细胞癌或前列腺癌细胞有效的mirna的hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果示于图31。与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的培养瓶(5%氧气)培养即使在长期连续稳定培养状态下hsa-mir-26a-5p也示出36.6倍、hsa-mir-23b-3p也示出15.4倍的高产生量,关于其它mirna,为同等程度的表达量。
[0362]
比较例1(培养皿_第13天)和实施例1(培养瓶(5%氧气)_第27天)的外泌体产生量比较和mirna阵列解析
[0363]
将比较例1(培养皿_第13天)和实施例1(培养瓶(5%氧气)_第27天)的平均每个细胞的外泌体产生量的比较示于图32。确认了:与培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的培养瓶(5%氧气)培养即使在长期连续稳定培养状态下也是外泌体产生能力高2.9倍的状态。
[0364]
将比较例1(培养皿_第13天)和实施例1(培养瓶(5%氧气)_第27天)的mirna阵列解析的散点图示于图33,将观察到10倍以上的mirna的表达比差异的mirna示于表2。
[0365]
[表2]
[0366]
表2.观察到10倍以上的表达比的差异的mirna
[0367][0368]
将专利文献2中记载的作为对损伤或患病的心脏组织的治疗有效的mirna的hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果示于图34。与即将到达汇合之前的培养皿_第13天相比,在长期连续稳定培养状态的使用了聚酰亚胺多孔膜模块的培养瓶(5%氧气)培养中,hsa-mir-24-3p也示出5.3倍的高产生量,关于其它mirna,为同等程度的表达量。
[0369]
将专利文献3中记载的作为对抑制口腔鳞状细胞癌有效的mirna的hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果示于图35。与即将到达汇合之前的培养皿_第13天相比,在长期连续稳定培养状态的使用了聚酰亚胺多孔膜模块的培养瓶(5%氧气)培养中,示出与培养皿_第13天同等的结果。
[0370]
将非专利文献6和非专利文献7中记载的作为对抑制胃细胞癌或前列腺癌细胞有效的mirna的hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析
的结果示于图36。与即将达到汇合之前的培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的培养瓶(5%氧气)培养即使在长期连续稳定培养状态下hsa-mir-26a-5p也示出29.1倍、hsa-mir-23b-3p也示出6.1倍的高产生量,关于其它mirna,为同等程度的表达量。
[0371]
比较例1(培养皿_第6天)和实施例2(培养瓶(普通氧气)_第27天)的外泌体产生量比较和mirna解析
[0372]
将比较例1(培养皿_第6天)和实施例2(培养瓶(普通氧气)_第27天)的平均每个细胞的外泌体产生量的比较示于图37。确认了:与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的培养瓶(普通氧气)培养即使在长期连续稳定培养状态下也是外泌体产生能力高2.5倍的状态。
[0373]
将比较例1(培养皿_第6天)和实施例2(培养瓶(普通氧气)_第27天)的mirna阵列解析的散点图示于图38,将观察到10倍以上的mirna的表达比差异的mirna示于表3。
[0374]
[表3]
[0375]
表3.观察到10倍以上的表达比的差异的mirna
[0376][0377]
将专利文献2中记载的作为对损伤或患病的心脏组织的治疗有效的mirna的hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果示于图39。与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的培养瓶(普通氧气)培养即使在长期连续稳定培养状态下hsa-mir-24-3p也示出3.9倍的高产生量,关于其它mirna,为同等程度的表达量。
[0378]
将专利文献3中记载的作为对抑制口腔鳞状细胞癌有效的mirna的hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果示于图40。使用了聚酰亚胺多孔膜模块的培养瓶(普通氧气)培养即使在长期连续稳定培养状态下也示出与培养皿_第6天同等程度的产生量。
[0379]
将非专利文献6和非专利文献7中记载的作为对抑制胃细胞癌或前列腺癌细胞有效的mirna的hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果示于图41。使用了聚酰亚胺多孔膜模块的培养瓶(普通氧气)培养即使在长期连续稳定培养状态下也与培养皿_第6天为同等程度的表达量。
[0380]
比较例1(培养皿_第13天)和实施例2(培养瓶(普通氧气)_第27天)的外泌体产生
量比较和mirna阵列解析
[0381]
将比较例1(培养皿_第13天)和实施例2(培养瓶(普通氧气)_第27天)的平均每个细胞的外泌体产生量的比较示于图42。确认了:与培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的培养瓶(普通氧气)培养即使在长期连续稳定培养状态下也是外泌体产生能力高2.6倍的状态。
[0382]
将比较例1(培养皿_第13天)和实施例2(培养瓶(普通氧气)_第27天)的mirna阵列解析的散点图示于图43,将观察到10倍以上的mirna的表达比差异的mirna示于表4。
[0383]
[表4]
[0384]
表4.观察到10倍以上的表达比的差异的mirna
[0385][0386]
将专利文献2中记载的作为对损伤或患病的心脏组织的治疗有效的mirna的hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果示于图44。与即将到达汇合之前的培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的培养瓶(普通氧气)培养即使在长期连续稳定培养状态下hsa-mir-24-3p也示出3.4倍的高产生量,关于其它mirna,为同等程度的表达量。
[0387]
将专利文献3中记载的作为对抑制口腔鳞状细胞癌有效的mirna的hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果示于图45。与使用了聚酰亚胺多孔膜模块的培养瓶(普通氧气)培养的长期连续稳定培养状态相比,即将达到汇合之前的培养皿_第13天的hsa-mir-193a-5p也示出7.0倍、hsa-mir-193b-5p也示出4.6倍和hsa-mir-193b-3p也示出4.4倍的高产生量,关于其它mirna,为同等程度
的表达量。
[0388]
将非专利文献6和非专利文献7中记载的作为对抑制胃细胞癌或前列腺癌细胞有效的mirna的hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果示于图46。与即将达到汇合之前的培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的培养瓶(普通氧气)培养即使在长期连续稳定培养状态下hsa-mir-26a-5p也示出43.8倍、hsa-mir-23b-3p也示出9.7倍、hsa-mir-26a-3p也示出3.4倍、hsa-mir-27b-3p也示出3.1倍的高产生量,关于其它mirna,为同等程度的表达量。
[0389]
比较例1(培养皿_第6天)和实施例3(反应器(5%氧气)_第27天)的外泌体产生量比较和mirna阵列解析
[0390]
将比较例1(培养皿_第6天)和实施例3(反应器(5%氧气)_第27天)的平均每个细胞的外泌体产生量的比较示于图47。确认了:与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的反应器(5%氧气)培养即使在长期连续稳定培养状态下也是外泌体产生能力高1.7倍的状态。
[0391]
将比较例1(培养皿_第6天)和实施例3(反应器(5%氧气)_第27天)的mirna阵列解析的散点图示于图48,将观察到10倍以上的mirna的表达比差异的mirna示于表5。
[0392]
[表5]
[0393]
表5.观察到10倍以上的表达比的差异的mirna
[0394][0395]
将专利文献2中记载的作为对损伤或患病的心脏组织的治疗有效的mirna的hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果示于图49。与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的反应器(5%氧气)培养即使在长期连续稳定培养状态下hsa-mir-24a-3p也示出10.3倍的高产生量,关于其它mirna,为同等程度的表达量。
[0396]
将专利文献3中记载的作为对抑制口腔鳞状细胞癌有效的mirna的hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果示于图50。使用了聚酰亚胺多孔膜模块的反应器(5%氧气)培养即使在长期连续稳定培养状态下也示出与培养皿_第6天同等程度的产生量。
[0397]
将非专利文献6和非专利文献7中记载的作为对抑制胃细胞癌或前列腺癌细胞有效的mirna的hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果示于图51。与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的反应器(5%氧气)培
养即使在长期连续稳定培养状态下hsa-mir-26a-5p也示出5.0倍、hsa-mir-23b-3p也示出5.4倍的高产生量,关于其它mirna,为同等程度的表达量。
[0398]
比较例1(培养皿_第13天)和实施例3(反应器(5%氧气)_第27天)的外泌体产生量比较和mirna阵列解析
[0399]
将比较例1(培养皿_第13天)和实施例3(反应器(5%氧气)_第27天)的平均每个细胞的外泌体产生量的比较示于图52。确认了:与培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的反应器(5%氧气)培养即使在长期连续稳定培养状态下也是外泌体产生能力高1.8倍的状态。
[0400]
将比较例1(培养皿_第13天)和实施例3(反应器(5%氧气)_第27天)的mirna阵列解析的散点图示于图53,将观察到10倍以上的mirna的表达比差异的mirna示于表6。
[0401]
[表6]
[0402]
表6.观察到10倍以上的表达比的差异的mirna
[0403][0404]
将专利文献2中记载的作为对损伤或患病的心脏组织的治疗有效的mirna的hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果示于图54。与即将达到汇合之前的培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的反应器(5%氧气)培养即使在长期连续稳定培养状态下hsa-mir-24-3p也示出3.4倍的高产生量,关于其它mirna,为同等程度的表达量。
[0405]
将专利文献3中记载的作为对抑制口腔鳞状细胞癌有效的mirna的hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果示于图55。与使用了聚酰亚胺多孔膜模块的反应器(5%氧气)培养的长期连续稳定培养状态相比,即将达到汇合之前的培养皿_第13天的hsa-mir-193a-5p也示出5.2倍、hsa-mir-193b-5p也示出2.9倍和hsa-mir-193b-3p也示出5.4倍、高产生量,关于其它mirna,为同等程度的表达量。
[0406]
将非专利文献6和非专利文献7中记载的作为对抑制胃细胞癌或前列腺癌细胞有效的mirna的hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果示于图56。与即将达到汇合之前的培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的反应器(5%氧气)培养即使在长期连续稳定培养状态下hsa-mir-26a-5p也示出4.0倍的高产生量,关于其它mirna,为同等程度的表达量。
[0407]
比较例1(培养皿_第6天)和实施例4(反应器(普通氧气)_第27天)的外泌体产生量比较和mirna阵列解析
[0408]
将比较例1(培养皿_第6天)和实施例4(反应器(普通氧气)_第27天)的平均每个细胞的外泌体产生量的比较示于图57。确认了:与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的反应器(普通氧气)培养即使在长期连续稳定培养状态下也是外泌体产生能力高2.6倍的状态。
[0409]
将比较例1(培养皿_第6天)和实施例4(反应器(普通氧气)_第27天)的mirna阵列解析的散点图示于图58。将观察到10倍以上的mirna的表达比差异的mirna示于表7。
[0410]
[表7]
[0411]
表7.观察到10倍以上的表达比的差异的mirna
[0412][0413]
将专利文献2中记载的作为对损伤或患病的心脏组织的治疗有效的mirna的hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果示于图59。与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的反应器(普通氧气)培养即使在长期连续稳定培养状态下hsa-mir-24-3p也示出10.1倍的产生量,关于其它mirna,为同等程度的表达量。
[0414]
将专利文献3中记载的作为对抑制口腔鳞状细胞癌有效的mirna的hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果示于图60。与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的反应器(普通氧气)培养即使在长期连续稳定培养状态下也示出同等的产生量。
[0415]
将非专利文献6和非专利文献7中记载的作为对抑制胃细胞癌或前列腺癌细胞有效的mirna的hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果示于图61。与培养皿_第6天相比,使用了聚酰亚胺多孔膜模块的反应器(普通氧气)培养即使在长期连续稳定培养状态下hsa-mir-26a-5p也示出55.0倍、hsa-mir-23b-3p也示出24.2倍、hsa-mir-27b-3p也示出4.2倍的高产生量,关于其它mirna,为同等程度的表达量。
[0416]
将比较例1(培养皿_第13天)和实施例4(反应器(普通氧气)_第27天)外泌体产生
量比较和mirna阵列解析
[0417]
将比较例1(培养皿_第13天)和实施例4(反应器(普通氧气)_第27天)的平均每个细胞的外泌体产生量的比较示于图62。确认了:与培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的反应器(普通氧气)培养即使在长期连续稳定培养状态下也是外泌体产生能力高2.7倍的状态。
[0418]
将比较例1(培养皿_第13天)和实施例4(反应器(普通氧气)_第27天)的mirna阵列解析的散点图示于图63,将观察到10倍以上的mirna的表达比差异的mirna示于表8。
[0419]
[表8]
[0420]
表8.观察到10倍以上的表达比的差异的mirna
[0421][0422]
将专利文献2中记载的作为对损伤或患病的心脏组织的治疗有效的mirna的hsa-mir-146a、hsa-mir-210、hsa-mir-22和hsa-mir-24的mirna阵列解析的结果示于图64。与培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的反应器(普通氧气)培养即使在长期连续稳定培养状态下hsa-mir-24-3p也示出3.4倍的产生量,关于其它mirna,为同等程度的表达量。
[0423]
将专利文献3中记载的作为对抑制口腔鳞状细胞癌有效的mirna的hsa-mir-34b、hsa-mir-132、hsa-mir-203、hsa-mir-137和hsa-mir-193的mirna阵列解析的结果示于图65。与即将达到汇合之前的培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的反应器(普通氧气)培养的长期连续稳定培养状态下,hsa-mir-193a-5p示出7.0倍、hsa-mir-193b-5p
示出4.6倍和hsa-mir-193b-3p示出4.4倍的高产生量,关于其它mirna,为同等程度的表达量。
[0424]
将非专利文献6和非专利文献7中记载的作为对抑制胃细胞癌或前列腺癌细胞有效的mirna的hsa-mir-26a/b、hsa-mir-23b、hsa-mir-27b和hsa-mir-24-1的mirna阵列解析的结果示于图66。与即将达到汇合之前的培养皿_第13天相比,使用了聚酰亚胺多孔膜模块的反应器(普通氧气)培养即使在长期连续稳定培养状态下hsa-mir-26a-5p也示出43.8倍、hsa-mir-23b-3p也示出9.7倍、hsa-mir-26b-3p也示出3.4倍、hsa-mir-27b-3p也示出3.2倍的高产生量,关于其它mirna,为同等程度的表达量。
[0425]
实施例6:在wave反应器中使用了模块的细胞培养
[0426]
利用与实施例5类似的方法,在放有预先用培养基(ham’s f-12培养基;fujifilm wako pure chemical corporation制_含谷氨酰胺/酚红)湿润2天以上的60个模块的ge公司制wave培养袋(cellbag disposable bioreactor part#cb0002l11-33)内加入培养基(kohjin bio co.,ltd.制无异源培养基;kbm adsc-4r)250ml,设置在ge公司制wave反应器(readytoprocess wave25)中后,在co25%、温度37℃、振动速度15rpm、振动角度9
°
的条件下搅拌约1小时来振荡模块。
[0427]
使用gibco公司制胰蛋白酶-edta(0.05%),酚红将在培养皿中培养的第4代的间充质干细胞(21y male;atcc公司制lot 70011721)剥离,悬浮在培养基(kohjin bio co.,ltd.制无异源培养基;kbm adsc-4r)11ml中。接种相对于模块内部的培养基材聚酰亚胺多孔膜的平均每1cm2面积为1.0
×
104个细胞(总数:1.1
×
107个细胞)的细胞悬浮液,在与模块湿润时相同振动条件下吸附细胞,开始进行长期培养。
[0428]
在相同条件下连续进行3天振动培养后,利用反应器的灌注功能(袋重量管理功能),从ge公司制wave培养袋内经由harvest管泵将细胞培养液以110ml/天的速度排出,将与该排出的培养基相同体积的培养基(葡萄糖调节kbm adsc-4r)经由进料管泵输送至ge公司制wave培养袋内。需要说明的是,由于wave25附带的回收泵中送液速度过快,因此使用as one corporation制微型管泵组fp100-1实施了培养基回收。对于回收的培养基,使用roche公司制cedexbio,通过各代谢参数的变化来观察细胞生长行为,观察到长期稳定的细胞的增殖/生长。另外,在需要时,利用基于同仁化学研究所制cell counting kit-8的显色反应,测定在袋内模块中生长的总细胞数,确认了细胞的生长状况。将葡萄糖消耗和乳酸产生量的经时变化示于图67。需要说明的是,在预计由于葡萄糖消耗量的增大而不足时,为了避免枯竭而通过添加葡萄糖液调节了葡萄糖浓度。
[0429]
为了测定回收的细胞培养液中包含的平均每天所产生的外泌体数,将每约20天的回收培养基整合为一批,制作了5批回收液。用0.2μm的过滤器去除异物后,按照前述的“使用了zeta电位/粒径分布测定装置的外泌体量测定”的步骤测定各液体,将结果示于表9。确认了:在代表了培养天数100天的5批回收液中持续产生了稳定的外泌体。
[0430]
[表9]
[0431]
回收原液的外泌体量评价
[0432][0433]
进而,利用切向流过滤法(sartorius公司制vivaflow 200100,000mwco hy)将这5批样品(培养回收液)浓缩至30倍~50倍左右后,添加浓缩液的一半量的thermofisher公司制总外泌体分离试剂(来自细胞培养基),将通过搅拌/整夜冷藏静置/离心(10000g/60分钟)而产生的沉淀体分离。在该沉淀物中加入与去除的液体相同程度量的dpbs并进行悬浮溶解,将进而用0.2μm过滤器去除了异物者作为获得外泌体液。如此获得了每个培养期间的5批外泌体液样品。
[0434]
对于这5批样品,按照前述的“使用了zeta电位/粒径分布测定装置的外泌体量测定”的步骤进行测定。另外,使用人源外泌体定量用cd9/cd63elisa试剂盒(cosmo bio co.,ltd.制;型号_exh0102el),将外泌体量定量为cd63的蛋白量。将外泌体量评价结果示于表10,将外泌体粒度分布结果示于图68。
[0435]
[表10]
[0436]
纯化浓缩获得液的外泌体量评价
[0437][0438]
*cosmo bio co.,ltd.制造人cd9/gd63外泌体elisa试剂盒cat.no exho1 02el
[0439]
关于上述各外泌体样品,使用实施例5中所示的genechip(商标)mirna4.0阵列实施了mirna阵列解析。进行了基因表达比较分析,结果无论培养期间如何,均确认了稳定的外泌体内的基因表达(图76)。
[0440]
对于利用与上述实施例同样的方法得到的外泌体,用凝胶过滤柱(hiload 16/600superdex200 prep grade)纯化后使用超滤膜进行浓缩后,进行tem(透射型电子显微镜)观察。使试样溶液吸附于带有碳支撑膜的cu筛网上后,进行清洗、染色、清洗、干燥,制作了tem观察用试样。使用日本电子制jem-2100f型场发射透射电子显微镜进行拍摄。将测定例示于图69。
[0441]
实施例7:在wave反应器中使用了模块的细胞培养
[0442]
利用与实施例5类似的方法,在放有预先用培养基(ham’s f-12培养基;fujifilm wako pure chemical corporation制_含谷氨酰胺/酚红)湿润2天以上的70个模块的ge公司制wave培养袋(cellbag disposable bioreactor part#cb0002l11-03)内加入培养基(kohjin bio co.,ltd.制无异源培养基;kbm adsc-4r)250ml,设置于ge公司制wave反应器(xuri cell expansion system w5)中后,在co25%、温度37℃、振动速度11rpm、振动角度9°
的条件下搅拌约1小时来振荡模块。
[0443]
使用gibco公司制胰蛋白酶-edta(0.05%),酚红将在培养皿中培养的第2代的间充质干细胞(21y male;atcc公司制lot 70011721)剥离,悬浮在培养基(kohjin bio co.,ltd.制无异源培养基;kbm adsc-4r)11ml中。接种相对于模块内部的培养基材聚酰亚胺多孔膜的平均每1em2面积为1.0
×
104个细胞(总数:1.3
×
107个细胞)的细胞悬浮液,在与模块湿润时相同振动条件下吸附细胞,开始进行长期培养。另外,在与向模块中接种间充质干细胞的相同时期也进行向iwaki制i型胶原蛋白涂层培养皿中的传代接种,实施了用于进行外泌体产生比较实验的培养。
[0444]
在相同条件下连续进行3天振动培养后,利用反应器配件(xuri cell expansion system w5 perfusion controller)的灌注功能(袋重量管理功能),每约3小时一次经由harvest管泵从ge公司制wave培养袋内排出约20ml细胞培养液,将与该排出的培养基相同体积的培养基(葡萄糖调节kbm adsc-4r)经由进料管泵送液至ge公司制wave培养袋内,实施了150ml/天的液体更换。对于回收的培养基,使用roche公司制cedexbio,通过各代谢参数的变化来观察细胞生长行为,观察到长期稳定的细胞的增殖/生长。另外,在14天/21天/28天/50天,利用基于同仁化学研究所制cell counting kit-8的显色反应,测定在袋内模块生长的人间充质干细胞的平均每1cm2的细胞密度和袋内的总细胞数,确认了细胞的生长状况。表11示出测定结果。
[0445]
[表11]
[0446]
表11.培养期间与生长细胞数的比较
[0447]
培养期间(天)细胞密度(个细胞/cm2)总细胞数(个细胞)146.1
×
1047.7
×
107218.4
×
1041.1
×
108289.4
×
1041.2
×
108508.5
×
1048.5
×
107[0448]
为了测定回收的细胞培养液中包含的平均每天所产生的外泌体数,定期地取出样品,用0.2μm的过滤器去除异物后,按照前述的“使用了zeta电位/粒径分布测定装置的外泌体量测定”的步骤测定各液体。将连同其它细胞中的运行结果在内的测定结果示于图70。图中,人间充质干细胞wave反应器(1)示出该实验结果。如由结果所明确的那样,确认了本培养方法中在培养天数50天时稳定的外泌体产生得到持续。
[0449]
另外,为了比较外泌体,使用从在iwaki制i型胶原蛋白涂层培养皿中利用kohjin bio co.,ltd.制无异源培养基;kbm adsc-4r培养的相同间充质干细胞中在培养第14天回收的培养上清液、以及基于上述wave反应器的连续培养系统在第50天回收培养基,使用实施例5中所示的genechip(商标)mirna 4.0阵列实施了mirna阵列解析。将结果示于图71。
[0450]
对于两种不同的培养条件下的mirna表达量的比较,在相同量的rna之间进行均值化并显示为分布。左侧示出人mirna的整体分布,右侧示出限定于mir21~24的部分分布。如由左侧的图的比较所明确的那样,即使rna量相同,通常在模块培养系统中mirna的表达量增大。另外,与该倾向相反,确认了:与模块培养相比,mir-22-3p的表达量在平板培养中增加。mir-22是已知随着细胞的老化、表达量会增加的mirna。发现:对于模块培养的期间,尽管比成为比较对象的平板中的平面培养了长3倍以上的期间,平板培养系统的该老化相关
mirna的表达量多3倍以上。确认通过模块培养而良好地维持特性且能够长期培养细胞。
[0451]
实施例8:在wave反应器中使用了模块的细胞培养
[0452]
利用与实施例5类似的方法,在放有预先用培养基(ham’s f-12培养基;fujifilm wako pure chemical corporation制_含谷氨酰胺/酚红)湿润2天以上的55个模块和55个2型模块的2个ge公司制wave培养袋(cellbag disposable bioreactor part#cb0002l11-03)内加入培养基(kohjin bio co.,ltd.制无异源培养基;kbm adsc-4r)250ml,设置在ge公司制wave反应器(xuri cell expansion system w5)中后,在co25%、温度37℃、振动速度13rpm、振动角度9
°
的条件下搅拌约1小时来振荡模块。
[0453]
使用gibco公司制胰蛋白酶-edta(0.05%),酚红将在培养皿中培养的第2代的间充质干细胞(25y male;lonza公司制lot 00451491)剥离,悬浮在培养基(kohjin bio co.,ltd.制无异源培养基;kbm adsc-4r)11ml中。相对于模块内部的培养基材聚酰亚胺多孔膜的平均每1cm2面积,接种1.0
×
104个细胞(总数:1.3
×
107个细胞)的细胞悬浮液,在与模块湿润时相同振动条件下吸附细胞,开始进行长期培养。
[0454]
在相同条件下连续进行3天振动培养后,利用反应器配件(xuri cell expansion system w5 perfusion controller)的灌注功能(袋重量管理功能),每约3小时一次经由harvest管泵从ge公司制wave培养袋内排出约20ml细胞培养液,将与该排出的培养基相同体积的培养基(葡萄糖调节kbm adsc-4r)经由进料管泵送液至ge公司制wave培养袋内,实施了150ml/天的液体更换。对于回收的培养基,使用roche公司制cedexbio,通过各代谢参数的变化来观察细胞生长行为,观察到长期稳定的细胞的增殖/生长。另外,在7天/14天/21天/29天/48天,利用基于同仁化学研究所制cell counting kit-8的显色反应,将在袋内模块中生长的细胞的平均每1cm2的生长数表示为细胞密度,通过测定在测定时的回收培养基内释放的外泌体的颗粒数,从而确认细胞的生长状况和连续的外泌体产生行为。表12示出测定结果。
[0455]
[表12]
[0456]
表12.培养期间与生长细胞密度和外泌体产生量的比较
[0457][0458]
需要说明的是,为了确认与其它实验的一致性,图70示出了外泌体产生行为。通常模块实验结果作为人间充质干细胞wave反应器(2)示于图中,将2型模块实验结果作为人间充质干细胞wave反应器(3)示于图中。
[0459]
实施例9:在溢流反应器中的成骨细胞长期模块培养
[0460]
在放有预先用培养基(ham’s f-12培养基;fujifilm wako pure chemical corporation制_含谷氨酰胺/酚红)湿润2天以上的50个模块的溢流反应器培养容器内加入培养基(kohjin bio公司制无异源培养基;kbm adsc-4)100ml,在设定在co25%、37℃的搭载有n-biotek公司制可加湿摇床的co2培养箱(anicell)内设置后,以转速80rpm将模块搅
expansion system w5)中后,在co25%、温度37℃、振动速度15rpm、振动角度9
°
的条件下搅拌约1小时来振荡模块。
[0472]
使用gibco公司制胰蛋白酶-edta(0.05%),酚红将在corning公司制细胞培养falcon培养皿中培养的第3代的promocell公司制人成骨细胞(y30女性_439z037.2)剥离,离心并回收细胞后悬浮在前述培养基(kbm adsc-4r)13ml中。将相对于模块内部的培养基材聚酰亚胺多孔膜的平均每1cm2面积为1.0
×
104个细胞(总数;1.3
×
107个细胞)的细胞悬浮液加入wave反应器培养容器内后,在振动速度15rpm、振动角度9
°
的振动条件下开始进行细胞的吸附和培养。
[0473]
在相同条件下连续进行3天振动培养后,利用反应器配件(xuri cell expansion system w5 perfusion controller)的灌注功能(袋重量管理功能),每约3小时一次经由harvest管泵从ge公司制wave培养袋内排出约20ml细胞培养液,将与该排出的培养基相同体积的培养基(葡萄糖调节kbm adsc-4r)经由进料管泵送液至ge公司制wave培养袋内,实施了150ml/天的液体更换。对于回收的培养基,使用roche公司制cedexbio,通过各代谢参数的变化来观察细胞生长行为,观察到长期稳定的细胞的增殖/生长。另外,在8天/22天/36天/58天,利用基于同仁化学研究所制cell counting kit-8的显色反应,测定在袋内模块中生长的人成骨细胞的平均每1cm2的细胞密度和袋内的总细胞数,确认了细胞的生长状况。将结果示于表14。另外,为了测定回收培养基内的外泌体产生量,按照前述的“使用了zeta电位/粒径分布测定装置的外泌体量测定”的步骤测定,将结果示于表15。与代谢行为同样地,确认了130天以上的长期且稳定的外泌体产生行为。
[0474]
[表14]
[0475]
表14.培养期间与生长细胞数的比较
[0476][0477]
[表15]
[0478]
表15.培养期间与外泌体产生行为的相关性
[0479][0480]
实施例11:在溢流反应器中的胎儿心肌细胞长期模块培养
[0481]
在放有预先用培养基(ham’s f-12培养基;fujifilm wako pure chemical corporation制_含谷氨酰胺/酚红)湿润2天以上的40个模块的溢流反应器培养容器内加入
培养基(kohjin bio公司制无异源培养基;kbm adsc-4)100ml,在设定在co25%、37℃的搭载有n-biotek公司制可加湿摇床的co2培养箱(anicell)内设置后,以转速80rpm将模块搅拌振荡约1小时。
[0482]
使用gibco公司制胰蛋白酶-edta(0.05%),酚红将在corning公司制细胞培养falcon培养皿中培养的第1代的sicencell公司制人胚心肌细胞(lot.no.21757)剥离,离心并回收细胞后悬浮在前述培养基(kbm adsc-4)7.2ml中。将相对于模块内部的培养基材聚酰亚胺多孔膜的平均每1cm2面积为1.0
×
104个细胞(总数;7.2
×
106个细胞)的细胞悬浮液加入溢流反应器培养容器内后,在转速80rpm的搅拌条件下开始进行细胞的吸附和培养。
[0483]
24小时后,利用管泵以100ml/天的速度将培养基(葡萄糖调节kbm adsc-4)向溢流反应器培养容器内开始送液,用回收储液瓶回收从设置于培养容器壁面的培养基回收口溢出来的培养基。对于回收的培养基,使用roche公司制cedexbio,通过回收液的各代谢参数的变化来观察细胞生长行为,根据细胞的葡萄糖等消耗状况适时改变送液量/转速,进行了长期细胞培养。将葡萄糖消耗量和乳酸产生量的经时变化示于图74。观察到80天长期且稳定的葡萄糖消耗和乳酸产生。
[0484]
在14天/38天/93天/114天,利用基于同仁化学研究所制cell counting kit-8的显色反应,测定在袋内模块中生长的人胚心肌细胞的平均每1cm2的细胞密度和反应器内的总细胞数,确认了细胞的生长状况。将结果示于表16。由于从一开始就显示出非常高的增殖性,因此通过测定示出在整个培养期间几乎维持了相同数量程度的细胞密度。从葡萄糖消耗和乳酸产生量也可设想同样的行为。
[0485]
为了测定回收培养基内的外泌体产生量,按照前述的“使用了zeta电位/粒径分布测定装置的外泌体量测定”的步骤测定,将结果示于表17。与代谢行为同样地,确认了100天以上的长期且稳定的外泌体产生行为。
[0486]
[表16]
[0487][0488]
[表17]
[0489][0490]
实施例12:wave反应器中的胎儿心肌细胞长期模块培养
[0491]
在放有预先用dpbs(fujifilm wako pure chemical corporation制)湿润2天以上的50个2型模块的ge公司制wave培养袋(cellbag disposable bioreactor part#
cb0002l11-03)内加入培养基(kohjin bio co.,ltd.制无异源培养基;kbm adsc-4r)250ml,设置在ge公司制wave反应器(xuri cell expansion system w5)中后,在co25%、温度37℃、振动速度15rpm、振动角度9
°
的条件下搅拌约1小时来振荡模块。
[0492]
使用gibco公司制胰蛋白酶-edta(0.05%),酚红将在corning公司制细胞培养falcon培养皿中培养的第4代的sicencell公司制人胚心肌细胞(lot.no.21757)剥离,离心并回收细胞后悬浮在前述培养基(kbm adsc-4r)10ml中。将相对于模块内部的培养基材聚酰亚胺多孔膜的平均每1cm2面积为1.0
×
104个细胞(总数;1.0
×
107个细胞)的细胞悬浮液加入wave反应器培养容器内后,在振动速度11rpm、振动角度7
°
的振动条件下开始进行细胞的吸附和培养。
[0493]
在相同条件下连续进行3天振动培养后,利用反应器配件(xuri cell expansion system w5 perfusion controller)的灌注功能(袋重量管理功能),每约3小时一次经由harvest管泵从ge公司制wave培养袋内排出约20ml细胞培养液,将与该排出的培养基相同体积的培养基(葡萄糖调节kbm adsc-4r)经由进料管泵送液至ge公司制wave培养袋内,实施了150ml/天的液体更换。对于回收的培养基,使用roche公司制cedexbio,通过各代谢参数的变化来观察细胞生长行为,观察到长期稳定的细胞的增殖/生长。另外,在7天/14天/21天/35天,利用基于同仁化学研究所制cell counting kit-8的显色反应,测定在袋内模块中生长的人胚心肌细胞的平均每1cm2的细胞密度和袋内的总细胞数,确认了胎儿心肌细胞特有的良好的细胞生长状况。将结果示于表18。
[0494]
[表18]
[0495][0496]
另外,为了测定回收培养基内的外泌体产生量,每次收集约20天量的排出培养基,准备了3批回收原液。将这些过滤器过滤后,与实施例6同样地,按照“使用了zeta电位/粒径分布测定装置的外泌体量测定”的步骤进行测定,同时利用elisa法以cd63的蛋白量的形式测定了外泌体产生量,将结果示于表19。除了培养开始时期之外,确认了稳定的外泌体产生行为。
[0497]
[表19]
[0498][0499]
实施例13:锥形瓶和小片多孔膜中的软骨细胞模块培养
[0500]
准备了放有预先用dpbs(fujifilm wako pure chemical corporation制)湿润2天以上的5个2型模块的thermo fisher scientfic公司制125ml锥形瓶和250ml锥形瓶、及装有经灭菌的聚酰亚胺多孔膜小片(1mm
×
1mm)120cm2的corning incorporated制125ml方
型pet制存储瓶(带有45mm盖)。在锥形瓶烧瓶中加入将葡萄糖值调整为3000mg/l的培养基(kohjin bio co.,ltd.制无异源培养基;kbm adsc-4r)20ml,在放有小片多孔膜的方型corning incorporated瓶中加入相同培养基30ml。
[0501]
使用gibco公司制胰蛋白酶-edta(0.05%),酚红将在iwaki i型胶原蛋白涂层培养皿中培养的第4代的promocell公司制人软骨细胞(y30女性_439z037.3)剥离,离心并回收细胞后悬浮在培养基(葡萄糖调节kbm adsc-4r)中。以平均每1ml为1.0
×
106个细胞的悬浮细胞密度加入相对于模块内部的培养基材聚酰亚胺多孔膜和相对于聚酰亚胺多孔膜小片的平均每1cm2面积为1.0
×
104个细胞(锥形瓶烧瓶中共计1.0
×
106个细胞,另外小片多孔膜中总计1.2
×
106个细胞)的细胞悬浮液。锥形瓶烧瓶中的培养使用前述的anicell中的振荡培养器,另外,小片多孔膜中的软骨细胞培养通过使用了co2培养箱的静置培养来进行。
[0502]
在培养第二天,在锥形瓶烧瓶中进一步加入10ml的葡萄糖调节kbm adsc-4r培养基,使用前述的anicell以80rpm进行旋转振荡培养,边进行每周2次左右的培养基更换边连续进行培养。在锥形瓶烧瓶中的模块培养(2型模块5个)和在小片多孔膜培养(聚酰亚胺多孔膜小片120cm2)均在30ml的培养基中培养。在8天/15天/20天/35天,利用基于同仁化学研究所制cell counting kit-8的显色反应,测定了在各反应器内模块和多孔膜小片中生长的总细胞数。通过各反应器特有的增殖行为,确认了人软骨细胞良好的细胞生长状况。将细胞密度和总细胞数示于图75。显示出使用小的培养容器能够容易地以多种方式稳定且长期地培养大量的细胞。
[0503]
另外,对于培养第19天的回收培养基内的外泌体产生量,利用elisa法以cd63的蛋白量的形式测定了外泌体产生量,结果确认了:储存3天时,在使用锥形瓶125ml容器且模块时产生218pg/ml的外泌体,另外在使用250ml容器且模块时产生141pg/ml的外泌体,在小片多孔膜中的培养系统中产生117pg/ml的外泌体。在前述的连续培养系统同样地间歇培养系统中,也确认了高效且稳定的外泌体产生。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。