1.本发明属于基因工程领域,涉及一种单核细胞增多性李斯特菌,具体来说是一种减毒的单核细胞增多性李斯特菌,可用于递送表达外源抗原,用作活疫苗载体。
背景技术:
2.单核细胞增多性李斯特菌简称单增李斯特菌(lm),是一种人畜共患的食源性胞内感染病原菌。广泛存在于自然环境中,在土壤和胞内环境中李斯特菌会面临多种应激反应,单增李斯特菌通过调控基因转录和蛋白表达以适应大部分来自环境的应激。
3.李斯特菌有着极强的生存能力且广泛分布于各种环境中,能够在许多不同的环境中持续生存,极易通过食物传播感染免疫力低下的人群(老人、儿童和孕妇等),造成细菌性败血症、脑膜炎以及流产等李斯特菌病。因此,单增李斯特菌的减毒是非常有必要的。
4.减毒活载体疫苗的特点是能引起较强的免疫反应,由于单増李斯特菌能在巨噬细胞内增殖,其能够更好的递呈抗原。除此之外,已知单増李斯特菌llo能够增强抗原的特异性免疫反应。因此,减毒活载体疫苗能有效的解决传统疫苗面临的技术缺陷,能更好的提高免疫治疗效果,缩短免疫周期,提搞患者的存活率。
5.目前,已公开报道减毒李斯特菌的减毒策略主要有以下几种方式:(1) lmδacta/δinlb菌株,也称为活减毒双缺菌株(ladd)。目前,该菌株作为许多临床试验中的疫苗载体。主要通过敲除负责lm向性和细胞间传递的基因。(2)xfl-7菌株。敲除基prfa的lm菌株可有效的减弱毒力。此外,prfa敲除的减毒株无法在细胞中从溶酶体逃逸并进入其他细胞。(3)lmdd菌株(lmδdal/δdat)。缺失这两个基因的菌株将无法进行复制。通过重组质粒(含启动子及编码dal基因)的质粒转化获得的lmdd 菌株,可以部分恢复毒力并具有免疫原性。另外一种lmdda菌株则是在lmdd菌株的基础上,将基因acta敲除,进一步减弱毒性。(4)kmba lm菌株。dna交联剂补骨脂素与紫外线照射联合作用,可使lm菌株缺乏核苷酸切除修复作用和光化学灭活,引起其不可逆的dna损伤,使lm无法复制。目前国内外的李斯特减毒策略主要局限于营养基因的敲除、质粒等抗性基因标记等策略,目前试验证明这些方式具有免疫原性减弱、影响细菌正常的生长能力、影响抗原呈递效率等局限性。
6.因此,本发明提出基于新发现的毒力相关基因改造获得的减毒单核细胞增多性李斯特菌,并在其基础上进一步加以利用。
技术实现要素:
7.本发明要解决的技术问题是,克服现有技术中的不足,提供一种基于新毒力基因改造的减毒单增李斯特菌构建方法及应用。
8.为解决技术问题,本发明通过以下技术方案予以实现:
9.提供一种减毒单核细胞增多性李斯特菌,该减毒单核细胞增多性李斯特菌是以单増李斯特菌野生株为背景,经敲除毒力相关基因lmo0734后获得。
10.本发明进一步提供了一种减毒菌株,含有前述的减毒单核细胞增多性李斯特菌;
该减毒菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏名称为单核细胞增生李斯特氏菌,listeria monocytogenes.lads0734;保藏编号为cgmccno:21384。
11.本发明进一步提供了前述减毒单核细胞增多性李斯特菌作为活疫苗载体、预防性疫苗载体或治疗性疫苗载体的用途。
12.本发明还提供了前述减毒单核细胞增多性李斯特菌的制备方法,包括以下步骤:
13.(1)构建重组质粒psl1969;
14.(2)以单増李斯特菌野生株制备感受态细胞;
15.(3)利用步骤(1)制备的重组质粒对步骤(2)制备的感受态细胞进行电转化;
16.(4)以单増李斯特菌野生株与重组质粒同源杂交培养、筛选验证。
17.作为本发明的优选方案,所述步骤(1)具体包括:
18.从ncbi上下载转录调控蛋白lmo0734的lmo0734基因前后共5个基因的序列;
19.使用snapgene软件选取lmo0734基因阅读框上、下游片段作为同源臂,设计引物扩增上、下游同源臂,条带大小分别为492bp和495bp,作为片段a和片段b;
20.以sal i和ecor i为酶切位点,经酶切、酶连至李斯特菌穿梭质粒pksv7,获得重组质粒psl1969。
21.作为本发明的优选方案,所述引物包括:引物p1,李斯特菌基因组上距离片段a 上游208bp用于验证重组质粒的引物,其序列如seq id no.2所示;引物p2,扩增片段a的上游引物,其序列如seq id no.3所示;引物p3,扩增片段a的下游引物,其序列如seq id no.4所示;引物p4,扩增片段b的上游引物,其序列如seq id no.5 所示;引物p6,扩增片段b的下游引物,其序列如seq id no.6所示。
22.作为本发明的优选方案,所述步骤(2)具体包括:
23.将单増李斯特菌野生株接种于新鲜无菌的bhi液体培养基中,37℃振荡培养至 od
600
nm值为0.18-0.25;加入青霉素g,使其终浓度为20μg/ml,37℃振荡培养2h;离心收集菌体,加入适量洗涤缓冲液,洗涤两次;离心弃上清,向沉淀中加入洗涤缓冲液,重悬菌体以获得感受态细胞;分装,置-80℃冰箱备用。
24.作为本发明的优选方案,所述步骤(3)具体包括:
25.将步骤(1)所得重组质粒电转入步骤(2)所得单増李斯特菌感受态细胞中,加入预热的2
×
bhi和1m蔗糖等体积混合的混合液,充分混匀,置30℃恒温培养箱2-3h;将转化液均匀涂布于氯霉素抗性的bhi固体培养基中,置37℃培养,得到单克隆菌落。
26.作为本发明的优选方案,所述步骤(4)具体包括:
27.挑取步骤(3)中经电转化获得的单克隆菌落,在无菌的bhi液体培养基扩大培养,进行pcr验证;将阳性菌株置于42℃进行同源重组,以及30℃连续传代丢失质粒,最后进行pcr筛选和基因测序验证,得到重组减毒单増李斯特菌;将菌液和60%甘油按体积比1:1混合,置-80℃冰箱保存。
28.发明原理描述:
29.经申请人团队长期研究后首次发现,lmo0734基因是单增李斯特菌新的转录调控蛋白,缺失该基因并不影响李斯特菌在体外环境中的生长和增殖能力,但能显著降低李斯特菌在胞内的存活增殖能力和对小鼠的致病性。
30.基于上述发现,申请人以单増李斯特菌野生株(wt株)为背景,利用同源重组技术、基础分子克隆试验操作和生物信息学等手段构建李斯特菌的lmo0734基因缺失株 (减毒株)。该缺失株内不含抗性质粒,符合生物安全要求,更适合用于临床。通过在李斯特菌基因组原位上进行缺失,可消除在免疫过程中质粒丢失的情况,减毒株更加稳定。在此基础上,当携带外源基因时,也能够更稳定的表达。
31.与现有技术相比,本发明的有益效果是:
32.1、本发明的单増李斯特菌的减毒株可用于活疫苗治疗载体或免疫佐剂;将lmo0734 基因从基因簇中敲除使该细菌毒力大大降低,在达到规定安全级别的同时,仍保留了非常好的免疫原性。
33.2、由于是在李斯特菌基因组上对毒力相关基因进行改造,不含抗性质粒等生物标记,符合生物安全性。
附图说明
34.为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
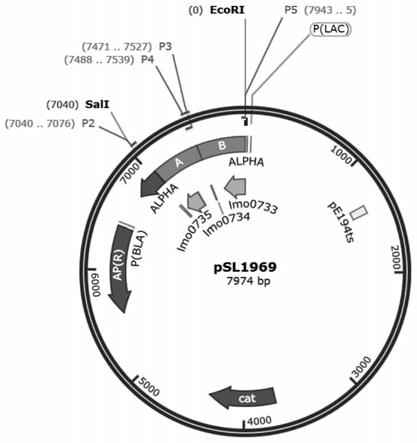
35.图1为本发明构建的单増李斯特菌同源重组质粒(psl1969)图谱;该图谱中包含 lmo0734上下游同源臂492bp和495bp的重组片段,以及氯霉素抗性基因cat;
36.图2为wt株与该减毒株在bhi中生长能力的比较的示意图;
37.图3为wt株与该减毒株在巨噬细胞中增殖能力比较的示意图;
38.图4为wt株与该减毒株在icr小鼠内的半数致死量的示意图;
39.图5为wt株与该减毒株在icr小鼠肝脾的细菌载量比的示意图。
具体实施方式
40.下面通过具体实施例子,对本发明的实现方式进行详细描述。
41.首先介绍本发明实施例中所使用的菌株、试剂与仪器:
42.主要菌株:
43.单増李斯特菌野生株(本发明中简称wt株)的菌株购自atcc标准菌株,社会公众可根据其规定自行获取。
44.本发明所述减毒单核细胞增多性李斯特菌,是以上述单増李斯特菌野生株为背景,经敲除lmo0734基因后获得。含有该减毒单核细胞增多性李斯特菌的减毒菌株,保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏名称为单核细胞增生李斯特氏菌,listeria monocytogenes lads0734;保藏编号为cgmcc no:21384;保藏日期为2020年12月16日。保藏机构地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;邮编100101。
45.主要试剂:
46.lb培养基、琼脂糖h、agar均购于上海生工生物工程公司,bhi培养基购自英国 oxoid公司,pcr纯化试剂盒、胶回收试剂盒均购自惠晶生物科技,质粒提取试剂盒、细胞总rna提取试剂盒均购自天根生化各级有限公司,pcr相关试剂购自南京诺唯赞, dna连接酶(ligation high ver.2)购自toyobo,限制性内切酶购自neb,氨苄霉素和卡那霉素购自
sangon,反转录试剂盒购自toyobo,dmem、fbs、pbs、蛋白maker 均购自赛默飞。
47.主要仪器:
48.摇床(hz-9211k)、涡旋振荡器(zealway gi541)、多功能酶标仪(bioteksynergytm h1)、梯度pcr仪(eppendorf)、凝胶成像系统(uvp)、金属浴(thermo)、生物安全柜(bsc-ii)、电击转化仪(btx ecm 630)、蛋白电泳仪(biorad)、细胞二氧化碳培养箱(thermo)。
49.实施例1减毒李斯特菌的构建
50.1、构建重组质粒psl1969
51.以单增李斯特菌标准菌株基因组(genbank序列号为nc_003210.1)为模板,从 ncbi(national center for biotechnology information,美国国家生物技术信息中心)下载转录调控蛋白lmo0734的lmo0734基因前后共5个基因的序列。使用snapgene软件选取lmo0734基因阅读框上、下游片段作为同源臂,设计引物扩增上、下游同源臂,条带大小分别为492bp和495bp,作为片段a和片段b。利用pcr扩增分别含酶切位点 sal i和ecor i的片段a(492bp,扩增引物为p2和p3)和b(495bp,扩增引物为p4 和p5);在此基础上,通过soe-pcr扩增得到“a-b”的目的片段(如seq id no.1 所示)。以sal i和ecor i为酶切位点,经酶切、酶连至李斯特菌穿梭质粒pksv7,获得重组质粒psl1969,测序验证正确后保存于-20℃。
52.相关引物的序列见表1。其中,p1为李斯特菌基因组上距离片段a上游208bp用于验证重组质粒的引物;p2为扩增片段a的上游引物;p3为扩增片段a的下游引物; p4为扩增片段b的上游引物;p5为扩增片段b的下游引物。
53.表1重组质粒psl1969构建所需引物
[0054][0055]
具体操作方法:用p2和p3引物扩增a片段,用p4和p5扩增b片段,通过oveerlappcr技术将两个片段连在一起获得“a-b”的目的片段,用sal i和ecor i对目的片段和载体(pksv7)进行双酶切,按照试剂盒说明书进行酶切产物纯化。将7μl目的片段、 3μl载体和10μl dna连接酶混合后置于16℃金属浴进行酶连,得到重组质粒 psl1969(构建图谱如图1所示)。
[0056]
2、wt株感受态细胞的制备
[0057]
在无菌超净工作台从李斯特菌野生株(wt株)中挑取单菌落至5ml bhi培养基中,放置于37℃恒温摇床培养箱过夜培养。取1ml过夜培养的菌液,转接至100ml 灭菌的bhi(含有0.5m蔗糖)液体培养基中,37℃振荡培养至od600 nm值约为0.18-0.25。加入青霉素g到100ml培养基中,使青霉素g终浓度为20μg/ml,37℃继续振荡培养2h。3500rpm,10min,4℃离心收集菌体,弃上清,用适量预冷的缓冲液(含1mmhepes和0.5m蔗糖)洗涤两次;离心,弃上清后向沉淀中加入1ml的洗涤缓冲液,重悬菌体以获得感受态细胞;分装,置-80℃冰箱备用。
[0058]
3、电转
[0059]
将1.5μg重组质粒(psl1969)通过电转仪电转入制备的感受态细胞中(电转设置条件为2.5kv、200ω、25μf),电击后,迅速加入1ml预热的2
×
bhi和1m蔗糖等体积混合的混合液,充分混匀后移至新的1.5ml ep管中,置于30℃恒温培养箱中静置培养2-3h,离心(3500rpm,15min),留100μl上清重悬菌液均匀涂布于含氯霉素抗性的bhi固体培养基中,置37℃恒温培养箱培养24-48h得单克隆菌落。
[0060]
4、同源重组及筛选验证
[0061]
挑取将上述获得的单克隆落菌落,接种于bhi液体培养基(氯霉素抗性)中,置 37℃振荡过夜培养。用p2和p5引物进行菌液pcr验证,约在947bp处有明显条带认定为含重组质粒的克隆,电转成功。
[0062]
将对应克隆接种于bhi液体培养基(氯霉素抗性)中置于42℃条件下传代培养进行同源重组,每传5代菌液,用50%甘油保菌并在bhi(含氯霉素抗性)固体平板上划线,用p1和p5引物进行菌落pcr验证,筛选出小片段的克隆(认定为同源重组整合成功)。将筛选出的阳性单克隆接种于bhi液体培养基(不含抗性)中于30℃条件下继续传代丢掉同源重组后的质粒传5代菌液,用60%甘油保菌并在bhi固体平板上划线,放置于37℃培养箱静置培养,挑取单克隆进行抗性筛选获得无抗性的克隆(质粒已丢失),最后经基因测序验证正确后获得减毒单増李斯特菌,将减毒单増李斯特菌的菌液以1:1体积比加入60%甘油并冻存于-80℃冰箱。
[0063]
实施例2减毒株表性分析和感染生物学分析
[0064]
1、生长能力分析
[0065]
从平板上挑取单增李斯特菌wt株、lads0734单克隆菌落,转接至5ml新鲜bhi 液体培养基中,在37℃振荡培养箱200rpm过夜培养;取5ml培养过夜的菌液10mmpbs洗一遍,并用10mm pbs调整菌液od
600
nm至0.6,取4ml加入到无菌的400ml 新鲜bhi肉汤培养基中并混匀,从中取200μl测量吸光值计为0h数据;从0h起每隔 1h,从锥形瓶中取200μl菌液到透明平底96孔板中,每次取3次样品作为平行,用酶标仪测量od
600
nm数据,直到12h结束测量;由图2所示,该减毒株与wt株相比,在bhi培养基中的生长能力不受影响。
[0066]
2、胞内增殖能力分析
[0067]
将raw264.7细胞铺板于24孔细胞培养板中,培养过夜,将李斯特菌按moi=1:20 感染细胞,37℃下培养30min后用10mm pbs(ph 7.4)洗涤2-3次,加入含有庆大霉素 (50μg/ml)的dmem培养基继续培养2h,5h,8h,分别在每个时间点用100μl0.25%胰酶和400μl预冷的灭菌二级水裂解细胞,菌液经倍比稀释至10-4
,点板并放置37℃培养24h后进行细菌菌落计数,计算胞内细菌增殖数(以log
10
cfu呈现)。如图3所示,lads0734感染巨噬细胞raw264.7后的2h、5h以及8h在细胞中的存活增殖能力较野生株分别显著下降大约一个次方。每组两个平行,均值比较采用t检验,*p《0.05, **p《0.01,***p《0.001,****p《0.0001。该结果代表至少两个独立实验。
[0068]
3、小鼠脏器增殖试验
[0069]
将单增李斯特菌通过腹腔注射方式感染18-22g icr雌性小鼠(感染量约为106cfu),分别在感染24和48h后剖杀小鼠,分离肝脏和脾脏,加入10mm pbs(ph 7.4)充分研磨后倍比稀释至合适浓度,点板并放置37℃培养24h后进行细菌菌落计数,结果以 log
10
cfu呈现。如图4所示,与wt株相比,其在小鼠肝脏(liver)、脾脏(spleen) 中的定殖能力均显著
得下降(相差2个数量级以上)。每组8只icr小鼠,均值比较采用t检验,*p《0.05,**p《0.01,***p《0.001,****p《0.0001。该结果代表至少两个独立实验。
[0070]
4、半数致死量比较
[0071]
将单增李斯特菌通过腹腔注射方式感染18-22g icr雌性小鼠(感染量约为106cfu),自注射细菌日起,每12h观察一次小鼠存活情况并进行统计,共观察7天,结果以小鼠存活率呈现。如图5所示,李斯特菌缺失lmo0734后在7d内小鼠90%存活(但野生株的存活率仅为10%),即lads0734对小鼠致病力显著降低,进一步证明lads0734 的毒力大大降低,具有良好的生物安全性。每组10只icr小鼠,均值比较采用t检验, *p《0.05,**p《0.01,***p《0.001,****p《0.0001。该结果代表两个独立实验。
[0072]
以上实验表明,与单増李斯特菌野生株相比,本发明获得的减毒菌株在bhi培养基中生长能力不受影响,在raw264.7(鼠源巨噬细胞)后胞内存活增殖能力减弱。缺失 lmo0734之后的减毒菌株相较于野生株,李斯特菌在小鼠肝脏和脾脏中的定殖李斯特菌数量显著降低;在小鼠存活试验中,缺失lmo0734后李斯特菌的致死率明显下降。
[0073]
基于上述特性,本发明的减毒菌株可以用作活疫苗载体、预防性疫苗载体或治疗性疫苗载体。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。