低丰度事件的微流体确定
交叉引用
1.本技术要求2019年5月31日提交的、名称为“microfluidic determination of low abundance events”的美国临时申请号62/855,734的权益,该申请通过引用而并入本文。
背景技术:
2.由于细胞的复杂异质性及其彼此间的互连性,单细胞分析技术对于生物技术研究和开发是关键的。一种广泛使用的单细胞分析工具是流式细胞术(fc),其能够根据细胞的大小、形状以及细胞表面和细胞内标记物的荧光特性来分析单个细胞。当装置还能够从异质细胞群中分选特定细胞时,称为荧光激活细胞分选(facs)。
3.facs的巨大成功部分归因于其基于每秒高达数万个细胞的荧光检测来筛选单个单细胞的高通量。然而,facs既不能探测单个单细胞的分泌因子,也不能探测两个单细胞之间的相互作用。
4.已开发了用于单细胞分析的多种微流体技术,包括微室、微孔和液滴。微室和纳米孔由于其相对低的通量因而具有有限的应用。在过去的十年里,液滴微流体越来越受到关注。液滴微流体由于超小测定体积(通常小于1纳升(nl))、灵活通量(数千至数亿个细胞)和可操作性(诸如合并、分离、捕获、检测和分选等)因而具有独特的优势,这非常适合于包括基因组分析和活细胞测定在内的单个单细胞的许多生物测定。
5.尽管液滴技术有进步,但仍然存在限制需要高度准确和高效的单细胞或颗粒检测和隔离的重要应用的主要瓶颈。例如,抗原特异性高质量t或b细胞一般分别是t或b细胞免疫组库中的低丰度事件。对于进一步提高当前液滴技术的准确性和效率存在显著的未满足的需求,这将使得能够有效地隔离在许多生物应用中普遍存在的这种低丰度事件。
技术实现要素:
6.因此,将期望提供能够更准确和高效地检测、分选和分配诸如单细胞和单颗粒等的低丰度事件的装置、系统和方法。所有这些方面或优点无需通过任何特定实施方式来实现。因此,各种实施方式可以以实现或优化本文教导的一个优点或一组优点的方式实施,而无需实现本文也可教导或建议的其它方面或优点。
7.本公开内容涉及用于检测、分选和分配生物测定中的液滴(包括确定诸如复杂生物样本中存在的罕见单细胞克隆和实体等的低丰度事件)的系统和方法。
8.以下发明内容仅仅是例示性的,并且不旨在以任何方式进行限制。也就是说,提供以下发明内容以介绍本文描述的新颖且非显而易见的技术的概念、要点、益处和优点。以下在具体实施方式中进一步描述了选择实现。因此,以下发明内容不旨在识别所要求保护的主题的基本特征,也不旨在用于确定所要求保护的主题的范围。
9.提供用于检测、分选和分配油包水液滴或乳液的方法、模块和系统,该油包水液滴或乳液包括微流体系统中的细胞和/或颗粒。提供了用于在低丰度事件相关应用中使用一
个、两个或更多个检测点和/或串行分选来高效地分选和分配单细胞的高级模块、系统和方法。还提供用于使液滴检测和分配同步以支持后处理下游分析的方法和系统。
10.在第一方面,提供用于检测、分选和分配用于生物测定的液滴的系统。系统包括:微流体装置,其包括通过第一分选接头连接至第二通道和废物通道的第一通道;多个油包水液滴,其中多个油包水液滴中的至少两个各自包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒;第一检测器或传感器,其与位于分选接头的上游的、沿着第一通道设置的第一检测点相对应,其中第一检测器包括光学检测器;第二检测器或传感器,其与位于分选接头的下游的、沿着第二通道设置的第二检测点相对应;靶液滴分配模块,其包括设置在第二检测点的下游的分配喷嘴;以及处理器,其被配置为利用由a)第一检测器或传感器在第一检测点处,b)由第二检测器或传感器在第二检测点处,或者c)由第一检测器或传感器和第二检测器或传感器两者检测到的相同靶液滴的光学信号来对分配喷嘴所分配的多个靶液滴中的每一个进行索引。
11.在一些实施方式中,系统还可以包括液滴产生模块、液滴培养模块、或液滴产生加液滴培养模块。
12.在一些实施方式中,至少一个细胞可以是哺乳动物细胞、真核细胞、酵母细胞、细菌细胞、原代细胞、永生细胞、癌细胞、杂交细胞或其衍生物或工程形式。
13.在一些实施方式中,至少一个颗粒可以是微颗粒或纳米颗粒。
14.在一些实施方式中,光学检测器可以包括光电倍增管(pmt)、类相机装置、电荷耦合器件(ccd)相机、互补金属氧化物半导体(cmos)相机或雪崩光电二极管检测器(apd)。
15.在一些实施方式中,第二检测器或传感器可以包括光学传感器或非光学传感器。光学传感器或非光学传感器可被配置为针对至少一个细胞或至少一个颗粒以无区别的方式检测液滴的存在。
16.在一些实施方式中,第二检测器或传感器可以包括光学传感器或非光学传感器。光学传感器或非光学传感器可被配置为检测第二通道中液滴的存在、液滴的相对速度和/或液滴的大小。
17.在一些实施方式中,第二检测器或传感器可以包括光学检测器或非光学检测器。
18.在一些实施方式中,第二检测器或第二传感器可以包括光学检测器。在一些实施方式中,第二检测器或第二传感器可以包括光电倍增管(pmt)、相机、类相机装置、类相机检测器、电荷耦合器件(ccd)相机、互补金属氧化物半导体(cmos)相机或雪崩光电二极管检测器(apd)。
19.在一些实施方式中,第二检测器或传感器可被配置为检测针对多个靶液滴中的每一个的两个或更多个光学信号(例如,图像),其中第二检测器或传感器所检测到的两个或更多个光学信号(例如,图像)包括来自第二检测点的第二信号。在一些实施方式中,针对多个靶液滴中的每一个的两个或更多个图像可以包括由被配置为提供光能的重复短照明的调制或脉冲光源产生的信号。在一些实施方式中,调制或脉冲光源可以可选地包括被配置为提供频闪照明的一个或多个激光器或类激光器源。
20.在一些实施方式中,系统可以包括光学组装件,该光学组装件被配置为在第二检测点处提供用于产生两个或更多个光学信号中的一个的短照明。短照明的持续时间可以在约0.5至约50毫秒,或约5至约30毫秒的范围内。在一些实施方式中,光学组装件可以包括调
制或脉冲激光源,并且其中短照明包括调制或脉冲激光源所提供的频闪照明。在一些实施方式中,第一检测器或传感器可被配置为向光学组装件提供精确的定时触发以触发频闪照明。可替代地或组合地,处理器可被配置为使第一检测器或传感器与调制或脉冲光源的触发同步,以重复地(诸如利用频闪照明)对第二检测点进行照明。
21.在一些实施方式中,系统可以包括光学组装件,该光学组装件被配置为在检测点(例如,第一检测点或第二检测点)提供(例如,利用频闪照明的)液滴成像。上游检测器或传感器(例如,第一检测器或传感器或第三检测器或传感器)可被配置为检测或感测检测点上游的液滴,以便提供第一信号以在适当定时触发照明(诸如频闪照明),从而在指定检测点以高时空分辨率对液滴进行成像(例如,产生第二信号)。通过成像产生的这种信号可用于通知随后的液滴分选和/或液滴分配。处理器可被配置为基于第一信号/图像和第二信号/图像中的一个或多个来使分选和/或分配机构与第一检测器或传感器和第二检测器或传感器中的一个或多个同步。
22.在一些实施方式中,第二检测器或第二传感器可以包括被配置为检测非光学信号的非光学检测器。非光学信号可以表示单个液滴。非光学信号可以包括接触电导率、无接触电导率、阻抗或磁力。
23.在一些实施方式中,系统可以包括一个或多个旁通通道,该一个或多个旁通通道连接至位于分选接头的下游、但位于分配喷嘴的上游的主流体通道(即,该段流体通道是“分选通道”)。旁通通道还可以连接至可用于降低分选通道中的行进液滴的速度的加宽通道、隔间或室(一般为“缓冲区”)。在一些实施方式中,可以在旁通通道和分选通道之间的界面处设置一系列柱或柱阵列,以约束沿着分选通道移动的液滴。
24.在一些实施方式中,至少一个细胞可以用荧光团标记或表达荧光分子。可替代地或组合地,至少一个细胞可以表达发光或致发光分子。
25.在一些实施方式中,至少一个颗粒可以用荧光团标记。
26.在一些实施方式中,第二检测点可被设置在分配喷嘴上游约1cm至约60cm处。
27.在一些实施方式中,本文描述的任何系统还可以包括与设置在第二检测点下游和靶液滴分配模块上游的第三检测点相对应的第三检测器或传感器。在一些实施方式中,第三检测点可被设置在分配喷嘴上游约1cm至约60cm处。
28.在一些实施方式中,本文描述的任何系统可以包括通过第二分选接头连接到第二通道和第二废物通道的第三通道,第二分选接头设置在第一分选接头的下游和靶液滴分配模块的上游。系统还可以包括与设置在第二分选接头下游和靶液滴分配模块上游的第三检测点相对应的第三检测器或传感器。在一些实施方式中,第三检测点可被设置在分配喷嘴上游约1cm至约60cm处。
29.在一些实施方式中,本文描述的任何系统可以包括激光器或类激光器源。激光器或类激光器源可被配置为对第一检测点、第二检测点和/或第三检测点进行照明。类激光器源可以包括发光二极管(led)。在一些实施方式中,系统还可以包括激光调制器,激光调制器包括束分离器,束分离器包括被配置为将由激光器或类激光器源产生的能量束分离成第一束和第二束的光学元件。光学元件可以将第一束和第二束引导到第一检测点或第二检测点,以沿着流体流动方向在第一检测点或第二检测点处提供双聚焦。在一些实施方式中,束分离器的光学元件可以包括光纤分离器,光纤分离器可以将光分离成两个出射激光束。在
一些实施方式中,束分离器的光学元件可以包括诸如wollaston棱镜等的双折射偏振器,其可以将光分离成具有正交或近正交偏振的两个线性偏振出射激光束。
30.在一些实施方式中,系统还可以包括被配置为在第一检测点处沿着第一通道提供双聚焦的光学元件。光学元件可以包括光纤分离器或双折射偏振器,该光纤分离器或双折射偏振器被配置为将由一个或多个激光器或类激光器源产生的能量束分离成第一束和第二束,并将第一束和第二束引导至第一检测点。
31.在一些实施方式中,本文描述的任何系统可以包括激光调制器,该激光调制器包括远程聚焦装置。远程聚焦装置可以包括被配置用于远程聚焦以使得沿着微流体通道(例如,第一通道、第二通道、第三通道等)的不同轴向位置处的多个焦平面能够以快速序列或并行地进行检测的光学元件。远程聚焦装置的光学元件可以包括电气透镜或可调谐声梯度(tag)折射率透镜。可替代地或组合地,系统还可以包括激光调制器,该激光调制器包括被配置为在第一检测点或第二检测点处分别产生跨第一通道或第二通道的均匀、非衍射束的光学元件。光学元件可以包括轴棱锥、环形孔径或空间光调制器。
32.在一些实施方式中,靶液滴分配模块可被配置为以受控方式将靶液滴分配到一个或多个收集管或板中。一个或多个收集管或板可以包括96孔板、384孔板或多孔板。在一些实施方式中,分配模块可以包括x-y-z移动分配器、旋转分配器或其组合。
33.在一些实施方式中,第一信号或第二信号可以包括光学信号、电气信号、或光学信号加电气信号。第一信号或第二信号可被配置为使第一检测点和/或第二检测点中的一个或多个与分配喷嘴同步。
34.在一些实施方式中,本文描述的任何系统还可以包括与第一通道或第二通道相邻的磁体、磁体对或磁体阵列。磁体、磁体对或磁体阵列可以定位在距第一检测点或第二检测点约0.01mm至约30mm的距离处。例如,磁体、磁体对或磁体阵列可以定位在距第一检测点或第二检测点约0.1mm至约10mm的距离处。在一些实施方式中,磁体、磁体对或磁体阵列可以包括永磁体、可调谐电磁体或其组合。
35.在一些实施方式中,处理器可被配置为基于第一信号或第二信号中的一个或多个来使分配喷嘴与第一检测器或传感器或第二检测器或传感器中的一个或多个同步。
36.在另一方面,提供用于检测生物测定中的液滴的系统。该系统包括:微流体装置,其包括第一通道,该第一通道在每个截面内尺寸中具有至少35μm(例如,至少约60μm)的大小;多个油包水液滴,该多个液滴中的至少两个液滴包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒;棱镜,其与第一通道相邻;第一物镜,其被设置在棱镜的第一转角处;第二物镜,其被设置在棱镜的第二转角处,该第二物镜被设置为相对于第一物镜成一定角度;激光器,其被配置为产生激光能量;以及激光调制器,该激光调制器包括远程聚焦单元或产生非衍射束的光学元件,其中激光调制器被配置为在激光能量进入第一物镜或第二物镜中的一个或多个之前对激光能量进行调制。第一物镜或第二物镜中的至少一个被配置为引导调制激光能量以对通过第一通道的第一检测点的多个液滴进行照明。
37.在一些实施方式中,系统还可以包括液滴分选模块。可替代地或组合地,系统还可以包括分配模块。
38.在一些实施方式中,角度可以是约60度至约120度。例如,角度可以是约80度至约100度。优选地,角度可以是约90度。
39.在一些实施方式中,第一物镜或第二物镜可被配置为以相对于第一通道约30度至约60度的角度引导调制激光能量。例如,第一物镜或第二物镜可被配置为以约40度至约50度的角度引导调制激光能量。优选地,第一物镜或第二物镜可被配置为以约45度的角度引导调制激光能量。
40.在一些实施方式中,远程聚焦单元可以包括可调谐声梯度(tag)折射率透镜。
41.在一些实施方式中,产生非衍射束的光学元件可以包括轴棱锥、环形孔径或空间光调制器。
42.在一些实施方式中,棱镜可以包括折射率为约1.28至约1.6的材料。例如,棱镜可以包括折射率为约1.29至约1.58的材料。
43.在另一方面,提供用于检测、分选和分配液滴的系统。系统包括:微流体装置,其包括通过第一分选接头连接至第二通道和废物通道的第一通道;多个油包水液滴,多个油包水液滴中的至少两个各自包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒;第一检测器或传感器,其与位于第一分选接头的上游的、沿着第一通道设置的第一检测点相对应;第二检测器或传感器,其与位于第一分选接头的下游的、沿着第二通道设置的第二检测点相对应,其中第二检测器或传感器被配置为检测针对多个靶液滴中的每一个的两个或更多个图像;分选模块;以及液滴分配模块,其包括设置在第二检测点的下游的分配喷嘴。
44.在一些实施方式中,多个靶液滴可以是第一批靶液滴,并且在第二检测器或传感器的下游或上游进一步分选可以产生第二批靶液滴。
45.在一些实施方式中,系统还可以包括处理器,该处理器被配置为利用由第二检测器或传感器在第二检测点处检测到的相同靶液滴的信号来对分配喷嘴所分配的多个靶液滴中的每一个进行索引。
46.在一些实施方式中,系统还可以包括一个或多个激光器或类激光器源,以在第一检测点产生照明。
47.在一些实施方式中,系统还可以包括被配置为在第一检测点处沿着第一流体通道提供双聚焦的光学元件。光学元件可以包括光纤分离器或双折射偏振器。光学元件可被配置为将一个或多个激光器或类激光器源所产生的能量束分离成第一束和第二束,并将第一束和第二束引导到第一检测点。
48.在一些实施方式中,第一检测器或传感器可以包括快速响应光学检测器。快速响应光学检测器可以包括光电倍增管(pmt)、光电二极管或雪崩光电二极管检测器(apd)。
49.在一些实施方式中,第二检测器或传感器可以包括相机或类相机检测器。
50.在一些实施方式中,针对多个靶液滴中的每一个的两个或更多个图像可以包括由被配置为提供光能的重复短照明的调制光源或脉冲光源产生的信号。在一些实施方式中,光能的重复短照明的每个持续时间可以持续约0.5毫秒至约50毫秒,或约5毫秒至约30毫秒。在一些实施方式中,调制或脉冲光源可以可选地包括被配置为提供频闪照明的一个或多个激光器。在一些实施方式中,频闪照明所产生的信号可以包括第一信号。第一检测器或传感器可被配置为检测或感测来自第一检测点的第二信号。处理器可被配置为基于第一信号和第二信号中的一个或多个来使分配喷嘴与第一检测器或传感器或第二检测器或传感器中的一个或多个同步。可替代地或组合地,处理器可被配置为使第一检测器或传感器与
调制或脉冲光源的触发同步,以重复地(诸如利用频闪照明)对第二检测点进行照明。
51.在一些实施方式中,系统还可以包括光学组装件,该光学组装件被配置为在第二检测点提供光能的重复短单脉冲或脉冲串(诸如频闪照明)。在一些实施方式中,系统还可以包括上游检测器或传感器,该上游检测器或传感器与沿着第一分选接头与和第二检测点之间的第二通道设置的第三检测点相对应。上游检测器或传感器可被配置为向光学组装件提供精确的定时触发以触发频闪照明。可替代地或组合地,第一检测器或传感器可被配置为向光学组装件提供精确的定时触发以触发频闪照明。
52.在一些实施方式中,第一检测器或传感器可被配置为检测或感测来自第一检测点的第一信号。第二检测器或传感器所检测到的两个或更多个图像可以包括来自第二检测点的第二信号。处理器可被配置为基于第一信号和第二信号中的一个或多个来使分配喷嘴与第一检测器或传感器或第二检测器或传感器中的一个或多个同步。
53.在一些实施方式中,系统可以包括光学组装件,该光学组装件被配置为在检测点(例如,第一检测点或第二检测点)提供(例如,利用频闪照明的)液滴成像。上游检测器或传感器可被配置为检测或感测检测点上游的液滴,以便提供第一信号以在适当定时触发照明(诸如频闪照明),从而在指定检测点以高时空分辨率对液滴进行成像(例如,产生第二信号)。通过成像产生的这种信号可用于通知随后的液滴分选和/或液滴分配。处理器可被配置为基于第一信号/图像和第二信号/图像中的一个或多个来使分选和/或分配机构与第一检测器或传感器和第二检测器或传感器中的一个或多个同步。
54.另一方面提供用于液滴检测、分选和分配的系统。系统包括:微流体装置,其包括(i)通过第一分选接头连接到第二通道和第一废物通道的第一通道以及(ii)通过设置在第一分选接头下游的第二分选接头连接到第二通道和第二废物通道的第三通道;多个油包水液滴,其中多个液滴中的至少两个液滴各自包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒;多区检测模块,其包括与沿着第一通道设置的第一光学检测点和沿着第二通道设置的第二光学检测点相对应的一个或多个检测器;液滴分配模块;以及处理器,其被配置为利用由第一光学检测器在第一检测点处检测到的相同靶液滴的光学信号或由第二光学检测器在第二检测点处检测到的相同靶液滴的光学信号来对液滴分配模块所分配的多个靶液滴中的每一个进行索引。
55.在一些实施方式中,一个或多个检测器可以包括多区光学检测器,该多区光学检测器在包括第一光学检测点和第二光学检测点的微流体装置中具有单个检测区域。在一些实施方式中,设置在第一光学检测点和第二光学检测点之间的第一通道或第二通道的至少一部分可以包括从第一光学检测点循环到第二光学检测点的循环通道。可替代地或组合地,多区光学检测器可以包括多通道光电倍增管或相机。
56.在另一方面,提供用于检测、分选和分配液滴的方法。方法包括:向微流体装置的第一通道提供多个油包水液滴,其中多个油包水液滴中的至少两个各自包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒;使多个油包水液滴流过沿着第一通道设置的第一光学检测点;在第一光学检测点处检测来自多个油包水液滴中的每一个的第一信号;基于第一信号来识别第一批靶液滴;通过分选致动器将第一批靶液滴分选到微流体装置的第二通道中,以获得分选液滴;使分选液滴流过沿着第二通道设置的第二检测点或传感器;在第二检测点或传感器处检测来自分选液滴中的每一个的第二信号;基于第二信
号来识别第二批靶液滴;单独分配第二批靶液滴;以及利用第一信号和第二信号中的一个或两个来对第二批靶液滴进行索引,使得每个索引的分配液滴与从第一批靶液滴中的每一个检测到的第一信号和从分选液滴中的每一个检测到的第二信号中的一个或两个精确地匹配。
57.在一些实施方式中,方法还可以包括产生多个油包水液滴、培养多个油包水液滴、或产生多个油包水液滴加培养多个油包水液滴。
58.在一些实施方式中,检测第一信号可以包括检测来自至少一个细胞、至少一个颗粒或至少一个细胞加至少一个颗粒的光学信号。
59.在一些实施方式中,检测第二信号可以包括检测来自至少一个细胞、至少一个颗粒或至少一个细胞加至少一个颗粒的光学信号。
60.在一些实施方式中,检测第二信号可以包括检测指示在第二检测点或传感器处的第二通道内的多个液滴中的一个的存在的光学信号或非光学信号。
61.在一些实施方式中,第二检测点或传感器可被设置在分配模块的分配喷嘴上游约1cm至约60cm的距离。
62.在一些实施方式中,可以基于第一检测点处沿着第一通道的双聚焦来产生第一信号。
63.在一些实施方式中,方法还可以包括利用一个或多个激光器或类激光器源来对第一光学检测点和/或第二光学检测点进行照明。
64.在一些实施方式中,方法还可以包括通过提供双聚焦的光学元件在第一检测点处调制激光。双聚焦光学元件可以包括光纤分离器或双折射偏振器。
65.在一些实施方式中,方法还可以包括通过远程聚焦装置在第一检测点处调制激光。远程聚焦装置可以包括电气透镜或可调谐声梯度(tag)折射率透镜。
66.在一些实施方式中,方法还可以包括调制激光以利用光学元件产生非衍射束。光学元件可以包括轴棱锥、环形孔径或空间光调制器。
67.在一些实施方式中,第二信号可以包括光学信号或非光学信号。
68.在一些实施方式中,检测第二信号可以包括检测针对第一批靶液滴中的每一个的两个或更多个图像。
69.在一些实施方式中,分配可以包括通过分配模块以受控方式将第二批靶液滴分配到收集管或板中。板可以包括96孔板、384孔板或多孔板。
70.在另一方面,提供用于检测、分选和分配液滴的方法。方法包括:向微流体装置的第一通道提供多个油包水液滴,其中多个油包水液滴中的至少两个各自包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒;使多个油包水液滴流过沿着第一通道设置的第一光学检测点;在第一检测点处检测来自多个液滴中的每一个的第一信号,其中基于第一检测点处的沿着第一通道的双聚焦来产生第一信号;基于第一信号来识别第一批靶液滴;将第一批靶液滴分选到微流体装置的第二通道中;使第一批靶液滴流过沿着第二通道设置的第二检测点;在第二检测点处检测来自第一批靶液滴中的每一个的第二信号,其中通过成像产生第二信号;识别第二批靶液滴,第二检测点基于诸如成像等的空间分辨率;以及分配第二批靶液滴。
71.在一些实施方式中,方法还可以包括对第二批靶液滴进行索引,使得每个分配的
液滴与从第二批靶液滴中的每一个检测到的第二信号精确地匹配。
72.在一些实施方式中,检测第一信号可以包括利用快速响应光学检测器来检测第一信号。快速响应光学检测器可以包括光电倍增管(pmt)、光电二极管或雪崩光电二极管检测器(apd)。
73.在一些实施方式中,方法还可以包括诸如利用光学分离器或双折射偏振器来产生双聚焦。
74.在一些实施方式中,检测第二信号可以包括利用相机来检测第二信号。
75.在一些实施方式中,方法还可以包括利用激光器或类激光器源来对第二检测点进行照明。类激光器源可以是led。
76.在一些实施方式中,第二信号可以通过频闪照明产生。方法还可以包括基于第一信号或第二信号来使第一信号的分配和检测或第二信号的分配和检测同步。
77.在另一方面,提供用于检测生物测定中的液滴的方法。方法包括:向微流体装置的第一通道提供多个油包水液滴,其中多个油包水液滴中的至少两个各自包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒,并且其中第一通道的至少一部分在每个截面内尺寸中具有至少35μm(例如,至少约60μm)的大小;使多个液滴流过沿着第一通道设置的第一检测点;将激光能量引导至第一检测点,其中引导包括:(1)使激光能量通过激光调制器,该激光调制器包括远程聚焦单元、产生非衍射束的光学元件或者两者,(2)引导调制激光能量通过第一物镜或第二物镜,其中第一物镜和第二物镜被设置为相对于彼此成一定角度,以及(3)将来自第一物镜或第二物镜的调制激光能量通过与第一通道相邻的棱镜引导到第一检测点上,其中第一物镜和第二物镜分别设置在棱镜的第一转角和第二转角处;当多个液滴流过第一检测点时,检测来自每个液滴的第一信号;以及基于第一信号来识别靶液滴。
78.在一些实施方式中,方法还可以包括从多个液滴的其余部分中分选靶液滴。
79.在一些实施方式中,方法还可以包括分配靶液滴。
80.在一些实施方式中,角度可以是约60度至约120度。例如,角度可以是约80度至约100度。优选地,角度可以是约90度。
81.在一些实施方式中,引导调制激光能量可以包括以相对于第一通道约30度至约60度的角度引导调制激光能量。例如,引导调制激光能量可以包括以约40度至约50度的角度引导调制激光能量。优选地,引导调制激光能量可以包括以约45度的角度引导调制激光能量。
82.在一些实施方式中,远程聚焦单元可以包括电气透镜或可调谐声梯度(tag)折射率透镜。
83.在一些实施方式中,产生非衍射束的光学元件可以包括轴棱锥、环形孔径或空间光调制器。
84.在一些实施方式中,棱镜可以包括折射率为约1.28至约1.6的材料。例如,棱镜可以包括折射率为约1.29至约1.58的材料。
85.在一些实施方式中,整个第一通道在每个截面内尺寸中可具有至少35μm(例如,至少约60μm)的大小。
86.在另一方面,提供了用于检测、分选和分配液滴的方法。方法包括:向微流体装置
的第一通道提供多个油包水液滴,其中多个油包水液滴中的至少两个各自包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒;使多个油包水液滴流过沿着第一通道设置的第一光学检测点;在第一检测点处检测来自多个液滴中的每一个的第一信号;基于第一信号来识别第一批靶液滴;将第一批靶液滴分选到微流体装置的第二通道中;使第一批靶液滴流过沿着第二通道设置的第二检测点;在第二检测点检测来自第一批靶液滴中的每一个的第二信号,其中第二信号通过频闪照明产生;识别第二批靶液滴,第二检测点基于频闪照明;分配第二批靶液滴;以及对第二批靶液滴进行索引,使得每个分配的液滴与从第二批靶液滴中的每一个检测到的第二信号精确地匹配。
87.在一些实施方式中,频闪照明可以由恒定或脉冲光源产生。例如,可以通过直接地或利用声光调制器调制连续波(cw)激光或通过使用诸如q开关激光器等的脉冲激光源来产生频闪照明。
88.在一些实施方式中,检测第二信号可以包括利用相机来检测第二信号。
89.在一些实施方式中,检测第一信号可以包括利用快速响应光学检测器来检测第一信号。快速响应光学检测器可以包括光电倍增管(pmt)、光电二极管或雪崩光电二极管检测器(apd)。
90.在一些实施方式中,第一信号或第二信号可以包括光学信号、电气信号、或光学信号加电气信号。方法还可以包括基于第一信号或第二信号来使第一信号的分配和检测或第二信号的分配和检测同步。
91.在另一方面,提供用于检测、分选和分配液滴的方法。方法包括:向微流体装置的第一通道提供多个油包水液滴,其中多个油包水液滴中的至少两个各自包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒;使多个液滴流过沿着第一通道设置的第一光学检测点;在第一检测点处检测来自多个液滴中的每一个的第一信号,其中通过包括一个或多个检测器的多区检测模块检测第一信号;基于第一信号来识别第一批靶液滴;将第一批靶液滴分选到微流体装置的第二通道中;使第一批靶液滴流过沿着第二通道设置的第二光学检测点;在第二检测点处检测来自第一批靶液滴中的每一个的第二信号,其中通过多区检测模块检测第二信号;识别第二批靶液滴,第二检测点基于成像;以及分配第二批靶液滴。
92.在一些实施方式中,方法还可以包括利用相同靶液滴的第一信号对分配的第二批靶液滴中的每个靶液滴进行索引。
93.在一些实施方式中,一个或多个检测器可以包括多区光学检测器,该多区光学检测器在包括第一光学检测点和第二光学检测点的微流体装置中具有单个检测区域。在一些实施方式中,设置在第一光学检测点和第二光学检测点之间的第一通道或第二通道的至少一部分可以包括从第一光学检测点循环到第二光学检测点的循环通道。在一些实施方式中,多区光学检测器可以包括多通道光电倍增管或相机。
94.在以下关于附图的描述中进一步详细描述这些和其它实施方式。援引并入
95.本说明书中提及的所有出版物、专利和专利申请通过引用并入本文,其程度如同每个单独的出版物、专利或专利申请被具体地和单独地指出通过引用并入。
附图说明
96.在所附权利要求书中特别地阐述了本发明的新颖特征。通过参考以下利用本发明原理的具体实施方式和附图将获得对本发明的特征和优点的更好理解,在附图中:
97.图1例示了根据实施方式的用于微流体装置中的液滴产生(在本文中也称为“包封”)、培养、分选和分配的系统的示意图。分配单元是可选的,并且对于仅需要大量分选和收集液滴内细胞和/或实体的应用而言可被消除。
98.图2示出了根据实施方式的,除包封单元被去除外与图1中所示的系统类似的系统的示意图。可以使用单独的微流体芯片或基于毛细管的平台进行包封。
99.图3示出了根据实施方式的,除包封单元和培养单元被去除(这可以在单独的微流体芯片上或者利用基于微流体管道(例如,毛细管)的平台组合地或单独地完成)外与图1和图2所示的系统类似的系统的示意图。作为替代配置,可以使用仅去除培养单元的、与图1类似的微流体芯片以例如用于瞬时的测定化学,因此可以直接在下游对液滴进行分选而无需单独的培养单元。
100.图4a至图4b示出了展示根据实施方式的、部分地通过使用远程聚焦(rf)在液滴检测单元中包括激光调制的概念和优点的示意图。例如,根据实施方式,可调谐声梯度(tag)折射率透镜(图4a)、电气透镜或其它非衍射照明方案(图4b)(诸如bessel束或airy束等)可以与物镜单元结合使用,作为本文描述的任何系统的检测点。
101.图5a至图5c示出了根据实施方式的作为检测点的一部分的高级光学配置,其使用在棱镜的两个转角处相对于彼此以约60度至约120度角度定位的两个物镜。
102.图6a至图6c例示了根据实施方式的作为检测点的一部分的高级光学配置,其使用以与图5a至图5c中类似的方式在棱镜的两个转角处相对于彼此以约60度至约120度的角度定位、但与如图4所示的远程聚焦装置进一步集成的两个物镜。
103.图7a至图7b例示了根据实施方式的用于在没有运动模糊的情况下对微流体系统中的快速移动靶进行成像的光学配置。
104.图8a至图8f例示了根据实施方式的通道,对于磁性颗粒与液滴中的一个或多个细胞一起包封以用于测定的应用,通道包括在检测点处或在检测点之前具有不同形状、大小、几何形状、功率或布置的单个永久和/或可调谐磁体、永久和/或可调谐磁体对或阵列。如图8a至图8f所示,可以实现不同的设计。
105.图9示出了根据实施方式的用于在微流体装置上进行两步串行分选的系统的示意图。
106.图10示出了根据实施方式的用于在使用具有两个或更多个区的检测模块实现并行检测设计期间进行如图9所示的串行分选的系统的示意图。根据实施方式,可以添加分配单元作为可选的下游单元。
107.图11例示了根据实施方式的具有多通道检测器(诸如用于同时检测两个或更多个并行微流体通道中的液滴的多阳极光电倍增管(pmt)或相机,如图10中所示)的光学配置。
108.图12示出了根据实施方式的具有多个(例如,两个、三个或更多个)检测点(诸如用于液滴迁移时间确定以及从液滴检测到分配的后续同步的pmt或相机)的系统的示意图。根据实施方式,每个分配的液滴可以被跟踪和索引以与在一个或多个光学检测点处收集到的信号数据匹配。
109.图13a至图13b示出了根据实施方式的具有用于在分选和分配期间更精确地跟踪液滴的一个或多个非光学(图13a)和/或光学(图13b)传感器的系统的示例性设计示意图。
110.图14示出了描绘了根据实施方式的具有通过遵循本文描述的一个或多个模块和概念来检测、分选和分配液滴的过程的一般示例性工作流程的流程图。
111.图15示出了根据实施方式的用于处理液滴分选、分配和索引的方法的各种示例性流程图。
112.图16示出了根据实施方式的用于多点检测的光学配置的示意图,其中第一检测点和第二检测点被集成到单个视野中,并且发射光被分离并分别发送到两个下游检测器。
113.图17a至图17b示出了根据实施方式的,包括具有用以降低移动液滴的速度以通过使用相机进行成像的一个或多个旁通通道(即,“缓冲区”)的区段的系统的示意图。
114.图18示出了根据实施方式的具有作为检测点的一部分的双聚焦特征的示例性光学检测器的示意图。
115.图19a至图19d示出了根据实施方式的作为检测点的一部分的高级光学配置的示例性实现,其使用在棱镜的两个转角处相对于彼此以45度角度(图19a和19c)或者在没有棱镜的情况下以45度角度(图19b和19d)定位的两个物镜。
116.图20a至图20b示出了根据实施方式的检测点处的双聚焦特征的示例性实现。
117.图21a示出了根据实施方式的用于多点检测的图16中的设计的示例性实现,其中第一检测点和第二检测点被集成到单个视野中。
118.图21b示出了根据实施方式的使用图21a的系统检测到的示例性信号。
119.图22示出了根据实施方式的作为利用如图17b所示的缓冲区设计的检测点的一部分的液滴成像的示例。
120.图23示出了根据实施方式的液滴检测和索引的示例性实现。
121.图24a示出了根据实施方式的用以检测单个液滴、液滴大小、液滴速度和沿着流动通道的液滴位置的示例性光学传感器及其实现的示例性组装件。
122.图24b至图24d示出了根据实施方式的使用图24a的系统检测到的示例性信号。
具体实施方式
123.在以下具体实施方式中,参考形成其一部分的附图。附图例示了本公开内容的实施方式,并且与具体实施方式一起用于解释本公开内容的原理。附图不一定是按比例绘制的,以便更好地呈现所示主题的某些特征。在附图中,除非上下文另有规定,否则相似的符号通常标识相似的组件。在具体实施方式、附图和权利要求书中描述的例示性实施方式并不意味着是限制性的。可以利用其它实施方式,并且可以在不脱离本文呈现的主题的范围的情况下进行其它改变。将容易理解的是,如在本文中一般描述并在附图中例示的本公开内容的方面可以以各种不同的配置来布置、替换、组合、分离和设计,所有这些配置在本文中予以明确地考虑。
124.尽管下文公开了某些实施方式和实施方式,但是本发明的主题超越具体公开的实施方式延伸到其它替代实施方式和/或用途及其修改和等同项。因此,所附权利要求的范围不受下文描述的任何特定实施方式的限制。例如,在本文公开的任何方法或过程中,该方法或过程的动作或操作可以以任何合适的序列进行,并且不一定限于任何特定的公开的序
列。各种操作可以以有助于理解某些实施方式的方式进而被描述为多个离散操作,然而,描述的顺序不应被解释为意味着这些操作是顺序相关的。另外,本文中描述的结构、系统和/或装置可以体现为集成组件或单独组件。
125.为了比较各种实施方式,描述了这些实施方式的某些方面和优点。所有这些方面或优点无需通过任何特定实施方式来实现。因此,例如,各种实施方式可以以实现或优化如本文所教导的一个优点或一组优点的方式实施,而无需实现如本文也可教导或建议的其它方面或优点。概述
126.本文提供了用以检测、分选和分配微流体装置中的多个油包水液滴以用于包括免疫治疗筛选的各种化学和生物测定的系统、模块、单元和方法。在一些实施方式中,液滴可以包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒。至少一个细胞可以由诸如组织细胞、免疫细胞和/或工程细胞库等的生物样本提供。这些细胞可以包括一般为所提供的总细胞群的≤1%、《0.1%或甚至《0.01%的低丰度靶细胞。
127.本文提供的系统和方法可以提供低至单分子或单细胞水平的快速、高通量、可多重的遗传、蛋白质和其它细胞分析,并且可用于若干应用,包括但不限于免疫细胞、循环肿瘤细胞(ctc)、无细胞核酸和外泌体、癌症起始细胞、细胞药物相互作用和抗性、肿瘤微环境中的细胞-细胞通信的分离和检测,以及使用单分子下一代测序技术的基因组和表观基因组分析。
128.在一方面,本文提供的系统、模块、单元和方法可用于发现免疫治疗剂,特别是双特异性抗体(bsab)。bsab是非天然生物制品,其被工程化为识别相同或不同靶抗原上的两个不同表位。示例性应用之一可以集中于t细胞激活bsab(tab),因为它们目前是bsab的最具代表性子类,尽管所提供的系统和方法可以应用于几乎任何bsab格式。该方法可以采用基于液滴微流体的系统来隔开和询问具有共包封t细胞报告基因的单个bsab产生细胞(可选地也表达靶抗原)。功能性bsab克隆可以能够使t细胞与液滴中抗原表达细胞交联,并激活t细胞报告基因以产生荧光,这进而可以允许从异质群体中检测和分选“阳性”液滴。
129.在一方面,可以使用一个、两个或更多个检测点,检测点包括基于至少一个激光器或至少一个类激光器源的至少一个光学检测点。在一些实施方式中,可以通过独特的光学配置来提供激光,该光学配置包括远程聚焦模块(例如,可调谐声梯度(tag)折射率透镜)、以及在棱镜的两个转角处以约60度至约120度或约90度的角度提供的两个物镜,以提供在检测点处穿过微流体装置的通道中的通过液滴的光学焦平面。在一些实施方式中,可以在微流体装置中提供任何截面内尺寸为至少35μm(例如,至少约60μm)的通道,以使得能够对通道中的通过液滴进行光学检测,而不收缩这些液滴,否则当使用一般窄于约35μm或约40μm或约50μm的通道时,液滴通常可能被收缩。例如,在任何截面内尺寸中,通道可以在约35μm至约200μm的范围内,优选地在约40μm至约120μm的范围内。在一些实施方式中,在任何截面内尺寸中,通道可以在约60μm至约200μm的范围内,优选地在约60μm至约150μm的范围内。可替代地或组合地,所提供的激光可以被调制为非衍射束。可以通过使用诸如轴棱锥透镜、环形孔径,或空间光调制器等或其任何组合等的光学装置来实现非衍射束。在一些实施方式中,棱镜可以由折射率为约1.28至约1.6或约1.29至约1.57的材料制成。
130.在一些实施方式中,检测器可以包括扫掠镜和/或诸如频闪照明等的重复短照明,
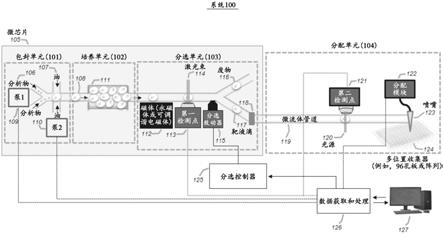
以便有效地去除由于快速移动对象(诸如快速流动的液滴及其中包含的实体)引起的图像模糊。在一些实施方式中,检测器可以包括光学检测器,该光学检测器与磁体或磁力源耦合,以改善在微芯片的通道中的检测点处或之前的通过液滴所包含的磁性或顺磁性颗粒的光学聚焦。
131.在另一方面,所提供的系统可以利用在微流体装置中包括两个或更多个并行通道的单个多区检测模块来递送通过液滴的并行检测。
132.在又一方面,液滴跟踪和/或索引可以由至少一个检测器或至少一个传感器提供。跟踪和/或索引可以部分地基于光学信号和/或非光学信号(诸如接触或无接触电导率、阻抗和/或磁力等)。在一些实施方式中,可以使用至少一个检测器加至少一个传感器来提供数据,以沿着微流体装置的通道中的流动方向从上游检测点向下游分配点跟踪或索引通过液滴。在一些实施方式中,液滴中的实体(诸如细胞和颗粒)可设置有荧光标签以能够实现光学检测。在一些实施方式中,液滴分选点可紧接在检测点之后实现。在一些实施方式中,至少一个检测器和至少一个传感器可以可选地以串联方式实现,紧接在分选点之后,但在分配点之前。在一些实施方式中,至少一个传感器可以是光学传感器、非光学传感器或两者的组合或实现。
133.在又一方面,可以沿着微流体装置的流动通道在分配模块的分配喷嘴上游约1至约60cm处实现最终检测点。在一些实施方式中,分选的液滴可以通过分配模块以受控的方式分配到收集管或板(诸如96孔板、384孔板或多孔板或平台)中。在一些实施方式中,可以向分配的液滴提供索引,以将分配的液滴与反映在上游光学检测点处检测到的液滴的光学信号的收集数据精确地匹配。
134.部分地使用本文描述的系统、模块和单元来提供用于检测、分选和分配液滴的方法和过程。在一些实施方式中,过程可以包括:在微流体装置中提供多个油包水液滴,至少一些液滴各自包括至少一个细胞、至少一个颗粒、或至少一个细胞加至少一个颗粒;使液滴沿着微流体装置的通道通过基于激光的光学检测的第一点并进行检测,以识别第一批靶液滴;通过分选致动器来分选第一批靶液滴以获得分选液滴;沿着微流体装置的通道通过第二检测点检测分选液滴以识别第二批靶液滴;以及单独地分配第二批靶液滴。每个分配的液滴可被索引,以使得每个索引的分配液滴与反映在上游检测点处检测到的液滴的光学信号的收集数据精确地匹配。
135.在一些实施方式中,通过基于激光的光学检测的第一点检测液滴可以包括:(1)通过远程聚焦单元调制的一个或多个激光器、产生非衍射束的光学元件或两者;(2)棱镜,其定位在微流体装置的通道的上方、下方或旁边,该通道在每个截面内尺寸中具有至少35μm(例如,至少约60μm)的大小;(3)两个物镜,其在棱镜的两个转角处相对于彼此以约60至约120度或约90度的角度放置,其中至少一个物镜用于提供调制激光以对穿过微流体装置中的通道的液滴进行照明。
136.在一些实施方式中,液滴中所提供的颗粒可以是各种形状或几何形状的微颗粒或纳米颗粒,其大小范围为约30纳米(nm)至约30微米(μm)或约100nm至约15μm。颗粒可以由不同材料制成,并且可以用包括蛋白质、抗体和功能性化学基团的分子标记。
137.在一些实施方式中,微流体装置中的液滴移动(在本文中也称为流动)可以由泵或其它压力控制器所产生的压力驱动。在一些实施方式中,液滴速度可以在约1mm/s至约
900mm/s的范围(对应于约30hz至约2000hz或更高的分选频率)内。
138.在一些实施方式中,所提供的系统可以包括用于液滴产生和/或培养的可选单元,其中液滴产生和/或培养可以在检测点之前在相同或单独的微流体装置上进行。在一些实施方式中,液滴可以在单独的容器中在芯片外培养。在一些实施方式中,系统可以提供被索引的分配液滴,使得分配液滴的标识可以与该单个液滴的相应数据精确地相关。这些数据可以在分配步骤之前的一个或多个检测点处收集,以便实现更全面的下游后处理分析。
139.在另一方面,可以提供来自分选点的一批分选液滴以通过另一分选步骤(即,串行分选),从而增加最终靶液滴的纯度,这对于具有包括低丰度靶事件的非常复杂的生物起始样本的应用来说可能是重要的。在一些实施方式中,这种串行分选可用于分选包含在多重测定中具有不同特性的实体或测定的液滴。在一些实施方式中,第二分选单元可被配置为使得第一检测点和第二检测点将处于基于多通道检测模块(诸如多通道光电倍增管(pmt)或相机(或类相机装置))的检测器的相同视野(约0.5mm至约5mm)中。
140.在一些实施方式中,为了克服快速移动靶的运动模糊,可以通过在较长相机曝光周期期间以相同速度移动靶的图像(例如,通过将可移动(扫掠)偏转器添加到由物镜透镜和镜筒透镜组成的检测路径中)来补偿行进液滴中的靶(例如,颗粒或细胞)的运动。为了在适当的时间触发图像偏转,还可以在成像装置的上游添加颗粒检测器/传感器。上游颗粒检测可以以若干方式实现,包括但不限于光学、电气和磁性检测。
141.在一些实施方式中,可以使用短(即,短暂)照明来对移动靶成像以克服运动模糊。照明必须足够短,以确保靶移动小于期望空间分辨率(例如,在100毫米/秒(mm/s)流速时,对于1μm空间分辨率,照明小于10μs)。在一些实施方式中,一个成像帧的短照明(例如,频闪照明)的每个持续时间可以持续约0.5毫秒(ms)至约50ms、约0.5ms至约10ms、约5ms至约20ms、约10ms至约30ms或约20ms至约50ms。在一些实施方式中,提供短照明作为调制光源或脉冲光源。在一些实施方式中,调制可以是短的单脉冲或脉冲串(例如,针对每个相机曝光周期为1-1000个脉冲),其中每个重复脉冲具有持续约1纳秒(ns)至1ms、约1ns至99ns、约50ns至500ns、约200ns至约999ns,或约400ns至1ms的持续时间。例如,可以通过直接地或利用声光或电光调制器调制连续波(cw)激光或通过使用q开关或锁模激光器的脉冲来产生一种重复的短照明,即频闪照明。短照明可以与检测移动液滴的相机检测器同步。
142.在一些实施方式中,可以通过减慢在装置中的图像检测区(即,“缓冲区”)中移动的液滴来使液滴图像的运动模糊最小化或减少。缓冲区可以包括连接到主微流体通道的一个或多个旁通通道,使得主流体通道中的流体将部分地进入旁通通道以有效地降低液滴移动速度,从而减少液滴成像的运动模糊。在一些实施方式中,可以在主流体通道和旁通通道之间的界面处提供两个或更多个柱,以约束沿着主通道移动的液滴。在一些实施方式中,缓冲区可以包括主流体通道的加宽段。在一些实施方式中,缓冲区可以包括通过旁通通道连接到主流体通道的一个或多个隔间或室。创建缓冲区可以与重复的短照明相结合以增强运动模糊的抑制。
143.在一些实施方式中,为了利用相机检测器在检测点捕捉对应于液滴的不同轴向位置的多个焦平面,可以使用用于远程聚焦的光学装置,并且该光学装置与相机曝光周期以及可选地与照明源调制同步。远程聚焦装置的示例是tag(可调谐声梯度)透镜和电气可调谐透镜(etl;例如,optotune switzerland ag)。远程聚焦装置可被同步以在不同图像内的
不同焦深处或在相同图像内重叠的多个焦深处拍摄相同液滴的多个图像。基于这些图像,在同一液滴内的不同轴向位置处出现的珠和细胞能够以更好的焦点捕捉。例示性实施方式
144.在一些实施方式中,如图1所示的系统100可以包括具有包封单元101、培养单元102、分选单元103和下游的基于微流体管道(毛细管)的分配单元104的微芯片(即,微流体装置)105。在包封单元101中,一种或多种分析物106可以注入第一入口,并且可选地与表面活性剂107混合的载体油可以利用本领域普通技术人员基于本文中的教导而已知的任何类型的泵(诸如注射泵和压力泵等)以约1μl/min至约100μl/min或更高的流速注入第二入口。细胞和/或颗粒可以共包封到液滴108中。
145.如本文所使用的,术语“微流体装置”、“微流体芯片”和“微芯片”通常可互换使用,其一般是指蚀刻或模制到材料(例如,玻璃、硅、塑料、聚合物或聚二甲基硅氧烷)中的一组微通道,其中形成微流体芯片的微通道连接在一起以实现期望的特征(例如,混合、泵送、分选、生化环境控制等)。应理解,本领域技术人员可以容易地在适当装备的机械或生物医学工程实验室或微机电系统(mems)/微制造核心设施中制造这样的微流体装置。
146.如本文所使用的,术语“液滴”一般是指由一种或多种不混溶或部分不混溶的液体(也称为“乳液”)包围的少量液体。对于诸如单细胞分析等的生物和化学测定,液滴体积可以在约0.01nl至约10nl、优选地约0.02nl至约2nl的范围内。预期本领域技术人员可以容易地利用注射泵或压力泵、具有流动焦点或t形接头特征的微流体芯片,和/或诸如3m
tm novec-7500
tm
油和惰性油(fc-40)等的生物相容性油、诸如浓度范围为约0.5%w/w至约3%w/w或更高的peg-pfpe三嵌段或二嵌段共聚物等的稳定表面活性剂来产生液滴,所有这些可以在适当装备的机械或生物医学工程实验室或mems/微制造核心设施中广泛获得。
147.如本文所使用的,术语“细胞”一般是指诸如人和小鼠细胞等的哺乳动物细胞、癌细胞、源自新鲜组织的原代细胞、诸如b和t细胞等的免疫细胞、诸如昆虫细胞等的非哺乳动物脊椎动物细胞、酵母或真菌细胞、细菌细胞、细菌噬菌体、杂交细胞及其任何衍生物或工程形式的细胞。应理解,细胞可以利用诸如fam(羧基荧光素)、calcein am、green cmfda、draq7、alexa fluor系列染料和dylight系列等的荧光染料、诸如gfp(绿色荧光蛋白)、yfp(黄色荧光蛋白),egfp、zsgreen、mrfp(红色荧光蛋白)和mcherry等的荧光蛋白、以及荧光酶底物来标记。
148.如本文所使用的,术语“颗粒”通常可与“珠”或“颗粒对象”或“颗粒实体”互换使用,其中“珠”或“颗粒对象”或“颗粒实体”一般是指尺寸范围为纳米(“纳米颗粒”)至微米(“微颗粒”)的固体或软固体对象,其可以表现出反映球体、圆柱体、管、棒、椭圆体和/或分支构型的形状或几何形状。颗粒可以选自包含有机和无机微珠、聚苯乙烯或塑料或玻璃珠、微球、硅珠、纳米颗粒、量子点、磁珠或顺磁珠、琼脂糖凝胶、藻酸盐微凝胶和水凝胶的组,它们的等效直径范围为10nm至50μm,优选为20nm至20μm以及更优选地为约50nm至约15μm。
149.应理解,颗粒通常可从诸如thermo fisher、bd biosciences、bio-rad、r&d systems、biolegend、spherotech和abcam等的多个商业厂商获得。可替代地,这些颗粒对象可以由本领域技术人员在化学或材料科学实验室中制造。还应理解,颗粒可以按照原样,或利用以下各项进行预标记或者被功能化:(1)荧光团,诸如alexa fluor 405、fitc、gfp和alexa fluor 647;(2)亲和试剂,诸如第二抗体和蛋白a;(3)测定酶,其可产生荧光或发光;
(4)化学基团;以及/或者(5)衔接分子,诸如生物素和链霉亲和素。
150.在一些实施方式中,如图1所示,所收集的液滴可以在模块111处在芯片上培养或在芯片外培养预先确定的持续时间,这取决于特定的测定。在一些实施方式中,培养模块111可以包括选自温度控制单元(具有约4℃-98℃的优选温度范围)、氧气控制单元(具有约0.01%-30%的优选o2水平)、二氧化碳控制单元(具有约0.1%-20%的优选co2水平)和/或湿度控制单元(具有约50%至99%的优选湿度水平)的一个或多个环境控制单元。在培养后,可以将液滴重新注入到微芯片中以进行检测和分选。可选地,可以使用永久或可调谐电磁体(单个、对和/或阵列)或两者(例如,与模块112)的组合将液滴内的颗粒聚焦用于检测,以在第一检测点113之前增强聚焦。在一些实施方式中,在使用激光诱发荧光(lif)检测方法的情况下,第一检测点113可以基于具有光学检测器和单色激光束或多色激光束114的光学检测。
151.如本文所使用的,检测点一般是指在微流体装置的通道内对应于焦点或在包括检测器和可选辅助组件的检测模块的范围内的位置。检测模块可以能够检测限定在微流体装置的特定空间(例如,通道或储存器的片段)中的液滴内的细胞、颗粒和/或测定读出信号。检测可以是定量的或半定量的。在一些实施方式中,检测模块可以是光学检测器,并且辅助组件可以选自物镜、反射镜、反射器、透镜和光源(诸如激光器、氙气灯和/或发光二极管(led))。示例性光学检测器包括光电倍增管(pmt)、类相机装置、电荷耦合器件(ccd)相机、光电二极管、互补金属氧化物半导体(cmos)相机和/或雪崩光电二极管检测器(apd)。在一些实施方式中,检测模块可以基于非光学检测器。
152.一般来说,沿着流动方向紧挨在分选接头上游(即,在分选接头之前)的第一检测点113可以包括快速响应检测器。示例性快速响应检测器包括诸如pmt、光电二极管和/或apd等的光学检测器。
153.在一些实施方式中,检测信号可以被发送到数据获取和处理单元126以进行信号处理。在检测到指示阳性液滴(即,“靶液滴”)的信号时,获取和处理单元126可以将触发信号递送到分选控制器125。分选控制器125然后可以激活分选致动器115以将移动靶液滴117重新引导到微流体装置中的靶收集通道。当分选致动器115未被触发时,通道中的移动液滴可继续其运动并进入废物通道116。同时,在获取和处理单元126处收集的数据可以可选地被发送到计算机127以用于存储和进一步分析。
154.如本文所使用的,术语“数据获取和处理单元”通常可与“处理器”、“处理单元”或“处理芯片”互换使用,其中“处理器”、“处理单元”或“处理芯片”一般是指可通过进行指令所指定的基本算术、逻辑、控制和输入/输出操作来执行计算机程序的指令的电子电路和/或装置。处理器的基本操作可以包括但不限于处理所收集的样本信号并将所得到的信号转换成可由计算机操纵的数字数值。处理器可以向其它系统单元和接口(例如,分选控制器单元)发送指令以发起过程(例如,激活分选致动器)。示例性处理器是中央处理单元(cpu)、现场可编程门阵列(fpga)、微处理器(包含在单个集成电路(ic)上的中央处理单元)、专用指令集处理器(asip;片上系统设计中所使用的组件)和数字信号处理器(dsp;专用于数字信号处理的专用微处理器)。
155.在一些实施方式中,液滴分选可以通过分选模块在微流体装置上的分选接头或分选点处进行;这种分选模块能够以可与紧挨的上游检测点同步的方式基于介电泳(dep)机
构、声机构、压电机构、基于微阀的机构、基于动态流偏转的机构和/或基于电容的机构,其中紧挨的上游检测点一般可由数据获取和处理单元控制。
156.在一些实施方式中,分选的靶液滴可以通过衔接器118被引导到微流体管道(或通道或毛细管)119中。衔接器可以是塑料管道或本领域普通技术人员基于本文的教导而已知的外径(od)范围为约0.1至约5mm的任何其它自适应连接器。由玻璃、聚合物或内径(id)为约0.02至1.5mm、优选为0.05至0.15mm的任何其它材料制成的微流体管道(例如,毛细管)可以是原始的或涂覆的。
157.在一些实施方式中,第二检测点121可用于验证靶液滴已被分选。可替代地或组合地,在一些应用中,第二检测点121可用于从分选液滴提取和/或提供附加信息,诸如细胞内的空间荧光分布。另外,第二检测点121还可以与数据获取和处理单元126结合工作,以精确地触发分配模块122以分配分选液滴。与第一检测点113类似,激光源或光源120可用于对第二检测点进行照明以产生由与第二检测点121相关联的检测器检测到的信号。具有喷嘴123的分配模块122可以包括被配置为将喷嘴123移动到分配收集器124(例如,移动到多孔板收集器124的特定孔)的x-y-z移动台或旋转移动台。分配收集器124可以是96孔板、384孔板、1536孔板或任何其它多孔板、pcr管、pcr条或任何感兴趣阵列。
158.图2描绘了除液滴在芯片外产生外具有与图1的系统100中类似的设置的系统150。系统150可以包括包含培养单元151、位于培养单元151下游的分选单元152的微芯片154以及位于分选单元152下游的分配单元153,其中分选单元152可以与本文描述基本上类似,例如包括相应的第一检测点162和第二检测点170、分选致动器164、通过分选接头彼此连接的第一通道和第二通道等。液滴可以在单体的微流体包封芯片上产生,原则上,该微流体包封芯片的功能与图1中描述的包封单元101类似。然后可以例如通过加压机构将液滴提供到微芯片154的通道中,用于如本文所述的后续芯片上培养、检测、分选和/或分配。在一些情况下,在芯片外(例如,在单独的微流体包封芯片上)产生液滴可能是有益的。根据测定类型和应用,可能需要不同的设置和操作条件来实现最优的液滴产生,从而能够实现诸如液滴分选等的高效下游处理,这在完全集成的多功能微流体芯片上可能不可实现或不实际。
159.图3示出除液滴也在芯片外培养(或不培养)外具有与系统150中类似的设置的系统190。系统190可以包括包含位于通道入口下游的分选单元191的微芯片193以及位于分选单元191下游的分配单元192,其中分选单元191可以与本文描述基本上类似,例如包括相应的第一检测点199和第二检测点206、分选致动器200、通过分选接头彼此连接的第一通道和第二通道等。液滴能够以与本文描述的片上培养基本上类似的方式培养。然后可以例如通过加压机构将液滴提供(例如,移液、注入等)到微芯片193中,用于如本文所述的后续芯片上检测、分选和/或分配。
160.在一些实施方式中,如系统100、150和190(图1至图3)中所示,包封在液滴中的颗粒可以可选地通过由永久或可调谐电磁体(例如,单个磁体、磁体对和/或磁体阵列)施加的磁力聚焦,以在第一检测点(例如,分别为第一检测点113、163或119)之前增强聚焦,在这种情况下,单色激光束或多色激光束可用作激发源以供激光诱发荧光检测。
161.许多感兴趣的靶(例如,细胞)是复杂生物样本中的低丰度或罕见事件。例如,一般应当理解,抗原特异性原代b细胞通常占b细胞免疫库的《0.1%或《0.01%,并且抗原特异性原代t细胞可以以低于t细胞免疫库的0.01%或0.001%的方式存在。如本文所使用的,术语“低丰度”一般是指低于约1%的任何发生率。如本文所使用的,术语“罕见”一般是指低于约0.1%的任何发生率。
162.此外,诸如源自血液或其它组织的常见生物样本通常非常复杂,这可能与高背景信号相关,使得任何筛选测定都是一项艰巨的任务。为了通过基于液滴的测定来有效地确定和分离低丰度或罕见事件,测定系统应以高灵敏度和特异性两者进行。如果包括在系统中,则光学检测模块可以提供高信噪比(snr)和信背比(sbr)。因此,可能需要均匀高的空间分辨率。同时,为了能够处理大量样本(诸如数百万个b细胞、t细胞或其它类型的细胞),时间分辨率(即,检测速度)应该较高。然而,实现高时间分辨率和高空间分辨率可能具有挑战性。
163.实现高时间分辨率的一种常见方法是使用单点光电倍增管(pmt)。pmt是可提供超过1000万个计数/秒的光子计数速率的高灵敏度光学检测器,从而允许超过100万个样本/秒的高采样速率。同时,在流体通道中广泛使用的照明方法是用圆柱形光学元件聚焦激光束,以便用薄片光对通道进行照明。因此,可分辨的最小对象大小对应于光片的厚度,光片的厚度又由聚焦透镜的数值孔径(na)确定。除了焦斑的扩展外,透镜的na值还控制焦深/共焦参数。共焦参数定义了随着距透镜焦平面的距离增加,散焦发生得多快。不幸的是,焦斑大小和焦深这两个参数都与na相关,使得随着na值增加,焦斑变小,同时散焦发生得更快。在焦平面处通过激光片的颗粒可以以高空间分辨率检测,而在束的外围通过的颗粒可以具有加宽的信号轮廓。因此,传统的片状照明在焦平面中的最大可实现空间分辨率和可实现该分辨率的景深之间提供折衷。
164.为了克服前述段落中描述的问题,本发明人设计了使用照明束的远程聚焦(即,“重新聚焦”或“rf”)的新颖策略,以有效地创建薄的均匀照明轮廓并提供独立于轴向位置的检测效率,如图4a(模块300)所示。rf的使用可能是有利的,因为与常规物镜相比,rf可以增加景深,并且可以提供具有亚微秒时间分辨率的用户指定可变焦距。可替代地或组合地,可以如图4b(模块310)所示使用诸如bessel束或airy束等的非衍射束。
165.对于涉及从大量异质或复杂起始样本检测和分选低丰度事件的应用,非常期望实现均匀的高空间分辨率而没有时间分辨率的任何折衷。在以下描述中,提供示例作为基于液滴的细胞分选应用。应当注意,本文描述的方法、装置和系统的益处并不意味着限于该特定应用,而是可以普遍适用。该具体示例有助于例示本文提出的系统的基本原理。
166.为了发现抗体,可以通过遵循已确立的方案从免疫动物的脾或骨髓中制备诸如原代b细胞等的抗体产生细胞,作为单细胞悬液。这些抗体产生细胞可以与可结合从包封b细胞分泌的抗原特异性抗体(即,“感兴趣的抗体”)的荧光标记抗原(即,“染色抗原”)一起包封在本文所述的液滴中。然而,在至少一些情况下,标记抗原可以均匀地分布在整个液滴中,使得荧光信号将是相同的,而与感兴趣的抗体的存在或不存在无关。该问题可以通过将微球与功能性表面共包封来克服,其中功能性表面可以例如通过诸如蛋白a和抗igg抗体等的igg亲和试剂来特异性地锚定从共包封的细胞释放的抗体。微球可以捕捉感兴趣的抗体,该抗体又可以捕捉荧光标记的抗原,从而导致在微球上形成荧光焦点。荧光焦点可以作为阳性液滴(即“靶液滴”)的测定读出进行光学检测,其中阳性液滴可以实时或近实时地分选和分配。两个因素可以确定检测这样的荧光焦点的光学信号的准确度和效率:
167.空间分辨率应足以分辨液滴内的微球,例如100μm液滴内的5μm微球;
168.应充分抑制离焦信号,以将定位到微球的信号与可归因于液滴中未结合的荧光标记抗原的信号分离。
169.因此,照明束可以聚焦到薄片中以产生足够的空间分辨率来区分诸如颗粒或细胞等的小特征。然而,紧密聚焦可能导致更大的束发散,这进而可能导致焦平面上方和下方的空间分辨率的损失。检测到的信号可以是液滴内未结合的染色抗原与经由感兴趣的锚定抗体结合到微颗粒的染色抗原的总和。如果液滴在颗粒靠近焦平面的情况下通过检测点,则可以清楚地分辨颗粒信号。然而,如果液滴内的颗粒在焦点边缘附近通过,则颗粒信号将是宽的,并且具有较低的振幅,这可能与液滴内的游离染色抗体的信号不可区分。因此,可能产生大量的假阴性事件。为了克服这个问题,如本文(例如,在图4a和4b中)所述可以使用扩展的景深照明和检测。
170.图4a例示了在本文描述的任何系统的检测点处使用rf来调制激光能量束。图4b例示了在本文描述的任何系统的检测点处使用nbd束来调制激光能量束。在这两个实施方式中,光束可以通过将光聚焦到瞄准样本的物镜透镜(304/314)的后孔径中的圆柱形光学元件,在这种情况下,沿着包括支撑基板(303/313)的微芯片(301/311)的通道(302/312)递送通过检测点。在示例性实施方式中,微芯片301/311可以由玻璃基板303/313上的pdms制成。
171.沿着圆柱透镜的聚焦轴,在给定圆柱元件的适当焦距的情况下可以通过物镜透镜的放大因子来使初始束缩小。初始束直径、圆柱透镜的焦距和/或物镜透镜的放大因子可被调节以使照明跨越样本平面处的流体通道的宽度。沿着圆柱透镜的非聚焦轴,平行照明束可以不改变,直到它通过将光聚焦到样本处的片中的物镜透镜为止。
172.最小片宽和共焦参数可以由物镜透镜的na和入射束直径(即,物镜透镜的有效na)定义。来自物镜透镜的焦平面的光可以经由束分离器收集并与照明分离,并聚焦到孔径上。孔径的目的是拒绝来自样本处的离焦平面的光以减少背景噪声。矩形孔径可以比圆形孔径更优选,以更好地匹配跨通道延伸并沿着通道聚焦的照明轮廓的形状。在不添加更多光学元件的情况下,必须进行若干折衷,以使该配置起作用:1.如果使用非常有效的照明na,则光片在流体通道的中心可以是薄的,但是朝向通道的边缘是宽的;2.通过作为替代降低有效照明na,可以以降低空间分辨率为代价创建更均匀的照明轮廓;3.在物镜透镜放大之后与光片的xy维度匹配的共焦孔径可以最有效地抑制来自没有被光片直接照明的xy位置的背景光。它还可以抑制来自不在物镜透镜的焦平面附近的轴向位置的信号,从而导致这些区域中的灵敏度损失;以及4.较大的共焦孔径可以允许检测来自通道的整个高度的信号,但可能导致增加的背景。
173.使用如图4a至图4b所示的远程聚焦(305和315)可以克服这些折衷中的一些或全部。通过在物镜透镜与样本接合之前引入具有可变焦距的透镜,样本焦平面可以沿轴向方向移动,如图4a所示。因此,即使照明/检测在轴向方向上高度受限,诸如整个通道高度的大轴向范围也可以经由焦点的光学平移可访问。可替代地,非衍射束可用于产生具有最小发散度(315)的片状照明,如图4b所示。利用任意远程聚焦设置,先前矛盾的参数优化方案可以通过以下方式使空间分辨率、景深和高背景噪声抑制最大化:
1.高效照明na可用于使照明束沿着通道的方向紧密地聚焦,从而在与样本结合的物镜透镜的焦平面处导致改善(例如,最大)的空间分辨率;2.在检测器之前可以使用与片状照明的xy维度匹配的共焦孔径以抑制背景噪声以及来自片厚度大的离焦平面的低分辨率信号;3.通过上述措施1和2,我们有效地将我们的检测限制到通道高度的一小部分。为了检测具有相同空间分辨率和灵敏度的颗粒,可以经由远程聚焦沿着光轴平移激发/有效检测体积;以及4.平移可以发生得足够快以不影响采样速度。在优选实施方式中,在需要一个样本的时间期间,应沿着通道的整个轴向延伸至少扫描通道一次。
174.虽然许多方法和光学模块可用于远程聚焦以支持我们提出的系统和方法,但不限于我们聚焦于使用tag透镜的高速度以避免采样速率(即,时间分辨率)的折衷。本文描述了至少两种远程聚焦设计:1.图4a所示的模块300:可使用远程聚焦来扩展光学检测的景深,以在整个通道高度内实现均匀分辨率和检测效率;2.图4b所示的模块310:使用非衍射束对整个通道高度进行均匀照明以实现均匀分辨率和检测效率。
175.为了以高灵敏度和特异性筛选包含相关细胞/分子(328、348、349、377、378、400、420、421、439和440)的液滴(327、347、376、399、419和438),光学检测设置应提供高snr和sbr比,同时保持高时间分辨率以实现高通量。因此,期望与高检测效率相结合的均匀高空间分辨率。除了颗粒或细胞的存在之外,颗粒或细胞在筛选体积内的空间位置也可能是感兴趣的。在高通量微流体测定系统中,这可能具有挑战性。
176.如本文所述,可以使用空间调制来提取与细胞或颗粒的大小、形状和/或位置有关的信息。可以用空间调制图案照明样品和/或检测光。根据颗粒或细胞的大小、形状和/或位置,向信号添加附加调制。通过适当的“解调”,可以推断颗粒或细胞的大小、形状和/或位置。然而,利用这种方法,将空间信息编码到时域中,从而导致时间分辨率的损失。
177.在用以克服这种挑战的替代实施方式中,可以在本文所述的任何系统中利用图5a至图5c中例示的、具有解耦的垂直照明和检测以使用单点检测器或相机高速提取与样本有关的空间信息的模块。如本文的其它实施方式中所述,例示的方案可以允许在相同的细胞/颗粒通过两个垂直光学平面时检测信号强度两次。通过将照明/检测平面相对于通道方向以约45度定向,我们可以克服在照明/检测垂直于通道的情况下可能成问题的有限焦深。因此,模块可以允许使用高na的透镜,同时还保持独立于通道高度的各向同性检测效率。图5a-图5c所示的模块在与本文描述的任何系统结合使用时还可以允许收集更多的光子并因此检测更低的强度信号以及识别更精细的空间特征。所提出的新设计可用于检测液滴内的一个、两个或更多个细胞和/或颗粒(图5a至图5c)。新设计还可以允许在跨两个垂直光学平面的液滴内检测给定细胞或颗粒两次(即,在液滴和/或通道内的两个不同位置检测)。此外,通过将照明/检测平面相对于通道方向以约45度定向,可以克服耦合的照明/检测光路垂直于通道方向的传统光学设置中的焦深限制。因此,图5a至图5c所描述的模块可以允许使用具有高na的透镜,同时保持独立于通道高度的各向同性检测效率,从而导致收集更多的光子并因此检测到更弱的信号以及更精细的空间特征。
178.在需要检测和分选单细胞或颗粒的应用中,非常需要实现高且均匀的空间分辨率而没有时间分辨率或检测效率的任何折衷。另外,收集尽可能多的信号光子以最大化信号强度并增强检测微弱信号的能力是至关重要的。例如,在抗体发现中,抗体产生细胞的某些细胞或亚细胞结构的存在或不存在可以是细胞是否为阳性的决定因素。为了对于这些结构获得显著分辨率,需要高且各向同性的空间分辨率。
179.传统的基于单物镜透镜的方法的问题是:为了最大化空间分辨率以及检测效率,需要高na透镜;1.高na透镜具有有限的焦深。当焦平面附近的对象被清晰分辨时,远离焦平面的对象的空间特征将出现模糊;2.如果成像平面与通道方向平行,则相机作为检测器的作用有限。为了对整个通道的截面进行成像,成像平面需要以一定角度定向。来自离焦平面的信号模糊,因此无法分辨那些离焦位置处的对象的空间特征。
180.在如图5a至图6c中例示的一些实施方式中,提供用以克服该问题并提高检测液滴内细胞和/或颗粒的灵敏度和准确度的系统,该系统包括以与通道方向成一定角度定位的解耦但垂直的激发和检测,并且可以如下面的段落中所描述地使用。
181.在系统中,两个物镜透镜(322/324、342/344、371/373、393/395、413/415和433/435)可以彼此垂直或近垂直地定位,其中通过物镜的激发激光束以约30-60度、约40-50度或约45度的角度与微流体通道接合。在激发路径中,可以使用圆柱光学元件来产生用于对微流体通道(329、350、380、401、422和441)的截面进行照明的光片(330/331、351/352、379、402/403、423/424和442)。该截面可以经由物镜透镜成像到检测器上,该检测器可以是诸如pmt等的单点检测器或诸如相机等的多通道检测器。因此,在观察平面中,空间分辨率可以由检测透镜的na限定。垂直于观察平面,空间分辨率可以由用于照明的光片的厚度确定,其又可以取决于激发透镜的na。
182.为了使通过具有不同折射率的材料的照明/检测所引入的光学像差最小化,可以使用棱镜(323、343、372、394、414和434)来旋转界面。作为棱镜的替代或除了棱镜之外,折射率匹配流体(326、346、375、398、418和437)可用于改善信号质量。由于第一物镜和第二物镜的布置可以是对称的,因此任意物镜透镜可以用于照明或检测。因此,通过引入束分离器,检测器和光源可以分别安装到每个臂。可以分别在两个垂直平面中检测通过通道的液滴内的颗粒和/或细胞两次(321/325、341/345、391/397、411/417和431/436)。如果颗粒或细胞在通道的中心通过,则可以同时在两个臂中检测到颗粒或细胞。如果颗粒或细胞在中心下方或中心上方通过,则可以在不同时间在两个臂中检测到颗粒或细胞。因此,根据两个检测臂之间的时间延迟,可以利用两个不同的单点检测器推断通道内颗粒的空间位置。如果使用相机,可以直接从通道的截面拍摄图像。因此,不仅可以获得空间位置,还可以获得通过观察平面的颗粒的图像。
183.图5a示出了当同一颗粒或细胞在两个不同位置和两个不同时间移动通过通道时对该颗粒或细胞的检测。激发路径和检测路径两者可以使用相同的激发波长和发射滤波器。图5b示出了在液滴内的两个不同位置具有匹配荧光团的不同颗粒或细胞的检测。两个激发/检测路径可以使用不同的激发波长和发射滤波器。图5c示出了仅具有单一激发/检测路径以增加光通量的不同颗粒或细胞的检测。
184.所提出的方案可用于如图6a所示的具有包含单细胞或单颗粒的液滴的应用,或用于如图6b和6c所示的包含两个或更多个细胞或颗粒的液滴。棱镜可用于与微流体芯片光学地接合,以使该角度的光学像差最小化。折射率匹配流体可用于保持恒定的折射率。细胞和/或颗粒在微流体通道内的空间位置可以由在两个照明/检测臂中检测到的信号的时间确定。在基于光学检测的任何给定的颗粒计数或分选应用中,非常需要以使时间分辨率或检测效率的折衷最小的方式实现高且均匀的空间分辨率。另外,收集尽可能多的信号光子以最大化信号强度、增强检测微弱信号的能力以及最终提高灵敏度并且还提供定量系统可能是重要的。
185.总之,图5a至图6c所示的示例性模块可以提供以下益处中的一个或多个,其可以集成在本文描述的任何系统中:1.高na透镜可以在不影响景深的情况下使用,从而得到更高的空间分辨率和更高的检测效率;2.沿着观察平面的检测效率可以是各向同性的;3.光通量可以提高(例如,最大化),这是因为没有使用孔径来抑制离焦信号;4.通过使用两个物镜透镜用于照明以及检测,可以在两个不同的平面观察样本,并且可以根据两个检测事件之间的时间延迟来计算样本在通道内的空间位置;5.相机可以用作捕捉通道截面的图像的检测器。因此,可以在空间上分辨样本的精细细节。
186.虽然利用上述方法,空间分辨率可能已经相对均匀,但是它可以通过在图5a至图5c中例示的设置中提供激发束的远程聚焦(392/396、412/416和432)而得到进一步改进。总之,在优选实施方式中,我们提出了在我们的系统中集成和使用一个或多个以下模块:
187.模块320:每个物镜可以在相对透镜的检测平面中产生光片。通过两个检测模块中的检测信号的延迟,可以获得轴向颗粒位置;
188.模块370:多个颜色通道可以与同一物镜透镜一起使用;
189.模块340:可选地,可以在两个透镜之间分割多个检测通道,以避免不同颜色通道之间的串扰;
190.模块390:如本文所述,可以使用远程聚焦或非衍射束来进行更高效和更定量的颗粒检测;
191.模块410:可选地,利用远程聚焦或非衍射束,可以在两个透镜之间分割多个检测通道,以避免不同颜色通道之间的串扰;
192.模块430:可替代地,利用远程聚焦或非衍射束,多个颜色通道可与同一物镜透镜一起使用。
193.对于高通量液滴检测和分选应用,液滴可以包括在液滴内移动的液滴内对象(例如,细胞和/或珠)。这些对象相对于检测点处的光学焦平面的相对位置可以是随机的,并且因此可能导致不良聚焦(即,不良信噪比),使得这些移动对象的检测效率可能是次优的,特别是在液滴直径或流体通道宽度显著大于焦平面高度的情况下。在一些实施方式中,可以使用两个激光束来提供双聚焦作为检测点的一部分,以提高液滴内移动对象的检测效率。在一些实施方式中,可以使用光纤分光器或光学元件将单个激光束分成两个激光束,以在检测点处提供双聚焦。例如,包括具有双折射元件的光学装置的激光调制器可用于通过将
激光分成两个单独的激光束来高效地提供线形激光照明,从而导致双聚焦(例如,图18所示的模块730)。这种双折射元件(即,双折射偏振器)可以通过折射将非偏振光或以45度角偏振的光分成具有正交或近正交偏振的两束线性偏振光。在给定双聚焦的情况下,每个液滴可以沿着液滴流动方向行进通过一个接一个地紧密定位的两个焦点,从而提高了至少一个焦点可以产生表示具有改进的信号-噪声分布的液滴内对象的光学信号的概率。通过调整物镜和光学装置之间的距离,可以调整两个焦点之间的距离。合适的双折射偏振器由nicol棱镜、glan-thompson棱镜、glan-foucault棱镜、glan-taylor棱镜表示。rochon棱镜、senarmont棱镜和wollaston棱镜是由两个粘合在一起的三角形方解石棱镜组成的双折射偏振器的其它示例。在图20a至图20b中示出了通过使用包括wollaston棱镜的光学装置作为检测点的一部分进行双聚焦的示例性实现。
194.对于高通量液滴分选和分配应用,典型的流速可以高达100mm/s,或者在某些情况下高达约900mm/s。虽然可能期望拍摄快速移动靶的图像,但是相机帧速率通常太慢而不能在没有运动模糊的情况下捕捉流过基板(453和484)上的微芯片(451和482)的通道(452和483)的靶(472和490)。例如,1μm的靶空间分辨率将需要在100mm/s的流速下小于10μs的曝光时间以避免运动模糊。否则,在单个曝光周期期间通过相机视野(456、471、487和494)的颗粒(472和490)将显示为条纹(456和487)。然而,如果已知,可以通过在较长的相机曝光周期期间以相同的速度移动靶的图像来补偿颗粒的运动。这例如可以通过向包括物镜透镜(454、460、485和492)和镜筒透镜(455、470、486和493)的检测路径中添加可移动的(“扫掠”)偏转器(459)来实现,如图7a(模块450)所示。合适的装置包括扫掠镜、声光偏转器和空间光调制器。
195.对于微流体系统中的液滴检测,可以通过测量流速来确定靶液滴的速度。为了在适当的时间触发图像偏转,可以在成像装置的上游添加感测或计数液滴(457和491)的传感器。通过传感器的上游液滴感测/计数能够以本文公开的若干方式实现,这些方式包括但不限于光学、电气和磁检测方法。传感器的空间和时间分辨率应足以感测以高达900mm/s的速度流动的液滴的存在。
196.如本文所使用的,术语“传感器”一般是指检测通过液滴的物理参数并将其转换为可被电气测量的信号的模块或装置。传感器可以是非光学的、光学的或两者的组合,其在液滴通过传感器的感测区域时感测或计数液滴、液滴大小、液滴和/或液滴的相对位置,而不管它是靶液滴还是非靶液滴,即,传感器对于靶液滴与非靶液滴是无区别的。相比之下,在检测点由检测器检测到的信号在检测器定量或半定量地检测液滴内的细胞和/或颗粒的能力方面是有区别的。本文描述了示例性传感器,其包括图7中例示的传感器和本文公开的具有标记为“传感器”的组件的其它示例性系统。
197.可替代地,如图7b(模块480)所示,短照明脉冲489可用于在没有运动模糊的情况下对移动靶成像。脉冲可以足够短,以使得靶已经移动小于期望的空间分辨率。例如,在100mm/s的流速和1μm的期望分辨率下,照明持续时间应小于10μs。在一些实施方式中,每个成像曝光周期的短照明(例如,频闪照明)具有约0.5ms至约50ms、约0.5ms至约10ms、约5ms至约20ms、约10ms至约30ms,或约20ms至50ms的总持续时间。这可以例如通过使用q开关或锁模激光器(例如,基于声光调制器(aom)和/或电光调制器(eom)的有源q开关激光器)来实现。靶的高分辨率图像可以包括有价值的信息,该信息可以用于随后的分选和分配以及可
便于分选和分配的跟踪。总之,提出了以下模块,这些模块可以可选地集成到本文描述的任何系统中:
198.模块450:为了获得高速移动通过微流体装置的靶的高分辨率图像,可以在检测路径中使用扫掠偏转器来补偿靶移动并获得无运动伪影图像;
199.模块480:为了获得高速移动通过流体装置的靶的高分辨率图像,可以在激发路径中使用频闪照明以避免运动伪影。
200.在一些实施方式中,为了获得高速移动通过流体装置的靶的高分辨率图像,可以通过在微流体装置中沿着流体通道(例如,分选通道)设置“缓冲区”来减慢行进靶(例如,液滴)。缓冲区可以设置有连接至具有行进液滴的主流体通道的一个或多个旁通通道(例如,侧孔或侧通道),使得主流体通道中的流体可以部分地进入旁通通道以有效地降低液滴的移动速度,从而减少作为检测点的一部分的液滴成像期间的运动模糊。在一些实施方式中,可以在主流体通道和旁通通道之间的界面处设置一个或两个柱阵列,以约束沿着主流体通道移动的行进液滴(例如,图17a至图17b所示的模块710和720)。在一些实施方式中,缓冲区可以包括加宽的流体通道(例如,图17a所示的模块710)。在一些实施方式中,缓冲区可以包括通过旁通通道连接到主流体通道的一个或多个侧室。在一些实施方式中,旁通通道可以位于分选接头的下游。在一些实施方式中,旁通通道可以位于分选接头的下游和分配喷嘴的上游。在一些实施方式中,具有旁通通道的缓冲区可以在检测点处实现,这在图17a至图17b和图22中例示。缓冲区的创建可以与重复的短照明组合以获得增强的结果。
201.在一些情况下,在同一平面中的微流体通道内具有快速移动的颗粒以用于精确的检测和增加的灵敏度可能是非常令人感兴趣的,这进而可以改进整体分选和分配效率。在许多实际应用中,改进的分选和分配对于分离低丰度或罕见事件可以是关键的,这通常有利于所有阳性事件的最大恢复和假阳性事件的最大去除。
202.一般来说,寻找用以将快速移动的液滴带到物镜的视野中的非破坏性方法在液滴微流体学中具有重大的价值,其中在选择微通道的形状、材料和尺寸以及选择液滴的大小方面存在限制。磁力是解决这一需要的一种解决方案,其可以在本文描述的任何系统中实现。
203.在一些实施方式中,一个磁体、磁体对或磁体阵列可以在检测点之前与可随液滴中的细胞一起提供的磁性颗粒组合使用,如图8a至图8f所示。磁体可以是永磁体、可调谐电磁体或两者的组合,其可以由具有不同形状、几何形状、尺寸和功率的不同材料制成。此外,磁性微颗粒或纳米颗粒广泛可用于分子和细胞生物学应用。磁性颗粒能够以涂覆有诸如羧基、蛋白质和寡核苷酸等的各种官能团的形式可用,这可以使得能够特定捕捉给定液滴中可用的期望靶分子、细胞类型或细胞器。磁体的各种组合可以实现到我们的系统中,如图8a至图8f所示。
204.在图8a所示的一个实施方式中,磁体505可以放置在距最近的下游检测点约0mm至约20mm的距离处。当液滴502朝微流体通道504中的磁场移动时,由磁体505产生的磁力可以逐渐改变液滴502中所提供的磁性颗粒401的路径。通过针对每个限定应用调节流速和/或磁力,应当能够将(例如,形成群的)磁性颗粒集中成彼此相邻且靠近物镜507的视野内的微流体通道504的检测侧。集中的磁性颗粒又可以产生近均匀且强的信号。应当注意,环形磁体505也可以集成到物镜507中,使得距最近的下游检测点的距离为0mm或几乎0mm。
205.在图8b所示的实施方式中,磁体阵列515可以放置在距最近的下游检测点约0mm至约20mm的距离处。当液滴512朝微流体通道514中的磁体区域移动时,由该磁体阵列515产生的磁力可以改变液滴512内的磁性颗粒511的路径。该阵列设计对于在液滴512内存在多个较大和/或高密度磁性颗粒511的应用可以特别有用,否则,如果仅使用一个磁体,则可能导致颗粒离开液滴。通过优化流速、磁力和/或阵列大小,应当能够将(例如,成群的)磁性颗粒集中成彼此相邻并靠近物镜517的视野内的微流体通道514的检测侧,这继而可以产生更均匀且更强的信号。
206.在图8c所示的又一实施方式中,磁体对525可以放置在距最近的下游检测点约0mm至约20mm的距离处。磁体之间的间隙可以从约0.1到10mm变化。当液滴522朝微流体通道524中的磁体区域移动时,由该磁体对525产生的磁力可以逐渐改变液滴522内的磁性颗粒521的路径。由磁体对产生的磁场可以迫使颗粒521彼此相邻定位,优选地在垂直于液滴流动和微流体通道524的线中。这种设计对于例如rf(例如,tag)集成物镜用于信号收集的应用可以特别有用,其中颗粒对准与通过液滴的光源的形状一致。通过优化流速和磁力,应当能够将磁性颗粒带到明确定义的线性位置,以针对每个给定应用通过物镜527实现最大检测效率。
207.在如图8d所示的又一实施方式中,两个磁体对534可以从微流体通道537的两侧以距最近的下游检测点约0mm至约20mm的最小距离放置。磁体之间的间隙可以从约0.1到约10mm变化。由这两个磁体对534产生的磁力可以跨微流体通道537具有更大的强度和均匀性,从而导致液滴533内的磁性颗粒531在垂直于微流体通道537中的液滴流动的线中的更高效对准。这种类型的对准对于例如rf(例如,tag)物镜用于信号收集的应用可以是有用的,其中颗粒对准与通过液滴的光源的形状一致。通过针对每个定义应用优化流速和磁力,应当能够使磁性颗粒明确定义并呈线性以针对每个应用通过物镜526获得最大检测效率。
208.在如图8e所示的一些实施方式中,两个磁体545能够以距最近的下游检测点约0mm至约20mm的距离放置在微流体通道544的顶侧和底侧,一个位于微流体通道544的一侧。当液滴542朝微流体通道544中的磁体区域移动时,由这些磁体545产生的磁力可以改变液滴542内的磁性颗粒541的路径。通过针对每个定义应用优化流速和磁力,对于需要详细分析来自微芯片或液滴界面的具有最小破坏的荧光信号的应用,应当能够使以线性形状对准在颗粒542的中心的磁性颗粒很好地对准物镜547的焦点。
209.在图8f所示的又一实施方式中,两个磁体阵列555被放置在距最近的下游检测点约0mm至约20mm的距离处,其中一个阵列位于微流体通道554的一侧。当液滴553朝微流体通道554中的磁体区域行进时,由这些磁体阵列555产生的磁力将改变液滴553内的磁性颗粒551的路径。通过针对每个定义应用优化流速和磁力,对于需要详细分析来自微芯片或液滴界面的具有最小破坏的荧光信号的应用,应当能够使颗粒以近线性形状逐渐对准在颗粒553的中心,在该中心处,颗粒将对准物镜557的焦点。当处理每个液滴553内的大量颗粒或变化数量的高密度颗粒时,这种设计可能是优选的,其中在每侧使用一个磁体可能没有提供足以使颗粒对准在最近的检测点处的力或均匀性。
210.本领域的普通技术人员将理解,基于本文描述的教导,可以根据需要使用任何数量、大小和/或配置的磁体(或磁体对或磁体阵列)。应当注意,除了磁性颗粒聚焦方法之外,还可以通过使用声泳方法来实现对液滴内颗粒进行聚焦的概念。用于液滴内声聚焦的声泳
方法可以基于声波与液滴内实体(例如,细胞、颗粒)的相互作用,使得液滴内的细胞或颗粒的位置可被限定为能够由检测器(例如,光学检测器)进行准确检测。与其它聚焦方法(例如,传统的流体动力学聚焦方法)相比,这种声泳方法可以提供若干优点,优点包括(1)细胞或颗粒可以是无标记的或无金属的,以及(2)声操作条件可被调谐为温和、与细胞无接触且对细胞的伤害最小。
211.在具有复杂生物样本的许多应用中,分选液滴的纯度可能是关键的,即,分选液滴中的最小假阳性率可能是有利的。在一些应用,特别是涉及长液滴培养期的应用和涉及使用较大液滴(例如,体积≥500pl)的应用中,一些液滴可能在分选接头处分选液滴之前的步骤中彼此聚结(即,合并或融合),这可能由各种随机或非随机因素(诸如机械应力、表面杂质和电力)引起。合并的液滴可以容易地在分选通道的分叉处分裂成两个或更多个不同大小的“子”液滴,并且所得到的子液滴中的一个可以在没有任何主动分选力的情况下自动进入靶液滴收集通道,从而在靶通道中产生假阳性液滴(这些假阳性事件被认为是“被动分选”)。在涉及复杂样本中的低丰度事件的应用中,这些被动分选事件甚至可能超过真阳性的数量。被动分选产生的污染可能使后筛选过程非常单调、低效和/或昂贵。为了在保持高分选速率的同时消除或减少被动分选事件,可以将第二分选点添加到第一分选点下游的相同微流体芯片。在一些实施方式中,可在同一微流体芯片上以串行或串联的方式使用两个或更多个额外分选步骤。
212.图9示出了系统200,该系统200可以包括以串行方式耦合的包封单元201、培养单元202以及两个下游分选单元203和204。包封单元、培养单元和分选单元可以与本文描述基本上类似。例如在期望单细胞分配的情况下,分配单元223可以可选地设置在第二分选单元204的下游。与先前对于系统100所描述的内容类似,利用一个或多个泵208和209,一种或多种分析物206可以注入微流体装置205的第一通道的第一入口中,并且载体油207可以从第二入口注入。细胞和/或颗粒可以共包封成液滴210。然后,液滴210可被收集在培养室211中并培养取决于特定测定的预定时间段。在培养后,液滴210可以移动通过微芯片以进行分选。可选地,细胞/颗粒可以由如本文所述的永久或可调谐电磁体212聚焦以在第一检测点213之前增强聚焦,其中第一检测点213可以在lif检测中使用单色或多色激光束214。检测信号可以被发送到数据获取和处理单元225(本文中也称为处理器)以供数据分析。当液滴被识别为阳性时,数据获取和处理单元225可以向分选控制器224递送触发信号以激活第一分选致动器215,从而将液滴重新引导至收集通道。对于不符合标准的液滴,将不发送触发信号,并且分选致动器215将保持关闭,从而允许流体压力将不需要的液滴驱使到废物通道216中。
213.然后将来自第一分选单元203的分选液滴导向到第二检测点218,该第二检测点218可以基于光学或非光学模块。第二分选致动器219可以由基于液滴行进时间(即,液滴从第一检测点迁移到第二检测点的时间)的时间延迟触发,或者直接通过分选控制器224触发。最终靶液滴222可被引导至可选的下游分配单元223以供进一步分析。
214.在另一实施方式中,如图10所示的系统230可以包括包封单元231、培养单元232、两个串行分选单元233和234以及可选的分配单元253。在包封单元231中,利用泵239和240,一种或多种分析物237注入一个入口中,并且载体油238从另一入口注入。细胞和/或颗粒被共包封到液滴241中,该液滴241然后被收集在培养模块242处并停放由特定测定确定的时
间段。在培养后,液滴被驱使至第一检测点244。可选地,当在液滴中提供磁性颗粒时,该磁性颗粒可以由磁体单元243聚焦,以在第一检测点244之前实现最佳聚焦。与图9中描述的检测模块设置不同,第一检测点244被配置为多通道检测模块,该多通道检测模块还用做通道方向的下游的第二检测点。对于共享相同检测模块244的第一检测点和第二检测点两者,使用相同的激光源或光源249。检测信号被发送到数据获取和处理单元255以供数据分析。当检测模块244检测到靶液滴时,获取和处理单元255将向分选控制器254递送触发信号以激活第一分选致动器245,从而将靶液滴引导到收集通道248中。获取和处理单元255将忽略不期望的液滴,并且非靶液滴将进入废物通道247。为了进行串行分选,来自分选单元1(233)的分选液滴被导向到第二检测点,该第二检测点由具有单个物镜的相同多区检测器244构成。具有多区单检测器的这种设置消除了一个额外的单独检测点,从而使装置更紧凑。随后,第二分选致动器250可由分选控制器254触发。最终靶液滴252可被引导至可选的下游分配单元253以供收集和进一步分析。在一些实施方式中,检测模块244中的发射光可以分离到两个下游检测器(例如,pmt)中。在一些实施方式中,检测模块244中的发射光由具有集成多检测芯片(即,多通道检测器)的pmt检测。
215.对于涉及数百万个液滴的筛选(诸如抗体发现或合成生物学内容中的候选筛选)的应用,要求具有高样本通量的筛选装置能够在合理的时间帧(通常为几小时)内完成筛选过程。然而,如果通过使样本流过微流体通道来筛选样本,则通量(即,流速)受到摩擦的限制,因为层流是优选的。在蛮力方法中,可以通过使样本分离且并行地运行通过多个颗粒检测/分选装置上的多个微流体室来增加通量。然而,这种方法不能负担得起,因为操作成本和消耗成本随着并行运行的数量而倍增。因此,非常期望在更流线型的单一系统设计中实现并行处理。
216.如果使用光学检测进行样本筛选,则可用的视野通常超过通道宽度,例如,10x、na 0.3物镜透镜的1mm视野对应于0.1mm的典型通道宽度。为了利用该差异,可以如本文进一步例示地设计用于具有单个光学路径的两个或更多个微流体通道中的同时光学检测的系统(例如,图11所示的模块600或图16所示的模块700)。
217.利用图11中描述的这种方法,测定通量可以大幅增加(约2-20倍)。这是高度相关的,因为快速样本筛选不仅减少了时间和成本,而且还增加了筛选应用的成功,这部分是因为更短的运行时间可以降低液滴聚结的发生率,同时提高液滴内细胞活力。
218.例如,在抗体发现中,通常在整个起始样本中仅具有少量细胞以产生感兴趣的抗体(例如,在数百万个起始细胞中具有《100个阳性细胞)。因此,在短时间(几小时或更短)内处理大样本量是有利的。为了确保以合理的成本和效率成功隔离阳性液滴,必须满足以下标准:1.高样本流速,而不会使液滴和细胞受到可能损害样本完整性的不必要的机械应力;2.在单个装置内进行样本筛选,以使成本和复杂性尽可能低。
219.为了满足对于诸如图10所示的所提出的细胞分选和分配系统的这些要求,可以在同一芯片上并行地布置多个微流体通道,以在单个视野内进行同时光学检测。如图11所示,模块600使我们能够同时检测来自多个微流体通道的光学信号。图16示出了包括束分离器的光学配置,该束分离器类似地能够同时并行检测来自多个微流体通道的光学信号。
220.在一些实施方式中,如图11中所例示,系统230可以包括多点检测模块600,该多点检测模块600被配置为检测来自(例如,如图10中所描述的)并行布置的两个或更多个通道的光学信号。图11左侧的模块示出利用单个通道设置的示例性单点检测(如可以在本文描述的任何系统中使用而没有并行检测)。相比之下,图11右侧的模块示出设置有配置在微芯片604的微芯片基板606上/中的两个或更多个并行通道的多点检测。并行通道可以由光源602照明,并且来自通道的信号可以由单个物镜608引导到多通道检测单元610(例如,多阳极光电倍增管或相机)。
221.在一些方面,从任何一个公开的系统中的检测点收集到的信号可提供每个靶液滴的信息细节,诸如细胞(或颗粒)数量和大小、细胞活力、荧光强度的空间分布、荧光信号的比率以及其它测定读出参数。虽然由于检测时间点和随后在阳性事件时的分选致动之间的时间约束,因而仅将详细信息的一小部分简要地用作实时分选标准,但是不利用所收集到的信息的大部分。
222.在一些实施方式中,可以在没有分选相关时间约束的情况下在分选和分配过程之后进行全面的数据分析。这种后处理数据分析可以提供与分选液滴有关的附加信息以帮助例如通过对从检测点收集的数据使用高级信号处理算法来对靶列表进行优先级排序。对分选和分配的液滴进行进一步剖析或优先级排序的能力对于隔离低丰度事件可以是非常有用的。在一方面,可以设置“更宽松”的标准以恢复尽可能多的靶,这将提高假阳性率。在另一方面,可以进行后处理数据分析并建立附加标准以有效地减少或去除低质量命中,同时保留高质量命中。然而,为了能够对靶液滴进行有效的后处理数据分析,在分选和分配期间精确地跟踪和索引单个靶液滴是关键的。这种精确的跟踪和索引特征可以通过实现下面几个段落中所示的新设计来实现或改进。
223.在如图12所示的一些实施方式中,系统260不仅包括第一检测点265和可选的第二检测点271,而且还包括用于促进靶液滴跟踪和索引的至少一个传感器266。至少一个传感器266将提供任何通过液滴的精确定时。精确定时可以与在上游检测点处检测靶液滴的定时和靶液滴的下游分配的定时有效地同步。这种同步控制可以由数据获取和处理单元276进行。在一些实施方式中,通过测量微流体芯片的通道中的载体流体的流速来进一步促进同步控制。在一些实施方式中,建立与预期定时的可接受偏差,使得只要液滴在超过所建立的偏差阈值的定时到达,到达分配点的任何不期望的液滴将被简单地忽略且不被收集。在一些实施方式中,偏差阈值基于统计模型。在一些实施方式中,偏差阈值被设置为反映流速波动的正态分布的至少一个标准偏差。
224.在系统260(图12)所示的一些实施方式中,分选标准(即,用以将液滴确定为靶液滴的阈值)可以由用户在每次运行开始时基于诸如信号峰值高度、面积、形状、宽度和/或它们在同一液滴内相对于彼此的位置等的因素来确定和设置。当在第一检测点265处检测到靶液滴时,数据获取和处理单元276将控制分选致动器268以将靶液滴重新引导到靶收集通道中以获得分选液滴。在第一检测点265处检测到的每个靶液滴由数据获取和处理单元276跟踪和索引,其中将相应的经处理的信号数据传送到计算机277并在计算机277处记录。同时,分选的靶液滴将继续其运动以通过传感器266的感测区域,在该感测区域中,传感器266检测通过的靶液滴的存在,这种存在或不存在信息也将由数据获取和处理单元276处理,以提供精确的定时控制以使上游分选步骤和下游分配步骤以及最终分配之前的任何可选检
测点同步。在通过传感器的检测之后,将通过微流体管道(例如,毛细管)270来驱使靶液滴,其中可选的第二检测点271可以利用作为第一检测点的类似或不同激光束实现;在该步骤收集的数据也将由数据获取和处理单元276处理,随后被传送到计算机277。针对数据获取和处理单元276所控制的每个用户定义设置,基于从265、266和271处的先前步骤收集到的信号数据以同步方式触发分配模块272。最后,在计算机277的辅助下,分配液滴可以与针对该分配液滴在第一点和可选的第二检测点处检测到的相应数据匹配。可以分析所收集到的数据以采用后处理方式提取对于每个分配液滴有用的信息。这种后处理数据匹配能力为筛选应用增加了显著的价值,因为它在下游分析和筛选标准之间启动了反馈循环。
225.在一些实施方式中,在上游分选点和下游分配点之间实现至少一个传感器。在一些实施方式中,传感器的响应用作补充和额外的液滴监测工具。分选和分配事件将主要依赖于在第一检测点和第二检测点上使用的阈值设置,其中阈值设置旨在提供与液滴有关的区别信息,并且主要焦点在包封的细胞和/或颗粒中。
226.在一些实施方式中,至少一个传感器沿着微流体芯片的流动方向定位在分选点之后但分配点之前的位置处。在一些实施方式中,至少一个传感器在分选点下游约3mm至约100mm,或分选点的分配喷嘴之前约5mm至约400mm的位置处实现。在一些实施方式中,至少一个传感器被集成到微流体芯片中。在替代实施方式中,至少一个传感器沿着将微流体芯片连接至分配模块的分配喷嘴的微流体管道实现。在进一步的替代实施方式中,至少一个传感器在微流体芯片上实现,并且至少另一传感器沿着将微流体芯片连接到分配模块的分配喷嘴的微流体管道实现。
227.在一些实施方式中,至少一个传感器是光学传感器。在一些实施方式中,至少一个传感器是非光学传感器。在一些实施方式中,使用光学传感器和非光学传感器两者。示例性非光学传感器是基于阻抗、电容、电导率、微波和/或声波的传感器。示例性光学传感器包括基于透射或反射的传感器。
228.在一个实施方式中,如图13a所例示,在系统800中实现两个传感器,其中所述两个传感器中的至少一个是非光学传感器。至少一个非光学传感器在微流体芯片、微流体管道(例如,毛细管)或两者(图13b)上实现。在一些实施方式中,为了在装置(例如,微芯片803;图13a)上使用,例如由具有约5μm至150μm的间隙和宽度的金、银、铜、镍或铂制成的导电电极对(828)被集成到微芯片基板(829)中。在一些实施方式中,可以利用微芯片材料(例如,pdms)的薄层涂覆电极,以在液滴通过传感器的感测区域时使液滴流动中断最小化。在一些实施方式中,为了在将微流体芯片连接到分配模块的分配喷嘴的微流体管道(817)上使用,围绕微流体管道(例如,毛细管)的一端的丝线圈单元(830)被用作传感器以感测从上游分选点行进到下游分配点的通过液滴(826)。基于丝线圈的传感器的线圈直径、大小、长度和环数可以变化。在一些实施方式中,丝线圈由选自镍、铜、铁、银和金的一种或多种类型的材料制成。
229.在另一实施方式中,如图13b所例示,其中所述两个传感器中的至少一个是光学传感器。至少一个光学传感器在微流体芯片、微流体管道(例如,毛细管)或两者(图13b)上实现。在一些实施方式中(例如,模块862,图13b),通过使用光纤(879)将由诸如激光器或led等的光源(876)产生的光束递送到微芯片通道。由通过液滴反射的束将通过同一光纤879收集,通过束分离器(877),并由传感器组件878检测,该传感器部件878与数据获取和处理单
元(874)连接以进行同步控制。在一些实施方式中,为了在透射感测模式下在微流体管道(867)侧使用传感器,光源(884)和检测(886)将定位在微流体管道的两侧,其中由激光器或led产生的光束将通过透镜(885),微流体管道中的移动液滴然后通过第二透镜(887)并被模块886收集,其中模块886将与数据获取处理单元(874)连接。为了在反射感测模式下在微流体管道(867)侧使用,光源(891)和检测(893)将定位在微流体管道的同一侧,其中由激光器或led产生的光束将通过透镜(890),微流体管道中的移动液滴然后以约60至120度角通过第二透镜(892)并被893收集,其中893与数据获取处理单元(874)连接以进行同步控制。
230.在一些实施方式中,与先前针对非光学传感器所描述的用途类似,使用至少一个光学传感器来提供任何通过液滴的精确定时;精确定时可以与在上游检测点检测液滴的定时和液滴的下游分配定时有效地同步。这种同步控制可以由数据获取和处理单元(例如,图13b中的874)进行。在一些实施方式中,通过测量微流体芯片的通道中的载体流体的流速来进一步促进同步控制。
231.一般来说,液滴传感器沿着流动通道、在分选接头的下游和分配模块的喷嘴之前实现。在一些实施方式中,至少一个传感器在分选接头的下游和第二检测点之前实现。在一些实施方式中,至少一个传感器在第二检测点的下游但分配模块的喷嘴之前实现。一般来说,沿着微流体装置的流动方向实现至少一个传感器和至少一个第二检测点的顺序可以改变或不同,并且不应被视为限于附图中所提供的图示。
232.在一些实施方式中,本文公开的任何系统(例如,图1至图3、图9至图10以及图12至图13b中例示的系统)可以包括可选的“微微注射器”(或纳米注射器)模块。微微注射器模块可以提供从侧通道到设置在上游分选接头和下游检测点之间(例如,第一分选接头和下游的第二检测点之间)的收集通道的新型样本和/或试剂的注射;侧通道设置有范围为收集通道中的靶液滴117的流速的约0.5%至约20%的流速。当靶液滴通过收集通道到达具有去往侧通道的侧开口的通道段时,可以通过微微注射器模块从侧通道注射新型样本和/或测定试剂;注射的样本和/或试剂可以与通过的靶液滴合并,其中样本和/或测定试剂的量和注射速度可由微微注射器模块控制。样本和/或试剂可以由微微注射器以液滴形式或作为直接的液流引入到靶液滴的流动中。样本和/或试剂可通过压力泵或其它压力控制器注入。微微注射器可以在第一分选接头之后与微流体装置(例如,微芯片105)集成,或者在第二检测点(例如,第二检测点121)之前的位置处与微流体管道(例如,微流体管道119)集成。如果(例如,在图13a至图13b所示的系统中)也使用传感器,则可以在通道的传感器感测区域之后实现从微微注射器到微流体通道的流体递送的接头,以确保微微注射器主要或专门地向感测/计数的靶液滴提供流体递送(即,新样本和/或试剂)。“微微注射”的新样本和/或试剂可以与靶液滴的现有实体反应,从而提供与靶液滴有关的新信息。所提供的新信息可以促进分配模块处的决策,以及/或者提高整体测定效率和/或准确度。
233.在又一实施方式中,本文公开的任何系统(例如,图1至图3、图9至图10以及图12至图13b中例示的系统)可以包括可选的液滴捕获室或储存器,以在分选步骤之后但在下游检测点之前或在分配喷嘴之前捕获、停放或延迟一批经分选的靶液滴的流动。例如,图1所示的分选液滴117可以暂时停放在液滴捕获室中;捕获室可以作为同一微芯片105的组件集成在收集通道下游和第二检测点121上游的位置处。如果(例如,在图13a至图13b所示的示例性系统中)也使用传感器,则可以在传感器之后但在下游分配喷嘴之前设置液滴捕获室。捕
获室可以提供分选的靶液滴117一段时间以在第二检测点和/或分配喷嘴117之前沉降和/或暂停,这进而可以导致第二检测点处的更精确检测以及靶液滴的更准确分配。使靶液滴停放在第二检测点和/或分配喷嘴之前还可以提供有用的动力学和测定信息作为额外的标准,以选择用于最终分配的靶液滴。捕获室的形状、几何形状和尺寸可以变化;例如,可以通过扩大收集通道的内部尺寸、在微流体装置(例如,微芯片105)上添加捕获柱和井阵列、和/或增加微流体管道的长度(例如,使用微流体管道的线圈)来制造室。液滴捕获室可以可选地在针对图1所示的培养单元102所描述的条件下操作。
234.在一些实施方式中,本文描述的任何系统(例如,图1至图3、图9至图10以及图12至图13b中例示的系统)可以包括微微注射器(或纳米注射器)模块和液滴捕获室两者。微微注射器和液滴捕获室可以沿着微流体装置的流动方向相对于彼此以不同的顺序设置,但是它们两者可以在分选接头的下游和第二检测点的上游实现,其中所述分选接头恰好在第一检测点之后。
235.提供用于实现当前公开中所呈现的系统、模块和概念的示例性过程;在图14中概述了该示例性过程。
236.图14例示了根据本公开内容的实现的示例性过程1000。过程1000可以表示实现所提出的概念和方案(诸如上文关于图1至图13b所描述的各种方案、概念和示例中的一个或多个)的方面。更具体地,过程1000可以表示所提出的概念和方案的一个方面,其涉及在分配液滴将被索引以用于下游分析的精确跟踪的同时使用基于液滴的微流体系统(诸如但不限于系统100、150、190、200、230、260、800和850)对用于不同测定应用的单细胞进行分选和分配。
237.过程1000可以包括如块1010至1100中的一个或多个所例示的一个或多个操作、动作或功能。尽管示出分立块,但过程1000的各个块可根据期望实现而被划分为附加块、被组合成更少的块或被消除。此外,过程1000的块可以按图14所示的顺序或者可替代地按不同顺序执行。此外,过程1000的块可以迭代地执行。过程1000可以在块1010、1020和1030处开始。
238.在块1010至1040处,方法1000可以涉及引入例如细胞和/或颗粒(例如,微珠、纳米颗粒)等的分析物的水溶液以及与表面活性剂预混合的生物相容性油,并使用两个精确的压力泵或注射泵将它们注入微流体装置。在1040处,可以在称为包封或液滴产生的步骤下产生可包括多个细胞和/或颗粒的多个油包水液滴。例如,可以通过使用高速相机紧接在产生时间点之后对“包封的”油包水液滴进行管线内检查,以确保它们满足大小和均匀性的要求,这些要求可能因测定应用而异。在重新检查系统部件、消耗品、样本和试剂并排除故障后,未能达到所要求的标准可能导致重复步骤1040。当通过时,过程1000可以从块1040进入1050。
239.块1050可被视为可选的,并且根据测定应用,块1050可以是或可以不是必需的。该步骤可被实现为包封芯片的扩展部分、单独的微流体芯片或与分选微流体芯片组合。在一些实施方式中,步骤1050包括一个或多个环境控制单元,例如温度控制单元、氧气控制单元、二氧化碳控制单元和/或湿度控制单元。培养步骤可能需要若干小时。在培养后,准备将液滴重新注入微芯片中以进行检测和分选。
240.在块1060处,过程1000可以涉及快速系统初始化以为液滴分选和分配作准备。这
可以通过从系统上的各种单元和模块(包括但不限于泵、激光器、检测器、传感器、数据处理单元、控制器、电子装置等)收集数据来完成,并且可以自动地或手动地进行。未能满足所需的性能可能导致在故障排除后重复步骤1060。当通过时,过程1000可以从1060进入1070。
241.在1070处,过程1000可以涉及根据用户定义设置在分选单元中检测和分选所选液滴。这可以包括在第一检测点处的检测,其中信号将被发送到用于信号处理的数据获取和处理单元。在检测到反映阳性液滴(即,“靶液滴”)的信号时,获取和处理单元可以将触发信号递送至分选控制器,该分选控制器进而强制靶液滴朝向收集通道迁移,而其它液滴将继续其在朝向废物通道的每个流动方向的移动。
242.在一些实施方式中,可以在该第一检测点使用诸如具有规则激光束或非衍射激光束的tag折射率透镜等的远程聚焦透镜,以产生足够的空间分辨率来区分诸如颗粒或细胞等的小特征。在所述两个实施方式中,光束通过将光聚焦到瞄准样本的物镜透镜的后孔径中的圆柱形光学元件,在这种情况下被递送通过微芯片的通道。
243.在替代实施方式中,通过将照明/检测平面相对于通道方向以约45度(可以使用约60至约120度)定向,我们可以克服在垂直于通道进行照明/检测时的有限焦深,从而允许高nas的透镜,同时保持独立于通道高度的各向同性检测效率,这进而使我们能够检测到较低的信号以及识别更精细的空间特征。在又一实施方式中,一个或两个物镜包括远程聚焦透镜。
244.在一些实施方式中,一个磁体、磁体对或磁体阵列可以在第一检测点之前与磁性颗粒(诸如与细胞一起包封在颗粒中的珠)组合使用。磁体可以是永磁体、可调谐电磁体或两者的组合,其可以由具有不同形状、几何形状、尺寸和功率的不同材料制成。此外,磁性颗粒(诸如但不限于珠)广泛可用,同时还可以涂覆有官能团。磁体可以如先前在图8a至图8f中所例示地以各种组合使用,并且可以在接近检测点(即,距检测点约0mm至20 mm)使用时产生均匀且更强的信号。
245.在又一方面,过程1000可以涉及将来自1070的分选靶液滴引导至可选的第二检测和分选单元(即,串行分选)。当仅使用一个分选单元时(例如,过程1070),该可选步骤1080对于涉及在仅使用一个分选单元(例如,过程1070)时很有可能获得被动分选事件的复杂样本中的低丰度事件的应用可以是关键的。在一些实施方式中,可以在同一微流体芯片上以串行或串联的方式使用两个或更多个额外分选步骤。如先前在图9和图10中所述,步骤1080可以包括仅一个检测器、两个或更多个检测器,在这种情况下,还可以使用多通道检测器覆盖串行分选方案中的液滴检测的第一步骤和第二步骤两者中的检测来利用该步骤1080。
246.过程1000可以涉及在靶液滴完成单个(1070)或串行(1080)分选步骤之后的步骤1090。在1090处,分选靶液滴通过外径范围为约0.1至约5mm的衔接器被引导到微流体管道(例如,毛细管)中。微流体管道可以是由玻璃、聚合物或任何其它材料制成的毛细管(原始的或涂覆的),其内径优选为0.05至0.15mm。在一些实施方式中,第二检测点用于验证分选靶液滴以在分配之前进行精确触发,并且在一些应用中用于提供诸如来自分选液滴的空间荧光分布等的附加信息。与第一检测点类似,激光源或光源用于第二检测点,而信号将通过物镜收集并通过光学检测(例如,pmt)来检测。与上文针对第一检测点所描述的内容类似,单独或与棱镜组合的、具有/不具有非衍射束的磁体或磁体阵列和rf透镜也可以用作用以在任何给定测定所需的情况下增强该第二检测点上的检测性能的选项。另外,在一些实施
方式中,(如图7a中的)扫掠偏转器或(如图7b中的)频闪照明可以用作用以消除图像模糊并获得高速移动通过微流体装置的靶的高分辨率图像的检测方案。
247.来自第二检测点的检测信号也将被发送到用于数据分析的数据获取和处理,其中与操作者针对每个测定应用所设置的阈值相比,可以基于分析从第一检测点和第二检测点两者接收到的所有数据来作出关于分配靶液滴的决定。分选标准可以基于诸如峰值高度、面积、形状、宽度和/或它们在同一液滴内相对于彼此的位置等的各种因素,这些因素基于经由一个、两个、三个或更多个激光波长接收和收集的信号。当满足分配要求时,数据获取和处理单元可以触发分配单元,同时计算机将记录对应于每个靶液滴的所有收集的数据,以跟踪和索引每个小瓶中的分配靶液滴。在毛细管端部具有喷嘴的分配单元可以是x-y-z移动台或旋转移动台,其中收集96孔板、384孔板、1536孔板或任何其它多孔板、pcr管、pcr条或任何感兴趣的阵列中的靶液滴。
248.在一些实施方式中,过程1000可以涉及步骤1100:存储所收集的靶液滴(阳性液滴)并将其递送到关联实验室以用于下游分析,同时每个分配液滴将伴随有所有检测点处的相应检测数据连同运行日志文件。
249.在一些实施方式中,过程1000包括使用用于感测或计数移动液滴的至少一个传感器。在上游分选点和下游分配点之间实现至少一个光学传感器、非光学传感器或这两个传感器的组合,以作为提供任何通过液滴的精确定时的互补且额外的液滴监测工具通过无区别方式对通过传感器的感测区域的液滴进行计数。精确定时可以与在上游检测点处检测液滴的定时和液滴的下游分配的定时有效地同步。这种同步控制可以通过数据获取和处理单元来进行,其还可以通过测量微流体芯片的通道中的载体流体的流速来促进。
250.尽管上面的步骤示出根据实施方式的使用微流体装置分选和分配液滴的方法1000,但是本领域的普通技术人员将基于本文描述的教导来识别许多变型。这些步骤可以按不同的顺序完成。可以添加或删除步骤。一些步骤可以包括子步骤。许多步骤可以根据需要经常重复,以确保靶液滴的检测、分选和分配。
251.提供了被提议用于实现当前公开中所呈现的系统、模块和概念的示例性过程,这些示例性方法在图15中总结。
252.图15例示了用于实现图1-图14的当前公开内容中所呈现的系统、模块和过程的各种示例性方法。本文提供了示例性方法,并且图15可以包括如a至d中所示的更多方案。尽管示出为分立块,但是a至d的每个方案的各个块可以根据期望实现而被扩展和划分为附加块,被组合成更少的块或被消除。此外,块可以按照图15所示的顺序或者可替代地按照不同顺序执行,并且其还可以迭代地执行。
253.在一些实施方式中,例如,如方案a所示,方法可以包括:产生液滴、培养液滴、使用常规物镜透镜在微流体芯片上的第一检测点检测液滴、根据操作者所定义的分选标准分选液滴、通过使用至少一个无区别的光学或非光学传感器来对液滴进行计数、在诸如毛细管等的微流体管道上的第二检测点处检测液滴、最后使用例如x-y-z分配模块来分配液滴。每个小瓶中分配的液滴可被递送至最终用户以用于下游和管线外分析,同时伴随有在第一检测点和第二检测点收集的相应数据、运行日志以及来自传感器的支持信息。
254.在又一实施方式中,例如,如方案b所示,方法可以包括:产生液滴、培养液滴、使用远程聚焦透镜(例如tag折射率透镜)在微流体芯片上的第一检测点处检测液滴、根据操作
者所定义的分选标准分选液滴、通过使用至少一个无区别的光学或非光学传感器来对液滴进行计数、在诸如毛细管等的微流体管道上的第二检测点处检测液滴、最后使用例如x-y-z分配模块来分配液滴。每个小瓶中分配的液滴可被递送至最终用户以用于下游和管线外分析,同时伴随有在第一检测点和第二检测点收集的相应数据、运行日志以及来自传感器的支持信息。
255.在又一实施方式中,例如,如方案c所示,方法可以包括:产生液滴;培养液滴;使用棱镜在微流体芯片上的第一检测点检测液滴,该棱镜在两个转角处以约45度与两个物镜集成,而一个或两个物镜可以是远程聚焦透镜,例如tag折射率透镜;根据操作员所定义的分选标准分选液滴;通过使用至少一个无区别的光学或非光学传感器来对液滴进行计数;在诸如毛细管等的微流体管道上的第二检测点处检测液滴;最后使用例如x-y-z分配模块来分配液滴。每个小瓶中分配的液滴可被递送至最终用户以用于下游和管线外分析,同时伴随有在第一检测点和第二检测点收集的相应数据、运行日志以及来自传感器的支持信息。
256.在一些实施方式中,例如,如方案d所示,方法包括:产生液滴、培养液滴、使用常规物镜透镜在微流体芯片上的第一检测点处检测液滴、根据操作者索定义的分选标准分选液滴、通过使用至少一个无区别的光学或非光学传感器来对液滴进行计数、经由扫掠偏转器或频闪照明在诸如毛细管等的微流体管道上的第二检测点处检测液滴、最后使用例如x-y-z分配模块来分配液滴。每个小瓶中分配的液滴可被递送至最终用户以用于下游和管线外分析,同时伴随有在第一检测点和第二检测点收集的相应数据、运行日志以及来自传感器的支持信息。
257.图16示出了用于多点检测的光学配置(模块700)的示意图,其中第一检测点和第二检测点被集成到单个视野中,并且发射光被分离并分别发送到两个下游检测器。图16所示的光学配置可以实现到用于并行检测的系统(例如,图10所示的系统230)中,例如作为图11所示的多点检测设计的替代。系统230可以包括多点检测模块600,该多点检测模块600被配置为检测来自并行布置的两个或更多个通道的光学信号(例如,如图10中所述)。在如图16所示的单个视野下,第一检测点和第二检测点可以沿着微流体通道的两个平行或反平行段集成/布置。可以提供单个圆柱形激光束(激发光)来对视野进行照明。发射光可由光学元件收集和分离,以供分别与两个检测点处的发射光相对应的两个下游检测器(pmt 1和pmt 2)检测。例如,发射光可以由单个物镜收集,通过透镜,然后由束分离器分离成第一束和第二束。第一束可被引导通过针孔到达第一检测器。第二束可被引导通过针孔到达第二检测器。
258.图17a至图17b示出了包括具有用以降低移动液滴的速度以通过使用相机或类相机检测器进行更高分辨率成像的一个或多个旁通通道(即,“缓冲区”)的区段的系统的示意图。本文描述的任何系统可以包括缓冲区以在成像期间减慢液滴。例如,如图17a所示,系统可以包括加宽的分选通道(例如,缓冲区)以减慢液滴流动。在一些实施方式中,可以在加宽的通道界面处设置一系列柱或柱阵列,以约束沿着分选通道移动的液滴。在一些实施方式中,如图17b所示,缓冲区可以在分选接头的下游设置有一个或多个旁通通道(例如,侧孔或侧通道)以降低行进液滴的速度。主流体通道中的流体可以部分地进入旁通通道以有效地降低液滴的移动速度,从而减少作为检测点的一部分的液滴成像期间的运动模糊。在一些实施方式中,可以在主流体通道和旁通通道之间的界面处设置一个或两个柱阵列,以约束
沿着主流体通道移动的行进液滴。可以使用相机或类相机检测器作为检测点的一部分来对缓冲区中具有降低的速度的液滴进行多次成像。可以使用重复短照明以进一步减少运动模糊。
259.图18示出了具有作为检测点的一部分的双聚焦特征(模块730)的示例性光学检测器的示意图。本文描述的任何系统可以包括双聚焦特征。对于高通量液滴检测和分选应用,液滴内对象(例如,细胞和/或珠)可以在通过检测器或传感器的液滴内移动,并且这些对象相对于检测点处的光学焦平面的相对位置可以是随机的。这可能导致不良的聚焦(即,不良信噪比)和降低的检测效率。双聚焦可以在检测点处提供液滴内移动对象的改进检测效率。如图18所示,可以提供光学元件来调制激发激光并实现检测点处的双聚焦。光学元件可以在装置上的流体通道内的行进液滴的两个时间点(时间点1和时间点2)聚焦在两个位置(聚焦1和聚焦2)上。光学元件可以将单个激光束分离成第一束和第二束,然后将第一束和第二束引导至检测点,以沿着流体流动方向提供双聚焦。每个液滴可以沿着液滴流动方向行进通过一个接一个地紧密定位的两个焦点,从而提高了至少一个焦点可以产生表示具有改进的信号-噪声分布的液滴内对象的光学信号的概率。通过调整物镜和光学装置之间的距离,可以调整两个焦点之间的距离。在一些实施方式中,束分离器的光学元件可以包括光纤分离器,光纤分离器可以将光分离成两个出射激光束。在一些实施方式中,如图18所示,束分离器的光学元件可以包括诸如wollaston棱镜等的双折射偏振器,其可以将光分离成具有正交或近正交偏振的两个线性偏振出射激光束。为了实现双聚焦,可以通过利用wollaston棱镜分离光来提供用于微流体通道的单段的线形激光照明。在分离之前,光可以是非偏振的,或者以45度角偏振。可以调整wollaston棱镜和物镜之间的距离以修改焦点1和焦点2之间的距离。示出光学元件的侧视示意图(图18a)和顶视示意图(图18b)的一部分。
260.将参考以下示例进一步描述附加示例性实施方式;然而,这些示例性实施方式不限于这些示例。示例示例1:作为检测点的一部分的通过棱镜进行45度角激发和发射的高级光学配置的实现。
261.图19a-图19d示出了作为检测点的一部分的高级光学配置的示例性实现。使用在棱镜的两个转角处彼此垂直定位的两个物镜相对于微流体通道的方向以约45度角提供激发/发射光(图19a和图19c),或者以常规的90度角提供激发/发射光(图19b和图19d)。在具有附接在流动通道上的棱镜的微流体装置(图19a)或没有棱镜的装置(图19b)的区段的照片中展示45度角与90度角的实现。液滴内对象是直径为约6μm并且具有fitc荧光团的荧光校准珠。通过使用pmt经由535/50nm带通滤波器来检测来自珠的荧光信号,并将其作为电压振幅输出。检测到的液滴内荧光信号的信号振幅的示例性直方图轮廓在图19c和图19d中示出,其中与传统的90度角(图19d;信号标准偏差~0.37伏)相比,45度激发/发射角(图19c)产生更均匀的信号大小(信号标准偏差~0.14伏)。示例2:具有双聚焦的检测点的实现。
262.图20a-图20b示出了检测点处的双聚焦特征的示例性实现。基于双聚焦的检测可以通过单个pmt(例如,在分选接头之前的第一检测点处)完成。图20a是视野的示例性照片,其中用虚线突出显示焦点位置,并且示出相对液滴流动。照片是基于背景散射光拍摄的快
照。如在图18中所描述的,通过利用wollaston棱镜分离照明来产生相同微流体通道的线形激光照明。图20b示出了分别使用圆形200μm针孔(浅灰色线)和200μm宽、1mm长狭缝(深灰色线)检测到的pmt信号的示例性轮廓。通过长缝隙,能够拾取焦点1和焦点2的信号。示例3:在单一视野下利用集成的第一检测点和第二检测点的多点检测的实现。
263.在图21a中示出了基于图16所示的多点检测示意图实现的光学组装件的快照。在单一视野下,第一检测点和第二检测点沿着微流体通道的两个平行或反平行段集成/布置。提供单个圆柱形激光束(激发光)来对视野进行照明,但是发射光被分离到两个下游检测器(pmt 1和pmt 2)中,这两个下游检测器与来自两个检测点的发射光相对应。图21b是使用前述光学组装件检测的检测到的液滴的信号的示例性轮廓。示例4:在缓冲区内的检测点处的液滴成像。
264.使用具有如图17b所描绘的缓冲区的微装置,在缓冲区中减慢液滴以获得改进的图像分辨率。图22示出了分别在时间点1(t1)、时间点2(t2)和时间点3(t3)处的包含多个荧光对象的单个移动液滴的示例性图像。使用彩色模式(rgb)cmos相机在缓冲区中的检测点处拍摄图像,每个图像具有20ms(毫秒)的曝光。示例5:多点液滴检测和索引。
265.如图23所示,通过用alexa fluor-488(“af-488”)、alexa fluor-647(“af-647”)和brilliant violent-421(“bv421”)染料包封捕捉小鼠抗cd3抗体(克隆sp34)和荧光标记的二抗(山羊抗小鼠igg)的蛋白a包被的微球来产生液滴。这些液滴经过两个检测点。第一检测点基于pmt(例如,在分选接头的上游),并且第二检测点基于cmos相机(例如,在分选接头的下游)。对于第二检测点,来自10ms曝光的图像分别与液滴#1、#2和#3的绿色(af-488)、远红色(af-647)和蓝色(bv421)通道相对应。分别在激光波长405nm、488nm和638nm处激发荧光。如本文所述对各个液滴进行索引以跟踪它们各自的pmt信号(来自第一点检测)和序列图像(来自第二点检测)。注意,对于这些索引液滴中的每一个,仅示出一个序列图像。
266.在另一示例性测定中,液滴内荧光对象可以是各种细胞,其用细胞跟踪染料标记、阳性地表达荧光报告蛋白(例如,绿色荧光蛋白),或用荧光标记细胞表面标记物(例如,cd4、cd8、cd3、c-kit和/或her2)。示例6:液滴传感器的实现。
267.图24a-图24d示出了用以检测单个液滴、液滴大小、液滴速度和沿着流动通道的液滴位置的示例性光学传感器及其实现的示例性组装件。在反向偏压下使用硅光电二极管检测ir-led(波长为780nm)的光。对光电二极管信号进行高通滤波(f=10hz截止)和放大(增益=100)。图24a示出了包含用于检测/感测液滴的两个光学传感器的组装件的照片。图24b示出了由流过经过硅光电二极管的玻璃毛细管通道的液滴产生的光电二极管电压信号。图24c示出了表示液滴的两组光电二极管电压信号,这两组光电二极管电压信号通过使用沿着流动通道以相距35mm的距离定位的两个传感器来检测。根据信号时延和两个传感器之间的已知距离,计算液滴速度,以对下游液滴分配模块处的精确分配步骤进行定时。图24d示出了通过图24c所示的正尖峰和负尖峰之间的距离测量的液滴大小分布的直方图。示例7:筛选分泌与人抗原特异性结合的igg的b细胞。
268.在用人抗原(例如,cd3、her2、il-17a)免疫后,可以从小鼠或其它常用动物(诸如大鼠和兔)的脾或骨髓中分离b细胞。使用本公开内容中所描述的方法(包括图14和图15中
的方法),免疫衍生的小鼠b细胞、抗小鼠igg包被的微颗粒和alexa fluor 647包被的人抗原可以共包封到具有均匀大小(例如,约60μm)的液滴中。液滴可被收集在管中,并在芯片外培养2-3小时。
269.在培养后,液滴将重新注入分选单元。靶液滴可以基于反映微颗粒上的alexa fluor 647焦点的远红色峰值信号来检测。可以通过设置荧光信号的阈值来触发分选致动器。然后,分选液滴可以通过微流体管道(例如,毛细管)被引导至第二检测点,以用于双重检查荧光标记的靶液滴。在通过第二检测点阈值之后,分配单元(x-y-z移动台)将被触发以将单个液滴分配到pcr管或条中。分配的液滴可被索引,并用于下游分析(诸如单细胞pcr和进一步的验证研究)。示例8:利用磁性颗粒来筛选分泌抗原特异性igg的b细胞
270.在该示例中,除了抗小鼠igg包被的微颗粒是磁性的,样本与示例1中所使用的样本相同。可以在如图8a-图8e所示的检测点之前使用永磁体或可调谐电磁体来对准这些磁性微颗粒。与随机分布的微颗粒相比,预先对准的磁性微颗粒将提供更好的聚焦,因此提高检测效率和准确性。分选的液滴将在单个管中分配和索引,并用于下游分析(诸如单细胞pcr和进一步的验证研究)。示例9:用于使用串行分选来分选分泌抗cd3抗体以驱使t细胞激活的b细胞的功能性测定。
271.将来自免疫小鼠的原代b细胞样本、微颗粒和jurkat报告细胞共包封到液滴中,并培养约10小时。阳性b细胞分泌抗cd3抗体,该抗体可以激活jurkat报告细胞,jurkat报告细胞通过报告细胞中的转录信号级联产生绿色荧光蛋白(gfp)作为功能性读出。因此,当488nm激光束激发出绿色荧光信号时,可以通过该绿色荧光信号的存在来检测靶液滴,并在可基于介电泳力或声力的分选点处将靶液滴分选到收集通道中。
272.对于功能性抗体筛选测定,阳性命中通常极低(例如,起始b细胞的《0.01%);因此,部分由于液滴合并相关的被动分选,假阳性率可能相对较高。为了减少假阳性分选,可以在图9所示的系统和方法中添加第二分选单元以再次分选液滴(即,串行分选)。双重分选的液滴将在单个管中分配和索引,并用于下游分析(诸如单细胞pcr和所得抗体的遗传序列的识别)。示例10:用于使用与并行检测组合的串行分选来分选分泌抗cd3抗体以驱使t细胞激活的b细胞的功能性测定。
273.在本示例中,样本与示例3中所使用的样本相同。然而,两个检测点将共享同一物镜,该物镜包括诸如多区pmt(例如,hamamatsu线性阵列多阳极pmt模块h11460-03)等的多区检测器。这种方法简化了光路,导致分选装置的紧凑设计。在第二步分选后,可以进行下游分配、索引和分析。示例11:利用用于跟踪单独分配的液滴的信号索引来筛选分泌与人bcma和猴bcma两者特异性结合的igg的b细胞。
274.在本示例中,b细胞将用celltrace violet染色,同时使用与alexa fluor 488缀合的人bcma抗原和与alexa fluor 647缀合的猴bcma抗原。将使用涂有抗小鼠igg的微颗粒。所有这些试剂将与从人bcma免疫小鼠的脾中富集的igg阳性原代b细胞一起共包封到液滴中。
275.在37℃下培养约3小时后,液滴将被引导至第一检测点以检测alexa fluor 647和alexa fluor 488荧光焦点信号,然后双阳性液滴将被分选以获得一批靶液滴,并且可以用celltrace信号进一步检测靶液滴,该celltrace信号用于指示活的b细胞并提供靶液滴的精确定时以与其在上游检测点处的检测同步。只有具有活的b细胞的靶液滴将被分配到诸如96孔pcr板等的多位置收集器中。通过使来自上游的第一检测点和下游的第二检测点的每个靶液滴同步,收集到的每个靶液滴的荧光信号(即,蓝色、绿色和红色)可以完全相关,以使得能够对任何靶液滴内的单个b细胞进行非常信息性的分析。示例12:检测点处的远程聚焦的实现。
276.本公开内容中所公开的细胞分选和分配系统其中之一的物镜透镜在与样本接合时将通过束分离器、接着是圆柱形透镜(例如,thorlabs n-bk7安装的平凸圆柱形透镜cat#lj1629rm-a)以平行束照明。将选择直径足够大以填充物镜透镜的后孔径以及tag透镜(例如,针对可见光谱优化的tag optics tag透镜2.0)的孔径的照明束。沿着圆柱形透镜的非聚焦轴,束将被聚焦到由物镜透镜(例如,olympus 10x na 0.3wd 10mm空气浸没透镜)的na限定的紧密斑点中。通过改变tag透镜的焦距,可以快速平移样本处的焦平面位置,并且可以沿着通道的整个轴向延伸实现相同的分辨率。
277.来自样本的光将利用同一透镜捕捉,经由束分离器与照明光分离,并聚焦到孔径中,该孔径的大小对应于焦斑的横向延伸乘以在用pmt(例如,hamamatsu光电传感器模块#h10721)检测之前的物镜透镜的有效放大率。
278.这种共焦检测方案应当有效地抑制离焦信号。沿着圆柱形透镜的聚焦轴,平行照明光束将被聚焦到物镜透镜的后焦平面中,导致在离开物镜透镜之后与通道宽度匹配的束的缩小。沿着这个方向,检测器之前的孔径将被设置为足够大以覆盖通道的放大图像。tag透镜将位于物镜透镜的后焦平面中,与圆柱形透镜的焦点位置一致,其中束直径应处于最薄处。因此,tag透镜的有效孔径将非常低,并且束传播应仅受沿着圆柱形透镜的聚焦轴重新聚焦的tag透镜的最小影响。示例13:检测点处的双面照明/检测的建议实现。
279.在本示例中,我们的细胞分选和分配系统包括两个物镜透镜(ol)ol1和ol2,同时经由棱镜(例如,thorlabs dove棱镜,15mm,n-bk7,arc:350-700nm ps992-a)与样本接合。这两个物镜透镜将通过束分离器、接着是圆柱透镜以平行束进行照明。沿着圆柱透镜的非聚焦轴,束将被聚焦到由物镜透镜的数值孔径以及照明束直径限定的片中。然后,来自被照明平面的光将利用相对的透镜捕捉,并经由束分离器与照明光分离。然后该信号将聚焦到pmt上。示例14:检测点处的多区检测模块的实现。
280.在本示例中,我们的细胞分选和分配系统包括恒定或脉冲照明源,诸如连续波(cw)激光器或q开关激光器(例如,晶体激光二极管泵浦的超紧凑q开关激光器)。靶将在具有物镜透镜和镜筒透镜的微流体装置中成像到电子倍增ccd(emccd)或科学cmos(scmos)相机芯片(例如,光度计prime 95b背照式scmos相机)上。
281.至少可以使用两种方法来避免运动模糊。可以使用检测路径中的扫掠偏转器(例如,剑桥电流计扫描器cat#62xx-h和82xxk)来补偿颗粒移动并在相机曝光周期期间保持其图像位置在相机芯片上恒定。可替代地,可以使用简短的照明脉冲来将样本平面处的信号
光子产生局限到与所要求的空间分辨率相比,靶没有显著移动的时间跨度。示例15:检测点处的多区检测模块的替代实现。
282.当从侧面观察时,我们的系统及其检测模块的设计类似于单个微流体通道内的传统光学检测。沿着非聚焦轴观察,平行束将穿过圆柱光学元件。在通过束分离器之后,束将经由物镜透镜被聚焦到微流体通道中。因此,薄光片将对垂直于流动方向的通道进行照明。
283.诸如荧光等的信号将由相同的物镜透镜从通过光片位置处的通道的样本拾取,从束分离器反射并且通过阻挡来自离焦平面的信号的孔径。在通过孔径之后,信号将被重新聚焦到诸如pmt等的合适检测器的有效区域上。
284.当从正面观察(即,从通道的截面看)时,单个通道通常可以沿其整个宽度照明。然而,该宽度通常将比光学布置的视野小得多。为了利用全视野来增加样本通量,可以在微流体芯片内将样本分离到彼此相邻的多个通道(例如,间距0.1mm的具有0.1mm宽度的三个通道,导致总要求视野为0.5mm)中。
285.沿着这个方向,照明束也将例如利用掩模或微透镜阵列分离成多个平行束。每个束将由圆柱形光学元件聚焦到物镜的后焦平面中。束的间距和宽度应当被配置成使得每个通道沿着其宽度被照明。
286.可替代地,可以使用单个束来对所有通道进行照明。使用多个束的优点是通道之间的间隙不会被照射,从而导致背景减小。来自所有通道的信号将被物镜透镜拾取并从束分离器反射。利用镜筒透镜,来自每个通道的光将被重新聚焦成一捆平行束。孔径可用于对该捆平行束进行空间滤波,以减少背景以及通道之间的串扰。利用另一透镜,每个束继而将聚焦在诸如线性pmt阵列等的多区检测器的单独有效区域上。可以将光学滤波器添加到检测路径以选择特定的波长带。作为多区pmt的替代,可以使用相机作为检测器,其中来自不同流体通道的光聚焦在相机芯片的不同区域。示例16:基于细胞因子分泌谱的抗原特异性t细胞的隔离。
287.细胞因子的分泌是许多免疫细胞的功能标记。例如,已知cd8阳性细胞毒性t细胞在t细胞受体(tcr)与由抗原呈递细胞或癌细胞呈递的同源肽mhc复合物相互作用时被激活并分泌诸如il-2、ifnγ和tnfα等的标志细胞因子,其中肽由诸如mart-1和ny-eso-1等的肿瘤新抗原加工而成。通常,抗原特异性t细胞是罕见事件(所有t细胞的《0.01%)。为了筛选可能存在于人血样本或源于患者的肿瘤浸润性淋巴细胞(til)样本中的罕见ny-eso-1特异性细胞毒性t细胞,可以由诸如k562等的模型细胞上的mhc分子(例如,hla-a2变体)呈递ny-eso-1肽(例如,包含sllmwitqv的肽序列),以获得工程化抗原呈递细胞k562
ny-eso-mhc
。然后,k562
ny-eso-mhc
细胞可以与源自供体或患者血液样本的人类t细胞池以及ifnγ捕捉微珠(用第一抗ifnγ抗体包被)和用缀合alexa fluor 488标记的第二抗ifnγ抗体共包封,使得绝大多数液滴将分别精确地接收零个或一个候选t细胞、一个或两个k562
ny-eso-mhc
细胞和至少一个ifnγ捕捉微珠。在t细胞和包封的k562
ny-eso-mhc
细胞的同源相互作用时,t细胞可被激活,其可以基于液滴中的ifnγ捕捉微珠上的阳性荧光焦点形成而被检测。然后,可以通过使用本文描述的一个或多个示例性系统来检测、分选和分配具有低丰度的焦点阳性液滴。可以进一步处理所检测到的荧光信号数据并将其与每个单独分配的液滴匹配,以便于分析和识别回收液滴内的单个t细胞。示例17:循环肿瘤细胞(ctc)的识别。
288.循环肿瘤细胞是肿瘤液体活检领域的重要课题。循环肿瘤细胞(ctc)是从原发肿瘤排出到脉管系统或淋巴管中,并在循环中搬运到全身的细胞。因此,ctc构成重要远端器官中额外肿瘤(转移)的后续生长的种子,触发了导致绝大多数癌症相关死亡的机制。ctc可作为早期肿瘤检测、肿瘤诊断、患者分层、治疗监测、疾病进展监测和预后的重要指标或诊断指标。血液样本可以利用ctc的检测试剂包封在液滴中并进行免疫检测或pcr检测,以使用本公开内容中所公开的方法和系统识别具有阳性信号的血液样本。然后可对所识别的(靶)液滴进行分选以供如本文所述的进一步分析。示例18:靶特异性化合物的体外筛选
289.本文描述的任何公开的示例性系统和方法可用于选择和筛选靶特异性化合物。包含也被编条形码的多个化合物负载珠的化合物库(即,所谓的“一个珠上一种化合物”或“一种化合物一个珠”)可以用多个液滴内的靶表达报告细胞单独分隔。如果所提供的靶与同一液滴中的特定化合物结合,则报告细胞将产生信号,该信号可以是荧光分子。可以使用本公开内容中所公开的任何示例性系统和方法来检测和分选液滴,以精确地识别回收液滴上的条形码并随后识别候选化合物。示例19:基因组编辑细胞的筛选。
290.本文描述的任何公开的示例性系统和方法可用于筛选已进行crispr-cas9介导的基因组编辑的单细胞(例如,t细胞、b细胞、树突细胞、自然杀伤细胞、干细胞、β细胞、神经元细胞、酵母、细菌等)。可以向编辑(即,工程化)细胞提供读出测定以指示成功的编辑事件。可以利用测定试剂(如果有的话)将单个编辑细胞包封搭配单个亚纳升液滴中,该亚纳升液滴然后可被引入微流体装置中以用于随后测量反映编辑细胞的功能或表型的读出信号。示例性读出信号可以是gfp报告基因、发光报告基因、荧光基质和/或荧光标记的检测珠。可以使用本文描述的任何公开的系统和方法来识别和回收具有用户建立的读出标准的靶液滴。
291.当一个特征或元件在本文中被称为“在另一特征或元件上”时,它可以直接在该另一特征或元件上,或者也可以存在介入特征和/或元件。相比之下,当一个特征或元件被称为“直接在另一特征或元件上”时,不存在介入特征或元件。还将理解,当一个特征或元件被称为“连接”、“附接”或“耦合”到另一特征或元件时,它可以直接连接、附接或耦合到该另一特征或元件,或者可以存在介入特征或元件。相比之下,当一个特征或元件被称为“直接连接”、“直接附接”或“直接耦合”到另一特征或元件时,不存在介入特征或元件。尽管针对一个实施方式描述或示出,但是如此描述或示出的特征和元件可适用于其它实施方式。本领域技术人员还将理解,对设置为“邻近”另一特征的结构或特征的参考可以具有与邻近特征重叠或位于邻近特征下面的部分。
292.本文中使用的术语仅用于描述特定实施方式的目的,而不旨在限制本发明。例如,如本文所使用的,单数形式“一”、“一个”和“那个”旨在也包括复数形式,除非上下文另有明确指示。将进一步理解,当在本说明书中使用时,术语“包含”和/或“含有”规定所述特征、步骤、操作、元件和/或组件的存在,但不排除一个或多个其它特征、步骤、操作、元件、组件和/或其组的存在或添加。如本文所使用的,术语“和/或”包括相关列出项中的一个或多个的任何和所有组合,并且可以缩写为“/”。
293.为了便于描述,本文可以使用诸如“在
…
下方”、“在
…
之下”、“低于”、“在
…
上方”和“在
…
之上”等的空间相对术语来描述一个元件或特征与图中所示的另一元件或特征的
关系。应当理解,除了附图中所描绘的定向之外,空间相对术语还旨在包含使用中或操作中的装置的不同定向。例如,如果图中的装置被反转,则被描述为“在其它元件或特征下方”或“在其它元件或特征下面”的元件将被定向为“在其它元件或特征上方”。因此,示例性术语“在
…
下方”可以包含上方和下方的定向。装置可以以其它方式定向(旋转90度或以其它定向),并且本文使用的空间相对描述符被相应地解释。类似地,术语“向上”、“向下”、“垂直”和“水平”等在本文中仅用于解释目的,除非另有明确指示。
294.虽然术语“第一”和“第二”在本文中可用于描述各种特征/元件(包括步骤),但是除非上下文另有指示,否则这些特征/元件不应受这些术语的限制。这些术语可用于区分一个特征/元件与另一特征/元件。因此,在不偏离本发明的教导的情况下,下文讨论的第一特征/元件可以被称为第二特征/元件,并且类似地,下文讨论的第二特征/元件可以被称为第一特征/元件。
295.在本说明书和随后的权利要求书中,除非上下文另有要求,否则“包括”一词以及诸如“包含”和“含有”等的变型意味着各种组件可以共同用于方法和物品(例如,包括装置和方法的组成和设备)中。例如,术语“含有”将被理解为意味着包括任何所述元件或步骤,但不排除任何其它元件或步骤。
296.如在本文的说明书和权利要求书中所使用的(包括如在示例中所使用的),并且除非另有明确规定,否则所有数字可被读作如同以“约”或“近似”一词开头,即使术语没有明确出现。当描述幅度和/或位置时,可以使用短语“约”或“近似”,以指示所描述的值和/或位置在合理的预期值和/或位置范围内。例如,数值可以具有如下的值,该值是所述数值(或值范围)的 /-0.1%、所述数值(或值范围)的 /-1%、所述数值(或值范围)的 /-2%、所述数值(或值范围)的 /-5%、所述数值(或值范围)的 /-10%的值,等等。除非上下文另有指示,否则本文给出任何数值也应理解为包括约或近似该值。例如,如果公开值“10”,则也公开“约10”。本文所述的任何数值范围旨在包括其中包含的所有子范围。还应当理解,当公开“小于或等于”某个值的值时,如本领域技术人员所适当地理解,也公开“大于或等于该值”以及值之间的可能范围。例如,如果公开值“x”,则还公开“小于或等于x”以及“大于或等于x”(例如,其中x是数值)。还应当理解,在整个应用中,数据以多种不同格式提供,并且该数据表示端点和起点以及数据点的任意组合的范围。例如,如果公开了特定数据点“10”和特定数据点“15”,则应当理解,大于、大于或等于、小于、小于或等于、以及等于10和15以及在10和15之间被认为是公开的。还应当理解,还公开了两个特定单元之间的每个单元。例如,如果公开了10和15,则还公开了11、12、13和14。
297.虽然本文已经示出和描述了本发明的优选实施方式,但是对于本领域技术人员显而易见的是,这些实施方式仅以示例的方式提供。在不脱离本发明的情况下,本领域技术人员现将想到许多变化、改变和替代。应当理解,本文所述的本发明的实施方式的各种替代可用于实践本发明。以下权利要求旨在限定本发明的范围,并且由此涵盖这些权利要求的范围内的方法和结构及其等同项。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。