包含pyy化合物和n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐的固体组合物
技术领域
1.本发明涉及包含肽酪氨酸酪氨酸(pyy)化合物和n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐的固体组合物及其在医学中的用途。
2.序列表的援引并入
3.名称为“190071ep01 seq_st25”的序列表为16,442个字节,创建于2019年7月5日,并且通过引用并入本文。
4.背景
5.pyy在进餐过程中从在远端小肠和结肠中的l-细胞中释放。已知pyy在胃肠(gi)道中具有外周作用,并且还主要起到饱腹感信号的作用。pyy作为具有c末端酰胺的36个氨基酸的肽(pyy(1-36))被天然地分泌,但被切割为构成约50%的循环pyy的pyy(3-36)。负责该降解的酶是二肽基肽酶iv(dppiv)。pyy(3-36)快速地被蛋白酶及其他清除机制消除。已经报道,pyy(3-36)在猪中的半衰期《30分钟。因此,pyy表现出次优的药代动力学性质,这意味着该肽必须每天施用至少两次。
6.pyy(1-36)以极小的选择性激活y1、y2和y5受体,而以略小的选择性激活y4受体,但dppiv处理过的pyy(3-36)表现出对y2受体的选择性比对y1、y4和y5受体的选择性增加,尽管保留了一定的y1和y5亲和性。已知y2受体活化降低食欲和食物摄入量,而y1和y5受体活化导致食欲和食物摄入量增加。此外,y1和y5受体活化可导致血压升高。
7.根据这些肽中的某些肽在动物模型和人类中所显示出的效果,以及根据肥胖者具有低基础水平的pyy以及该肽较低的餐食响应这一事实,已建议在肥胖症以及相关疾病的治疗中使用pyy(3-36)。此外,已经证明y2受体激动剂在胃肠(gi)道中具有抗分泌和促吸收作用。已经提示了y2受体激动剂在一些胃肠病症的治疗中的潜在应用。
8.根据在例如zucker大鼠和饮食诱发的肥胖(dio)小鼠中所显示出的效果,y2选择性pyy(3-36)类似物对葡萄糖代谢具有积极影响,因此被建议用于糖尿病的治疗。wo2011/058165、wo2015/071355和wo2016/198682公开了具有延长的药代动力学性质的y2选择性受体激动剂的实例。
9.pyy(3-36)已与其他肽联合施用,例如与glp-1(7-36)联合,并显示出治疗肥胖症和糖尿病的有希望的结果(schmidt等人,am j physiol endocrinol metab,306:e1248-e1256,2014)。
10.人pyy及其类似物具有低口服生物利用度。人pyy及其类似物只有在用特定量的某些吸收促进剂配制时才能在口服给药后在血浆中检测到。
11.steinert等人(am j clin nutr,2010年10月;92,810-817)公开了包含pyy(3-36)和150mg n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac)的片剂的口服给药,以及包含glp-1(7-36)和pyy(3-36)与150mg snac的组合的片剂的口服给药。wo2004/104018和wo2006/017251分别描述了使用snac作为递送剂以片剂形式口服施用pyy(3-36)或其颊部给药。glp-1受体激动剂司美格鲁肽已与snac一起配制,以获得具有口服生物利用度的片剂
(wo2012/080471和wo2013/139694)。
12.尽管有这些发现,但仍需要优化的用于口服给药的药物组合物,该组合物包含任选地与glp-1受体激动剂组合的pyy化合物。
技术实现要素:
13.在一个方面,本发明涉及包含pyy化合物和吸收促进剂或递送剂的组合物。在一个实施方案中,根据本发明的组合物的辅料包括极高含量的递送剂和最小含量的如本文所述的其他辅料。所提供的组合物表现出加速的溶出,使得能够更快速地摄取活性药物成分。
14.由于治疗性肽在胃肠系统中的快速降解,这类肽的口服给药具有挑战性。
15.本文描述了通过口服给药提供pyy化合物的加速溶出和吸收的药物组合物。因此根据先前对司美格鲁肽获得的数据可以预见,通过口服给药,pyy化合物的暴露得到改善。发明人惊奇地发现,当组合物的辅料包含极高含量的吸收促进剂和最小含量的任何其他辅料时,pyy化合物的溶出增加。
16.在一个方面,本发明涉及组合物,其中递送剂相对于总组合物,或者特别是相对于该组合物的其他辅料的重量比非常高。
17.在一个实施方案中,本发明涉及包含pyy化合物、递送剂和/或吸收促进剂如snac的药物组合物,其中所述递送剂/吸收促进剂占该组合物的辅料的至少90%(w/w)。
18.在一个实施方案中,本发明涉及包含pyy化合物、递送剂和/或吸收促进剂如snac的药物组合物,其中所述递送剂/吸收促进剂占该组合物的至少60%(w/w)。
19.在另外的实施方案中,所述组合物进一步包含润滑剂。
20.在一个方面,本发明涉及用于医学,例如用于治疗糖尿病和/或肥胖症的本发明组合物,其中所述组合物经口服施用。
21.在一个方面,本发明涉及治疗糖尿病或肥胖症的方法,其包括向有需要的患者施用如本文定义的组合物,其中所述组合物是片剂并且经口服施用。
附图说明
22.图1显示了与测试组合物1相比,测试组合物2和测试组合物3的pyy化合物4的快速溶出(释放)。
23.描述
24.在一个方面,本发明涉及包含pyy化合物和吸收促进剂或递送剂的组合物。该组合物可以是适合口服给药的形式,如片剂、囊剂或胶囊。在一个实施方案中,该组合物是口服组合物,或药物组合物,如口服药物组合物。
25.在一个实施方案中,根据本发明的组合物包含高含量的递送剂和最小含量的如下文所述的其他辅料。所提供的组合物表现出加速的溶出,从而使得能够快速且有效地摄取活性药物成分。
26.pyy化合物
27.如本文所用的术语“hpyy(1-36)”是指人肽yy,其序列以seq id no:1包含在序列表中。具有seq id no:1的序列的肽也可以被称为天然hpyy。
28.如本文所用的术语“pyy化合物”是指作为hpyy(1-36)的变体的肽或化合物。如本
文所用的术语“pyy化合物”还可指作为hpyy(3-36)(seq id no:2)的变体的肽或化合物。如本文所用的术语“pyy化合物”还可指作为hpyy(4-36)(seq id no:29)的变体的肽或化合物。在一些实施方案中,术语“变体”是指包含一个或多个氨基酸置换、缺失、添加和/或插入的化合物。
29.本发明组合物中包含的pyy化合物的c末端是酰胺,正如天然hpyy(1-36)(seq id no:1)、hpyy(3-36)(seq id no:2)和hpyy(4-36)(seq id no:29)各自的c末端一样。
30.本发明组合物中包含的pyy化合物可以是pyy类似物和/或其衍生物。
31.术语“pyy类似物”用于这样的pyy化合物,其中与hpyy(1-36)相比,在骨架中存在至少一个氨基酸修饰。
32.术语“pyy衍生物”用于包含至少一个共价连接的非氨基酸取代基的pyy化合物。因此,pyy衍生物是pyy类似物的衍生物,因而是在骨架中包含至少一个氨基酸修饰并包含至少一个共价连接的非氨基酸取代基的pyy化合物。
33.与hpyy(3-36)(seq id no:2)相比,本发明组合物中包含的pyy化合物可包含至多10个氨基酸修饰。
34.在本技术中通篇使用的术语“氨基酸修饰”以如下含义使用:与hpyy(3-36)相比,对氨基酸的修饰。该修饰可以是氨基酸缺失、氨基酸添加或一个氨基酸被另一个氨基酸置换的结果。
35.在一个方面,本发明组合物中包含的pyy化合物在wo2016/198682的实施例1中描述(化合物1-63、65-71),并且其中描述了它们的生物学数据,效力(实施例2)、结合亲和力(实施例3))、半衰期(实施例4)及其药效学数据(对血糖和食物摄入量的影响,实施例5)。
36.在一个方面,本发明组合物中包含的pyy化合物可包含:i)在与hpyy(1-36)(seq id no:1)的位置7或10相对应的位置处的赖氨酸;ii)在与hpyy(1-36)(seq id no:1)的位置30相对应的位置处的色氨酸;iii)在与hpyy(1-36)(seq id no:1)的位置31相对应的位置处的亮氨酸;以及iv)在与hpyy(1-36)(seq id no:1)的位置28相对应的位置处的酪氨酸,这意味着除了在与hpyy(1-36)(seq id no:1)的位置7、30、28和31相对应的位置处的这些修饰之外,该方面的pyy化合物与hpyy(3-36)相比还可包含至多6个氨基酸修饰。
37.在另一方面,本发明组合物中包含的pyy化合物可包含:i)在与hpyy(1-36)(seq id no:1)的位置7或10相对应的位置处的赖氨酸;ii)在与hpyy(1-36)(seq id no:1)的位置30相对应的位置处的色氨酸;iii)在与hpyy(1-36)(seq id no:1)的位置31相对应的位置处的亮氨酸;iv)在与hpyy(1-36)(seq id no:1)的位置28相对应的位置处的酪氨酸;以及v)在与hpyy(1-36)(seq id no:1)的位置22相对应的位置处的异亮氨酸,这意味着除了在与hpyy(1-36)(seq id no:1)的位置7、30、28和31相对应的位置处的这些修饰之外,该方面的pyy化合物与hpyy(3-36)相比还可包含至多5个氨基酸修饰。
38.作为一个示例,与hpyy(3-36)相比,[arg4,lys7,gln18,try28,trp30,leu31]hpyy(3-36)包含6个氨基酸置换。作为另一个示例,与hpyy(3-36)相比,[arg4,lys7,gln18,try28,trp30,leu31]hpyy(4-36)包含6个氨基酸置换和1个缺失,这意味着与hpyy(3-36)相比,该化合物具有7个氨基酸修饰。
[0039]
本发明组合物中包含的pyy化合物可参照以下两方面来描述:i)hpyy(1-36)(seq id no:1)中与改变的氨基酸残基相对应的氨基酸残基的编号(即,hpyy(1-36)中的相应位
置),和ii)实际改变。
[0040]
表述“等同于...的位置”或“与...相对应的位置”用来参照hpyy(1-36)表征变异pyy序列中的变化位点。
[0041]
通常在整个申请中,当提及pyy类似物的特定位置时,所提及的位置是与hpyy(1-36)的该特定位置相对应的pyy类似物的位置。
[0042]
在序列表中,给定序列的第一个氨基酸残基被指定为第1号。这意味着例如hpyy(3-36)的第一个氨基酸残基,即异亮氨酸,被指定为序列表中的第1号。然而,在整个本技术中,该位置被称为与hpyy(1-36)的位置3相对应的位置。
[0043]
本技术通篇使用的表述——pyy化合物在与hpyy(1-36)的某位置相对应的位置处包含特定氨基酸,意指在该位置处的天然氨基酸已被该特定氨基酸所替换。
[0044]
以下是合适的类似物命名法的非限制性实例。
[0045]
[lys7,tyr28,trp30,leu31]hpyy(3-36)表示人pyy(1-36)的类似物,其中位置7的天然存在的丙氨酸已被置换为赖氨酸,位置28的天然存在的亮氨酸已被置换为酪氨酸,位置30的天然存在的亮氨酸已被置换为色氨酸,位置31的天然存在的缬氨酸已被置换为亮氨酸,且位置1和2的酪氨酸和脯氨酸已分别缺失。同样,[lys7,tyr28,trp30,leu31]hpyy(3-36)也可被认为是表示人pyy(3-36)的类似物,其中位置7的天然存在的丙氨酸已被置换为赖氨酸,位置28的天然存在的亮氨酸已被置换为酪氨酸,位置30的天然存在的亮氨酸已被置换为色氨酸,且位置31的天然存在的缬氨酸已被置换为亮氨酸。
[0046]
以下是pyy类似物的衍生物的合适命名的非限制性实例。n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]hpyy(4-36)表示hpyy(4-36)的类似物的衍生物,其中[arg4,lys7,gln18,tyr28,trp30,leu31]表示与人pyy(4-36)相比的氨基酸变化,数字是指pyy(1-36)的相应位置,并且其中取代基3-甲基丁酰基连接至n末端氨基酸残基的α氨基,并且取代基[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]连接至在与hpyy(1-36)的位置7相对应的位置处的赖氨酸的ε氨基。
[0047]
氨基酸残基可用其全名、其单字母代码和/或其三字母代码来表示。这三种方式完全等效。
[0048]
与hpyy(1-36)相比,“包含”某些指定改变的类似物可包含进一步的改变。在一个方面,类似物“具有”指定的改变。
[0049]
pyy类似物
[0050]
pyy类似物是与hpyy(1-36)或hpyy(3-36)相比其中一些氨基酸残基已经被修饰的pyy化合物。这些修饰包括单独或组合形式的置换、插入和/或缺失。
[0051]
在特定方面,本发明组合物中包含的pyy类似物包含一个或多个“非必需”氨基酸残基修饰。在本发明的上下文中,“非必需”氨基酸残基是在人pyy氨基酸序列中可被改变,即缺失或置换,而不消除或基本上不降低pyy类似物对y2受体的活性的残基。
[0052]
在一个方面,氨基酸可以通过保守置换来置换。如本文所用的术语“保守置换”表示一个或多个氨基酸被生物学上类似的另一残基代替。实例包括具有类似特性的氨基酸残基的置换,例如小氨基酸、酸性氨基酸、极性氨基酸、碱性氨基酸、疏水性氨基酸和芳香族氨基酸的置换。
[0053]
在一个方面,本发明组合物中包含的pyy类似物可包含一个或多个非天然氨基酸和/或非氨基酸如氨基酸模拟物向pyy序列内的置换。
[0054]
在一个方面,本发明组合物中包含的pyy类似物可以单独地或与一个或多个插入或置换相组合地,相对于人pyy的氨基酸序列缺失一个或多个氨基酸残基。
[0055]
在一个方面,本发明组合物中包含的pyy类似物可以单独地或与一个或多个缺失和/或置换相组合地,具有插入到人pyy的氨基酸序列中的一个或多个氨基酸残基。
[0056]
在一个方面,本发明的pyy类似物可包含一个或多个非天然氨基酸和/或非氨基酸向pyy序列中的插入。
[0057]
术语“氨基酸”包括蛋白型(proteinogenic)(或编码的或天然)氨基酸(其中有20种标准氨基酸)以及非蛋白型(或非编码的或非天然)氨基酸。蛋白型氨基酸是天然地并入蛋白质中的氨基酸。标准氨基酸是由遗传密码编码的氨基酸。非蛋白型氨基酸或者不存在于蛋白质中,或者不通过标准细胞机制产生(例如,它们可能已经经历翻译后修饰)。非蛋白型氨基酸的非限制性实例是蛋白型氨基酸的d-异构体。蛋白型氨基酸的d-异构体的一个实例是天冬氨酸的d-异构体,其还可书写为d-asp。
[0058]
在下文中,未说明其光学异构体的pyy化合物的所有氨基酸都应被理解为意指l-异构体(除非另有说明)。
[0059]
pyy衍生物
[0060]
如本文在pyy化合物的语境中所用的术语“衍生物”是指化学修饰的pyy肽,其中一个或多个取代基已经共价连接至该肽。
[0061]
在本发明的一个方面,该取代基可以是n末端取代基。
[0062]
另外或备选地,在一个方面,所述取代基可以是修饰基团,或者备选地被称为延长部分。
[0063]
n末端取代基
[0064]
在本发明的一个方面,pyy化合物包含与该pyy化合物的n末端的氨基酸残基中的α-氨基共价连接的取代基。在一个方面,在与hpyy(1-36)的位置1-3相对应的位置处的氨基酸残基不存在,并且n末端取代基共价连接至与hpyy(1-36)的位置4相对应的位置处的氨基酸残基。
[0065]
在一个方面,所述n末端取代基是烷酰基。在一个方面,所述n末端取代基是包含至多12个碳原子的烷酰基。在另一方面,所述n末端取代基是包含至多6个碳原子的烷酰基。在另一方面,所述n末端取代基选自3-甲基丁酰基或乙酰基。
[0066]
修饰基团
[0067]
在一个方面,所述pyy化合物包含修饰基团,该修饰基团共价连接至与hpyy(1-36)的位置7或10相对应的位置处的氨基酸残基。在一个进一步的方面,该取代基或修饰基团能够与蛋白质形成非共价缀合物,从而促进该衍生物随血流的循环,并且还具有延长该衍生物的作用时间的效果,这是由于pyy衍生物与白蛋白的缀合物仅通过肾脏清除缓慢地除去。因此,该取代基或修饰基团作为整体也可被称为延长部分。
[0068]
所述修饰基团可以通过酰化,即经由在修饰基团的羧酸基团与赖氨酸残基的ε氨基之间形成的酰胺键,共价连接至pyy肽的赖氨酸残基。赖氨酸的氨基也可以通过还原胺化与修饰基团的醛偶联。在另一方面,半胱氨酸的巯基可通过迈克尔加成偶联至修饰基团的
马来酰亚胺基基团,或通过亲核取代偶联至修饰基团的氯乙酰基或碘乙酰基。
[0069]
在一个方面,所述修饰基团通过酰化,即经由在修饰基团的羧酸基团与赖氨酸残基的ε氨基之间形成的酰胺键,共价连接至与hpyy(1-36)的位置7或10相对应的位置处的赖氨酸残基。
[0070]
在一些实施方案中,本发明组合物中包含的pyy化合物是这样的pyy衍生物:其选自wo2016/198682(实施例1)中的化合物1-63、65-71,或在本文实施方案中作为化合物1-63、65-71所包含,以及作为seq id no:3-28的肽骨架。
[0071]
递送剂
[0072]
在本发明组合物中使用的递送剂是n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,并且作为辅料包含在内。n-(8-(2-羟基苯甲酰基)氨基)辛酸根的结构式在式(i)中示出。
[0073][0074]
在一些实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐包含一个单价阳离子、两个单价阳离子或一个二价阳离子。在一些实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐选自n-(8-(2-羟基苯甲酰基)氨基)辛酸的钠盐、钾盐和/或钙盐。在一个实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐选自钠盐、钾盐和/或铵盐。在一个实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是钠盐或钾盐。在一个实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是钠盐或铵盐。n-(8-(2-羟基苯甲酰基)氨基)辛酸盐可以使用例如wo96/030036、wo00/046182、wo01/092206或wo2008/028859中所述的方法来制备。
[0075]
n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐可以是结晶的和/或无定形的。在一些实施方案中,递送剂包括n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐的无水物、一水合物、二水合物、三水合物、溶剂化物或三分之一水合物,及其组合。在一些实施方案中,递送剂是如wo2007/121318中所述的n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。
[0076]
在一些实施方案中,递送剂是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(在本文中称为“snac”),也称为8-(水杨酰基氨基)辛酸钠。
[0077]
与glp-1受体激动剂组合
[0078]
在一些实施方案中,本发明的组合物进一步包含与pyy化合物组合的glp-1受体激动剂。如本文所用的术语“glp-1受体激动剂”是指完全或部分激活人glp-1受体的化合物。术语glp-1受体激动剂以及本文描述的具体glp-1受体激动剂也意在涵盖其盐形式。
[0079]
因此,glp-1受体激动剂应表现出“glp-1活性”,glp-1活性是指该化合物(即glp-1类似物或包含glp-1类似物的化合物)与glp-1受体结合,并启动信号转导途径,从而导致促胰岛素作用或其他本领域已知的生理效应的能力。在一些实施方案中,如通过本领域已知的方法所测量的(参见例如wo 98/08871),“glp-1受体激动剂”例如以亲和常数(kd)结合glp-1受体,或以低于1μm,例如低于100nm的效力(ec
50
)激活该受体,并且表现出促胰岛素活性,其中促胰岛素活性可以通过本领域普通技术人员已知的体内或体外测定来测量。例如,可以将glp-1受体激动剂施用于血糖升高的动物(例如,使用静脉葡萄糖耐量试验(ivgtt)
获得的)。本领域技术人员将能够确定合适的葡萄糖剂量和合适的血液采样方案,例如,根据动物的物种,对于ivgtt,并随时间测量血浆胰岛素浓度。合适的测定已经在诸如wo2015/155151中描述。
[0080]
在一些实施方案中,所述glp-1受体激动剂是glp-1类似物,任选地包含一个取代基。如本文所用的术语“glp-1类似物”是指肽或化合物,其为人胰高血糖素样肽-1(glp-1(7-37))的变体。glp-1(7-37)具有序列haegtftsdv ssylegqaakefiawlvkgrg(seq id no:31)。glp-1(7-36)具有序列haegtftsdv ssylegqaakefiawlvkgr(seq id no:30)。在一些实施方案中,术语“变体”是指包含一个或多个氨基酸置换、缺失、添加和/或插入的化合物。
[0081]
在一个实施方案中,所述glp-1受体激动剂的c末端是酰胺。在一些实施方案中,所述glp-1受体激动剂是glp-1(7-37)酰胺或glp-1(7-36)酰胺。
[0082]
在一些实施方案中,所述glp-1受体激动剂包含取代基,其中该取代基是[2-(2-{2-[2-(2-{2-[(s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基氨基]乙氧基}乙氧基)乙酰基氨基]乙氧基}乙氧基)乙酰基]。在一些实施方案中,该取代基是[2-(2-{2-[2-(2-{2-[(s)-4-羧基-4-({反式-4-[(19-羧基十九碳酰基氨基)甲基]环己烷羰基}氨基)丁酰基氨基]乙氧基}乙氧基)乙酰基氨基]乙氧基}乙氧基)乙酰基]。
[0083]
在一些实施方案中,所述glp-1受体激动剂是司美格鲁肽,也称为n-ε26-[2-(2-{2-[2-(2-{2-[(s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基氨基]乙氧基}乙氧基)乙酰基氨基]乙氧基}乙氧基)乙酰基][aib8,arg34]glp-1(7-37)(seq id no:32),其可以如wo2006/097537的实施例4所述制备,并且具有以下结构:
[0084][0085]
在一个实施方案中,所述glp-1受体激动剂是“glp-1激动剂a”,其为二酰化[aib8,glu22,arg26,lys27,glu30,arg34,lys36]-glp-1-(7-37)-肽基-glu-gly(seq id no.33),如wo2012/140117的实施例31中所示,并被命名为n-ε27-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-[10-(4-羧基苯氧基)癸酰基氨基]丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]-乙酰基],n-ε36-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-[10-(4-羧基苯氧基)癸酰基氨基]-丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酰基]-[aib8,glu22,arg26,lys27,glu30,arg34,lys36]-glp-1-(7-37)-肽基-glu-gly,且具有以下结构:
[0086][0087]
如pct申请pct/ep2019/052487中所述,司美格鲁肽和glp-1激动剂a当在snac制剂中配制时,显示出是口服可利用的。
[0088]
通常,术语“glp-1受体激动剂”意在包括glp-1受体激动剂及其任何药学上可接受的盐、酰胺或酯。在一些实施方案中,所述组合物包含glp-1受体激动剂或其药学上可接受的盐、酰胺或酯。在一些实施方案中,该组合物包含glp-1受体激动剂和一种或多种药学上可接受的抗衡离子。
[0089]
在一些实施方案中,所述glp-1受体激动剂选自在wo93/19175、wo96/29342、wo98/08871、wo99/43707、wo99/43706、wo99/43341、wo99/43708、wo2005/027978、wo2005/058954、wo2005/058958、wo2006/005667、wo2006/037810、wo2006/037811、wo2006/097537、wo2006/097538、wo2008/023050、wo2009/030738、wo2009/030771和wo2009/030774中提及的一种或多种glp-1受体激动剂。
[0090]
组合物
[0091]
本发明的组合物或药物组合物是适合于通过口服途径施用的固体或干燥组合物,如下文进一步描述。
[0092]
在一些实施方案中,所述组合物包含至少一种药学上可接受的辅料。如本文所用的术语“辅料”宽泛地指除活性治疗成分或活性药物成分(api)外的任何组分。辅料可以是药学惰性物质、无活性物质和/或治疗上或医学上无活性的物质。
[0093]
辅料可用于多种目的,例如作为载体、媒介物、填充剂、粘合剂、润滑剂、助流剂、崩解剂、流动控制剂、结晶抑制剂、增溶剂、稳定剂、着色剂、调味剂、表面活性剂、乳化剂或其组合,并且/或者用于改善治疗活性物质或活性药物成分的给药和/或吸收。如本文所述,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是充当递送剂的辅料。所使用的每种辅料的量可以在本领域的常规范围内变化。可用于配制口服剂型的技术和辅料在以下文献中描述:handbook of pharmaceutical excipients,第8版,sheskey等人编,american pharmaceuticals association and the pharmaceutical press,publications department of the royal pharmaceutical society of great britain(2017);和remington:the science and practice of pharmacy,第22版,remington和allen编,pharmaceutical press(2013)。
[0094]
在一些实施方案中,辅料可以选自粘合剂,如聚乙烯吡咯烷酮(聚维酮)等;填充剂,如纤维素粉末、微晶纤维素、纤维素衍生物,例如羟甲基纤维素、羟乙基纤维素、羟丙基纤维素和羟丙基甲基纤维素,磷酸氢钙、玉米淀粉、预胶化淀粉等;润滑剂和/或助流剂,如硬脂酸、硬脂酸镁、硬脂酰富马酸钠、三山萮酸甘油酯等;流动控制剂,如胶体二氧化硅、滑石等;结晶抑制剂,如聚维酮等;增溶剂,如pluronic、聚维酮等;着色剂,包括染料和颜料,如氧化铁红或氧化铁黄、二氧化钛、滑石等;ph控制剂,如柠檬酸、酒石酸、富马酸、柠檬酸钠、磷酸氢钙、磷酸氢二钠等;表面活性剂和乳化剂,如pluronic、聚乙二醇、羧甲基纤维素钠、聚乙氧基化和氢化蓖麻油等;以及两种或更多种这些辅料和/或佐剂的混合物。
[0095]
所述组合物可以包含粘合剂,如聚维酮;淀粉;纤维素及其衍生物,如微晶纤维素,例如来自fmc(philadelphia,pa)的avicel ph、来自dow chemical corp.(midland,mi)的羟丙基纤维素、羟乙基纤维素和羟丙基甲基纤维素methocel;蔗糖;右旋糖;玉米糖浆;多糖;和明胶。粘合剂可以选自干法制粒粘合剂和/或湿法制粒粘合剂。合适的干法制粒粘合剂是,例如,纤维素粉末和微晶纤维素,如avicel ph 102和avicel ph 200。在一些实施方案中,该组合物包含avicel,如avicel ph 102。用于湿法制粒或干法制粒的合适的粘合剂
是玉米淀粉、聚乙烯吡咯烷酮(聚维酮)、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(共聚维酮)和纤维素衍生物,如羟甲基纤维素、羟乙基纤维素、羟丙基纤维素和羟丙基甲基纤维素。在一些实施方案中,该组合物包含聚维酮。
[0096]
在一些实施方案中,所述组合物包含填充剂,该填充剂可以选自乳糖、甘露糖醇、赤藓糖醇、蔗糖、山梨糖醇、磷酸钙如磷酸氢钙、微晶纤维素、粉状纤维素、糖果糖、可压缩糖、葡萄糖结合剂、糊精和右旋糖。在一些实施方案中,该组合物包含微晶纤维素,如avicel ph 101、avicel ph 102或avicel ph 200。
[0097]
在一些实施方案中,所述组合物包含润滑剂和/或助流剂。在一些实施方案中,该组合物包含润滑剂和/或助流剂,如滑石、硬脂酸镁、硬脂酸钙、硬脂酸锌、山萮酸甘油酯、二山萮酸甘油酯、山萮酰基聚氧乙烯-8甘油酯、聚环氧乙烷聚合物、月桂基硫酸钠、月桂基硫酸镁、油酸钠、硬脂酰富马酸钠、硬脂酸、氢化植物油、二氧化硅和/或聚乙二醇等。在一些实施方案中,该组合物包含硬脂酸镁或二山萮酸甘油酯(例如由山萮酸(c22)的单酯、二酯和三酯组成的产品888ato,其中二酯部分占优势)。
[0098]
在一些实施方案中,所述组合物包含崩解剂,如羟乙酸淀粉钠、波拉克林钾、羟乙酸淀粉钠、交聚维酮、交联羧甲纤维素、羧甲基纤维素钠或干燥的玉米淀粉。
[0099]
所述组合物可包含一种或多种表面活性剂,例如一种表面活性剂、至少一种表面活性剂或两种不同的表面活性剂。术语“表面活性剂”是指由水溶性(亲水性)部分与脂溶性(亲脂性)部分组成的任何分子或离子。该表面活性剂例如可选自阴离子型表面活性剂、阳离子型表面活性剂、非离子型表面活性剂和/或两性离子表面活性剂。
[0100]
如本文的实施例所示,本发明的组合物具有极高含量的递送剂。这种极高的含量可以相对于还包含活性药物成分(即,任选地与glp-1受体激动剂组合的pyy化合物)的片剂的全部含量或相对于不包括活性药物成分的辅料的总含量来定义。下文中的描述还涉及由特定成分——pyy化合物、辅料和可选的glp-1受体激动剂——组成的组合物,术语“组成”应理解为可包含痕量的对组合物的功能没有影响的任何物质,也可以称为基本由...组成。这类物质可能是在任选地由glp-1受体激动剂制备pyy化合物时或在生产nac盐时残留的杂质,或最少量(低于1%)的不影响制剂质量或吸收的任何药学上可接受的辅料。
[0101]
在一个实施方案中,所述药物组合物包含
[0102]
a)pyy化合物,和
[0103]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占所述组合物的至少或高于60%(w/w)。
[0104]
在其他这样的实施方案中,所述nac的盐占所述组合物的70%(w/w)以上,如75%(w/w)以上,如80%(w/w)以上,如85%(w/w)以上,如90%(w/w)以上。
[0105]
在其他这样的实施方案中,所述nac的盐占所述组合物的至少70%(w/w),如至少75%(w/w),如至少80%(w/w),如至少85%(w/w),如至少90%(w/w)。
[0106]
在一个实施方案中,所述药物组合物包含
[0107]
a)pyy化合物,和
[0108]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,
[0109]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占所述组合物的辅料的至少90%(w/w)。
[0110]
在其他这样的实施方案中,所述nac的盐占所述组合物的辅料的至少91%(w/w),如至少92%(w/w),如至少93%(w/w),如至少94%(w/w),如至少95%(w/w)。
[0111]
在一个实施方案中,所述药物组合物由以下成分组成
[0112]
c)pyy化合物,和
[0113]
d)n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,
[0114]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占所述组合物的辅料的至少90%(w/w)。
[0115]
在其他这样的实施方案中,所述nac的盐占所述组合物的辅料的至少91%(w/w),如至少92%(w/w),如至少93%(w/w),如至少94%(w/w),如至少95%(w/w)。
[0116]
在一个实施方案中,所述药物组合物由以下成分组成
[0117]
a)pyy化合物;
[0118]
b)辅料,其中所述辅料是
[0119]
i.n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,和
[0120]
ii.一种或多种其他辅料,以及
[0121]
c)可选的glp-1受体激动剂;
[0122]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占所述组合物的辅料的至少90%(w/w)。
[0123]
在其他这样的实施方案中,所述nac的盐占所述组合物的辅料的至少91%(w/w),如至少92%(w/w),如至少93%(w/w),如至少94%(w/w),如至少95%(w/w)。
[0124]
在一个实施方案中,所述药物组合物由以下成分组成
[0125]
a)pyy化合物,和
[0126]
b)glp-1受体激动剂,以及
[0127]
c)辅料,其中所述辅料是
[0128]
i.n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,和
[0129]
ii.一种或多种其他辅料
[0130]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占所述组合物的辅料的至少90%(w/w)。
[0131]
在其他这样的实施方案中,所述nac的盐占所述组合物的辅料的至少91%(w/w),如至少92%(w/w),如至少93%(w/w),如至少94%(w/w),如至少95%(w/w)。
[0132]
在一个实施方案中,所述药物组合物包含
[0133]
a)pyy化合物,和
[0134]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0135]
在一个实施方案中,所述药物组合物由以下成分组成
[0136]
c)pyy化合物,和
[0137]
d)n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0138]
在一个实施方案中,所述药物组合物由以下成分组成
[0139]
a)pyy化合物,和
[0140]
b)可选的glp-1受体激动剂,以及
[0141]
c)辅料,其中所述辅料是
[0142]
i.n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,和
[0143]
ii.一种或多种其他辅料,以及
[0144]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0145]
在其他这样的实施方案中,所述nac的盐占所述组合物的60%(w/w)以上,如70%(w/w)以上,如75%(w/w)以上,如80%(w/w),或者如90%(w/w)以上。
[0146]
在其他这样的实施方案中,所述nac的盐占所述组合物的辅料的至少95%(w/w),如至少96%(w/w),如至少97%(w/w),如者如至少98%(w/w)。
[0147]
在一个实施方案中,所述药物组合物由以下成分组成
[0148]
a)pyy化合物,和
[0149]
b)glp-1受体激动剂,以及
[0150]
c)辅料,其中所述辅料是
[0151]
i.n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,和
[0152]
ii.一种或多种其他辅料
[0153]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0154]
在其他这样的实施方案中,所述nac的盐占所述组合物的60%(w/w)以上,如70%(w/w)以上,如75%(w/w)以上,如80%(w/w)以上,或者如90%(w/w)以上。
[0155]
在其他这样的实施方案中,所述nac的盐占所述组合物的辅料的至少95%(w/w),如至少96%(w/w),如至少97%(w/w),如者如至少98%(w/w)。
[0156]
如上所述,除了递送剂以外,辅料的含量根据本发明优选为最小。在一个实施方案中,所述药物组合物包含至少一种润滑剂。
[0157]
在一个实施方案中,所述药物组合物包含以下成分或由以下成分组成:
[0158]
a)pyy化合物,
[0159]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,和
[0160]
c)至少一种润滑剂。
[0161]
在这样的实施方案中,所述润滑剂可以是硬脂酸镁或二山萮酸甘油酯。在一个实施方案中,该润滑剂是硬脂酸镁。在一个实施方案中,该润滑剂是二山萮酸甘油酯。
[0162]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)盐占组合物辅料的至少90%(w/w)如至少95%(w/w)的上述组合物可以进一步是这样的组合物,其中所述盐占该组合物的至少或高于60%(w/w)。
[0163]
同样,其中所述盐占组合物的至少或高于60%(w/w)的上述组合物可以进一步是这样的组合物,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占该组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0164]
在一个实施方案中,所述药物组合物包含以下成分或由以下成分组成:
[0165]
a)pyy化合物,
[0166]
b)glp-1受体激动剂,
[0167]
c)n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,和
[0168]
d)至少一种润滑剂。
[0169]
在这样的实施方案中,所述润滑剂可以是硬脂酸镁或二山萮酸甘油酯。在一个实施方案中,该润滑剂是硬脂酸镁。在一个实施方案中,该润滑剂是二山萮酸甘油酯。
[0170]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)盐占组合物辅料的至少90%(w/w)如至少95%(w/w)的上述组合物可以进一步是这样的组合物,其中所述盐占该组合物的至少或高于60%(w/w)。
[0171]
同样,其中所述盐占组合物的至少或高于60%(w/w)的上述组合物可以进一步是这样的组合物,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐占该组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0172]
所述药物组合物可以进一步是这样的组合物,其中n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐选自n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的钠盐、钾盐和/或钙盐,或者就选自该钠盐和钾盐。在一个实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠。
[0173]
在其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)盐占组合物辅料的至少90%(w/w)的实施方案中,任何其他辅料占辅料的至多10%(w/w),即任何这样的粘合剂、填充剂和/或润滑剂/助流剂占组合物辅料重量的至多10%(w/w)。在一些实施方案中,该组合物的辅料包含至少或高于90%(w/w)的递送剂,和少于5%(w/w)的任何其他辅料,如粘合剂、填充剂和/或润滑剂/助流剂。在一个实施方案中,该组合物的辅料包含至少90%(w/w)的递送剂和少于5%(w/w)的润滑剂。在一个实施方案中,该组合物的辅料包含至少90%(w/w)的递送剂和少于3%(w/w)的润滑剂。
[0174]
在一些实施方案中,所述组合物的辅料包含至少或高于90%(w/w)的递送剂,和0.1-5%(w/w),如0.5-4%(w/w)或1-3%(w/w)的润滑剂。在其他这样的实施方案中,该组合物的辅料包含2-2.5%(w/w)的润滑剂。在其他这样的实施方案中,该组合物的辅料包含1-5%(w/w)的润滑剂。在其他这样的实施方案中,该组合物的辅料包含1-4%(w/w)的润滑剂。在其他这样的实施方案中,该组合物的辅料包含1-3%(w/w)的润滑剂。在其他这样的实施方案中,该组合物的辅料包含1-2.5%(w/w)的润滑剂。在其他这样的实施方案中,该组合物的辅料包含2-3%(w/w)的润滑剂。在其他这样的实施方案中,该组合物的辅料包含2-4%(w/w)的润滑剂。在其他这样的实施方案中,该组合物的辅料包含2-5%(w/w)的润滑剂。在其他这样的实施方案中,该组合物的辅料包含2.5%(w/w)的润滑剂。
[0175]
在其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)盐占组合物辅料的至少95%(w/w)的实施方案中,该组合物的任何其他辅料占辅料的至多5%(w/w),即任何这样的粘合剂、填充剂和/或润滑剂/助流剂占组合物辅料重量的至多5%(w/w)。在一些实施方案中,该组合物的辅料包含至少95%(w/w)的递送剂和少于5%(w/w)的润滑剂。在一个实施方案中,该组合物的辅料包含至少95%(w/w)的递送剂和少于3%(w/w)的润滑剂。
[0176]
在一些实施方案中,所述组合物的辅料包含至少95%(w/w)的递送剂,和0.1-5%(w/w),如0.5-4%(w/w)或1-3%(w/w)的润滑剂。在其他这样的实施方案中,该组合物的辅料包含2-2.5%(w/w)的润滑剂。
[0177]
如下文所述,根据本发明的药物组合物优选以适合于口服给药的剂型生产。在下
45mg,如20、30或40mg,或如25、35或45mg,或如30-50mg,或如20-40mg的pyy化合物。
[0192]
pyy化合物的量可以根据pyy化合物的身份、期望的效果和适应症而变化。
[0193]
在一些实施方案中,所述药物组合物除了pyy化合物之外还包含glp-1受体激动剂。在一些实施方案中,本发明药物组合物的剂量单位包含0.1-100mg或0.2-100mg的glp-1受体激动剂。在一些实施方案中,该组合物的剂量单位包含的glp-1受体激动剂的量在0.2至50mg或1至40mg的范围内。在一些实施方案中,剂量单位包含0.5-5mg的glp-1受体激动剂,如每个剂量单位0.75-4.5mg,如1、1.5、2、2.5或3mg或3.5、4、4.5mg,如1-3或3-5mg的glp-1受体激动剂。在一些实施方案中,剂量单位包含2至20mg的glp-1受体激动剂,如每个剂量单位2-15mg,如2、3、4、5、6或7mg,如2、3、4或5mg,或如8、10、12或14mg,如15mg或如20mg的glp-1受体激动剂。在一些实施方案中,剂量单位包含5至50mg的glp-1受体激动剂,如每个剂量单位10-45mg,如20、30或40mg,或如25、35或45mg,或如30-50mg,或如20-40mg的glp-1受体激动剂。glp-1受体激动剂的量可以根据glp-1受体激动剂的身份、期望的效果和适应症而变化,例如与糖尿病相比,治疗肥胖症可能需要更高的含量。
[0194]
在优选实施方案中,所述组合物的单位剂量包含0.5-25mg硬脂酸镁,如1-10mg,如2-8mg或如2-5mg硬脂酸镁。
[0195]
在优选实施方案中,相对于nac的盐如snac的量确定硬脂酸镁的量,使得组合物的单位剂量包含1-8mg硬脂酸镁或如2-5mg硬脂酸镁或2-3mg硬脂酸镁/100mg n-(8-(2-羟基苯甲酰基)氨基)辛酸盐如snac。
[0196]
在优选实施方案中,该组合物的单位剂量包含80-120mg snac、0.5-5mg pyy化合物和2-3mg润滑剂。
[0197]
在优选实施方案中,该组合物的单位剂量包含80-120mg snac、1.5-10mg pyy化合物和2-3mg润滑剂。
[0198]
在优选实施方案中,该组合物的单位剂量包含80-120mg snac、5-50mg pyy化合物和2-3mg润滑剂。
[0199]
在优选实施方案中,该组合物的单位剂量包含250-350mg snac、0.5-5mg化合物和3-10mg润滑剂。
[0200]
在优选实施方案中,该组合物的单位剂量包含250-350mg snac、1.5-10mg pyy化合物和3-10mg润滑剂。
[0201]
在优选实施方案中,该组合物的单位剂量包含250-350mg snac、5-50mg pyy化合物和3-10mg润滑剂。
[0202]
在优选实施方案中,该组合物的单位剂量包含80-120mg snac、0.5-5mg pyy化合物、0.5-5mg glp-受体激动剂和2-3mg润滑剂。
[0203]
在优选实施方案中,该组合物的单位剂量包含80-120mg snac、1.5-10mg pyy化合物、1.5-10mg glp-受体激动剂和2-3mg润滑剂。
[0204]
在优选实施方案中,该组合物的单位剂量包含80-120mg snac、5-50mg pyy化合物、5-50mg glp-受体激动剂和2-3mg润滑剂。
[0205]
在优选实施方案中,该组合物的单位剂量包含250-350mg snac、0.5-5mg化合物、0.5-5mg glp-受体激动剂和3-10mg润滑剂。
[0206]
在优选实施方案中,该组合物的单位剂量包含250-350mg snac、1.5-10mg pyy化
合物、1.5-10mg glp-受体激动剂和3-10mg润滑剂。
[0207]
在优选实施方案中,该组合物的单位剂量包含250-350mg snac、5-50mg pyy化合物、5-50mg glp-受体激动剂和3-10mg润滑剂。
[0208]
在一个实施方案中,本发明的药物组合物在体外具有快速崩解或溶出。崩解或溶出可以如本领域已知的那样并且如本文试验i或试验ii所述进行检测。
[0209]
溶出或释放可以表示为相对于组合物的pyy化合物的总含量,在给定时间段后在溶液中测得的pyy化合物的量。相对量可以以百分比给出。在一个实施方案中,pyy化合物从本发明药物组合物中的释放在15分钟内为至少85%或在30分钟内为至少95%。在一个这样的实施方案中,释放在ph 6.8下测量。
[0210]
在一个实施方案中,所述药物组合物包含
[0211]
a)pyy化合物,和
[0212]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0213]
其中所述pyy化合物的释放在15分钟内达到85%,或者在30分钟内达到95%。在一个实施方案中,释放在ph 6.8下测量。
[0214]
实验已经证明,包含pyy化合物/snac的本发明组合物在崩解和溶出方面的表现类似于司美格鲁肽/snac组合物(本文的实施例2和3)。另外,本发明的组合物通过口服给药在体内是生物可利用的(本文实施例4)。与根据wo 2012/080471和wo 2013/139694制备的pyy化合物/snac组合物相比,使用根据本发明的组合物改善的pyy化合物的血浆暴露,可以使用本文的试验iv来证明,类似于先前针对司美格鲁肽和其他glp-1受体激动剂所观察到的(pct/ep2019/052487)。
[0215]
在一个实施方案中,本发明的药物组合物在体内提供早期暴露。在一个实施方案中,本发明的药物组合物在体内提供pyy化合物的增加的暴露。在一个实施方案中,本发明的药物组合物在体内提供增加的早期暴露。可以在相关模型,如本文所述的试验iv中测试这种体内暴露。还可以在预定时间段内测量暴露,并计算累积剂量校正的暴露(auc),例如对于t=0-30分钟。
[0216]
在一个实施方案中,本发明涉及药物组合物,其中相对于如wo2013/139694所述用pyy化合物代替glp-1激动剂制备的pyy化合物组合物,t=30min时剂量校正的暴露增加。或者,参考物可以是本文所述的测试组合物1。
[0217]
在一个实施方案中,所述药物组合物包含
[0218]
a)pyy化合物,和
[0219]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0220]
其中t=30min时剂量校正的暴露相对于制备为wo2013/139694的f型的pyy化合物组合物增加。
[0221]
在一个实施方案中,所述药物组合物包含
[0222]
a)pyy化合物,和
[0223]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0224]
其中t=0-30min的剂量校正的暴露(auc)相对于制备为wo2013/139694的f型的pyy化合物组合物增加。
[0225]
在一个实施方案中,与制备为wo2013/139694的f型的pyy化合物组合物相比,t=
0-30min的剂量校正的暴露(auc)增加至少1.2倍,如1.5倍,如2倍。
[0226]
在一个实施方案中,所述药物组合物包含
[0227]
c)pyy化合物,和
[0228]
d)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0229]
其中t=30min时剂量校正的暴露相对于本文所述的测试组合物1增加。
[0230]
在一个实施方案中,所述药物组合物包含
[0231]
c)pyy化合物,和
[0232]
d)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0233]
其中t=0-30min的剂量校正的暴露(auc)相对于本文所述的测试组合物1增加。
[0234]
在一个实施方案中,与本文所述的测试组合物1相比,t=0-30min的剂量校正的暴露(auc)增加至少1.2倍,如1.5倍,如2倍。
[0235]
剂型
[0236]
所述组合物可以以几种剂型施用,例如以片剂、包衣片剂、囊剂或胶囊如硬壳或软壳明胶胶囊施用,并且所有这类组合物均被认为是固体口服剂型。
[0237]
例如,为了改善稳定性和/或溶解性或进一步改善生物利用度,可将组合物进一步复合在药物载体或药物递送系统中。该组合物可以是冷冻干燥或喷雾干燥的组合物。
[0238]
所述组合物可以是剂量单位的形式,如片剂。在一些实施方案中,单位剂量的重量在50mg至1000mg的范围内,如50-750mg的范围内,或如100-500mg的范围内。在一些实施方案中,剂量单位的重量在75mg至350mg的范围内,如100-300mg的范围内,或如200-350mg的范围内。在一些实施方案中,剂量单位的重量在100mg至400mg的范围内,如50-300mg的范围内,或如200-400mg的范围内。
[0239]
在一些实施方案中,可以在压实,例如压缩成片剂之前使组合物粒化。该组合物可包含颗粒内部分和/或颗粒外部分,其中颗粒内部分已经被粒化,并且颗粒外部分已经在粒化之后添加。在一些实施方案中,该组合物可包含一个或多个颗粒内部分和/或颗粒外部分,其中所述一个或多个颗粒内部分已经被粒化,并且颗粒外部分已经在粒化之后添加。
[0240]
颗粒内部分可包含pyy化合物、递送剂和/或辅料,如润滑剂和/或助流剂。在一些实施方案中,颗粒内部分包含递送剂和润滑剂和/或助流剂以及可选的glp-1受体激动剂。在一些实施方案中,所述组合物可包含pyy化合物和glp-1受体激动剂两者。在一个这样的实施方案中,所述组合物可以由一个包含pyy化合物、glp-1受体激动剂、递送剂和润滑剂和/或助流剂的颗粒内部分制成。另外或备选地,在一个实施方案中,所述组合物可以通过混合两个颗粒内部分来制备:i)一个包含pyy化合物、递送剂和润滑剂和/或助流剂的颗粒内部分,和ii)另一个包含glp-1受体激动剂、递送剂和润滑剂和/或助流剂的颗粒内部分。
[0241]
在一些实施方案中,颗粒外部分包含pyy化合物,和/或润滑剂和/或助流剂,如硬脂酸镁,以及可选的glp-1受体激动剂。在一些实施方案中,颗粒外部分包含pyy化合物和可选的glp-1受体激动剂。在一些实施方案中,颗粒外部分包含辅料,如润滑剂和/或助流剂,如硬脂酸镁。
[0242]
在进一步的实施方案中,颗粒内部分包含pyy化合物、递送剂和润滑剂和/或助流剂。在这样的实施方案中,可以将颗粒直接压缩成片剂,并且该片剂不具有颗粒外部分。
[0243]
组合物的制备
[0244]
根据本发明的组合物的制备可以按照本领域已知的方法进行。
[0245]
为了制备压片材料的干掺合物,对各种组分任选地进行消除结块(delumped)或过筛,称重,然后合并。组分的混合可以进行到获得均匀的掺合物。
[0246]
术语“颗粒”和“颗粒物”在本文中可互换使用,是指可如上所述制备的组合物材料的颗粒。该术语宽泛地指用于制备固体剂量制剂的颗粒、微粒和聚集体形式的药物成分。通常,颗粒如下获得:加工粉末或掺合物以获得固体,随后将其分解以获得所需大小的颗粒。
[0247]
如果要在压片材料中使用颗粒,则可以以本领域技术人员已知的方式来生产颗粒,例如使用已知用于生产“组合”颗粒或“分离”颗粒的湿法制粒方法。形成组合颗粒的方法可以连续运行,并且包括例如同时用造粒溶液喷洒造粒物料并干燥,例如在鼓式造粒机中,在盘式造粒机中,在圆盘造粒机中,在流化床中,通过喷雾干燥、喷雾粒化或喷雾固化,或者可以不连续运行,例如在流化床中,在旋转式流化床中,在间歇式混合器如高剪切混合器或低剪切混合器中,或在喷雾干燥鼓中。生产分离颗粒的方法可以不连续地进行,其中造粒物料首先与造粒溶液形成湿聚集体,随后将其粉碎或通过其他手段形成所需大小的颗粒,然后可以将颗粒干燥。用于湿法制粒步骤的合适的设备是行星式混合器、低剪切混合器、高剪切混合器、挤出机和滚圆机,如来自loedige、glatt、diosna、fielder、collette、aeschbach、alexanderwerk、ytron、wyss&probst、werner&pfleiderer、hkd、loser、fuji、nica、caleva和gabler公司的设备。也可以通过干法制粒技术形成颗粒,其中将一种或多种辅料和/或活性药物成分压缩以形成相对较大的模制品,例如条状物或带状物,通过研磨将其粉碎,并将研磨的材料用作压片材料,随后压实。用于干法制粒的合适的设备是但不限于来自gerteis的辊压设备,如gerteis micro-pactor、mini-pactor和macro-pactor。
[0248]
为了将压片材料压实成固体口服剂型,例如片剂,可以使用压片机。在压片机中,将压片材料填充(例如压力进料或重力进料)到模具腔中。然后用施加压力的一组冲头将压片材料压实。随后,从压片机中排出所得到的压缩物(compact)或片剂。上述压片过程在本文中随后被称为“压实过程”。合适的压片机包括但不限于旋转式压片机和偏心式压片机。压片机的实例包括但不限于fette 102i(fette gmbh)、korsch xl100、korsch ph 106旋转式压片机(korsch ag,德国)、korsch ek-o偏心式压片机(korsch ag,德国)、romaco kilian styl’one evo压片机和manesty f-press(manesty machines ltd.,英国)。
[0249]
通常,颗粒可以通过湿法、熔融或干法制粒,优选通过干法制粒来制备。i、ii和/或iii和/或可选的iv的颗粒因此可以通过对其掺合物进行干法制粒,例如通过辊压而获得。另外或备选地,在一个实施方案中,可以使用湿法制粒来获得颗粒。这种材料然后可以直接使用,或者进一步精制以获得最终颗粒。
[0250]
在一个实施方案中,所述组合物包含至少一种颗粒。在一个实施方案中,该组合物包含一种类型的颗粒。或者,该组合物可以包含两种类型的颗粒。
[0251]
在一个实施方案中,本发明涉及组合物,其包含
[0252]
i.pyy化合物,
[0253]
ii.n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,和
[0254]
iii.润滑剂
[0255]
其中所述组合物包含ii和可选的iii的颗粒。在进一步的实施方案中,颗粒部分可包含i和ii以及可选的iii。
[0256]
在一个实施方案中,本发明涉及组合物,其包含
[0257]
i.pyy化合物,
[0258]
ii.n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,
[0259]
iii.润滑剂,和
[0260]
iv.glp-1受体激动剂
[0261]
其中所述组合物包含ii和可选的iii的颗粒。在进一步的实施方案中,颗粒部分可包含i、ii和iv以及可选的iii。
[0262]
在一个实施方案中,本发明涉及组合物,其包含
[0263]
i.pyy化合物,
[0264]
ii.n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,
[0265]
iii.润滑剂,和
[0266]
iv.glp-1受体激动剂
[0267]
其中所述组合物包含两种颗粒:i和ii以及可选的iii的第一颗粒,以及iv、ii和可选的iii的第二颗粒。
[0268]
可以通过上述各种方法实现制粒,其中i、ii和/或iii和/或可选的iv首先以粉末形式混合或通过制备包含这些成分的溶液进行混合。
[0269]
在一些实施方案中,片剂的制备方法包括:a)将包含递送剂和可选的润滑剂的混合物粒化;b)将a)的颗粒与pyy化合物和可选的其他润滑剂掺混,然后c)将b)的掺合物压缩成片剂。
[0270]
在一个实施方案中,片剂的制备方法包括:a)将包含递送剂和可选的润滑剂的混合物粒化;b)将a)的颗粒与pyy化合物和glp-1受体激动剂以及可选的其他润滑剂掺混,然后c)将b)的掺合物压缩成片剂。
[0271]
在一些实施方案中,片剂的制备方法包括:a)将包含递送剂、pyy化合物和可选的润滑剂的混合物粒化,以及b)将a)的颗粒压缩成片剂,并任选地包含其他润滑剂。在一些实施方案中,片剂的制备方法包括:a)将包含递送剂、pyy化合物、glp-1受体激动剂和可选的润滑剂的混合物粒化,以及b)将a)的颗粒压缩成片剂,并任选地包含其他润滑剂。在一些实施方案中,片剂的制备方法包括:a)将包含递送剂、pyy化合物和可选的润滑剂的第一混合物粒化;b)将包含递送剂、glp-1受体激动剂和可选的润滑剂的第二混合物粒化;以及c)将a)和b)的颗粒混合,并将a)和b)的颗粒的混合物压缩成片剂,并且任选地包含另外的润滑剂。
[0272]
为了获得均质的产品,可以在最终干法制粒步骤/辊压或压片步骤之前包括一个或多个筛分步骤。
[0273]
最后,可以添加额外的辅料,如润滑剂,之后进行压片,从而形成颗粒外部分。
[0274]
药物适应症
[0275]
本发明还涉及用作药物的本发明组合物。在一些实施方案中,本发明的组合物可用于以下医学治疗,这些医学治疗全部优选地总是与糖尿病和/或肥胖症有关:
[0276]
(i)预防和/或治疗所有形式的糖尿病,如高血糖症、2型糖尿病、糖耐量减低、1型糖尿病、非胰岛素依赖性糖尿病、mody(青年成熟发作型糖尿病)、妊娠糖尿病,和/或用于减少hba1c;
[0277]
(ii)延缓或预防糖尿病进展,如2型糖尿病的进展,延缓糖耐量减低(igt)进展成需要胰岛素的2型糖尿病,延缓或预防胰岛素抵抗,和/或延缓无需胰岛素的2型糖尿病进展成需要胰岛素的2型糖尿病;
[0278]
(iii)改善β-细胞功能,如减少β-细胞凋亡、提高β-细胞功能和/或β-细胞质量,和/或恢复β-细胞的葡萄糖敏感性;
[0279]
(iv)例如通过减少食物摄入量、降低体重、抑制食欲、诱导饱腹感来预防和/或治疗饮食失调,如肥胖症;治疗或预防暴食症、神经性贪食症和/或由抗精神病药或类固醇给药诱发的肥胖症;减少胃运动;延缓胃排空;增加身体活动;和/或预防和/或治疗肥胖症的共病,如骨关节炎和/或尿失禁;
[0280]
(v)预防和/或治疗糖尿病并发症,如血管病;神经病,包括周围神经病变;肾病;和/或视网膜病变;
[0281]
(vi)改善脂质参数,如预防和/或治疗血脂异常、降低总血清脂质;增加hdl;降低小而致密的ldl;降低vldl;降低甘油三酯;降低胆固醇;降低人的脂蛋白a(lp(a))的血浆水平;在体外和/或体内抑制载脂蛋白a(apo(a))的生成;
[0282]
(vii)预防和/或治疗心血管疾病;
[0283]
(viii)预防和/或治疗肝脏病症,如肝脂肪变性、非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)、肝脏炎症或脂肪肝;
[0284]
(ix)预防和/或治疗睡眠呼吸暂停;和/或
[0285]
(x)成功减肥(无论是药物引起的还是饮食和运动引起的)后的体重维持——即,防止成功减肥后的体重增加。
[0286]
特别优选以下适应症:2型糖尿病和/或肥胖症。
[0287]
治疗方法
[0288]
本发明进一步涉及治疗有需要的受试者的方法,其包括向所述受试者施用治疗有效量的根据本发明的组合物。在一个实施方案中,该治疗方法用于治疗糖尿病或肥胖症和/或以上指定的其他适应症。
[0289]
在一些实施方案中,描述了治疗肥胖症的方法,该方法包括向有需要的受试者施用治疗有效量的包含pyy化合物、n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐和可选的润滑剂的药物组合物。在一些实施方案中,描述了治疗肥胖症的方法,该方法包括向有需要的受试者施用治疗有效量的包含pyy化合物、n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐、可选的润滑剂和可选的glp-1受体激动剂的药物组合物。
[0290]
在一些实施方案中,描述了治疗肥胖症的方法,该方法包括向有需要的受试者施用治疗有效量的药物组合物,该药物组合物包含
[0291]
0.5-100mg pyy化合物,
[0292]
25-600mg n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,
[0293]
1-10mg如本文所述的润滑剂。
[0294]
在一些实施方案中,描述了治疗肥胖症的方法,该方法包括向有需要的受试者施用治疗有效量的药物组合物,该药物组合物包含
[0295]
0.5-100mg pyy化合物,
[0296]
25-600mg n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐,
[0297]
1-10mg润滑剂,和
[0298]
0.5-50mg如本文所述的glp-1受体激动剂。
[0299]
在优选实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占组合物的辅料的至少90%(w/w)。在优选实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占组合物的辅料的至少95%(w/w)。
[0300]
在替代实施方案中,描述了治疗肥胖症的方法,该方法包括向有需要的受试者施用治疗有效量的包含约1-30mg pyy化合物、约100-300mg n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐、约2-8mg硬脂酸镁和可选的约1-20mg glp-1受体激动剂的药物组合物。
[0301]
在一些实施方案中,所述pyy化合物选自如本文和wo2016/198682中公开的化合物1-63、65-71(化合物1-63、65-71,实施例1)。在一些实施方案中,所述pyy化合物选自化合物4(n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]hpyy(4-36))、化合物20(n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,gln18,ile24,tyr28,trp30,leu31]hpyy(4-36))和化合物32(n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,gln18,ile22,tyr28,trp30,leu31]hpyy(4-36))。
[0302]
在一些实施方案中,所述glp-1激动剂是通式为n-ε26-[2-(2-{2-[2-(2-{2-[(s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基氨基]乙氧基}乙氧基)乙酰基氨基]乙氧基}乙氧基)乙酰基][aib8,arg34]glp-1(7-37)的司美格鲁肽,并且n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac)。描述了润滑剂的各种实例,包括硬脂酸镁。所述组合物经口服施用,并且是片剂、胶囊或囊剂的形式。
[0303]
在另一个这样的实施方案中,一个或多个剂量单位可以施用于所述有需要的受试者。
[0304]
实施方案
[0305]
通过以下本发明的非限制性实施方案进一步描述本发明:
[0306]
1.药物组合物,其包含
[0307]
a)pyy化合物,和
[0308]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0309]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的至少60%(w/w)。
[0310]
2.药物组合物,其包含
[0311]
a)pyy化合物,和
[0312]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0313]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0314]
3.药物组合物,其包含
[0315]
a)pyy化合物,和
[0316]
b)辅料,其中所述辅料是
[0317]
i.n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,和
[0318]
ii.一种或多种其他辅料
[0319]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0320]
4.根据实施方案1-3中任一项所述的药物组合物,其中所述组合物进一步包含至少一种润滑剂。
[0321]
5.根据实施方案1-4中任一项所述的药物组合物,其中所述组合物进一步包含glp-1受体激动剂。
[0322]
6.药物组合物,其包含:
[0323]
a)pyy化合物,
[0324]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,和
[0325]
c)至少一种润滑剂。
[0326]
7.根据实施方案6所述的药物组合物,其由以下成分组成:
[0327]
a)pyy化合物,
[0328]
b)glp-1受体激动剂,
[0329]
c)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,和
[0330]
d)至少一种润滑剂。
[0331]
8.根据实施方案4-7中任一项所述的药物组合物,其中所述润滑剂是硬脂酸镁。
[0332]
9.根据前述实施方案中任一项所述的药物组合物,其中所述组合物包含1-8mg,如2-5mg,或如2-3mg硬脂酸镁/100mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。
[0333]
10.根据前述实施方案中任一项所述的药物组合物,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的至少60%(w/w)。
[0334]
11.根据前述实施方案中任一项所述的药物组合物,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少95%(w/w)。
[0335]
12.根据前述实施方案中任一项所述的药物组合物,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐选自n-(8-(2-羟基苯甲酰基)氨基)辛酸的钠盐、钾盐和/或钙盐。
[0336]
13.根据前述实施方案中任一项所述的药物组合物,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac)。
[0337]
14.根据前述实施方案中任一项所述的药物组合物,其中剂量单位包含至多1000mg所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。
[0338]
15.根据前述实施方案中任一项所述的药物组合物,其中剂量单位包含0.5-100mg所述pyy化合物。
[0339]
16.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物是pyy类似物。
[0340]
17.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物是pyy衍生物。
[0341]
18.根据前述实施方案中任一项所述的组合物,其中所述pyy化合物选自wo2016/198682的化合物1-63、65-71。
[0342]
19.根据实施方案17-18所述的药物组合物,其中所述pyy衍生物包括脂肪酸或脂肪二酸。
[0343]
20.根据实施方案17-19中任一项所述的药物组合物,其中所述pyy衍生物包含c16、c18或c20脂肪酸或者c16、c18或c20脂肪二酸。
[0344]
21.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物是包含连接至所述pyy化合物的骨架上的修饰基团的pyy衍生物,其中所述修饰基团由a-[b]
r-c-或a-[b]
r-c-[b]w定义,其中
[0345]
a-选自化学式1和化学式2
[0346]
化学式1:hooc-(ch2)
p-co-*,
[0347]
化学式2:ho3s-(ch2)
q-co-*
[0348]
其中p为14-18范围内的整数,且q为15-17范围内的整数;
[0349]
b-为化学式3
[0350]
化学式3:*[nh-ch(cooh)-(ch2)
2-co-]-*,
[0351]
r为1-3范围内的整数;
[0352]
w为1-3范围内的整数;并且
[0353]
c-不存在或选自化学式4和化学式5
[0354]
化学式4:*[nh-(ch2)
2-[o-(ch2)2]
s-o-(ch2)
t-co-]
u-*
[0355]
化学式5:*[nh-(ch2)
v-co-]
x-*
[0356]
其中s为1-3范围内的整数,t为1-3范围内的整数,u为1-4范围内的整数,v为3-7范围内的整数,且x为1-3范围内的整数;
[0357]
其中*表示连接点,并且其中a、b和c经由酰胺键且以所指示的顺序经由所述连接点相互连接;或所述pyy化合物的药学上可接受的盐、酰胺或酯;并且其中如果所述修饰基团为a-b-c-b,则c不能不存在。
[0358]
22.根据实施方案21所述的药物组合物,其中所述修饰基团由a-[b]
r-c-定义,其中
[0359]
a-为化学式1
[0360]
化学式1:hooc-(ch2)
p-co-*,
[0361]
其中p为16;
[0362]
b-为化学式3
[0363]
化学式3:*[nh-ch(cooh)-(ch2)
2-co-]-*,
[0364]
r为1;且
[0365]
c-为化学式5
[0366]
化学式5:*[nh-(ch2)
v-co-]
x-*
[0367]
其中v为5且x为1。
[0368]
23.根据实施方案21-22中任一项所述的药物组合物,其中所述修饰基团在与hpyy(1-36)的位置7或10相对应的位置处连接至所述pyy化合物的骨架。
[0369]
24.根据前述实施方案中任一项所述的组合物,其中所述pyy化合物是与hpyy(3-36)相比具有最多10个氨基酸修饰的pyy衍生物,其中所述pyy衍生物包含
[0370]
a)在与hpyy(1-36)的位置7或10相对应的位置处的赖氨酸;
[0371]
b)在与hpyy(1-36)的位置30相对应的位置处的色氨酸;
[0372]
c)在与hpyy(1-36)的位置31相对应的位置处的亮氨酸;
[0373]
d)在与hpyy(1-36)的位置28相对应的位置处的酪氨酸和/或在与hpyy(1-36)的位置22相对应的位置处的异亮氨酸;和
[0374]
e)修饰基团,其连接至所述在与hpyy(1-36)(seq id no:1)的位置7或10相对应的位置处的赖氨酸的ε氨基,
[0375]
其中所述修饰基团由a-[b]
r-c-或a-[b]
r-c-[b]w定义,其中
[0376]
a-选自化学式1和化学式2
[0377]
化学式1:hooc-(ch2)
p-co-*,
[0378]
化学式2:ho3s-(ch2)
q-co-*
[0379]
其中p为14-18范围内的整数,且q为15-17范围内的整数;
[0380]
b-为化学式3
[0381]
化学式3:*[nh-ch(cooh)-(ch2)
2-co-]-*,
[0382]
r为1-3范围内的整数;
[0383]
w为1-3范围内的整数;并且
[0384]
c-不存在或选自化学式4和化学式5
[0385]
化学式4:*[nh-(ch2)
2-[o-(ch2)2]
s-o-(ch2)
t-co-]
u-*
[0386]
化学式5:*[nh-(ch2)
v-co-]
x-*
[0387]
其中s为1-3范围内的整数,t为1-3范围内的整数,u为1-4范围内的整数,v为3-7范围内的整数,且x为1-3范围内的整数;
[0388]
其中*表示连接点,并且其中a、b和c经由酰胺键且以所指示的顺序经由所述连接点相互连接;或所述pyy化合物的药学上可接受的盐、酰胺或酯;并且其中如果所述修饰基团为a-b-c-b,则c不能不存在。
[0389]
25.根据前述实施方案中任一项所述的组合物,其中所述化合物是与hpyy(3-36)相比具有最多10个氨基酸修饰的pyy衍生物,其中所述pyy衍生物包含
[0390]
a)在与hpyy(1-36)的位置4相对应的位置处的精氨酸;
[0391]
b)在与hpyy(1-36)的位置7相对应的位置处的赖氨酸;
[0392]
c)在与hpyy(1-36)的位置18相对应的位置处的谷氨酰胺;
[0393]
d)在与hpyy(1-36)的位置30相对应的位置处的色氨酸;
[0394]
e)在与hpyy(1-36)的位置31相对应的位置处的亮氨酸;
[0395]
f)在与hpyy(1-36)的位置28相对应的位置处的酪氨酸;和
[0396]
g)修饰基团,其连接至所述在与hpyy(1-36)(seq id no:1)的位置7相对应的位置处的赖氨酸的ε氨基,
[0397]
其中所述修饰基团由a-b-c-定义,其中
[0398]
a-为化学式1
[0399]
化学式1:hooc-(ch2)
p-co-*,
[0400]
其中p为14-18范围内的整数;
[0401]
b-为化学式3
[0402]
化学式3:*[nh-ch(cooh)-(ch2)
2-co-]-*;且
[0403]
c-为化学式5
[0404]
化学式5:*[nh-(ch2)
v-co-]
x-*
[0405]
其中v为5,且x为1的范围内的整数;
[0406]
其中*表示连接点,并且其中a、b和c经由酰胺键且以所指示的顺序经由所述连接点相互连接;或其药学上可接受的盐、酰胺或酯。
[0407]
26.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物选自:
[0408]
n{ε-7}-[(4s)-4-羧基-4-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)-丁酰基]氨基]丁酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]hpyy(3-36)(化合物1,seq id no:3);
[0409]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物2,seq id no:4);
[0410]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]-乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物3,seq id no:4);
[0411]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物4,seq id no:5);
[0412]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]丁酰基]氨基]-乙氧基]乙氧基]-乙酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物5,seq id no:4);
[0413]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(15-羧基-十五碳酰基氨基)丁酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物6,seq id no:4);
[0414]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(19-羧基-十九碳酰基氨基)丁酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物7,seq id no:4);
[0415]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物8,seq id no:4);
[0416]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(16-磺基十六碳酰基-氨基)丁酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物9,seq id no:4);
[0417]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(19-羧基-十九碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物10,seq id no:4);
[0418]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]丁酰基]-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物11,seq id no:5);
[0419]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-[[(4s)-4-羧基-4-(19-羧基十九碳酰基氨基)丁酰基]氨基]丁酰基]-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物12,seq id no:5);
[0420]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]-乙氧基]乙氧基]乙酰
基]-[arg4,lys7,ser9,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物13,seq id no:6);
[0421]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]-乙氧基]乙氧基]乙酰基]-[arg4,lys7,thr9,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物14,seq id no:7);
[0422]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]-[arg4,lys7,thr13,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物15,seq id no:8);
[0423]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]-乙氧基]乙氧基]乙酰基]-[arg4,lys7,thr13,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物16,seq id no:8);
[0424]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]-[arg4,lys7,gln18,ala24,tyr28,trp30,leu31]hpyy(4-36)(化合物17,seq id no:9);
[0425]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]-[arg4,lys7,gln18,ile24,tyr28,trp30,leu31]hpyy(4-36)(化合物18,seq id no:10);
[0426]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(19-羧基-十九碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,gln18,ile24,tyr28,trp30,leu31]hpyy(4-36)(化合物19,seq id no:10);
[0427]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,gln18,ile24,tyr28,trp30,leu31]hpyy(4-36)(化合物20,seq id no:10);
[0428]
n{α-4}-}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物21,seq id no:5);
[0429]
n{α-4}-乙酰基,n{ε-7}-[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)-丁酰基]-[arg4,lys7,gln18,ile24,tyr28,trp30,leu31]hpyy(4-36)(化合物22,seq id no:11);
[0430]
n{ε-7}-[(4s)-4-羧基-4-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)-丁酰基]氨基]丁酰基]-[arg4,lys7,gln18,ile22,trp30,leu31]hpyy(3-36)(化合物23,seq id no:12);
[0431]
n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)-丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,ile22,trp30,leu31]hpyy(3-36)(化合物24,seq id no:12);
[0432]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]-[arg4,lys7,gln18,ile22,trp30,leu31]hpyy(4-36)(化合物25,seq id no:13);
[0433]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]-乙氧基]乙氧基]乙酰
[arg4,lys10,gln18,glu22,tyr28,trp30,leu31]-pyy(4-36)(化合物50,seq id no:23);
[0458]
n{α-4}-(3-甲基丁酰基)-n{ε-10}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys10,gln18,glu22,tyr28,trp30,leu31]-pyy(4-36)(化合物51,seq id no:23);
[0459]
n{α-4}-(3-甲基丁酰基)-n{ε-10}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]-乙氧基]乙氧基]乙酰
[0460]
基]-[arg4,lys10,gln18,glu23,tyr28,trp30,leu31]-pyy(4-36)(化合物52,seq id no:24);
[0461]
n{α-4}-(3-甲基丁酰基)-n{ε-10}-[(4s)-4-羧基-4-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]-乙酰基]氨基]丁酰基]-[arg4,lys10,gln18,glu23,tyr28,trp30,leu31]-pyy(4-36)(化合物53,seq id no:24);
[0462]
n{α-4}-(3-甲基丁酰基)-n{ε-10}-[(4s)-4-羧基-4-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]-乙酰基]氨基]丁酰基]-[arg4,pro9,lys10,gln18,glu22,tyr28,trp30,leu31]-pyy(4-36)(化合物54,seq id no:25);
[0463]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(16-磺基十六碳酰基氨基)丁酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]-pyy(4-36)(化合物55,seq id no:4);
[0464]
n{α-4}-(3-甲基丁酰基)-n{ε-10}-[(4s)-4-羧基-4-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]-乙酰基]氨基]丁酰基]-[arg4,pro9,lys10,gln18,tyr28,trp30,leu31]-pyy(4-36)(化合物56,seq id no:26);
[0465]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,val22,tyr28,trp30,leu31]-pyy(4-36)(化合物57,seq id no:18);
[0466]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[(4s)-4-羧基-4-(15-羧基十五碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]-pyy(4-36)(化合物58,seq id no:4);
[0467]
n{α-4}-(3-甲基丁酰基)-n{ε-10}-[(4s)-4-羧基-4-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]-乙酰基]氨基]丁酰基]-[arg4,lys10,gln18,tyr28,trp30,leu31]-pyy-(4-36)(化合物59,seq id no:27);
[0468]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,ala24,tyr28,trp30,leu31]-pyy(4-36)(化合物60,seq id no:9);
[0469]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(15-羧基十五碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]-pyy-(4-36)(化合物61,seq id no:5);
[0470]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[(4s)-4-羧基-4-(13-羧基十三碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,tyr28,trp30,
leu31]-pyy(4-36)(化合物62,seq id no:4);
[0471]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(15-羧基十五碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]-pyy(3-36)(化合物63,seq id no:3);
[0472]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基]氨基]-乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]-pyy(4-36)(化合物65,seq id no:5);
[0473]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(16-磺基十六碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]-pyy(4-36)(化合物66,seq id no:5);
[0474]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[(4s)-4-羧基-4-(16-磺基十六碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]-pyy(4-36)(化合物67,seq id no:4);
[0475]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-(16-磺基十六碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,gln18,tyr28,trp30,leu31]-pyy(4-36)(化合物68,seq id no:4);
[0476]
n{α-4}-(3-甲基丁酰基)-n{ε-10}-[(4s)-4-羧基-4-[[2-[2-[2-[[(4s)-4-羧基-4-(16-磺基十六碳酰基氨基)丁酰基]氨基]乙氧基]-乙氧基]乙酰基]氨基]丁酰基]-[arg4,pro9,lys10,gln18,tyr28,trp30,leu31]-pyy-(4-36)(化合物69,seq id no:26);
[0477]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[(4s)-4-羧基-4-(13-羧基十三碳酰基氨基)丁酰基]-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]-pyy-(4-36)(化合物70,seq id no:5);和
[0478]
n{α-4}-(3-甲基丁酰基)-n{ε-7}-[2-[2-[2-[[(4s)-4-羧基-4-(13-羧基十三碳酰基氨基)丁酰基]氨基]乙氧基]乙氧基]乙酰基]-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]-pyy-(4-36)(化合物71,seq id no:5)。
[0479]
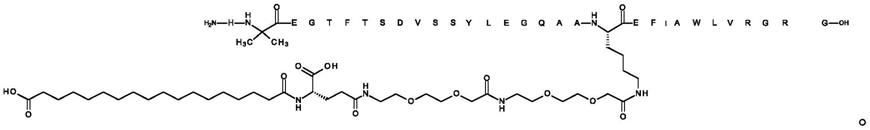
27.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物是n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物4)
[0480][0481]
28.根据实施方案1-26中任一项所述的药物组合物,其中所述pyy化合物是n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨
基]己酰基-[arg4,lys7,gln18,ile24,tyr28,trp30,leu31]hpyy(4-36)(化合物20)
[0482][0483]
29.根据实施方案1-26中任一项所述的药物组合物,其中所述pyy化合物是n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,gln18,ile22,tyr28,trp30,leu31]hpyy(4-36)(化合物32)
[0484][0485]
30.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物是人y2受体激动剂。
[0486]
31.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物是完全人y2受体激动剂。
[0487]
32.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物是选择性人y2受体激动剂。
[0488]
33.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物是选择性完全人y2受体激动剂。
[0489]
34.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物能够激活人y2受体。
[0490]
35.根据前述实施方案中任一项所述的药物组合物,其中所述pyy化合物能够与人y2受体结合。
[0491]
36.根据前述实施方案中任一项所述的药物组合物,其中所述组合物包含glp-1受体激动剂。
[0492]
37.根据前述实施方案中任一项所述的药物组合物,其中所述组合物包含选自司美格鲁肽和glp-1激动剂a的glp-1受体激动剂。
[0493]
38.根据前述实施方案中任一项所述的药物组合物,其中所述组合物包含至少一种颗粒。
[0494]
39.根据实施方案38所述的药物组合物,其中所述至少一种颗粒包含n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。
[0495]
40.根据实施方案38-39中任一项所述的药物组合物,其中所述至少一种颗粒进一步包含润滑剂,如硬脂酸镁。
[0496]
41.根据实施方案38-40中任一项所述的药物组合物,其中所述至少一种颗粒进一步包含pyy化合物和可选的glp-1受体激动剂。
[0497]
42.根据实施方案38-41中任一项所述的药物组合物,其中所述至少一种颗粒通过干法制粒,例如通过辊压法制备。
[0498]
43.根据实施方案38-42中任一项所述的药物组合物,其中所述组合物包含颗粒外部分。
[0499]
44.根据实施方案38-43中任一项所述的药物组合物,其中所述组合物的颗粒外部分包含润滑剂或助流剂如硬脂酸镁和/或pyy化合物。
[0500]
45.根据实施方案38-44中任一项所述的药物组合物,其中所述组合物的颗粒外部分包含润滑剂如硬脂酸镁、pyy化合物和glp-1受体激动剂。
[0501]
46.药物组合物,其包含
[0502]
a)0.5-100mg pyy化合物,和
[0503]
b)20-800mg,如25-600mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0504]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物4。
[0505]
47.药物组合物,其包含
[0506]
a)0.5-50mg pyy化合物,和
[0507]
b)50-400mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0508]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物4。
[0509]
48.药物组合物,其包含
[0510]
a)1-30mg pyy化合物,和
[0511]
b)75-150mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0512]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物4。
[0513]
49.药物组合物,其包含
[0514]
a)1-30mg pyy化合物,和
[0515]
b)75-125mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0516]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物4。
[0517]
50.药物组合物,其包含
[0518]
a)1-30mg pyy化合物,和
[0519]
b)80-120mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0520]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物4。
[0521]
51.药物组合物,其包含
[0522]
a)1-30mg pyy化合物,和
[0523]
b)200-400mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物4。
[0524]
52.药物组合物,其包含
[0525]
a)1-30mg pyy化合物,和
[0526]
b)250-350mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0527]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物4。
[0528]
53.根据实施方案46-52中任一项所述的药物组合物,其进一步包含glp-1受体激动剂,例如司美格鲁肽或glp-1激动剂a。
[0529]
54.根据实施方案53所述的药物组合物,其中所述组合物包含0.5-50mg glp-1受体激动剂,如1-25mg或1-15mg glp-1受体激动剂。
[0530]
55.根据实施方案46-54中任一项所述的药物组合物,其进一步包含1-10mg润滑剂,如硬脂酸镁。
[0531]
56.根据实施方案46-54中任一项所述的药物组合物,其进一步包含1-8mg,如2-5mg,或如2-3mg硬脂酸镁/100mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。
[0532]
57.根据实施方案46-56中任一项所述的药物组合物,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac)。
[0533]
58.药物组合物,其包含
[0534]
a)0.5-100mg pyy化合物,和
[0535]
b)20-800mg,如25-600mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0536]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物32。
[0537]
59.药物组合物,其包含
[0538]
a)0.5-50mg pyy化合物,和
[0539]
b)50-400mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0540]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物32。
[0541]
60.药物组合物,其包含
[0542]
a)1-30mg pyy化合物,和
[0543]
b)75-150mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0544]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物32。
[0545]
61.药物组合物,其包含
[0546]
a)1-30mg pyy化合物,和
[0547]
b)75-125mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0548]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少
90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物32。
[0549]
62.药物组合物,其包含
[0550]
a)1-30mg pyy化合物,和
[0551]
b)80-120mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0552]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物32。
[0553]
63.药物组合物,其包含
[0554]
a)1-30mg pyy化合物,和
[0555]
b)200-400mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0556]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物32。
[0557]
64.药物组合物,其包含
[0558]
a)1-30mg pyy化合物,和
[0559]
b)250-350mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0560]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐占所述组合物的辅料的至少90%(w/w),如至少95%(w/w),并且其中所述pyy化合物是化合物32。
[0561]
65.根据实施方案58-64中任一项所述的药物组合物,其进一步包含glp-1受体激动剂,例如司美格鲁肽或glp-1激动剂a。
[0562]
66.根据实施方案65所述的药物组合物,其中所述组合物包含0.5-50mg glp-1受体激动剂,如1-25mg或1-15mg glp-1受体激动剂。
[0563]
67.根据实施方案58-66中任一项所述的药物组合物,其进一步包含1-10mg润滑剂,如硬脂酸镁。
[0564]
68.根据实施方案58-66中任一项所述的药物组合物,其进一步包含1-8mg,如2-5mg,或如2-3mg硬脂酸镁/100mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。
[0565]
69.根据实施方案58-68中任一项所述的药物组合物,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac)。
[0566]
70.根据前述实施方案中任一项所述的药物组合物,其中所述组合物用于口服给药。
[0567]
71.根据前述实施方案中任一项所述的药物组合物,其中所述组合物是固体组合物。
[0568]
72.根据实施方案71所述的药物组合物,其中所述组合物是例如片剂、胶囊或囊剂形式的固体组合物。
[0569]
73.药物组合物,其包含
[0570]
a)pyy化合物,和
[0571]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0572]
其中所述pyy化合物的释放在15分钟内达到85%,或者在30分钟内达到95%。
[0573]
74.药物组合物,其包含
[0574]
a)pyy化合物,和
[0575]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0576]
其中t=30min时剂量校正的暴露相对于本文的测试组合物1增加。
[0577]
75.药物组合物,其包含
[0578]
a)pyy化合物,和
[0579]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0580]
其中t=0-30min的剂量校正的暴露(auc)相对于本文的测试组合物1增加。
[0581]
76.根据实施方案1-72中任一项所述的药物组合物,其中
[0582]
a)所述pyy化合物的释放在15分钟内达到85%,
[0583]
b)所述pyy化合物的释放在30分钟内达到95%,
[0584]
c)t=30min时剂量校正的暴露相对于本文的测试组合物1增加,或者
[0585]
d)t=0-30min的剂量校正的暴露(auc)相对于测试组合物1增加。
[0586]
77.根据实施方案73或实施方案76所述的药物组合物,其中t=0-30min的剂量校正的暴露(auc)增加至少1.2倍,如至少1.5倍,或者如至少2倍。
[0587]
78.根据实施方案73-77中任一项所述的药物组合物,其中所述释放如在本文的试验ii中测定,并且/或者所述剂量校正的暴露如在试验iv中测定。
[0588]
79.根据前述实施方案中任一项所述的药物组合物,其用于医学用途。
[0589]
80.根据前述实施方案中任一项所述的药物组合物,其用于治疗和/或预防肥胖症。
[0590]
81.根据实施方案1-78中任一项所述的药物组合物,其用于治疗和/或预防糖尿病,例如2型糖尿病。
[0591]
82.根据实施方案1-78中任一项的组合物在制备药物中的用途,该药物用于例如通过减少食物摄入量、降低体重、抑制食欲、诱导饱腹感来治疗和/或预防饮食失调,如肥胖症;治疗或预防暴食症、神经性贪食症和/或由抗精神病药或类固醇给药诱发的肥胖症;减少胃运动;延缓胃排空;增加身体活动;并且/或者预防和/或治疗肥胖症的共病,如骨关节炎和/或尿失禁。
[0592]
83.根据实施方案1-78中任一项的组合物在制备用于治疗和/或预防肥胖症的药物中的用途。
[0593]
84.根据实施方案1-78中任一项的组合物在制备用于治疗和/或预防糖尿病,例如2型糖尿病的药物中的用途。
[0594]
85.治疗有需要的受试者的方法,其中所述方法包括向所述受试者施用治疗有效量的根据实施方案1-78中任一项所述的组合物。
[0595]
86.治疗和/或预防受试者的肥胖症的方法,其中所述方法包括向所述受试者施用治疗有效量的根据实施方案1-78中任一项所述的组合物。
[0596]
87.治疗和/或预防受试者的糖尿病,例如2型糖尿病的方法,其中所述方法包括向所述受试者施用治疗有效量的根据实施方案1-78中任一项所述的组合物。
[0597]
88.药物组合物,其包含
[0598]
a)0.5-100mg pyy化合物
[0599]
b)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0600]
c)润滑剂,
[0601]
其中所述pyy化合物与hpyy(3-36)(seq id no:2)相比具有最多10个氨基酸修饰,
并且包含
[0602]
i)在与hpyy(1-36)(seq id no:1)的位置7或10相对应的位置处的赖氨酸;
[0603]
ii)在与hpyy(1-36)(seq id no:1)的位置30相对应的位置处的色氨酸;
[0604]
iii)在与hpyy(1-36)(seq id no:1)的位置31相对应的位置处的亮氨酸;
[0605]
iv)在与hpyy(1-36)(seq id no:1)的位置28相对应的位置处的酪氨酸和/或在与hpyy(1-36)(seq id no:1)的位置22相对应的位置处的异亮氨酸;和
[0606]
v)修饰基团,其连接至所述在与hpyy(1-36)(seq id no:1)的位置7或10相对应的位置处的赖氨酸的ε氨基,
[0607]
其中所述修饰基团由a-[b]r-c-或a-[b]r-c-[b]w定义,其中
[0608]
a-选自化学式1和化学式2
[0609]
化学式1:hooc-(ch2)p-co-*,
[0610]
化学式2:ho3s-(ch2)q-co-*
[0611]
其中p为14-18范围内的整数,且q为15-17范围内的整数;
[0612]
b-为化学式3
[0613]
化学式3:*[nh-ch(cooh)-(ch2)2-co-]-*,
[0614]
r为1-3范围内的整数;
[0615]
w为1-3范围内的整数;并且
[0616]
c-不存在或选自化学式4和化学式5
[0617]
化学式4:*[nh-(ch2)2-[o-(ch2)2]s-o-(ch2)t-co-]u-*
[0618]
化学式5:*[nh-(ch2)v-co-]x-*
[0619]
其中s为1-3范围内的整数,t为1-3范围内的整数,u为1-4范围内的整数,v为3-7范围内的整数,且x为1-3范围内的整数;
[0620]
其中*表示连接点,并且其中a、b和c经由酰胺键且以所指示的顺序经由所述连接点相互连接;或所述pyy化合物的药学上可接受的盐、酰胺或酯;并且
[0621]
其中如果所述修饰基团为a-b-c-b,则c不能不存在。
[0622]
89.根据前述实施方案中任一项所述的药物组合物,
[0623]
其中a-选自化学式1和化学式2
[0624]
化学式1:hooc-(ch2)p-co-*,
[0625]
化学式2:ho3s-(ch2)q-co-*
[0626]
并且其中p为16-18范围内的整数,且q为15。
[0627]
90.根据前述实施方案中任一项所述的药物组合物,其中a-为化学式1
[0628]
化学式1:hooc-(ch2)p-co-*,
[0629]
并且其中p为14-18范围内的整数。
[0630]
91.根据前述实施方案中任一项所述的药物组合物,其中a-为化学式1
[0631]
化学式1:hooc-(ch2)p-co-*,
[0632]
并且其中p为16-18范围内的整数。
[0633]
92.根据前述实施方案中任一项所述的药物组合物,其中b-为化学式3
[0634]
化学式3:*[nh-ch(cooh)-(ch2)2-co-]-*,
[0635]
r为1-2范围内的整数;
[0636]
w为1-2范围内的整数。
[0637]
93.根据前述实施方案中任一项所述的药物组合物,其中c-不存在或选自化学式4a和化学式5a
[0638]
化学式4a:*[nh-(ch2)2-[o-(ch2)2]2-o-(ch2)2-co-]u-*
[0639]
化学式5a:*[nh-(ch2)5-co-]x-*
[0640]
其中u为1-4范围内的整数,且x为1-3范围内的整数。
[0641]
94.根据前述实施方案中任一项所述的药物组合物,其中与hpyy(1-36)(seq id no:1)的位置1和2相对应的位置不存在。
[0642]
95.根据前述实施方案中任一项所述的药物组合物,其中与hpyy(1-36)(seq id no:1)的位置1-3相对应的位置不存在。
[0643]
96.根据前述实施方案中任一项所述的药物组合物,其中与hpyy(1-36)(seq id no:1)的位置1-3相对应的位置不存在,并且其中该pyy化合物进一步包含n末端取代基,其中该n末端取代基是包含至多12个碳原子的烷氧基。
[0644]
97.药物组合物,其包含
[0645]
d)0.5-100mg pyy化合物4、20或32
[0646]
e)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0647]
f)润滑剂,
[0648]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%
[0649]
(w/w),如至少95%(w/w)。
[0650]
98.药物组合物,其包含
[0651]
a)0.5-100mg pyy化合物4
[0652]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0653]
c)润滑剂,
[0654]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0655]
99.药物组合物,其包含
[0656]
a)0.5-100mg pyy化合物20
[0657]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0658]
c)润滑剂,
[0659]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0660]
100.药物组合物,其包含
[0661]
a)0.5-100mg pyy化合物32
[0662]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0663]
c)润滑剂,
[0664]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0665]
101.根据前述实施方案中任一项所述的组合物,其中所述润滑剂是硬脂酸镁。
[0666]
102.药物组合物,其包含
[0667]
a)0.5-100mg pyy化合物
[0668]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0669]
c)硬脂酸镁,
[0670]
其中硬脂酸镁占所述组合物的辅料的1-5%(w/w),并且
[0671]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0672]
103.根据实施方案102所述的药物组合物,其中硬脂酸镁占所述组合物的辅料的1-4%(w/w)。
[0673]
104.根据实施方案102-103中任一项所述的药物组合物,其中硬脂酸镁占所述组合物的辅料的1-3%(w/w)。
[0674]
105.根据实施方案102-104中任一项所述的药物组合物,其中硬脂酸镁占所述组合物的辅料的1-2.5%(w/w)。
[0675]
106.根据实施方案102-105中任一项所述的药物组合物,其中硬脂酸镁占所述组合物的辅料的2-3%(w/w)。
[0676]
107.根据实施方案102-106中任一项所述的药物组合物,其中硬脂酸镁占所述组合物的辅料的2-4%(w/w)。
[0677]
108.根据实施方案102-107中任一项所述的药物组合物,其中硬脂酸镁占所述组合物的辅料的2-5%(w/w)。
[0678]
109.根据实施方案102-108中任一项所述的药物组合物,其中硬脂酸镁占所述组合物的辅料的2-2.5%(w/w)。
[0679]
110.根据实施方案102-109中任一项所述的药物组合物,其中硬脂酸镁占所述组合物的辅料的2.5%(w/w)。
[0680]
111.根据实施方案102-110中任一项所述的药物组合物,
[0681]
其中所述pyy化合物与hpyy(3-36)(seq id no:2)相比具有最多10个氨基酸修饰,并且包含
[0682]
i)在与hpyy(1-36)(seq id no:1)的位置7或10相对应的位置处的赖氨酸;
[0683]
ii)在与hpyy(1-36)(seq id no:1)的位置30相对应的位置处的色氨酸;
[0684]
iii)在与hpyy(1-36)(seq id no:1)的位置31相对应的位置处的亮氨酸;
[0685]
iv)在与hpyy(1-36)(seq id no:1)的位置28相对应的位置处的酪氨酸和/或在与hpyy(1-36)(seq id no:1)的位置22相对应的位置处的异亮氨酸;和
[0686]
v)修饰基团,其连接至所述在与hpyy(1-36)(seq id no:1)的位置7或10相对应的位置处的赖氨酸的ε氨基,
[0687]
其中所述修饰基团由a-[b]r-c-或a-[b]r-c-[b]w定义,其中
[0688]
a-选自化学式1和化学式2
[0689]
化学式1:hooc-(ch2)p-co-*,
[0690]
化学式2:ho3s-(ch2)q-co-*
[0691]
其中p为14-18范围内的整数,且q为15-17范围内的整数;
[0692]
b-为化学式3
[0693]
化学式3:*[nh-ch(cooh)-(ch2)2-co-]-*,
[0694]
r为1-3范围内的整数;
[0695]
w为1-3范围内的整数;并且
[0696]
c-不存在或选自化学式4和化学式5
[0697]
化学式4:*[nh-(ch2)2-[o-(ch2)2]s-o-(ch2)t-co-]u-*
[0698]
化学式5:*[nh-(ch2)v-co-]x-*
[0699]
其中s为1-3范围内的整数,t为1-3范围内的整数,u为1-4范围内的整数,v为3-7范围内的整数,且x为1-3范围内的整数;
[0700]
其中*表示连接点,并且其中a、b和c经由酰胺键且以所指示的顺序经由所述连接点相互连接;或所述pyy化合物的药学上可接受的盐、酰胺或酯;并且
[0701]
其中如果所述修饰基团为a-b-c-b,则c不能不存在。
[0702]
112.根据实施方案24所述的药物组合物,
[0703]
其中a-选自化学式1和化学式2
[0704]
化学式1:hooc-(ch2)p-co-*,
[0705]
化学式2:ho3s-(ch2)q-co-*
[0706]
并且其中p为16-18范围内的整数,且q为15。
[0707]
113.根据实施方案111-112中任一项所述的药物组合物,其中a-为化学式1
[0708]
化学式1:hooc-(ch2)p-co-*,
[0709]
并且其中p为14-18范围内的整数。
[0710]
114.根据实施方案111-113中任一项所述的药物组合物,其中a-为化学式1
[0711]
化学式1:hooc-(ch2)p-co-*,
[0712]
并且其中p为16-18范围内的整数。
[0713]
115.根据实施方案111-114中任一项所述的药物组合物,其中b-为化学式3
[0714]
化学式3:*[nh-ch(cooh)-(ch2)2-co-]-*,
[0715]
r为1-2范围内的整数;
[0716]
w为1-2范围内的整数。
[0717]
116.根据实施方案111-115中任一项所述的药物组合物,其中c-不存在或选自化学式4a和化学式5a
[0718]
化学式4a:*[nh-(ch2)2-[o-(ch2)2]2-o-(ch2)2-co-]u-*
[0719]
化学式5a:*[nh-(ch2)5-co-]x-*
[0720]
其中u为1-4范围内的整数,且x为1-3范围内的整数。
[0721]
117.根据实施方案111-116中任一项所述的药物组合物,其中与hpyy(1-36)(seq id no:1)的位置1和2相对应的位置不存在。
[0722]
118.根据实施方案111-117中任一项所述的药物组合物,其中与hpyy(1-36)(seq id no:1)的位置1-3相对应的位置不存在。
[0723]
119.根据实施方案111-118中任一项所述的药物组合物,其中与hpyy(1-36)(seq id no:1)的位置1-3相对应的位置不存在,并且其中该pyy化合物进一步包含n末端取代基,其中该n末端取代基是包含至多12个碳原子的烷氧基。
[0724]
120.根据实施方案111所述的药物组合物,其中所述pyy化合物是化合物4、20或
32。
[0725]
121.根据实施方案111所述的药物组合物,其中所述pyy化合物是化合物4。
[0726]
122.药物组合物,其包含
[0727]
a)0.5-100mg pyy化合物4、20或32,
[0728]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,和
[0729]
c)硬脂酸镁,
[0730]
其中硬脂酸镁占所述组合物的辅料的2.5%(w/w),并且
[0731]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0732]
123.药物组合物,其包含
[0733]
a)0.5-100mg pyy化合物4
[0734]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0735]
c)硬脂酸镁,
[0736]
其中硬脂酸镁占所述组合物的辅料的2.5%(w/w),并且
[0737]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0738]
124.药物组合物,其包含
[0739]
a)1-50mg pyy化合物4
[0740]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0741]
c)硬脂酸镁,
[0742]
其中硬脂酸镁占所述组合物的辅料的2.5%(w/w),并且其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0743]
125.药物组合物,其包含
[0744]
a)1-30mg pyy化合物4
[0745]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0746]
c)硬脂酸镁,
[0747]
其中硬脂酸镁占所述组合物的辅料的2.5%(w/w),并且其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0748]
126.药物组合物,其包含
[0749]
a)0.5-100mg pyy化合物20
[0750]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0751]
c)硬脂酸镁,
[0752]
其中硬脂酸镁占所述组合物的辅料的2.5%(w/w),并且其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0753]
127.药物组合物,其包含
[0754]
a)0.5-100mg pyy化合物32
[0755]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0756]
c)硬脂酸镁,
[0757]
其中硬脂酸镁占所述组合物的辅料的2.5%(w/w),并且其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0758]
128.药物组合物,其包含
[0759]
a)0.5-100mg pyy化合物4
[0760]
b)20-800mg,如50-500mg n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐
[0761]
c)硬脂酸镁,
[0762]
其中硬脂酸镁占所述组合物的辅料的2-3%(w/w),并且
[0763]
其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(snac),并且占所述组合物的辅料的至少90%(w/w),如至少95%(w/w)。
[0764]
129.根据前述实施方案中任一项所述的药物组合物,其中所述组合物用于口服给药。
[0765]
130.根据前述实施方案中任一项所述的药物组合物,其中所述组合物是固体组合物。
[0766]
131.根据实施方案130所述的药物组合物,其中所述组合物是片剂、胶囊或囊剂形式的固体组合物。
[0767]
132.药物组合物,其包含
[0768]
c)pyy化合物,和
[0769]
d)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0770]
其中所述pyy化合物的释放在15分钟内达到85%,或者在30分钟内达到95%。
[0771]
133.药物组合物,其包含
[0772]
c)pyy化合物,和
[0773]
d)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0774]
其中t=30min时剂量校正的暴露相对于本文的测试组合物1增加。
[0775]
134.药物组合物,其包含
[0776]
c)pyy化合物,和
[0777]
d)n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,
[0778]
其中t=0-30min的剂量校正的暴露(auc)相对于本文的测试组合物1增加。
[0779]
135.根据实施方案88-131中任一项所述的药物组合物,其中
[0780]
a.所述pyy化合物的释放在15分钟内达到85%,
[0781]
b.所述pyy化合物的释放在30分钟内达到95%,
[0782]
c.t=30min时剂量校正的暴露相对于本文的测试组合物1增加,或者
[0783]
d.t=0-30min的剂量校正的暴露(auc)相对于测试组合物1增加。
[0784]
136.根据实施方案132或实施方案135所述的药物组合物,其中t=0-30min的剂量校正的暴露(auc)增加至少1.2倍,如至少1.5倍,或者如至少2倍。
[0785]
137.根据实施方案132-136中任一项所述的药物组合物,其中所述释放如在本文的试验ii中测定,并且/或者所述剂量校正的暴露如在试验iv中测定。
[0786]
138.根据前述实施方案中任一项所述的药物组合物,其用于医学用途。
[0787]
139.根据前述实施方案中任一项所述的药物组合物,其用于治疗和/或预防肥胖症。
[0788]
140.根据实施方案88-137中任一项所述的药物组合物,其用于治疗和/或预防糖尿病,例如2型糖尿病。
[0789]
141.根据实施方案88-137中任一项的组合物在制备药物中的用途,该药物用于例如通过减少食物摄入量、降低体重、抑制食欲、诱导饱腹感来治疗和/或预防饮食失调,如肥胖症;治疗或预防暴食症、神经性贪食症和/或由抗精神病药或类固醇给药诱发的肥胖症;减少胃运动;延缓胃排空;增加身体活动;并且/或者预防和/或治疗肥胖症的共病,如骨关节炎和/或尿失禁。
[0790]
142.根据实施方案88-137中任一项的组合物在制备用于治疗和/或预防肥胖症的药物中的用途。
[0791]
143.根据实施方案88-137中任一项的组合物在制备用于治疗和/或预防糖尿病,例如2型糖尿病的药物中的用途。
[0792]
144.治疗有需要的受试者的方法,其中所述方法包括向所述受试者施用治疗有效量的根据实施方案88-137中任一项所述的组合物。
[0793]
145.治疗和/或预防受试者的肥胖症的方法,其中所述方法包括向所述受试者施用治疗有效量的根据实施方案88-137中任一项所述的组合物。
[0794]
146.治疗和/或预防受试者的糖尿病,例如2型糖尿病的方法,其中所述方法包括向所述受试者施用治疗有效量的根据实施方案88-137中任一项所述的组合物。
[0795]
方法和实施例
[0796]
检测和表征的通用方法
[0797]
试验i:崩解试验
[0798]
在适当的崩解设备,例如usp崩解设备中进行崩解试验,以测量测试组合物在体外的崩解时间。
[0799]
试验ii:溶出试验
[0800]
可以进行根据欧洲药典(ph eur 2.9.3)的标准溶出试验,以测量pyy化合物和snac的体外释放。
[0801]
溶出试验在适当的溶出设备,例如usp溶出设备2中进行。更具体地,使用50rpm的桨转速,根据美国药典35使用设备2。对于在ph 6.8下的测试,在37
±
0.5℃的温度下使用0.05m磷酸盐缓冲液的500ml溶出介质。溶出介质的含量为0.1%以适当的时间间隔取出样品,并使用用于snac和pyy化合物双重检测的rp-uhplc方法确定样品含量。
[0802]
基于色谱图中pyy化合物和snac峰的峰面积分别相对于pyy化合物和snac参考物的峰面积计算样品含量。将pyy化合物和snac的释放量计算为测试组合物中总含量的百分比。片剂中的实际含量使用试验iii来确定。
[0803]
试验iii:pyy化合物和snac的量的分析
[0804]
对于测定分析,在提取pyy化合物和snac之前对片剂进行称重。将片剂溶解在相关量的含有20%乙腈的0.05m磷酸盐缓冲液(ph 7.4)中。使用两小时的提取时间。对样品进行离心,并将合适的体积转移至hplc小瓶。相关pyy化合物和snac的标准品使用与样品相同的
稀释剂来制备。使用带有紫外线检测器的uhplc进行pyy化合物和snac含量的双重确定。基于色谱图中pyy化合物和snac峰的峰面积分别相对于pyy化合物和snac参考物的峰面积计算片剂含量。
[0805]
试验iv:比格犬中的药代动力学研究
[0806]
在比格犬中进行药代动力学(pk)研究,以确定在经口施用不同剂型后pyy化合物的暴露。
[0807]
对于药代动力学研究,使用在研究开始时为1至5岁且重约10-12kg的雄性比格犬。犬在围栏中分组圈养(12小时光照:12小时黑暗),并单独且限制性地每日一次饲以royal canin medium adult狗粮(royal canin products,china branch,或brogaarden a/s,丹麦)。只要可能,允许每天进行运动和社交活动。使用这些犬进行重复的药代动力学研究,其中在连续给药之间具有适当的洗脱期。在开始第一次药代动力学研究之前给予适当的适应期。动物的所有处理、给药和血液采样都由受过训练且熟练的人员进行。在研究之前,在给药前整夜以及给药后0至4h将犬禁食。此外,在给药前1小时直到给药后4小时限制犬饮水,但在整个时间段的其他时间自由饮水。
[0808]
包含pyy化合物的片剂以下述方式施用:在施用片剂前10min,向犬皮下给予约3nmol/kg的seq id no:34。将pyy片剂置于犬的口腔后部以防止咀嚼。然后使嘴闭合,并通过注射器或强饲给予自来水,以促进片剂的吞咽。
[0809]
血液采样
[0810]
在预定的时间点采集血样,持续直到给药后10hr,以充分覆盖pyy化合物的完整的血浆浓度-时间吸收谱。
[0811]
对于每个血液采样时间点,在1.5ml edta涂覆的管中收集约0.8ml的全血,并将该管轻轻转动以使样品与edta混合。将血液样品(例如0.8ml)采集到edta缓冲液(8mm)中,然后在4℃下以2000g离心10分钟。将血浆用移液器移取至干冰上的micronic管中,并在-20℃下保存直到分析。
[0812]
视情况取得血液样品,例如在前2小时从前腿的头静脉中的venflon取得,随后对于其余的时间点,采用注射器从颈静脉取得(使前几滴从venflon中排出,以避免样品中有来自venflon的肝素盐水)。
[0813]
血浆分析
[0814]
通过血浆蛋白质沉淀和涡流(turboflow)液相色谱串联质谱法(tf-lc-ms/ms)测定犬血浆中的pyy化合物。通过在空白犬血浆中掺加0.5至200nm范围内的pyy化合物来制备校准品。将一倍体积的校准品、空白血浆和研究样品用三倍体积的乙醇(含内标)沉淀并离心。将一倍体积的上清液与两倍体积的milli-q水(含1%甲酸)混合。使用cyclone涡流(turboflow)柱(0.5x 50mm,thermofisher scientific)和aeris peptide 3.6um xb-c18分析柱(50x 2.1mm,phenomenex)或poroshell sb-c18 2.7um分析柱(50x 2.1mm,agilent)通过tf-lc-ms/ms分析该混合物。使用流动相a(由含有1%甲酸和5%甲醇/乙腈(50/50)的milli-q水组成)和流动相b(由含有1%甲酸和5%milli-q水的甲醇/乙腈(50/50)组成)进行梯度洗脱。以单反应或平行反应监测模式(m/z 968.5至m/z 883.4或m/z 806.7576,nce 17),使用tsq altis或qe plus质谱仪(thermofisher scientific)作为检测器。线性校准曲线(权重1/x2)用于计算血浆样品中的浓度。包括质量控制样品。校准品和质量控制样品
中的标称浓度和计算浓度之间的偏差低于20%。
[0815]
片剂制备的通用方法
[0816]
方法1:干法制粒
[0817]
干法制粒在gerteis mini-pactor上通过辊压进行。将辊速设置为3rpm,并将辊压缩力设置为6kn/cm,间隙为1mm。
[0818]
在干法制粒之前,将snac和硬脂酸镁以及可选的mcc在合适的掺和器如v形壳掺和器pharmatech mb100中掺混。
[0819]
方法2:压片
[0820]
在模拟fette 102i的kilian styl’one上或安装有一组冲头的fette102i上生产片剂,产生7mm圆形或7.2
×
12mm或7.5
×
13mm椭圆形片剂,没有刻痕。根据片剂的总重量选择冲头尺寸。将压片机速度设置为20rpm。调节填充体积以获得目标重量为107mg至403mg的片剂。施加约7至8.5kn的压缩力,以获得与片剂大小相应的抗碎强度约为56-134n的片剂。
[0821]
在压片之前,将通过方法1获得的颗粒与pyy化合物和任何其他辅料在turbula混合器上掺混(7min,25rpm)。
实施例
[0822]
实施例1-组合物的制备
[0823]
根据以下表1制备测试组合物,其包含如wo2016/198682所述制备的基于肽的pyy化合物(实施例1,化合物4和32)。所测试的化合物具有以下名称和结构:n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,pro9,gln18,tyr28,trp30,leu31]hpyy(4-36)(化合物4):
[0824][0825]
和n{α-4}-(3-甲基丁酰基)-n{ε-7}-6-[[(4s)-4-羧基-4-(17-羧基-十七碳酰基氨基)丁酰基]氨基]己酰基-[arg4,lys7,gln18,ile22,tyr28,trp30,leu31]hpyy(4-36)(化合物32):
[0826][0827]
该组合物通过使用上文所述方法的组合来制备。如wo 2013/139694所述,通过将snac、硬脂酸镁和mcc的掺合物粒化来产生测试组合物1。随后将颗粒与聚维酮、pyy化合物,并进一步与mcc和硬脂酸镁掺混,之后压片(方法2)。测试组合物2、3和4通过将snac与硬脂酸镁掺混,之后进行干法制粒来制备(方法1)。所得颗粒随后与pyy化合物掺混,之后压片(方法2)。所述组合物在表1中描述。
[0828]
表1-pyy化合物片剂的组合物
[0829][0830]
实施例2-崩解试验
[0831]
本研究的目的是评价实施例1中描述的一系列片剂组合物的崩解。
[0832]
采用自动检测,根据欧洲药典,使用pharmatech ptz自动崩解测试仪,按照试验i测量崩解。测试组合物1-4在水r中进行测试,并且在展开自动检测时被认为是崩解的。结果被报告为3片的平均值。
[0833]
表2显示了根据以上实施例1制备的片剂的结果。
[0834]
表2.崩解时间
[0835]
组合物测试1测试2测试3测试4崩解时间12min 2s3min 57s7min 36s5min 49s
[0836]
获得的结果表明,测试组合物2、3和4表现出比测试组合物1所观察到的显著更快
的崩解。
[0837]
实施例3-溶出试验
[0838]
本研究的目的是评价实施例1中描述的一系列片剂组合物的溶出。
[0839]
根据试验ii测量溶出,并根据试验iii测量snac和pyy化合物的量。snac和pyy化合物的释放量被计算为片剂中实际含量的百分比,即100/300mg/片的snac和3mg/片的pyy化合物。
[0840]
pyy化合物的含量(释放量)被报告为3片的平均值。
[0841]
表3显示了根据以上实施例1制备的片剂的结果,其中释放被表示为“溶液中的pyy化合物(%)”,其描述相对于实验开始时片剂中pyy化合物的总量,在15、30和60min后溶液中pyy化合物的量。根据试验iii测定片剂中pyy化合物的总量。
[0842]
表3.溶液中的pyy化合物(%)
[0843][0844][0845]
所获得的结果表明,与测试组合物1的观察结果相比,测试组合物2和3表现出更快的pyy化合物释放。在早期时间点,即15和30分钟时,观察到明显更快的pyy化合物释放。60分钟后释放差异不太显著。片剂中snac的量基本上不影响pyy化合物的释放,即,在15分钟后或以后测量时,包含100mg snac的片剂的溶出与包含300mg snac的片剂一样快。
[0846]
图1显示了测试组合物1-3在5、10、15、20、30、45和60分钟后获得的进一步数据,表明测试2和测试3在每个时间点都优于测试1。
[0847]
实施例4-口服暴露
[0848]
该研究的目的是评价包含pyy化合物32和4的组合物(测试组合物4和3,表1)在比格犬中的口服暴露。
[0849]
表4.剂量校正的暴露
[0850][0851]
数据证实,pyy化合物在本发明的制剂中通过口服给药是生物可利用的。
[0852]
虽然本文已经阐述并描述了本发明的某些特征,但是本领域普通技术人员现在将会想到许多修改、替换、改变和等同方案。因此,应当理解,意欲以所附权利要求书涵盖所有
这些落入本发明真正范围内的修改和改变。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。