如扁桃酸乌洛托品的乌洛托品盐的成品药物剂型
背景技术:
1.对于药物制剂的科学家来说,活性药物成分(“apis”或单数形式“api”)的使用是具有挑战的,所述活性药物成分是api占大部分药物制剂(在单个片剂中定义为75%w/w或更多的api)的高剂量片剂剂型在水中的化学反应性。这些高剂量片剂剂型是具有挑战性的,因为(1)api的压实特性对于形成坚固的片剂剂型至关重要,(2)每片剂中少量的赋形剂使得难以得到合适的压缩,并且(3)某些api的化学反应性使得普通高剂量片剂剂型的常用加工技术是无法接受的。本领域技术人员理解赋形剂是可接受的用于成品药物剂型的惰性成分。
2.对于高剂量片剂剂型,通常使用湿法制粒加工技术来赋予活性药物成分和赋形剂的混合物合适的压实特性。本领域技术人员理解湿法制粒产生促进改善流动性和压实特性的药物制剂成分的紧密混合物,从而在任何药物加工技术的最大程度上改变了api的特性。湿法制粒通常采用粘合剂溶液对所得的配方混合物进行湿团,在许多情况下,api颗粒会在每个二级颗粒的表面上带有粘合剂,因此在压实过程中,粘合剂材料与其他粘合剂材料直接接触以形成成品片剂剂型。这些二级api颗粒不仅包含api,还包含配方的混合物,其会显示出改善的压实特性。如上文对于高剂量片剂剂型的定义,当与赋形剂的百分比相比,活性药物成分和赋形剂的制剂混合物含有更高百分比的活性药物成分,通常为75%w/w或更多;因此,湿法制粒对赋予合适的压实特性和形成令人满意的成品片剂剂型是特别有价值的。然而,对于对水敏感的活性药物成分,典型的水基湿法制粒可能不是一种选择,因为湿法制粒会使api暴露于水。
3.即使是被本领域技术人员称为干混加工的直接压片,在处理高剂量片剂剂型在水中具有化学反应性的api时也会存在挑战。如果不能使用湿法制粒来改变api的压实特性,纯api的流动性和压实特性会对形成坚固的片剂剂型变得至关重要。
4.在直接压片中,必须考虑最终共混物的残余水分含量(或者在高剂量片剂剂型的情况下,api本身的水分含量),并且增加该水分含量通常用于改善最终共混物的压实特性。然而,对于对水敏感的apis,增加水分含量并不合适因为它会导致api的降解。另一方面,简单地降低api的水分含量以降低化学反应性或降解也可能会对高剂量片剂剂型的形成/压实产生反作用,这就是为什么配制具有对水敏感的api对药物配方科学家来说是一个重大挑战。
5.乌洛托品盐(包括扁桃酸盐和马尿酸盐形式)是在水中具有上述化学反应性的api的实例。乌洛托品作为尿液抗菌剂,其在酸水介质中反应生成氨和抗菌剂甲醛。乌洛托品盐盐的治疗活性也需要高剂量才能有效。市售的含有乌洛托品盐的片剂有500mg和1,000mg两种配方。乌洛托品盐的作用机制阐述了为什么乌洛托品盐的高剂量片剂剂型中的水含量是至关重要的。为免生疑问,乌洛托品盐在水性介质中反应,因此控制剂型中的水量以防止乌洛托品盐与残留的水反应。由于对水的敏感性仅是乌洛托品部分的一个问题,乌洛托品的任何盐形式的配方(包括扁桃酸和马尿酸盐)在水含量方面都面临着同样的挑战。为便于讨论,本说明书聚集于扁桃酸乌洛托品,但本领域技术人员理解本文中的概念适用于乌洛托
品的任何盐形式。
6.在作为药物片剂剂型给药后,扁桃酸乌洛托品被迅速吸收(作为乌洛托品和扁桃酸)并由肾脏排泄集中在尿液中。抗菌治疗活性主要是乌洛托品部分水解的结果,其在尿液中的ph值为5.5或更低时最大化。扁桃酸还提供抗菌活性,并且它有助于提高乌洛托品部分的有效性,因为扁桃酸会使患者的尿液酸化。虽然尿液ph值的正常范围是4.6-8.0,这取决于肾脏排泄的物质,但扁桃酸的存在会降低患者尿液的ph值,从而提高乌洛托品部分的有效性。
7.乌洛托品部分和扁桃酸的共生对药物科学家提出了挑战。与任何其他api一样,扁桃酸乌洛托品作为原料药具有固有的水分含量。在每个api晶体周围的微环境中,api中存在的水分/水实际上是乌洛托品和扁桃酸的饱和溶液,为水解或药物降解提供了理想的环境。因此,控制api的水含量有助于防止水解或药物降解,这对原料药和成品片剂均有效。
8.美国药典(usp)对apis的水分含量设定了限制。usp对扁桃酸乌洛托品的专著使用通用物理usp测试干燥损失《731》,建立了低于1.5%的水分含量的规格。usp对乌洛托品马尿酸盐的专著使用通用物理usp测试干燥损失《731》,建立了低于1.0%的水分含量的规格。将水含量控制在低于usp中指定限度的规格会导致成品的水解较少,从而降低药物降解的可能性并提高成品的保质期。
技术实现要素:
9.本发明提供了一种高剂量成品药物剂型,其包含作为活性药物成分的乌洛托品盐,例如扁桃酸乌洛托品,其中乌洛托品盐api的水分含量低于usp中规定的上限。本发明可包括一种或多种药学上可接受的赋形剂。对于api和所得成品片剂剂型,本发明平衡了保持低水分含量的需要,以防止药物降解,以及具有可压制成所需成品片剂剂型的药物产品共混物的需要。
10.下面更详细地公开了乌洛托品盐(比如,扁桃酸乌洛托品)的药物产品制剂。本发明包括水分含量显著低于usp所允许的水分含量的乌洛托品盐的药物产品,该盐仍具有合适的压实特性,从而产生可用于商业生产的成品片剂剂型。
具体实施方式
11.本发明提供一种高剂量成品药物剂型,其包含作为活性药物成分的乌洛托品盐,例如扁桃酸乌洛托品,其中乌洛托品盐api的水分含量低于usp中规定的上限。本发明的一个优选实施方案具有的含水量是usp中针对每种特定的乌洛托品盐规定的限度的一半。甚至更优选的实施方案是,无论乌洛托品盐如何,其水分含量都是千分之一(0.1%)。本发明的优选实施方案包括每片含有500mg或1,000mg乌洛托品盐的片剂剂量,其中api占成品剂型的75%w/w或更多,但任何量的乌洛托品盐均包括在本发明范围内。
12.本发明可包括一种或多种药学上可接受的成分。本领域技术人员将理解药学上可接受的赋形剂的类型。可以使用的某些类型的赋形剂包括稀释剂/粘合剂/填充剂,崩解剂,助流剂和润滑剂。示例性的稀释剂/粘合剂/填充剂包括淀粉、微晶纤维素、羟丙基纤维素、聚维酮、乳糖和磷酸二钙。示例性的崩解剂包括淀粉、交联羧甲基纤维素钠、羟基乙酸淀粉钠和交联聚乙烯吡咯烷酮。示例性的助流剂包括二氧化硅和滑石。示例性的润滑剂包括硬
脂酸、硬脂酸镁和硬脂富马酸钠。
13.如上所述,水形式下的乌洛托品盐的反应性是成品剂型产品的治疗活性的基础,但它也是关注成品片剂剂型在保质期内药物降解的基础。除了控制api的水分含量之外,本发明还寻求控制成品剂型的水分含量,因为由其他成分或过程产生的水分也会导致药物降解。成品药物剂型的一个优选实施方案还具有小于1.0%的水分含量。
14.本领域技术人员理解,降低成品片剂剂型中使用的api的水分含量会对成品片剂剂型的加工和压实产生负面影响。如果无法制成成品片剂,例如,如果不能将低水分制剂压制成成品片剂,则降低api或成品的水分含量不是实际的解决方案。本发明的一个关键方面是使用具有低水分含量规格的高剂量api与设计合适的药物片剂制剂之间的平衡。这种平衡在现有技术中没有出现并且对于本领域技术人员来说不是显而易见的。
15.提供以下实施例以帮助理解本发明,但不旨在限制本发明的范围。
16.实施例1
17.下面描述本发明的一个示例性实施方案的配方和工艺。
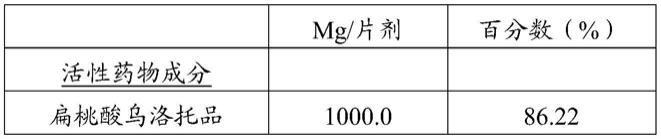
[0018] mg/片剂百分数(%)活性药物成分
ꢀꢀ
扁桃酸乌洛托品1000.075.00赋形剂
ꢀꢀ
微晶纤维素50μm320.024.00硬脂酸镁13.31.00总计1333.3100.00
[0019]
将前两种材料(扁桃酸乌洛托品和微晶纤维素50μm)装入v型混合器中。混合材料直至充分分散。将硬脂酸镁通过40目筛网并与v型混合器中一小部分的共混材料进行预共混。将预混料加入到v型混合器中剩余的材料中并混合直至充分分散。最终共混物从混合器中排出并装入压片机的料斗中以压制成成品片剂剂型。
[0020]
在该实施例中添加了320.0mg的50μm的微晶纤维素。对于含有1,000mg api的片剂,例如实施例1中的片剂,该赋形剂的量可以在200至350mg的范围内。在本实施例中加入了13.3mg硬脂酸镁。对于含有1,000mg api的片剂,例如实施例1中的片剂,该赋形剂的量可以在7至25mg的范围内。
[0021]
实施例2
[0022]
下面描述本发明的另一个示例性实施方案的配方和工艺。
[0023] mg/片剂百分数(%)活性药物成分
ꢀꢀ
扁桃酸乌洛托品500.080.00赋形剂
ꢀꢀ
微晶纤维素50μm119.019.04硬脂酸镁6.00.96总计625.0100.00
[0024]
将前两种材料(扁桃酸乌洛托品和微晶纤维素50μm)装入v型混合器中。混合材料直至充分分散。将硬脂酸镁通过40目筛网并与v型混合器中一小部分的共混材料进行预共
混。将预混料加入到v型混合器中剩余的材料中并混合直至充分分散。最终共混物从混合器中排出并装入压片机的料斗中以压制成成品片剂剂型。
[0025]
在该实施例中添加了119.0mg的50μm的微晶纤维素。对于含有500mg api的片剂,例如实施例2中的片剂,该赋形剂的量可以在75至150mg的范围内。在本实施例中加入了6.0mg硬脂酸镁。对于含有500mg api的片剂,例如实施例2中的片剂,该赋形剂的量可以在3至13mg的范围内。
[0026]
实施例3
[0027]
下面描述本发明的另一个示例性实施方案的配方和工艺。
[0028][0029][0030]
将前四种材料(扁桃酸乌洛托品、微晶纤维素50μm、微晶纤维素20μm和羟丙基纤维素)装入v型混合器中。混合材料直至充分分散。将硬脂酸镁通过40目筛网并与v型混合器中一小部分的共混材料进行预共混。将预混料加入到v型混合器中剩余的材料中并混合直至充分分散。最终共混物从混合器中排出并装入压片机的料斗中以压制成成品片剂剂型。
[0031]
在该实施例中添加了60.0mg的50μm的微晶纤维素。对于含有1,000mg api的片剂,例如实施例3中的片剂,该赋形剂的量可以在10至110mg的范围内。在该实施例中添加了60.0mg的20μm的微晶纤维素。对于含有1,000mg api的片剂,例如实施例3中的片剂,该赋形剂的量可以在10至110mg的范围内。在该实施例中添加了20.0mg的羟丙基纤维素。对于含有1,000mg api的片剂,例如实施例3中的片剂,该赋形剂的量可以在5至50mg的范围内。在该实施例中添加了20.0mg的硬脂酸镁。对于含有1,000mg api的片剂,例如实施例3中的片剂,该赋形剂的量可以在6至24mg的范围内。
[0032]
实施例4
[0033]
下面描述本发明的另一个示例性实施方案的配方和工艺。
[0034] mg/片剂百分数(%)活性药物成分
ꢀꢀ
扁桃酸乌洛托品1000.083.32赋形剂
ꢀꢀ
微晶纤维素50μm60.05.00微晶纤维素20μm60.05.00
羟丙基纤维素26.02.17淀粉乙醇酸钠26.02.17胶体二氧化硅80.67硬脂酸镁201.67总计1200.0100.00
[0035]
将前五种材料(扁桃酸乌洛托品、微晶纤维素50μm、微晶纤维素20μm、羟丙基纤维素和淀粉乙醇酸钠)装入v型混合器中。混合材料直至充分分散。将胶体二氧化硅和硬脂酸镁通过40目筛网并与v型混合器中一小部分的共混材料进行预共混。将预混料加入到v型混合器中剩余的材料中并混合直至充分分散。最终共混物从混合器中排出并装入压片机的料斗中以压制成成品片剂剂型。
[0036]
在该实施例中添加了60.0mg的50μm的微晶纤维素。对于含有1,000mg api的片剂,例如实施例4中的片剂,该赋形剂的量可以在10至110mg的范围内。在该实施例中添加了60.0mg的20μm的微晶纤维素。对于含有1,000mg api的片剂,例如实施例4中的片剂,该赋形剂的量可以在10至110mg的范围内。在该实施例中添加了26.0mg的羟丙基纤维素。对于含有1,000mg api的片剂,例如实施例4中的片剂,该赋形剂的量可以在5至50mg的范围内。在该实施例中添加了26.0mg的淀粉乙醇酸钠。对于含有1,000mg api的片剂,例如实施例4中的片剂,该赋形剂的量可以在6至44mg的范围内。在该实施例中添加了8.0mg的胶体二氧化硅。对于含有1,000mg api的片剂,例如实施例4中的片剂,胶体二氧化硅的量可以在1至16mg的范围内。在该实施例中添加了20.0mg的硬脂酸镁。对于含有1,000mg api的片剂,例如实施例4中的片剂,该赋形剂的量可以在6至24mg的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。