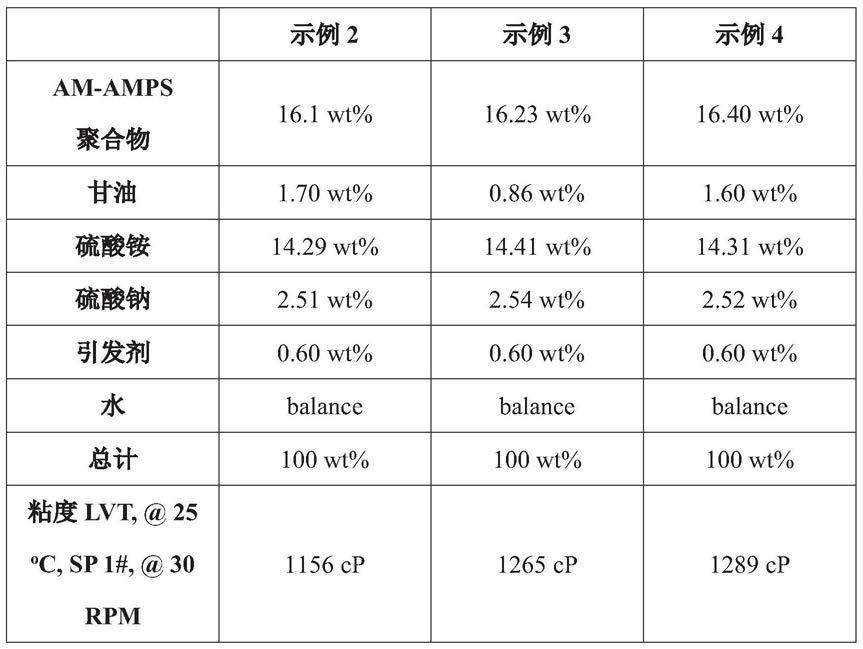
抗vegf蛋白组合物及其制备方法1.序列表2.本技术含有序列表,所述序列表已以ascii格式以电子方式提交并且特此通过引用整体并入。所述ascii副本创建于2020年8月13日,命名为070816-02451_sl.txt并且大小为134,385字节。3.相关申请的交叉引用4.本技术要求2020年8月13日提交的美国临时专利申请第63/065,012号的优先权和权益,所述专利申请的内容通过引用整体并入本文。
技术领域:
:5.本发明大体上涉及抗vegf组合物及其制备方法。
背景技术:
::6.基于蛋白质的生物药物组合物已成为用于研究、治疗眼科疾病、癌症、自身免疫疾病、感染以及其他疾病和病症的重要产品。生物医药代表医药行业增长最快的产品领域之一。7.已识别出一类对血管内皮细胞具有选择性的细胞衍生的二聚促分裂原,并将其命名为血管内皮细胞生长因子(vegf)。8.持续的血管生成(angiogenesis)可引起或加剧某些疾病,例如牛皮癣、类风湿性关节炎、血管瘤、血管纤维瘤、糖尿病性视网膜病和新生血管性青光眼。vegf活性的抑制剂可用于治疗此类疾病和其他vegf诱发的病理性血管生成和血管通透性疾患,例如肿瘤血管形成(vascularization)。血管生成素和血管内皮生长因子(vegf)家族的成员是唯一被认为对血管内皮细胞有很大特异性的生长因子。9.若干眼部病症与病理性血管生成相关。例如,年龄相关的黄斑变性(amd)的发展与称为脉络膜新生血管形成(cnv)的过程相关。cnv的渗漏会引起黄斑水肿和黄斑下方积液,从而导致视力丧失。糖尿病性黄斑水肿(dme)是另一种具有血管生成组分的眼部病症。dme是糖尿病患者中度视力丧失的最普遍原因,并且是糖尿病性视网膜病的常见并发症,糖尿病性视网膜病是一种影响视网膜血管的疾病。当液体渗漏至黄斑中心时,会发生具有临床意义的dme,黄斑是视网膜的光敏部分,负责清晰、直接视力。黄斑中的液体会导致严重视力丧失或失明。10.各种vegf抑制剂,例如vegftrapeylea(阿柏西普(aflibercept)),已经批准用于治疗此类眼部病症。技术实现要素:11.本发明涉及抗vegf蛋白,其包括作为融合蛋白的vegftrap蛋白阿柏西普。本发明还涉及新的抗vegf蛋白,即阿柏西普minitrap或vegfminitrap(除非另有说明,否则统称为minitrap)。本文公开了制备这些抗vegf蛋白的方法,包括提供有效和高效手段来产生目标蛋白质的产生模式。在一个方面,本发明涉及使用化学成分确定的培养基(cdm)来产生抗vegf蛋白。在一个特定方面,目标cdm是当使用时产生蛋白质样品的cdm,其中所述样品具有黄棕色并且可包含氧化种类。在本技术中,还进一步公开了阿柏西普和vegfminitrap的蛋白质变体以及附随产生方法。12.阿柏西普的产生13.本公开描述了使用细胞培养基产生阿柏西普。在一个实施方案中,细胞培养基是化学成分确定的培养基(“cdm”)。经常使用cdm,因为它是一种不含蛋白质的化学成分确定的配方,不使用动物来源的组分,并且可确定培养基的组成。在另一个实施方案中,细胞培养基是大豆水解物培养基。14.在一个实施方案中,产生重组蛋白的方法包括:(a)提供经基因工程化以表达目标重组蛋白的宿主细胞;(b)在合适的条件下在cdm中培养所述宿主细胞,其中所述细胞表达所述目标重组蛋白;以及(c)收获由所述细胞产生的目标重组蛋白的制剂。在一个方面,目标重组蛋白是抗vegf蛋白。在一个特定方面,抗vegf蛋白选自由阿柏西普和重组minitrap(其实例在美国专利第7,279,159号中公开)、阿柏西普scfv和其他抗vegf蛋白组成的组。在一个优选的方面,目标重组蛋白是阿柏西普。15.在本实施方案的一个方面,阿柏西普在合适的宿主细胞中表达。此类宿主细胞的非限制性实例包括但不限于cho、chok1、ns0、sp2/0、胚胎肾细胞和bhk。16.合适的cdm包括杜尔贝科改良伊格尔(dulbecco'smodifiedeagle's,dme)培养基、汉氏营养混合物(ham'snutrientmixture)、excell培养基和ischo-cd培养基。本领域技术人员已知的其他cdm也涵盖在本发明的范围内。在一个特定方面,合适的cdm是cdm1b(regeneron)或excell高级培养基(safc)。17.在一个实施方案中,使来自包含阿柏西普的cdm培养物的澄清收获物样品经历捕获色谱程序。在一个方面,捕获步骤是使用例如蛋白a的亲和色谱程序。在另一方面,亲和程序的洗脱液呈现出某种颜色,例如,洗脱液可呈现出黄棕色。如在下文更详细地描述,颜色可使用以下手段来评价:(i)欧洲颜色标准“by”,其中进行定性目视检查;或(ii)比色测定,ciel*,a*,b*(或cielab),其比by系统更具量化性。然而,无论哪种情况,都应针对蛋白质浓度将多个样品之间的颜色评价进行归一化,以确保有意义的评价。例如,参看下文实施例9,蛋白a洗脱液具有约2.52的“b*”值,相当于大约by5的by值(于蛋白a洗脱液中以5g/l的蛋白质浓度测量)。如果要将蛋白a洗脱液的颜色与另一样品进行比较,则应针对相同蛋白质浓度进行比较。cielab颜色空间的b*值用于表示样品的着色,并覆盖蓝色(-)至黄色( )。样品的b*值比另一样品越高,表明样品中的黄棕色着色比另一样品越强。18.在一个实施方案中,使用cdm由经基因工程化以表达阿柏西普的宿主细胞产生阿柏西普。在一个方面,还产生阿柏西普的其他种类或变体。此类变体包括包含一个或多个经氧化氨基酸残基的阿柏西普同功型,统称为氧代变体(oxo-variant)。使用包含阿柏西普以及其氧代变体的cdm产生的澄清收获物样品可经历捕获色谱程序。在一个方面,捕获步骤是使用例如蛋白a柱的亲和色谱程序。当使用例如液相色谱-质谱法(lc-ms)分析从亲和洗脱液中提取的样品(其可显示或不显示黄棕色)时,可检测到阿柏西普的一种或多种氧化变体。显示经修饰的阿柏西普的某些氨基酸残基被氧化,包括但不限于组氨酸和/或色氨酸残基。在一个方面,变体可包括一个或多个甲硫氨酸残基以及其他残基的氧化,参见下文。19.在另一方面,变体可包括一个或多个色氨酸残基的氧化以形成n-甲酰犬尿氨酸。在另一方面,变体可包括一个或多个色氨酸残基的氧化以形成单羟基色氨酸。在一个特定方面,蛋白质变体可包括一个或多个色氨酸残基的氧化以形成二羟基色氨酸。在一个特定方面,蛋白质变体可包括一个或多个色氨酸残基的氧化以形成三羟基色氨酸。20.在另一方面,变体可包括一个或多个选自由以下组成的组的修饰:例如,一个或多个天冬酰胺的脱酰胺;一个或多个天冬氨酸转化为异天冬氨酸和/或asn;一个或多个甲硫氨酸的氧化;一个或多个色氨酸氧化为n-甲酰犬尿氨酸;一个或多个色氨酸氧化为单羟基色氨酸;一个或多个色氨酸氧化为二羟基色氨酸;一个或多个色氨酸氧化为三羟基色氨酸;一个或多个精氨酸的arg3-脱氧葡糖醛酮化(deoxyglucosonation);c末端甘氨酸的去除;以及一个或多个非糖基化糖位点(non-glycosylatedglycosite)的存在。21.在另一个实施方案中,本发明涉及用于产生阿柏西普的方法。在一个方面,包含阿柏西普及其变体的澄清收获物样品经历捕获步骤,例如蛋白a亲和色谱。在亲和步骤之后,亲和洗脱液可经历离子交换色谱。离子交换色谱可为阳离子交换色谱或阴离子交换色谱。混合模式或多模式色谱以及其他色谱程序也涵盖在本实施方案的范围内,下面将进一步论述。在一个特定方面,离子交换色谱是阴离子交换色谱(aex)。采用aex的合适条件包括但不限于ph值为约8.3至约8.6的tris盐酸盐。在使用例如ph值为约8.3至约8.6的tris盐酸盐进行平衡后,将样品加载至aex柱上。加载柱后,可使用例如平衡缓冲液将柱洗涤一次或多次。在一个特定方面,所用条件可促进阿柏西普及其氧化变体的差异色谱行为,使得可在流通级分中收集包含阿柏西普而无显著量的氧代变体的级分,同时显著部分的氧代变体保留在aex柱的固相上并且可在汽提柱后获得—参见下文实施例2,图11。参看图11和实施例2,可在不同产生步骤之间观察到氧代变体的变化。例如,可通过“色氨酸氧化水平(%)”部分(特别是“w138( 16)”柱)中的数据来说明此变化。可观察到,在aex色谱(aex分离2)后,氧代变体(具体来说,氧代色氨酸)从加载样品中的约0.131%变为流通样品中的约0.070%,表明使用aex减少了阿柏西普的氧代变体。22.可使用离子交换来减弱或最小化颜色。在本实施方案的一个方面,使澄清收获物样品经历捕获色谱,例如使用蛋白a亲和色谱。亲和柱经洗脱并具有第一颜色,所述颜色具有为其赋予的特定by和/或b*值。这种蛋白a洗脱液接着经历离子交换色谱,例如阴离子交换色谱(aex)。洗涤离子交换柱,并收集流通液,所述流通液具有第二颜色,所述颜色具有为其赋予的特定by和/或b*值。在一个特定方面,第一颜色的颜色值(“by”或“b*”)与第二颜色的颜色值不同。在另一方面,如由相应by和/或b*值所反映,与aex流通液的第二颜色相比,蛋白a洗脱液的第一颜色具有更黄棕色的颜色。通常,与蛋白a洗脱液的第一颜色相比,aex之后的第二颜色的黄棕色减弱。例如,使用阴离子交换将蛋白a洗脱液样品中观察到的黄棕色从约3.06的b*值(第一颜色)减弱至aex之后的约0.96(第二颜色)—参见下文实施例2,表2-3。23.在实施方案的一个方面,用于aex柱的平衡缓冲液和洗涤缓冲液的ph值均可为约8.30至约8.60。在另一方面,用于aex柱的平衡缓冲液和洗涤缓冲液的电导率均可为约1.50至约3.00ms/cm。24.在实施方案的一个方面,平衡缓冲液和洗涤缓冲液可为约50mmtris盐酸盐。在一个方面,汽提缓冲液包含2m氯化钠或1n氢氧化钠或两者(参见表2-2)。25.本实施方案可包括不以特定顺序添加一个或多个步骤,例如疏水相互作用色谱(hic)、亲和色谱、多模式色谱、病毒灭活(例如,使用低ph值)、病毒过滤和/或超滤/渗滤以及其他熟知的色谱步骤。26.在一个实施方案中,抗vegf蛋白在如下一个或多个天冬酰胺处被糖基化:g0-glcnac糖基化;g1-glcnac糖基化;g1s-glcnac糖基化;g0糖基化;g1糖基化;g1s糖基化;g2糖基化;g2s糖基化;g2s2糖基化;g0f糖基化;g2f2s糖基化;g2f2s2糖基化;g1f糖基化;g1fs糖基化;g2f糖基化;g2fs糖基化;g2fs2糖基化;g3fs糖基化;g3fs3糖基化;g0-2glcnac糖基化;man4糖基化;man4_a1g1糖基化;man4_a1g1s1糖基化;man5糖基化;man5_a1g1糖基化;man5_a1g1s1糖基化;man6糖基化;man6_g0 磷酸糖基化;man6 磷酸糖基化;和/或man7糖基化。在一个方面,抗vegf蛋白可为阿柏西普、抗vegf抗体或vegfminitrap。27.在一个方面,抗vegf蛋白的组合物的糖基化谱如下:约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约6%至约15%甘露糖-5和约60%至约79%半乳糖基化聚糖(参见实施例6)。在一个方面,抗vegf蛋白在约32.4%天冬酰胺123残基和/或约27.1%天冬酰胺196残基处具有man5糖基化。28.在一个实施方案中,所述方法还可包括使用药学上可接受的赋形剂配制原料药。在实施方案的一个方面,药学上可接受的赋形剂可选自以下:水、缓冲剂、糖、盐、表面活性剂、氨基酸、多元醇、螯合剂、乳化剂和防腐剂。本领域技术人员熟知的其他赋形剂在此实施方案的范围内。29.在实施方案的一个方面,制剂可适于向人类受试者施用。特别是,可通过玻璃体内注射实现施用。在一个方面,制剂可具有约40至约200mg/ml目标蛋白质。30.制剂可用作治疗或预防血管生成性眼部病症的方法,所述病症可包括:年龄相关的黄斑变性(例如,湿性或干性)、黄斑水肿、视网膜静脉阻塞后的黄斑水肿、视网膜静脉阻塞(rvo)、视网膜中央静脉阻塞(crvo)、视网膜分支静脉阻塞(brvo)、糖尿病性黄斑水肿(dme)、脉络膜新生血管形成(cnv)、虹膜新生血管形成、新生血管性青光眼、青光眼手术后纤维化、增生性玻璃体视网膜病(pvr)、视盘新生血管形成、角膜新生血管形成、视网膜新生血管形成、玻璃体新生血管形成、角膜翳、翼状胬肉、血管性视网膜病、在患有糖尿病性黄斑水肿的受试者中的糖尿病性视网膜病;或糖尿病性视网膜病(例如非增生性糖尿病性视网膜病(例如,以约47或53的糖尿病性视网膜病严重程度量表(drss)分级为特征),或增生性糖尿病性视网膜病;例如,在不患有dme的受试者中)。31.vegfminitrap的产生32.本公开描述阿柏西普的修饰形式的产生,其中fc部分被去除或不存在,并且被称为阿柏西普minitrap或vegfminitrap。这种minitrap可在包括化学成分确定的培养基(cdm)或大豆水解物培养基的细胞培养基中产生。33.在一个实施方案中,使用cdm产生minitrap。在minitrap产生的一个方面,使用合适的宿主并且在合适的条件下产生全长阿柏西普,并进一步加工从而通过酶促去除fc部分产生minitrap。或者,可使用合适的宿主细胞在合适的条件下产生编码minitrap的基因(例如,编码缺少其fc部分的阿柏西普的核苷酸序列)。34.在一个实施方案中,用于制造minitrap的方法包括产生全长阿柏西普融合蛋白,接着切割fc区。在一个方面,所述方法涉及产生重组蛋白,即全长阿柏西普融合蛋白(参见美国专利第7,279,159号,其全部教导通过引用并入本文),包含:(a)提供经基因工程化以表达全长阿柏西普的宿主细胞;(b)在合适的条件下在cdm中培养所述宿主细胞,其中所述细胞表达全长阿柏西普;(c)收获由所述细胞产生的所述全长阿柏西普的制剂;以及(d)对所述全长阿柏西普进行酶切割,所述酶切割对去除融合蛋白的fc部分具有特异性。在另一方面,在本领域技术人员熟知的合适条件下,由合适的宿主细胞表达编码阿柏西普减去其fc部分的核苷酸序列(参见美国专利第7,279,159号)。35.在本实施方案的一个方面,阿柏西普在合适的宿主细胞中表达。此类宿主细胞的非限制性实例包括但不限于cho、chok1、ns0、sp2/0、胚胎肾细胞和bhk。36.合适的cdm包括杜尔贝科改良伊格尔(dme)培养基、汉氏营养混合物、ex-cell培养基(safc)和ischo-cd培养基(irvine)。本领域技术人员已知的其他cdm也涵盖在本发明的范围内。在一个特定方面,合适的cdm是cdm1b(regeneron)或excell培养基(safc)。37.在一个方面,在产生minitrap期间,包含目标蛋白质(即,阿柏西普融合蛋白和/或minitrap)以及其变体(包括氧代变体)的样品可呈现出某些颜色特性-黄棕色。例如,来自亲和色谱步骤的洗脱液样品可呈现使用by和/或b*系统测量的某种黄棕色(参见下文实施例2和9)。“样品”的示例性来源可包括亲和色谱,例如蛋白a洗脱液;样品可从离子交换色谱的流通级分获得;其还可从离子交换柱的汽提获得—在产生过程中存在本领域技术人员熟知的可由此分析样品的其他来源。如上文所提及并且在下文中进一步描述,颜色可使用以下手段来评价:(i)欧洲颜色标准“by”,其中进行定性目视检查;或(ii)比色测定,cielab,其比by系统更具量化性。然而,无论哪种情况,都应例如使用蛋白质浓度对多个样品之间的颜色评价进行归一化,以确保样品之间有意义的评价。38.在本实施方案的一个方面,可例如使用采用蛋白酶或其酶活性变体的蛋白水解消化对全长阿柏西普融合蛋白进行酶处理(“切割活性”)以产生vegfminitrap。在此实施方案的一个方面,蛋白酶可为酿脓链球菌(streptococcuspyogenes)的免疫球蛋白降解酶(ides)。在另一方面,蛋白酶可为凝血酶胰蛋白酶、胞内蛋白酶arg-c、胞内蛋白酶asp-n、胞内蛋白酶glu-c、外膜蛋白酶t(ompt)、ides、胰凝乳蛋白酶、胃蛋白酶、嗜热菌蛋白酶、木瓜蛋白酶、链霉蛋白酶或来自佐氏曲霉(aspergillussaitoi)的蛋白酶。在一个方面,蛋白酶可为半胱氨酸蛋白酶。在实施方案的一个特定方面,蛋白酶可为ides。在另一方面,蛋白酶可为ides的变体。ides变体的非限制性实例在下文中描述,并且包括具有由以下组成的组中列出的氨基酸序列的多肽:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一个方面,蛋白酶可固定在琼脂糖或另一种合适的基质上。39.在一个方面,使用cdm产生目标蛋白质(连同其变体)。在一个特定方面,目标蛋白质包括阿柏西普或minitrap。变体包含一个或多个被氧化的氨基酸残基,统称为氧代变体。氧化残基的实例包括但不限于一个或多个组氨酸和/或色氨酸残基,也已使用lc-ms检测到其他氧化残基并且在下文中描述,例如氧化甲硫氨酸。后续色谱法例如aex可用于将给定样品中的这些氧代变体与目标蛋白质分离,并且在本文中描述。40.在一个方面,变体可包括一个或多个色氨酸残基的氧化以形成n-甲酰犬尿氨酸。在另一方面,变体可包括一个或多个色氨酸残基的氧化以形成单羟基色氨酸。在一个特定方面,蛋白质变体可包括一个或多个色氨酸残基的氧化以形成二羟基色氨酸。在一个特定方面,蛋白质变体可包括一个或多个色氨酸残基的氧化以形成三羟基色氨酸。41.在另一方面,氧代变体可包括一种或多种选自由以下组成的组的修饰:一个或多个天冬酰胺残基的脱酰胺;一个或多个天冬氨酸转化为异天冬氨酸和/或asn;一个或多个甲硫氨酸残基的氧化;一个或多个色氨酸残基的氧化以形成n-甲酰犬尿氨酸;一个或多个色氨酸残基的氧化以形成单羟基色氨酸;一个或多个色氨酸残基的氧化以形成二羟基色氨酸;一个或多个色氨酸残基的氧化以形成三羟基色氨酸;一个或多个精氨酸残基的arg3-脱氧葡糖醛酮化;c末端甘氨酸的去除;以及一个或多个非糖基化糖位点的存在。42.在一个实施方案中,制造minitrap蛋白的方法包括(a)在第一色谱平台上捕获全长阿柏西普融合蛋白,以及(b)切割阿柏西普,从而形成minitrap蛋白,即缺少其fc结构域的阿柏西普。在一个方面,第一色谱支撑物包含亲和色谱介质、离子交换色谱介质或疏水相互作用色谱介质。在一个特定方面,第一色谱平台包含亲和色谱平台,例如蛋白a。在另一方面,将捕获步骤(a)的蛋白质从第一色谱平台中洗脱出,之后是切割步骤(b)。在再一个方面,切割步骤(b)之后是第二捕获步骤。在一个特定方面,此第二捕获步骤可通过亲和色谱例如蛋白a亲和色谱来促进。此第二捕获步骤的流通液(包含minitrap)具有第一颜色,例如黄棕色,并且经测量具有特定的by和/或b*值—参见例如下文实施例9。另外,此第二捕获流通液的lc-ms分析可证明存在氧代变体,其中minitrap的一个或多个残基被氧化(参见下文实施例9)。43.在另一方面,第二捕获流通液可经历离子交换色谱,例如aex。可使用合适的缓冲液洗涤此aex柱,并且可收集基本上包含minitrap的aex流通级分。此aex流通级分可具有第二颜色,所述颜色具有黄棕色着色,具有特定的by和/或b*值。在另一方面,如通过by和/或b*系统所测量,第一颜色(来自第二捕获步骤的流通液)与第二颜色(离子交换程序的流通液)具有不同颜色。在一个方面,与第一颜色相比,在aex之后,使用by和/或b*值测得的第二颜色显示出减弱的黄棕色。44.在另一个实施方案中,步骤(b)的切割活性可使用色谱柱进行,其中将切割活性,例如酶活性附着或固定在柱基质上。步骤(b)中使用的柱可包含一种或多种已经提到并且在下文更充分描述的蛋白酶。45.在一个实施方案中,离子交换色谱程序可包含阴离子交换(aex)色谱介质。在另一方面,离子交换色谱介质包含阳离子交换(cex)色谱介质。采用aex的合适条件包括但不限于ph值为约8.3至约8.6的tris盐酸盐。在使用例如ph值为约8.3至约8.6的tris盐酸盐进行平衡后,将样品加载至aex柱上。加载柱后,可使用例如平衡缓冲液将柱洗涤一次或多次。在一个特定方面,所用条件可促进使用aex的minitrap及其氧代变体的差异色谱行为,从而使minitrap基本上位于流通级分中,而氧代变体则基本上保留在aex柱上并可通过汽提柱而收集(参见下文实施例9)。46.在一个实施例中,分析来自不同产生阶段的样品的颜色和氧代变体的存在。参看实施例9,亲和流通池(来自第二蛋白a亲和步骤的流通液)具有约1.58的第一b*值(参见表9-3)。使此第二亲和流通液经历aex。aex流通液具有约0.50的第二b*值,表明使用aex后黄棕色显著减弱。aex柱的汽提产生汽提样品并且观察到约6.10的第三b*值,表明与加载液或流通液相比,此汽提样品具有更黄棕色的颜色。47.再次参看实施例9,还进行了氧代变体分析。所分析的样品是亲和流通池(第二蛋白a亲和洗脱液)、aex流通液和aex汽提液。参看表9-5和表9-6,可在不同产生步骤之间观察到氧代变体的变化。例如,可通过“色氨酸氧化水平(%)”部分(具体来说,“w58( 16)”柱)中的数据来说明此变化。可观察到,在aex色谱之后,氧代变体(具体来说,氧代色氨酸)从加载样品中的约0.055%变为流通样品中的约0.038%,表明在aex之后氧代变体减少。分析aex汽提液,并且发现氧代色氨酸种类的百分比为约0.089%。当将此汽提值与加载液(以及流通液)进行比较时,似乎此氧代变体的很大一部分保留在aex柱上。48.本实施方案可包括不以特定顺序添加一个或多个步骤,例如疏水相互作用色谱、亲和色谱、多模式色谱、病毒灭活(例如,使用低ph值)、病毒过滤和/或超滤/渗滤。49.本发明的一个实施方案涉及一种再生包含树脂的色谱柱的方法。在实施方案的一个方面,树脂具有固定的水解剂。在实施方案的又一个方面,树脂包含固定的蛋白酶。在实施方案的再一个方面,树脂是树脂或所述树脂的突变体。在实施方案的一个方面,再生包含树脂的柱的方法提高树脂的反应效率。50.在实施方案的一个方面,再生包含树脂的柱的方法包括将柱树脂与乙酸一起温育。在一个方面,所用乙酸的浓度为约0.1m至约2m。在一个方面,乙酸浓度为约0.5m。在一个方面,将树脂温育至少约10分钟。在另一方面,将树脂温育至少约30分钟。在此实施方案的又一方面,将树脂温育至少约50分钟。在此实施方案的又一方面,将树脂温育至少约100分钟。在此实施方案的又一方面,将树脂温育至少约200分钟。在此实施方案的又一方面,将树脂温育至少约300分钟。51.任选地,将柱树脂进一步与胍盐酸盐(gu-hcl)一起温育。在一个方面,使用不含乙酸的gu-hcl再生柱树脂。所用gu-hcl的浓度为约1n至约10n。在另一方面,gu-hcl的浓度为约6n。在另一方面,柱树脂可与再生剂(乙酸、gu-hcl)一起温育至少约10分钟。在又一方面,将树脂温育至少约30分钟。在再一方面,将树脂温育至少约50分钟。在又一方面,将所述树脂温育至少约100分钟。52.在一个实施方案中,将包含树脂的柱储存在乙醇中。在一个方面,将柱储存在乙醇中,其中乙醇百分比为约5%v/v至约20%v/v。在一个特定方面,使用20%v/v乙醇储存柱。53.在一个实施方案中,所述方法还可包括使用药学上可接受的赋形剂配制vegfminitrap。在一个方面,药学上可接受的赋形剂可选自以下:水、缓冲剂、糖、盐、表面活性剂、氨基酸、多元醇、螯合剂、乳化剂和防腐剂。本领域技术人员熟知的其他赋形剂在此实施方案的范围内。54.本发明的制剂适于向人类受试者施用。在本实施方案的一个方面,可通过玻璃体内注射实现施用。在一个方面,制剂可具有约40至约200mg/ml目标蛋白质。在一个特定方面,目标蛋白质是阿柏西普或阿柏西普minitrap。55.制剂可用于治疗或预防血管生成性眼部病症的方法中,所述病症可包括:年龄相关的黄斑变性(例如,湿性或干性)、黄斑水肿、视网膜静脉阻塞后的黄斑水肿、视网膜静脉阻塞(rvo)、视网膜中央静脉阻塞(crvo)、视网膜分支静脉阻塞(brvo)、糖尿病性黄斑水肿(dme)、脉络膜新生血管形成(cnv)、虹膜新生血管形成、新生血管性青光眼、青光眼手术后纤维化、增生性玻璃体视网膜病(pvr)、视盘新生血管形成、角膜新生血管形成、视网膜新生血管形成、玻璃体新生血管形成、角膜翳、翼状胬肉、血管性视网膜病、在患有糖尿病性黄斑水肿的受试者中的糖尿病性视网膜病;或糖尿病性视网膜病(例如非增生性糖尿病性视网膜病(例如,以约47或53的糖尿病性视网膜病严重程度量表(drss)分级为特征),或增生性糖尿病性视网膜病;例如,在不患有dme的受试者中)。56.ides的变体57.本公开描述了使用ides(fabricator)(seqidno.:1)或作为ides变体(seqidno.:2至16)的其他多肽来产生vegfminitrap。ides(seqidno.:1)在位置87、130、182和/或274处包括天冬酰胺残基(在以下seqidno.:1中显示为粗体且斜体的“n*”)。这些位置处的天冬酰胺可突变为除天冬酰胺以外的氨基酸,以形成ides变体(并且突变氨基酸显示为斜体且加下划线的氨基酸):58.seqidno.:1[0059][0060]seqidno.:2[0061][0062][0063]seqidno.:3[0064][0065]seqidno.:4[0066][0067]seqidno.:5[0068]mrkrcystsaavlaavtlfvlsvdrgviadsfsanqeirysevtpyhvtsvwtkgvtppanftqgedvfhapyvanqgwyditktfn*gkddllcgaatagnmlhwwfdqnkdqikryleehpekqkinfn*geqmfdvkeaidtknhqldsklfeyfkekafpylstkhlgvfpdhvidmfin*gyrlsltnhgptpvkegskdprggifdavftrgdqsklltsrhdfkeknlkeisdlikkeltegkalglshtyanvrinhvinlwgadfdsdgnlkaiyvtdsdsnasigmkkyfvgvnsagkvaisakeikednigaqvlglftlstgqdswnqtn[0069]seqidno.:6[0070]mrkrcystsaavlaavtlfvlsvdrgviadsfsanqeirysevtpyhvtsvwtkgvtppanftqgedvfhapyvanqgwyditktfdgkddllcgaatagnmlhwwfdqnkdqikryleehpekqkinfrgeqmfdvkeaidtknhqldsklfeyfkekafpylstkhlgvfpdhvidmfin*gyrlsltnhgptpvkegskdprggifdavftrgdqsklltsrhdfkeknlkeisdlikkeltegkalglshtyanvrinhvinlwgadfdsn*gnlkaiyvtdsdsnasigmkkyfvgvnsagkvaisakeikednigaqvlglftlstgqdswnqtn[0071]seqidno.:7[0072][0073]seqidno.:8[0074][0075][0076]seqidno.:9[0077][0078]seqidno.:10[0079][0080]seqidno.:11[0081][0082][0083]seqidno.:12[0084][0085]seqidno.:13[0086][0087]seqidno.:14[0088][0089][0090]seqidno.:15[0091][0092]seqidno.:16[0093][0094]在一个实施方案中,多肽具有分离的氨基酸序列,其在如由以下组成的组中列出的分离的氨基酸序列的全长上包含至少70%序列同一性:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一个方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约80%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约90%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有约100%序列同一性。在一个方面,多肽能够将靶蛋白切割成片段。在一个特定方面,靶蛋白是igg。在另一方面,靶蛋白是融合蛋白。在又一方面,片段可包含fab片段和/或fc片段。[0095]seqid1,no.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。[0096]本公开还包括一种分离的核酸分子,其编码具有分离的氨基酸序列的多肽,所述氨基酸序列在如由以下组成的组中列出的分离的氨基酸序列的全长上包含至少70%序列同一性:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一个方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约80%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约90%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有约100%序列同一性。在一个方面,多肽能够将靶蛋白切割成片段。在一个特定方面,靶蛋白是igg。在另一个特定方面,靶蛋白是融合蛋白。在又一个特定方面,片段可包含fab片段和/或fc片段。[0097]本公开还包括一种载体,所述载体包含编码具有分离的氨基酸序列的多肽的核酸,所述氨基酸序列在如由以下组成的组中列出的分离的氨基酸序列的全长上具有至少70%序列同一性:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一个方面,核酸分子与表达控制序列可操作地连接,所述表达控制序列能够指导其在宿主细胞中的表达。在一个方面,载体可为质粒。在一个方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约80%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约90%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有约100%序列同一性。在一个方面,多肽能够将靶蛋白切割成片段。在一个特定方面,靶蛋白是igg。在另一方面,靶蛋白是融合蛋白。在又一方面,片段可包含fab片段和/或fc片段。[0098]在一个实施方案中,经分离的氨基酸可包含由seqidno.:1定义的亲本氨基酸序列,其在位置87、130、182和/或274处的天冬酰胺残基突变为除天冬酰胺以外的氨基酸。在一个方面,与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高。在另一方面,与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高50%。在一个方面,氨基酸可选自天冬氨酸、亮氨酸和精氨酸。在一个特定方面,位置87处的天冬酰胺残基突变为天冬氨酸残基。在另一方面,位置130处的天冬酰胺残基突变为精氨酸残基。在又一方面,位置182处的天冬酰胺残基突变为亮氨酸残基。在又一方面,位置274处的天冬酰胺残基突变为天冬氨酸残基。在又一方面,位置87和130处的天冬酰胺残基经突变。在又一方面,位置87和182处的天冬酰胺残基经突变。在又一方面,位置87和274处的天冬酰胺残基经突变。在又一方面,位置130和182处的天冬酰胺残基经突变。在又一方面,位置130和274处的天冬酰胺残基经突变。在又一方面,位置182和274处的天冬酰胺残基经突变。在又一方面,位置87、130和182处的天冬酰胺残基经突变。在又一方面,位置87、182和274处的天冬酰胺残基经突变。在又一方面,位置130、182和274处的天冬酰胺残基经突变。在又一方面,位置87、130、182和274处的天冬酰胺残基经突变。[0099]在一个相关实施方案中,本公开包括一种分离的核酸分子,其编码具有分离的氨基酸序列的多肽,所述氨基酸序列包含由seqidno.:1定义的亲本氨基酸序列,其在位置87、130、182和/或274处的天冬酰胺残基突变为除天冬酰胺以外的氨基酸—参见上文。与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高。[0100]在另一个相关实施方案中,本公开包括一种载体,其包含编码具有分离的氨基酸序列的多肽的核酸分子,所述氨基酸序列包含由seqidno.:1定义的亲本氨基酸序列,其在位置87、130、182和/或274处的天冬酰胺残基突变为除天冬酰胺以外的氨基酸—参见上文。与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高。在一个方面,核酸分子与表达控制序列可操作地连接,所述表达控制序列能够指导其在宿主细胞中的表达。在一个方面,载体可为质粒。[0101]基于亲和力的产生[0102]本公开还提供了使用亲和色谱在抗vegf蛋白产生期间减少宿主细胞蛋白以及其他不期望的蛋白质和核酸的方法。[0103]在一个实施方案中,产生重组蛋白的方法包括:(a)提供经基因工程化以表达目标重组蛋白的宿主细胞;(b)在所述宿主细胞表达所述目标重组蛋白的合适条件下培养所述宿主细胞;以及(c)收获由所述细胞产生的目标重组蛋白的制剂。在一个方面,目标重组蛋白是抗vegf蛋白。在一个特定方面,抗vegf蛋白选自由以下组成的组:阿柏西普、minitrap、重组minitrap(其实例在美国专利第7,279,159号中公开)、scfv和其他抗vegf蛋白。[0104]在本实施方案的一个方面,目标重组蛋白在合适的宿主细胞中表达。合适的宿主细胞的非限制性实例包括但不限于cho、chok1、ns0、sp2/0、胚胎肾细胞和bhk。[0105]在本实施方案的一个方面,目标重组蛋白在cdm中培养。合适的cdm包括杜尔贝科改良伊格尔(dme)培养基、汉氏营养混合物、excell培养基、ischo-cd培养基和cdm1b。本领域技术人员已知的其他cdm也涵盖在本发明的范围内。[0106]除了目标重组蛋白外,产生制剂还可包含至少一种污染物,包括一种或多种宿主细胞蛋白。所述至少一种污染物可源自细胞底物、细胞培养物或下游工艺。[0107]在一个实施方案中,本发明涉及使用亲和色谱从生物样品产生抗vegf蛋白的方法。在一个特定方面,本文所公开的方法可用于将抗vegf蛋白与一种或多种宿主细胞蛋白和在抗vegf蛋白的培养产生过程中形成的核酸(例如dna)至少部分地分离。[0108]在一个方面,所述方法可包括在合适的条件下对包含抗vegf蛋白以及伴随污染物的生物样品进行亲和色谱。在一个特定方面,亲和色谱可包含能够选择性或特异性地结合至抗vegf蛋白(“捕获”)的材料。此色谱材料的非限制性实例包括:蛋白a、蛋白g、包含例如能够结合至抗vegf蛋白的蛋白质的色谱材料以及包含fc结合蛋白的色谱材料。在一个具体方面,能够与抗vegf蛋白结合或相互作用的蛋白质可为抗体、融合蛋白或其片段。能够选择性或特异性地结合至抗vegf蛋白的此类材料的非限制性实例描述于实施例7中。[0109]在本实施方案的一个方面,所述方法可包括使包含抗vegf蛋白和一种或多种宿主细胞蛋白/污染物的生物样品在合适的条件下进行亲和色谱,其中亲和色谱固定相包含能够选择性或特异性地结合至抗vegf蛋白的蛋白质。在一个特定方面,蛋白质可为抗体、融合蛋白、scfv或抗体片段。在一个具体方面,蛋白质可为vegf165、vegf121、来自其他物种例如兔的vegf形式。例如,如表7-1和表7-10中所示例,使用vegf165作为能够选择性或特异性地与抗vegf蛋白结合或相互作用的蛋白质可成功地产生mt5(抗vegf蛋白)、阿柏西普和抗vegfscfv片段。在另一具体方面,蛋白质可为一种或多种具有如seqidno.:73-80中所示的氨基酸序列的蛋白质。表7-1还公开使用具有如seqidno.:73-80中所示的氨基酸序列的蛋白质作为能够选择性或特异性地结合至抗vegf蛋白(mt5)的蛋白质成功产生mt5。[0110]在本实施方案的一个方面,所述方法可包括使包含抗vegf蛋白和一种或多种宿主细胞蛋白/污染物的生物样品在合适的条件下进行亲和色谱,其中亲和色谱固定相包含能够选择性或特异性地与抗vegf蛋白结合或相互作用的蛋白质,其中抗vegf蛋白可选自阿柏西普、vegfminitrap或抗vegf抗体。在一个特定方面,vegfminitrap可获自vegf受体组分;此外,其可通过在宿主细胞中重组表达vegfminitrap而形成。执行所述方法可减少样品中一种或多种宿主细胞蛋白的量。例如,图35a和图35b显示在使用包含以下作为能够选择性或特异性地结合至mt5的不同蛋白质的五种不同亲和色谱柱时,包含mt5(抗vegf蛋白)的样品中的总宿主细胞蛋白的显著减少:(i)vegf165(seqidno.:72);(ii)mab1(小鼠抗vegfr1mab人类igg1,其中seqidno.:73是重链,而seqidno.:74是轻链);(iii)mab2(小鼠抗vegfr1mab人类igg1,其中seqidno.:75是重链,而seqidno.:76是轻链);(iv)mab3(小鼠抗vegfr1mab小鼠igg1,其中seqidno.:77是重链,而seqidno.:78是轻链)以及(v)mab4(小鼠抗vegfr1mab小鼠igg1,其中seqidno.:79是重链,而seqidno.:80是轻链)。如图35a和图35b所见,来自每个基于亲和力的产生过程的洗脱液将宿主细胞蛋白从7000ppm以上分别降至约25ppm和约55ppm。[0111]使用亲和色谱的合适条件可包括但不限于使用平衡缓冲液来平衡亲和色谱柱。在使用例如ph值为约8.3至约8.6的tris盐酸盐进行平衡后,将生物样品加载至亲和色谱柱上。加载柱后,可使用例如平衡缓冲液(例如杜尔贝科磷酸盐缓冲盐水(dpbs))将柱洗涤一次或多次。在洗脱柱之前,可使用其他洗涤,包括采用不同缓冲液的洗涤。柱洗脱可受到缓冲液类型以及ph值和电导率的影响,可采用本领域技术人员熟知的其他洗脱条件。使用一种或多种类型的洗脱缓冲液(例如,ph值为约2.0至约3.0的甘氨酸)进行洗脱后,可通过添加中和缓冲液(例如,ph7.5的1mtris)来中和洗脱级分。[0112]在实施方案的一个方面,洗涤缓冲液和平衡缓冲液的ph值均可为约7.0至约8.6。在实施方案的一个方面,洗涤缓冲液可为dpbs。在一个方面,洗脱缓冲液可包含100mm甘氨酸缓冲液,ph值为约2.5。在另一方面,洗脱缓冲液可为ph值为约2.0至约3.0的缓冲液。在一个方面,中和缓冲液可包含1mtris,ph值为约7.5。[0113]在本实施方案的一个方面,所述方法还可包括用洗涤缓冲液洗涤柱。在本实施方案的一个方面,所述方法还可包括用洗脱缓冲液洗脱柱以获得洗脱级分。在一个特定方面,与生物样品中的宿主细胞蛋白的量相比,洗脱级分中的宿主细胞蛋白的量显著减少,例如,减少了约70%、约80%、90%、约95%、约98%或约99%。[0114]本实施方案可包括不以特定顺序添加一个或多个步骤,例如疏水相互作用色谱、基于亲和力的色谱、多模式色谱、病毒灭活(例如,使用低ph值)、病毒过滤和/或超滤/渗滤。[0115]在一个方面,抗vegf蛋白的组合物的糖基化谱如下:约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约6%至约15%甘露糖-5和约60%至约79%半乳糖基化聚糖。[0116]在此实施方案的一个方面,抗vegf蛋白在约32.4%天冬酰胺123残基和/或约27.1%天冬酰胺196残基上具有man5糖基化。在一个特定实施方案中,抗vegf蛋白可为阿柏西普、抗vegf抗体或vegfminitrap。[0117]在一个实施方案中,所述方法还可包括使用药学上可接受的赋形剂配制原料药。在一个方面,药学上可接受的赋形剂可选自以下:水、缓冲剂、糖、盐、表面活性剂、氨基酸、多元醇、螯合剂、乳化剂和防腐剂。本领域技术人员熟知的其他赋形剂在此实施方案的范围内。[0118]在实施方案的一个方面,制剂可适于向人类受试者施用。在本实施方案的一个方面,可通过玻璃体内注射实现施用。在一个方面,制剂可具有约40至约200mg/ml目标蛋白质。在一个特定方面,目标蛋白质可为阿柏西普、抗vegf抗体或vegfminitrap。[0119]制剂可用于治疗或预防血管生成性眼部病症的方法中,所述病症可包括:年龄相关的黄斑变性(例如,湿性或干性)、黄斑水肿、视网膜静脉阻塞后的黄斑水肿、视网膜静脉阻塞(rvo)、视网膜中央静脉阻塞(crvo)、视网膜分支静脉阻塞(brvo)、糖尿病性黄斑水肿(dme)、脉络膜新生血管形成(cnv)、虹膜新生血管形成、新生血管性青光眼、青光眼手术后纤维化、增生性玻璃体视网膜病(pvr)、视盘新生血管形成、角膜新生血管形成、视网膜新生血管形成、玻璃体新生血管形成、角膜翳、翼状胬肉、血管性视网膜病、在患有糖尿病性黄斑水肿的受试者中的糖尿病性视网膜病;或糖尿病性视网膜病(例如非增生性糖尿病性视网膜病(例如,以约47或53的糖尿病性视网膜病严重程度量表(drss)分级为特征)或增生性糖尿病性视网膜病;例如,在不患有dme的受试者中)。[0120]氧代种类的合成[0121]本发明的一个实施方案涉及一种或多种使用光来合成被氧化的蛋白质种类的方法。在本实施方案的一个方面,目标蛋白质是抗vegf蛋白。在一个特定方面,抗vegf蛋白是阿柏西普。在另一方面,抗vegf蛋白是包括重组vegfminitrap的vegfminitrap。在本实施方案的又一个方面,抗vegf蛋白是单链可变片段(scfv)。[0122]在本实施方案的一个方面,样品包含目标蛋白质,例如阿柏西普融合蛋白,具有最少或没有氧代变体。对样品进行光应力处理以合成阿柏西普的氧化种类。在一个特定方面,通过使用冷白光对样品进行光应力处理。在另一个特定方面,通过使用紫外光对样品进行光应力处理。[0123]在实施方案的一个具体方面,将包含阿柏西普或另一种抗vegf蛋白的样品暴露于冷白光约30小时至约300小时,从而造成经修饰的寡肽增加约1.5至约50倍。这些肽经酶消化并分析,包含选自由以下组成的组的一者或多者:[0124]dkth*tc*ppc*papellg(seqidno.:17)、eiglltc*eatvngh*lyk(seqidno.:18)、qtntiidvvlspsh*gielsvgek(seqidno.:19)、telnvgidfnweypsskh*qhk(seqidno.:20)、tnylth*r(seqidno.:21)、sdtgrpfvemyseipeiih*mtegr(seqidno.:22)、vh*ekdk(seqidno.:23)、sdtgrpfvem*yseipeiihmtegr(seqidno.:64)、sdtgrpfvemyseipeiihm*tegr(seqidno.:65)、tqsgsem*k(seqidno.:66)、sdqglytc*aassglm*tk(seqidno.:67)、iiw*dsr/riiw*dsr/iiw*dsrk(seqidno.:28)、telnvgidfnw*eypssk(seqidno.:29)、gfiisnaty*k(seqidno.:69)、kf*pldtlipdgk(seqidno.:70)、f*lstltidgvtr(seqidno.:32),其中h*是被氧化为2-氧代-组氨酸的组氨酸,其中c*是被羧甲基化的半胱氨酸,其中m*是被氧化的甲硫氨酸,其中w*是被氧化的色氨酸,其中y*是被氧化的酪氨酸,并且其中f*是被氧化的苯丙氨酸。可通过之前提及的蛋白酶例如胰蛋白酶来进行消化。可使用质谱法来分析寡肽。[0125]在实施方案的一个具体方面,将包含阿柏西普或其他抗vegf蛋白的样品暴露于紫外光约4小时至约40小时,从而造成经修饰的寡肽产物增加约1.5至约25倍(在进行消化时获得),其中样品包含一种或多种选自由以下组成的组的经修饰的寡肽:[0126]dkth*tc*ppc*papellg(seqidno.:17)、eiglltc*eatvngh*lyk(seqidno.:18)、qtntiidvvlspsh*gielsvgek(seqidno.:19)、telnvgidfnweypsskh*qhk(seqidno.:20)、tnylth*r(seqidno.:21)、sdtgrpfvemyseipeiih*mtegr(seqidno.:22)、vh*ekdk(seqidno.:23)、sdtgrpfvem*yseipeiihmtegr(seqidno.:64)、sdtgrpfvemyseipeiihm*tegr(seqidno.:65)、tqsgsem*k(seqidno.:66)、sdqglytc*aassglm*tk(seqidno.:67)、iiw*dsr/riiw*dsr/iiw*dsrk(seqidno.:28)、telnvgidfnw*eypssk(seqidno.:29)、gfiisnaty*k(seqidno.:69)、kf*pldtlipdgk(seqidno.:70)、f*lstltidgvtr(seqidno.:32),其中h*是被氧化为2-氧代-组氨酸的组氨酸,其中c*是被羧甲基化的半胱氨酸,其中m*是被氧化的甲硫氨酸,其中w*是被氧化的色氨酸,其中y*是被氧化的酪氨酸,并且其中f*是被氧化的苯丙氨酸。可通过之前提及的蛋白酶例如胰蛋白酶来进行消化。可使用质谱法来分析寡肽。[0127]最小化黄棕色的方法[0128]本公开提供了在cdm中产生的阿柏西普、minitrap等的产生期间减少黄棕色着色的方法。[0129]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,接着收获包含目标重组蛋白的制剂。在一个方面,目标重组蛋白是抗vegf蛋白。在一个特定方面,抗vegf蛋白选自由以下组成的组:阿柏西普、minitrap、重组minitrap(其实例在美国专利第7,279,159号中公开,所述专利通过引用整体并入本文)、scfv和其他抗vegf蛋白。在一个方面,所述方法可产生目标重组蛋白的制剂,其中所述制剂的颜色使用欧洲by方法或cielab方法(b*)来表征。另外,可使用例如lc-ms分析氧代变体的存在。[0130]在本实施方案的一个方面,减弱条件包括提高或降低一种或多种培养基组分(例如,氨基酸、金属或抗氧化物,包括盐和前体)的累积浓度,其对应于颜色以及阿柏西普和vegfminitrap的蛋白质变体的减少。氨基酸的非限制性实例包括丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸。在一个特定方面,减少半胱氨酸可有效减弱制剂的黄棕色。半胱氨酸浓度也可影响氧代变体。[0131]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普,以及收获由细胞产生的目标蛋白质的制剂,其中合适的条件部分地通过将cdm中半胱氨酸的累积浓度降低至小于或等于约10mm而获得。合适的培养基的实例包括但不限于cdm1b、excell等。如本文所用,术语“累积量”是指在细胞培养过程中添加至生物反应器中以形成cdm的特定组分的总量,包括在培养开始时添加的组分的量(在第0天的cdm)和后续添加的组分的量。当计算组分的累积量时,还包括在生物反应器产生之前(即,在第0天的cdm之前)添加至种菌培养物或接种物中的组分的量。累积量不受培养过程中组分随时间损失(例如,经由代谢或化学降解)的影响。因此,具有相同累积量的组分的两种培养物可能仍具有不同绝对水平,例如,如果在不同时间将组分添加至两种培养物中(例如,如果在一种培养物中,所有组分均在开始时添加,而在另一种培养物中,组分是随时间的推移而添加)。累积量也不受培养过程中组分随时间的原位合成(例如,经由代谢或化学转化)的影响。因此,具有相同累积量的给定组分的两种培养物可能仍具有不同绝对水平,例如,如果组分为经由生物转化过程在两种培养物的一者中原位合成。累积量可以例如组分的克数或摩尔数为单位表示。[0132]如本文所用,术语“累积浓度”是指组分的累积量除以生产批次开始时生物反应器中液体的体积,包括培养物中使用的任何接种物对起始体积的贡献。例如,如果生物反应器在生产批次开始时含有2升细胞培养基,并且在第0、1、2和3天添加1克的组分x,则第3天之后的累积浓度为2g/l(即4克除以2升)。如果在第4天向生物反应器中添加另外一升不含组分x的液体,则累积浓度将保持为2g/l。如果在第5天,从生物反应器中损失一些液体(例如,经由蒸发),则累积浓度将保持为2g/l。累积浓度可以例如克/升或摩尔/升为单位表示。[0133]在此实施方案的一个方面,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白;收获由细胞产生的蛋白质的制剂,其中通过将累积半胱氨酸浓度与累积总氨基酸浓度的比率从约1:10至1:29降至约1:50至约1:30来获得合适的条件。[0134]在一个实施方案中,所述方法包括(i)在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普,以及(ii)收获由细胞产生的目标重组蛋白的制剂,其中通过将cdm中的铁累积浓度降至小于约55.0μm来获得合适的条件。在此实施方案的一个方面,与通过其中cdm中的铁累积浓度大于约55.0μm的方法获得的制剂相比,通过此方法获得的制剂显示较弱的黄棕色。[0135]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普。所述方法还包括收获由细胞产生的目标重组蛋白的制剂,其中通过将cdm中的铜累积浓度降至小于或等于约0.8μm来获得合适的条件。在此实施方案的一个方面,与通过其中cdm中的铜累积浓度大于约0.8μm的方法获得的制剂相比,通过此方法获得的制剂显示较弱的黄棕色。[0136]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普;以及收获由细胞产生的目标重组蛋白的制剂,其中通过将cdm中的镍累积浓度降至小于或等于约0.40μm来获得合适的条件。在此实施方案的一个方面,与通过其中cdm中的镍累积浓度大于约0.40μm的方法获得的制剂相比,通过此方法获得的制剂显示较弱的黄棕色。[0137]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普。所述方法还包括收获由细胞产生的目标重组蛋白的制剂,其中通过将cdm中的锌累积浓度降至小于或等于约56μm来获得合适的条件。在此实施方案的一个方面,与通过其中cdm中的锌累积浓度大于约56μm的方法获得的制剂相比,通过此方法获得的制剂显示较弱的黄棕色。[0138]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普。所述方法还包括收获由细胞产生的目标重组蛋白的制剂,其中通过在cdm中针对单一抗氧化剂存在累积浓度约0.001mm至约10mm的抗氧化剂和如果在所述cdm中添加多种抗氧化剂则不大于约30mm的累积浓度来获得合适的条件。在此实施方案的一个方面,与通过其中在cdm中不存在累积浓度小于约0.01mm或大于约100mm的抗氧化剂的方法获得的制剂相比,通过此方法获得的制剂显示较弱的黄棕色。抗氧化剂的非限制性实例可为牛磺酸、次牛磺酸、甘氨酸、硫辛酸、谷胱甘肽、氯化胆碱、氢皮质酮、维生素c、维生素e、螯合剂、过氧化氢酶、s-羧甲基-l-半胱氨酸及其组合。螯合剂的非限制性实例包括金精三羧酸(ata)、去铁胺(dfo)、edta和柠檬酸盐。[0139]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普。所述方法还包括收获由细胞产生的目标重组蛋白的制剂,其中合适的条件包括具有以下的cdm:在所述cdm中小于约55μm的铁累积浓度;在所述cdm中小于或等于约0.8μm的铜累积浓度;在所述cdm中小于或等于约0.40μm的镍累积浓度;在所述cdm中小于或等于约56μm的锌累积浓度;在所述cdm中小于10mm的半胱氨酸累积浓度;和/或在所述cdm中对于单一抗氧化剂来说浓度为约0.001mm至约10mm的抗氧化剂和如果在所述cdm中添加多种抗氧化剂,则不大于约30mm的累积浓度。[0140]在本实施方案的一个方面,使用合适的条件获得的制剂造成阿柏西普和vegfminitrap的蛋白质变体减少至所需量的阿柏西普和vegfminitrap的蛋白质变体(称为阿柏西普和vegfminitrap的蛋白质变体的“目标值”)。在此实施方案的另一个方面,使用合适的条件获得的制剂造成当包括阿柏西普和vegfminitrap的变体的蛋白质制剂被归一化为5g/l或10g/l的浓度时,制剂的颜色减小至所需b*值或by值(分别称为“目标b*值”、“目标by值”)。在本实施方案的又一个方面,目标b*值(或目标by值)和/或变体的目标值可在效价增加或不明显减小的制剂中获得。[0141]当结合以下描述和附图考虑时,将更好地领会和理解本发明的这些和其他方面。以下描述虽然指示各种实施方案及其许多特定细节,但是借助于说明而非限制方式给出。可在本发明的范围内进行许多替代、修改、增加或重新布置。附图说明[0142]图1描绘使用一个示例性实施方案产生的vegfminitrap,其包括vegfr1(seqidno.:34)、vegfr2(seqidno.:36)、铰链结构域片段(seqidno.:60)和从阿柏西普切下的fc片段(seqidno.:55)。[0143]图2描绘所提出的组氨酸氧化为2-氧代-组氨酸(14da)的机制。[0144]图3描绘所提出的组氨酸氧化为2-氧代-组氨酸(16da)的机制。[0145]图4描绘所提出的色氨酸氧化为n-甲酰犬尿氨酸和犬尿氨酸的机制。[0146]图5描绘用于产生阿柏西普的一个示例性实施方案。[0147]图6描绘用于产生vegfminitrap的一个示例性实施方案。[0148]图7描绘用于产生阿柏西普的一个示例性实施方案。[0149]图8描绘用于产生vegfminitrap的一个示例性实施方案。[0150]图9描绘作为一个示例性实施方案计算得出的by标准对比所计算的b*值的图表。[0151]图10描绘为评估来自蛋白酶消化的aex加载液和流通液的寡肽(包括还原和烷化阿柏西普的片段(seqidno.:55))中的2-氧代-组氨酸和色氨酸的氧化百分比(其中下划线表示残基的氧化)而进行的实验的结果。[0152]图11描绘由使用来自蛋白酶消化的aex加载液和流通液的寡肽(包括阿柏西普的片段(seqidno.:55))进行的肽作图分析(其中下划线表示肽序列中残基的氧化)所识别的肽的相对丰度。[0153]图12a描绘在350nm处mt4和mt1的吸光度对时间(分钟)的色谱图的全视图。[0154]图12b描绘在350nm处mt4和mt1(包括seqidno.:21和28)的吸光度对时间(16-30分钟)的色谱图的展开视图。[0155]图12c描绘在350nm处mt4和mt1(包括seqidno.:17、18、19、20)的吸光度对时间(30-75分钟)的色谱图的展开视图。[0156]图13描绘为评估来自已通过aex色谱处理的蛋白酶消化的mt1的寡肽和来自已由aex色谱汽提的蛋白酶消化的mt1的寡肽(包括seqidno.:17、18、19、20、21、28)中的2-氧代-组氨酸(和色氨酸二氧化)百分比而进行的实验的结果。[0157]图14描绘为比较mt1的不同产生批次中存在的酸性种类和在进行强阳离子交换(cex)色谱时获得的酸性级分而进行的实验的结果,包括seqidno.:17、18、19、20、21、28。[0158]图15描绘使用强阳离子交换色谱富集细胞培养物收获物样品中存在的酸性种类和其他变体的示例性方法。[0159]图16描绘根据一个示例性实施方案来自进行强阳离子交换色谱的级分。[0160]图17描绘使用双重盐-ph梯度针对经历cex的mt1产生(在任何生产程序之前,≤by3)和针对去唾液酸化minitrap(dsmt1)的富集变体根据一个示例性实施方案进行的强阳离子交换色谱图。[0161]图18a描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对未分级分离的亲本对照的3d色谱图。[0162]图18b描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分1(代表实验的一些拖尾特征)的3d色谱图。[0163]图18c描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分2特征的3d色谱图。[0164]图18d描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分3特征的3d色谱图。[0165]图18e描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分4特征的3d色谱图。[0166]图18f描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分5特征的3d色谱图。[0167]图18g描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分6特征的3d色谱图。[0168]图18h描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分7特征的3d色谱图。[0169]图19描绘根据用于mt1产生的一个示例性实施方案进行的成像毛细管等电聚焦(icief)电泳图。[0170]图20描绘mt1冷白光或uva光的暴露与被氧化的氨基酸残基的出现(包括seqidno.:17、18、19、20、21、28、29和83)相关联的研究的结果。[0171]图21描绘根据一个示例性实施方案具有~350nm的吸光度(参见,例如圆圈突出显示~350nm)的经cwl应力处理的mt1的3dsec-pda(与光电二极管阵列检测耦合的尺寸排阻色谱)色谱图,其中a显示t=0时的色谱图,b显示在0.5xich处的色谱图,c显示在2.0xich处的色谱图,并且d显示由cwl在不同时间间隔下进行应力处理的小瓶(归一化为80mg/ml)中的mt1图像。[0172]图22描绘根据一个示例性实施方案具有~350nm的吸光度(参见,例如圆圈突出显示~350nm)的经uva应力处理的mt1的3dsec-pda色谱图,其中a显示t=0时的色谱图,b显示在0.5xich处的色谱图,c显示在2.0xich处的色谱图,并且d显示由uva在不同时间间隔下进行应力处理的小瓶(归一化为80mg/ml)中的mt1图像。[0173]图23a描绘从使用cwl进行应力处理的样品的sec-pda色谱图中定量得到的a320/280吸光度比(上图)并且图23b描绘使用cwl进行应力处理的样品中的尺寸变体的a320/280吸光度比的图表(下图),其中根据一个示例性实施方案对样品进行应力处理。[0174]图24a描绘从使用uva进行应力处理的样品的sec-pda色谱图中定量得到的a320/280吸光度比(上图)并且图24b描绘使用uva进行应力处理的样品中的尺寸变体的a320/280吸光度比的图表(下图),其中根据一个示例性实施方案对样品进行应力处理。[0175]图25a描绘将各种组分与阿柏西普一起温育对颜色产生(ciel*,a*,b*预测的b值)的影响的按比例估算值;并且图25b描绘实际b值相对于预测b值的图。[0176]图26描绘包含低半胱胺酸和低金属的cdm对阿柏西普效价(a)、活细胞浓度(b)、生存力(c)、氨(d)和重量渗透压摩尔浓度(e)的影响。[0177]图27是显示根据一个示例性实施方案随着金属和半胱氨酸浓度的增加/减少,收获物颜色的预测曲线的图表(视为第13天b*值)。[0178]图28(a-b)描绘将各种组分与阿柏西普在废cdm中一起温育对颜色产生(ciel*,a*,b*预测的b值)的影响(a);和对b值的按比例预测的影响的图(b)。[0179]图28c描绘在振荡瓶培养中将各种组分与阿柏西普在cdm中一起温育对颜色产生(ciel*,a*,b*预测的b值)的按比例估算的影响。[0180]图28d描绘将次牛磺酸和甲磺酸去铁胺盐(dfo)与阿柏西普在废cdm中一起温育对颜色产生(ciel*,a*,b*预测的“b”值)的影响。[0181]图28e描绘来自振荡瓶培养的各种组分与阿柏西普个别温育对颜色产生(ciel*,a*,b*预测的“b”值)的影响。[0182]图29是显示在cdm中添加尿苷、锰、半乳糖和地塞米松对所产生的阿柏西普的产生效价的影响的图表。[0183]图30是显示在cdm中添加尿苷、锰、半乳糖和地塞米松对表达阿柏西普的细胞的生存力的影响的图表,其中产生了阿柏西普。[0184]图31是显示在cdm中添加尿苷、锰、半乳糖和地塞米松对表达阿柏西普的细胞的活细胞计数的影响的图表,其中产生了阿柏西普。[0185]图32是显示使用来自cygnus3g(f550)的标准宿主细胞蛋白溶液所制备的吸光度对宿主细胞蛋白浓度(ng/ml)的标准曲线的图表。[0186]图33是使用非还原sds-page样品缓冲液进行的sds-page分析的图像。[0187]图34是使用还原sds-page样品缓冲液进行的sds-page分析的图像。[0188]图35a是在加载溶液、分别从包含vegf165、mab1和mab2的亲和色谱柱1-3洗脱的级分中检测到的总宿主细胞蛋白的图表。[0189]图35b是在加载溶液、分别从包含vegf165、mab1、mab3和mab4的亲和色谱柱1、2、4和5洗脱的级分中检测到的总宿主细胞蛋白的图表。[0190]图36描绘在进行亲和色谱产生之前a和之后bvegfminitrap的sec谱。[0191]图37描绘vegfminitrap至vegf165的动力学研究的草图表示,其中所研究的vegfminitrap构建体来自根据一些示例性实施方案进行亲和色谱产生之前和之后。[0192]图38描绘vegfminitrap至vegf165的动力学研究的spr传感图,其中所研究的vegfminitrap构建体来自根据一些示例性实施方案进行亲和色谱产生之前和之后。[0193]图39是在加载溶液、从重复用于包含vegf165、mab1和mab2的柱的亲和色谱柱洗脱的级分中检测到的总宿主细胞蛋白的图表。[0194]图40描绘根据一个示例性实施方案的vegfminitrapmt1(seqidno.:46)的结构。[0195]图41描绘根据一个示例性实施方案的vegfminitrapmt6(seqidno.:51)的结构。[0196]图42描绘mt1、mt5和mt6的天然sec-ms分析的相对吸光度对时间(分钟)的总离子色谱图(tic),以及来自tic的低分子量区域的放大视图。[0197]图43描绘mt1和mt5主峰的去卷积质谱,以通过阐明一些ptm来证实minitrap二聚体身份。[0198]图44描绘mt6主峰的去卷积质谱,以通过阐明一些ptm来证实单链minitrap身份。[0199]图45a描绘在mt1中的低分子量杂质的相对吸光度对时间(分钟)的图表。[0200]图45b描绘在mt1中的低分子量杂质的质谱。[0201]图46描绘mt1的相对吸光度对时间(分钟)的图,其显示不存在用于将阿柏西普切割成mt1的fabricator酶。[0202]图47描绘mt5中的低分子量杂质的相对吸光度对时间(分钟)的图。[0203]图48描绘mt6中的低分子量杂质的相对吸光度对时间(分钟)的图。[0204]图49a描绘在对vegfminitrapmt6执行hilic-uv/ms时获得的吸光度对时间(分钟)的图表,其中所述图表显示在21分钟时主峰的洗脱和在21.5分钟左右时o-聚糖的洗脱。[0205]图49b描绘对vegfminitrapmt6执行hilic-uv/ms时获得的质谱,其显示在47985.8da处的主峰。[0206]图49c描绘在进行hilic-uv/ms时获得的vegfminitrapmt6的o-聚糖的质谱。[0207]图50是vegfminitrap二聚体的图像,其中vegfminitrap的铰链区(seqidno.:83)中的二硫桥可平行或交叉。[0208]图51描绘在mt1、mt5和mt6中在asn36(包括seqidno.:100)处观察到的聚糖分布的相对丰度。[0209]图52描绘在mt1、mt5和mt6中在asn68(包括seqidno.:101)处观察到的聚糖分布的相对丰度。[0210]图53描绘在mt1、mt5和mt6中在asn123(包括seqidno.:102)处观察到的聚糖分布的相对丰度。[0211]图54描绘在mt1、mt5和mt6中在asn196(包括seqidno.:103)处观察到的聚糖分布的相对丰度。[0212]图55描绘通过亲水相互作用色谱(hilic)与荧光检测和质谱分析(全标度和叠加式)耦合得到的释放的n-连接的聚糖分析。[0213]图56描绘mt1、mt5和mt6的hilic-flr色谱图。[0214]图57描绘通过hilic与荧光检测和质谱分析(全标度、叠加式和归一化)耦合得到的释放的n-连接的聚糖分析。[0215]图58a是来自vegfminitrap样品mt1、mt5和mt6的详细聚糖识别和定量的表。[0216]图58b是来自vegfminitrap样品mt1、mt5和mt6的详细聚糖识别和定量的表。[0217]图58c是来自vegfminitrap样品mt1、mt5和mt6的详细聚糖识别和定量的表。[0218]图59描绘根据一个示例性实施方案制造minitrap的示例性生产程序。具体实施方式[0219]血管生成是由先前存在的脉管系统生长新血管,是高度协调的过程,其对于正常的胚胎和产后血管发育至关重要。异常或病理性血管生成是癌症和若干种视网膜疾病的标志,在此类疾病中,促血管生成因子(例如血管内皮生长因子(vegf))的上调导致内皮增生增加、脉管系统形态改变和血管通透性增加。在患有各种眼病的患者的玻璃体液和视网膜脉管系统中发现水平升高的vegf。阻断vegf活性还已成为治疗dme、湿性amd、cnv、视网膜静脉阻塞和其中异常血管生成是潜在病因的其他眼病的首选疗法。[0220]如本文所用,阿柏西普是一种所述抗vegf蛋白,其包含全人类氨基酸序列,所述序列包含人类vegfr1的第二ig结构域和人类vegfr2的第三ig结构域,表达为与人类igg1的(fc)的内联融合物(inlinefusion)。阿柏西普结合所有形式的vegf-a(vegf),但另外结合plgf和vegf-b。几种其他同型二聚vegfminitrap已作为阿柏西普的酶切产物产生或直接由宿主细胞系重组表达。vegfminitrap的一个此种实例示于图1中。在此图中,描绘末端赖氨酸(k),一些培养过程去除此末端赖氨酸,而另一些则没有。图1示出保留末端赖氨酸的过程。通常,阿柏西普涵盖末端赖氨酸的存在和不存在。[0221]如本文所证明,本发明部分公开使用cdm产生抗vegf蛋白(实施例1)。包含使用某些cdm产生的阿柏西普的溶液的分析显示出一定颜色特性,例如强烈的黄棕色。溶液颜色的强度取决于所用的cdm。在将溶液归一化至5g/l的浓度后,并非所有检查的cdm均产生具有明显黄棕色的样品。[0222]在可注射的治疗药物溶液中的颜色(例如黄棕色)可为不期望的特征。其可为用于确定药品是否满足特定治疗剂的预定纯度和质量水平的重要参数。在生物制剂的制造过程中观察到的颜色(例如黄棕色)可能是由于所述生物制剂的化学修饰、制剂赋形剂的降解产物或经由生物制剂和制剂赋形剂的反应而形成的降解产物引起。然而,所述信息对于理解颜色变化的原因可能有价值。其还可帮助设计短期以及长期储存条件,以防止促成这种颜色变化的修饰。[0223]本发明人观察到,在抗vegf蛋白溶液产生期间使用aex使黄棕色着色最小化。另外,本发明人发现可通过修饰用于产生重组蛋白,例如阿柏西普或经修饰的阿柏西普如minitrap的细胞培养物来减少黄棕色着色。[0224]本发明涵盖抗vegf蛋白和使用cdm产生所述抗vegf蛋白。另外,本发明是基于用于蛋白质产生的上游和下游工艺技术的识别和优化。[0225]如本文所证明,以下列出的一些实施例描述抗vegf蛋白的产生(实施例1)、抗vegf蛋白的经氧化种类的产生(实施例4)、通过优化培养基(实施例5)和通过优化产生方法(实施例2)来减少抗vegf蛋白的氧化种类的方法。[0226]许多近期的专利申请和授权专利旨在描述各种阿柏西普种类及其产生方法,但没有一者描述或提出本文所述的抗vegf组合物及其产生方法。参见例如coherusbiosciencesinc.的美国申请第16/566,847号、samchundangpharm.co.,ltd.的美国专利第10,646,546号、formyconag的美国专利第10,576,128号、amgeninc.的国际申请第pct/us2020/015659号以及momentapharmaceuticals,inc.的美国专利第8,956,830号;第9,217,168号;第9,487,810号;第9,663,810号;第9,926,583号;和第10,144,944号。[0227]i.所选术语的解释[0228]除非另有描述,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。与熟练技术人员已知的本文所述的那些类似或等同的方法和材料可用于实施本文所述的特定实施方案。所提及的所有出版物特此通过引用整体并入。[0229]术语“一”应理解是指代“至少一”,并且术语“约”和“近似”应理解为允许标准偏差,如普通本领域技术人员所理解,并且在提供范围的情况下,包括端点。[0230]如本文所用,术语“血管生成性眼部病症”是指由血管的生长或增生或由血管渗漏引起或与其相关的任何眼部疾病。[0231]如本文所用,术语“化学成分确定的培养基(chemicallydefinedmedium)”或“化学成分确定的培养基(chemicallydefinedmedia)”(均缩写是“cdm”)是指其中所有成分的身份和浓度确定的合成生长培养基。化学成分确定的培养基不含细菌、酵母、动物或植物提取物、动物血清或血浆,尽管可添加单个植物或动物衍生的组分(例如蛋白质、多肽等)。化学成分确定的培养基可含有支持生长所需的无机盐,例如磷酸盐、硫酸盐等。碳源经确定,并且通常是糖,例如葡萄糖、乳糖、半乳糖等,或其他化合物,例如甘油、乳酸盐、乙酸盐等。尽管某些化学成分确定的培养基还使用磷酸盐作为缓冲液,但可使用其他缓冲液,例如碳酸氢钠、hepes、柠檬酸盐、三乙醇胺等。市售的化学成分确定的培养基的实例包括但不限于各种杜尔贝科改良伊格尔(dme)培养基(sigma-aldrichco;safcbiosciences,inc.)、汉氏营养混合物(sigma-aldrichco;safcbiosciences,inc.)、各种ex-cells培养基(sigma-aldrichco;safcbiosciences,inc.)、各种ischo-cd培养基(fujifilmirvinescientific)、其组合等。制备化学成分确定的培养基的方法是本领域中已知的,例如在美国专利第6,171,825号和第6,936,441号、wo2007/077217和美国专利申请公开案第2008/0009040号和第2007/0212770号,其全部教导都通过引用并入本文。[0232]如本文所用,术语“累积量”是指在细胞培养过程中添加至生物反应器中以形成cdm的特定组分的总量,包括在培养开始时添加的组分的量(在第0天的cdm)和后续添加的组分的量。当计算组分的累积量时,还包括在生物反应器产生之前(即,在第0天的cdm之前)添加至种菌培养物或接种物中的组分的量。累积量不受培养过程中组分随时间损失(例如,经由代谢或化学降解)的影响。因此,具有相同累积量的组分的两种培养物可能仍具有不同绝对水平,例如,如果在不同时间将组分添加至两种培养物中(例如,如果在一种培养物中,所有组分均在开始时添加,而在另一种培养物中,组分是随时间的推移而添加)。累积量也不受培养过程中组分随时间的原位合成(例如,经由代谢或化学转化)的影响。因此,具有相同累积量的给定组分的两种培养物可能仍具有不同绝对水平,例如,如果组分是经由生物转化过程在两种培养物的一种中原位合成。累积量可以例如组分的克数或摩尔数为单位表示。[0233]如本文所用,术语“累积浓度”是指组分的累积量除以生产批次开始时生物反应器中液体的体积,包括培养物中使用的任何接种物对起始体积的贡献。例如,如果生物反应器在生产批次开始时包含2升细胞培养基,并且在第0、1、2和3天添加1克的组分x,则第3天之后的累积浓度为2g/l(即4克除以2升)。如果在第4天将另外1升不含组分x的液体添加至生物反应器中,则累积浓度将保持为2g/l。如果在第5天从生物反应器中损失一些液体(例如经由蒸发),则累积浓度将保持为2g/l。累积浓度可以例如克/升或摩尔/升为单位表示。[0234]如本文所用,术语“制剂”是指与一种或多种药学上可接受的媒介物一起配制的目标蛋白质。在一个方面,目标蛋白质是阿柏西普和/或minitrap。在一些示例性实施方案中,制剂中目标蛋白质的量可在约0.01mg/ml至约600mg/ml的范围内。在一些特定实施方案中,制剂中目标蛋白质的量可为约0.01mg/ml、约0.02mg/ml、约0.03mg/ml、约0.04mg/ml、约0.05mg/ml、约0.06mg/ml、约0.07mg/ml、约0.08mg/ml、约0.09mg/ml、约0.1mg/ml、约0.2mg/ml、约0.3mg/ml、约0.4mg/ml、约0.5mg/ml、约0.6mg/ml、约0.7mg/ml、约0.8mg/ml、约0.9mg/ml、约1mg/ml、约2mg/ml、约3mg/ml、约4mg/ml、约5mg/ml、约6mg/ml、约7mg/ml、约8mg/ml、约9mg/ml、约10mg/ml、约15mg/ml、约20mg/ml、约25mg/ml、约30mg/ml、约35mg/ml、约40mg/ml、约45mg/ml、约50mg/ml、约55mg/ml、约60mg/ml、约65mg/ml、约70mg/ml、约5mg/ml、约80mg/ml、约85mg/ml、约90mg/ml、约100mg/ml、约110mg/ml、约120mg/ml、约130mg/ml、约140mg/ml、约150mg/ml、约160mg/ml、约170mg/ml、约180mg/ml、约190mg/ml、约200mg/ml、约225mg/ml、约250mg/ml、约275mg/ml、约300mg/ml、约325mg/ml、约350mg/ml、约375mg/ml、约400mg/ml、约425mg/ml、约450mg/ml、约475mg/ml、约500mg/ml、约525mg/ml、约550mg/ml、约575mg/ml或约600mg/ml。在一些示例性实施方案中,组合物的ph值可大于约5.0。在一个示例性实施方案中,ph值可大于约5.0、大于约5.5、大于约6、大于约6.5、大于约7、大于约7.5、大于约8或大于约8.5。[0235]如本文所用,术语“数据库”是指生物信息学工具,其提供针对数据库中所有可能序列搜寻未解释的ms-ms谱的可能性。此类工具的非限制性实例是mascot(http://www.matrixscience.com)、spectrummill(http://www.chem.agilent.com)、plgs(http://www.waters.com)、peaks(http://www.bioinformaticssolutions.com)、proteinpilot(http://download.appliedbiosystems.com//proteinpilot)、phenyx(http://www.phenyx-ms.com)、sorcerer(http://www.sagenresearch.com)、omssa(http://www.pubchem.ncbi.nlm.nih.gov/omssa/)、x!tandem(http://www.thegpm.org/tandem/)、proteinprospector(http://www.http://prospector.ucsf.edu/prospector/mshome.htm)、byonic(https://www.proteinmetrics.com/products/byonic)或sequest(http://fields.scripps.edu/sequest)。[0236]如本文所用,术语“超滤”或“uf”可包括类似于逆渗透的膜过滤过程,其使用静水压力迫使水通过半透膜。超滤详细描述于:leosj.zeman和andrewl.zydney,microfiltrationandultrafiltration:principlesandapplications(1996)中,其全部教导并入本文。孔径小于0.1μm的过滤器可用于超滤。通过使用具有如此小孔径的过滤器,可经由使样品缓冲液渗透穿过过滤器而将蛋白质保留在过滤器后面来减少样品的体积。[0237]如本文所用,“渗滤”或“df”可包括使用超滤器去除和交换盐、糖和非水溶剂;将游离种类与结合种类分离;去除低分子量材料和/或引起离子和/或ph环境的快速变化的方法。通过以近似等于超滤速率的速率向经超滤的溶液中添加溶剂,可最有效地去除微溶质。由此从溶液中以恒定体积洗涤微种。在本发明的某些示例性实施方案中,可使用渗滤步骤来交换用于本发明的各种缓冲液,例如,在色谱或其他产生步骤之前,以及从蛋白质制剂中去除杂质。如本文所用,术语“下游工艺技术”是指在上游工艺技术之后用于产生蛋白质的一种或多种技术。下游工艺技术包括例如使用以下方法产生蛋白质产物:例如,亲和色谱,包括蛋白a亲和色谱以及使用固相的亲和色谱,所述固相具有明确限定的分子如vegf,其可与其同源物如vegf受体(vegfr)相互作用;离子交换色谱,例如阴离子或阳离子交换色谱;疏水相互作用色谱或置换色谱。[0238]短语“重组宿主细胞”(或简称为“宿主细胞”)包括已引入编码目标蛋白质的重组表达载体的细胞。应理解,此术语旨在不仅指特定主题细胞,而且指这种细胞的子代。因为由于突变或环境影响,某些修饰可能在后代中发生,所以所述子代实际上可与亲本细胞不同,但仍包括于如本文所用的术语“宿主细胞”的范围内。在一个实施方案中,宿主细胞包括选自任何生命王国的原核和真核细胞。在一个方面,真核细胞包括原生生物、真菌、植物和动物细胞。在另一方面,宿主细胞包括真核细胞,例如植物和/或动物细胞。细胞可为哺乳动物细胞、鱼类细胞、昆虫细胞、两栖类细胞或禽类细胞。在一个特定方面,宿主细胞是哺乳动物细胞。适于在培养物中生长的广泛多种哺乳动物细胞系可获自例如美国菌种保藏中心(manassas,va.)和其他寄存处以及商业供应商。可用于本发明的工艺中的细胞包括但不限于mk2.7细胞、per-c6细胞、中国仓鼠卵巢细胞(cho)例如cho-k1(atccccl-61)、dg44(chasin等人,1986,som.cellmolec.genet.,12:555-556;kolkekar等人,1997,biochemistry,36:10901-10909;和wo01/92337a2)、二氢叶酸还原酶阴性cho细胞(cho/-dhfr,urlaub和chasin,1980,proc.natl.acad.sci.usa,77:4216)和dp12.cho细胞(美国专利第5,721,121号);猴肾细胞(cv1,atccccl-70);由sv40转化的猴肾cv1细胞(cos细胞,cos-7,atcccrl-1651);hek293细胞和sp2/0细胞、5l8杂交瘤细胞、daudi细胞、el4细胞、hela细胞、hl-60细胞、k562细胞、jurkat细胞、thp-1细胞、sp2/0细胞、原代上皮细胞(例如角质细胞、宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾上皮细胞和视网膜上皮细胞)以及已建立的细胞系及其品系(例如人类胚胎肾细胞(例如293细胞或被亚克隆以便在悬浮培养中生长的293细胞,graham等人,1977,j.gen.virol.,36:59);幼仓鼠肾细胞(bhk,atccccl-10);小鼠足细胞(tm4,mather,1980,biol.reprod.,23:243-251);人类宫颈癌细胞(hela,atccccl-2);犬肾细胞(mdck,atccccl-34);人类肺细胞(w138,atccccl-75);人类肝癌细胞(hep-g2,hb8065);小鼠乳腺肿瘤细胞(mmt060562,atccccl-51);水牛鼠肝细胞(brl3a,atcccrl-1442);tri细胞(mather,1982,annalsnyacad.sci.,383:44-68);mcr5细胞;fs4细胞;per-c6视网膜细胞、mdbk(nbl-1)细胞、911细胞、crfk细胞、mdck细胞、bewo细胞、chang细胞、detroit562细胞、hela229细胞、helas3细胞、hep-2细胞、kb细胞、ls180细胞、ls174t细胞、nci-h-548细胞、rpmi2650细胞、sw-13细胞、t24细胞、wi-28va13,2ra细胞、wish细胞、bs-c-i细胞、llc-mk2细胞、克隆m-3细胞、1-10细胞、rag细胞、tcmk-1细胞、y-1细胞、llc-pk1细胞、pk(15)细胞、gh1细胞、gh3细胞、l2细胞、llc-rc256细胞、mh1c1细胞、xc细胞、mdok细胞、vsw细胞和th-i,b1细胞或其衍生物);来自任何组织或器官(包括但不限于心脏、肝脏、肾脏、结肠、肠、食道、胃、神经组织(脑、脊髓)、肺、血管组织(动脉、静脉、毛细血管)、淋巴组织(淋巴腺、腺样体、扁桃体、骨髓和血液)、脾脏)的成纤维细胞、以及成纤维细胞和成纤维细胞样细胞系(例如,trg-2细胞、imr-33细胞、don细胞、ghk-21细胞、瓜氨酸血症细胞、dempsey细胞、detroit551细胞、detroit510细胞、detroit525细胞、detroit529细胞、detroit532细胞、detroit539细胞、detroit548细胞、detroit573细胞、hel299细胞、imr-90细胞、mrc-5细胞、wi-38细胞、wi-26细胞、micl1细胞、cv-1细胞、cos-1细胞、cos-3细胞、cos-7细胞、非洲绿猴肾细胞(vero-76,atcccrl-1587;vero,atccccl-81);dbs-frhl-2细胞、balb/3t3细胞、f9细胞、sv-t2细胞、m-msv-balb/3t3细胞、k-balb细胞、blo-11细胞、nor-10细胞、c3h/ioti/2细胞、hsdm1c3细胞、kln205细胞、mccoy细胞、小鼠l细胞、品系2071(小鼠l)细胞、l-m品系(小鼠l)细胞、l-mtk(小鼠l)细胞、nctc克隆2472和2555、scc-psa1细胞、swiss/3t3细胞、印度黄麂细胞(indianmuntaccell)、sirc细胞、cii细胞和jensen细胞、或其衍生物)或本领域技术人员已知的任何其他细胞类型。[0239]如本文所用,术语“宿主细胞蛋白”(hcp)包括源自宿主细胞的蛋白,并且可与所需的目标蛋白无关。宿主细胞蛋白可为过程相关的杂质,其可来源于制造过程,并且可包括三个主要类别:细胞底物来源、细胞培养来源和下游来源。细胞底物来源的杂质包括但不限于来源于宿主生物的蛋白质和核酸(宿主细胞基因组、载体或总dna)。细胞培养来源的杂质包括但不限于诱导剂、抗生素、血清和其他培养基组分。下游来源的杂质包括但不限于酶、化学和生化处理试剂(例如,溴化氰、胍、氧化剂和还原剂)、无机盐(例如,重金属、砷、非金属离子)、溶剂、载剂、配体(例如单克隆抗体)和其他可浸出物。[0240]在一些示例性实施方案中,宿主细胞蛋白可具有在约4.5至约9.0范围内的pi。在一个示例性实施方案中,pi可为约4.5、约5.0、约5.5、约5.6、约5.7、约5.8、约5.9、约6.0、约6.1、约6.2、约6.3、约6.4、约6.5、约6.6、约6.7、约6.8、约6.9、约7.0、约7.1、约7.2、约7.3、约7.4、约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4、约8.5、约8.6、约8.7、约8.8、约8.9或约9.0。[0241]如本文所用,术语“水解剂”是指可进行蛋白质消化的大量不同试剂中的任何一种或组合。可进行酶消化的水解剂的非限制性实例包括来自佐氏曲霉的蛋白酶、弹性蛋白酶、枯草杆菌蛋白酶、蛋白酶xiii、胃蛋白酶、胰蛋白酶、tryp-n、胰凝乳蛋白酶、曲霉菌胃蛋白酶i、lysn蛋白酶(lys-n)、lysc胞内蛋白酶(lys-c)、胞内蛋白酶asp-n(asp-n)、胞内蛋白酶arg-c(arg-c)、胞内蛋白酶glu-c(glu-c)或外膜蛋白t(ompt)、酿脓链球菌的免疫球蛋白降解酶(ides)、嗜热菌蛋白酶、木瓜蛋白酶、链霉蛋白酶、v8蛋白酶或其生物活性片段或同源物或其组合。可进行非酶消化的水解剂的非限制性实例包括使用高温、微波、超声波、高压、红外、溶剂(非限制性实例是乙醇和乙腈)、固定化酶消化(imer)、磁粒固定化酶和芯片上固定化酶。有关论述可用的蛋白质消化技术的最新综述,参见switzar等人,“proteindigestion:anoverviewoftheavailabletechniquesandrecentdevelopments”(lindaswitzar,martingiera和wilfriedm.a.niessen,proteindigestion:anoverviewoftheavailabletechniquesandrecentdevelopments,12journalofproteomeresearch1067-1077(2013),其全部教导都并入本文)。一种水解剂或多种水解剂的组合可以序列特异性方式切割蛋白质或多肽中的肽键,从而产生较短肽的可预测集合。可适当选择水解剂与蛋白质的比率和消化所需时间以获得蛋白质的最佳消化。当酶与底物的比率过高时,相应的高消化速率将不能为肽通过质谱仪进行分析提供足够的时间,并且会损害序列覆盖率。另一方面,低e/s比率将需要长时间消化,并因此需要较长的数据采集时间。酶与底物的比率可在约1:0.5至约1:200范围内。如本文所用,术语“消化”是指蛋白质的一个或多个肽键的水解。有若干种使用适当的水解剂对生物样品中的蛋白质进行消化的方法,例如,酶消化或非酶消化。用于消化样品中的蛋白质的一种广泛接受的方法涉及使用蛋白酶。有许多蛋白酶可用,并且每种蛋白酶在特异性、效率和最佳消化条件方面都有其自身特征。蛋白酶是指内肽酶和外肽酶,根据蛋白酶在肽内的非末端或末端氨基酸上的切割能力进行分类。或者,蛋白酶还指六种不同的类别-天冬氨酸蛋白酶、谷氨酸蛋白酶和金属蛋白酶、半胱氨酸蛋白酶、丝氨酸蛋白酶和苏氨酸蛋白酶,根据催化机制进行分类。术语“蛋白酶”与“肽酶”可互换使用,以指水解肽键的酶。[0242]术语“与……相关联”表示可将本发明的组分,即抗vegf组合物与另一种剂例如抗ang2一起配制成单一组合物用于同时递送,或单独配制成两种或更多种组合物(例如,包含每种组分的试剂盒)。彼此相关联施用的组分可在与施用其他组分不同的时间向受试者施用;例如,可在给定时间段以一定时间间隔非同时(例如,单独地或依次地)进行每次施用。彼此相关联施用的单独组分还可在相同施用时段中基本上同时(例如,精确地同时或以非临床上重要的时间段间隔开)施用。此外,彼此相关联施用的单独组分可通过相同或不同途径向受试者施用,例如,阿柏西普的组合物与另一种剂例如抗ang2一起,其中阿柏西普的组合物包含约15%或更少的其变体。[0243]如本文所用,术语“液相色谱”是指以下过程:当组分流过(或流入)固定液相或固相时,由于组分的差异分布,可将由液体携带的生物/化学混合物分离为各组分。液相色谱的非限制性实例包括反相液相色谱、离子交换色谱、尺寸排阻色谱、亲和色谱、混合模式色谱、疏水色谱或混合模式色谱。[0244]如本文所用,“亲和色谱”可包括分离,所述分离包括基于两种物质对色谱材料的亲和力来分离两种物质的任何方法。其可包括使物质经历包含合适的亲和色谱介质的柱。此类色谱介质的非限制性实例包括但不限于蛋白a树脂、蛋白g树脂、包含抗原(针对所述抗原产生结合分子(例如抗体))的亲和支撑物、能够结合至目标蛋白质的蛋白质和包含fc结合蛋白的亲和支撑物。在一个方面,在样品加载之前,可用合适的缓冲液平衡亲和柱。合适的缓冲液的实例可为tris/nacl缓冲液,ph值为约7.0至8.0。熟练技术人员可开发合适的缓冲液而不会造成不当的负担。此平衡之后,可将样品加载至柱上。加载柱后,可使用例如平衡缓冲液将柱洗涤一次或多次。在洗脱柱之前,可使用其他洗涤,包括采用不同缓冲液的洗涤。接着可使用适当的洗脱缓冲液洗脱亲和柱。合适的洗脱缓冲液的一个实例可为乙酸/nacl缓冲液,ph值为约2.0至3.5。熟练技术人员还可开发适当的洗脱缓冲液而不会造成不当的负担。洗脱液可使用本领域技术人员熟知的技术(包括uv)进行监测,例如,可使用280nm处的吸光度,尤其是在目标样品包含芳环(例如,具有像色氨酸一样的芳族氨基酸的蛋白质)时。[0245]如本文所用,“离子交换色谱”可指包括任何方法的分离,通过所述方法可基于目标分子和/或色谱材料上(整体或局部位于目标分子和/或色谱材料的特定区域上)的个别离子电荷的差异来分离两种物质,并因此可使用阳离子交换材料或阴离子交换材料。离子交换色谱根据目标分子的局部电荷与色谱材料的局部电荷之间的差异来分离分子。填充式离子交换色谱柱或离子交换膜装置可在结合-洗脱模式、流通模式或混合模式下操作。用平衡缓冲液或另一种缓冲液洗涤柱或膜装置之后,可通过提高洗脱缓冲液的离子强度(即电导率)以与溶质竞争离子交换基质的带电位点来实现产物回收。改变ph值并由此改变溶质的电荷可为实现溶质洗脱的另一种方式。电导率或ph值的变化可为逐渐的(梯度洗脱)或逐步的(分步洗脱)。可将阴离子或阳离子取代基附着于基质上,以形成用于色谱法的阴离子或阳离子支撑物。阴离子交换取代基的非限制性实例包括二乙氨基乙基(deae)、季氨乙基(qae)和季胺(q)基团。阳离子取代基包括羧甲基(cm)、磺乙基(se)、磺丙基(sp)、磷酸盐(p)和磺酸盐(s)。纤维素离子交换介质或支撑物可包括可由whatmanltd.maidstone,kent,u.k获得的de23tm、de32tm、de52tm、cm-23tm、cm-32tm和cm-52tm。基和交联的离子交换剂也是已知的。例如,deae-、qae-、cm-和以及deae-、q-、cm-和以及fastflow和captotms均可由gehealthcare获得。此外,deae和cm衍生化的乙二醇-甲基丙烯酸酯共聚物,例如toyopearltmdeae-650s或m和toyopearltmcm-650s或m可由tosohaasco.,philadelphia,pa.获得,或nuvias和unospheretms可由biorad,hercules,calif.获得,s可由emdmillipore,ma获得。[0246]如本文所用,术语“疏水相互作用色谱树脂”可包括固相,其可用苯基、辛基、丁基等共价修饰。其可利用疏水性将分子彼此分离。在这种类型的色谱法中,疏水基团(例如苯基、辛基、己基或丁基)可形成柱的固定相。例如蛋白质、肽等的分子穿过hic(疏水相互作用色谱)柱,所述柱在其表面上具有一个或多个疏水区域或具有疏水袋,并且能够与构成hic固定相的疏水基团相互作用。hic树脂或支撑物的实例包括phenylsepharoseff、captophenyl(gehealthcare,uppsala,sweden)、phenyl650-m(tosohbioscience,tokyo,japan)和sartobindphenyl(sartoriuscorporation,newyork,usa)。[0247]如本文所用,术语“混合模式色谱”或“多模式色谱”(均称为“mmc”)包括以下色谱法:其中溶质经由一种以上相互作用模式或机制与固定相相互作用。mmc可用作传统反相(rp)、离子交换(iex)和正相色谱(np)的替代或补充工具。与rp、np和iex色谱(其中分别以疏水相互作用、亲水相互作用和离子相互作用作为主要相互作用模式)不同,混合模式色谱可采用这些相互作用模式中的两种或更多种的组合。混合模式色谱介质可提供无法通过单模式色谱重现的独特选择性。与基于亲和力的方法相比,混合模式色谱还可节省潜在成本、延长柱寿命和提高操作灵活性。在一些示例性实施方案中,混合模式色谱介质可包含直接或经由间隔体与有机或无机支撑物(有时表示为基础基质)偶联的混合模式配体。支撑物可呈以下形式:颗粒,例如基本上呈球形的颗粒、整料、过滤器、膜、表面、毛细管等。在一些示例性实施方案中,支撑物可由天然聚合物例如交联碳水化合物材料如琼脂糖、agpv、纤维素、右旋糖酐、壳聚糖、魔芋、角叉菜胶、结冷胶、藻酸盐等来制备。为了获得高吸附能力,支撑物可为多孔的,并且接着将配体偶联至外表面以及孔表面。此类天然聚合物支撑物可根据标准方法制备,例如反相悬浮胶凝(shjerten:biochimbiophysacta79(2),393-398(1964),其全部教导并入本文)。或者,可由以下物质来制备载体:合成聚合物,例如交联合成聚合物,例如苯乙烯或苯乙烯衍生物、二乙烯基苯、丙烯酰胺、丙烯酸酯、甲基丙烯酸酯、乙烯酯、乙烯酰胺等。此类合成聚合物可根据标准方法产生,例如“通过悬浮聚合开发的苯乙烯基聚合物支撑物(styrenebasedpolymersupportsdevelopedbysuspensionpolymerization)”(rarshady:chimicael'industria70(9),70-75(1988),其全部教导并入本文)。多孔的天然或合成聚合物支撑物也可从例如gehealthcare,uppsala,sweden的商业来源获得。[0248]如本文所用,术语“质谱仪”包括能够识别特定分子种类并测量其准确质量的装置。所述术语意在包括可表征多肽或肽的任何分子检测器。质谱仪可包括三个主要部分:离子源、质量分析仪和检测器。离子源的作用是产生气相离子。可将分析物的原子、分子或簇转移至气相中并同时(如以电喷雾电离)或经由单独过程电离。离子源的选择取决于应用。在一些示例性实施方案中,质谱仪可为串联质谱仪。如本文所用,术语“串联质谱”包括其中通过使用质量选择和质量分离的多个阶段获得关于样品分子的结构信息的技术。先决条件是将样品分子转化为气相并电离,以便在第一质量选择步骤之后以可预测和可控制的方式形成片段。多阶段ms/ms或msn可通过首先选择和分离前体离子(ms2),使其片段化,分离初级碎片离子(ms3),使其片段化,分离次级碎片(ms4)等方式进行,只要可获得有意义的信息,或碎片离子信号是可检测的。串联ms已成功地与广泛多种分析仪组合一起使用。可根据许多不同因素(例如灵敏度、选择性和速度,以及尺寸、成本和可用性)来确定对于某种应用组合哪些分析仪。串联ms方法的两个主要类别是空间串联和时间串联,但还有一些混合方案,其中时间串联分析仪在空间中或与空间串联分析仪耦合。空间串联质谱仪包括离子源、前体离子活化装置和至少两个非捕获质量分析仪。具体的m/z分离功能可被设计,以便在仪器的一个部分中选择离子,在中间区域将其解离,接着将产物离子传输至另一分析仪以进行m/z分离和数据采集。在时间串联质谱仪中,可在同一物理装置中捕获、分离、片段化和m/z分离离子源中产生的离子。质谱仪所识别的肽可用作完整蛋白及其翻译后修饰的替代代表。它们可通过将实验与理论ms/ms数据相关联来用于蛋白质表征,理论ms/ms数据是由蛋白质序列数据库中的可能的肽产生。所述表征包括但不限于对蛋白质片段的氨基酸进行测序;确定蛋白质测序;确定蛋白质从头测序;定位翻译后修饰或识别翻译后修饰;或可比性分析;或其组合。[0249]如本文所用,“mini-trap”或“minitrap”或“minitrap结合分子”能够结合至vegf分子。此类minitrap可包括(i)嵌合多肽以及(ii)包含两个或更多个例如经由一个或多个二硫桥非共价结合的多肽的多聚(例如,二聚)分子。minitrap可经由化学修饰、酶促活性产生或重组制造。[0250]如本文所用,“vegfminitrap”或“vegfminitrap结合分子”可为与vegf结合并具有一组或多组vegf受体ig样结构域(或其变体)(例如,vegfr1ig结构域2和/或vegfr2ig结构域3和/或4)的分子或分子复合物以及经修饰或不存在的多聚组分(mc),例如,其中mc是经修饰的免疫球蛋白fc。所述修饰可为vegftrap(例如,阿柏西普或康柏西普(conbercept))的蛋白水解消化或具有经缩短的mc序列的所得多肽链的直接表达的结果。(参见图1中描绘的分子结构)图1是vegfminitrap分子的描绘,其是用酿脓链球菌ides蛋白水解阿柏西普的产物。描绘了同型二聚分子,其具有通过两个平行二硫键连接的ig铰链结构域片段。指示vegfr1结构域、vegfr2结构域和铰链结构域片段(mc)。阿柏西普中发生ides切割的点用“//”指示。还指示从阿柏西普切下的fc片段。未经二聚化的单个此类嵌合多肽如果具有vegf结合活性则也可为vegfminitrap。术语“vegfminitrap”包括单个多肽,其包含第一组一个或多个vegf受体ig结构域(或其变体),所述ig结构域缺乏mc但以接头(例如,肽接头)与一个或多个其他组的一个或多个vegf受体ig结构域(或其变体)融合。在本发明的vegfminitrap中的vegf结合结构域可彼此相同或不同(参见wo2005/00895,其全部教导都并入本文)。[0251]例如,在本发明的一个实施方案中,未经修饰的免疫球蛋白fc结构域包含以下氨基酸序列或其氨基酸1-226:[0252]dkthtcpx1cpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykx2tppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno.:33;其中x1是l或p并且x2是a或t)。[0253]vegf的抑制包括例如vegf与vegf受体结合的拮抗作用,例如通过与vegf受体竞争vegf(例如,vegf110、vegf121和/或vegf165)结合。这种抑制可造成vegf介导的vegfr活化的抑制,例如,表达嵌合vegf受体(例如,其同型二聚体)的细胞系(例如,hek293)中荧光素酶表达的抑制,所述细胞系在细胞表面上具有与il18rα和/或il18rβ胞内结构域融合的vegfr胞外结构域并且还具有nfkb-荧光素酶-ires-egfp报告基因,例如本文所阐述的细胞系hek293/d9/flt-il18rα/flt-il18rβ。[0254]本发明的vegfminitrap的vegf受体ig结构域组分可包括:[0255](i)vegfr1(flt1)的一个或多个免疫球蛋白样(ig)结构域2(r1d2),[0256](ii)vegfr2(flk1或kdr)的一个或多个ig结构域3(flk1d3)(r2d3),[0257](iii)vegfr2(flk1或kdr)的一个或多个ig结构域4(flk1d4)(r2d4),和/或[0258](iv)vegfr3(flt4)的一个或多个ig结构域3(flt1d3或r3d3)。[0259]vegf受体的免疫球蛋白样结构域在本文中可称为vegfr“ig”结构域。本文所提及的vegfrig结构域,例如r1d2(在本文中可称为vegfr1(d2))、r2d3(在本文中可称为vegfr2(d3))、r2d4(在本文中可称为vegfr2(d4))和r3d3(在本文中可称为vegfr3(d3))旨在不仅涵盖完整的野生型ig结构域,而且也涵盖基本上保留野生型结构域的功能特征的其变体,例如,当并入vegfminitrap中时,保留形成功能性vegf结合结构域的能力。本领域技术人员显而易知,可获得上述ig结构域的许多变体,其将保留与野生型结构域基本上相同的功能特征。[0260]本发明提供包含以下结构域结构的vegfminitrap多肽:[0261]·((r1d2)-(r2d3))a-接头-((r1d2)-(r2d3))b;[0262]·((r1d2)-(r2d3)-(r2d4))c-接头-((r1d2)-(r2d3)-(r2d4))d;[0263]·((r1d2)-(r2d3))e-(mc)g;[0264]·((r1d2)-(r2d3)-(r2d4))f-(mc)g;[0265]其中,[0266]-r1d2是vegf受体1(vegfr1)ig结构域2(d2);[0267]-r2d3是vegfr2ig结构域3;[0268]-r2d4是vegfr2ig结构域4;[0269]-mc是多聚组分(例如,igg铰链结构域或其片段,例如来自igg1);[0270]-接头是包含约5、6、7、8、9、10、11、12、13、14、15或16个氨基酸的肽,例如(gggs)g;[0271]并且,[0272]独立地,[0273]a=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;[0274]b=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;[0275]c=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;[0276]d=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;[0277]e=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;[0278]f=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;并且[0279]g=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。[0280]在本发明的一个实施方案中,r1d2包含氨基酸序列:sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiid(seqidno.:34)。在一个方面,r1d2缺少n末端sdt。[0281]在本发明的一个实施方案中,r1d2包含氨基酸序列:pfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqt(seqidno.:35)。[0282]在本发明的一个实施方案中,r2d3包含氨基酸序列:vvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seqidno.:36)。[0283]在本发明的一个实施方案中,r2d4包含氨基酸序列:pfvafgsgmeslveatvgervripakylgypppeikwykngiplesnhtikaghvltimevserdtgnytviltnpiskekqshvvslvvyvppgpg(seqidno.:37)。[0284]在本发明的一个实施方案中,r2d4包含氨基酸序列:fvafgsgmeslveatvgervripakylgypppeikwykngiplesnhtikaghvltimevserdtgnytviltnpiksekqshvvslvvyvp(seqidno.:38)。[0285]在本发明的一个实施方案中,用于vegfminitrap中的多聚组分(mc)是肽,例如,经修饰的fc免疫球蛋白(例如,来自igg1),其能够与另一多聚组分结合。在一个方面,mc是包括免疫球蛋白铰链区的经修饰的fc免疫球蛋白。例如,在本发明的一个实施方案中,mc是包含一个或多个(例如1、2、3、4、5或6个)半胱氨酸的肽,所述半胱氨酸能够与另一个mc中的半胱氨酸形成一个或多个半胱氨酸桥,例如dkthtcppc(seqidno.:39)、dkthtcppcppc(seqidno.:40)、dkthtcppcppcppc(seqidno.:41)、dkthtc(ppc)h(其中h是1、2、3、4或5)、dkthtcppcpapellg(seqidno.:60)、dkthtcplcpapellg(seqidno.:43)、dkthtc(seqidno.:44)或dkthtcplcpap(seqidno.:45)。[0286]本发明还提供了一种包含以下结构域结构的vegfminitrap多肽:[0287](i)(r1d2)a-(r2d3)b-(mc)c;或[0288](ii)(r1d2)a-(r2d3)b-(r2d4)c-(mc)d;[0289]其可例如通过每个多肽的mc之间的结合与第二所述多肽同型二聚,[0290]其中[0291](i)所述r1d2结构域配位;[0292](ii)所述r2d3结构域配位;和/或[0293](iii)所述r2d4结构域配位,[0294]以形成二聚vegf结合结构域。[0295]在本发明的一个实施方案中,vegfminitrap多肽包含以下氨基酸序列:sdtgrpfvemyseipeiihmtegrelvipcrvtspn36itvtlkkfpldtlipdgkriiwdsrkgfiisn68atykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvln123ctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkkn196stfvrvhekdkthtcppcpapellg(seqidno.:46;mc加下划线);grpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhenlsvafgsgmeslveatvgervripakylgypppeikwykngiplesnhtikaghvltimevserdtgnytviltnpiskekqshvvslvvyvppgpgdkthtcplcpapellg(seqidno.:47;mc加下划线);sdtgrpfvemyseipeiihmtegrelvipcrvtspn36itvtlkkfpldtlipdgkriiwdsrkgfiisn68atykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvln123ctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkkn196stfvrvhekdkthtcppc(seqidno.:48;mc加下划线);sdtgrpfvemyseipeiihmtegrelvipcrvtspn36itvtlkkfpldtlipdgkriiwdsrkgfiisn68atykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvln123ctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkkn196stfvrvhekdkthtcppcppc(seqidno.:49;mc加下划线);sdtgrpfvemyseipeiihmtegrelvipcrvtspn36itvtlkkfpldtlipdgkriiwdsrkgfiisn68atykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvln123ctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkkn196stfvrvhekdkthtcppcppcppc(seqidno.:50;mc加下划线);或sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekdkthtc-(ppc)x(mc加下划线;其中x是1、2、3、4或5)。如所论述,此类多肽可被多聚化(例如二聚化(例如,同型二聚化)),其中多肽之间的结合是经由多聚化组分介导。[0296]在本发明的一个实施方案中,本发明的单体vegfminitrap的vegfr1ig样结构域2在n36和/或n68处具有n连接的糖基化作用;和/或在c30与c79之间具有链内二硫桥;和/或本发明的单体vegfminitrap的vegfr2ig样结构域3在n123和/或n196处具有n连接的糖基化作用;和/或在c124与c185之间具有链内二硫桥。[0297]在本发明的一个实施方案中,vegfminitrap包含以下结构:[0298]·(r1d2)1-(r2d3)1-(g4s)3-(r1d2)1-(r2d3)1;[0299]·(r1d2)1-(r2d3)1-(g4s)6-(r1d2)1-(r2d3)1;[0300]·(r1d2)1-(r2d3)1-(g4s)9-(r1d2)1-(r2d3)1;或[0301]·(r1d2)1-(r2d3)1-(g4s)12-(r1d2)1-(r2d3)1。[0302]g4s是-gly-gly-gly-gly-ser-[0303]在本发明的一个实施方案中,vegfminitrap包含以下氨基酸序列:[0304](i)[0305]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekggggsggggsggggsggggsggggsggggssdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seqidno.:51;接头加下划线);[0306](iii)[0307]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekggggsggggsggggssdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seqidno.:52;接头加下划线);[0308](iv)[0309]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekggggsggggsggggsggggsggggsggggsggggsggggsggggssdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seqidno.:53;接头加下划线);[0310](v)[0311]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekggggsggggsggggsggggsggggsggggsggggsggggsggggsggggsggggsggggssdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seqidno.:54;接头加下划线);[0312]或[0313](vi)[0314]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek-(ggggs)x[0315]-sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek[0316](其中x是1、2、3、4、5、6、7、8、9、10、11、12、13、14或15)。如本文所论述,这些多肽可包含二级结构,其中同样的vegfrig结构域缔合以形成链内vegf结合结构域(例如,图2)。在本发明的一个实施方案中,两个或更多个此类多肽多聚化(例如,二聚化(例如,同型二聚化)),其中每条链的vegfrig结构域与另一条链的同样ig结构域缔合以形成链间vegf结合结构域。[0317]在本发明的某一实施方案中,本发明的vegfminitrap缺乏对vegfminitrap多肽的氨基酸残基的任何显著修饰(例如,例如在n末端和/或c末端处的直接化学修饰如peg化或碘乙酰胺化)。[0318]在本发明的一个实施方案中,多肽包含二级结构,其中在单个嵌合多肽(例如,(r1d2)a-(r2d3)b-接头-(r1d2)c-(r2d3)d;或(r1d2)a-(r2d3)b-(r2d4)c-接头-(r1d2)d-(r2d3)e-(r2d4)f)中或在单独的嵌合多肽(例如,同型二聚体)中的同样的vegfrig结构域配位以形成vegf结合结构域。例如,其中[0319](i)所述r1d2结构域配位;[0320](ii)所述r2d3结构域配位;和/或[0321](iii)所述r2d4结构域配位,[0322]以形成vegf结合结构域。图2是描绘这种结构域配位的单链vegfminitrap的说明。指示vegfr1、vegfr2和接头结构域。所示接头是(g4s)6。本发明包括具有(g4s)3、(g4s)9或(g4s)12接头的单链vegfminitrap。[0323]另外,本发明还提供了一种复合物,其包含与vegf多肽或其片段或其融合物复合的如本文所论述的vegfminitrap。在本发明的一个实施方案中,将vegf(例如,vegf165)同型二聚化和/或将vegfminitrap在2:2复合物(2个vegf:2个minitrap)中同型二聚化和/或将vegfminitrap在1:1复合物中同型二聚化。复合物可包括与同型二聚化的vegfminitrap多肽结合的同型二聚化的vegf分子。在本发明的一个实施方案中,复合物是在体外(例如,固定在固体基质上)或在受试者体内。本发明还包括与vegfminitrap复合的vegf二聚体(例如,vegf165)的复合物的组合物。[0324]如本文所用,术语“蛋白质”或“目标蛋白质”可包括具有共价连接的酰胺键的任何氨基酸聚合物。目标蛋白质的实例包括但不限于阿柏西普和minitrap。蛋白质包含一条或多条氨基酸聚合物链,在本领域中通常称为“多肽”。“多肽”是指由氨基酸残基、相关天然存在的结构变体及其经由肽键连接的合成的非天然存在的类似物、相关天然存在的结构变体及其合成的非天然存在的类似物构成的聚合物。“合成肽或多肽”是指非天然存在的肽或多肽。合成肽或多肽可例如使用自动多肽合成器来合成。各种固相肽合成方法是本领域技术人员已知的。蛋白质可包含一个或多个多肽以形成单一功能的生物分子。另一个示例性方面,蛋白质可包括抗体片段、纳米抗体、重组抗体嵌合体、细胞因子、趋化因子、肽激素等。目标蛋白质可包括以下任一者:生物治疗性蛋白、用于研究或疗法中的重组蛋白、trap蛋白和其他嵌合受体fc融合蛋白、嵌合蛋白、抗体、单克隆抗体、多克隆抗体、人类抗体和双特异性抗体。在一个特定方面,目标蛋白质是抗vegf融合蛋白(例如,阿柏西普或minitrap)。可使用以下基于重组细胞的生产系统来产生蛋白质,例如昆虫杆状病毒系统、酵母系统(例如毕赤酵母属(pichiasp.))、哺乳动物系统(例如cho细胞和cho衍生物,如cho-k1细胞)。有关论述生物治疗性蛋白及其产生的最新综述,参见ghaderi等人,“productionplatformsforbiotherapeuticglycoproteins.occurrence,impact,andchallengesofnon-humansialylation,”(dariusghaderi等人,productionplatformsforbiotherapeuticglycoproteins.occurrence,impact,andchallengesofnon-humansialylation,28biotechnologyandgeneticengineeringreviews147-176(2012),其全部教导都并入本文)。在一些示例性实施方案中,蛋白质包含修饰、加合物和其他共价连接的部分—这些修饰、加合物和部分包括例如抗生物素蛋白、链霉亲和素、生物素、聚糖(例如,n-乙酰半乳糖胺、半乳糖、神经氨酸、n-乙酰基葡糖胺、岩藻糖、甘露糖和其他单糖)、peg、聚组氨酸、flagtag、麦芽糖结合蛋白(mbp)、几丁质结合蛋白(cbp)、谷胱甘肽-s-转移酶(gst)myc表位、荧光标记和其他染料等。蛋白质可根据组成和溶解度来分类,并且因此可包括简单蛋白质,例如球状蛋白质和纤维状蛋白质;缀合蛋白,例如核蛋白、糖蛋白、粘蛋白、色蛋白、磷蛋白、金属蛋白和脂蛋白;以及衍生蛋白,例如初级衍生蛋白和次级衍生蛋白。[0325]在一些示例性实施方案中,目标蛋白质可为重组蛋白、抗体、双特异性抗体、多特异性抗体、抗体片段、单克隆抗体、融合蛋白、scfv及其组合。[0326]如本文所用,术语“重组蛋白”是指由于重组表达载体上携带的基因的转录和翻译而产生的蛋白,所述重组表达载体已引入合适的宿主细胞中。在某些示例性实施方案中,重组蛋白可为融合蛋白。在一个特定方面,重组蛋白是抗vegf融合蛋白(例如,阿柏西普或minitrap)。在某些示例性实施方案中,重组蛋白可为抗体,例如,嵌合的、人源化的或完全人类抗体。在某些示例性实施方案中,重组蛋白可为选自由以下组成的组的同种型抗体:igg、igm、iga1、iga2、igd或ige。在某些示例性实施方案中,抗体分子是全长抗体(例如,igg1),或替代地,抗体可为片段(例如,fc片段或fab片段)。[0327]如本文所用,术语“抗体”包括包含通过二硫键互连的四条多肽链(即两条重(h)链和两条轻(l)链)的免疫球蛋白分子,以及其多聚体(例如,igm)。每条重链包含重链可变区(本文中缩写为hcvr或vh)和重链恒定区。重链恒定区包含三个结构域,即ch1、ch2和ch3。每条轻链包含轻链可变区(本文中缩写为lcvr或vl)和轻链恒定区。轻链恒定区包含一个结构域(cl1)。vh区和vl区可进一步再分成称为互补决定区(cdr)的高变区,散布有称为构架区(fr)的较保守区。每个vh和vl由三个cdr和四个fr组成,所述区依以下顺序从氨基末端至羧基末端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。在本发明的不同实施方案中,抗big-et-1抗体(或其抗原结合部分)的fr可与人类种系序列相同,或者可为天然或人工修饰的。可基于两个或更多个cdr的并排分析来定义氨基酸共有序列。如本文所用,术语“抗体”还包括全抗体分子的抗原结合片段。如本文所用,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”等包括特异性结合抗原以形成复合物的任何天然存在的、以酶促方式获得的、合成或基因工程化的多肽或糖蛋白。抗体的抗原结合片段可使用以下任何合适的标准技术例如由全抗体分子衍生而来:例如蛋白水解消化或重组基因工程技术,其涉及编码抗体可变结构域和任选地恒定结构域的dna的操纵和表达。所述dna是已知的和/或可易于由例如商业来源、dna文库(包括例如噬菌体-抗体文库)获得,或者可经合成。可以化学方式或通过使用分子生物学技术对dna进行测序和操纵,例如以将一个或多个可变结构域和/或恒定结构域排列成合适的构型;或引入密码子;产生半胱氨酸残基;修饰、添加或删除氨基酸等。[0328]如本文所用,“抗体片段”包括完整抗体的一部分,例如抗体的抗原结合或可变区。抗体片段的实例包括但不限于fab片段、fab'片段、f(ab')2片段、scfv片段、fv片段、dsfv双抗体、dab片段、fd'片段、fd片段和经分离的互补决定区(cdr)区域,以及由抗体片段形成的三抗体、四抗体、线性抗体、单链抗体分子和多特异性抗体。fv片段是免疫球蛋白重链与轻链可变区的组合,并且scfv蛋白是重组单链多肽分子,其中免疫球蛋白轻链与重链可变区经由肽接头连接。在一些示例性实施方案中,抗体片段包含亲本抗体的足够的氨基酸序列,其是与亲本抗体结合相同抗原的片段;在一些示例性实施方案中,片段以与亲本抗体相当的亲和力结合至抗原和/或与亲本抗体竞争结合至抗原。抗体片段可通过任何方式产生。例如,抗体片段可通过完整抗体的片段化以酶促或化学方式产生和/或其可由编码部分抗体序列的基因以重组方式产生。或者或另外,抗体片段可全部或部分合成地产生。抗体片段可任选地包含单链抗体片段。或者或另外,抗体片段可包含例如通过二硫键联连接在一起的多条链。抗体片段可任选地包含多分子复合物。功能性抗体片段通常包含至少约50个氨基酸,并且更通常包含至少约200个氨基酸。[0329]术语“双特异性抗体”包括能够选择性地结合两个或更多个表位的抗体。双特异性抗体通常包含两条不同重链,每条重链特异性结合不同表位-在两种不同分子(例如,抗原)上或在相同分子(例如,相同抗原)上。如果双特异性抗体能够选择性地结合两个不同表位(第一表位和第二表位),则第一重链对第一表位的亲和力通常比第一重链对第二表位的亲和力低至少一个至两个或三个或四个数量级,并且反之亦然。由双特异性抗体识别的表位可在相同或不同靶标上(例如,在相同或不同蛋白质上)。双特异性抗体可例如通过组合识别相同抗原的不同表位的重链来制备。例如,可将编码识别相同抗原的不同表位的重链可变序列的核酸序列与编码不同重链恒定区的核酸序列融合,并且可在表达免疫球蛋白轻链的细胞中表达此类序列。[0330]典型的双特异性抗体具有两条重链,每条重链均具有三个重链cdr,接着是ch1结构域、铰链、ch2结构域和ch3结构域;和免疫球蛋白轻链,其不赋予抗原结合特异性但可与每条重链缔合,或者可与每条重链缔合并且可结合由重链抗原结合区结合的一个或多个表位,或者可与每条重链缔合并能够将一条或两条重链结合至一个或两个表位。bsab可分为两种主要类别,一类是带有fc区的抗体(igg样),而另一类是缺少fc区的抗体,后者通常小于包含fc的igg和igg样双特异性分子。igg样bsab可具有不同形式,例如但不限于三功能抗体(triomab)、杵臼igg(kihigg)、crossmab、orth-fabigg、双可变结构域ig(dvd-ig)、二合一或双重作用的fab(daf)、igg单链fv(igg-scfv)或κλ体。非igg样不同形式包括串联scfv、双抗体形式、单链双抗体、串联双抗体(tandab)、双亲和重靶向分子(dart)、dart-fc、纳米抗体或通过对接锁定(dnl)方法产生的抗体(gaoweifan,zujianwang和mingjuhao,bispecificantibodiesandtheirapplications,8journalofhematology&oncology130;dafnemüller和rolande.kontermann,bispecificantibodies,handbookoftherapeuticantibodies265-310(2014),其全部教导都并入本文)。产生bsab的方法不限于基于两种不同杂交瘤细胞系的体细胞融合的四源杂交瘤技术、涉及化学交联剂的化学缀合以及利用重组dna技术的遗传方法。bsab的实例包括在以下专利申请(其通过引用并入本文)中公开的那些:2010年6月25日提交的美国第12/823838号;2012年6月5日提交的美国第13/488628号;2013年9月19日提交的美国第14/031075号;2015年7月24日提交的美国第14/808171号;2017年9月22日提交的美国第15/713574号;2017年9月22日提交的美国第15/713569号;2016年12月21日提交的美国第15/386453号;2016年12月21日提交的美国第15/386443号;2016年7月29日提交的美国第15/22343号;和2017年11月15日提交的美国第15814095号。在制造双特异性抗体的几个步骤中,可存在少量同型二聚体杂质。当使用完整质量分析进行检测时,此类同型二聚体杂质的检测可具有挑战性,因为同型二聚体杂质的丰度低并且当使用常规液相色谱法进行检测时,这些杂质与主要种类共洗脱。[0331]如本文所用,“多特异性抗体”是指对至少两种不同抗原具有结合特异性的抗体。尽管此类分子通常仅结合两种抗原(即双特异性抗体,bsab),但具有额外特异性的抗体(例如三特异性抗体和kih三特异性抗体)还可由本文公开的系统和方法提出。[0332]如本文所用,术语“单克隆抗体”不限于经由杂交瘤技术产生的抗体。单克隆抗体可通过本领域可获得或已知的任何手段衍生自单一克隆,包括任何真核、原核或噬菌体克隆。可使用本领域已知的广泛多种技术来制备可用于本公开的单克隆抗体,包括使用杂交瘤、重组和噬菌体展示技术或其组合。[0333]在一些示例性实施方案中,目标蛋白质可具有在约4.5至约9.0范围内的pi。在一个示例性具体实施方案中,pi可为约4.5、约5.0、约5.5、约5.6、约5.7、约5.8、约5.9、约6.0、约6.1、约6.2、约6.3、约6.4、约6.5、约6.6、约6.7、约6.8、约6.9、约7.0、约7.1、约7.2、约7.3、约7.4、约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4、约8.5、约8.6、约8.7、约8.8、约8.9或约9.0。在一些示例性实施方案中,组合物中目标蛋白质的类型可超过一种。[0334]在一些示例性实施方案中,目标蛋白质可由哺乳动物细胞产生。哺乳动物细胞可具有人类来源或非人类来源,可包括原代上皮细胞(例如,角质细胞、宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾上皮细胞和视网膜上皮细胞);已建立的细胞系及其品系(例如,293胚胎肾细胞、bhk细胞、hela宫颈上皮细胞和per-c6视网膜细胞、mdbk(nbl-1)细胞、911细胞、crfk细胞、mdck细胞、cho细胞、bewo细胞、chang细胞、detroit562细胞、hela229细胞、helas3细胞、hep-2细胞、kb细胞、lsi80细胞、ls174t细胞、nci-h-548细胞、rpmi2650细胞、sw-13细胞、t24细胞、wi-28va13,2ra细胞、wish细胞、bs-c-i细胞、llc-mk2细胞、克隆m-3细胞、1-10细胞、rag细胞、tcmk-1细胞、y-l细胞、llc-pki细胞、pk(15)细胞、ghi细胞、gh3细胞、l2细胞、llc-rc256细胞、mhici细胞、xc细胞、mdok细胞、vsw细胞和th-i,b1细胞、bsc-1细胞、raf细胞、rk-细胞、pk-15细胞或其衍生物)、来自任何组织或器官(包括但不限于心脏、肝脏、肾脏、结肠、肠、食道、胃、神经组织(脑、脊髓)、肺、血管组织(动脉、静脉、毛细血管)、淋巴组织(淋巴腺、腺样体、扁桃体、骨髓和血液)、脾脏)的成纤维细胞、以及成纤维细胞和成纤维细胞样细胞系(例如,cho细胞、trg-2细胞、imr-33细胞、don细胞、ghk-21细胞、瓜氨酸血症细胞、dempsey细胞、detroit551细胞、detroit510细胞、detroit525细胞、detroit529细胞、detroit532细胞、detroit539细胞、detroit548细胞、detroit573细胞、hel299细胞、imr-90细胞、mrc-5细胞、wi-38细胞、wi-26细胞、midi细胞、cho细胞、cv-1细胞、cos-1细胞、cos-3细胞、cos-7细胞、vero细胞、dbs-frhl-2细胞、balb/3t3细胞、f9细胞、sv-t2细胞、m-msv-balb/3t3细胞、k-balb细胞、blo-11细胞、nor-10细胞、c3h/ioti/2细胞、hsdmic3细胞、kln205细胞、mccoy细胞、小鼠l细胞、品系2071(小鼠l)细胞、l-m品系(小鼠l)细胞、l-mtk'(小鼠l)细胞、nctc克隆2472和2555、scc-psa1细胞、swiss/3t3细胞、印度黄麂细胞、sirc细胞、cn细胞和jensen细胞、sp2/0、ns0、ns1细胞或其衍生物)。[0335]如本文所用,术语“蛋白质烷化剂”是指用于烷化蛋白质中某些游离氨基酸残基的试剂。蛋白质烷化剂的非限制性实例是碘乙酰胺(ioa)、氯乙酰胺(caa)、丙烯酰胺(aa)、n-乙基马来亚酰胺(nem)、甲烷硫代磺酸甲酯(mmts)和4-乙烯基吡啶或其组合。[0336]如本文所用,“蛋白质变性”可指其中分子的三维形状自其天然状态改变的过程。蛋白质变性可使用蛋白质变性剂进行。蛋白质变性剂的非限制性实例包括热、高或低ph值、还原剂如dtt(参见下文)或暴露于离液剂。几种离液剂可用作蛋白质变性剂。离液溶质通过干扰由非共价力(例如氢键、范德华力和疏水作用)介导的分子内相互作用增加系统的熵。离液剂的非限制性实例包括丁醇、乙醇、氯化胍、过氯酸锂、乙酸锂、氯化镁、苯酚、丙醇、十二烷基硫酸钠、硫脲、n-月桂酰肌氨酸、尿素及其盐。[0337]如本文所用,术语“蛋白质还原剂”是指用于还原蛋白质中的二硫桥的试剂。用于还原蛋白质的蛋白质还原剂的非限制性实例是二硫苏糖醇(dtt)、β-巯基乙醇、爱耳门氏试剂(ellman'sreagent)、盐酸羟胺、氰基硼氢化钠、三(2-羧乙基)膦盐酸盐(tcep-hcl)或其组合。[0338]如本文所用,术语多肽(例如,vegfrig结构域的多肽)的“变体”是指包含与目标蛋白质的参考或天然氨基酸序列至少约70-99.9%(例如70%、71%、72%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、99.9%)同一或相似的氨基酸序列的多肽。可通过例如blast算法来执行序列比较,其中选择算法的参数以在个别参考序列的整个长度上给出个别序列之间的最大匹配(例如,预期阈值:10;字长:3;查询范围内的最大匹配:0;blosum62矩阵;空位成本:存在11,延伸1;条件组成评分矩阵调整)。多肽(例如,vegfrig结构域的多肽)的变体还可指除一个或多个(例如1、2、3、4、5、6、7、8、9或10个)突变例如错义突变(例如保守取代)、无义突变、缺失或插入之外包含参考氨基酸序列的多肽。以下参考文献涉及经常用于序列分析的blast算法:blastalgorithms:altschul等人(2005)febsj.272(20):5101-5109;altschul,s.f.等人,(1990)j.mol.biol.215:403-410;gish,w.等人,(1993)naturegenet.3:266-272;madden,t.l.等人,(1996)meth.enzymol.266:131-141;altschul,s.f.等人,(1997)nucleicacidsres.25:3389-3402;zhang,j.等人,(1997)genomeres.7:649-656;wootton,j.c.等人,(1993)comput.chem.17:149-163;hancock,j.m.等人,(1994)comput.appl.biosci.10:67-70;alignmentscoringsystems:dayhoff,m.o.等人,“amodelofevolutionarychangeinproteins.”,atlasofproteinsequenceandstructure,(1978)第5卷,增刊3.m.o.dayhoff(编辑),第345-352页,natl.biomed.res.found.,washington,d.c.;schwartz,r.m.等人,“matricesfordetectingdistantrelationships.”,atlasofproteinsequenceandstructure,(1978)第5卷,增刊3.”m.o.dayhoff(编辑),第353-358页,natl.biomed.res.found.,washington,d.c.;altschul,s.f.,(1991)j.mol.biol.219:555-565;states,d.j.等人,(1991)methods3:66-70;henikoff,s.等人,(1992)proc.natl.acad.sci.usa89:10915-10919;altschul,s.f.等人,(1993)j.mol.evol.36:290-300;alignmentstatistics:karlin,s.等人,(1990)proc.natl.acad.sci.usa87:2264-2268;karlin,s.等人,(1993)proc.natl.acad.sci.usa90:5873-5877;dembo,a.等人,(1994)ann.prob.22:2022-2039;以及altschul,s.f.“evaluatingthestatisticalsignificanceofmultipledistinctlocalalignments.”,theoreticalandcomputationalmethodsingenomeresearch(s.suhai编),(1997)第1-14页,plenum,n.y.;其全部教导都并入本文。[0339]一些变体可为多肽在其核糖体合成期间(共翻译修饰)或之后(翻译后修饰“ptm”)经历的共价修饰。通常通过特定的酶或酶途径引入ptm。许多出现在蛋白质骨架内的特定特征性蛋白质序列(例如,特征序列)的位点处。已记录数百个ptm,并且这些修饰始终会影响蛋白质结构或功能的某些方面(walsh,g.“proteins”(2014)第二版,由wileyandsons,ltd.出版,isbn:9780470669853,其全部教导都并入本文)。在某些示例性实施方案中,蛋白质组合物可包含一种以上类型的目标蛋白质的蛋白质变体。[0340]在阿柏西普(和具有阿柏西普结构特征的蛋白质,例如,阿柏西普的一个或多个重链或轻链区)情况下的蛋白质变体可包含但不限于可由一个或多个在例如以下各处出现的氨基酸残基的氧化产生的氧化变体:组氨酸、半胱氨酸、甲硫氨酸、色氨酸、苯丙氨酸和/或酪氨酸残基;可由天冬酰胺残基处的脱酰胺产生的脱酰胺变体和/或由精氨酸残基处的脱氧葡糖醛酮化产生的变体。[0341]关于阿柏西普(和具有阿柏西普的结构特征的蛋白质,例如,阿柏西普的一个或多个重链或轻链区),氧化变体可包含在his86、his110、his145、his209、his95、his19和/或his203(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的组氨酸残基的氧化;在trp58和/或trp138(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的色氨酸残基的氧化;在tyr64(或具有阿柏西普的某些结构特征的蛋白质上的等效位置)处的酪氨酸残基的氧化;在phe44和/或phe166(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的苯丙氨酸残基的氧化;和/或在met10、met20、met163和/或met192(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的甲硫氨酸残基的氧化。[0342]关于阿柏西普(和具有阿柏西普的结构特征的蛋白质,例如阿柏西普的一个或多个重链或轻链区),脱酰胺变体可包含在asn84和/或asn99(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的天冬酰胺残基的脱酰胺。[0343]关于阿柏西普(和具有阿柏西普的结构特征的蛋白质,例如,阿柏西普的一个或多个重链或轻链区),脱氧葡糖醛酮化变体可包含在arg5(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的精氨酸残基的3-脱氧葡糖醛酮化。[0344]蛋白质变体可包括酸性种类和碱性种类。酸性种类通常是比cex的主峰更早洗脱或比aex的主峰更晚洗脱的变体,而碱性种类是比cex的主峰更晚洗脱或比aex的主峰更早洗脱的变体。[0345]如本文所用,术语“酸性种类”、“as”、“酸性区域”和“ar”是指特征为总酸性电荷的蛋白质变体。例如,在重组蛋白制剂中,可通过以下各种方法检测此类酸性种类,例如离子交换,例如wcx-10hplc(弱阳离子交换色谱)或ief(等电聚焦)。抗体的酸性种类可包括变体、结构变体和/或片段化变体。示例性变体可包括但不限于脱酰胺变体、无岩藻糖基化变体、氧化变体、甲基乙二醛(mgo)变体、糖化变体和柠檬酸变体。示例性结构变体包括但不限于糖基化变体和丙酮化变体。示例性片段化变体包括由于肽链的解离、酶和/或化学修饰而由靶分子产生的任何经修饰的蛋白质种类,包括但不限于fc和fab片段、缺少fab的片段、缺少重链可变结构域的片段、c末端截短变体、在轻链中切除n末端asp的变体以及具有轻链的n末端截短的变体。其他酸性种类变体包括包含以下各物的变体:未配对的二硫化物、宿主细胞蛋白和宿主核酸、色谱材料和培养基组分。通常,酸性种类在cex期间比主峰更早洗脱或在aex分析期间比主峰更晚洗脱(参见图16和图17)。[0346]在某些实施方案中,蛋白质组合物可包含一种以上类型的酸性种类变体。例如,但不作为限制,可基于出现的峰的色谱保留时间对总酸性种类进行分类。可将全部酸性种类归类的另一个实例可基于变体的类型—变体、结构变体或片段化变体。[0347]术语“酸性种类”或“as”不涉及过程相关的杂质。如本文所用,术语“过程相关的杂质”是指存在于包含蛋白质的组合物中但并非衍生自蛋白质本身的杂质。过程相关的杂质包括但不限于宿主细胞蛋白(hcp)、宿主细胞核酸、色谱材料和培养基组分。[0348]在一个示例性实施方案中,与目标蛋白质相比,抗vegf组合物中酸性种类的量可为至多约20%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一biochemistryofmethioninesulfoxideresiduesinproteins.trendsbiochem.sci.7:137-139,其全部教导都并入本文)。[0355]色氨酸的氧化可产生复杂的产物混合物。主要产物可为n-甲酰犬尿氨酸和犬尿氨酸以及单氧化、二氧化和/或三氧化产物(图4)。带有氧化的trp修饰的肽通常显示4、16、32和48da的质量增加,对应于形成犬尿氨酸(kyn)、羟基色氨酸(wox1)和n-甲酰犬尿氨酸/二羟基色氨酸(nfk/wox2,也称为“双重氧化的trp”)、三羟基色氨酸(wox3,也称为“三重氧化的trp”)及其组合,例如羟基犬尿氨酸(kynox1, 20da)。氧化为羟基色氨酸(wox1)(massspectrometricidentificationofoxidativemodificationsoftryptophanresiduesinproteins:chemicalartifactorpost-translationalmodification?j.am.soc.massspectrom.2010年7月;21(7):1114-1117,其全部教导都并入本文)。已发现色氨酸氧化而非甲硫氨酸和组氨酸氧化会在蛋白质产物中产生颜色变化(characterizationofthedegradationproductsofacolor-changedmonoclonalantibody:tryptophan-derivedchromophores.dx.doi.org/10.1021/ac404218t|anal.chem.2014,86,6850-6857)。与色氨酸相似,酪氨酸的氧化主要生成3,4-二羟基苯丙氨酸(dopa)和二酪氨酸(li,s,cschoneich和rt.borchardt.1995.chemicalinstabilityofproteinpharmaceuticals:mechanismsofoxidationandstrategiesforstabilization.biotechnol.bioeng.48:490-500)。[0356]如本文所用,术语“碱性种类”、“碱性区域”和“br”是指蛋白质,例如抗体或其抗原结合部分的变体,其特征在于相对于蛋白质中存在的初级电荷变体种类的总碱性电荷。例如,在重组蛋白制剂中,可通过各种方法,例如离子交换,例如wcx-10hplc(弱阳离子交换色谱)或ief(等电聚焦)检测此类碱性种类。示例性变体可包括但不限于赖氨酸变体、天冬氨酸的异构化、天冬酰胺处的琥珀酰亚胺形成、甲硫氨酸氧化、酰胺化、不完全二硫键形成、从丝氨酸至精氨酸的突变、无糖基化、片段化和聚集。通常,碱性种类的洗脱在cex期间晚于主峰或在aex分析期间早于主峰。(chromatographicanalysisoftheacidicandbasicspeciesofrecombinantmonoclonalantibodies.mabs.2012年9月1日;4(5):578–585.doi:10.4161/mabs.21328,其全部教导都并入本文。)[0357]在某些实施方案中,蛋白质组合物可包含一种以上类型的碱性种类变体。例如但不限于,可基于出现的峰的色谱保留时间对总碱性种类进行划分。可划分总碱性种类的另一个实例可基于变体的类型—变体、结构变体或片段化变体。[0358]如针对酸性种类所论述,术语“碱性种类”不包括过程相关的杂质,并且碱性种类可为产物制备的结果(在本文中称为“制备来源的碱性种类”)或储存的结果(在本文中称为“储存来源的碱性种类”)。[0359]在一个示例性实施方案中,与目标蛋白质相比,抗vegf组合物中碱性种类的量可为至多约15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。抗vegf组合物的实例论述于以下部分iii中。在一个方面,抗vegf组合物可包含选自由以下组成的组的抗vegf蛋白:阿柏西普、重组minitrap(其实例在美国专利第7,279,159号中公开)、scfv和其他抗vegf蛋白。在一个优选的方面,目标重组蛋白是阿柏西普。[0360]如本文所用,“样品基质”或“生物样品”可获自生物工艺的任何步骤,例如细胞培养液(ccf)、收获的细胞培养液(hccf)、下游加工中的任何步骤、原料药(ds)或包含最终配制产物的药品(dp)。在一些其他特定示例性实施方案中,生物样品可选自澄清、色谱产生、病毒灭活或过滤的下游过程的任何步骤。在一些特定示例性实施方案中,药品可选自诊所、运输、储存或处理中的制造药品。[0361]如本文所用,术语“受试者”是指哺乳动物(例如,大鼠、小鼠、猫、狗、奶牛、绵羊、马、山羊、兔),优选是需要预防和/或治疗癌症或血管生成性眼部病症的人类。受试者可能患有癌症或血管生成性眼部病症,或易患癌症或血管生成性眼部病症。[0362]就蛋白质制剂而言,如本文所用,术语“稳定的”是指在本文所定义的示例性条件下储存后,所述制剂内的目标蛋白质能够保持可接受程度的化学结构或生物功能。即使其中所含的目标蛋白质在储存限定量的时间后未保持100%的其化学结构或生物功能,制剂还可为稳定的。在某些情形下,储存限定量的时间后保持约90%、约95%、约96%、约97%、约98%或约99%的蛋白质结构或功能可视为“稳定的”。[0363]术语“治疗(treat)”或“治疗(treatment)”是指逆转、稳定或消除不希望的疾病或病症(例如,血管生成性眼部病症或癌症)的治疗措施,例如,通过使所述种疾病或病症的一种或多种症状或征象消退、稳定或消除任何临床可测量的程度(例如,关于血管生成性眼部病症);通过使糖尿病性视网膜病严重程度评分(drss)降低或维持;通过改善或维持视力(例如,最佳矫正视力,例如,通过etdrs字母的增加来量度);增加或维持视野和/或减小或维持中央视网膜厚度;以及就癌症而言,停止或逆转受试者中的癌细胞的生长、存活和/或转移。通常,治疗措施是向患有疾病或病症的受试者施用一个或多个剂量的治疗有效量的vegfminitrap。[0364]在蛋白质制备的情形下,如本文所用,术语“上游工艺技术”是指涉及在目标蛋白质的细胞培养期间或之后由细胞产生蛋白质和收集蛋白质的活动。如本文所用,术语“细胞培养”是指用于产生和维持能够产生目标重组蛋白的宿主细胞群的方法,以及用于优化目标蛋白质的产生和收集的方法和技术。例如,一旦将表达载体并入合适的宿主细胞中,则可将宿主细胞维持在适于相关核苷酸编码序列的表达以及所需重组蛋白的收集和产生的条件下。[0365]当使用本发明的细胞培养技术时,目标蛋白质可在胞内、在周质空间中产生,或直接分泌至培养基中。在胞内产生目标蛋白质的实施方案中,可通过包括但不限于离心或超滤的多种方式去除微粒碎片-宿主细胞或溶解的细胞(例如,由均质化产生的碎片)。当目标蛋白质分泌至培养基中时,可首先使用市售的蛋白质浓缩过滤器(例如,使用amicontm或milliporepellicontm超滤单元)浓缩来自此类表达系统的上清液。在一个方面,可通过离心,接着深度过滤,随后亲和捕获色谱来收获目标蛋白质。[0366]如本文所用,“vegf拮抗剂”是与vegf结合或相互作用的任何蛋白质或肽。通常,这种与vegf的结合或相互作用会抑制vegf与其受体(vegfr1和vegfr2)的结合,和/或抑制vegf的生物信号传导和活性。vegf拮抗剂包括干扰vegf与天然vegf受体之间的相互作用的分子,例如,与vegf或vegf受体结合并阻止或以其他方式阻碍vegf与vegf受体之间的相互作用的分子。特定的示例性vegf拮抗剂包括抗vegf抗体(例如兰尼单抗(ranibizumab))、抗vegf受体抗体(例如,抗vegfr1抗体、抗vegfr2抗体等)、以及基于vegf受体的嵌合分子或vegf抑制融合蛋白(在本文中也称为“vegf-trap”或“vegfminitrap”),例如阿柏西普、ziv-阿柏西普和具有seqidno.:60的氨基酸的蛋白质。vegf-trap的其他实例是alt-l9、m710、fyb203和chs-2020。vegf-trap的额外实例可见于美国专利第7,070,959号;第7,306,799号;第7,374,757号;第7,374,758号;第7,531,173号;第7,608,261号;第5,952,199号;第6,100,071号;第6,383,486号;第6,897,294号和第7,771,721号中,此类专利明确地通过引用整体并入本文。[0367]基于vegf受体的嵌合分子包括嵌合多肽,其包含vegf受体如vegfr1(也称为flt1)和/或vegfr2(也称为flk1或kdr)的两个或更多个免疫球蛋白(ig)样结构域,并且还可包含多聚结构域(例如,促进两种或更多种嵌合多肽的多聚化[例如,二聚化]的fc结构域)。示例性的基于vegf受体的嵌合分子被称为vegfr1r2-fcδc1(a)的分子(也称为阿柏西普;以商品名出售)。在某些示例性实施方案中,阿柏西普包含如下所列的氨基酸序列:[0368]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfmwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk。(seqidno.:55)[0369]如本文所用,“病毒过滤”可包括使用合适的过滤器进行过滤,所述过滤器包括但不限于来自asahikaseipharma的planova20ntm、50n或bioex;来自emdmillipore的viresolvetm过滤器;来自sartorius的virosartcpv;或来自pallcorporation的ultipordv20或dv50tm过滤器。对于本领域普通技术人员显而易见的是,选择合适的过滤器以获得所需过滤性能。[0370]ii.颜色测定[0371]如本文所用,可通过各种方法来测量在重组蛋白、具体来说抗vegf蛋白的产生期间观察到的颜色。非限制性实例包括使用碘色号、黑曾(hazen)色号、加德纳(gardner)色号、洛维邦德(lovibond)色号、赛氏(saybolt)色号、矿物油色号、欧洲药典色号、美国药典色号、ciel*,a*,b*(或cielab)、凯尔特(klett)色号、hess-ives色号、黄度指数、admi色号以及asbc和ebc啤酒色号。有关此类标度的细节可见于lange的申请报告第3.9e号中,其全部教导都并入本文。[0372]基于欧洲药典(pheur)(欧洲颜色标准,参见europeanpharmacopoeia.第2.2.2章degreeofcolorationofliquids.第8版ep,其全部教导都并入本文)的视觉色彩匹配可包括制备如下中所述的颜色参考溶液:ph.eur.(ep2.2.2.degreeofcolorationofliquids2)-制备红色(氯化钴(ii))、黄色(氯化亚铁(iii))和蓝色(硫酸亚铜(ii))的三种母液以及1%盐酸,黄色(y)、绿黄色(gy)、棕黄色(by)、棕色(b)和红色(r)色相的五种颜色参考溶液。依次使用这五种参考溶液,总共制备三十七种颜色参考溶液(y1-y7、gy1-gy7、by1-by7、b1-b9和r1-r7)。每个参考溶液都在cie-lab色彩空间中由例如明度、色相和色度明确定义。在七个黄棕色标准(by标准)中,by1是最暗标准,而by7是最不暗标准。给定样品与by颜色标准的匹配通常是在漫射日光下进行。欧洲黄棕色颜色标准的组成在下表1中描述。[0373]表1.欧洲棕黄色标准的组成[0374][0375]棕黄色标准溶液(by):10.8g/lfecl3.6h2o、6.0g/lcocl2.6h2o和2.5g/lcuso4.5h2o[0376]液体颜色的测试是通过将测试溶液与标准颜色溶液进行比较来进行。根据测试溶液颜色的色相和强度来选择标准颜色溶液的组成。通常,比较是在无色、透明、中性玻璃的平底试管中进行,所述试管的内径和所有其他方面都应尽可能匹配(例如,直径为约12、15、16或25mm的试管)。例如,比较可在2或10ml的测试溶液与标准颜色溶液之间进行。液体的深度例如可为约15、25、40或50mm。分配给测试溶液的颜色不应比标准颜色更强烈。颜色比较通常是在针对白色背景的漫射光(例如,日光)下进行。可沿试管的垂直轴或水平轴比较颜色。[0377]与ep颜色测量对比,uspmonograph1061color–instrumentalmeasurement引用ciel*,a*,b*(或cielab)颜色测量的使用以便精确和客观地量化颜色。在美国药典中定义总共二十种颜色参考溶液(依次由字母a至t识别)。所测量样品的颜色自动与颜色参考溶液相关。这意味着展示最接近样品的颜色参考溶液(即,与样品颜色具有最小色差δe*的参考溶液)。δl*、δa*和δb*值给出样品的l*、a*和b*值与所示usp溶液的l*、a*和b*值之间的定量差异。ciel*a*b*坐标系,l*代表颜色的明度,标度为0–100,其中0是最暗并且100是最亮;a*代表颜色的红度或绿度(正值a*代表红色,而负值a*代表绿色),并且b*代表样品的黄度或蓝度,其中正值b*代表黄色,而负值b*代表蓝色。与标准或评估中的初始样品的颜色差异可通过个别颜色组分的变化δl*、δa*和δb*来表示。复合变化或颜色差异可使用下式来计算作为空间中的简单欧氏距离(euclidiandistance):可例如使用hunterlabsultrascanpro(hunterassociateslaboratory,reston,virginia)或bykgardnerlcsiv(byk-gardner,columbia,maryland)生成ciel*,a*,b*颜色坐标。对于hunterlabsultrascanpro,可执行didymiumfiltertest以用于波长校准。仪器在使用前可在具有0.780英寸端口插件和diw的ttran中标准化;因此,使用光阱和黑卡建立光度标度的顶部(l=100)和底部(l=0)。参见pack等人,modernizationofphysicalappearanceandsolutioncolortestsusingquantitativetristimuluscolorimetry:advantages,harmonization,andvalidationstrategies,j.pharmaceuticalsci.104:3299-3313(2015),其全部教导都并入本文。by标准的颜色也可在ciel*,a*,b*颜色空间(“cielab”或“cielab”颜色空间)下表示。参见表2。[0378]表2.ciel*,a*,b*颜色空间中欧洲棕黄色颜色标准的表征[0379]标准l*^a*^b*^l*~a*~b*~by193.95-2.7628.5592.84-3.1631.15by294.76-2.9622.6994.25-3.7726.28by396.47-2.8416.4195.92-3.4418.52by497.17-1.949.0797.67-2.6310.70by598.91-1.194.7398.75-1.615.77by699.47-0.592.0999.47-0.712.38by799.37-0.311.1399.71-0.371.17[0380]^由pack等人报告[0381]~本文中以实验方式测量-l*和b*值,针对每个by颜色标准[0382]为了对颜色测定进行高通量筛选,与by颜色标准相比,分光光度测定法(cielab)是更适合且更具量化性的量度。如实施例部分所述,进一步优化替代测定。[0383]对于评估颜色的任何样品,必须针对样品中的蛋白质浓度标准化测试样品的蛋白质浓度,例如5g/l、10g/l等用于比较。[0384]iii.抗vegf组合物[0385]调节vegf信号通路的vegf蛋白质家族中有至少有五个成员:vegf-a、vegf-b、vegf-c、vegf-d和胎盘生长因子(plgf)。抗vegf组合物可包含vegf拮抗剂,其与vegf蛋白质家族的一个或多个成员特异性相互作用,并抑制其一种或多种生物活性,例如其促有丝分裂、血管生成和/或血管通透性活性。[0386]在一个实施方案中,产生抗vegf蛋白的方法包括:(a)提供经基因工程化以表达抗vegf蛋白的宿主细胞;(b)在适于细胞表达抗vegf蛋白的条件下在cdm中培养宿主细胞;以及(c)收获由细胞产生的抗vegf蛋白的制剂。在一个方面,抗vegf蛋白选自由以下组成的组:阿柏西普、重组minitrap(其实例在美国专利第7,279,159号中公开)、scfv和其他抗vegf蛋白。在一个优选的方面,目标重组蛋白是阿柏西普。[0387]本发明人发现,在某些cdm中制造抗vegf蛋白(例如,阿柏西普)产生呈现独特颜色的生物样品。在不同制造步骤中并且甚至在包含抗vegf蛋白的最终制剂中都观察到不同颜色特性。如实施例9中所观察,为了产生vegfminitrap,在cdm中培养细胞产生具有强烈的黄棕色的抗vegf蛋白(例如,阿柏西普)。收获后的亲和捕获步骤还产生呈现某种颜色(黄棕色)的洗脱液。使用aex的其他产生步骤也呈现黄棕色,但强度降低。[0388]如下文中更详细地描述,颜色可使用以下手段来评价:(i)欧洲颜色标准by,其中进行定性目视检查;或(ii)比色测定,cielab,其比by系统更具量化性。然而,无论哪种情况,都应针对蛋白质浓度将多个样品之间的颜色评价进行归一化,以确保有意义的评价/比较。例如,参看实施例9,特别是表9-2,蛋白a洗脱液具有约2.52的b*值,大致相当于by5的by值(在蛋白a洗脱液中以5g/l的蛋白质浓度测量时)。如果要将蛋白a洗脱液的颜色与另一样品进行比较,则应使用相同的蛋白质浓度进行所述比较。因此,将蛋白a洗脱液与具有约0.74的b*值(在蛋白a洗脱液中以5g/l的蛋白质浓度测量时)的aex池相比较,产生方法显示在aex色谱之后,从蛋白a洗脱液至aex池,样品的黄棕色大幅减弱。[0389]本发明的组合物的特征可在于如本文所论述的黄棕色,例如,不比欧洲棕黄色颜色标准by2-by3、by3-by4、by4-by5或by5-by6更暗/强烈,和/或具有b*值17-23、10-17、5-10、3-5或1-3,其中组合物包含约5g/l的抗vegf蛋白或约10g/l的抗vegf蛋白,并且其中组合物是从澄清收获物或澄清收获物的蛋白a洗脱液中作为样品获得。[0390]在一个实施方案中,使用cdm产生的本发明的组合物产生具有明显黄棕色的生物样品,其中所述样品可通过公认的标准颜色表征来表征:[0391](i)黄棕色不超过欧洲颜色标准by2;[0392](ii)黄棕色不超过欧洲颜色标准by3;[0393](iii)黄棕色不超过欧洲颜色标准by4;[0394](iv)黄棕色不超过欧洲颜色标准by5;[0395](v)介于欧洲颜色标准by2与by3之间;[0396](vi)介于欧洲颜色标准by3与by4之间;[0397](vii)介于欧洲颜色标准by4与by5之间,其中组合物包含约5g/l或约10g/l的抗vegf蛋白并且其中组合物是从澄清收获物的蛋白a洗脱液中作为样品获得。[0398]在另一个实施方案中,使用cdm产生的本发明的组合物产生具有明显黄棕色的生物样品,其中所述组合物通过cielab标度中公认的标准颜色表征来表征:[0399](i)黄棕色不超过约22-23的b*值;[0400](ii)黄棕色不超过约16-17的b*值;[0401](iii)黄棕色不超过9-10的b*值;[0402](iv)黄棕色不超过4-5的b*值;[0403](v)黄棕色不超过2-3的b*值;[0404](vi)介于17-23之间的b*值;[0405](vii)介于10-17之间的b*值;[0406](viii)介于5-10之间的b*值;[0407](ix)介于3-5之间的b*值;或[0408](x)介于1-3之间的b*值,其中组合物包含约5g/l或约10g/l的抗vegf蛋白并且其中组合物是从澄清收获物的蛋白a洗脱液中作为样品获得。[0409]在一个实施方案中,使用cdm产生的本发明的组合物可包含抗vegf蛋白的其他种类或变体。这些变体包括抗vegf蛋白同功型,其包含一个或多个氧化的氨基酸残基,所述同功型统称为氧代变体。此类包含抗vegf蛋白及其氧代变体的组合物的酶消化物可包含以下一者或多者:[0410]eiglltc*eatvngh*lyk(seqidno.:18),其包含约0.004-0.013%的2-氧代-组氨酸,[0411]qtntiidvvlspsh*gielsvgek(seqidno.:19),其包含约0.006-0.028%的2-氧代-组氨酸,[0412]telnvgidfnweypsskh*qhk(seqidno.:20),其包含约0.049-0.085%的2-氧代-组氨酸,[0413]dkth*tc*ppc*papellg(seqidno.:17),其包含约0.057-0.092%的2-氧代-组氨酸,[0414]tnylth*r(seqidno.:21),其包含约0.008-0.022%的2-氧代-组氨酸,和/或[0415]iiwdsr(seqidno.:56),其包含约0.185-0.298%的二氧化色氨酸;[0416]或[0417]eiglltc*eatvngh*lyk(seqidno.:18),其包含约0.008%的2-氧代-组氨酸,[0418]qtntiidvvlspsh*gielsvgek(seqidno.:19),其包含约0.02%的2-氧代-组氨酸,[0419]telnvgidfnweypsskh*qhk(seqidno.:20),其包含约0.06%的2-氧代-组氨酸,[0420]dkth*tc*ppc*papellg(seqidno.:17),其包含约0.07%的2-氧代-组氨酸,[0421]tnylth*r(seqidno.:21),其包含约0.01%的2-氧代-组氨酸,和/或[0422]iiwdsr(seqidno.:56),其包含约0.23%的二-氧代-色氨酸,其中h*是可被氧化成2-氧代-组氨酸的组氨酸,并且其中c*是可被羧甲基化的半胱氨酸。在一个特定实施方案中,抗vegf蛋白是阿柏西普。在另一个实施方案中,抗vegf蛋白是vegfminitrap。[0423]在本发明的一个示例性实施方案中,本发明的组合物可包含抗vegf蛋白,其中抗vegf蛋白中不多于约1%、不多于约0.1%或约0.1-1%、0.2-1%、0.3-1%、0.4-1%、0.5-1%、0.6-1%、0.7-1%、0.8-1%或0.9-1%的组氨酸残基是2-氧代-组氨酸。在此类组合物中,可存在抗vegf蛋白变体的异质群体,每个变体具有不同量的2-氧代-组氨酸残基和未氧化的组氨酸残基。因此,组合物中的2-氧代-组氨酸抗vegf蛋白的百分比是指抗vegf分子中的位点特异性2-氧代-组氨酸除以抗vegf蛋白分子中的总位点特异性组氨酸(氧化加未氧化)乘以100。定量组合物中的2-氧代-组氨酸水平的一种方法是用蛋白酶(例如,lys-c和/或胰蛋白酶)消化多肽和通过例如质谱(ms)分析所得肽中的2-氧代-组氨酸的量。[0424]在消化抗vegf蛋白之前,半胱氨酸巯基通过与碘乙酰胺(iam)的反应被阻断,产生由以下化学结构表示的残基:[0425]此类修饰保护游离硫醇免于重整二硫桥,并防止二硫键加扰。本发明包括包含抗vegf蛋白及其变体的组合物(例如,水性组合物),当用iam修饰并用蛋白酶(例如,lys-c和胰蛋白酶)消化并通过质谱进行分析时,其包含以下肽:[0426]eiglltc*eatvngh*lyk(seqidno.:18),其包含约0.004-0.013%的2-氧代-组氨酸,[0427]qtntiidvvlspsh*gielsvgek(seqidno.:19),其包含约0.006-0.028%的2-氧代-组氨酸,[0428]telnvgidfnweypsskh*qhk(seqidno.:20),其包含约0.049-0.085%的2-氧代-组氨酸,[0429]dkth*tc*ppc*papellg(seqidno.:17),其包含约0.057-0.092%的2-氧代-组氨酸,[0430]tnylth*r(seqidno.:21),其包含约0.008-0.022%的2-氧代-组氨酸,和/或[0431]iiwdsr(seqidno.:56),其包含约0.185-0.298%的二氧化色氨酸;[0432]或ms)分析从亲和步骤中提取的样品时,可检测到一种或多种这些变体。[0444]本发明包括包含抗vegf蛋白的组合物,其中抗vegf蛋白中所有色氨酸的约0.1%-10%被修饰为三羟基色氨酸。此外,组合物的颜色不比欧洲棕黄色颜色标准by2-by3、by3-by4、by4-by5或by5-by6更暗/强烈,和/或具有如通过ciel*,a*,b*所表征的以下b*值:约17-23、10-17、5-10、3-5或1-3,其中组合物包含约5g/l的抗vegf蛋白或约10g/l的抗vegf蛋白。组合物是从澄清收获物或澄清收获物的蛋白a洗脱液中作为样品获得。此类组合物可使用捕获色谱获得。捕获步骤是使用例如蛋白a亲和柱的亲和色谱程序。当使用液相色谱-质谱法(lc-ms)分析从亲和中提取的样品时,可检测到一种或多种这些变体。[0445]在一个实施方案中,本发明的组合物可包含抗vegf蛋白,其中抗vegf蛋白可包含如下一个或多个残基的修饰:一个或多个天冬酰胺被脱酰胺;一个或多个天冬氨酸被转化为异天冬氨酸和/或asn;一个或多个甲硫氨酸被氧化;一个或多个色氨酸被转化为n-甲酰犬尿氨酸;一个或多个色氨酸是单羟基色氨酸;一个或多个色氨酸是二羟基色氨酸;一个或多个色氨酸是三羟基色氨酸;一个或多个精氨酸被转化为arg3-脱氧葡糖醛酮;c末端甘氨酸不存在;和/或存在一个或多个非糖基化糖位点。[0446]此类组合物可从使用包含抗vegf蛋白以及其变体的cdm制成的澄清收获物中获得,所述澄清收获物经历例如捕获色谱程序。捕获步骤是使用例如蛋白a柱的亲和色谱程序。当使用例如液相色谱-质谱法(lc-ms)分析从亲和步骤中提取的样品时,可检测到一种或多种这些变体。[0447]在一个示例性实施方案中,本发明的组合物可包含具有阿柏西普的结构特征的抗vegf蛋白,其可在以下一者或多者处被氧化:his86、his110、his145、his209、his95、his19和/或his203(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置);trp58和/或trp138(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置);tyr64(或具有阿柏西普的某些结构特征的蛋白质上的等效位置);phe44和/或phe166(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置);和/或met10、met20、met163和/或met192(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置。此类组合物可从使用包含阿柏西普以及其氧代变体的cdm制成的澄清收获物中获得,所述澄清收获物经历捕获色谱程序。捕获步骤可为使用例如蛋白a柱的亲和色谱程序。当使用例如液相色谱-质谱法(lc-ms)分析从亲和步骤中提取的样品时,可检测到一种或多种这些变体。[0448]在一个实施方案中,本发明的组合物可包含具有氨基酸序列seqidno.:46的vegfminitrap,其可在以下各处被氧化:his86、his110、his145、his209、his95、his19和/或his203;trp58和/或trp138;tyr64;phe44和/或phe166;和/或met10、met20、met163和/或met192。此类组合物可从使用包含vegfminitrap以及其氧代变体的cdm制成的澄清收获物中获得,所述澄清收获物经历捕获色谱程序。捕获步骤是使用例如蛋白a柱的亲和色谱程序-当使用液相色谱-质谱法(lc-ms)进行分析时,可检测到一种或多种这些变体。[0449]在一些示例性实施方案中,本发明的组合物可包含抗vegf蛋白及其变体(包括氧代变体),其中组合物中的蛋白质变体的量可为至多约20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。此类组合物可从使用包含抗vegf蛋白以及其变体的cdm制成的澄清收获物中获得,所述澄清收获物经历捕获色谱程序。捕获步骤是使用例如蛋白a柱的亲和色谱程序-当使用液相色谱-质谱法(lc-ms)进行分析时,可检测到一种或多种这些变体。在一个方面,这种组合物的颜色不比例如欧洲棕黄色颜色标准by2-by3、by3-by4、by4-by5或by5-by6更暗/强烈,和/或具有如通过ciel*,a*,b*所表征的以下b*值:约17-23、10-17、5-10、3-5或1-3,其中组合物包含约5g/l或约10g/l的抗vegf蛋白。[0450]在其他示例性实施方案中,本发明的组合物可包含抗vegf蛋白及其变体,其中组合物中的蛋白质变体的量可为约0%至约20%,例如,约0%至约20%、约0.05%至约20%、约0.1%至约20%、约0.2%至约20%、约0.3%至约20%、约0.4%至约20%、约0.5%至约20%、约0.6%至约20%、约0.7%至约20%、约0.8%至约20%、约0.9%至约20%、约1%至约20%、约1.5%至约20%、约2%至约20%、约3%至约20%、约4%至约20%、约5%至约20%、约6%至约20%、约7%至约20%、约8%至约20%、约9%至约20%、约10%至约20%、约0%至约10%、约0.05%至约10%、约0.1%至约10%、约0.2%至约10%、约0.3%至约10%、约0.4%至约10%、约0.5%至约10%、约0.6%至约10%、约0.7%至约10%、约0.8%至约10%、约0.9%至约10%、约1%至约10%、约1.5%至约10%、约2%至约10%、约3%至约10%、约4%至约10%、约5%至约10%、约6%至约10%、约7%至约10%、约8%至约10%、约9%至约10%、约0%至约7.5%、约0.05%至约7.5%、约0.1%至约7.5%、约0.2%至约7.5%、约0.3%至约7.5%、约0.4%至约7.5%、约0.5%至约7.5%、约0.6%至约7.5%、约0.7%至约7.5%、约0.8%至约7.5%、约0.9%至约7.5%、约1%至约7.5%、约1.5%至约7.5%、约2%至约7.5%、约3%至约7.5%、约4%至约7.5%、约5%至约7.5%、约6%至约7.5%、约7%至约7.5%、约0%至约5%、约0.05%至约5%、约0.1%至约5%、约0.2%至约5%、约0.3%至约5%、约0.4%至约5%、约0.5%至约5%、约0.6%至约5%、约0.7%至约5%、约0.8%至约5%、约0.9%至约5%、约1%至约5%、约1.5%至约5%、约2%至约5%、约3%至约5%、约4%至约5%,以及在上述一者或多者内的范围。此类组合物可通过对收获物样品进行捕获色谱而获得。捕获步骤是使用例如蛋白a柱的亲和色谱程序。当使用液相色谱-质谱法(lc-ms)分析样品时,可检测到一种或多种这些变体。在一个方面,这种组合物的颜色不比例如欧洲棕黄色颜色标准by2-by3、by3-by4、by4-by5或by5-by6更暗/强烈,和/或具有如通过ciel*,a*,b*所表征的以下b*值:约17-23、10-17、5-10、3-5或1-3,其中组合物包含约5g/l或约10g/l的抗vegf蛋白。[0451]在一个实施方案中,本发明的组合物可包含抗vegf蛋白,包括其酸性种类,其中组合物中的酸性种类的量可为约20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。如前述所论述,此类酸性种类可通过各种方法如离子交换,例如wcx(wcx-10hplc,弱阳离子交换色谱)或ief(等电聚焦)来检测。通常,酸性种类的洗脱在cex期间早于主峰或在aex分析期间晚于主峰(参见图16和图17)。包含酸性种类的组合物可使用离子交换色谱由生物材料(例如收获物或亲和产生的材料)获得。[0452]在一个方面,这种组合物的颜色不比例如欧洲棕黄色颜色标准by2-by3、by3-by4、by4-by5或by5-by6更暗/强烈,和/或具有如通过ciel*,a*,b*所表征的以下b*值:约17-23、10-17、5-10、3-5或1-3,其中组合物包含约5g/l或约10g/l。作为一个实例,参看图16和图17,级分f1和f2代表包含大部分酸性种类的酸性级分。图17中的mt1的峰1和2包含酸性种类,并且级分f1和f2包含大部分酸性级分。与其他级分相比,包含此类酸性种类的级分(f1和f2)也显示出黄棕色(图18b和图18c)。[0453]在另一个实施方案中,本发明的组合物包含抗vegf蛋白,包括其酸性种类,其中组合物中的酸性种类的量可为约0%至约20%,例如,约0%至约20%、约0.05%至约20%、约0.1%至约20%、约0.2%至约20%、约0.3%至约20%、约0.4%至约20%、约0.5%至约20%、约0.6%至约20%、约0.7%至约20%、约0.8%至约20%、约0.9%至约20%、约1%至约20%、约1.5%至约20%、约2%至约20%、约3%至约20%、约4%至约20%、约5%至约20%、约6%至约20%、约7%至约20%、约8%至约20%、约9%至约20%、约10%至约20%、约0%至约10%、约0.05%至约10%、约0.1%至约10%、约0.2%至约10%、约0.3%至约10%、约0.4%至约10%、约0.5%至约10%、约0.6%至约10%、约0.7%至约10%、约0.8%至约10%、约0.9%至约10%、约1%至约10%、约1.5%至约10%、约2%至约10%、约3%至约10%、约4%至约10%、约5%至约10%、约6%至约10%、约7%至约10%、约8%至约10%、约9%至约10%、约0%至约7.5%、约0.05%至约7.5%、约0.1%至约7.5%、约0.2%至约7.5%、约0.3%至约7.5%、约0.4%至约7.5%、约0.5%至约7.5%、约0.6%至约7.5%、约0.7%至约7.5%、约0.8%至约7.5%、约0.9%至约7.5%、约1%至约7.5%、约1.5%至约7.5%、约2%至约7.5%、约3%至约7.5%、约4%至约7.5%、约5%至约7.5%、约6%至约7.5%、约7%至约7.5%、约0%至约5%、约0.05%至约5%、约0.1%至约5%、约0.2%至约5%、约0.3%至约5%、约0.4%至约5%、约0.5%至约5%、约0.6%至约5%、约0.7%至约5%、约0.8%至约5%、约0.9%至约5%、约1%至约5%、约1.5%至约5%、约2%至约5%、约3%至约5%、约4%至约5%,以及在上述一者或多者内的范围。如上所述,可通过各种方法如离子交换,例如wcx(wcx-10hplc,弱阳离子交换色谱)或ief(等电聚焦)来检测此类酸性种类。典型地,酸性种类的洗脱在cex期间早于主峰或在aex分析期间晚于主峰(参见图16和图17)。[0454]使用阳离子交换柱,将目标主峰之前洗脱的所有峰累加为酸性区域,而目标蛋白后洗脱的所有峰累加为碱性区域。在示例性实施方案中,基于峰的特定保留时间和所用离子交换柱,可将酸性种类洗脱为两个或更多个酸性区域,并且可编号为ar1、ar2、ar3等等。[0455]在一个实施方案中,组合物可包含抗vegf蛋白,包括酸性种类,其中ar1为20%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白,包括其酸性种类,其中ar1为约0.0%至约10%、约0.0%至约5%、约0.0%至约4%、约0.0%至约3%、约0.0%至约2%、约3%至约5%、约5%至约8%、或约8%至约10%、或约10%至约15%,以及在上述一者或多者内的范围。如上文所论述,可通过各种方法如离子交换,例如wcx(wcx-10hplc,弱阳离子交换色谱)或ief(等电聚焦)来检测此类酸性区域。通常,酸性种类的洗脱在cex期间早于主峰或在aex分析期间晚于主峰(参见图16和图17)。[0456]在另一个实施方案中,组合物可包含抗vegf蛋白,包括酸性种类,其中ar2为20%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白,包括酸性种类,其中ar2为约0.0%至约10%、约0.0%至约5%、约0.0%至约4%、约0.0%至约3%、约0.0%至约2%、约3%至约5%、约5%至约8%、或约8%至约10%、或约10%至约15%,以及在上述一者或多者内的范围。[0457]在一个实施方案中,组合物可包含抗vegf蛋白,包括碱性种类,其中组合物中的碱性种类的量可为至多约20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白及其碱性种类,其中与抗vegf蛋白相比,组合物中的碱性种类的量可为0%至约20%,例如,约0%至约20%、约0.05%至约20%、约0.1%至约20%、约0.2%至约20%、约0.3%至约20%、约0.4%至约20%、约0.5%至约20%、约0.6%至约20%、约0.7%至约20%、约0.8%至约20%、约0.9%至约20%、约1%至约20%、约1.5%至约20%、约2%至约20%、约3%至约20%、约4%至约20%、约5%至约20%、约6%至约20%、约7%至约20%、约8%至约20%、约9%至约20%、约10%至约20%、约0%至约10%、约0.05%至约10%、约0.1%至约10%、约0.2%至约10%、约0.3%至约10%、约0.4%至约10%、约0.5%至约10%、约0.6%至约10%、约0.7%至约10%、约0.8%至约10%、约0.9%至约10%、约1%至约10%、约1.5%至约10%、约2%至约10%、约3%至约10%、约4%至约10%、约5%至约10%、约6%至约10%、约7%至约10%、约8%至约10%、约9%至约10%、约0%至约7.5%、约0.05%至约7.5%、约0.1%至约7.5%、约0.2%至约7.5%、约0.3%至约7.5%、约0.4%至约7.5%、约0.5%至约7.5%、约0.6%至约7.5%、约0.7%至约7.5%、约0.8%至约7.5%、约0.9%至约7.5%、约1%至约7.5%、约1.5%至约7.5%、约2%至约7.5%、约3%至约7.5%、约4%至约7.5%、约5%至约7.5%、约6%至约7.5%、约7%至约7.5%、约0%至约5%、约0.05%至约5%、约0.1%至约5%、约0.2%至约5%、约0.3%至约5%、约0.4%至约5%、约0.5%至约5%、约0.6%至约5%、约0.7%至约5%、约0.8%至约5%、约0.9%至约5%、约1%至约5%、约1.5%至约5%、约2%至约5%、约3%至约5%、约4%至约5%,以及在上述一者或多者内的范围。[0458]可将碱性种类洗脱为两个或更多个碱性区域,并且可根据峰的特定保留时间和所用离子交换将其编号为br1、br2、br3等等。[0459]在一个实施方案中,组合物可包含抗vegf蛋白,包括其碱性种类,其中br1为15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白及其碱性种类,其中br1为约0.0%至约10%、约0.0%至约5%、约0.0%至约4%、约0.0%至约3%、约0.0%至约2%、约3%至约5%、约5%至约8%、或约8%至约10%、或约10%至约15%,以及在上述一者或多者内的范围。[0460]在另一个实施方案中,组合物可包含抗vegf蛋白及其碱性种类,其中br2为15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白和抗vegf蛋白的其碱性种类,其中br2为约0.0%至约10%、约0.0%至约5%、约0.0%至约4%、约0.0%至约3%、约0.0%至约2%、约3%至约5%、约5%至约8%、或约8%至约10%、或约10%至约15%,以及在上述一者或多者内的范围。[0461]在另一个实施方案中,组合物可包含抗vegf蛋白及其碱性种类,其中br3为15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白和抗vegf蛋白的其碱性种类,其中br3为约0.0%至约10%、约0.0%至约5%、约0.0%至约4%、约0.0%至约3%、约0.0%至约2%、约3%至约5%、约5%至约8%、或约8%至约10%、或约10%至约15%,以及在上述一者或多者内的范围。[0462]阿柏西普的光诱导氧化[0463]除了发现使用cdm产生的抗vegf蛋白组合物的不同颜色特征或变体之外,本发明人还发现可在实验室中通过暴露于光来人工产生此类组合物。[0464]可通过使抗vegf蛋白暴露于冷白光或紫外光来产生抗vegf组合物的经修饰(包括经氧化)的变体。在一个方面,与样品相比,抗vegf组合物可包含一种或多种经修饰的寡肽约1.5至约50倍的增加,其中所述寡肽选自由以下组成的组:[0465]dkth*tc*ppc*papellg(seqidno.:17)、eiglltc*eatvngh*lyk(seqidno.:18)、qtntiidvvlspsh*gielsvgek(seqidno.:19)、telnvgidfnweypsskh*qhk(seqidno.:20)、tnylth*r(seqidno.:21)、sdtgrpfvemyseipeiih*mtegr(seqidno.:22)、vh*ekdk(seqidno.:23)、sdtgrpfvem*yseipeiihmtegr(seqidno.:64)、sdtgrpfvemyseipeiihm*tegr(seqidno.:65)、tqsgsem*k(seqidno.:66)、sdqglytc*aassglm*tk(seqidno.:67)、iiw*dsr/riiw*dsr/iiw*dsrk(seqidno.:28)、telnvgidfnw*eypssk(seqidno.:29)、gfiisnaty*k(seqidno.:69)、kf*pldtlipdgk(seqidno.:70)、f*lstltidgvtr(seqidno.:32),其中h*是被氧化为2-氧代-组氨酸的组氨酸,其中c*是被羧甲基化的半胱氨酸,其中m*是被氧化的甲硫氨酸,其中w*是被氧化的色氨酸,其中y*是被氧化的酪氨酸,并且其中f*是被氧化的苯丙氨酸。在另一方面,通过使抗vegf组合物暴露于冷白光一段时间,例如约30小时,抗vegf组合物可包含一种或多种经修饰的寡肽约1.5至约10倍的增加。在另一方面,通过使样品暴露于冷白光约75小时,抗vegf组合物可包含一种或多种经修饰的寡肽约1.5至约10倍的增加。在又一方面,通过使样品暴露于冷白光约100小时,抗vegf组合物可包含上述一种或多种寡肽约1.5至约20倍的增加。在又一方面,通过使样品暴露于冷白光约150小时,抗vegf组合物可包含上述一种或多种寡肽约1.5至约20倍的增加。在再一方面,通过使样品暴露于冷白光约300小时,抗vegf组合物可包含一种或多种寡肽约1.5至约50倍的增加—参见下文实施例4。41%、1-42%、1-43%、1-44%、1-45%、1-46%、1-47%、1-48%、1-49%、1-50%、2-10%、2-15%、2-20%、2-25%、2-30%、2-35%、2-40%、2-41%、2-42%、2-43%、2-44%、2-45%、2-46%、2-47%、2-48%、2-49%、2-50%、3-10%、3-15%、3-20%、3-25%、3-30%、3-35%、3-40%、3-41%、3-42%、3-43%、3-44%、3-45%、3-46%、3-47%、3-48%、3-49%、3-50%、4-10%、4-15%、4-20%、4-25%、4-30%、4-35%、4-40%、4-41%、4-42%、4-43%、4-44%、4-45%、4-46%、4-47%、4-48%、4-49%、4-50%或1-99%。[0477]在一个实施方案中,抗vegf蛋白可具有水平降低了约1%、1.2%、1.5%、2%、2.2%、2.5%、3%、3.2%、3.5%、4%、4.2%、4.5%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%的唾液酸化聚糖。与使用大豆水解物产生的抗vegf蛋白中的唾液酸化聚糖水平相比,在一个或多个前述值内的范围:例如,1-10%、1-15%、1-20%、1-25%、1-30%、1-35%、1-40%、1-41%、1-42%、1-43%、1-44%、1-45%、1-46%、1-47%、1-48%、1-49%、1-50%、2-10%、2-15%、2-20%、2-25%、2-30%、2-35%、2-40%、2-41%、2-42%、2-43%、2-44%、2-45%、2-46%、2-47%、2-48%、2-49%、2-50%、3-10%、3-15%、3-20%、3-25%、3-30%、3-35%、3-40%、3-41%、3-42%、3-43%、3-44%、3-45%、3-46%、3-47%、3-48%、3-49%、3-50%、4-10%、4-15%、4-20%、4-25%、4-30%、4-35%、4-40%、4-41%、4-42%、4-43%、4-44%、4-45%、4-46%、4-47%、4-48%、4-49%、4-50%或1-99%。[0478]在另一个实施方案中,抗vegf蛋白可具有水平降低了约1%、1.2%、1.5%、2%、2.2%、2.5%、3%、3.2%、3.5%、4%、4.2%、4.5%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%的半乳糖基化聚糖。与使用大豆水解物产生的抗vegf蛋白中的半乳糖基化聚糖水平相比,在一个或多个前述值内的范围:例如,1-10%、1-15%、1-20%、1-25%、1-30%、1-35%、1-40%、1-41%、1-42%、1-43%、1-44%、1-45%、1-46%、1-47%、1-48%、1-49%、1-50%、2-10%、2-15%、2-20%、2-25%、2-30%、2-35%、2-40%、2-41%、2-42%、2-43%、2-44%、2-45%、2-46%、2-47%、2-48%、2-49%、2-50%、3-10%、3-15%、3-20%、3-25%、3-30%、3-35%、3-40%、3-41%、3-42%、3-43%、3-44%、3-45%、3-46%、3-47%、3-48%、3-49%、3-50%、4-10%、4-15%、4-20%、4-25%、4-30%、4-35%、4-40%、4-41%、4-42%、4-43%、4-44%、4-45%、4-46%、4-47%、4-48%、4-49%、4-50%或1-99%。[0479]在一个实施方案中,抗vegf蛋白可具有水平提高了约1%、1.2%、1.5%、2%、2.2%、2.5%、3%、3.2%、3.5%、4%、4.2%、4.5%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%的甘露糖基化聚糖。与使用大豆水解物产生的抗vegf蛋白中的甘露糖基化聚糖水平相比,在一个或多个前述值内的范围:例如,1-10%、1-15%、1-20%、1-25%、1-30%、1-35%、1-40%、1-41%、1-42%、1-43%、1-44%、1-45%、1-46%、1-47%、1-48%、1-49%、1-50%、2-10%、2-15%、2-20%、2-25%、2-30%、2-35%、2-40%、2-41%、2-42%、2-43%、2-44%、2-45%、2-46%、2-47%、2-48%、2-49%、2-50%、3-10%、3-15%、3-20%、3-25%、3-30%、3-35%、3-40%、3-41%、3-42%、3-43%、3-44%、3-45%、3-46%、3-47%、3-48%、3-49%、3-50%、4-10%、4-15%、4-20%、4-25%、4-30%、4-35%、4-40%、4-41%、4-42%、4-43%、4-44%、4-45%、4-46%、4-47%、4-48%、4-49%、4-50%或1-99%。[0480]这个部分中所述的组合物可分别由以下部分iv和v中所述的若干个上游和下游参数产生。[0481]iv.使用上游工艺技术制备组合物[0482]对于生物制剂来说,需要施行强健而灵活的上游工艺。有效的上游工艺可实现目标蛋白质的所需产生和按比例放大。本发明人发现包含抗vegf蛋白的本发明的组合物可通过调节上游蛋白产生期间的条件,例如cdm的培养基组分的变化来产生。上游工艺中的每个步骤都会影响所制造的蛋白质的质量、纯度和数量。[0483]本公开提供了使用cdm产生的阿柏西普和/或minitrap的某些变体的存在的证据。这些变体包括包含一个或多个被氧化的氨基酸残基的同功型。被氧化残基的实例包括但不限于一个或多个组氨酸、色氨酸、甲硫氨酸、苯丙氨酸或酪氨酸残基。通过使用经修饰的cdm产生的组合物可产生抗vegf蛋白的制剂,所述制剂具有阿柏西普和/或minitrap的蛋白质变体的所需目标值。如上所述,还可存在与使用cdm产生的级分相关的黄棕色。(如上文所提及,并非本发明人测试的所有cdm都显示出明显变色。)[0484]本发明包括在细胞表达目标重组蛋白的合适条件下在经修饰的cdm中培养宿主细胞,接着收获由细胞产生的目标重组蛋白的制剂。这种经修饰的cdm可用于产生如上文部分iii中所述的组合物。(注意,cdm是表达阿柏西普时存在黄棕色的培养基。)[0485]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普。所述方法还包括收获由细胞产生的目标重组蛋白的制剂,其中合适的条件包括具有以下的cdm:在所述cdm中小于约55μm的铁累积浓度、在所述cdm中小于或等于约0.8μm的铜累积浓度、在所述cdm中小于或等于约0.40μm的镍累积浓度、在所述cdm中小于或等于约56μm的锌累积浓度、在所述cdm中小于约10mm的半胱氨酸累积浓度;和/或在所述cdm中对于单一抗氧化剂来说浓度为约0.001mm至约10mm的抗氧化剂,和如果在所述cdm中添加多种抗氧化剂,则不大于约30mm的累积浓度。[0486]在本实施方案的一个方面,使用合适的条件获得的制剂造成阿柏西普和vegfminitrap的蛋白质变体减少至所需量的阿柏西普和vegfminitrap的蛋白质变体(称为阿柏西普和vegfminitrap的蛋白质变体的“目标值”)。在这个实施方案的另一个方面,当将包括阿柏西普和vegfminitrap的变体的蛋白质制剂归一化为5g/l、10g/l或甚至更高的浓度时,使用合适的条件获得的制剂导致制剂的颜色减至所需by值(称为“目标by值”)。[0487]在本实施方案的另一个方面,变体的目标by值和/或目标值可在效价增加或不显著减小的制剂中获得(参见实施例5)。[0488]在一些实施方案中,通过使用经修饰的cdm产生的组合物可产生具有所需目标by值的抗vegf蛋白的制剂,其中所述制剂的颜色表征如下:[0489](i)黄棕色不超过欧洲颜色标准by2;[0490](ii)黄棕色不超过欧洲颜色标准by3;[0491](iii)黄棕色不超过欧洲颜色标准by4;[0492](iv)黄棕色不超过欧洲颜色标准by5;[0493](v)介于欧洲颜色标准by2与by3之间;[0494](vi)介于欧洲颜色标准by3与by4之间;[0495](vii)介于欧洲颜色标准by4与by5之间,其中组合物包含约5g/l或约10g/l的抗vegf蛋白,并且其中组合物的样品可从澄清收获物的蛋白a洗脱液中作为样品获得。如在下文实施例9,表9-3中所见,包含5g/l阿柏西普的蛋白a洗脱液呈现黄棕色,经测量为具有1.77的b*值。这种样品当在aex下游产生时具有0.50的b*值,证明了aex降低样品的黄棕色着色的效用(表9-3)。[0496]通过使用经修饰的cdm产生的组合物可产生抗vegf蛋白的制剂,其中制剂的颜色通过cielab标度中公认的标准颜色表征来表征:[0497](i)黄棕色不超过约22-23的b*值;[0498](ii)黄棕色不超过约16-17的b*值;[0499](iii)黄棕色不超过9-10的b*值;[0500](iv)黄棕色不超过4-5的b*值;[0501](v)黄棕色不超过2-3的b*值;[0502](vi)介于17-23之间的b*值;[0503](vii)介于10-17之间的b*值;[0504](viii)介于5-10之间的b*值;[0505](ix)介于3-5之间的b*值;或[0506](x)介于1-3之间的b*值,其中组合物包含约5g/l或约10g/l的抗vegf蛋白,并且其中组合物从澄清收获物的蛋白a洗脱液中作为样品获得。参见实施例9,表9-3。[0507]对于添加至细胞培养物中以形成经修饰的cdm的组分,术语“累积量”是指在细胞培养过程中添加至生物反应器中以形成cdm的特定组分的总量,包括在培养开始时添加的组分的量(在第0天的cdm)和随后添加的组分的量。当计算组分的累积量时,还包括在生物反应器产生之前(即,在第0天的cdm之前)添加至种菌培养物或接种物中的组分的量。累积量不受培养过程中组分随时间损失(例如,经由代谢或化学降解)的影响。因此,具有相同累积量的组分的两种培养物可能仍具有不同绝对水平,例如,如果在不同时间将组分添加至两种培养物中(例如,如果在一种培养物中,所有组分均在开始时添加,而在另一种培养物中,组分是随时间的推移而添加)。累积量也不受培养过程中组分随时间的原位合成(例如,经由代谢或化学转化)的影响。因此,具有相同累积量的给定组分的两种培养物可能仍具有不同绝对水平,例如,如果组分为经由生物转化过程在两种培养物的一种中原位合成。累积量可以例如组分的克数或摩尔数为单位表示。术语“累积浓度”是指组分的累积量除以生产批次开始时生物反应器中液体的体积,包括培养中使用的任何接种物对起始体积的贡献。例如,如果生物反应器在生产批次开始时含有2升细胞培养基,并且在第0、1、2和3天添加1克的组分x,则第3天之后的累积浓度为2g/l(即4克除以2升)。如果在第4天将另外1升不含组分x的液体添加至生物反应器中,则累积浓度将保持为2g/l。如果在第5天从生物反应器中损失一些液体(例如经由蒸发),则累积浓度将保持为2g/l。累积浓度可以例如克/升或摩尔/升为单位表示。[0508]a.氨基酸:[0509]在一些实施方案中,可通过降低或提高cdm中氨基酸的累积浓度来获得经修饰的cdm。此类氨基酸的非限制性实例包括丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸(或其盐)。与起始cdm相比,经修饰的cdm中的这些氨基酸的累积量的增加或减少可为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%,以及在上述一者或多者内的范围。或者,与未经修饰的cdm相比,经修饰的cdm中的一种或多种氨基酸的累积量的增加或减少可为约5%至约20%、约10%至约30%、约30%至约40%、约30%至约50%、约40%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%,以及在上述一者或多者内的范围(参见图25-27和实施例5)。[0510]在一些实施方案中,可通过降低cdm中半胱氨酸的累积浓度来获得经修饰的cdm。与未经修饰的cdm相比,cdm中形成经修饰的cdm的半胱氨酸的量的减少可为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%,以及在上述一者或多者内的范围。或者,与cdm相比,经修饰的cdm中的半胱氨酸的累积量的减少可为约5%至约20%、约10%至约30%、约30%至约40%、约30%至约50%、约40%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%,以及在上述一者或多者内的范围。在一个方面,经修饰的cdm中的累积半胱氨酸的量小于约1mm、约2mm、约3mm、约4mm、约5mm、约6mm、约7mm、约8mm、约9mm或约10mm(参见图25-27和实施例5)。[0511]在一些实施方案中,可通过用胱氨酸替换cdm中的至少一定百分比的累积半胱氨酸来获得经修饰的cdm。与未经修饰的cdm相比,替换可为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%,以及在上述一者或多者内的范围。或者,与未经修饰的cdm相比,替换可为约5%至约20%、约10%至约30%、约30%至约40%、约30%至约50%、约40%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%,以及在上述一者或多者内的范围(参见图25-27和实施例5)。[0512]在一些实施方案中,可通过用硫酸半胱氨酸替换cdm中的至少一定百分比的累积半胱氨酸来获得经修饰的cdm。与未经修饰的cdm相比,替换可为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%,以及在上述一者或多者内的范围。或者,与未经修饰的cdm相比,替换可为约5%至约20%、约10%至约30%、约30%至约40%、约30%至约50%、约40%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%,以及在上述一者或多者内的范围。[0513]b.金属:[0514]在一些实施方案中,可通过降低或提高cdm中的金属的累积浓度来获得经修饰的cdm。金属的非限制性实例包括铁、铜、锰、钼、锌、镍、钙、钾和钠。与未经修饰的cdm相比,经修饰的cdm中的一种或多种金属的量的增加或减少可为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%,以及在上述一者或多者内的范围。或者,与未经修饰的cdm相比,经修饰的cdm中的一种或多种金属的累积量的增加或减少可为约5%至约20%、约10%至约30%、约30%至约40%、约30%至约50%、约40%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%,以及在上述一者或多者内的范围(参见图25-27和实施例5)。[0515]c.抗氧化剂:[0516]在一些实施方案中,经修饰的cdm包含一种或多种抗氧化剂。抗氧化剂的非限制性实例可包括牛磺酸、次牛磺酸、甘氨酸、硫辛酸、谷胱甘肽、氯化胆碱、氢皮质酮、维生素c、维生素e及其组合(参见图28a-e和实施例5)。[0517]在一些实施方案中,经修饰的cdm包含约0.01mm至约20mm牛磺酸,即0.01mm至约1mm、约0.01mm至约5mm、约0.01mm至约10mm、0.1mm至约1mm、约0.1mm至约5mm、约0.1mm至约10mm、约1mm至约5mm、约1mm至约10mm,以及在上述一者或多者内的范围。[0518]在一些实施方案中,经修饰的cdm包含约0.01mm至约20mm次牛磺酸,即0.01mm至约1mm、约0.01mm至约5mm、约0.01mm至约10mm、0.1mm至约1mm、约0.1mm至约5mm、约0.1mm至约10mm、约1mm至约5mm、约1mm至约10mm,以及在上述一者或多者内的范围。[0519]在一些实施方案中,经修饰的cdm包含约0.01mm至约20mm甘氨酸,即0.01mm至约1mm、约0.01mm至约5mm、约0.01mm至约10mm、0.1mm至约1mm、约0.1mm至约5mm、约0.1mm至约10mm、约1mm至约5mm、约1mm至约10mm,以及在上述一者或多者内的范围。[0520]在一些实施方案中,经修饰的cdm包含约0.01μm至约5μm硫辛酸,即,约0.01μm至约0.1μm、约0.1μm至约1μm、约1μm至约2.5μm、约1μm至约3μm、约1μm至约5μm,以及在上述一者或多者内的范围。[0521]在一些实施方案中,经修饰的cdm包含约0.01m至约5mm谷胱甘肽,即0.01mm至约1mm、0.1mm至约1mm、约0.1mm至约5mm、约1mm至约5mm,以及在上述一者或多者内的范围。[0522]在一些实施方案中,经修饰的cdm包含约0.01μm至约5μm氢皮质酮,即,约0.01μm至约0.1μm、约0.1μm至约1μm、约1μm至约2.5μm、约1μm至约3μm、约1μm至约5μm,以及在上述一者或多者内的范围。[0523]在一些实施方案中,经修饰的cdm包含约1μm至约50μm维生素c,即,约1μm至约5μm、约5μm至约20μm、约10μm至约30μm、约5μm至约30μm、约20μm至约50μm、约25μm至约50μm,以及在上述一者或多者内的范围。[0524]d.为调节糖基化而对培养基进行的改变:[0525]本公开还包括了通过改变cdm中的某些组分的累积浓度来调节抗vegf蛋白的糖基化的方法。可基于添加至cdm中的组分的累积量来改变总岩藻糖基化%、总半乳糖基化%、总唾液酸化%和甘露糖-5。[0526]在示例性实施方案中,调节抗vegf蛋白的糖基化的方法可包括向cdm中补充尿苷。抗vegf蛋白可具有约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约2%至约15%甘露糖-5、和约60%至约79%半乳糖基化聚糖。(参见下文实施例6)。[0527]在一些实施方案中,调节抗vegf蛋白的糖基化的方法可包括向cdm中补充锰。在一个方面,cdm在补充前不含锰。抗vegf蛋白可具有约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约2%至约15%甘露糖-5、和约60%至约79%半乳糖基化聚糖。(参见下文实施例6)。[0528]在一些实施方案中,调节抗vegf蛋白的糖基化的方法可包括向cdm中补充半乳糖。在一个方面,cdm在补充前不含半乳糖。抗vegf蛋白可具有约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约2%至约15%甘露糖-5、和约60%至约79%半乳糖基化聚糖。(实施例6)。[0529]在一些实施方案中,调节抗vegf蛋白的糖基化的方法可包括向cdm中补充地塞米松。在一个方面,cdm在补充前不含地塞米松。抗vegf蛋白可具有约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约2%至约15%甘露糖-5、和约60%至约79%半乳糖基化聚糖。(参见下文实施例6)。[0530]在一些实施方案中,调节抗vegf蛋白的糖基化的方法可包括向cdm中补充尿苷、锰、半乳糖和地塞米松中的一种或多种。在一个方面,cdm在补充之前不含尿苷、锰、半乳糖和地塞米松中的一种或多种。抗vegf蛋白可具有约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约2%至约15%甘露糖-5、和约60%至约79%半乳糖基化聚糖。(实施例6)。[0531]v.使用下游工艺技术制备组合物[0532]包含本发明的抗vegf蛋白的组合物可通过调节下游蛋白质产生过程中的条件来产生。本发明人发现优化下游程序可导致抗vegf蛋白的某些变体最少化以及变色。下游工艺的优化可产生具有减少的氧代变体以及优化的颜色特征的组合物。[0533]下游工艺技术可单独使用或与前述部分iv中所述的上游工艺技术组合使用。[0534]a.阴离子交换色谱:[0535]在一些实施方案中,本发明的组合物可涉及一种方法,所述方法包括:在cdm中在宿主细胞中表达抗vegf蛋白,其中抗vegf蛋白从宿主细胞分泌至培养基中,并获得澄清收获物。所述收获物经历以下步骤:(a)将从收获物获得的生物样品加载至阴离子交换色谱(aex)柱上;(b)用合适的洗涤缓冲液洗涤aex柱,(c)收集流通级分,任选地(d)用合适的汽提缓冲液洗涤柱,以及(e)收集汽提级分。[0536]流通级分可包含抗vegf蛋白的氧代变体,当与阴离子交换色谱柱的汽提级分中的氧代变体相比时,其为抗vegf蛋白样品的约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%。例如,参看表9-5和表9-6,流通级分包含抗vegf蛋白的氧化变体,其中与汽提级分中的氧化变体相比,若干组氨酸和色氨酸残基为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%(以及在上述一者或多者内的范围)被氧化。[0537]用于aex柱的平衡缓冲液和洗涤缓冲液的ph值均可为约8.20至约8.60。在另一方面,用于aex柱的平衡缓冲液和洗涤缓冲液的电导率均可为约1.50至约3.0ms/cm。在一个方面,平衡缓冲液和洗涤缓冲液可为约50mmtris盐酸盐。在一个方面,汽提缓冲液包含2m氯化钠或1n氢氧化钠或两者(参见表2-2)。实施例2进一步说明优化平衡缓冲液和洗涤缓冲液的浓度和电导率。[0538]蛋白质变体可包括如下一个或多个残基的修饰:一个或多个天冬酰胺被脱酰胺;一个或多个天冬氨酸转化为异天冬氨酸和/或asn;一个或多个甲硫氨酸被氧化;一个或多个色氨酸被转化为n-甲酰犬尿氨酸;一个或多个色氨酸是单羟基色氨酸;一个或多个色氨酸是二羟基色氨酸;一个或多个色氨酸是三羟基色氨酸;一个或多个精氨酸被转化为arg3-脱氧葡糖醛酮;c末端甘氨酸不存在;和/或存在一个或多个非糖基化糖位点。[0539]目标蛋白质可为阿柏西普、抗vegf抗体或vegfminitrap。可通过以下方式中的一种或多种形成蛋白质变体:(i)从选自his86、his110、his145、his209、his95、his19和/或his203(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)的组氨酸残基的组氨酸的氧化;(ii)选自trp58和/或trp138(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的色氨酸残基的色氨酸残基的氧化;(iii)tyr64(或具有阿柏西普的某些结构特征的蛋白质上的等效位置)处的酪氨酸残基的氧化;(iv)选自phe44和/或phe166(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)的苯丙氨酸残基的氧化;和/或(v)选自met10、met20、met163和/或met192(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)的甲硫氨酸残基的氧化。[0540]流通级分可包含以下一者或多者:[0541](a)一定百分比的已氧化为2-氧代-组氨酸的组氨酸残基,其中其颜色表征如下:[0542](i)黄棕色不超过欧洲颜色标准by2;[0543](ii)黄棕色不超过欧洲颜色标准by3;[0544](iii)黄棕色不超过欧洲颜色标准by4;[0545](iv)黄棕色不超过欧洲颜色标准by5;[0546](v)介于欧洲颜色标准by2与by3之间;[0547](vi)介于欧洲颜色标准by3与by4之间;[0548](vii)介于欧洲颜色标准by4与by5之间,其中组合物包含约5g/l或约10g/l的抗vegf蛋白,并且其中组合物从流通级分中作为样品获得。[0549](b)一定百分比的已氧化为2-氧代-组氨酸的组氨酸残基。此外,其颜色的特征在于具有近似于by2、by3、by4、by5、by6、by7的黄棕色;或者不比by2更暗/强烈、不比by3暗、不比by4暗、不比by5暗、不比by6暗、不比by7暗;或介于by2与by3之间、介于by2与by4之间、介于by3与by4之间或介于by3与by5之间。[0550](c)一定百分比的已氧化为2-氧代-组氨酸的组氨酸残基,其中其颜色以如下ciel*,a*,b*颜色空间中的颜色表征:[0551](i)黄棕色不超过约22-23的b*值;[0552](ii)黄棕色不超过约16-17的b*值;[0553](iii)黄棕色不超过9-10的b*值;[0554](iv)黄棕色不超过4-5的b*值;[0555](v)黄棕色不超过2-3的b*值;[0556](vi)介于17-23之间的b*值;[0557](vii)介于10-17之间的b*值;[0558](viii)介于5-10之间的b*值;[0559](ix)介于3-5之间的b*值;或[0560](x)介于1-3之间的b*值,其中组合物包含约5g/l或约10g/l的抗vegf蛋白,并且其中组合物从流通级分中作为样品获得。[0561](d)组合物中不多于约1%、不多于约0.1%或约0.1-1%、0.2-1%、0.3-1%、0.4-1%、0.5-1%、0.6-1%、0.7-1%、0.8-1%或0.9-1%的组氨酸残基被氧化为2-氧代-组氨酸。百分比计算描述于部分ii中。[0562]b.亲和色谱:[0563]在一些实施方案中,本发明的组合物可使用包括以下的方法产生:在宿主细胞中表达抗vegf蛋白,其中抗vegf蛋白由宿主细胞分泌至培养基中并获得澄清收获物。收获物经历以下步骤,包括:(a)将从澄清收获物获得的生物样品加载至亲和色谱柱上,其中亲和色谱包含能够选择性或特异性地结合至抗vegf蛋白的蛋白质;(b)用合适的洗脱缓冲液洗涤亲和色谱柱,以及(c)收集洗脱的级分。例如,如表7-1和表7-7至7-10所示例,使用vegf165作为能够选择性或特异性地结合至抗vegf蛋白的蛋白质并按照上述方法收集洗脱的级分,成功产生mt5(抗vegf蛋白)、阿柏西普和抗vegfscfv片段。表7-1还公开使用以下各物作为能够选择性或特异性地结合至mt5的不同蛋白质成功地产生mt5:(i)mab1(小鼠抗vegfr1mab人类igg1,其中seqidno.:73是重链,而seqidno.:74是轻链);(ii)mab2(小鼠抗vegfr1mab人类igg1,其中seqidno.:75是重链,而seqidno.:76是轻链);(iii)mab3(小鼠抗vegf-r1mab小鼠igg1,其中seqidno.:77是重链,而seqidno.:78是轻链);以及(iv)mab4(小鼠抗vegfr1mab小鼠igg1,其中seqidno.:79是重链,而seqidno.:80是轻链)。[0564]关于上述步骤(a),有待加载至亲和柱上的生物样品可来自其中澄清收获物可在亲和之前经历产生的样品,包括但不限于离子交换色谱(阴离子或阳离子)。在使用亲和步骤之前,还可采用本领域技术人员熟知的其他色谱程序。重要之处在于包含抗vegf蛋白的生物样品可经历亲和色谱。[0565]在一些实施方案中,本发明的组合物可使用包括以下的方法产生:在宿主细胞中表达vegfminitrap蛋白,其中vegfminitrap从宿主细胞分泌至培养基中,并且其中可进一步处理培养基以形成澄清收获物。可通过已知的色谱程序进一步处理此收获物,从而产生包含vegfminitrap的生物样品。此生物样品可通过采用以下步骤进一步处理,包括:(a)将生物样品加载至亲和色谱柱上,其中亲和色谱包含能够与vegfminitrap蛋白选择性或特异性地结合或相互作用的蛋白;(b)用合适的洗脱缓冲液洗涤亲和色谱柱,以及(c)收集洗脱的级分。再次参看表7-1,此表中公开了使用以下各物作为能够选择性或特异性地结合至mt5或与mt5相互作用的不同蛋白质成功地产生mt5(vegfminitrap):(i)vegf165;(ii)mab1(小鼠抗vegfr1mab人类igg1,其中seqidno.:73是重链,而seqidno.:74是轻链);(iii)mab2(小鼠抗vegfr1mab人类igg1,其中seqidno.:75是重链,而seqidno.:76是轻链);(iv)mab3(小鼠抗vegf-r1mab小鼠igg1,其中seqidno.:77是重链,而seqidno.:78是轻链);以及(v)mab4(小鼠抗vegfr1mab小鼠igg1,其中seqidno.:79是重链,而seqidno.:80是轻链)。[0566]在一个实施方案中,亲和色谱还可用于分离其他minitrap蛋白。切割阿柏西普之后,可使用对经切割的阿柏西普具特异性的结合物对包含经切割的阿柏西普的样品进行亲和色谱。在一个方面,结合物可为抗体或其部分。[0567]可使用例如用ides蛋白酶(fabricator)或其变体对阿柏西普进行蛋白水解消化来促进阿柏西普的切割,以产生vegfminitrap。用ides蛋白酶或其变体切割阿柏西普可产生包含fc片段和vegfminitrap的产物的混合物。vegfminitrap可通过使用本文所述的一种或多种生产策略进一步处理。[0568]在一些示例性实施方案中,能够与抗vegf蛋白例如阿柏西普或minitrap选择性或特异性结合(“结合物”)或与其相互作用的蛋白质可来源于人类或小鼠。[0569]亲和产生过程还可包括在加载生物样品之前使用平衡缓冲液平衡亲和柱。示例性平衡缓冲液可为20mm磷酸钠ph6-8(尤其是7.2)、10mm磷酸钠、500mmnaclph6-8(尤其是7.2)、50mmtrisph7-8、dpbsph7.4。[0570]可使用合适的缓冲液例如dpbs来加载生物样品。[0571]此亲和产生过程还可包括用一种或多种洗涤缓冲液洗涤亲和柱。可洗涤柱一次或多次。此外,洗涤液也可作为洗涤级分收集。洗涤缓冲液的ph值都可为约7.0至约8.60。在一个方面,洗涤缓冲液可为dpbs。在另一方面,洗涤缓冲液可为20mm磷酸钠ph6-8(尤其是7.2)、10mm磷酸钠、500mmnaclph6-8(尤其是7.2)、50mmtrisph7-8或dpbsph7.4。[0572]此亲和过程还可包括用一种或多种合适的洗脱缓冲液洗涤亲和柱并收集洗脱的级分。可洗涤柱一次或多次。这种合适的洗脱缓冲液的非限制性实例包括:乙酸铵(ph值为约2.0至约3.0)、乙酸(ph值为约2.0至约3.2)、甘氨酸-hcl(ph值为约2.0至约3.0)、柠檬酸钠(ph值为约2.0至约3.0)、柠檬酸(ph值为约2.0至约3.0)、异硫氰酸钾(ph值为约2.0至约3.0)或其组合。[0573]在一些方面,可使用中和缓冲液中和洗脱级分。这种中和缓冲液的一个实例是tris至tris-hcl(ph值为约7.0至约9.0)。[0574]c.ides突变体:[0575]用于切割fc融合蛋白(例如阿柏西普)的ides蛋白酶在碱性ph条件下会迅速丧失酶活性,这可限制其在vegfminitrap制造期间的使用。因此,已开发在碱性ph下,例如在强碱如naoh存在下更稳定的变体。此类碱性条件可为0.05nnaoh1小时或0.1nnaoh0.5小时。[0576]在一些实施方案中,ides突变体可具有在其全长上与由以下组成的组中列出的氨基酸序列具有至少约70%序列同一性的氨基酸序列:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一些方面,氨基酸序列与上文刚刚提及的氨基酸序列在其全长上具有约75%、80%、85%、90%、95%或约100%序列同一性。[0577]在一些实施方案中,ides突变体可具有编码多肽的经分离的核酸分子,所述多肽的氨基酸序列在其全长上与由以下组成的组中列出的氨基酸序列具有至少70%序列同一性:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一些方面,氨基酸序列在其全长上与上文刚刚提及的氨基酸序列具有约75%、80%、85%、90%、95%或约100%序列同一性。[0578]在一些实施方案中,所述多肽具有在其全长上与由以下组成的组中列出的氨基酸序列具有至少70%序列同一性的氨基酸序列:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16,并且由具有合适载体的宿主细胞表达,所述载体包含编码所识别的肽的核酸。在一个方面,核酸分子与表达控制序列可操作地连接,所述表达控制序列能够指导其在宿主细胞中的表达。在一个方面,载体可为质粒。在一些方面,氨基酸序列在其全长上与上文刚刚提及的氨基酸序列具有约75%、80%、85%、90%、95%或约100%序列同一性。在一些方面,经分离的核酸分子可用于编码多肽。[0579]在一些实施方案中,ides突变体可具有包含由seqidno.:1(ides)定义的亲本氨基酸序列的氨基酸序列,其中在位置87、130、182和/或274处的天冬酰胺残基突变为除天冬酰胺以外的氨基酸。在一个方面,与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高。在另一方面,与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高50%。在一个方面,氨基酸可选自天冬氨酸、亮氨酸和精氨酸。在一个特定方面,位置87处的天冬酰胺残基突变为天冬氨酸残基。在另一个特定方面,位置130处的天冬酰胺残基突变为精氨酸残基。在又一个特定方面,位置182处的天冬酰胺残基突变为亮氨酸残基。在又一个特定方面,位置274处的天冬酰胺残基突变为天冬氨酸残基。在又一个特定方面,位置87和130处的天冬酰胺残基经突变。在又一个特定方面,位置87和182处的天冬酰胺残基经突变。在又一个特定方面,位置87和274处的天冬酰胺残基经突变。在又一个特定方面,位置130和182处的天冬酰胺残基经突变。在又一个特定方面,位置130和274处的天冬酰胺残基经突变。在又一个特定方面,位置182和274处的天冬酰胺残基经突变。在又一个特定方面,位置87、130和182处的天冬酰胺残基经突变。在又一个特定方面,位置87、182和274处的天冬酰胺残基经突变。在又一个特定方面,位置130、182和274处的天冬酰胺残基经突变。在又一个特定方面,位置87、130、182和274处的天冬酰胺残基经突变。在一些方面,氨基酸序列在其全长上与上述氨基酸序列具有约75%、80%、85%、90%、95%或约100%序列同一性。在一些方面,经分离的核酸分子可用于编码多肽。[0580]熟悉标准分子生物学技术的本领域普通技术人员可在无过度负担的情况下制备和使用本发明的ides突变体。标准技术可用于重组dna、寡核苷酸合成、组织培养和转化(例如,电穿孔、脂质转染)。参见例如sambrook等人,molecularcloning:alaboratorymanual,同上,其出于任何目的通过引用并入本文。可根据制造商的说明或如本文所述来执行酶反应和产生技术。[0581]vi.一般蛋白质产生[0582]设想多种不同产生技术,包括但不限于亲和色谱、离子交换色谱、混合模式色谱、尺寸排阻色谱和疏水相互作用色谱(单独或以组合形式)在本发明的范围内。取决于特定分离形式,这些色谱步骤基于电荷、疏水性程度或尺寸或其组合来分离生物样品的蛋白质混合物。对于前述提及的每项技术,都可使用若干种不同的色谱树脂,从而允许根据所涉及的特定蛋白质精确调整生产方案。每种分离方法都会造成蛋白质以不同速率穿过柱,从而实现物理分离,随着蛋白质进一步穿过柱或选择性地粘附于分离介质上,物理分离会增加。接着,将蛋白质(i)使用适当的洗脱缓冲液进行差异洗脱和/或(ii)从所用柱获得的流通级分中收集,任选地,用适当的平衡缓冲液洗涤柱。在一些情况下,当杂质优先粘附于柱上并且目标蛋白质较少粘附时,目标蛋白质就会与杂质(hcp、蛋白质变体等)分离,即,目标蛋白质不会吸附于特定柱的固相上,并且因此流过柱。在一些情况下,当杂质无法吸附于柱上并因此流过柱时,它们就会与目标蛋白质分离。[0583]在使用上述上游产生方法和/或通过本领域中常规的替代产生方法产生重组蛋白后,产生过程可以分离步骤开始。一旦获得包含目标蛋白质(例如融合蛋白)的澄清溶液或混合物,就将目标蛋白质与过程相关的杂质(例如由细胞(如hcp)产生的其他蛋白质,以及产物相关的物质,例如酸性或碱性变体)分离。可采用一种或多种不同产生技术的组合,包括亲和色谱、离子交换(例如cex、aex)色谱、混合模式(mm)色谱和/或疏水相互作用色谱。此类产生步骤基于例如电荷、疏水性程度和/或表观尺寸分离生物样品内的组分混合物。对于本文提及的每项色谱技术,许多色谱树脂是市售的,从而允许根据所涉及的特定蛋白质精确调整生产方案。每种分离方法都允许蛋白质以不同速率穿过柱,从而实现物理分离,随着蛋白质进一步穿过柱或选择性地粘附于分离树脂(或介质)上,物理分离会增加。接着可差异地收集蛋白质。在一些情况下,当其他组分特异性地吸附于柱树脂上,而目标蛋白质不吸附时,目标蛋白质就与生物样品的组分分离。[0584]a.初步回收和病毒灭活[0585]在某些实施方案中,本文公开的产生方法的初始步骤涉及从生物样品中澄清和初步回收目标蛋白质。初步回收将包括一个或多个离心步骤,以便从宿主细胞和伴随的细胞碎片中分离出目标蛋白质。样品的离心可例如但不限于在7,000xg至约12,750xg下进行。在大规模生产的情形下,可以一定流率在线进行此离心,所述流率被设定成在所得上清液中达到例如150ntu的浊度水平。接着可收集所述上清液以进行进一步处理,或经由一个或多个深度过滤器进行在线过滤,以进一步澄清样品。[0586]在某些实施方案中,初步回收可包括使用一个或多个深度过滤步骤来澄清样品,从而有助于处理目标蛋白质。在其他实施方案中,初步回收可包括在离心后使用一个或多个深度过滤步骤。可在本发明的上下文中使用的深度过滤器的非限制性实例包括millistak x0hc、f0hc、d0hc、a1hc、b1hc深度过滤器(emdmillipore);3mtm型号30/60za、60/90za、vr05、vr07、delipid深度过滤器(3mcorp.)。0.2μm过滤器如sartorius的0.45/0.2μmsartoporetm双层或millipore的expressshr或shc滤筒通常在深度过滤器之后。还可使用本领域技术人员熟知的其他过滤器。[0587]在某些实施方案中,初步回收过程也可为减少或灭活可存在于生物样品中的病毒的关键。多种病毒减少/灭活方法中的任何一者或多者可在产生初步回收阶段使用,包括:热灭活(巴氏灭菌)、ph灭活、缓冲剂/清洁剂处理、uv和γ射线辐照以及添加某些化学灭活剂如β-丙内酯,或例如菲咯啉铜,如美国专利第4,534,972号中所述,其全部教导都通过引用并入本文。在本发明的某些示例性实施方案中,样品在初步回收阶段期间暴露于清洁剂病毒灭活。在其他实施方案中,样品可在初步回收阶段期间暴露于低ph灭活。[0588]在采用病毒减少/灭活的那些实施方案中,可对生物样品进行调整(在需要时)以用于其他产生步骤。例如,在低ph病毒灭活之后,在继续产生过程之前,通常将样品的ph值调节至更中性的ph值,例如,约4.5至约8.5。另外,可用注射用水(wfi)稀释混合物以获得所需电导率。[0589]b.亲和色谱[0590]在某些示例性实施方案中,使生物样品经历亲和色谱对于产生目标蛋白质可为有利的。色谱材料能够选择性地或特异性地与目标蛋白质结合或相互作用。所述色谱材料的非限制性实例包括:蛋白a和蛋白g。此外,包含例如蛋白质或其部分的色谱材料能够与目标蛋白质结合或相互作用。在一个方面,目标蛋白质是抗vegf蛋白,例如阿柏西普、minitrap或与其相关的蛋白质。[0591]亲和色谱可涉及使生物样品经历包含合适的蛋白a树脂的柱。当在本文中使用时,术语“蛋白a”涵盖从其天然来源回收的蛋白a,合成产生的蛋白a(例如,通过肽合成或通过重组技术)及其保留结合具有ch2/ch3区的蛋白质的能力的变体。在某些方面,蛋白a树脂通过与分子的fc部分(如果其具有所述区域)特异性相互作用而可用于多种抗体同种型的基于亲和力的产生和分离。[0592]蛋白a树脂有若干商业来源。一种合适的树脂是来自gehealthcare的mabselecttm。合适的树脂包括但不限于:来自gehealthcare的mabselectsuretm、mabselectsurelx、mabselect、mabselectsurepcc、mabselectxtra、rproteinasepharose;来自emdmillipore的prosephc、prosepultra和prosepultraplus;来自lifetechnologies的mapcapture。装填有mabselecttm的合适的柱的非限制性实例是直径约1.0cmx长度约21.6cm的柱(17ml床体积)。合适的柱可包含树脂,例如mabselecttmsure或类似树脂。蛋白a还可从repligen、pharmacia和fermatech商购获得。[0593]样品加载之前,可使用合适的缓冲液平衡亲和柱。加载柱后,可使用合适的洗涤缓冲液将柱洗涤一次或多次。接着可使用适当的洗脱缓冲液(例如,甘氨酸-hcl、乙酸或柠檬酸)洗脱柱。可使用本领域技术人员熟知的技术例如uv检测器来监测洗脱液。可收集洗脱的目标级分,接着准备用于进一步处理。[0594]在一个方面,可例如通过清洁剂或低ph对洗脱液进行病毒灭活。可选择合适的清洁剂浓度或ph值(和时间)以获得所需病毒灭活结果。病毒灭活后,通常对洗脱液进行ph值和/或电导率调整以便后续产生步骤。[0595]洗脱液可经由深度过滤器进行过滤以便在额外的色谱精制(chromatographicpolishing)步骤之前从目标蛋白质中去除浊度和/或各种杂质。合适的深度过滤器的实例包括但不限于millistak xohc、fohc、dohc、aihc、x0sp和bihcpod过滤器(emdmillipore)或zetaplus30za/60za、60za/90za、delipid、vr07和vr05过滤器(3m)。emphazeaexhybridpurifier多机理过滤器也可用于澄清洗脱液。为了从深度过滤步骤实现所需杂质去除和产物回收,可能需要将洗脱液池调节至特定的ph值和电导率。[0596]c.阴离子交换色谱[0597]在某些实施方案中,通过使生物样品经历至少一个阴离子交换分离步骤来产生目标蛋白质。在一种情形下,阴离子交换步骤可在亲和色谱程序(例如,蛋白a亲和)之后进行。在其他情形下,阴离子交换步骤可在亲和色谱步骤之前进行。在其他方案中,阴离子交换可在亲和色谱步骤之前和之后进行。在一个方面,目标蛋白质是阿柏西普或minitrap。[0598]相对于阳离子交换材料来说,阴离子交换材料的使用部分地基于目标蛋白质的局部电荷。阴离子交换色谱可与以下其他色谱程序组合使用:例如亲和色谱、尺寸排阻色谱、疏水相互作用色谱以及熟练技术人员已知的其他色谱模式。[0599]在进行分离时,可通过使用多种技术中的任一者,例如使用批量生产技术或色谱技术,使初始蛋白质组合物(生物样品)与阴离子交换材料接触。[0600]在批量生产的情形下,在所需起始缓冲液中制备或平衡阴离子交换材料。制备后,获得阴离子交换材料的浆液。使生物样品与浆液接触,以使蛋白质吸附于阴离子交换材料上。通过使浆液沉降并去除上清液,从浆液中分离出包含不与aex材料结合的酸性种类的溶液。浆液可经历一个或多个洗涤步骤和/或洗脱步骤。[0601]在色谱分离的情形下,色谱柱用于容纳色谱支撑物材料(树脂或固相)。将包含目标蛋白质的样品加载至特定色谱柱上。接着柱可经历一个或多个使用合适的洗涤缓冲液的洗涤步骤。未吸附于树脂上的样品组分可能会流过柱。可使用适当的洗脱缓冲液对已吸附于树脂上的组分进行差异洗脱。[0602]通常在aex色谱中使用类似于加载条件的条件或替代地通过以逐步或线性梯度方式降低洗涤液的ph值和/或提高其离子强度/电导率来进行洗涤步骤。在一个方面,在加载缓冲液和洗涤缓冲液中使用的盐水溶液的ph处于或接近目标蛋白质的等电点(pi)。通常,ph比目标蛋白质的pi高或低约0至2个单位,但其范围可为高或低0至0.5个单位。其还可位于目标蛋白质的pi处。[0603]阴离子剂可选自由乙酸盐、氯化物、甲酸盐及其组合组成的组。阳离子剂可选自由tris、精氨酸、钠及其组合组成的组。在一个特定实例中,缓冲溶液是tris/甲酸盐缓冲液。缓冲液可选自由以下组成的组:吡啶、哌嗪、l-组氨酸,bis-tris、bis-tris丙烷、咪唑、n-乙基吗啉、tea(三乙醇胺)、tris、吗啉、n-甲基二乙醇胺、ampd(2-氨基-2-甲基-1,3-丙二醇)、二乙醇胺、乙醇胺、amp(2-氨基-2-甲基-1-丙醇)、哌嗪、1,3-二氨基丙烷和哌啶。[0604]填充式阴离子交换色谱柱、阴离子交换膜装置、阴离子交换整体式装置或深度过滤器介质可以结合-洗脱模式、流通模式或混合模式操作,其中蛋白质展示与色谱材料的结合并且仍可使用与加载缓冲液相同或基本上相似的缓冲液从所述材料上洗去。[0605]在结合-洗脱模式下,首先在某些蛋白质会吸附于基于树脂的基质上的条件下,使用具有适当离子强度和ph值的缓冲液对柱或膜装置进行调节。例如,在进料加载期间,由于静电吸引,目标蛋白质可吸附于树脂上。在用平衡缓冲液或具有不同ph值和/或电导率的另一种缓冲液洗涤柱或膜装置后,通过提高洗脱缓冲液的离子强度(即电导率)以便与溶质竞争阴离子交换基质的带电位点来实现产物回收。改变ph值和由此更改溶质的电荷是实现溶质洗脱的另一种方式。电导率或ph值的变化可为逐渐的(梯度洗脱)或逐步的(分步洗脱)。[0606]在流通模式下,柱或膜装置是在选定的ph值和电导率下操作,以使目标蛋白质不会与树脂或膜结合,而酸性种类将保留在柱上或与目标蛋白质相比将具有独特的洗脱谱。在这种策略的情形下,酸性种类将在合适的条件下与色谱材料相互作用或结合,而目标蛋白质和目标蛋白质的某些聚集体和/或片段将流过柱。[0607]阴离子交换树脂的非限制性实例包括二乙氨基乙基(deae)、季氨乙基(qae)和季胺(q)基团。另外的非限制性实例包括:poros50pi和poros50hq,其为刚性聚合物珠粒,其中骨架由交联聚[苯乙烯-二乙烯苯]组成;captoqimpres和captodeae,其是高流动性琼脂糖珠粒;toyopearlqae-550、toyopearldeae-650和toyopearlgigacapq-650,其是聚合物基珠粒;emdtmaehicap,其是具有触手离子交换剂的合成聚合树脂;sartobindpanano,其是具有伯胺配体的耐盐色谱膜;sartobindqnano,其是强阴离子交换色谱膜;cunobiocap,其是由无机助滤剂、精制纤维素和离子交换树脂构成的zeta-plus深度过滤器介质;以及xohc,其是由无机助滤剂、纤维素和混合纤维素酯构成的深度过滤器介质。[0608]在某些实施方案中,可将样品的蛋白质加载量调整至以下柱的总蛋白质加载量:介于约50g/l与约500g/l之间、或介于约75g/l与约350g/l之间、或介于约200g/l与约300g/l之间。在其他实施方案中,将加载蛋白质混合物的蛋白质浓度调整至加载于柱上的材料的以下蛋白质浓度:介于约0.5g/l与约50g/l之间、介于约1g/l与约20g/l之间、或介于约3g/l与约10g/l之间。在其他实施方案中,将加载蛋白质混合物的蛋白质浓度调整至加载于柱上的材料的约37g/l蛋白质浓度。[0609]可添加添加剂,例如聚乙二醇(peg)、清洁剂、氨基酸、糖、离液剂,以增强分离性能,从而实现更好的分离、回收和/或产物质量。[0610]在某些实施方案中,包括与阿柏西普和/或vegfminitrap有关的那些实施方案,本发明的方法可用于选择性地去除、显著减少或基本上去除至少10%的蛋白质变体,从而产生具有减少的蛋白质变体的蛋白质组合物。[0611]蛋白质变体可包括如下一个或多个残基的修饰:一个或多个天冬酰胺被脱酰胺;一个或多个天冬氨酸被转化为天冬氨酸-甘氨酸和/或asn-gly;一个或多个甲硫氨酸被氧化;一个或多个色氨酸被转化为n-甲酰犬尿氨酸;一个或多个色氨酸是单羟基色氨酸;一个或多个色氨酸是二羟基色氨酸;一个或多个色氨酸是三羟基色氨酸;一个或多个精氨酸转化为arg3-脱氧葡糖醛酮;c末端甘氨酸不存在;和/或存在一个或多个非糖基化糖位点。还观察到使用aex可减少所述亲和洗脱液中的抗vegf变体的氧化和酸性种类。与亲和洗脱液相比,在使用aex后,流通级分可展示出抗vegf变体的氧化和/或酸性种类至少约20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%或5%的减少。[0612]阿柏西普和/或vegfminitrap的蛋白质变体可包括以下一者或多者:(i)来自选自his86、his110、his145、his209、his95、his19和/或his203的组氨酸残基的氧化组氨酸;(ii)选自在trp58和/或trp138处的色氨酸残基的氧化色氨酸残基;(iii)在tyr64处的氧化酪氨酸残基;(iv)选自phe44和/或phe166的氧化苯丙氨酸残基;和/或(v)选自met10、met20、met163和/或met192的氧化甲硫氨酸残基。[0613]d.阳离子交换色谱[0614]本发明的组合物可通过使包含目标蛋白质的生物样品经历至少一个阳离子交换(cex)步骤来产生。在某些示例性实施方案中,cex步骤将是aex步骤的补充,并且在aex步骤之前或之后进行。在一个方面,目标蛋白质是阿柏西普、minitrap或与其相关的分子。[0615]阳离子交换材料相对于阴离子交换材料(例如上文论述的那些阴离子交换材料)的使用部分地基于给定溶液中目标蛋白质的局部电荷和所需分离条件。在使用阴离子交换步骤之前采用阳离子交换步骤,或在使用阳离子交换步骤之前采用阴离子交换步骤都在本发明的范围内。此外,仅采用阳离子交换步骤与其他色谱程序的组合在本发明的范围内。[0616]在进行阳离子交换时,可通过使用以下多种技术中的任一种将包含目标蛋白质的样品与阳离子交换材料接触,例如,使用批量生产技术或色谱技术,如上文针对aex所述。[0617]盐水溶液既可用作加载缓冲液又可用作洗涤缓冲液,其ph值低于目标蛋白质的等电点(pi)。在一个方面,ph值比蛋白质的pi低约0至5个单位。在另一方面,其在比蛋白质的pi低1至2个单位的范围内。在又一方面,其在比蛋白质的pi低1至1.5个单位的范围内。[0618]在某些实施方案中,增加或减少盐水溶液中阴离子剂的浓度以达到以下ph值:介于约3.5与约10.5之间、或介于约4与约10之间、或介于约4.5与约9.5之间、或介于约5与约9之间、或介于约5.5与约8.5之间、或介于约6与约8之间、或介于约6.5与约7.5之间。在一个方面,增加或减少盐水溶液中阴离子剂的浓度以达到5、或5.5、或6、或6.5、或6.8、或7.5的ph值。适用于cex方法中的缓冲液系统包括但不限于tris甲酸盐、tris乙酸盐、硫酸铵、氯化钠和硫酸钠。hypercel的基础基质是高孔隙度的交联纤维素。它们的配体分别是苯丙胺和己胺。苯丙胺和己胺为蛋白质分离提供不同选择性和疏水性选择。额外的混合模式色谱支撑物包括但不限于nuviacprime、toyopearlmxtrp650m和hcx。在某些方面,混合模式色谱树脂是由直接或经由间隔体与有机或无机支撑物(有时称为基础基质)偶联的配体构成。支撑物可呈以下形式:颗粒,例如基本上呈球形的颗粒、整料、过滤器、膜、表面、毛细管等。在某些方面,支撑物是由天然聚合物例如交联碳水化合物材料如琼脂糖、琼脂、纤维素、右旋糖酐、壳聚糖、魔芋、角叉菜胶、结冷胶、藻酸盐等制备。为了获得高吸附能力,支撑物可为多孔的,接着将配体偶联至外表面以及孔表面。此类天然聚合物支撑物可根据标准方法制备,例如反相悬浮胶凝(shjerten:biochimbiophysacta79(2),393-398(1964),其全部教导都通过引用并入本文)。或者,支撑物可由合成聚合物例如交联合成聚合物,例如苯乙烯或苯乙烯衍生物、二乙烯苯、丙烯酰胺、丙烯酸酯、甲基丙烯酸酯、乙烯基酯、乙烯酰胺等制备。此类合成聚合物可根据标准方法产生,参见“styrenebasedpolymersupportsdevelopedbysuspensionpolymerization”(rarshady:chimicael'industria70(9),70-75(1988),其全部教导都通过引用并入本文)。多孔天然或合成聚合物支撑物也可从例如gehealthcare,uppsala,sweden的商业来源获得。[0628]可将包含目标蛋白质的生物样品混合物的蛋白质加载量调整至以下柱的总蛋白质加载量:介于约25g/l与约750g/l之间、或介于约75g/l与约500g/l之间、或介于约100g/l与约300g/l之间。在某些示例性实施方案中,将加载蛋白质混合物的蛋白质浓度调整至加载于柱上的材料的以下蛋白质浓度:介于约1g/l与约50g/l之间、或介于约9g/l与约25g/l之间。[0629]可添加添加剂,例如聚乙二醇、清洁剂、氨基酸、糖、离液剂,以增强分离性能,从而实现更好的分离、回收和/或产物质量。[0630]在某些实施方案中,包括与阿柏西普和/或minitrap有关的那些实施方案,本发明的方法可用于选择性地去除、显著减少或基本上去除所有ptm,包括氧代变体。[0631]用于产生本发明的组合物的方法也可以连续色谱模式实施。在这种模式下,使用至少两个柱(称为“第一”柱和“第二”柱)。在某些实施方案中,可进行此连续色谱模式,以使得洗脱级分和/或汽提级分(包含ptm,例如氧代变体)可随后或同时加载于第二柱上(有或无稀释)。[0632]在一个实施方案中,用于连续模式的介质选择可为具有侧悬疏水和阴离子交换官能基的许多色谱树脂、整料介质、膜吸附介质或深度过滤介质中的一种。[0633]f.疏水相互作用色谱[0634]本发明的组合物还可使用疏水相互作用色谱(hic)来制备。[0635]在进行分离时,例如使用批量生产技术或使用柱或膜色谱使生物样品与hic材料接触。在hic处理之前,可能需要调整盐缓冲液的浓度以实现所需蛋白质与树脂或膜的结合/相互作用。[0636]离子交换色谱依赖于目标蛋白质的局部电荷来进行选择性分离,而疏水相互作用色谱则利用蛋白质的疏水特性来实现选择性分离。蛋白质上或蛋白质内的疏水基团与色谱树脂或膜的疏水基团相互作用。通常,在合适的条件下,蛋白质(或蛋白质的一部分)的疏水性越强,其与柱或膜的相互作用就越强。因此,在合适的条件下,hic可用于促进样品中的过程相关的杂质(例如,hcp)以及产物相关的物质(例如,聚集体和碎片)与目标蛋白质的分离。[0637]像离子交换色谱一样,hic柱或hic膜装置也可在洗脱模式、流通模式或混合模式下操作,其中产物展示与色谱材料的结合或相互作用,而仍可使用与加载缓冲液相同或基本上相似的缓冲液从所述材料上洗去。(上面结合aex处理概述了这些模式的细节。)由于疏水相互作用在高离子强度下最强,所以这种分离形式宜在盐洗脱步骤(例如通常与离子交换色谱结合使用的那些)之后进行。或者,可在采用hic步骤之前将盐添加至样品中。高盐浓度有利于蛋白质吸附于hic柱上,但实际浓度可取决于目标蛋白质的性质、盐类型和所选的特定hic配体而在很大范围内变化。取决于它们是促进疏水相互作用(盐析效应)还是破坏水的结构(离液效应)并导致疏水相互作用减弱,各种离子可以所谓的疏溶(soluphobic)系列排列。根据递增的盐析效应将阳离子排序为ba2 ;ca2 ;mg2 ;li ;cs ;na ;k ;rb ;nh4 ,而阴离子可根据递增的离液效应被排序为po43-;so42-;ch3co3-;ci-;br-;no3-;clo4-;i-;scn-。[0638]一般来说,na 、k 或nh4 硫酸盐使用hic有效促进配体-蛋白质相互作用。可如以下关系所给出来配制影响相互作用强度的盐:(nh4)2so4》na2so4》nacl》nh4c1》nabr》nascn。一般来说,介于约0.75m与约2m之间的硫酸铵或介于约1m与约4m之间的nacl的盐浓度是有用的。[0639]hic介质通常包含疏水性配体(例如烷基或芳基)与其偶联的基础基质(例如,交联琼脂糖或合成共聚物材料)。合适的hic介质包含用苯基官能化的琼脂糖树脂或膜(例如,来自gehealthcare的phenylsepharosetm或来自sartorius的phenylmembrane)。许多hic树脂是市售的。实例包括但不限于:captophenyl、具有低或高取代的phenylsepharosetm6fastflow、phenylsepharosetmhighperformance、octylsepharosetmhighperformance(gehealthcare);fractogeltmemdpropyl或fractogeltmemdphenyl(e.merck,germany);macro-preptmmethyl或macro-preptmt-butyl柱(bio-rad,california);wphi-propyl(c3)tm(j.t.baker,newjersey);以及toyopearltm醚、苯基或丁基(tosohaas,pa);toyoscreenppg;toyoscreenphenyl;toyoscreenbutyl;toyoscreenhexyl;gehiscreen和butylffhiscreenoctylff。[0640]将包含目标蛋白质的样品的蛋白质加载量调整至以下柱的总蛋白质加载量:介于约50g/l至约1000g/l之间、介于约5g/l与约150g/l之间、介于约10g/l与约100g/l之间、介于约20g/l与约80g/l之间、介于约30g/l与约50g/l之间、或介于约40g/l与约50g/l之间。在某些实施方案中,将加载蛋白质混合物的蛋白质浓度调整至有待加载于柱上的以下材料的蛋白质浓度:介于约0.5g/l与约50g/l之间、或介于约1g/l与约20g/l之间。[0641]由于为任何特定生产过程选择的ph值必须与蛋白质的稳定性和活性相容,因此特定的ph值条件对每种应用可为特有的。然而,由于在ph5.0-8.5时,特定的ph值对hic分离的最终选择性和分辨率影响极小,因此此类条件可为有利的。ph值的增加削弱疏水相互作用,并且在ph值高于8.5或低于5.0时,蛋白质的保留发生更剧烈的变化。另外,离子强度的变化、有机溶剂的存在、温度和ph值(尤其是当没有净表面电荷时,在等电点pi下)会影响蛋白质的结构和溶解性,并由此影响与其他疏水性表面(例如在hic介质中的那些)的相互作用,并且因此,在某些实施方案中,本发明结合生产策略,其中对上述一者或多者进行调整,以实现过程相关的杂质和/或产物相关的物质的所需减少。[0642]在某些实施方案中,可使用光谱法,例如uv、nir、ftir、荧光、拉曼,从而以随线(on-line)、近线(at-line)或在线(in-line)模式监测目标蛋白质和杂质,接着可将其用于控制从hic吸附剂流出物中收集的汇集材料中的聚集体水平。在某些实施方案中,可在色谱步骤的流出管在线或在收集容器中使用随线、近线或在线监测方法,以实现所需产物的质量/回收。在某些实施方案中,uv信号可用作替代物以实现适当的产物质量/回收,其中uv信号可经适当处理,包括但不限于例如积分、微分、移动平均值的处理技术,以使得可解决正常过程可变性并且可实现目标产物质量。在某些实施方案中,此类测量可与在线稀释方法组合,以使得加载/洗涤液的离子浓度/电导率可通过反馈来控制,并因此有助于产物质量控制。[0643]g.尺寸排阻色谱[0644]尺寸排阻色谱或凝胶过滤依赖于随分子尺寸而变的组分的分离。分离取决于与流体中的时间相比,物质在多孔固定相中所花费的时间。分子将驻留在孔中的概率取决于分子和孔的尺寸。另外,物质渗透至孔中的能力是由大分子的扩散迁移率决定,大分子越小,扩散迁移率越高。极巨大的大分子可能根本不会渗透至固定相的孔中;而且,对于非常小的大分子,渗透的可能性接近于一。较大分子尺寸的组分更快地移动通过固定相,而较小分子尺寸的组分通过固定相的孔的路径则较长,因此在固定相中的保留时间更长。[0645]色谱材料可包含尺寸排阻材料,其中尺寸排阻材料是树脂或膜。用于尺寸排阻的基质优选是惰性凝胶介质,其可为交联多糖,例如呈球形珠粒形式的交联琼脂糖和/或右旋糖酐的复合物。交联度决定溶胀的凝胶珠粒中存在的孔的尺寸。大于某一尺寸的分子不会进入凝胶珠粒,并且因此最快移动通过色谱床。较小的分子,例如清洁剂、蛋白质、dna等,会根据其尺寸和形状而不同程度地进入凝胶珠粒,它们通过床时会受到阻碍。因此通常以分子尺寸递减的顺序洗脱分子。[0646]适用于病毒的尺寸排阻色谱的多孔色谱树脂可由具有不同物理特征的右旋糖、琼脂糖、聚丙烯酰胺或二氧化硅制成。还可使用聚合物组合。最常用的是可从amershambiosciences以商品名“sephadex”获得的那些。来自不同构造材料的其他尺寸排阻载体也是适当的,例如toyopearl55f(聚甲基丙烯酸酯,来自tosohbioscience,montgomerypa.)和bio-gelp-30fine(bioradlaboratories,hercules,ca)。[0647]可将包含目标蛋白质的样品的蛋白质加载量调整至以下柱的总蛋白质加载量:介于约50g/l至约1000g/l之间、介于约5g/l与约150g/l之间、介于约10g/l与约100g/l之间、介于约20g/l与约80g/l之间、介于约30g/l与约50g/l之间、或介于约40g/l与约50g/l之间。在某些实施方案中,将加载蛋白质混合物的蛋白质浓度调整至有待加载于柱上的以下材料的蛋白质浓度:介于约0.5g/l与约50g/l之间、或介于约1g/l与约20g/l之间。[0648]h.病毒过滤[0649]病毒过滤是产生过程中专用的病毒减少步骤。此步骤通常在色谱精制后进行。可通过使用合适的过滤器来减少病毒,此类过滤器包括但不限于来自asahikaseipharma的planova20ntm、50n或bioex;来自emdmillipore的viresolvetm过滤器;来自sartorius的virosartcpv;或来自pallcorporation的ultipordv20或dv50tm过滤器。本领域普通技术人员显而易见,选择合适的过滤器以获得所需过滤性能。[0650]i.超滤/渗滤[0651]本发明的某些实施方案采用超滤和渗滤以进一步浓缩和配制目标蛋白质。在以下文献中详细描述超滤:principlesandapplications,l.zeman和a.zydney(marceldekker,inc.,newyork,n.y.,1996);和ultrafiltrationhandbook,munircheryan(technomicpublishing,1986;isbn号87762-456-9);其全部教导都通过引用并入本文。一种过滤方法是如题为“pharmaceuticalprocessfiltrationcatalogue”第177-202页(bedford,mass.,1995/96)的millipore目录中所述的切向流过滤,所述文献的全部教导都通过引用并入本文。通常认为超滤是指使用孔径小于0.1μm的过滤器进行的过滤。使用具有如此小的孔径的过滤器,可通过使样品缓冲液渗透通过过滤器膜孔来减少样品的体积,而蛋白质则保留在膜表面之上。[0652]本领域普通技术人员可选择一种适当的膜过滤器装置用于uf/df操作。适用于本发明的膜盒(membranecassette)的实例包括但不限于来自emdmillipore的具有10kd、30kd或50kd膜的pellicon2或pellicon3盒;来自gehealthcare的kvick10kd、30kd或50kd膜盒;以及来自pallcorporation的centramate或centrasette10kd、30kd或50kd盒。[0653]j.示例性生产策略[0654]可通过依次采用ph降低、离心和过滤从生产生物反应器收获物中去除细胞和细胞碎片(包括hcp)来进行初步回收。本发明涉及使来自初步回收的包含目标蛋白质的生物样品经历一个或多个生产步骤,包括(但无特别顺序)aex、cex、sec、hic和/或mm。本发明的某些方面包括进一步处理步骤。额外的处理程序的实例包括乙醇沉淀、等电聚焦、反相hplc、硅胶色谱、肝素sepharosetm色谱、其他阴离子交换色谱和/或其他阳离子交换色谱、色谱聚焦、sds-page、硫酸铵沉淀、羟磷灰石色谱、凝胶电泳、透析和亲和色谱(例如,使用蛋白a或g、抗体、特异性底物、配体或抗原作为捕获试剂)。在某些方面,可独立地改变柱温度(以及其他参数)以提高分离效率和/或任何特定产生步骤的产率。[0655]在某些实施方案中,可将未结合的流通和洗涤级分进一步分级分离,并且可汇集提供目标产物纯度的级分的组合。[0656]柱加载和洗涤步骤可通过以下操作来控制:在柱流出物或收集池或两者中在线、近线或脱机测量产物相关的杂质/物质水平,以达到特定的目标产物质量和/或产率。在某些实施方案中,可通过用缓冲液或其他溶液在线或分批或连续稀释来动态控制加载浓度,以实现提高分离效率和/或产率所需的分配。[0657]此类生产程序的实例描绘于图5-8中。[0658]图5代表用于产生阿柏西普的一个示例性实施方案。参看图5,所述方法包括:(a)在cdm中培养的宿主细胞中表达阿柏西普;(b)使用可包括亲和捕获树脂的第一色谱支撑物捕获阿柏西普;以及(c)使阿柏西普的至少一部分与可包括阴离子交换色谱的第二色谱支撑物接触。步骤(c)还可包括洗涤aex柱以及收集包含阿柏西普的样品的流通级分。任选地,步骤(c)可包括汽提第二色谱支撑物以及收集汽提级分。所述步骤可通过常规方法联合上文提及的方法来进行。应理解,本领域技术人员可能选择采用cex而非aex或除aex之外还使用cex。还可不以特定顺序采用额外的色谱步骤,包括但不限于hic和sec。[0659]除了图5中的示例性实施方案之外,其他额外的示例性实施方案可包括(d)使步骤(c)的所述阿柏西普的至少一部分与第三色谱支撑物接触。在一个方面,方案可包括(e)使步骤(d)的至少一部分阿柏西普与第四色谱支撑物接触。在此实施方案的一个方面,方案可任选地包括使步骤(c)的包含阿柏西普的样品经历小于5.5的ph值。在一个方面,本方法包括在步骤(a)之前的澄清步骤。[0660]图6代表用于产生vegfminitrap的一个示例性实施方案。此方法包括:(a)在cdm中培养的宿主细胞中表达阿柏西普;(b)使用可包括亲和色谱树脂的第一色谱支撑物捕获阿柏西普;(c)切割阿柏西普,从而去除fc结构域并形成包含vegfminitrap的样品;(d)使步骤(c)的样品与可为亲和色谱的第二色谱支撑物接触,以及(e)使步骤(d)的流通液与可包括阴离子交换色谱的第三色谱支撑物接触。步骤(d)包括流通级分的收集,其中由于缺少fc结构域,minitrap应驻留,而阿柏西普或具有fc结构域的任何其他蛋白质应基本上与步骤(d)的亲和柱相互作用。任选地,步骤(d)可包括汽提第三色谱支撑物和收集汽提级分。所述步骤可通过常规方法结合以上概述的方法来进行。不以特定顺序,可包括额外的色谱步骤,但不限于例如hic和sec。[0661]图7代表用于产生阿柏西普的一个示例性实施方案。此方法包括:(a)在cdm中培养的宿主细胞中表达阿柏西普;(b)使用可包括阳离子交换色谱的第一色谱支撑物捕获阿柏西普;以及(c)使步骤(b)的流通液与可包括阴离子交换色谱的第二色谱支撑物接触。任选地,步骤(c)可包括汽提第二色谱支撑物和收集汽提级分。所述步骤可通过常规方法结合以上提及的方案来进行。不以特定顺序,可采用其他色谱程序,包括但不限于hic和sec。[0662]图8代表用于产生vegfminitrap的一个示例性实施方案。此方法包括:(a)在cdm中培养的宿主细胞中表达阿柏西普;(b)使用可包括离子交换色谱的第一色谱支撑物捕获阿柏西普;(c)对(b)的包含阿柏西普的流通级分进行亲和色谱;洗脱,其中洗脱液包含阿柏西普;(d)使(c)的阿柏西普经历切割活性,从而切割fc结构域,由此形成vegfminitrap。在一个方面,步骤(b)的离子交换包含aex。或者,步骤(b)可包含cex。不以特定顺序,可包括额外的色谱步骤,例如步骤(d)之后的其他离子交换色谱步骤、hic和/或sec的添加。[0663]vii.包含组合物的药物制剂[0664]本发明还公开包含抗vegf组合物(如上所述)的制剂。抗vegf蛋白的合适的制剂包括但不限于以下专利中所述的制剂:美国专利第7,608,261号、美国专利第7,807,164号、美国专利第8,092,803号、美国专利第8,481,046号、美国专利第8,802,107号、美国专利第9,340,594号、美国专利第9,914,763号、美国专利第9,580,489号、美国专利第10,400,025号、美国专利第8,110,546号、美国专利第8,404,638号、美国专利第8,710,004号、美国专利第8,921,316号、美国专利第9,416,167号、美国专利第9,511,140号、美国专利第9,636,400号和美国专利第10,406,226号,其都通过引用整体并入本文。[0665]上游工艺技术(在上文部分iv中描述)、下游工艺技术(在上文部分v中描述)可单独使用或彼此组合使用以实现制剂产生。[0666]本发明公开包含抗vegf组合物和一种或多种成分/赋形剂的制剂以及其使用方法和制备此类组合物的方法。在本发明的一个实施方案中,本发明的药物制剂具有约5.5、5.6、5.7、5.8、5.9、6.0、6.1或6.2的ph值。[0667]为了制备抗vegf组合物的药物制剂,将抗vegf组合物与药学上可接受的载剂或赋形剂混合。参见例如remington'spharmaceuticalsciencesandu.s.pharmacopeia:nationalformulary,mackpublishingcompany,easton,pa.(1984);hardman等人(2001)goodmanandgilman'sthepharmacologicalbasisoftherapeutics,mcgraw-hill,newyork,n.y.;gennaro(2000)remington:thescienceandpracticeofpharmacy,lippincott,williams,andwilkins,newyork,n.y.;avis等人(编辑)(1993)pharmaceuticaldosageforms:parenteralmedications,marceldekker,ny;lieberman等人(编辑)(1990)pharmaceuticaldosageforms:tablets,marceldekker,ny;lieberman等人(编辑)(1990)pharmaceuticaldosageforms:dispersesystems,marceldekker,n.y.;weiner和kotkoskie(2000)excipienttoxicityandsafety,marceldekker,inc.,newyork,n.y.;其全部教导都通过引用并入本文。在本发明的一个实施方案中,药物制剂是无菌的。[0668]本发明的药物制剂包括抗vegf组合物和药学上可接受的载剂,包括例如水、缓冲剂、防腐剂和/或清洁剂。[0669]本发明提供一种药物制剂,其包含本文所列的抗vegf组合物中的任一者和药学上可接受的载剂,例如,其中多肽的浓度为约40mg/ml、约60mg/ml、约80mg/ml、90mg/ml、约100mg/ml、约110mg/ml、约120mg/ml、约130mg/ml、约140mg/ml、约150mg/ml、约200mg/ml或约250mg/ml。[0670]本发明的范围包括经干燥、例如经冷冻干燥的组合物,其包含抗vegf蛋白和基本上(约85%至约99%或更高)无水的药学上可接受的载剂。[0671]在一个实施方案中,根据physicians'deskreference2003(thomsonhealthcare;第57版(2002年11月1日),其全部教导都通过引用并入本文),将与本文公开的抗vegf组合物联合向受试者施用的另一种治疗剂施用于受试者。[0672]本发明提供一种容器(例如,具有盖的塑料或玻璃小瓶或色谱柱、中空针或注射器筒),其包含本文所述的抗vegf组合物中的任一者或包含药学上可接受的载剂的药物制剂。本发明还提供一种包含本文所述的抗vegf组合物或制剂的注射装置,例如注射器、预填充注射器或自动注射器。在一个方面,将容器染色(例如棕色)以遮挡自然光或其他光。[0673]本发明包括包含抗vegf组合物以及一种或多种其他治疗剂的组合。抗vegf组合物和其他治疗剂可在单一组合物中或在单独组合物中。例如,治疗剂是ang-2抑制剂(例如奈伐苏单抗(nesvacumab))、tie-2受体活化剂、抗pdgf抗体或其抗原结合片段、抗pdgf受体或pdgf受体β抗体或其抗原结合片段和/或另外的vegf拮抗剂,例如阿柏西普、康柏西普、贝伐单抗(bevacizumab)、雷尼单抗(ranibizumab);抗vegf适体,例如哌加他尼(pegaptanib)(例如,哌加他尼钠);单链(例如,vl-vh)抗vegf抗体,例如溴珠单抗(brolucizumab);抗vegfdarpin,例如abiciparpegoldarpin;双特异性抗vegf抗体,例如其也与ang2结合,例如rg7716;或可溶形式的包含胞外结构域1-3的人类血管内皮生长因子受体3(vegfr-3),表示为fc融合蛋白。[0674]viii.治疗方法[0675]本发明提供用于在受试者中治疗或预防癌症(例如,其生长和/或转移至少部分地由vegf介导,例如vegf介导的血管生成)或血管生成性眼部病症的方法,所述方法包括施用治疗有效量的如本文(前述部分iii)所公开的组合物。[0676]上游工艺技术(前述部分iv)和下游工艺技术(前述部分v和vi)可单独使用或相互组合使用,以产生如部分iii中所述的组合物和/或如部分vii中所述的制剂,其可用于治疗或预防多种病症,包括眼科和肿瘤疾病。[0677]本发明还提供了一种向受试者(例如人类)施用本文(部分iii和vii)所述的组合物的方法,所述方法包括将在不多于约100μl,例如约50μl、约70μl或约100μl中具有约0.5mg、2mg、4mg、6mg、8mg、10mg、12mg、14mg、16mg、18mg或20mg目标蛋白质(例如阿柏西普或minitrap)和任选地另一治疗剂的组合物通过例如眼内注射(例如通过玻璃体内注射)引入受试者体内。[0678]本发明提供了一种在有需要的受试者中治疗癌症(其生长和/或转移至少部分地由vegf介导,例如vegf介导的血管生成)或血管生成性眼部病症的方法,所述方法包括向受试者施用治疗有效量的本文(以上部分iii和部分vii)所述的组合物,例如,在不多于约100μl中的2mg、4mg、6mg、8mg或10mg目标蛋白质和任选地另一治疗剂。在本发明的一个实施方案中,通过玻璃体内注射进行施用。可使用本文的方法治疗或预防的血管生成性眼部病症的非限制性实例包括:[0679]·年龄相关的黄斑变性(例如,湿性或干性),[0680]·黄斑水肿,[0681]·视网膜静脉阻塞后的黄斑水肿,[0682]·视网膜静脉阻塞(rvo),[0683]·视网膜中央静脉阻塞(crvo),[0684]·视网膜分支静脉阻塞(brvo),[0685]·糖尿病性黄斑水肿(dme),[0686]·脉络膜新生血管形成(cnv),[0687]·虹膜新生血管形成,[0688]·新生血管性青光眼,[0689]·青光眼手术后纤维化,[0690]·增生性玻璃体视网膜病(pvr),[0691]·视盘新生血管形成,[0692]·角膜新生血管形成,[0693]·视网膜新生血管形成,[0694]·玻璃体新生血管形成,[0695]·角膜翳,[0696]·翼状胬肉,[0697]·血管性视网膜病,[0698]·在患有糖尿病性黄斑水肿的受试者中的糖尿病性视网膜病;以及[0699]·糖尿病性视网膜病(例如非增生性糖尿病性视网膜病(例如,以约47或53的糖尿病性视网膜病严重程度量表(drss)分级为特征),或增生性糖尿病性视网膜病;例如,在不患有dme的受试者中)。[0700]此类组合物或制剂(部分iii和部分vii)的施用方式可改变并且由熟练从业者确定。施用途径包括肠胃外、非肠胃外、经口、直肠、透粘膜、肠、肠胃外、肌内、皮下、皮内、髓内、鞘内、直接心室内、静脉内、腹膜内、鼻内、眼内、吸入、吹入、表面、皮肤、眼内、玻璃体内、透皮或动脉内。[0701]在本发明的一个实施方案中,本发明的药物制剂(包括本发明的组合物或制剂)的玻璃体内注射包括以下步骤:用包含制剂的注射器和针(例如30号注射针)刺穿眼睛,以及将制剂(例如,小于或等于约100微升;约40、50、55、56、57、57.1、58、60或70微升)以足量体积注入眼玻璃体中以便递送如本文所述的治疗有效量,例如约2、4、6、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8或8.9、10或20mg的目标蛋白质。任选地,所述方法包括以下步骤:向所注射的眼睛施用局部麻醉剂(例如,丙美卡因(proparacaine)、利多卡因(lidocaine)或四卡因(tetracaine))、抗生素(例如,氟喹诺酮(fluoroquinolone))、防腐剂(例如,聚维酮-碘)和/或瞳孔扩张剂。在一个方面,在注射之前,在有待注射的眼睛周围建立无菌区。玻璃体内注射后,监测受试者的眼内压升高、炎症和/或血压。[0702]用于血管生成性眼部病症的目标蛋白质的有效或治疗有效量是指足以引起癌症或血管生成性眼部病症的消退、稳定或消除的目标蛋白质的量,例如,通过使癌症或血管生成性眼部病症的一种或多种症状或征象以任何临床上可测量的程度消退、稳定或消除(例如,关于血管生成性眼部病症);通过使糖尿病性视网膜病严重程度评分(drss)降低或维持;通过改善或维持视力(例如,最佳矫正视力,如通过etdrs字母的增加来量度);增加或维持视野和/或减小或维持中央视网膜厚度;以及就癌症而言,停止或逆转受试者中的癌细胞的生长、存活和/或转移。[0703]在本发明的一个实施方案中,用于治疗或预防血管生成性眼部病症的目标蛋白质(例如阿柏西普)的有效或治疗有效量为约0.5mg、2mg、3mg、4mg、5mg、6mg、7mg、7.25mg、7.7mg、7.9mg、8.0mg、8.1mg、8.2mg、8.3mg、8.4mg、8.5mg、8.6mg、8.7mg、8.8mg、8.9mg、9mg、10mg、11mg、12mg、13mg、14mg、15mg、16mg、17mg、18mg、19mg或20mg,例如,在不多于约100μl中。所述量可根据有待施用的受试者的年龄和体格、目标疾病、疾患、施用途径等而变化。在某些示例性实施方案中,可在初始剂量之后施用第二或多个后续剂量的目标蛋白质,所述第二或多个后续剂量的量可与初始剂量的剂量大致相同或更少或更多,其中后续剂量间隔至少1天至3天、至少一周、至少2周、至少3周、至少4周、至少5周、至少6周、至少7周、至少8周、至少9周、至少10周、至少12周或至少14周。[0704]应注意,剂量值可随着有待减轻的疾患的类型和严重程度而变化。应进一步理解对于任何特定受试者,具体剂量方案应根据受试者需求和施用或监督施用所述组合物的人的专业判断随时间加以调节,并且本文所列举的剂量范围仅是示例性的并且不旨在限制所要求保护的组合物的范围或实践。[0705]ix.测定蛋白质变体的方法[0706]使用本文所述的技术产生的色谱样品中的蛋白质变体的水平可如下文实施例中所述来分析。在某些实施方案中,使用带有用碳氟化合物涂覆的毛细管筒(100μπιx5cm)的ice3分析仪(proteinsimple)来采用cief方法。两性电解质溶液由以下各物在纯净水中的混合物组成:0.35%甲基纤维素(mc)、4%pharmalyte3-10载剂两性电解质、4%pharmalyte5-8载剂两性电解质、10mml-精氨酸hcl、24%甲酰胺以及pi标志物5.12和9.77。阳极电解液是80mm磷酸,而阴极电解液是100mm氢氧化钠,均在0.10%甲基纤维素中。将样品在纯净水中稀释至10mg/ml。将样品与两性电解质溶液混合,接着通过引入1500v的电位持续一分钟,接着引入3000v的电位持续7分钟来聚焦。通过使280nm紫外光穿过毛细管并进入电荷耦合装置数字相机的镜头中,获得聚焦变体的图像。随后分析此图像以确定各种电荷变体的分布。本领域技术人员可改变精确参数,同时仍达到期望结果。[0707]在整个说明书中引用各种出版物,包括专利、专利申请、公开的专利申请、登录号、技术论文和学术论文。这些引用的参考文献中的每一篇都通过引用整体并入。[0708]本公开将通过参考下文实施例更充分地理解。然而,它们不应被理解为限制本发明的范围。[0709]实施例[0710]在实施例中论述的minitraps(mt)1-6如下:[0711]mt1:通过切割使用cdm1产生的阿柏西普获得的vegfminitrap。[0712]mt2:通过切割使用cdm2产生的阿柏西普获得的vegfminitrap。[0713]mt3:通过切割使用cdm3产生的阿柏西普获得的vegfminitrap。[0714]mt4:通过切割使用大豆水解物产生的阿柏西普获得的vegfminitrap。[0715]mt5:重组vegfminitrap(二聚体)。[0716]mt6:重组vegfminitrap(scfv)。[0717]mt1、mt5和mt6的表征描述于下文实施例8中。[0718]样品颜色评价[0719]发现测量b*值(cielab)的分光光度测定法适合进行颜色评价。[0720]在可见光谱(380至780nm)上定量1ml蛋白质样品的吸光度,并且使用一组矩阵运算将吸光度曲线转换为cielab颜色空间。所述仪器每小时可处理大约6个样品。所述测定的高通量格式使用clariostar读板仪(bmglabtech)。使用需要0.3ml样品的96孔板,可分析至多96个样品。[0721]为了将by标准转换为b*值,使用高通量测定格式对by参考标准(by1至by7)进行定量。[0722]溶液是按照以上论述的by标准来制备。每个标准的b*值如图9中所示。此方法提供更快的测定、更少的样品需求和更短的运行时间,如下表3中所示。对于使用此方法评估的所有样品,将测试样品的蛋白质浓度标准化为5g/l或10g/l。[0723]表3.[0724]原始高通量量/样品1ml0.3ml测量格式比色管(单个)96孔板(整体)运行时间6个样品/小时96个样品/5分钟数据输入手动自动资料存储excellims[0725]实施例1:使用化学成分确定的培养基产生蛋白质[0726]1.1细胞来源和收获[0727]在本研究中使用产生阿柏西普的细胞系。使用化学成分确定的培养基(cdm)培养和收获产生阿柏西普的细胞系。[0728]1.2阿柏西普的蛋白水解切割[0729]将具有经固定的ides酶(获自genovis(cambridge,ma)的)的柱用于产生mt1。将获自细胞培养收获物的阿柏西普(在1.0ml切割缓冲液中的20mg)添加至柱中,并在18℃下温育30分钟。30分钟后,用切割缓冲液(1.0ml)洗涤柱。将消化混合物与洗涤溶液合并。将混合物加载于分析型蛋白a亲和柱(appliedbiosystemstm,porostm20μm蛋白a筒2.1x30mm,0.1ml(目录号2-1001-00)上并从其洗脱。根据用于porostm20μm蛋白a筒2.1x30mm,0.1ml(目录号2-1001-00)的appliedbiosystems'tm方案进行处理。柱高度为20±1.0cm,保留时间是15分钟,并且使用40mmtris、54mm乙酸盐ph7.0±0.1进行平衡/洗涤。[0730]实施例2.阴离子交换色谱(aex)用于使颜色最小化[0731](a)使用aex减少颜色形成[0732]进行aex色谱以去除在使用cdm1表达的阿柏西普的产生期间获得的着色。[0733]2.1设计[0734]如表2-1中所详示,使用如表2-2中所述的aex方案对本研究进行五次aex分离。将15.7mlqsepharosefastflow柱(19.5cm床高,1.0cmi.d.)和14.1mlporos50hq柱(18.0cm床高,1.0cmi.d.)整合至aktaavant台式液相色谱控制器中。[0735]使用2mtris碱或2m乙酸将aex加载液的ph值调节至目标±0.05个ph单位。使用5m氯化钠或去离子水将aex加载液的电导率调节至目标±0.1ms/cm。分析所有汇集样品的高分子量(hmw)、颜色和产率。[0736]表2-1.用于aex颜色减少的研究设计的概述[0737]aex分离评估条件树脂1ph8.30–8.50,1.90–2.10ms/cmporos50hq2ph7.90–8.10,2.40–2.60ms/cmqsepharoseff3ph7.90–8.10,2.40–2.60ms/cmporos50hq4ph7.70–7.90,3.90–4.10ms/cmqsepharoseff5ph7.70–7.90,3.90–4.10ms/cmporos50hq[0738]表2-2.用于颜色减少的aex方案[0739][0740]2.2结果[0741]将aex分离用于产生会呈现颜色的显著减少。(表2-3)。例如,如表2-3中所见,在aex分离1(ph8.30-8.50,1.90-2.10ms/cm)的流通液(ft)和洗涤液中观察到的颜色具有1.05的b*值,而用于aex的加载液(“aex加载液”)的颜色具有3.06的b*值。b*值的增加反映样品的黄棕色着色的强度。[0742]进行五次aex分离以评估树脂(qsepharoseff或poros50hq)以及ph和电导率设定点(ph8.40和2.00ms/cm、ph8.00和2.50ms/cm、或ph7.80和4.00ms/cm)对颜色减少的影响。对于poros50hq,产率(64.4%、81.9%和91.4%)和汇集hmw水平(1.02%、1.29%和1.83%)随着设定点变化为较低ph值和较高电导率而提高。颜色(b*值)也随着设定点变化为较低ph值和较高电导率而增加(1.05、1.33和1.55)。对于poros50hq的aex分离,较高的ph值和较低的电导率提供最大程度的颜色减少。[0743]对于qsepharosefastflow,产率(49.5%和77.7%)和汇集hmw水平(0.59%和1.25%)也随着设定点变化为较低ph值和较高电导率而提高。颜色(b*值)也随着设定点变化为较低ph值和较高电导率而增加(0.96和1.35)。[0744]aex的使用减少黄棕色着色—参见表2-3。另外,对于在两种树脂上评估的两个设定点,确定qsepharosefastflow减少的颜色比poros50hq多。在ph8.00和2.50ms/cm设定点下,poros50hq池具有1.33的b*值,而qsepharosefastflow池具有0.96的b*值。类似地,在ph7.80和4.00ms/cm设定点下,poros50hq池具有1.55的b*值,而qsepharosefastflow池具有1.35的b*值(表2-3)。[0745]表2-3.aex颜色减少研究的实验结果的概述[0746][0747]aex,阴离子交换色谱;hmw,高分子量种类;n/a,不适用[0748]将级分调节至10g/l的蛋白质浓度以用于颜色测量。[0749]2.3结论[0750]发现aex的使用减少黄棕色着色,参见表2-3。参看表2-3,aex加载液具有3.06的b*值,但在经历aex色谱(aex分离1-5)时,b*值减小表明黄棕色着色的减少。此外,随着b*值的减小,着色也随之减少;随着b*值的增大,其反映了给定样品中黄棕色的增加。[0751]使用两种aex树脂(poros50hq和qsepharosefastflow)以及三个设定点(ph8.40和2.00ms/cm、ph8.00和2.50ms/cm、以及ph7.80和4.00ms/cm)评估颜色减少。在这两种树脂下,对于较高ph值和较低电导率的设定点,颜色减少较多。此外,在对两种树脂评估的两个设定点(ph8.00和2.50ms/cm以及ph7.80和4.00ms/cm)下,qsepharosefastflow比poros50hq提供更多的颜色减少。然而,与用于aex的加载溶液(“aex加载液”)相比,所有五种aex分离方法均导致显著的颜色减少,表明在使用cdm表达的阿柏西普的产生过程中aex产生的重要性。aex加载液(浓度为10g/l)的初始b*值可在约0.5至约30的范围内,更特别是在约1.0至约25.0的范围内,并且甚至更特别是在约2.0至约20.0的范围内。使用aex之后,流通液(浓度为10g/l)的b*值可在0.5至约10.0的范围内,更特别是在约0.5至约7.0的范围内,并且甚至更特别是在约0.5至约5.0的范围内。[0752]2.4肽作图[0753]样品制备。进行从上述实验(表2-3)的aex加载液和流通液获得的还原和烷化阿柏西普样品的胰蛋白酶作图,以识别和量化翻译后修饰(ptm)。将每个样品(加载液和流通液)的等分试样用8.0m尿素、0.1mtris-hclph7.5变性,用dtt还原,接着用碘乙酰胺烷化。首先将经变性、还原和烷化的样品在37℃下用重组lys-c(rlys-c)以1:100(w/w)的酶与底物比率消化30分钟,用0.1mtris-hclph7.5稀释,使得最终尿素浓度为1.8m,随后在37℃下用胰蛋白酶以1:20(w/w)的酶与底物比率消化2小时,接着在37℃下用pngasef以1:5(w/w)的酶与底物比率去糖基化1小时。通过使用甲酸(fa)使ph值低于2.0来中止消化。[0754]lc-ms分析。将从每个样品得到的rlys-c/胰蛋白酶肽的20μg等分试样通过以下来分离和分析:使用watersacquityuplccshc18柱(1.7μm,2.1×150mm)进行反相超高效液相色谱(uplc),接着随线pda检测(在280nm、320nm和350nm的波长下)和质谱分析。流动相a是在水中的0.1%fa,而流动相b是在乙腈中的0.1%fa。样品注入后,梯度以在0.1%b下保持5分钟开始,接着在75分钟内线性增加至35%b,以实现最佳肽分离。使用thermoscientificqexactivehybridquadrupole-orbitrap质谱仪进行ms和ms/ms实验,所述质谱仪采用高能碰撞解离(hcd)进行用于ms/ms实验的肽片段化。肽身份分配是基于在全ms谱中的给定肽的经实验确定的精确质量以及在相应hcdms/ms谱中的b和y碎片离子。生成来自加载液和流通液的肽的提取离子色谱图(参见图10)。如图10中的提取离子色谱图中所见,显示了在来自aex分离1-5的“aex加载液”和“aexft/洗涤液”中识别的肽片段(如表2-3中所识别)。来自肽作图分析的在图10中识别的这些肽中的一些的相对丰度示于图11中。[0755]参看图11,此图识别所分析的各种肽片段及其相对氧化水平。特别是,第三柱识别经分离和分析的肽片段的氨基酸残基(“肽序列”)。每个肽序列都具有加下划线的氨基酸残基。加下划线的氨基酸残基识别肽序列中被氧化的氨基酸。被氧化的氨基酸对应于组氨酸(h)氧化或色氨酸(w)氧化。此图中还描绘每个肽序列右侧的行,显示氧化种类的丰度。行中的阴影表示使用在相应的列标题中识别的不同aex分离,在特定样品中的氧化残基的相对量的差异。例如,参看图11中的第二肽eiglltceatvnghlyk,当以水平方式读取时,在特定样品(“阿柏西普aex加载液”)中被氧化的此肽的相对总群体大致0.013%被氧化。当在同一行上进行时,阴影发生偏移,表明氧化种类的相对丰度发生改变。例如,使用此相同的肽序列,当遵循不同aex分离方案时,用于aex分离的氧化种类的相对丰度是0.006%至0.010%。因此,可理解,aex色谱降低氧化种类的丰度。[0756](b)使用aex来减少minitrap产生中的颜色形成[0757]进行aex色谱以去除在mt1的产生期间获得的着色,所述着色是在进行使用cdm1表达的全长阿柏西普的切割后获得。[0758]2.5设计[0759]如表2-4中所述,本研究进行4次aex分离。从mt1的过滤样品(“mt1过滤池”)获得aex加载液。将15.7mlcaptoq柱(床高20.0cm,1.0cmi.d.)、14.1mlporos50hq柱(床高18.0cm,1.0cmi.d.)和16.5mlqsepharoseff柱(床高21.0cm,1.0cmi.d.)整合至用于本实验的aktaavant台式液相色谱控制器中。[0760]使用2mtris碱或2m乙酸将aex加载液的ph值调节至目标±0.05个ph单位。使用5m氯化钠或去离子水将aex加载液的电导率调节至目标±0.1ms/cm。分析所有汇集样品的hmw、颜色和产率。[0761]表2-4.aex颜色减少研究的研究设计的概述[0762]aex分离树脂aex方案1captoq表2-62poros50hq表2-63qsepharoseff表2-64poros50hq表2-5[0763]表2-5.用于颜色减少研究的流通aex方案[0764][0765][0766]aex,阴离子交换色谱;cv,柱体积[0767]表2-6.用于颜色减少研究的结合和洗脱aex方案[0768][0769]aex,阴离子交换色谱;cv,柱体积[0770]2.6结果[0771]如对于aex分离1-4的流通液和洗涤液的着色(表2-7)所见,所有四次aex分离均导致颜色减少。虽然前三次aex分离是在结合和洗脱模式下评估(表2-6),但观察到大部分产物存在于加载和洗涤区(62%–94%)中。[0772]前三次分离评估用于captoq、poros50hq和qsepharoseff树脂的ph8.4和2.0ms/cm设定点。所有三次分离均具有良好的产率(》80%)。poros50hqaex池显示在aex池中的最低黄色(b*值为2.09),接着是qsepharoseffaex池(b*值为2.22)和captoqaex池(b*值为2.55)。[0773]表2-7.aex颜色减少研究的实验结果的概述[0774][0775]aex,阴离子交换色谱;hmw,高分子量种类。[0776]将级分调节至5g/l的蛋白质浓度以用于颜色测量。[0777]2.7结论[0778]如对于阿柏西普所见(参见以上部分2.3),发现使用aex可减少minitrap产生的黄棕色着色(表2-7)。参看表2-7,aex加载液具有4.17的b*值,但在经历aex色谱(aex分离1-4)时,b*值减小,表明黄棕色着色的减少。此外,随着b*值的减小,着色也随之减少。aex加载液(浓度为5g/l)的初始b*值可在约0.5至约25的范围内,更特别是在约1.0至约20.0的范围内,并且甚至更特别是在约1.5至约15.0的范围内。使用aex之后,流通液(浓度为5g/l)的b*值可在0.5至约10.0的范围内,更特别是在约0.5至约7.0的范围内,并且甚至更特别是在约0.5至约5.0的范围内。[0779]实施例3.氧化肽研究[0780]3.1肽作图[0781]样品制备。进行还原和烷化minitrap(mt1)和mt4(类似于mt1的minitrap,使用采用大豆水解物细胞培养产生的不同全长阿柏西普)样品的胰蛋白酶作图,以识别和量化翻译后修饰。将样品的等分试样使用在0.1mtris-hcl,ph7.5中的8.0m尿素变性,用dtt还原,接着用碘乙酰胺烷化。将经变性、还原和烷化的原料药首先在37℃下用重组lys-c(rlys-c)以1:100(w/w)的酶与底物比率消化30分钟,用0.1mtris-hclph7.5稀释,使得最终尿素浓度为1.8m,随后在37℃下用胰蛋白酶以1:20(w/w)的酶与底物比率消化2小时,接着在37℃下用pngasef以1:5(w/w)的酶底物比率去糖基化1小时。通过使用甲酸(fa)使ph值低于2.0来中止消化。[0782]lc-ms分析。将从每个样品得到的rlys-c/胰蛋白酶肽的20μg等分试样通过以下来分离和分析:使用watersacquityuplccshc18柱(1.7μm,2.1×150mm)进行反相超高效液相色谱(uplc),接着随线pda检测(在280nm、320nm和350nm的波长下)和质谱分析。流动相a是在水中的0.1%fa,而流动相b是在乙腈中的0.1%fa。样品注入后,梯度以在0.1%b下保持5分钟开始,接着在75分钟内线性增加至35%b,以实现最佳肽分离。在thermoscientificqexactivehybridquadrupole-orbitrap质谱仪上进行ms和ms/ms实验,所述质谱仪采用高能碰撞解离(hcd)进行用于ms/ms实验的肽片段化。肽身份分配是基于在全ms谱中的给定肽的经实验确定的精确质量以及在相应hcdms/ms谱中的b和y碎片离子。生成氧化肽和相应的天然肽的提取离子色谱图,并对峰面积积分,以计算mt1样品中一个或多个氧化氨基酸残基的位点特异性百分比。[0783]与增加的350nm吸光度有关的肽片段[0784]在比较mt1与mt4的胰蛋白酶肽图后,观察到mt1上的ptm(图12a显示从20.0至75分钟洗脱的肽的吸光度)。突出显示具有变化的uv峰的肽。色谱图的展开视图示于图12b中,所述图显示从16至30分钟洗脱的肽的吸光度。在mt1与mt4之间的uv吸光度具有强对比的肽是tnylth*r、iiw( 4)dsr和iiiw( 132)dsr(*或下划线表示残基的氧化)。此外,色谱图的展开视图示于图12c中,所述图显示从30至75分钟洗脱的肽的吸光度。在mt1与mt4之间的uv吸光度具有强对比的肽是dkth*tc*ppc*papellg(seqidno.:17)、telnvgidfnweypsskh*qhk(seqidno.:20)、eiglltceatvngh*lyk(seqidno.:18)和qtntiidvvlspsh*gielsvgek(seqidno.:19)(*表示残基的氧化)。肽作图揭示了在vegfminitrap之间的丰度显著不同的肽的身份。由肽作图分析识别的肽的相对丰度示于表3-1中。mt1(在cdm中产生)中的2-氧代-组氨酸的量高于mt4(在大豆水解物中产生),表明用于表达阿柏西普的培养基可对具有氧化组氨酸或氧化色氨酸的肽的相对丰度具有显著影响。例如,对于肽qtntiidvvlspsh*gielsvgek(seqidno.:19),所述肽在mt1(在cdm中产生)中的相对丰度百分比为0.015%,与肽在mt4(在大豆水解物中产生;其比mt1小约15倍)中的相对丰度百分比形成对比。[0785]表3-1.[0786][0787]颜色和2-氧代-组氨酸的定量。还显示了如通过蛋白酶消化所产生的寡肽中的2-氧代-组氨酸的百分比,如通过质谱法所测量(表3-2)。(将值针对未经修饰的肽进行归一化。)表3-2(i)显示针对以下所观察到的氧化组氨酸/色氨酸的百分比:mt1批次1的aex流通液、mt1批次2的aex流通液和mt1批次3的aex流通液。表3-2(ii)显示针对以下所观察到的氧化组氨酸/色氨酸的百分比:酸性级分1、酸性级分2和针对mt1批次3进行cex分离所获得的主要级分。根据此表中可清楚地看出,酸性变体包含氧化种类。从表3-2(i)中可明显看出,构成肽/蛋白质的2-氧代-组氨酸和色氨酸二氧化的百分比与aex汽提液相比在aex流通液中是降低的。显然,汽提aex柱可富集此类经修饰的肽的百分比。例如,经修饰的肽“eiglltc[ 57]eatvngh[ 14]lyk(seqidno.:18)”的百分比在aex流通液(mt1批次1)中为0.013%,而在“aex汽提液”中为0.080%。由此还证实aex柱捕获经修饰的肽,从而降低aex流通液中经修饰的肽的百分比。[0788]表3-2(i).2-氧代-组氨酸/色氨酸的百分比[0789][0790]表3-2(ii).2-氧代-组氨酸/色氨酸的百分比[0791][0792]在表3-2(ii)中,[ 57]表示通过碘乙酰胺使半胱氨酸烷化将在半胱氨酸上添加羧甲基胺部分,其净质量与未经修饰的半胱氨酸相比增加了约 57:[0793][0794]在表3-2(ii)中,[ 14]表示由his转化为2-氧代-his,一个氧原子添加在碳2上,但失去两个氢原子(一个来自碳2,另一个来自氮3),其净质量与未经修饰的组氨酸相比增加了约 14。[0795][0796]在表3-2(ii)中,[ 32]表示色氨酸二氧化导致形成n-甲酰犬尿氨酸,其净质量与未经修饰的色氨酸相比增加了约 32(图4)。[0797]进行第二组实验以评估通过aex色谱处理的经蛋白酶消化的fabricator切割的阿柏西普(mt4)的寡肽中2-氧代-组氨酸(和色氨酸二氧化)的百分比(以下图13和表3-3)。在经蛋白酶消化的fabricator切割的阿柏西普(mt4)的寡肽的aex汽提液中2-氧代-组氨酸和色氨酸二氧化的百分比显著高于aex流通液中2-氧代-组氨酸和色氨酸二氧化的百分比(参看下表3-3中的“mt1”)。[0798]表3-3.2-氧代-组氨酸的百分比[0799][0800]a使用全长阿柏西普的不同肽计算的值,因为c末端肽与minitrap不同。[0801]在mt1产生期间,aex汽提液中2-氧代-组氨酸和色氨酸二氧化的百分比显著高于aex流通液中2-氧代-组氨酸和色氨酸二氧化的百分比(参看上表3-3中的“mt1”)。与表3-2相比,表3-3显示相似的结果:汽提aex柱所产生的样品中的2-氧代-组氨酸和色氨酸二氧化百分比显著高于aex流通液中2-氧代-组氨酸和色氨酸二氧化百分比,表明在分离期间2-氧代-组氨酸和色氨酸二氧化种类与aex柱结合,并在汽提aex柱后去除。这在提取离子色谱图中更明显,如图14中所见。[0802]强阳离子交换色谱(cex)[0803]为了识别包含抗vegf蛋白的样品中存在的酸性种类和其他变体,进行了一系列实验。[0804]使用monos(10/100)gl柱(gelifesciences,marlborough,ma)进行强阳离子交换色谱。对于样品分离,所用流动相是20mm2-(n-吗啉基)乙磺酸(mes)ph5.7(流动相a)和40mm磷酸钠、100mm氯化钠ph9.0(流动相b)。将非线性ph梯度用于洗脱mt1的电荷变体,在280nm处检测。在相对保留时间早于主峰洗脱的峰在本文中称为酸性种类。[0805]在任何富集之前,来自mt1批次2(≤by3)的样品都使用如图15中所示的方法进行cex。为了降低mt1变体的复杂性,对样品进行去唾液酸化处理。接着进行制备型sec处理(superdex200制备级xk26/100),使用1xdpbsph7.2±0.2作为流动相。将获自包含去唾液酸化minitrap(dsmt1)的制备型sec柱的级分合并,并进一步进行强阳离子交换(scx)色谱,以便使用双重盐-ph梯度富集mt1的电荷变体。程序产生总共7个级分(f1-f7;mc表示方法对照,图16和图17)。[0806]进行cex时,酸性种类的洗脱时间早于主峰,而碱性种类的洗脱时间晚于主峰。如图17中所观察,峰3-5是主峰。在洗脱mt1的主要种类(峰3-5)之前,洗脱出峰1和2,并且因此包含酸性种类。在洗脱mt1的主要种类(峰3-5)之后,洗脱出峰6,并且因此包含碱性种类。表3-4显示在mc中的峰的相对丰度(如图16中所识别)。例如,表3-4的第二行(标记为mc)显示mc中酸性种类的总相对量为约19.8%(即峰1 峰2)。表3-4还显示每个单独级分的峰的相对丰度。尽管在不同级分中有重叠种类(如图16和图17所反映),但级分f1和f2的大部分为酸性种类(即峰1和峰2)。例如,级分f1包含63.7%峰1和19.2%峰2(总共82.9%的酸性种类)。级分f2包含9.6%峰1和75.9%峰2(总共85.5%的酸性种类)。级分f3-f5的大部分为mt1的主要种类(峰3-5)。最后,级分f6-f7的大部分为碱性种类(峰6),但确实包括一些部分的主要种类(例如峰4和峰5)。[0807]还观察到,级分f1和f2(包含酸性种类)与级分f3-f5(包含主要种类或“mt1”)相比具有强烈的黄棕色着色。在浓度≥13mg/ml下检查所有级分的颜色。从此实施例中明显看出,样品中酸性种类的存在以黄棕色着色的出现来追踪,所述着色的去除(或最小化)可通过从mt1中去除(或最少化)酸性种类来实现。[0808]表3-4.基于分析cex的峰的相对丰度[0809][0810]nd:未检测到[0811]mt1批次2和级分f1-f7的3d色谱图示于图18a-h中。mt1批次2未展现任何显著的光谱特征(图18a)。级分1和2(包含酸性种类)展现介于320-360nm之间的光谱特征(参见图18b中的圆圈)。与级分2相比,此特征在级分1中更为突出(图18b和图18c),而在级分3和级分4-7(主要种类,mt1)中则不存在(图18d和图18h),此类级分未展现黄棕色着色。[0812]因此,如上文所观察,cex实现酸性种类/酸性级分(级分1和2)的识别,它们与主要种类/级分(级分3-6)相比显示强烈的黄棕色着色。此结果也以级分f1-f2的3d色谱图中存在而级分f3-f7中不存在的独特光谱特征的形式观察到。[0813]成像毛细管等电聚焦(icief)电泳图[0814]通过icief进一步评价级分f1-7和mc(来自cex后的mt1-批次2)中的变体分布(图19)。[0815]级分f1-7和mc(来自cex后的mt1-批次2)的变体分布是使用具有用碳氟化合物涂覆的毛细管筒(100μmx5cm)的ice3分析仪(proteinsimple)通过icief来进一步评价。两性电解质溶液由以下各物于纯净水中的混合物组成:0.35%甲基纤维素(mc)、0.75%pharmalyte3-10载剂两性电解质、4.2%pharmalyte8-10.5载剂两性电解质以及0.2%pi标志物7.40和0.15%pi标志物9.77。阳极电解液是80mm磷酸,而阴极电解液是100mm氢氧化钠,均在0.10%甲基纤维素中。将样品在纯净水中稀释,并以1:200(每毫克mt1的唾液酸酶a的单位数)的酶与底物比率将唾液酸酶a添加至每个经稀释的样品中,接着在环境温度下温育大约16小时。将经唾液酸酶a处理的样品与两性电解质溶液混合,接着通过引入1500v的电位持续1分钟,随后引入3000v的电位持续7分钟来聚焦。经聚焦的mt1变体的图像是通过使280nm紫外光通过毛细管并进入电荷耦合装置数字相机的镜头中而获得。接着分析此图像以确定各种电荷变体的分布。(图19)。参看图19,级分f1和f2(或酸性级分)显示不存在mt1的峰,所述峰在mc和级分f3-f7(主要种类,mt1)中清楚地观察到。因此,认为icief电泳图能够检测和确定所考虑的蛋白质(在这种情况下是mt1)的不同电荷变体的分布。因此,很明显,进行cex分析时,酸性级分显示(a)2-氧代-组氨酸或二氧代-色氨酸的相对丰度百分比的增加(表3-2(ii));(b)黄棕色着色的增加(数据未显示);和(c)如级分1和2的3d色谱图中所见的光谱特征的存在(图18b和图18c)。[0816]实施例4.光诱导研究[0817]在此实施例中,通过使蛋白质样品暴露于变化量的冷白(cw)荧光或紫外线a(uva)光来进行vegfminitrap(mt)(例如mt1)的光诱导。测定光暴露的样品的颜色和氧化氨基酸含量。如上所述,在暴露后进行lcms分析。mt暴露于冷白光或uva光将造成氧化氨基酸残基(例如组氨酸)的增加(表4-1、表4-2和表4-3)。[0818]表4-1.光诱导研究设计[0819][0820]ich是指ich协调三方指南(ichharmonisedtripartiteguideline):稳定性测试:新原料药和产品q1b的光稳定性测试(photostabilitytestingofnewdrugsubstancesandproductsq1b),其中规定在不小于120万lux*小时冷白荧光和近紫外线能量不小于200w*hr/m2下进行光稳定性研究。[0821]表4-2描绘暴露于冷白光和紫外光的mt样品的着色的增加。例如,样品(t=0)的b值为9.58。此样品在暴露于240万lux*hr下的冷白光时,b值增加至22.14。b值的此增加表明使mt暴露于240万lux*hr下的冷白光与样品(t=0)相比,增加样品的黄棕色着色。类似地,在mt样品(t=0)暴露于400w*h/m2下的紫外光时,b值从9.58增至10.72。b值的此增加表明,与样品(t=0)相比,使mt样品暴露于400w*h/m2下的紫外光增加样品的黄棕色着色。[0822]表4-2.暴露于冷白光和紫外光的样品的着色[0823][0824]样品颜色是使用cielab颜色空间(l*、a*和b*变量)并相对于epby颜色标准表示;l*=白色至黑色(l*是明度);a*=洋红色至浅绿色;b*=黄色至蓝色,b值越高,黄色越强。[0825]表4-3(i).来自经紫外光应力处理的minitrap的肽中的2-氧代-his水平[0826][0827][0828]表4-3(ii).来自经冷白光应力处理的minitrap的肽中的2-氧代-his水平[0829][0830]阿柏西普mt暴露于冷白光或uva光是以氧化组氨酸(2-氧代-his)的出现来追踪(表4-3)。参看表4-3,在mt样品(t=0)中具有氧代-组氨酸的肽“sdtgrpfvemyseipeiihmtegr(seqidno.:22)”为0.007%,而在紫外光下暴露40小时时,其丰度增加至0.324%(表4-3(i)),而在冷白光下暴露300小时时,其丰度增加至1.309%(表4-3(ii))。[0831]观察到2-氧代-组氨酸的两种种类,即13.98da种类(如图2所示)和15.99da种类(如图3所示),其中13.98da种类在经光应力处理的minitrap样品中占优势。已知15.99da种类是铜金属催化过程的产物。j.pharm.biomedanal.,21:1093-1097(2000)。此外,13.98da种类是光驱动过程的产物。liu等人,anal.chem.86(10:4940-4948(2014))。[0832]类似于暴露于冷白光和uva光的样品中的氧化组氨酸的丰度增加,使mt暴露于冷白光或uva光还诱导其他ptm的形成(表4-4和表4-5)。[0833]表4-4(i).在来自经紫外光应力处理的minitrap的肽中的其他ptm[0834][0835]表4-4(ii).来自经冷白光应力处理的minitrap的肽中的其他ptm[0836][0837]表4-5(i).来自经紫外光应力处理的minitrap的肽中的色氨酸/酪氨酸/苯丙氨酸的氧化水平[0838][0839][0840]表4-5(ii).来自经冷白光应力处理的minitrap的肽中的色氨酸/酪氨酸/苯丙氨酸的氧化水平[0841][0842]因此,mt暴露于冷白光或uva光是以氧化残基(例如组氨酸/色氨酸(氧代-trp))的出现来追踪。观察到氧代-trp的四种种类: 4da、 16da、 32da和 48da。 4da种类是由犬尿氨酸的形成来解释(图4),而16da、 32da和 48da是色氨酸残基的单氧化、二氧化和三氧化。在320nm处监测的mt样品的胰蛋白酶消化物的肽作图如图20中所示。可在图20中比较构成肽的氧化残基的相对存在。例如,对于肽iiw( 4)dsrk来说,可看出对于t=0的mt样品、和暴露于uva40小时的mt1样品以及暴露于cwl300小时的mt样品,其存在具有显著差异。[0843]还评估了mt在暴露于冷白光或uva光下,hmw/低分子量(lmw)种类的存在(表4-6)。[0844]表4-6.在延长的uva和cwl应力处理之后产生hmw/lmw种类[0845][0846]为了追踪关于每个样品的hmw/lmw种类的着色,如上所示对所有应力处理的样品(cwl和uva)执行具有全谱pda检测的分析型尺寸排阻色谱(sec-pda)。sec-pda对经cwl应力处理的mt的分析揭示,除了lmw种类外的所有尺寸变体在~350nm处的吸光度的显著增加(图21),而对经uva应力处理的mt的sec-pda则未揭示出在~350nm处的吸光度增加(图22)。与cwl应力处理的样品不同,经uva应力处理的样品不产生任何显著可量化的黄棕色。[0847]在研究经uva和cwl应力处理的样品在320nm与280nm处的吸光度比之后,获得相似的结果。通过原始强度或总峰面积分析的a320/a280比率在经cwl应力处理的样品中以黄色强度的增加来追踪(图23),而a320/a280比率在经uva应力处理的样品中不以黄色强度的增加来追踪(图24)。这证实了先前的观察结果,即经uva应力处理的mt1样品在cwl应力处理后观察不到相同的黄棕色。[0848]实施例5.减少着色的上游方法[0849]5.1化学成分确定的培养基的温育研究[0850]考察掺入包含阿柏西普的新鲜的化学成分确定的培养基(cdm)中的各种成分对于着色的影响。[0851]将一个或多个具有10ml工作体积(新鲜cdm1)的50ml加透气盖(vent-capped)的振荡管温育7天,分别在第0天和第7天取样。将阿柏西普样品(在缓冲水溶液ph6.2中的阿柏西普重组蛋白,所述缓冲水溶液包含5mm磷酸钠、5mm柠檬酸钠和100mm氯化钠)以6g/l的浓度掺入振荡管中。[0852]添加组分以达到如下累积浓度:[0853]·半胱氨酸:16.6mm[0854]·铁:0.23mm[0855]·铜:0.0071mm[0856]·锌:0.54mm[0857]所添加的每种成分对b*值(ciel*,a*,b*颜色空间)的按比例效应在图25a中列出,并且实际b*值针对预测b*值的绘图在图25b中列出。半胱氨酸的添加导致最大的黄棕色增加。铁和锌还产生颜色。叶酸和b族维生素(包括硫胺素、烟碱酰胺、d-泛酸、d-生物素和吡哆醇)增加黄棕色。核黄素和维生素b12在统计学上没有影响颜色。[0858]5.2减少半胱氨酸和金属对b*值的影响[0859]由产阿柏西普的细胞系的种菌培养物接种生物反应器(例如2l)。使经接种的培养物在35.5℃的温度、ph7.1±0.25和22ccm的空气喷射设定点下生长。根据需要向生物反应器中补充葡萄糖、消泡剂和基础进料。在cdm1中评估表达阿柏西普时降低半胱氨酸和金属的浓度对颜色的影响。[0860]第0天的培养基=cdm1,包括1.48mm的半胱氨酸[0861]·营养进料:[0862]ο第2天=化学成分确定的进料(cdf) 1.3-2.1mm半胱氨酸[0863]ο第4天=cdf 1.6-1.7mm半胱氨酸[0864]ο第6天=cdf 1.6-1.7mm半胱氨酸[0865]ο第8天=cdf 1.6-1.7mm半胱氨酸[0866]生物反应器的条件如下:[0867]·以每l培养物约6-7毫摩尔、每l培养物8-9毫摩尔或每l培养物10-11毫摩尔的累积浓度添加半胱氨酸。[0868]·下面列出cdm1(0.5x、1x或1.5xcdm1水平)中1x水平的金属(其中浓度为接种物添加之前的浓度):[0869]οfe=每升培养物68-83微摩尔[0870]οzn=每升培养物6-7微摩尔[0871]οcu=每升培养物0.1-0.2微摩尔[0872]οni=每升培养物0.5-1微摩尔[0873]累积半胱氨酸水平降至6-7毫摩尔/l会减少黄棕色,其中对效价无明显影响。培养基中的金属浓度降至0.5x会减少颜色,其中效价有显著提高。对效价、vcc(活细胞浓度)、生存力、氨或重量渗透压摩尔浓度的影响最小(参见图26a-e)。金属含量和半胱氨酸对b*值和效价的预测的按比例效应在图27中列出。[0874]5.3抗氧化剂对b*值的影响的评估[0875]评估掺入包含阿柏西普的废cdm中的抗氧化剂、牛磺酸、次牛磺酸、硫辛酸、谷胱甘肽、甘氨酸和维生素c对颜色的影响。将一个或多个具有10ml工作体积(cdm1)的50ml加透气盖的振荡管温育7天,在第0天和第7天取样。[0876]向废cdm1中添加组分的条件如下:[0877]·阿柏西普样品(在缓冲水溶液ph6.2中的阿柏西普重组蛋白,其包含5mm磷酸钠、5mm柠檬酸钠和100mm氯化钠)以6g/l的浓度掺入振荡管中[0878]·以下列浓度添加至废cdm1中的抗氧化剂:[0879]ο牛磺酸=10mm的培养物[0880]ο次牛磺酸=10mm的培养物[0881]ο甘氨酸=10mm的培养物[0882]ο硫辛酸=0.0024mm的培养物[0883]ο还原谷胱甘肽=2mm的培养物[0884]ο氢皮质酮=0.0014mm的培养物[0885]ο维生素c(抗坏血酸)=0.028mm的培养物[0886]多重抗氧化剂减少废培养基中的颜色形成:次牛磺酸、牛磺酸和甘氨酸的组合;硫辛酸;以及维生素c。谷胱甘肽增加b*值。[0887]表5-1.抗氧化剂对minitrap的颜色形成的影响的概述[0888]条件b*值第0天的废培养基0.37第7天的废培养基对照1.47第7天的废培养基 抗氧化剂*1.02[0889]*显著减小b*值的抗氧化剂:次牛磺酸/牛磺酸/甘氨酸、硫辛酸、维生素c。[0890]各种抗氧化剂对b*值(ciel*,a*,b*颜色空间)的预测效应的概述在图28(a-c)中列出。[0891]评估掺入包含阿柏西普的废cdm中的抗氧化剂时进一步添加对颜色的影响。将一个或多个具有10ml工作体积(cdm1)的50ml加透气盖的振荡管温育7天,在第0天和第7天取样。[0892]向废cdm1中添加组分的条件如下:[0893]·阿柏西普样品(在缓冲水溶液ph6.2中的阿柏西普重组蛋白,所述缓冲水溶液包含5mm磷酸钠、5mm柠檬酸钠和100mm氯化钠)以6g/l的浓度掺入振荡管中[0894]·运行两个doe实验:[0895]·(i)抗氧化剂以下列浓度添加至废cdm1中:[0896]ο牛磺酸=10mm的培养物[0897]ο次牛磺酸=10mm的培养物[0898]ο甘氨酸=10mm的培养物[0899]ο硫辛酸=0.0024mm的培养物[0900]ο维生素c(抗坏血酸)=0.028mm的培养物[0901]·(ii)添加抗氧化剂以达到以下累积浓度:[0902]οata=2.5μm–5μm[0903]ο甲磺酸去铁胺(dfo)=5μm–10μm[0904]ο过氧化氢酶=101.5mg/l[0905]οs-羧甲基-l-半胱氨酸=10mm[0906]发现次牛磺酸减少废培养基中的颜色形成(图28d)。dfo还显著减少废培养基中的颜色形成(图28d)。其他抗氧化剂对颜色形成没有统计学上的影响。[0907]表5-2.抗氧化剂对minitrap的颜色形成的影响的概述[0908]条件b*值第0天的废培养基0.44第7天的废培养基对照1.73第7天的废培养基 次牛磺酸1.32第7天的废培养基 dfo0.92[0909]振荡瓶抗氧化剂研究:[0910]对牛磺酸、次牛磺酸、甘氨酸、硫辛酸和维生素c关于减少细胞培养物中颜色形成的能力进行单独和组合评估(表5-3)。[0911]由产阿柏西普的细胞系的种菌培养物接种250ml振荡瓶。使经接种的细胞在35.5℃下在5%co2控制下的温育箱中生长。根据需要向振荡瓶中补充葡萄糖和基础进料。使用上述工艺,其中金属在cdm1中以0.5x浓度存在,并且半胱氨酸以6-7mm的累积浓度添加。[0912]表5-3.[0913][0914]图28e显示表5-3中的抗氧化剂对b*值(ciel*,a*,b*颜色空间)和最终效价的预测效应。牛磺酸、次牛磺酸、甘氨酸显著减小b*值,而不会对效价产生负面影响。[0915]实施例6.使用cdm产生阿柏西普的糖基化和生存力研究[0916]由产阿柏西普的细胞系的种菌培养物接种生物反应器(例如2l)。使经接种的培养物在35.5℃的温度、ph7.1±0.25和22ccm的空气喷射设定点下生长。根据需要向生物反应器中补充葡萄糖、消泡剂和基础进料。阿柏西普蛋白的产生是使用cdm1(专有)进行。表达阿柏西普融合蛋白的宿主细胞系的产生是使用cdm1(专有)、cdm2(商购获得)和cdm3(商购获得)进行。使用cdm1、2和3进行一组实验,其中没有额外的培养基组分。使用cdm1-3(将锰(四水合氯化锰,sigma,3.2mg/l)、半乳糖(sigma,8g/l)和尿苷(sigma,6g/l)添加至进料中以修饰半乳糖基化谱)进行另一组实验。最后,使用cdm1-3(将锰(四水合氯化锰,sigma,3.2mg/l)、半乳糖(sigma,8g/l)和尿苷(sigma,6g/l)添加至进料中以修饰半乳糖基化谱,并将地塞米松(sigma,12mg/l)添加至进料中以修饰组合物的唾液酸化谱)进行一组实验。通过离心,接着0.45μm过滤,即可制备出使用每种cdm的澄清收获物。[0917]在n-聚糖分析之前,用蛋白a处理样品。[0918]效价测量[0919]在整个这些实施例中,除非另有说明,否则每天使用agilent(santaclara,ca)1200系列hplc或等效物测量阿柏西普效价,其中在低ph值和逐步洗脱梯度下操作,在280nm处检测。相对于参考标准校准曲线指定浓度。[0920]活细胞密度(vcd)和细胞生存力值[0921]在整个这些实施例中,除非另有说明,否则通过novabioprofileflex自动细胞计数器(novabiomedical,waltham,ma)经由台盼蓝排除法测量活细胞密度(vcd)和细胞生存力值。葡萄糖、乳酸盐、脱机ph、溶解氧(do)、pco2测量值和重量渗透压摩尔浓度是用novabioprofileflex(novabiomedical,waltham,ma)测量。[0922]n-聚糖寡糖谱分析[0923]根据watersglycoworks方案,使用glycoworks快速去糖基化和glycoworksrapifluor-mslabel试剂盒(分别为waters零件号186008939和186008091),制备大约15μg来自cdm1-3收获物的经蛋白a处理的样品以用于n-聚糖分析。通过在50.5℃下用pngase-f处理样品5分钟,接着在25℃下冷却5分钟,从阿柏西普蛋白中去除n-聚糖。经由在室温下反应5分钟,用rapifluor-ms荧光染料标记释放的聚糖。通过向反应混合物中添加乙腈使蛋白质沉淀,并通过在2,204xg下离心10分钟沉淀至孔底。收集包含经标记的聚糖的上清液,并在uplc上使用具有柱后荧光检测的亲水相互作用液相色谱(watersbehamide柱)进行分析。在结合至柱后,分离经标记的聚糖,并使用由乙腈和50mm甲酸铵水溶液(ph4.4)构成的二元流动相梯度来洗脱。使用荧光检测器检测经标记的聚糖,所述荧光检测器的激发波长为265nm并且发射波长为425nm。使用所得色谱图中n-聚糖峰的相对面积百分比,将n-聚糖分布报告为符合以下条件的n-聚糖的总百分比:(1)含有核心岩藻糖残基(总岩藻糖基化,表6-1),(2)含有至少一个唾液酸残基(总唾液酸化,表6-2),(3)识别为甘露糖-5(甘露糖-5,表6-3),(4)含有至少一个半乳糖残基(总半乳糖基化,表6-4)和(5)具有已知身份(总识别峰,表6-5)。[0924]结果[0925]对于cdm1-3(有或无额外组分),活细胞计数(vcc)、生存力和收获物效价的结果示于图29-31中。[0926]在这九种培养物中,包含尿苷、锰和半乳糖的cdm1培养物在12天时显示最高效价(5.5g/l)。无额外组分的cdm1在12天时与其他七种培养物相比也显示高效价(约4.25g/l)(图29)。[0927]直至处理第6天,在各种条件下的细胞生存力结果均相似。在处理第7天后,有或无额外培养基组分的cdm2和cdm3培养物均显示大于约90%生存力(图30)。[0928]具有尿苷、锰和半乳糖的cdm1培养物在第6天左右显示最高vcc(图31)。[0929]培养物和补充剂对总体n-聚糖分布有重要影响(表6-1至6-5)。使用由大豆水解物制成的经蛋白a处理的阿柏西普(评估两个样品)比较聚糖水平。表6-5中列出总识别峰。[0930]表6-1.总岩藻糖基化(%)[0931][0932]u是尿苷,m是锰,g是半乳糖,dex是地塞米松[0933]表6-2.总唾液酸化(%)[0934][0935]u是尿苷,m是锰,g是半乳糖,dex是地塞米松[0936]表6-3.甘露糖-5(%)[0937][0938][0939]u是尿苷,m是锰,g是半乳糖,dex是地塞米松[0940]表6-4.总半乳糖基化(%)[0941][0942]u是尿苷,m是锰,g是半乳糖,dex是地塞米松[0943]表6-5.总识别峰(%)[0944][0945]u是尿苷,m是锰,g是半乳糖,dex是地塞米松[0946]在各种cdm的培养物中,在第12天观察到的总岩藻糖基化、总唾液酸化、总半乳糖基化和甘露糖-5分别为42.61%至46.26%、30.84%至39.14%、59.02%至66%和8.86%至13.38%。这些糖基化值不同于使用大豆水解物获得的糖基化值。[0947]最后,对澄清收获物进行颜色测量,所述收获物是由在补充有尿苷、锰和半乳糖的cdm1、cdm2和cdm3中表达阿柏西普的细胞获得。生物反应器研究步骤的操作参数将是本领域普通技术人员所知。[0948]实施例7.抗vegf蛋白的亲和产生[0949]7.1vegfminitrap的表达[0950]将重组vegfminitrap(例如,mt5,seqidno.:46)的编码区与信号序列可操作地连接,克隆到哺乳动物表达载体中,并转染到中国仓鼠卵巢(cho-k1)细胞中;在用400μg/ml潮霉素选择12天之后分离经稳定转染的池。将在化学成分确定的不含蛋白质的培养基中生长的稳定cho细胞池用于产生蛋白质以进行测试。重组多肽从细胞分泌至生长培养基中。[0951]vegfminitrap的组成结构域序列[0952]·人类flt1(登录号np_001153392.1)[0953]·人类flk1(登录号np_002244.1)[0954]·人类fc(ighg1,登录号p01857-1)[0955]具有(mt5)的重组vegfminitrap是获自此工艺并进一步处理。[0956]7.2亲和色谱柱的制备[0957]评估能够与vegfminitrap(mt5)结合的五种不同蛋白质。所用蛋白质包括vegf165(seqidno.:72)、mab1(小鼠抗vegfr1mab人类igg1,其中seqidno.:73是重链,而seqidno.:74是轻链);mab2(小鼠抗vegfr1mab人类igg1,其中seqidno.:75是重链,而seqidno.:76是轻链);mab3(小鼠抗vegf-r1mab小鼠igg1,其中seqidno.:77是重链,而seqidno.:78是轻链)和mab4(小鼠抗vegfr1mab小鼠igg1,其中seqidno.:79是重链,而seqidno.:80是轻链)。[0958]通过用6个柱体积(cv)的1mm冰冷的盐酸以不超过1ml/min的流率洗涤柱来激活柱。将10mg每种蛋白质加载至三个hitrapnhs激活的hp亲和柱(1ml,gehealthcare,目录号17-0716-01)上,并封闭柱以允许偶联在室温下进行30分钟。用18个柱体积的0.5m乙酸钠、0.5mnaclph4.0洗涤柱,并用18个柱体积的0.5mtris-hcl、0.5mnaclph8.3封闭开放位点(按以下顺序进行洗涤:6个柱体积的0.5mtris-hcl、0.5mnaclph8.3;6个柱体积的0.5m乙酸钠(乙酸钠:jtbaker,目录号3470-01)、0.5mnaclph4.0;6个柱体积的0.5mtrisph8.3;在室温下温育柱30分钟;6个柱体积的0.5m乙酸钠缓冲液、0.5mnaclph4.0;6个柱体积的0.5mtris-hcl、0.5naclph8.3;以及6个柱体积的0.5m乙酸钠缓冲液、0.5mnaclph4.0)。将柱储存在dpbsph7.5中。所评估的五个柱分别指定为柱1(包含vegf165)、柱2(包含mab1)、柱3(包含mab2)、柱4(包含mab3)和柱5(包含mab4)。[0959]7.3使用亲和色谱产生minitrap[0960]样品制备。对minitrap执行两种不同产生工艺。在一种情况下,使用每个亲和柱产生包含minitrap样品的材料,其中将母体材料(minitrap)在1xdpbs缓冲液中稀释至20mg/ml并将其施加于柱上,并在室温下温育30分钟。使用亲和柱,从~7000ppm的hcp中分离minitrap。[0961]或者,使用在上清液中包含0.4mg/ml蛋白质的收获的培养物上清液,并且单独加载至不同亲和柱(1-5)上。不再进行稀释。接着将亲和柱用9cv的1xdpbs缓冲液洗涤,接着用igg洗脱缓冲液ph2.8(thermo,目录号21009)洗脱。[0962]然后,将如上所述获得的minitrap材料经由0.45μm过滤器过滤或离心,之后加载至如以上部分7.2中所述制备的柱上。将25ml包含约0.4mg/ml蛋白质的加载溶液加载至每个柱上并温育20分钟。用9cv的dpbs(invitrogen,目录号14190-144)洗涤每个柱,之后洗脱以进行平衡。洗涤级分中的mt5的量示于表7-1中。洗涤后使用6cv的ph2.8(商用洗脱缓冲液(thermo,目录号21009))和100mm甘氨酸缓冲液ph2.5来洗脱,并通过添加1mtrisph7.5(invitrogen,目录号15567-027)迅速中和各级分。洗脱级分中的minitrap的量也示于表7-1中。[0963]从所有五个亲和柱成功产生minitrap(mt5)。与mab1和mab2柱相比,使用vegf165的柱的产率更高。包含人源化抗vegfr1mab的mab3和mab4也显示mt5的成功产生,其产率与mab1和mab2相似。在表7-1中,基于100%缀合效率和亲和捕获蛋白与mt5的1:1摩尔比来计算预期产率。[0964]表7-1.[0965][0966]7.4柱稳定性研究[0967]按照部分7.3中论述的方法,使用柱1和2进行多次运行(针对柱1的表7-2和针对柱2的表7-3)。[0968]表7-2[0969][0970]表7-3[0971][0972]将柱在4℃下储存约5周。从每次产生中洗脱出相似量的mt5,表明柱具有良好稳定性。[0973]7.5所产生的vegfminitrap的稳定性研究[0974]对来自三个柱(柱1、柱2和柱3)的洗脱级分执行sds-page分析。在非还原和还原sds-page样品缓冲液中制备样品,并使用1xmes(目录号np0322,invitrogen,carlsbad,ca)在4-12%梯度的nupagebis-tris凝胶上运行。[0975]向孔中加载:(1)分子量标准物,(2)加载溶液,(3)来自柱1的柱洗涤液,(4)来自柱2的洗脱级分,(5)来自柱1的洗脱级分,(6)来自柱3的洗脱级分,(7)在ph2.8下储存1分钟的mt5,(8)在ph2.8下储存30分钟的mt5,以及(9)分子量标准物(图33和图34)。分析表明,从所有三个亲和柱(柱1-3)的洗脱级分中获得的级分显示出相似的尺寸分布,并且亲和柱的使用不会使minitrap不稳定。[0976]7.6宿主细胞蛋白水平的计算[0977]使用chohcpelisa试剂盒,3g(f550)(cygustechnologies)获得宿主细胞蛋白浓度的标准曲线(图32和表7-4)。使用如图32所示的标准曲线和表7-4中列出的曲线公式计算加载溶液和洗脱级分中的hcp的量。[0978]表7-4.[0979][0980]使用标准曲线计算总hcp,并且具有宿主细胞蛋白的总量的图表在图35a中示出。图35b也显示与来自柱1、2、4和5的洗涤液和洗脱级分相比,加载液中的宿主细胞蛋白的总量。使用柱进行多次运行并且图35b中的(#)表示评估级分的运行。[0981]使用能够结合至minitrap的蛋白质进行的亲和捕获显示hcp从约7000ppm有效降至约25-50ppm。如针对产率所观察到的,具有vegf165的柱显示来自hcp的minitrap纯度高于mab1和mab2柱所示的。[0982]7.7在亲和产生之前和之后的vegfminitrap的sec谱图[0983]将来自三个柱(柱1-3)的洗脱级分的sec谱图与加载溶液中minitrap的sec谱图相比较。如图36和表7-5中所见,在亲和产生之前或之后的mt5的sec谱图高度相似。[0984]表7-5.[0985][0986][0987]7.8vegfminitrap柱前和柱后样品与mab1、mab2和vegf165结合的动力学[0988]使用biacoret200仪器进行动力学研究。[0989]使用biacoret200仪器,使用实时表面等离子体共振生物传感器测定vegf165与来自柱1和2的洗脱液和加载溶液中的minitrap结合的平衡解离常数(kd值)。所有结合研究均在25℃下在10mmhepes、150mmnacl、3mmedta和0.05%v/v表面活性剂tween-20ph7.4(hbs-et)运行缓冲液中进行。首先通过与mab1偶联的胺衍生化biacore传感器表面,以捕获mt5。结合研究的草图表示在图37中示出。[0990]简而言之,将来自柱的洗脱液和加载溶液稀释至hbs-ep(biacore)缓冲液中,并以~70ru的捕获水平跨固定化蛋白质基质注入。接着以50μl/min的流率注入vegf165。将等价浓度的分析物同时注入未经处理的参考表面上,以充当空白传感图,用于减去总体折射率背景。在各周期之间,经由以25μl/min两次5-min注入10mm甘氨酸来使传感器芯片表面再生。接着使用bia评估4.0.1软件评估所得的实验结合传感图,以确定动力学速率参数。将每个样品的数据集拟合至1:1朗缪尔模型(langmuirmodel)。对于这些研究,在globalfitanalysis方案下分析结合和解离数据,同时选择局部拟合最大分析物结合能力(ru)或rmax属性。在这种情况下,软件计算单个解离常数(kd)、缔合常数(ka)和亲和常数(kd)。平衡解离常数是kd=kd/ka。通过使用在0.03-2nm范围内的不同vegf165浓度来确定动力学结合速率、动力学解离速率和总亲和力(表7-6)。根据动力学速率常数将解离半衰期(t1/2)计算为:t1/2=ln(2)/60*kd。表7-6中显示在25℃下亲和色谱生产之前和之后获得的mt5与vegf165的结合动力学参数。[0991]将由亲和色谱产生的mt5的亲和力(kd)、结合速率(ka,m-1s-1)和解离速率(kd)与加载溶液比较,以评价亲和色谱步骤的效果,显示来自不同样品的mt5的动力学没有变化。vegfminitrap构建体的spr传感图示于图38中。[0992]表7-6.[0993][0994]7.9多个生产周期[0995]如7.3所示,使用柱1(hvegf165)和柱2(mab1)进行如通过步骤7.1所得的收获物的色谱产生。将柱用于多个色谱周期。柱中的产率没有由于进行额外的运行而显著变化,表明柱保留结合能力(表7-7)。[0996]表7-7.[0997][0998]使用7.4中所述的方法获得柱1和2的加载溶液、洗涤级分和洗脱级分中的hcp计算(图39)。所计算的总hcp显示,重复使用柱不会降低柱与minitrap结合的能力。[0999]7.10优化亲和色谱柱[1000]使用柱1(vegf165)和柱2(mab1)进行如部分7.1中获得的收获物材料的色谱产生。为了进行优化研究,将14mg或45mg而非10mg的vegf165或抗vegf-r1mab加载至两个hitrapnhs激活的hp亲和柱(1ml,gehealthcare)上,并封闭柱以允许偶联在室温下进行30分钟。minitrap(mt5)的编码区与信号序列可操作地连接并克隆到哺乳动物表达载体中,转染到中国仓鼠卵巢(cho-k1)细胞中,并在用400μg/ml潮霉素选择12天后分离经稳定转染的池。将在cdm中生长的稳定cho细胞池用于产生蛋白质以进行分析。[1014]8.1糖蛋白的去糖基化[1015]将来自mt1、mt2和mt3的经澄清收获物的样品在1%(w/v)rg表面活性剂(rapigestsf,waters,milford,ma)和50mmhepes(ph7.9)的28.8μl溶液中稀释或重构至0.52mg/ml的浓度。将这些溶液经2分钟加热至大约95℃,允许冷却至50℃,并与1.2μl的pngasef溶液(glycoworksrapidpngasef,waters,milford,ma)混合。通过将样品在50℃下温育5分钟来完成去糖基化。[1016]8.2hilic-荧光-esi-ms(ms/ms)分析。[1017]经由hilic分离组合荧光和质谱检测对mt1进行分析。仅使用hilic分析mt2和mt3。使用配备有光电二极管阵列和荧光(flr)检测器并与waterssynaptg2-s质谱仪(ms条件)连接的waters2dacquityuplc进行色谱法。将亲水相互作用色谱(hilic)分离模式与150×2.1mm,1.7μm的watersuplcglycanbehamide柱一起使用。柱温度设定为60℃,而自动进样器温度设定为5℃。注入体积是50μl。光电二极管阵列的扫描范围为190–700nm。flr设定为:对于rapifluor标记的聚糖来说,激发265nm,发射425nm;而对于糖肽中存在的酪氨酸来说,激发274nm和发射303nm。初始流率为0.4ml/min,其中流动相a包含100mm甲酸铵(ph4.4),而流动相b为乙腈。[1018]8.3ms条件[1019]液相色谱/质谱(lc/ms)实验是使用waterssynaptg2-s质谱仪进行的。针对正离子模式和负离子模式分析,扫描范围为质荷比100-2400。扫描时间是1s,并且恒定输注(2μl/min)glu-血纤维肽b作为校准物(“锁定质量(lockmass)”)。毛细管电压设定为2.5kv,其中源温度为120℃并且去溶剂化温度为500℃。氮气喷雾器气体流量设定为700l/h。[1020]8.4天然sec-ms[1021]将acquityuplci类系统(waters,milford,ma)与qexactivehf混合四极杆orbitrap质谱仪(thermoscientific,bremen,germany)耦合,以用于所有随线sec-ms分析。将acquityuplcproteinbehsec柱(1.7μm,4.6×300mm)设定在30℃,并用于蛋白质分离。流动相是ph6.8的100mm乙酸铵。每次分离为30分钟,其中流率为0.3ml/min,并且注入量设定为40μg。以下ms参数用于随线sec-nano-esi-ms数据采集。每次获取为25分钟,在样品注入后立即开始。将去糖基化样品在3kv喷雾电压、200℃毛细管温度和70s镜头rf位准下以正模式电离。源内(in-source)cid设定为75ev。以15k解析力获取全ms扫描,质量范围介于m/z2000-8000之间。将100ms的最大注入时间、3e6的自动增益控制目标值和10次微扫描用于全ms扫描。[1022]8.5肽作图[1023]用于肽作图的样品制备。通过添加500mmol/l二硫苏糖醇(dtt)至5mmol/l的最终浓度,接着在4℃下温育60分钟来实现还原。通过添加500mmol/l碘乙酰胺(iam)至10mmol/l的最终浓度并在黑暗中于4℃下温育60分钟来进行烷化。根据制造商的说明,使用zebatmspin7kmwco尺寸排阻脱盐柱(p/n89882)(thermoscientific,waltham,ma)将变性缓冲液更换为消化缓冲液(1mol/l尿素,在0.1mol/ltrisph7.8中)。将重组猪胰蛋白酶(购自sigma,目录号03708985001)以1:18(酶:样品)质量比(基于vegfminitrap蛋白浓度,如在缓冲液交换后通过uv-vis分光光度法所测量)添加,将vegfminitrap蛋白的浓度调节至0.5μg/μl并允许在室温下温育4小时期间进行消化。消化完成时,以1:1体积比添加在lc-ms级水中的0.1%甲酸。将消化物在-80℃下储存直至分析。[1024]胰蛋白酶消化物的lc-ms/ms分析。经由自动进样器将一份或多份2.5μg(10μl)的肽消化物加载至封闭在设定为40℃的恒温柱烘箱中的c18柱上。样品在排队注入时保持在7℃。色谱方法是以98%流动相a(于水中0.1%体积分数的甲酸)和2%流动相b(于乙腈中0.1%体积分数的甲酸)开始,其中流率设定在恒定为0.200ml/min。洗涤10分钟后,将肽在110分钟的梯度上洗脱,其中流动相b含量以每分钟0.39%的速率升高,以达到包含45%流动相b的最终组成。在下一次样品注入之前,将柱用97%流动相b洗涤15分钟,接着在98%流动相a中平衡25分钟。在运行之前1.5分钟和最后5分钟将洗脱液转移至废液。通过在214nm下的uv吸收,接着在ltqorbitrapelite或discoveryxl上的质谱法,分析从色谱柱洗脱的肽。收集ps8670和rm8671样品的复制肽作图数据,以便各自包括三个串联ms(ms/ms)分析和一个仅有ms的分析。ms/ms分析是以数据依赖性模式进行以用于肽识别,其中一个实验周期由以下组成:300m/z至2000m/z的一次全ms扫描,接着五个顺序ms/ms事件,它们是在启动所述周期的ms扫描中以500的最小阈值计数检测到的第一至第五个最强离子上进行。顺序质谱法(msn)agc目标设定为1e4,其中微扫描=3。在质心模式下以正常扫描速率使用离子阱来分析ms/ms片段。使用高分辨率ftms分析仪(r=30,000)以轮廓图模式收集全ms扫描,其中全扫描agc目标是1e6并且微扫描=1。选择离子以便使用2da的隔离宽度进行ms/ms,接着使用35的归一化cid能量、0.25的激活q值和10毫秒的激活时间,通过与氦气的碰撞诱导解离(cid)进行片段化。默认电荷状态设定在z=2。如果前体离子在30s内两次触发事件,则将数据依赖性质量放置在排除清单中持续45s;排除质量宽度设定在±1da。对未经分配的电荷状态启用电荷状态拒绝。拒绝质量清单包括在以下各处的常见污染物:122.08m/z、185.94m/z、355.00m/z、371.00m/z、391.00m/z、413.30m/z、803.10m/z、1222.10m/z、1322.10m/z、1422.10m/z、1522.10m/z、1622.10m/z、1722.10m/z、1822.10m/z和1922.10m/z。进行仅有ms的分析以生成tic非还原肽图和还原图。[1025]8.6结果[1026]vegfminitrap构建体的结构。vegfminitrapmt1、mt5和mt6的结构描绘于图40、图41、图43和图44中。[1027]使用sec-ms进行的初始质量分析证实去糖基化之后在完整蛋白质水平上所有三个分子的身份(图42)。天然sec-ms分析的总离子色谱图(tic)证明在约12-13分钟时检测到完整的vegfminitrap分子。tic的低分子量(lmw)区域的扩展显示在所有三个蛋白质样品中均存在lmw杂质。[1028]vegfminitrap的去卷积质谱进一步证实它们的身份,并提供数据来阐明主要ptm存在于包含mt1和mt5(图43)(其为二聚体)和mt6(图44)(其为单链蛋白)的样品中。[1029]mt1样品的分析。提取由包含mt1的样品的sec-ms分析的tic中识别的lmw种类,以检查三种不同的lmw杂质—lmw1、lmw2和lmw3(图45a和图45b)。lmw1种类包含阿柏西普的经截短的种类。lmw2种类包含样品中存在的fc杂质,此类杂质是通过阿柏西普的切割产生,进行所述切割以产生minitrap。lmw3种类包含可能从mt1(二聚体)分子上切割的单体。[1030]mt1样品未显示fabricator酶的存在,所述酶已用于切割阿柏西普以形成minitrap蛋白。所述酶如果存在,则在约11.5和12.5分钟时检测到。在mt1样品的sec-ms分析期间未检测到所述峰(图46)。[1031]mt5样品的分析。提取由包含mt5的样品的sec-ms分析的tic中识别的lmw种类,以检查两种不同的lmw杂质—lmw1和lmw2的存在(图47)。[1032]mt6样品的分析。提取由包含mt1的样品的sec-ms分析的tic中识别的lmw种类,以检查三种不同的lmw杂质—lmw1、lmw2和lmw3的存在(图48)。lmw2种类包含mt6的片段,其中切割产生带有g4s接头的vegfminitrap的片段。lmw5种类包含mt6的片段,其中切割发生在g4s接头之前或之后。[1033]mt6样品中的聚糖是在hilic色谱法中使用由waters和nationalinstituteforbioprocessingresearchandtraining(dublin,ireland)率先提出的葡萄糖单位值通过其质量和洗脱顺序来识别(图49a和图49b)。[1034]游离硫醇定量。vegfminitrap构建体的半胱氨酸残基可参与分子内和分子间二硫键的形成,或者它们可以游离硫醇形式存在。肽和蛋白质中硫键的存在已显示会对蛋白质施加构象刚性。硫醇可通过多种试剂和分离技术来检测。针对三种vegfminitrap构建体的极低水平的游离硫醇的分析示于表8-1中。[1035]表8-1.[1036]位置肽(游离半胱氨酸的位点)mt1mt5mt6vegf-r1elvipcr(seqidno.:81)《0.1%《0.1%《0.1%vegf-r2lvlnctar(seqidno.:82)0.3%0.3%0.3%fc铰链thtcppcpapellg(seqidno.:83)0.0%0.0%n/a[1037]三硫化物定量。与vegfminitrap构建体的cys残基中的游离硫醇相似,三硫键可影响蛋白质的结构。在具有极低游离硫醇水平的条件下三种vegfminitrap构建体的分析示于表8-2中。[1038]表8-2.[1039][1040]铰链区中的链内二硫键。铰链区中的错配二硫键可对vegfminitrap构建体的结构、功能和稳定性产生影响。对三种vegfminitrap构建体关于在vegfminitrap构建体[thtc*ppc*papellg,c*展示可形成链内二硫键的位置]的铰链区中的极低或不存在的链内二硫键进行的分析示于表8-3中。[1041]表8-3.[1042]肽mt1mt5mt6二硫化物《0.1%《0.1%n/a三硫化物《0.1%《0.1%n/a[1043]交叉和平行二硫键联异构体的定量。对于mt1和mt5(它们是由铰链区中的平行二硫键连接的二聚体),存在异构体的可能性,其中铰链区中的二硫键可交叉(图50)。[1044]二硫键类型(平行对比交叉)的定量显示,与作为fabricator消化的分子的mt1相比,mt2重组表达的蛋白在fc铰链区中具有稍微较高水平的交叉二硫桥(表8-4)。[1045]表8-4.[1046]二硫化物mt1mt5mt6交叉0.2%3.9%n/a平行99.8%96.1%n/a[1047]翻译后修饰(ptm)。[1048]表8-5.[1049][1050]聚糖宏观异质性(糖基化位点占用率)和微观异质性(位点特异性聚糖结构))对于理解糖蛋白的生物合成和功能很重要。糖基化程度可根据蛋白质的表达方式而变化。对于所有三种vegfminitrap,在n36处的糖基化水平是相似的(表8-8和图51)。类似地,对于所有三种vegfminitrap,在n68处的糖基化水平也是相似的(表8-8和图52)。对于所有三种vegfminitrap,在n123处的糖基化水平也是相似的(表8-8和图53),但在mt1制剂中发现甘露糖-5升高。对于vegfminitrap构建体,与mt1相比,mt5和mt6在asn196处的糖基化程度较低(表8-8和图54)。另外,与mt4和mt6制剂相比,mt1制剂中的甘露糖-5也是升高的。[1060]表8-8.[1061]位点肽mt1mt5mt6n36(r)vtspnitvtlk(seqidno.:100)98.3%98.1%99.4%n68(k)gfiisnatyk(seqidno.:101)51.9%55.4%64.9%n123(k)lvlnctar(seqidno.:102)99.9%99.4%98.4%n196(k)nstfvr(seqidno.:103)98.6%44.5%55.1%[1062]n-聚糖的分析。n36处的糖基化示于表8-9中。g2f、g2fs、g2fs2是在所有三种vegfminitrap中存在的主要n-聚糖。对于表8-10中所示的n68处的糖基化,g2f和g2fs是在所有三种vegfminitrap中存在的主要n-聚糖。对于表8-11中的n123处的糖基化,g2f和g2s是在所有三种vegfminitrap中存在的主要n-聚糖,并且与mt5和mt6相比,在mt1中检测到高水平的甘露糖-5。对于表8-12中所示的n196处的糖基化,g2、g2s、g2s2是在所有三种vegfminitrap中存在的主要n-聚糖,并且与mt5和mt6相比,在mt1中检测到高水平的甘露糖-5。[1063]表8-9.[1064]n36处的聚糖mt1mt5mt6g0f-glcnac2.0%1.8%1.8%g1f3.2%1.0%1.4%g1f-glcnac4.8%4.6%4.9%g1fs-glcnac3.1%3.8%3.1%g2f17.4%15.1%19.8%g2f2s1.7%2.0%2.2%g2fs34.2%31.5%31.9%g2fs220.4%25.8%19.0%g3fs2.3%4.0%5.5%g3fs22.6%4.7%5.0%g3fs31.1%2.4%1.9%g1_man5 phos1.2%0.3%0.2%man6 phos5.7%2.5%2.8%[1065]表8-10.[1066]n68处的聚糖mt1mt5mt6g0f-glcnac1.2%1.1%1.1%g1f5.1%1.4%1.7%g1f-glcnac3.9%3.9%4.0%g1fs1.2%0.4%0.4%g1fs1-glcnac1.2%1.6%1.4%g2f27.4%23.6%28.6%g2f2s2.2%3.0%3.4%g2fs52.4%55.2%50.2%g2fs23.9%6.9%5.8%g3fs0.5%1.2%1.6%g3fs20.4%1.1%1.2%[1067]表8-11.[1068]n123处的聚糖mt1mt5mt6g0-glcnac3.5%3.7%3.5%g1-glcnac6.2%6.8%6.4%g1s-glcnac4.1%3.5%2.8%g210.6%16.7%17.1%g2f1.5%7.2%7.0%g2fs2.1%13.6%14.2%g2s12.7%26.1%25.5%g2s21.3%5.0%6.6%g1_man43.8%1.3%1.4%g1s_man43.9%2.1%1.8%g1_man54.0%1.2%1.1%g1s_man53.2%1.4%1.4%man42.6%1.9%1.8%man535.5%4.3%3.1%man61.1%0.1%0.1%man72.8%0.1%0.1%[1069]表8-12.[1070][1071][1072]mt3的接头处的o-聚糖。评估mt3的gs接头以研究mt3上的o-聚糖。发现o-木糖基化位于mt3(ggggsggggsggggsggggsggggsggggssdtgrpfvemyseipeiihmtegr,加下划线的丝氨酸残基被糖基化)的gs接头上的丝氨酸残基上。o-聚糖的组成示于表8-13中。[1073]表8-13.[1074][1075]hilic-flr-ms分析。如部分8.2中所述,对所有vegfminitrap蛋白进行hilic-flr-ms分析。分析表明,mt5和mt6的n-连接聚糖相似,但与针对mt1所获得的n-连接聚糖不同(图55显示全标度和叠加式色谱图,图56显示全标度和重叠式色谱图,并且图57显示全标度、叠加式和归一化色谱图)。[1076]最后,表8-14和图58a-c中分别列出所有三种vegfminitrap蛋白的糖基化百分比以及详细的聚糖识别和定量。如在所有聚糖分析中所观察到的,mt5与mt6的糖基化谱和甘露糖水平相似,但与mt1不同。[1077]表8-14.[1078]mt1mt2mt3岩藻糖基化%42.9%57.8%57.2%半乳糖基化%71.6%92.9%93.7%唾液酸化%33.1%47.6%44.8%高甘露糖%17.6%2.6%2.3%平分%(%bisecting)1.9%0.4%0.4%[1079]实施例9.使用上游培养基的生产和颜色定量以及进料工艺优化[1080](a)未优化的cdm(对照生物反应器)[1081]使用实施例5中所述的minitrap的制造。[1082]研究步骤的操作参数是本领域普通技术人员已知的。[1083]第0天的培养基=cdm1,并且包括以下营养素、抗氧化剂和金属:[1084]·以8-9mm的累积浓度添加半胱氨酸[1085]·下面以1x浓度(其中浓度是在接种物添加之前)列出起始培养基中的金属:[1086]οfe=每升培养物68-83微摩尔[1087]οzn=每升培养物6-7微摩尔[1088]οcu=每升培养物0.1-0.2微摩尔[1089]οni=每升培养物0.5-1微摩尔[1090]在收获mt1时,遵循如图59中所示的生产程序。色谱的操作参数是本领域普通技术人员已知的。用于亲和捕获(图59的步骤3)、亲和流通(图59的步骤5)、aex(图59的步骤8)和hic(图59的步骤9)的操作参数概述于表9-1中。在亲和捕获和过滤步骤之后,使用实施例1.2中概述的程序进行阿伯西普的蛋白水解切割。[1091]表9-1.[1092][1093]表9-2显示在进行各种色谱步骤时获得的池的颜色定量。使用来自蛋白质浓度为5g/l的池的样品进行颜色定量。[1094]亲和捕获池是指在进行亲和捕获步骤(图59的步骤3)时收集的洗脱液。酶池是指在进行酶切割步骤(图59的步骤4)时收集的流通液。亲和流通池是指在进行亲和流通步骤(图59的步骤5)时收集的流通液,而亲和流通洗脱液是指在进行亲和流通步骤(图59的步骤5)时收集的洗脱液。aex池和aex汽提液是指在进行阴离子交换色谱步骤(图59的步骤8)时获得的流通和汽提级分。hic池是指在进行疏水相互作用色谱步骤(图59的步骤9)时收集的流通液。[1095]如表9-2中所见的每个步骤均显示着色减少(如由池的b*值减小所观察到)。例如,在进行亲和流通色谱时,流通级分具有2.16的b*值(与从亲和捕获步骤收集的流通液的2.52的b*值相比减小)。aex分离后的流通液和洗涤液进一步减少着色,如通过b*值从2.16降至0.74所观察到。如所预期的,汽提aex柱产生带有黄棕色的样品,所述颜色比来自aex分离后的流通液和洗涤液的着色显著更强烈,如由b*值可见(8.10对比0.74)。最后,hic步骤进一步提供着色减少(b*值可针对5g/l蛋白质浓度进行归一化,所述b*值来自在28.5g/l蛋白质浓度下的hic池所获得的b*值)。[1096]表9-2.各个生产步骤处的样品的颜色定量[1097]样品浓度(g/l)l*a*b*亲和捕获池5.0±0.198.75-0.122.52酶切割池5.0±0.199.03-0.071.61亲和流通池5.0±0.198.95-0.082.16亲和流通洗脱液5.0±0.198.92-0.010.83aex池5.0±0.199.72-0.030.74aex2mnacl汽提液5.0±0.196.25-0.428.10hic池28.598.78-0.283.11[1098](b)优化的cdm(低半胱氨酸、低金属和增加的抗氧化剂生物反应器)[1099]使用以下方案评估降低的半胱氨酸浓度、降低的金属浓度和增加的抗氧化剂对着色的影响:[1100]第0天的培养基=cdm1[1101]ο以5-6mm的累积浓度添加半胱氨酸[1102]·将抗氧化剂添加至cdm1中,以达到以下累积浓度(其中浓度是接种物添加之前的浓度):[1103]ο牛磺酸=10mm的培养物[1104]ο甘氨酸=10mm的培养物[1105]ο硫辛酸=0.0024mm的培养物[1106]ο维生素c(抗坏血酸)=0.028mm的培养物[1107]·下面以1x水平列出起始培养基中的金属。[1108]οfe=每升培养物68-83微摩尔[1109]οzn=每升培养物6-7微摩尔[1110]οcu=每升培养物0.1-0.2微摩尔[1111]οni=每升培养物0.5-1微摩尔。[1112]ο所有金属的减少,包括使用0.25x上文针对培养基所示的浓度。[1113]在收获mt1样品时,遵循如图59中所示的生产程序。色谱的操作参数是本领域普通技术人员已知的。表9-1中概述用于亲和捕获、亲和流通和hic的操作参数。在亲和捕获和过滤步骤之后,使用实施例1.2中概述的程序进行阿伯西普的蛋白水解切割。[1114]表9-3显示在进行各种色谱步骤时获得的池的颜色定量。使用来自蛋白质浓度为5g/l的池的样品进行颜色定量。如表9-3中所示的步骤提供与表9-2中的步骤所见类似的生产。[1115]表9-3.minitrap的各个生产步骤处的样品的颜色定量[1116]样品浓度(g/l)l*a*b*亲和捕获池5.0±0.199.18-0.091.77酶切割池5.0±0.199.44-0.061.17亲和流通池5.0±0.199.32-0.101.58亲和流通洗脱液5.0±0.199.74-0.050.60aex池5.0±0.199.63-0.070.50aex2mnacl汽提液5.0±0.197.63-0.496.10hic池27.699.07-0.292.32[1117]比较表9-2与表9-3,很明显,与“对照生物反应器条件”(b*值为2.52)相比,“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”在亲和捕获池中具有较低的颜色(b*值为1.77)。[1118]预计浓度为160g/l的mt样品(使用表9-2和表9-3中列出的步骤形成mt)对于“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”具有13.45的b*值并且对于“对照生物反应器条件”具有17.45的b*值。经由优化上游培养基和进料,达到23%颜色减少。类似地,预计浓度为110g/l的mt样品(使用表9-2和表9-3中列出的步骤形成mt)对于“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”具有9.25的b*值并且对于“对照生物反应器条件”具有12的b*值。[1119]为了理解每个生产单元操作如何有助于减少颜色,将每个生产工艺中间体的b*值计算为亲和捕获池的颜色百分比(表9-4)。[1120]表9-4.[1121][1122][1123]aex单元操作提供最多的颜色减少(b*值变化从1.08至1.42),而hic单元操作提供一些额外的颜色减少(b*值变化从0.08至0.19)。所评估的单元操作总体上去除亲和捕获池中存在的76.3%–78.2%的颜色。[1124]还关于以下指标对“对照生物反应器条件”以及“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”的各种生产工艺中间体的颜色进行研究:通过蛋白酶消化产生的寡肽中的2-氧代-组氨酸的百分比和氧代-色氨酸的百分比,如通过质谱法所测量,如表9-5和表9-6中分别所示。如实施例3中所论述进行肽作图。[1125]参看表9-5,在比较不同生产步骤中池中的组氨酸氧化水平时,很明显,随着生产过程的进展,池中形成的mt的组氨酸氧化水平百分比的相对丰度降低。例如,对于“对照生物反应器条件”下的h209,组氨酸氧化水平的百分比对于酶切割池为0.062,并且对于aex流通液,其降至0.029,并且对于hic池,进一步降至0.020。类似地,对于“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”下的h209,组氨酸氧化水平的百分比对于酶切割池为0.039,并且对于aex流通液,其降至0.023,并且对于hic池,进一步降至0.016。因此,生产策略导致mt中组氨酸氧化水平的百分比的降低。随着着色的减少,样品中一些氧化残基的存在也减少。与组氨酸氧化相似,在“对照生物反应器条件”以及“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”下的不同生产步骤中,也对池的色氨酸氧化水平进行追踪(表9-6)。[1126]表9-5[1127][1128]表9-6.[1129][1130][1131]列举的实施例[1132]下文提供的示例性列举实施例不旨在限制,而应理解,基于如本领域技术人员所了解的本文中的描述,使用cdm和修改条件以减少或增加蛋白质变体和黄棕色来产生抗vegf组合物(包括阿柏西普和vegfminitrap)的另外的变化方案可按照本文中的描述实施。[1133]1.一种包含氧代-mintrap的组合物,其中minitrap的一个或多个氨基酸残基被氧化。[1134]2.如权利要求1所述的组合物,其中所述一个或多个氨基酸残基是组氨酸和/或色氨酸。[1135]3.如权利要求1所述的组合物,其中所述氧代-minitrap经酶消化,产生一种或多种寡肽,并且其中所述一种或多种寡肽选自由以下组成的组:seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.29、seqidno.30、seqidno.31、seqidno.32及其组合。[1136]4.如权利要求3所述的组合物,其中所述酶消化是使用胰蛋白酶进行的。[1137]5.一种产生minitrap的氧化种类的方法,所述方法包括使具有minitrap的样品经受约24万lux*hr至约240万lux*hr的冷白光。[1138]6.一种产生minitrap的氧化种类的方法,所述方法包括:[1139]a.使包含minitrap的样品经受约24万lux*hr至约240万lux*hr的冷白光;以及[1140]b.进行(a)的消化,形成寡肽,其中所述寡肽包含下列寡肽中的一者或多者:[1141]dkth*tc*ppc*papellg(seqidno.:17)、eiglltc*eatvngh*lyk(seqidno.:18)、qtntiidvvlspsh*gielsvgek(seqidno.:19)、telnvgidfnweypsskh*qhk(seqidno.:20)、tnylth*r(seqidno.:21)、sdtgrpfvemyseipeiih*mtegr(seqidno.:22)、vh*ekdk(seqidno.:23)、sdtgrpfvem*yseipeiihmtegr(seqidno.:64)、sdtgrpfvemyseipeiihm*tegr(seqidno.:65)、tqsgsem*k(seqidno.:66)、sdqglytc*aassglm*tk(seqidno.:67)、iiw*dsr/riiw*dsr/iiw*dsrk(seqidno.:28)、telnvgidfnw*eypssk(seqidno.:29)、gfiisnaty*k(seqidno.:69)、kf*pldtlipdgk(seqidno.:70)f*lstltidgvtr(seqidno.:32),其中h*是被氧化为2-氧代-组氨酸的组氨酸,其中c*是被羧甲基化的半胱氨酸,其中m*是被氧化的甲硫氨酸,其中w*是被氧化的色氨酸,其中y*是被氧化的酪氨酸,并且其中f*是被氧化的苯丙氨酸。[1142]7.如权利要求6所述的方法,其中在冷白光暴露后,minitrap的氧化种类的量与未经处理的minitrap相比增加约1.5至约50倍。[1143]8.如权利要求6所述的方法,其中所述消化是使用胰蛋白酶进行的。[1144]9.如权利要求6所述的方法,其中所述寡肽是使用质谱法分析的。[1145]10.如权利要求6所述的方法,其中所述冷白光具有约8klux的强度。[1146]11.如权利要求5或6所述的方法,其中所述minitrap经受约24万lux*hr的冷白光,并且其中所述minitrap的氧化种类的量与未经处理的minitrap相比增加约1.5至约10倍。[1147]12.如权利要求5或6所述的方法,其中所述minitrap经受约96万lux*hr的冷白光,并且其中所述minitrap的氧化种类的量与未经处理的minitrap相比增加约1.5至约20倍。[1148]13.如权利要求5或6所述的方法,其中所述minitrap经受约120万lux*hr的冷白光,并且其中所述minitrap的氧化种类的量与未经处理的minitrap相比增加约1.5至约20倍。[1149]14.如权利要求5或6所述的方法,其中所述minitrap经受约240万lux*hr的冷白光,其中所述minitrap的氧化种类的量与未经处理的minitrap相比增加约1.5至约50倍。[1150]15.一种产生minitrap的氧化种类的方法,所述方法包括:[1151]a.在化学成分确定的培养基(cdm)中培养经基因工程化以表达阿柏西普的细胞;[1152]b.将来自所述澄清收获物的阿柏西普结合至蛋白a树脂;[1153]c.洗脱步骤(b)的所述阿柏西普并使所述阿柏西普经历酶切割以去除其fc结构域,从而形成具有第一量的minitrap的氧化种类的minitrap;[1154]d.使来自步骤(c)的minitrap经历第二捕获色谱,其中使所述第二捕获色谱步骤经历一次或多次洗涤,并且其中第一流通级分包含minitrap;[1155]e.使步骤(d)的所述第一流通液经历阴离子交换色谱(aex);以及[1156]f.洗涤来自步骤(e)的所述aex柱并收集第二流通液;以及[1157]g.使用汽提缓冲液汽提步骤(f)的aex柱,其中在所述aex柱的所述汽提之后的所述流通液中的所述minitrap包含第二量的氧化minitrap。[1158]16.如权利要求15所述的方法,其中所述汽提缓冲液选自包括2m氯化钠(nacl)、1n氢氧化钠(naoh)或其组合的组。[1159]17.如权利要求15所述的方法,所述方法使来自步骤(c)的所述minitrap进一步经受约24万lux*hr至约240万lux*hr的冷白光,并且其中所述minitrap的氧化种类的量增加约1.5至约50倍。[1160]18.如权利要求15所述的方法,所述方法使来自步骤(c)的所述洗脱的minitrap进一步经受约96万lux*hr的冷白光,并且其中所述minitrap的氧化种类的第二量增加约1.5至约20倍。[1161]19.如权利要求15所述的方法,所述方法使来自步骤(c)的所述洗脱的minitrap进一步经受约120万lux*hr的冷白光,并且其中所述minitrap的氧化种类的第二量增加约1.5至约20倍。[1162]20.如权利要求15所述的方法,所述方法使来自步骤(c)的所述洗脱的minitrap进一步经受约240万lux*hr的冷白光,并且其中所述minitrap的氧化种类的第二量增加约1.5至约50倍。当前第1页12当前第1页12
技术领域:
:5.本发明大体上涉及抗vegf组合物及其制备方法。
背景技术:
::6.基于蛋白质的生物药物组合物已成为用于研究、治疗眼科疾病、癌症、自身免疫疾病、感染以及其他疾病和病症的重要产品。生物医药代表医药行业增长最快的产品领域之一。7.已识别出一类对血管内皮细胞具有选择性的细胞衍生的二聚促分裂原,并将其命名为血管内皮细胞生长因子(vegf)。8.持续的血管生成(angiogenesis)可引起或加剧某些疾病,例如牛皮癣、类风湿性关节炎、血管瘤、血管纤维瘤、糖尿病性视网膜病和新生血管性青光眼。vegf活性的抑制剂可用于治疗此类疾病和其他vegf诱发的病理性血管生成和血管通透性疾患,例如肿瘤血管形成(vascularization)。血管生成素和血管内皮生长因子(vegf)家族的成员是唯一被认为对血管内皮细胞有很大特异性的生长因子。9.若干眼部病症与病理性血管生成相关。例如,年龄相关的黄斑变性(amd)的发展与称为脉络膜新生血管形成(cnv)的过程相关。cnv的渗漏会引起黄斑水肿和黄斑下方积液,从而导致视力丧失。糖尿病性黄斑水肿(dme)是另一种具有血管生成组分的眼部病症。dme是糖尿病患者中度视力丧失的最普遍原因,并且是糖尿病性视网膜病的常见并发症,糖尿病性视网膜病是一种影响视网膜血管的疾病。当液体渗漏至黄斑中心时,会发生具有临床意义的dme,黄斑是视网膜的光敏部分,负责清晰、直接视力。黄斑中的液体会导致严重视力丧失或失明。10.各种vegf抑制剂,例如vegftrapeylea(阿柏西普(aflibercept)),已经批准用于治疗此类眼部病症。技术实现要素:11.本发明涉及抗vegf蛋白,其包括作为融合蛋白的vegftrap蛋白阿柏西普。本发明还涉及新的抗vegf蛋白,即阿柏西普minitrap或vegfminitrap(除非另有说明,否则统称为minitrap)。本文公开了制备这些抗vegf蛋白的方法,包括提供有效和高效手段来产生目标蛋白质的产生模式。在一个方面,本发明涉及使用化学成分确定的培养基(cdm)来产生抗vegf蛋白。在一个特定方面,目标cdm是当使用时产生蛋白质样品的cdm,其中所述样品具有黄棕色并且可包含氧化种类。在本技术中,还进一步公开了阿柏西普和vegfminitrap的蛋白质变体以及附随产生方法。12.阿柏西普的产生13.本公开描述了使用细胞培养基产生阿柏西普。在一个实施方案中,细胞培养基是化学成分确定的培养基(“cdm”)。经常使用cdm,因为它是一种不含蛋白质的化学成分确定的配方,不使用动物来源的组分,并且可确定培养基的组成。在另一个实施方案中,细胞培养基是大豆水解物培养基。14.在一个实施方案中,产生重组蛋白的方法包括:(a)提供经基因工程化以表达目标重组蛋白的宿主细胞;(b)在合适的条件下在cdm中培养所述宿主细胞,其中所述细胞表达所述目标重组蛋白;以及(c)收获由所述细胞产生的目标重组蛋白的制剂。在一个方面,目标重组蛋白是抗vegf蛋白。在一个特定方面,抗vegf蛋白选自由阿柏西普和重组minitrap(其实例在美国专利第7,279,159号中公开)、阿柏西普scfv和其他抗vegf蛋白组成的组。在一个优选的方面,目标重组蛋白是阿柏西普。15.在本实施方案的一个方面,阿柏西普在合适的宿主细胞中表达。此类宿主细胞的非限制性实例包括但不限于cho、chok1、ns0、sp2/0、胚胎肾细胞和bhk。16.合适的cdm包括杜尔贝科改良伊格尔(dulbecco'smodifiedeagle's,dme)培养基、汉氏营养混合物(ham'snutrientmixture)、excell培养基和ischo-cd培养基。本领域技术人员已知的其他cdm也涵盖在本发明的范围内。在一个特定方面,合适的cdm是cdm1b(regeneron)或excell高级培养基(safc)。17.在一个实施方案中,使来自包含阿柏西普的cdm培养物的澄清收获物样品经历捕获色谱程序。在一个方面,捕获步骤是使用例如蛋白a的亲和色谱程序。在另一方面,亲和程序的洗脱液呈现出某种颜色,例如,洗脱液可呈现出黄棕色。如在下文更详细地描述,颜色可使用以下手段来评价:(i)欧洲颜色标准“by”,其中进行定性目视检查;或(ii)比色测定,ciel*,a*,b*(或cielab),其比by系统更具量化性。然而,无论哪种情况,都应针对蛋白质浓度将多个样品之间的颜色评价进行归一化,以确保有意义的评价。例如,参看下文实施例9,蛋白a洗脱液具有约2.52的“b*”值,相当于大约by5的by值(于蛋白a洗脱液中以5g/l的蛋白质浓度测量)。如果要将蛋白a洗脱液的颜色与另一样品进行比较,则应针对相同蛋白质浓度进行比较。cielab颜色空间的b*值用于表示样品的着色,并覆盖蓝色(-)至黄色( )。样品的b*值比另一样品越高,表明样品中的黄棕色着色比另一样品越强。18.在一个实施方案中,使用cdm由经基因工程化以表达阿柏西普的宿主细胞产生阿柏西普。在一个方面,还产生阿柏西普的其他种类或变体。此类变体包括包含一个或多个经氧化氨基酸残基的阿柏西普同功型,统称为氧代变体(oxo-variant)。使用包含阿柏西普以及其氧代变体的cdm产生的澄清收获物样品可经历捕获色谱程序。在一个方面,捕获步骤是使用例如蛋白a柱的亲和色谱程序。当使用例如液相色谱-质谱法(lc-ms)分析从亲和洗脱液中提取的样品(其可显示或不显示黄棕色)时,可检测到阿柏西普的一种或多种氧化变体。显示经修饰的阿柏西普的某些氨基酸残基被氧化,包括但不限于组氨酸和/或色氨酸残基。在一个方面,变体可包括一个或多个甲硫氨酸残基以及其他残基的氧化,参见下文。19.在另一方面,变体可包括一个或多个色氨酸残基的氧化以形成n-甲酰犬尿氨酸。在另一方面,变体可包括一个或多个色氨酸残基的氧化以形成单羟基色氨酸。在一个特定方面,蛋白质变体可包括一个或多个色氨酸残基的氧化以形成二羟基色氨酸。在一个特定方面,蛋白质变体可包括一个或多个色氨酸残基的氧化以形成三羟基色氨酸。20.在另一方面,变体可包括一个或多个选自由以下组成的组的修饰:例如,一个或多个天冬酰胺的脱酰胺;一个或多个天冬氨酸转化为异天冬氨酸和/或asn;一个或多个甲硫氨酸的氧化;一个或多个色氨酸氧化为n-甲酰犬尿氨酸;一个或多个色氨酸氧化为单羟基色氨酸;一个或多个色氨酸氧化为二羟基色氨酸;一个或多个色氨酸氧化为三羟基色氨酸;一个或多个精氨酸的arg3-脱氧葡糖醛酮化(deoxyglucosonation);c末端甘氨酸的去除;以及一个或多个非糖基化糖位点(non-glycosylatedglycosite)的存在。21.在另一个实施方案中,本发明涉及用于产生阿柏西普的方法。在一个方面,包含阿柏西普及其变体的澄清收获物样品经历捕获步骤,例如蛋白a亲和色谱。在亲和步骤之后,亲和洗脱液可经历离子交换色谱。离子交换色谱可为阳离子交换色谱或阴离子交换色谱。混合模式或多模式色谱以及其他色谱程序也涵盖在本实施方案的范围内,下面将进一步论述。在一个特定方面,离子交换色谱是阴离子交换色谱(aex)。采用aex的合适条件包括但不限于ph值为约8.3至约8.6的tris盐酸盐。在使用例如ph值为约8.3至约8.6的tris盐酸盐进行平衡后,将样品加载至aex柱上。加载柱后,可使用例如平衡缓冲液将柱洗涤一次或多次。在一个特定方面,所用条件可促进阿柏西普及其氧化变体的差异色谱行为,使得可在流通级分中收集包含阿柏西普而无显著量的氧代变体的级分,同时显著部分的氧代变体保留在aex柱的固相上并且可在汽提柱后获得—参见下文实施例2,图11。参看图11和实施例2,可在不同产生步骤之间观察到氧代变体的变化。例如,可通过“色氨酸氧化水平(%)”部分(特别是“w138( 16)”柱)中的数据来说明此变化。可观察到,在aex色谱(aex分离2)后,氧代变体(具体来说,氧代色氨酸)从加载样品中的约0.131%变为流通样品中的约0.070%,表明使用aex减少了阿柏西普的氧代变体。22.可使用离子交换来减弱或最小化颜色。在本实施方案的一个方面,使澄清收获物样品经历捕获色谱,例如使用蛋白a亲和色谱。亲和柱经洗脱并具有第一颜色,所述颜色具有为其赋予的特定by和/或b*值。这种蛋白a洗脱液接着经历离子交换色谱,例如阴离子交换色谱(aex)。洗涤离子交换柱,并收集流通液,所述流通液具有第二颜色,所述颜色具有为其赋予的特定by和/或b*值。在一个特定方面,第一颜色的颜色值(“by”或“b*”)与第二颜色的颜色值不同。在另一方面,如由相应by和/或b*值所反映,与aex流通液的第二颜色相比,蛋白a洗脱液的第一颜色具有更黄棕色的颜色。通常,与蛋白a洗脱液的第一颜色相比,aex之后的第二颜色的黄棕色减弱。例如,使用阴离子交换将蛋白a洗脱液样品中观察到的黄棕色从约3.06的b*值(第一颜色)减弱至aex之后的约0.96(第二颜色)—参见下文实施例2,表2-3。23.在实施方案的一个方面,用于aex柱的平衡缓冲液和洗涤缓冲液的ph值均可为约8.30至约8.60。在另一方面,用于aex柱的平衡缓冲液和洗涤缓冲液的电导率均可为约1.50至约3.00ms/cm。24.在实施方案的一个方面,平衡缓冲液和洗涤缓冲液可为约50mmtris盐酸盐。在一个方面,汽提缓冲液包含2m氯化钠或1n氢氧化钠或两者(参见表2-2)。25.本实施方案可包括不以特定顺序添加一个或多个步骤,例如疏水相互作用色谱(hic)、亲和色谱、多模式色谱、病毒灭活(例如,使用低ph值)、病毒过滤和/或超滤/渗滤以及其他熟知的色谱步骤。26.在一个实施方案中,抗vegf蛋白在如下一个或多个天冬酰胺处被糖基化:g0-glcnac糖基化;g1-glcnac糖基化;g1s-glcnac糖基化;g0糖基化;g1糖基化;g1s糖基化;g2糖基化;g2s糖基化;g2s2糖基化;g0f糖基化;g2f2s糖基化;g2f2s2糖基化;g1f糖基化;g1fs糖基化;g2f糖基化;g2fs糖基化;g2fs2糖基化;g3fs糖基化;g3fs3糖基化;g0-2glcnac糖基化;man4糖基化;man4_a1g1糖基化;man4_a1g1s1糖基化;man5糖基化;man5_a1g1糖基化;man5_a1g1s1糖基化;man6糖基化;man6_g0 磷酸糖基化;man6 磷酸糖基化;和/或man7糖基化。在一个方面,抗vegf蛋白可为阿柏西普、抗vegf抗体或vegfminitrap。27.在一个方面,抗vegf蛋白的组合物的糖基化谱如下:约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约6%至约15%甘露糖-5和约60%至约79%半乳糖基化聚糖(参见实施例6)。在一个方面,抗vegf蛋白在约32.4%天冬酰胺123残基和/或约27.1%天冬酰胺196残基处具有man5糖基化。28.在一个实施方案中,所述方法还可包括使用药学上可接受的赋形剂配制原料药。在实施方案的一个方面,药学上可接受的赋形剂可选自以下:水、缓冲剂、糖、盐、表面活性剂、氨基酸、多元醇、螯合剂、乳化剂和防腐剂。本领域技术人员熟知的其他赋形剂在此实施方案的范围内。29.在实施方案的一个方面,制剂可适于向人类受试者施用。特别是,可通过玻璃体内注射实现施用。在一个方面,制剂可具有约40至约200mg/ml目标蛋白质。30.制剂可用作治疗或预防血管生成性眼部病症的方法,所述病症可包括:年龄相关的黄斑变性(例如,湿性或干性)、黄斑水肿、视网膜静脉阻塞后的黄斑水肿、视网膜静脉阻塞(rvo)、视网膜中央静脉阻塞(crvo)、视网膜分支静脉阻塞(brvo)、糖尿病性黄斑水肿(dme)、脉络膜新生血管形成(cnv)、虹膜新生血管形成、新生血管性青光眼、青光眼手术后纤维化、增生性玻璃体视网膜病(pvr)、视盘新生血管形成、角膜新生血管形成、视网膜新生血管形成、玻璃体新生血管形成、角膜翳、翼状胬肉、血管性视网膜病、在患有糖尿病性黄斑水肿的受试者中的糖尿病性视网膜病;或糖尿病性视网膜病(例如非增生性糖尿病性视网膜病(例如,以约47或53的糖尿病性视网膜病严重程度量表(drss)分级为特征),或增生性糖尿病性视网膜病;例如,在不患有dme的受试者中)。31.vegfminitrap的产生32.本公开描述阿柏西普的修饰形式的产生,其中fc部分被去除或不存在,并且被称为阿柏西普minitrap或vegfminitrap。这种minitrap可在包括化学成分确定的培养基(cdm)或大豆水解物培养基的细胞培养基中产生。33.在一个实施方案中,使用cdm产生minitrap。在minitrap产生的一个方面,使用合适的宿主并且在合适的条件下产生全长阿柏西普,并进一步加工从而通过酶促去除fc部分产生minitrap。或者,可使用合适的宿主细胞在合适的条件下产生编码minitrap的基因(例如,编码缺少其fc部分的阿柏西普的核苷酸序列)。34.在一个实施方案中,用于制造minitrap的方法包括产生全长阿柏西普融合蛋白,接着切割fc区。在一个方面,所述方法涉及产生重组蛋白,即全长阿柏西普融合蛋白(参见美国专利第7,279,159号,其全部教导通过引用并入本文),包含:(a)提供经基因工程化以表达全长阿柏西普的宿主细胞;(b)在合适的条件下在cdm中培养所述宿主细胞,其中所述细胞表达全长阿柏西普;(c)收获由所述细胞产生的所述全长阿柏西普的制剂;以及(d)对所述全长阿柏西普进行酶切割,所述酶切割对去除融合蛋白的fc部分具有特异性。在另一方面,在本领域技术人员熟知的合适条件下,由合适的宿主细胞表达编码阿柏西普减去其fc部分的核苷酸序列(参见美国专利第7,279,159号)。35.在本实施方案的一个方面,阿柏西普在合适的宿主细胞中表达。此类宿主细胞的非限制性实例包括但不限于cho、chok1、ns0、sp2/0、胚胎肾细胞和bhk。36.合适的cdm包括杜尔贝科改良伊格尔(dme)培养基、汉氏营养混合物、ex-cell培养基(safc)和ischo-cd培养基(irvine)。本领域技术人员已知的其他cdm也涵盖在本发明的范围内。在一个特定方面,合适的cdm是cdm1b(regeneron)或excell培养基(safc)。37.在一个方面,在产生minitrap期间,包含目标蛋白质(即,阿柏西普融合蛋白和/或minitrap)以及其变体(包括氧代变体)的样品可呈现出某些颜色特性-黄棕色。例如,来自亲和色谱步骤的洗脱液样品可呈现使用by和/或b*系统测量的某种黄棕色(参见下文实施例2和9)。“样品”的示例性来源可包括亲和色谱,例如蛋白a洗脱液;样品可从离子交换色谱的流通级分获得;其还可从离子交换柱的汽提获得—在产生过程中存在本领域技术人员熟知的可由此分析样品的其他来源。如上文所提及并且在下文中进一步描述,颜色可使用以下手段来评价:(i)欧洲颜色标准“by”,其中进行定性目视检查;或(ii)比色测定,cielab,其比by系统更具量化性。然而,无论哪种情况,都应例如使用蛋白质浓度对多个样品之间的颜色评价进行归一化,以确保样品之间有意义的评价。38.在本实施方案的一个方面,可例如使用采用蛋白酶或其酶活性变体的蛋白水解消化对全长阿柏西普融合蛋白进行酶处理(“切割活性”)以产生vegfminitrap。在此实施方案的一个方面,蛋白酶可为酿脓链球菌(streptococcuspyogenes)的免疫球蛋白降解酶(ides)。在另一方面,蛋白酶可为凝血酶胰蛋白酶、胞内蛋白酶arg-c、胞内蛋白酶asp-n、胞内蛋白酶glu-c、外膜蛋白酶t(ompt)、ides、胰凝乳蛋白酶、胃蛋白酶、嗜热菌蛋白酶、木瓜蛋白酶、链霉蛋白酶或来自佐氏曲霉(aspergillussaitoi)的蛋白酶。在一个方面,蛋白酶可为半胱氨酸蛋白酶。在实施方案的一个特定方面,蛋白酶可为ides。在另一方面,蛋白酶可为ides的变体。ides变体的非限制性实例在下文中描述,并且包括具有由以下组成的组中列出的氨基酸序列的多肽:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一个方面,蛋白酶可固定在琼脂糖或另一种合适的基质上。39.在一个方面,使用cdm产生目标蛋白质(连同其变体)。在一个特定方面,目标蛋白质包括阿柏西普或minitrap。变体包含一个或多个被氧化的氨基酸残基,统称为氧代变体。氧化残基的实例包括但不限于一个或多个组氨酸和/或色氨酸残基,也已使用lc-ms检测到其他氧化残基并且在下文中描述,例如氧化甲硫氨酸。后续色谱法例如aex可用于将给定样品中的这些氧代变体与目标蛋白质分离,并且在本文中描述。40.在一个方面,变体可包括一个或多个色氨酸残基的氧化以形成n-甲酰犬尿氨酸。在另一方面,变体可包括一个或多个色氨酸残基的氧化以形成单羟基色氨酸。在一个特定方面,蛋白质变体可包括一个或多个色氨酸残基的氧化以形成二羟基色氨酸。在一个特定方面,蛋白质变体可包括一个或多个色氨酸残基的氧化以形成三羟基色氨酸。41.在另一方面,氧代变体可包括一种或多种选自由以下组成的组的修饰:一个或多个天冬酰胺残基的脱酰胺;一个或多个天冬氨酸转化为异天冬氨酸和/或asn;一个或多个甲硫氨酸残基的氧化;一个或多个色氨酸残基的氧化以形成n-甲酰犬尿氨酸;一个或多个色氨酸残基的氧化以形成单羟基色氨酸;一个或多个色氨酸残基的氧化以形成二羟基色氨酸;一个或多个色氨酸残基的氧化以形成三羟基色氨酸;一个或多个精氨酸残基的arg3-脱氧葡糖醛酮化;c末端甘氨酸的去除;以及一个或多个非糖基化糖位点的存在。42.在一个实施方案中,制造minitrap蛋白的方法包括(a)在第一色谱平台上捕获全长阿柏西普融合蛋白,以及(b)切割阿柏西普,从而形成minitrap蛋白,即缺少其fc结构域的阿柏西普。在一个方面,第一色谱支撑物包含亲和色谱介质、离子交换色谱介质或疏水相互作用色谱介质。在一个特定方面,第一色谱平台包含亲和色谱平台,例如蛋白a。在另一方面,将捕获步骤(a)的蛋白质从第一色谱平台中洗脱出,之后是切割步骤(b)。在再一个方面,切割步骤(b)之后是第二捕获步骤。在一个特定方面,此第二捕获步骤可通过亲和色谱例如蛋白a亲和色谱来促进。此第二捕获步骤的流通液(包含minitrap)具有第一颜色,例如黄棕色,并且经测量具有特定的by和/或b*值—参见例如下文实施例9。另外,此第二捕获流通液的lc-ms分析可证明存在氧代变体,其中minitrap的一个或多个残基被氧化(参见下文实施例9)。43.在另一方面,第二捕获流通液可经历离子交换色谱,例如aex。可使用合适的缓冲液洗涤此aex柱,并且可收集基本上包含minitrap的aex流通级分。此aex流通级分可具有第二颜色,所述颜色具有黄棕色着色,具有特定的by和/或b*值。在另一方面,如通过by和/或b*系统所测量,第一颜色(来自第二捕获步骤的流通液)与第二颜色(离子交换程序的流通液)具有不同颜色。在一个方面,与第一颜色相比,在aex之后,使用by和/或b*值测得的第二颜色显示出减弱的黄棕色。44.在另一个实施方案中,步骤(b)的切割活性可使用色谱柱进行,其中将切割活性,例如酶活性附着或固定在柱基质上。步骤(b)中使用的柱可包含一种或多种已经提到并且在下文更充分描述的蛋白酶。45.在一个实施方案中,离子交换色谱程序可包含阴离子交换(aex)色谱介质。在另一方面,离子交换色谱介质包含阳离子交换(cex)色谱介质。采用aex的合适条件包括但不限于ph值为约8.3至约8.6的tris盐酸盐。在使用例如ph值为约8.3至约8.6的tris盐酸盐进行平衡后,将样品加载至aex柱上。加载柱后,可使用例如平衡缓冲液将柱洗涤一次或多次。在一个特定方面,所用条件可促进使用aex的minitrap及其氧代变体的差异色谱行为,从而使minitrap基本上位于流通级分中,而氧代变体则基本上保留在aex柱上并可通过汽提柱而收集(参见下文实施例9)。46.在一个实施例中,分析来自不同产生阶段的样品的颜色和氧代变体的存在。参看实施例9,亲和流通池(来自第二蛋白a亲和步骤的流通液)具有约1.58的第一b*值(参见表9-3)。使此第二亲和流通液经历aex。aex流通液具有约0.50的第二b*值,表明使用aex后黄棕色显著减弱。aex柱的汽提产生汽提样品并且观察到约6.10的第三b*值,表明与加载液或流通液相比,此汽提样品具有更黄棕色的颜色。47.再次参看实施例9,还进行了氧代变体分析。所分析的样品是亲和流通池(第二蛋白a亲和洗脱液)、aex流通液和aex汽提液。参看表9-5和表9-6,可在不同产生步骤之间观察到氧代变体的变化。例如,可通过“色氨酸氧化水平(%)”部分(具体来说,“w58( 16)”柱)中的数据来说明此变化。可观察到,在aex色谱之后,氧代变体(具体来说,氧代色氨酸)从加载样品中的约0.055%变为流通样品中的约0.038%,表明在aex之后氧代变体减少。分析aex汽提液,并且发现氧代色氨酸种类的百分比为约0.089%。当将此汽提值与加载液(以及流通液)进行比较时,似乎此氧代变体的很大一部分保留在aex柱上。48.本实施方案可包括不以特定顺序添加一个或多个步骤,例如疏水相互作用色谱、亲和色谱、多模式色谱、病毒灭活(例如,使用低ph值)、病毒过滤和/或超滤/渗滤。49.本发明的一个实施方案涉及一种再生包含树脂的色谱柱的方法。在实施方案的一个方面,树脂具有固定的水解剂。在实施方案的又一个方面,树脂包含固定的蛋白酶。在实施方案的再一个方面,树脂是树脂或所述树脂的突变体。在实施方案的一个方面,再生包含树脂的柱的方法提高树脂的反应效率。50.在实施方案的一个方面,再生包含树脂的柱的方法包括将柱树脂与乙酸一起温育。在一个方面,所用乙酸的浓度为约0.1m至约2m。在一个方面,乙酸浓度为约0.5m。在一个方面,将树脂温育至少约10分钟。在另一方面,将树脂温育至少约30分钟。在此实施方案的又一方面,将树脂温育至少约50分钟。在此实施方案的又一方面,将树脂温育至少约100分钟。在此实施方案的又一方面,将树脂温育至少约200分钟。在此实施方案的又一方面,将树脂温育至少约300分钟。51.任选地,将柱树脂进一步与胍盐酸盐(gu-hcl)一起温育。在一个方面,使用不含乙酸的gu-hcl再生柱树脂。所用gu-hcl的浓度为约1n至约10n。在另一方面,gu-hcl的浓度为约6n。在另一方面,柱树脂可与再生剂(乙酸、gu-hcl)一起温育至少约10分钟。在又一方面,将树脂温育至少约30分钟。在再一方面,将树脂温育至少约50分钟。在又一方面,将所述树脂温育至少约100分钟。52.在一个实施方案中,将包含树脂的柱储存在乙醇中。在一个方面,将柱储存在乙醇中,其中乙醇百分比为约5%v/v至约20%v/v。在一个特定方面,使用20%v/v乙醇储存柱。53.在一个实施方案中,所述方法还可包括使用药学上可接受的赋形剂配制vegfminitrap。在一个方面,药学上可接受的赋形剂可选自以下:水、缓冲剂、糖、盐、表面活性剂、氨基酸、多元醇、螯合剂、乳化剂和防腐剂。本领域技术人员熟知的其他赋形剂在此实施方案的范围内。54.本发明的制剂适于向人类受试者施用。在本实施方案的一个方面,可通过玻璃体内注射实现施用。在一个方面,制剂可具有约40至约200mg/ml目标蛋白质。在一个特定方面,目标蛋白质是阿柏西普或阿柏西普minitrap。55.制剂可用于治疗或预防血管生成性眼部病症的方法中,所述病症可包括:年龄相关的黄斑变性(例如,湿性或干性)、黄斑水肿、视网膜静脉阻塞后的黄斑水肿、视网膜静脉阻塞(rvo)、视网膜中央静脉阻塞(crvo)、视网膜分支静脉阻塞(brvo)、糖尿病性黄斑水肿(dme)、脉络膜新生血管形成(cnv)、虹膜新生血管形成、新生血管性青光眼、青光眼手术后纤维化、增生性玻璃体视网膜病(pvr)、视盘新生血管形成、角膜新生血管形成、视网膜新生血管形成、玻璃体新生血管形成、角膜翳、翼状胬肉、血管性视网膜病、在患有糖尿病性黄斑水肿的受试者中的糖尿病性视网膜病;或糖尿病性视网膜病(例如非增生性糖尿病性视网膜病(例如,以约47或53的糖尿病性视网膜病严重程度量表(drss)分级为特征),或增生性糖尿病性视网膜病;例如,在不患有dme的受试者中)。56.ides的变体57.本公开描述了使用ides(fabricator)(seqidno.:1)或作为ides变体(seqidno.:2至16)的其他多肽来产生vegfminitrap。ides(seqidno.:1)在位置87、130、182和/或274处包括天冬酰胺残基(在以下seqidno.:1中显示为粗体且斜体的“n*”)。这些位置处的天冬酰胺可突变为除天冬酰胺以外的氨基酸,以形成ides变体(并且突变氨基酸显示为斜体且加下划线的氨基酸):58.seqidno.:1[0059][0060]seqidno.:2[0061][0062][0063]seqidno.:3[0064][0065]seqidno.:4[0066][0067]seqidno.:5[0068]mrkrcystsaavlaavtlfvlsvdrgviadsfsanqeirysevtpyhvtsvwtkgvtppanftqgedvfhapyvanqgwyditktfn*gkddllcgaatagnmlhwwfdqnkdqikryleehpekqkinfn*geqmfdvkeaidtknhqldsklfeyfkekafpylstkhlgvfpdhvidmfin*gyrlsltnhgptpvkegskdprggifdavftrgdqsklltsrhdfkeknlkeisdlikkeltegkalglshtyanvrinhvinlwgadfdsdgnlkaiyvtdsdsnasigmkkyfvgvnsagkvaisakeikednigaqvlglftlstgqdswnqtn[0069]seqidno.:6[0070]mrkrcystsaavlaavtlfvlsvdrgviadsfsanqeirysevtpyhvtsvwtkgvtppanftqgedvfhapyvanqgwyditktfdgkddllcgaatagnmlhwwfdqnkdqikryleehpekqkinfrgeqmfdvkeaidtknhqldsklfeyfkekafpylstkhlgvfpdhvidmfin*gyrlsltnhgptpvkegskdprggifdavftrgdqsklltsrhdfkeknlkeisdlikkeltegkalglshtyanvrinhvinlwgadfdsn*gnlkaiyvtdsdsnasigmkkyfvgvnsagkvaisakeikednigaqvlglftlstgqdswnqtn[0071]seqidno.:7[0072][0073]seqidno.:8[0074][0075][0076]seqidno.:9[0077][0078]seqidno.:10[0079][0080]seqidno.:11[0081][0082][0083]seqidno.:12[0084][0085]seqidno.:13[0086][0087]seqidno.:14[0088][0089][0090]seqidno.:15[0091][0092]seqidno.:16[0093][0094]在一个实施方案中,多肽具有分离的氨基酸序列,其在如由以下组成的组中列出的分离的氨基酸序列的全长上包含至少70%序列同一性:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一个方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约80%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约90%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有约100%序列同一性。在一个方面,多肽能够将靶蛋白切割成片段。在一个特定方面,靶蛋白是igg。在另一方面,靶蛋白是融合蛋白。在又一方面,片段可包含fab片段和/或fc片段。[0095]seqid1,no.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。[0096]本公开还包括一种分离的核酸分子,其编码具有分离的氨基酸序列的多肽,所述氨基酸序列在如由以下组成的组中列出的分离的氨基酸序列的全长上包含至少70%序列同一性:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一个方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约80%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约90%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有约100%序列同一性。在一个方面,多肽能够将靶蛋白切割成片段。在一个特定方面,靶蛋白是igg。在另一个特定方面,靶蛋白是融合蛋白。在又一个特定方面,片段可包含fab片段和/或fc片段。[0097]本公开还包括一种载体,所述载体包含编码具有分离的氨基酸序列的多肽的核酸,所述氨基酸序列在如由以下组成的组中列出的分离的氨基酸序列的全长上具有至少70%序列同一性:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一个方面,核酸分子与表达控制序列可操作地连接,所述表达控制序列能够指导其在宿主细胞中的表达。在一个方面,载体可为质粒。在一个方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约80%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有至少约90%序列同一性。在另一方面,分离的氨基酸序列在分离的氨基酸序列的全长上具有约100%序列同一性。在一个方面,多肽能够将靶蛋白切割成片段。在一个特定方面,靶蛋白是igg。在另一方面,靶蛋白是融合蛋白。在又一方面,片段可包含fab片段和/或fc片段。[0098]在一个实施方案中,经分离的氨基酸可包含由seqidno.:1定义的亲本氨基酸序列,其在位置87、130、182和/或274处的天冬酰胺残基突变为除天冬酰胺以外的氨基酸。在一个方面,与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高。在另一方面,与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高50%。在一个方面,氨基酸可选自天冬氨酸、亮氨酸和精氨酸。在一个特定方面,位置87处的天冬酰胺残基突变为天冬氨酸残基。在另一方面,位置130处的天冬酰胺残基突变为精氨酸残基。在又一方面,位置182处的天冬酰胺残基突变为亮氨酸残基。在又一方面,位置274处的天冬酰胺残基突变为天冬氨酸残基。在又一方面,位置87和130处的天冬酰胺残基经突变。在又一方面,位置87和182处的天冬酰胺残基经突变。在又一方面,位置87和274处的天冬酰胺残基经突变。在又一方面,位置130和182处的天冬酰胺残基经突变。在又一方面,位置130和274处的天冬酰胺残基经突变。在又一方面,位置182和274处的天冬酰胺残基经突变。在又一方面,位置87、130和182处的天冬酰胺残基经突变。在又一方面,位置87、182和274处的天冬酰胺残基经突变。在又一方面,位置130、182和274处的天冬酰胺残基经突变。在又一方面,位置87、130、182和274处的天冬酰胺残基经突变。[0099]在一个相关实施方案中,本公开包括一种分离的核酸分子,其编码具有分离的氨基酸序列的多肽,所述氨基酸序列包含由seqidno.:1定义的亲本氨基酸序列,其在位置87、130、182和/或274处的天冬酰胺残基突变为除天冬酰胺以外的氨基酸—参见上文。与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高。[0100]在另一个相关实施方案中,本公开包括一种载体,其包含编码具有分离的氨基酸序列的多肽的核酸分子,所述氨基酸序列包含由seqidno.:1定义的亲本氨基酸序列,其在位置87、130、182和/或274处的天冬酰胺残基突变为除天冬酰胺以外的氨基酸—参见上文。与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高。在一个方面,核酸分子与表达控制序列可操作地连接,所述表达控制序列能够指导其在宿主细胞中的表达。在一个方面,载体可为质粒。[0101]基于亲和力的产生[0102]本公开还提供了使用亲和色谱在抗vegf蛋白产生期间减少宿主细胞蛋白以及其他不期望的蛋白质和核酸的方法。[0103]在一个实施方案中,产生重组蛋白的方法包括:(a)提供经基因工程化以表达目标重组蛋白的宿主细胞;(b)在所述宿主细胞表达所述目标重组蛋白的合适条件下培养所述宿主细胞;以及(c)收获由所述细胞产生的目标重组蛋白的制剂。在一个方面,目标重组蛋白是抗vegf蛋白。在一个特定方面,抗vegf蛋白选自由以下组成的组:阿柏西普、minitrap、重组minitrap(其实例在美国专利第7,279,159号中公开)、scfv和其他抗vegf蛋白。[0104]在本实施方案的一个方面,目标重组蛋白在合适的宿主细胞中表达。合适的宿主细胞的非限制性实例包括但不限于cho、chok1、ns0、sp2/0、胚胎肾细胞和bhk。[0105]在本实施方案的一个方面,目标重组蛋白在cdm中培养。合适的cdm包括杜尔贝科改良伊格尔(dme)培养基、汉氏营养混合物、excell培养基、ischo-cd培养基和cdm1b。本领域技术人员已知的其他cdm也涵盖在本发明的范围内。[0106]除了目标重组蛋白外,产生制剂还可包含至少一种污染物,包括一种或多种宿主细胞蛋白。所述至少一种污染物可源自细胞底物、细胞培养物或下游工艺。[0107]在一个实施方案中,本发明涉及使用亲和色谱从生物样品产生抗vegf蛋白的方法。在一个特定方面,本文所公开的方法可用于将抗vegf蛋白与一种或多种宿主细胞蛋白和在抗vegf蛋白的培养产生过程中形成的核酸(例如dna)至少部分地分离。[0108]在一个方面,所述方法可包括在合适的条件下对包含抗vegf蛋白以及伴随污染物的生物样品进行亲和色谱。在一个特定方面,亲和色谱可包含能够选择性或特异性地结合至抗vegf蛋白(“捕获”)的材料。此色谱材料的非限制性实例包括:蛋白a、蛋白g、包含例如能够结合至抗vegf蛋白的蛋白质的色谱材料以及包含fc结合蛋白的色谱材料。在一个具体方面,能够与抗vegf蛋白结合或相互作用的蛋白质可为抗体、融合蛋白或其片段。能够选择性或特异性地结合至抗vegf蛋白的此类材料的非限制性实例描述于实施例7中。[0109]在本实施方案的一个方面,所述方法可包括使包含抗vegf蛋白和一种或多种宿主细胞蛋白/污染物的生物样品在合适的条件下进行亲和色谱,其中亲和色谱固定相包含能够选择性或特异性地结合至抗vegf蛋白的蛋白质。在一个特定方面,蛋白质可为抗体、融合蛋白、scfv或抗体片段。在一个具体方面,蛋白质可为vegf165、vegf121、来自其他物种例如兔的vegf形式。例如,如表7-1和表7-10中所示例,使用vegf165作为能够选择性或特异性地与抗vegf蛋白结合或相互作用的蛋白质可成功地产生mt5(抗vegf蛋白)、阿柏西普和抗vegfscfv片段。在另一具体方面,蛋白质可为一种或多种具有如seqidno.:73-80中所示的氨基酸序列的蛋白质。表7-1还公开使用具有如seqidno.:73-80中所示的氨基酸序列的蛋白质作为能够选择性或特异性地结合至抗vegf蛋白(mt5)的蛋白质成功产生mt5。[0110]在本实施方案的一个方面,所述方法可包括使包含抗vegf蛋白和一种或多种宿主细胞蛋白/污染物的生物样品在合适的条件下进行亲和色谱,其中亲和色谱固定相包含能够选择性或特异性地与抗vegf蛋白结合或相互作用的蛋白质,其中抗vegf蛋白可选自阿柏西普、vegfminitrap或抗vegf抗体。在一个特定方面,vegfminitrap可获自vegf受体组分;此外,其可通过在宿主细胞中重组表达vegfminitrap而形成。执行所述方法可减少样品中一种或多种宿主细胞蛋白的量。例如,图35a和图35b显示在使用包含以下作为能够选择性或特异性地结合至mt5的不同蛋白质的五种不同亲和色谱柱时,包含mt5(抗vegf蛋白)的样品中的总宿主细胞蛋白的显著减少:(i)vegf165(seqidno.:72);(ii)mab1(小鼠抗vegfr1mab人类igg1,其中seqidno.:73是重链,而seqidno.:74是轻链);(iii)mab2(小鼠抗vegfr1mab人类igg1,其中seqidno.:75是重链,而seqidno.:76是轻链);(iv)mab3(小鼠抗vegfr1mab小鼠igg1,其中seqidno.:77是重链,而seqidno.:78是轻链)以及(v)mab4(小鼠抗vegfr1mab小鼠igg1,其中seqidno.:79是重链,而seqidno.:80是轻链)。如图35a和图35b所见,来自每个基于亲和力的产生过程的洗脱液将宿主细胞蛋白从7000ppm以上分别降至约25ppm和约55ppm。[0111]使用亲和色谱的合适条件可包括但不限于使用平衡缓冲液来平衡亲和色谱柱。在使用例如ph值为约8.3至约8.6的tris盐酸盐进行平衡后,将生物样品加载至亲和色谱柱上。加载柱后,可使用例如平衡缓冲液(例如杜尔贝科磷酸盐缓冲盐水(dpbs))将柱洗涤一次或多次。在洗脱柱之前,可使用其他洗涤,包括采用不同缓冲液的洗涤。柱洗脱可受到缓冲液类型以及ph值和电导率的影响,可采用本领域技术人员熟知的其他洗脱条件。使用一种或多种类型的洗脱缓冲液(例如,ph值为约2.0至约3.0的甘氨酸)进行洗脱后,可通过添加中和缓冲液(例如,ph7.5的1mtris)来中和洗脱级分。[0112]在实施方案的一个方面,洗涤缓冲液和平衡缓冲液的ph值均可为约7.0至约8.6。在实施方案的一个方面,洗涤缓冲液可为dpbs。在一个方面,洗脱缓冲液可包含100mm甘氨酸缓冲液,ph值为约2.5。在另一方面,洗脱缓冲液可为ph值为约2.0至约3.0的缓冲液。在一个方面,中和缓冲液可包含1mtris,ph值为约7.5。[0113]在本实施方案的一个方面,所述方法还可包括用洗涤缓冲液洗涤柱。在本实施方案的一个方面,所述方法还可包括用洗脱缓冲液洗脱柱以获得洗脱级分。在一个特定方面,与生物样品中的宿主细胞蛋白的量相比,洗脱级分中的宿主细胞蛋白的量显著减少,例如,减少了约70%、约80%、90%、约95%、约98%或约99%。[0114]本实施方案可包括不以特定顺序添加一个或多个步骤,例如疏水相互作用色谱、基于亲和力的色谱、多模式色谱、病毒灭活(例如,使用低ph值)、病毒过滤和/或超滤/渗滤。[0115]在一个方面,抗vegf蛋白的组合物的糖基化谱如下:约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约6%至约15%甘露糖-5和约60%至约79%半乳糖基化聚糖。[0116]在此实施方案的一个方面,抗vegf蛋白在约32.4%天冬酰胺123残基和/或约27.1%天冬酰胺196残基上具有man5糖基化。在一个特定实施方案中,抗vegf蛋白可为阿柏西普、抗vegf抗体或vegfminitrap。[0117]在一个实施方案中,所述方法还可包括使用药学上可接受的赋形剂配制原料药。在一个方面,药学上可接受的赋形剂可选自以下:水、缓冲剂、糖、盐、表面活性剂、氨基酸、多元醇、螯合剂、乳化剂和防腐剂。本领域技术人员熟知的其他赋形剂在此实施方案的范围内。[0118]在实施方案的一个方面,制剂可适于向人类受试者施用。在本实施方案的一个方面,可通过玻璃体内注射实现施用。在一个方面,制剂可具有约40至约200mg/ml目标蛋白质。在一个特定方面,目标蛋白质可为阿柏西普、抗vegf抗体或vegfminitrap。[0119]制剂可用于治疗或预防血管生成性眼部病症的方法中,所述病症可包括:年龄相关的黄斑变性(例如,湿性或干性)、黄斑水肿、视网膜静脉阻塞后的黄斑水肿、视网膜静脉阻塞(rvo)、视网膜中央静脉阻塞(crvo)、视网膜分支静脉阻塞(brvo)、糖尿病性黄斑水肿(dme)、脉络膜新生血管形成(cnv)、虹膜新生血管形成、新生血管性青光眼、青光眼手术后纤维化、增生性玻璃体视网膜病(pvr)、视盘新生血管形成、角膜新生血管形成、视网膜新生血管形成、玻璃体新生血管形成、角膜翳、翼状胬肉、血管性视网膜病、在患有糖尿病性黄斑水肿的受试者中的糖尿病性视网膜病;或糖尿病性视网膜病(例如非增生性糖尿病性视网膜病(例如,以约47或53的糖尿病性视网膜病严重程度量表(drss)分级为特征)或增生性糖尿病性视网膜病;例如,在不患有dme的受试者中)。[0120]氧代种类的合成[0121]本发明的一个实施方案涉及一种或多种使用光来合成被氧化的蛋白质种类的方法。在本实施方案的一个方面,目标蛋白质是抗vegf蛋白。在一个特定方面,抗vegf蛋白是阿柏西普。在另一方面,抗vegf蛋白是包括重组vegfminitrap的vegfminitrap。在本实施方案的又一个方面,抗vegf蛋白是单链可变片段(scfv)。[0122]在本实施方案的一个方面,样品包含目标蛋白质,例如阿柏西普融合蛋白,具有最少或没有氧代变体。对样品进行光应力处理以合成阿柏西普的氧化种类。在一个特定方面,通过使用冷白光对样品进行光应力处理。在另一个特定方面,通过使用紫外光对样品进行光应力处理。[0123]在实施方案的一个具体方面,将包含阿柏西普或另一种抗vegf蛋白的样品暴露于冷白光约30小时至约300小时,从而造成经修饰的寡肽增加约1.5至约50倍。这些肽经酶消化并分析,包含选自由以下组成的组的一者或多者:[0124]dkth*tc*ppc*papellg(seqidno.:17)、eiglltc*eatvngh*lyk(seqidno.:18)、qtntiidvvlspsh*gielsvgek(seqidno.:19)、telnvgidfnweypsskh*qhk(seqidno.:20)、tnylth*r(seqidno.:21)、sdtgrpfvemyseipeiih*mtegr(seqidno.:22)、vh*ekdk(seqidno.:23)、sdtgrpfvem*yseipeiihmtegr(seqidno.:64)、sdtgrpfvemyseipeiihm*tegr(seqidno.:65)、tqsgsem*k(seqidno.:66)、sdqglytc*aassglm*tk(seqidno.:67)、iiw*dsr/riiw*dsr/iiw*dsrk(seqidno.:28)、telnvgidfnw*eypssk(seqidno.:29)、gfiisnaty*k(seqidno.:69)、kf*pldtlipdgk(seqidno.:70)、f*lstltidgvtr(seqidno.:32),其中h*是被氧化为2-氧代-组氨酸的组氨酸,其中c*是被羧甲基化的半胱氨酸,其中m*是被氧化的甲硫氨酸,其中w*是被氧化的色氨酸,其中y*是被氧化的酪氨酸,并且其中f*是被氧化的苯丙氨酸。可通过之前提及的蛋白酶例如胰蛋白酶来进行消化。可使用质谱法来分析寡肽。[0125]在实施方案的一个具体方面,将包含阿柏西普或其他抗vegf蛋白的样品暴露于紫外光约4小时至约40小时,从而造成经修饰的寡肽产物增加约1.5至约25倍(在进行消化时获得),其中样品包含一种或多种选自由以下组成的组的经修饰的寡肽:[0126]dkth*tc*ppc*papellg(seqidno.:17)、eiglltc*eatvngh*lyk(seqidno.:18)、qtntiidvvlspsh*gielsvgek(seqidno.:19)、telnvgidfnweypsskh*qhk(seqidno.:20)、tnylth*r(seqidno.:21)、sdtgrpfvemyseipeiih*mtegr(seqidno.:22)、vh*ekdk(seqidno.:23)、sdtgrpfvem*yseipeiihmtegr(seqidno.:64)、sdtgrpfvemyseipeiihm*tegr(seqidno.:65)、tqsgsem*k(seqidno.:66)、sdqglytc*aassglm*tk(seqidno.:67)、iiw*dsr/riiw*dsr/iiw*dsrk(seqidno.:28)、telnvgidfnw*eypssk(seqidno.:29)、gfiisnaty*k(seqidno.:69)、kf*pldtlipdgk(seqidno.:70)、f*lstltidgvtr(seqidno.:32),其中h*是被氧化为2-氧代-组氨酸的组氨酸,其中c*是被羧甲基化的半胱氨酸,其中m*是被氧化的甲硫氨酸,其中w*是被氧化的色氨酸,其中y*是被氧化的酪氨酸,并且其中f*是被氧化的苯丙氨酸。可通过之前提及的蛋白酶例如胰蛋白酶来进行消化。可使用质谱法来分析寡肽。[0127]最小化黄棕色的方法[0128]本公开提供了在cdm中产生的阿柏西普、minitrap等的产生期间减少黄棕色着色的方法。[0129]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,接着收获包含目标重组蛋白的制剂。在一个方面,目标重组蛋白是抗vegf蛋白。在一个特定方面,抗vegf蛋白选自由以下组成的组:阿柏西普、minitrap、重组minitrap(其实例在美国专利第7,279,159号中公开,所述专利通过引用整体并入本文)、scfv和其他抗vegf蛋白。在一个方面,所述方法可产生目标重组蛋白的制剂,其中所述制剂的颜色使用欧洲by方法或cielab方法(b*)来表征。另外,可使用例如lc-ms分析氧代变体的存在。[0130]在本实施方案的一个方面,减弱条件包括提高或降低一种或多种培养基组分(例如,氨基酸、金属或抗氧化物,包括盐和前体)的累积浓度,其对应于颜色以及阿柏西普和vegfminitrap的蛋白质变体的减少。氨基酸的非限制性实例包括丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸。在一个特定方面,减少半胱氨酸可有效减弱制剂的黄棕色。半胱氨酸浓度也可影响氧代变体。[0131]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普,以及收获由细胞产生的目标蛋白质的制剂,其中合适的条件部分地通过将cdm中半胱氨酸的累积浓度降低至小于或等于约10mm而获得。合适的培养基的实例包括但不限于cdm1b、excell等。如本文所用,术语“累积量”是指在细胞培养过程中添加至生物反应器中以形成cdm的特定组分的总量,包括在培养开始时添加的组分的量(在第0天的cdm)和后续添加的组分的量。当计算组分的累积量时,还包括在生物反应器产生之前(即,在第0天的cdm之前)添加至种菌培养物或接种物中的组分的量。累积量不受培养过程中组分随时间损失(例如,经由代谢或化学降解)的影响。因此,具有相同累积量的组分的两种培养物可能仍具有不同绝对水平,例如,如果在不同时间将组分添加至两种培养物中(例如,如果在一种培养物中,所有组分均在开始时添加,而在另一种培养物中,组分是随时间的推移而添加)。累积量也不受培养过程中组分随时间的原位合成(例如,经由代谢或化学转化)的影响。因此,具有相同累积量的给定组分的两种培养物可能仍具有不同绝对水平,例如,如果组分为经由生物转化过程在两种培养物的一者中原位合成。累积量可以例如组分的克数或摩尔数为单位表示。[0132]如本文所用,术语“累积浓度”是指组分的累积量除以生产批次开始时生物反应器中液体的体积,包括培养物中使用的任何接种物对起始体积的贡献。例如,如果生物反应器在生产批次开始时含有2升细胞培养基,并且在第0、1、2和3天添加1克的组分x,则第3天之后的累积浓度为2g/l(即4克除以2升)。如果在第4天向生物反应器中添加另外一升不含组分x的液体,则累积浓度将保持为2g/l。如果在第5天,从生物反应器中损失一些液体(例如,经由蒸发),则累积浓度将保持为2g/l。累积浓度可以例如克/升或摩尔/升为单位表示。[0133]在此实施方案的一个方面,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白;收获由细胞产生的蛋白质的制剂,其中通过将累积半胱氨酸浓度与累积总氨基酸浓度的比率从约1:10至1:29降至约1:50至约1:30来获得合适的条件。[0134]在一个实施方案中,所述方法包括(i)在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普,以及(ii)收获由细胞产生的目标重组蛋白的制剂,其中通过将cdm中的铁累积浓度降至小于约55.0μm来获得合适的条件。在此实施方案的一个方面,与通过其中cdm中的铁累积浓度大于约55.0μm的方法获得的制剂相比,通过此方法获得的制剂显示较弱的黄棕色。[0135]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普。所述方法还包括收获由细胞产生的目标重组蛋白的制剂,其中通过将cdm中的铜累积浓度降至小于或等于约0.8μm来获得合适的条件。在此实施方案的一个方面,与通过其中cdm中的铜累积浓度大于约0.8μm的方法获得的制剂相比,通过此方法获得的制剂显示较弱的黄棕色。[0136]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普;以及收获由细胞产生的目标重组蛋白的制剂,其中通过将cdm中的镍累积浓度降至小于或等于约0.40μm来获得合适的条件。在此实施方案的一个方面,与通过其中cdm中的镍累积浓度大于约0.40μm的方法获得的制剂相比,通过此方法获得的制剂显示较弱的黄棕色。[0137]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普。所述方法还包括收获由细胞产生的目标重组蛋白的制剂,其中通过将cdm中的锌累积浓度降至小于或等于约56μm来获得合适的条件。在此实施方案的一个方面,与通过其中cdm中的锌累积浓度大于约56μm的方法获得的制剂相比,通过此方法获得的制剂显示较弱的黄棕色。[0138]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普。所述方法还包括收获由细胞产生的目标重组蛋白的制剂,其中通过在cdm中针对单一抗氧化剂存在累积浓度约0.001mm至约10mm的抗氧化剂和如果在所述cdm中添加多种抗氧化剂则不大于约30mm的累积浓度来获得合适的条件。在此实施方案的一个方面,与通过其中在cdm中不存在累积浓度小于约0.01mm或大于约100mm的抗氧化剂的方法获得的制剂相比,通过此方法获得的制剂显示较弱的黄棕色。抗氧化剂的非限制性实例可为牛磺酸、次牛磺酸、甘氨酸、硫辛酸、谷胱甘肽、氯化胆碱、氢皮质酮、维生素c、维生素e、螯合剂、过氧化氢酶、s-羧甲基-l-半胱氨酸及其组合。螯合剂的非限制性实例包括金精三羧酸(ata)、去铁胺(dfo)、edta和柠檬酸盐。[0139]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普。所述方法还包括收获由细胞产生的目标重组蛋白的制剂,其中合适的条件包括具有以下的cdm:在所述cdm中小于约55μm的铁累积浓度;在所述cdm中小于或等于约0.8μm的铜累积浓度;在所述cdm中小于或等于约0.40μm的镍累积浓度;在所述cdm中小于或等于约56μm的锌累积浓度;在所述cdm中小于10mm的半胱氨酸累积浓度;和/或在所述cdm中对于单一抗氧化剂来说浓度为约0.001mm至约10mm的抗氧化剂和如果在所述cdm中添加多种抗氧化剂,则不大于约30mm的累积浓度。[0140]在本实施方案的一个方面,使用合适的条件获得的制剂造成阿柏西普和vegfminitrap的蛋白质变体减少至所需量的阿柏西普和vegfminitrap的蛋白质变体(称为阿柏西普和vegfminitrap的蛋白质变体的“目标值”)。在此实施方案的另一个方面,使用合适的条件获得的制剂造成当包括阿柏西普和vegfminitrap的变体的蛋白质制剂被归一化为5g/l或10g/l的浓度时,制剂的颜色减小至所需b*值或by值(分别称为“目标b*值”、“目标by值”)。在本实施方案的又一个方面,目标b*值(或目标by值)和/或变体的目标值可在效价增加或不明显减小的制剂中获得。[0141]当结合以下描述和附图考虑时,将更好地领会和理解本发明的这些和其他方面。以下描述虽然指示各种实施方案及其许多特定细节,但是借助于说明而非限制方式给出。可在本发明的范围内进行许多替代、修改、增加或重新布置。附图说明[0142]图1描绘使用一个示例性实施方案产生的vegfminitrap,其包括vegfr1(seqidno.:34)、vegfr2(seqidno.:36)、铰链结构域片段(seqidno.:60)和从阿柏西普切下的fc片段(seqidno.:55)。[0143]图2描绘所提出的组氨酸氧化为2-氧代-组氨酸(14da)的机制。[0144]图3描绘所提出的组氨酸氧化为2-氧代-组氨酸(16da)的机制。[0145]图4描绘所提出的色氨酸氧化为n-甲酰犬尿氨酸和犬尿氨酸的机制。[0146]图5描绘用于产生阿柏西普的一个示例性实施方案。[0147]图6描绘用于产生vegfminitrap的一个示例性实施方案。[0148]图7描绘用于产生阿柏西普的一个示例性实施方案。[0149]图8描绘用于产生vegfminitrap的一个示例性实施方案。[0150]图9描绘作为一个示例性实施方案计算得出的by标准对比所计算的b*值的图表。[0151]图10描绘为评估来自蛋白酶消化的aex加载液和流通液的寡肽(包括还原和烷化阿柏西普的片段(seqidno.:55))中的2-氧代-组氨酸和色氨酸的氧化百分比(其中下划线表示残基的氧化)而进行的实验的结果。[0152]图11描绘由使用来自蛋白酶消化的aex加载液和流通液的寡肽(包括阿柏西普的片段(seqidno.:55))进行的肽作图分析(其中下划线表示肽序列中残基的氧化)所识别的肽的相对丰度。[0153]图12a描绘在350nm处mt4和mt1的吸光度对时间(分钟)的色谱图的全视图。[0154]图12b描绘在350nm处mt4和mt1(包括seqidno.:21和28)的吸光度对时间(16-30分钟)的色谱图的展开视图。[0155]图12c描绘在350nm处mt4和mt1(包括seqidno.:17、18、19、20)的吸光度对时间(30-75分钟)的色谱图的展开视图。[0156]图13描绘为评估来自已通过aex色谱处理的蛋白酶消化的mt1的寡肽和来自已由aex色谱汽提的蛋白酶消化的mt1的寡肽(包括seqidno.:17、18、19、20、21、28)中的2-氧代-组氨酸(和色氨酸二氧化)百分比而进行的实验的结果。[0157]图14描绘为比较mt1的不同产生批次中存在的酸性种类和在进行强阳离子交换(cex)色谱时获得的酸性级分而进行的实验的结果,包括seqidno.:17、18、19、20、21、28。[0158]图15描绘使用强阳离子交换色谱富集细胞培养物收获物样品中存在的酸性种类和其他变体的示例性方法。[0159]图16描绘根据一个示例性实施方案来自进行强阳离子交换色谱的级分。[0160]图17描绘使用双重盐-ph梯度针对经历cex的mt1产生(在任何生产程序之前,≤by3)和针对去唾液酸化minitrap(dsmt1)的富集变体根据一个示例性实施方案进行的强阳离子交换色谱图。[0161]图18a描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对未分级分离的亲本对照的3d色谱图。[0162]图18b描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分1(代表实验的一些拖尾特征)的3d色谱图。[0163]图18c描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分2特征的3d色谱图。[0164]图18d描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分3特征的3d色谱图。[0165]图18e描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分4特征的3d色谱图。[0166]图18f描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分5特征的3d色谱图。[0167]图18g描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分6特征的3d色谱图。[0168]图18h描绘根据一个示例性实施方案通过强阳离子交换色谱进行的针对mt1级分7特征的3d色谱图。[0169]图19描绘根据用于mt1产生的一个示例性实施方案进行的成像毛细管等电聚焦(icief)电泳图。[0170]图20描绘mt1冷白光或uva光的暴露与被氧化的氨基酸残基的出现(包括seqidno.:17、18、19、20、21、28、29和83)相关联的研究的结果。[0171]图21描绘根据一个示例性实施方案具有~350nm的吸光度(参见,例如圆圈突出显示~350nm)的经cwl应力处理的mt1的3dsec-pda(与光电二极管阵列检测耦合的尺寸排阻色谱)色谱图,其中a显示t=0时的色谱图,b显示在0.5xich处的色谱图,c显示在2.0xich处的色谱图,并且d显示由cwl在不同时间间隔下进行应力处理的小瓶(归一化为80mg/ml)中的mt1图像。[0172]图22描绘根据一个示例性实施方案具有~350nm的吸光度(参见,例如圆圈突出显示~350nm)的经uva应力处理的mt1的3dsec-pda色谱图,其中a显示t=0时的色谱图,b显示在0.5xich处的色谱图,c显示在2.0xich处的色谱图,并且d显示由uva在不同时间间隔下进行应力处理的小瓶(归一化为80mg/ml)中的mt1图像。[0173]图23a描绘从使用cwl进行应力处理的样品的sec-pda色谱图中定量得到的a320/280吸光度比(上图)并且图23b描绘使用cwl进行应力处理的样品中的尺寸变体的a320/280吸光度比的图表(下图),其中根据一个示例性实施方案对样品进行应力处理。[0174]图24a描绘从使用uva进行应力处理的样品的sec-pda色谱图中定量得到的a320/280吸光度比(上图)并且图24b描绘使用uva进行应力处理的样品中的尺寸变体的a320/280吸光度比的图表(下图),其中根据一个示例性实施方案对样品进行应力处理。[0175]图25a描绘将各种组分与阿柏西普一起温育对颜色产生(ciel*,a*,b*预测的b值)的影响的按比例估算值;并且图25b描绘实际b值相对于预测b值的图。[0176]图26描绘包含低半胱胺酸和低金属的cdm对阿柏西普效价(a)、活细胞浓度(b)、生存力(c)、氨(d)和重量渗透压摩尔浓度(e)的影响。[0177]图27是显示根据一个示例性实施方案随着金属和半胱氨酸浓度的增加/减少,收获物颜色的预测曲线的图表(视为第13天b*值)。[0178]图28(a-b)描绘将各种组分与阿柏西普在废cdm中一起温育对颜色产生(ciel*,a*,b*预测的b值)的影响(a);和对b值的按比例预测的影响的图(b)。[0179]图28c描绘在振荡瓶培养中将各种组分与阿柏西普在cdm中一起温育对颜色产生(ciel*,a*,b*预测的b值)的按比例估算的影响。[0180]图28d描绘将次牛磺酸和甲磺酸去铁胺盐(dfo)与阿柏西普在废cdm中一起温育对颜色产生(ciel*,a*,b*预测的“b”值)的影响。[0181]图28e描绘来自振荡瓶培养的各种组分与阿柏西普个别温育对颜色产生(ciel*,a*,b*预测的“b”值)的影响。[0182]图29是显示在cdm中添加尿苷、锰、半乳糖和地塞米松对所产生的阿柏西普的产生效价的影响的图表。[0183]图30是显示在cdm中添加尿苷、锰、半乳糖和地塞米松对表达阿柏西普的细胞的生存力的影响的图表,其中产生了阿柏西普。[0184]图31是显示在cdm中添加尿苷、锰、半乳糖和地塞米松对表达阿柏西普的细胞的活细胞计数的影响的图表,其中产生了阿柏西普。[0185]图32是显示使用来自cygnus3g(f550)的标准宿主细胞蛋白溶液所制备的吸光度对宿主细胞蛋白浓度(ng/ml)的标准曲线的图表。[0186]图33是使用非还原sds-page样品缓冲液进行的sds-page分析的图像。[0187]图34是使用还原sds-page样品缓冲液进行的sds-page分析的图像。[0188]图35a是在加载溶液、分别从包含vegf165、mab1和mab2的亲和色谱柱1-3洗脱的级分中检测到的总宿主细胞蛋白的图表。[0189]图35b是在加载溶液、分别从包含vegf165、mab1、mab3和mab4的亲和色谱柱1、2、4和5洗脱的级分中检测到的总宿主细胞蛋白的图表。[0190]图36描绘在进行亲和色谱产生之前a和之后bvegfminitrap的sec谱。[0191]图37描绘vegfminitrap至vegf165的动力学研究的草图表示,其中所研究的vegfminitrap构建体来自根据一些示例性实施方案进行亲和色谱产生之前和之后。[0192]图38描绘vegfminitrap至vegf165的动力学研究的spr传感图,其中所研究的vegfminitrap构建体来自根据一些示例性实施方案进行亲和色谱产生之前和之后。[0193]图39是在加载溶液、从重复用于包含vegf165、mab1和mab2的柱的亲和色谱柱洗脱的级分中检测到的总宿主细胞蛋白的图表。[0194]图40描绘根据一个示例性实施方案的vegfminitrapmt1(seqidno.:46)的结构。[0195]图41描绘根据一个示例性实施方案的vegfminitrapmt6(seqidno.:51)的结构。[0196]图42描绘mt1、mt5和mt6的天然sec-ms分析的相对吸光度对时间(分钟)的总离子色谱图(tic),以及来自tic的低分子量区域的放大视图。[0197]图43描绘mt1和mt5主峰的去卷积质谱,以通过阐明一些ptm来证实minitrap二聚体身份。[0198]图44描绘mt6主峰的去卷积质谱,以通过阐明一些ptm来证实单链minitrap身份。[0199]图45a描绘在mt1中的低分子量杂质的相对吸光度对时间(分钟)的图表。[0200]图45b描绘在mt1中的低分子量杂质的质谱。[0201]图46描绘mt1的相对吸光度对时间(分钟)的图,其显示不存在用于将阿柏西普切割成mt1的fabricator酶。[0202]图47描绘mt5中的低分子量杂质的相对吸光度对时间(分钟)的图。[0203]图48描绘mt6中的低分子量杂质的相对吸光度对时间(分钟)的图。[0204]图49a描绘在对vegfminitrapmt6执行hilic-uv/ms时获得的吸光度对时间(分钟)的图表,其中所述图表显示在21分钟时主峰的洗脱和在21.5分钟左右时o-聚糖的洗脱。[0205]图49b描绘对vegfminitrapmt6执行hilic-uv/ms时获得的质谱,其显示在47985.8da处的主峰。[0206]图49c描绘在进行hilic-uv/ms时获得的vegfminitrapmt6的o-聚糖的质谱。[0207]图50是vegfminitrap二聚体的图像,其中vegfminitrap的铰链区(seqidno.:83)中的二硫桥可平行或交叉。[0208]图51描绘在mt1、mt5和mt6中在asn36(包括seqidno.:100)处观察到的聚糖分布的相对丰度。[0209]图52描绘在mt1、mt5和mt6中在asn68(包括seqidno.:101)处观察到的聚糖分布的相对丰度。[0210]图53描绘在mt1、mt5和mt6中在asn123(包括seqidno.:102)处观察到的聚糖分布的相对丰度。[0211]图54描绘在mt1、mt5和mt6中在asn196(包括seqidno.:103)处观察到的聚糖分布的相对丰度。[0212]图55描绘通过亲水相互作用色谱(hilic)与荧光检测和质谱分析(全标度和叠加式)耦合得到的释放的n-连接的聚糖分析。[0213]图56描绘mt1、mt5和mt6的hilic-flr色谱图。[0214]图57描绘通过hilic与荧光检测和质谱分析(全标度、叠加式和归一化)耦合得到的释放的n-连接的聚糖分析。[0215]图58a是来自vegfminitrap样品mt1、mt5和mt6的详细聚糖识别和定量的表。[0216]图58b是来自vegfminitrap样品mt1、mt5和mt6的详细聚糖识别和定量的表。[0217]图58c是来自vegfminitrap样品mt1、mt5和mt6的详细聚糖识别和定量的表。[0218]图59描绘根据一个示例性实施方案制造minitrap的示例性生产程序。具体实施方式[0219]血管生成是由先前存在的脉管系统生长新血管,是高度协调的过程,其对于正常的胚胎和产后血管发育至关重要。异常或病理性血管生成是癌症和若干种视网膜疾病的标志,在此类疾病中,促血管生成因子(例如血管内皮生长因子(vegf))的上调导致内皮增生增加、脉管系统形态改变和血管通透性增加。在患有各种眼病的患者的玻璃体液和视网膜脉管系统中发现水平升高的vegf。阻断vegf活性还已成为治疗dme、湿性amd、cnv、视网膜静脉阻塞和其中异常血管生成是潜在病因的其他眼病的首选疗法。[0220]如本文所用,阿柏西普是一种所述抗vegf蛋白,其包含全人类氨基酸序列,所述序列包含人类vegfr1的第二ig结构域和人类vegfr2的第三ig结构域,表达为与人类igg1的(fc)的内联融合物(inlinefusion)。阿柏西普结合所有形式的vegf-a(vegf),但另外结合plgf和vegf-b。几种其他同型二聚vegfminitrap已作为阿柏西普的酶切产物产生或直接由宿主细胞系重组表达。vegfminitrap的一个此种实例示于图1中。在此图中,描绘末端赖氨酸(k),一些培养过程去除此末端赖氨酸,而另一些则没有。图1示出保留末端赖氨酸的过程。通常,阿柏西普涵盖末端赖氨酸的存在和不存在。[0221]如本文所证明,本发明部分公开使用cdm产生抗vegf蛋白(实施例1)。包含使用某些cdm产生的阿柏西普的溶液的分析显示出一定颜色特性,例如强烈的黄棕色。溶液颜色的强度取决于所用的cdm。在将溶液归一化至5g/l的浓度后,并非所有检查的cdm均产生具有明显黄棕色的样品。[0222]在可注射的治疗药物溶液中的颜色(例如黄棕色)可为不期望的特征。其可为用于确定药品是否满足特定治疗剂的预定纯度和质量水平的重要参数。在生物制剂的制造过程中观察到的颜色(例如黄棕色)可能是由于所述生物制剂的化学修饰、制剂赋形剂的降解产物或经由生物制剂和制剂赋形剂的反应而形成的降解产物引起。然而,所述信息对于理解颜色变化的原因可能有价值。其还可帮助设计短期以及长期储存条件,以防止促成这种颜色变化的修饰。[0223]本发明人观察到,在抗vegf蛋白溶液产生期间使用aex使黄棕色着色最小化。另外,本发明人发现可通过修饰用于产生重组蛋白,例如阿柏西普或经修饰的阿柏西普如minitrap的细胞培养物来减少黄棕色着色。[0224]本发明涵盖抗vegf蛋白和使用cdm产生所述抗vegf蛋白。另外,本发明是基于用于蛋白质产生的上游和下游工艺技术的识别和优化。[0225]如本文所证明,以下列出的一些实施例描述抗vegf蛋白的产生(实施例1)、抗vegf蛋白的经氧化种类的产生(实施例4)、通过优化培养基(实施例5)和通过优化产生方法(实施例2)来减少抗vegf蛋白的氧化种类的方法。[0226]许多近期的专利申请和授权专利旨在描述各种阿柏西普种类及其产生方法,但没有一者描述或提出本文所述的抗vegf组合物及其产生方法。参见例如coherusbiosciencesinc.的美国申请第16/566,847号、samchundangpharm.co.,ltd.的美国专利第10,646,546号、formyconag的美国专利第10,576,128号、amgeninc.的国际申请第pct/us2020/015659号以及momentapharmaceuticals,inc.的美国专利第8,956,830号;第9,217,168号;第9,487,810号;第9,663,810号;第9,926,583号;和第10,144,944号。[0227]i.所选术语的解释[0228]除非另有描述,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。与熟练技术人员已知的本文所述的那些类似或等同的方法和材料可用于实施本文所述的特定实施方案。所提及的所有出版物特此通过引用整体并入。[0229]术语“一”应理解是指代“至少一”,并且术语“约”和“近似”应理解为允许标准偏差,如普通本领域技术人员所理解,并且在提供范围的情况下,包括端点。[0230]如本文所用,术语“血管生成性眼部病症”是指由血管的生长或增生或由血管渗漏引起或与其相关的任何眼部疾病。[0231]如本文所用,术语“化学成分确定的培养基(chemicallydefinedmedium)”或“化学成分确定的培养基(chemicallydefinedmedia)”(均缩写是“cdm”)是指其中所有成分的身份和浓度确定的合成生长培养基。化学成分确定的培养基不含细菌、酵母、动物或植物提取物、动物血清或血浆,尽管可添加单个植物或动物衍生的组分(例如蛋白质、多肽等)。化学成分确定的培养基可含有支持生长所需的无机盐,例如磷酸盐、硫酸盐等。碳源经确定,并且通常是糖,例如葡萄糖、乳糖、半乳糖等,或其他化合物,例如甘油、乳酸盐、乙酸盐等。尽管某些化学成分确定的培养基还使用磷酸盐作为缓冲液,但可使用其他缓冲液,例如碳酸氢钠、hepes、柠檬酸盐、三乙醇胺等。市售的化学成分确定的培养基的实例包括但不限于各种杜尔贝科改良伊格尔(dme)培养基(sigma-aldrichco;safcbiosciences,inc.)、汉氏营养混合物(sigma-aldrichco;safcbiosciences,inc.)、各种ex-cells培养基(sigma-aldrichco;safcbiosciences,inc.)、各种ischo-cd培养基(fujifilmirvinescientific)、其组合等。制备化学成分确定的培养基的方法是本领域中已知的,例如在美国专利第6,171,825号和第6,936,441号、wo2007/077217和美国专利申请公开案第2008/0009040号和第2007/0212770号,其全部教导都通过引用并入本文。[0232]如本文所用,术语“累积量”是指在细胞培养过程中添加至生物反应器中以形成cdm的特定组分的总量,包括在培养开始时添加的组分的量(在第0天的cdm)和后续添加的组分的量。当计算组分的累积量时,还包括在生物反应器产生之前(即,在第0天的cdm之前)添加至种菌培养物或接种物中的组分的量。累积量不受培养过程中组分随时间损失(例如,经由代谢或化学降解)的影响。因此,具有相同累积量的组分的两种培养物可能仍具有不同绝对水平,例如,如果在不同时间将组分添加至两种培养物中(例如,如果在一种培养物中,所有组分均在开始时添加,而在另一种培养物中,组分是随时间的推移而添加)。累积量也不受培养过程中组分随时间的原位合成(例如,经由代谢或化学转化)的影响。因此,具有相同累积量的给定组分的两种培养物可能仍具有不同绝对水平,例如,如果组分是经由生物转化过程在两种培养物的一种中原位合成。累积量可以例如组分的克数或摩尔数为单位表示。[0233]如本文所用,术语“累积浓度”是指组分的累积量除以生产批次开始时生物反应器中液体的体积,包括培养物中使用的任何接种物对起始体积的贡献。例如,如果生物反应器在生产批次开始时包含2升细胞培养基,并且在第0、1、2和3天添加1克的组分x,则第3天之后的累积浓度为2g/l(即4克除以2升)。如果在第4天将另外1升不含组分x的液体添加至生物反应器中,则累积浓度将保持为2g/l。如果在第5天从生物反应器中损失一些液体(例如经由蒸发),则累积浓度将保持为2g/l。累积浓度可以例如克/升或摩尔/升为单位表示。[0234]如本文所用,术语“制剂”是指与一种或多种药学上可接受的媒介物一起配制的目标蛋白质。在一个方面,目标蛋白质是阿柏西普和/或minitrap。在一些示例性实施方案中,制剂中目标蛋白质的量可在约0.01mg/ml至约600mg/ml的范围内。在一些特定实施方案中,制剂中目标蛋白质的量可为约0.01mg/ml、约0.02mg/ml、约0.03mg/ml、约0.04mg/ml、约0.05mg/ml、约0.06mg/ml、约0.07mg/ml、约0.08mg/ml、约0.09mg/ml、约0.1mg/ml、约0.2mg/ml、约0.3mg/ml、约0.4mg/ml、约0.5mg/ml、约0.6mg/ml、约0.7mg/ml、约0.8mg/ml、约0.9mg/ml、约1mg/ml、约2mg/ml、约3mg/ml、约4mg/ml、约5mg/ml、约6mg/ml、约7mg/ml、约8mg/ml、约9mg/ml、约10mg/ml、约15mg/ml、约20mg/ml、约25mg/ml、约30mg/ml、约35mg/ml、约40mg/ml、约45mg/ml、约50mg/ml、约55mg/ml、约60mg/ml、约65mg/ml、约70mg/ml、约5mg/ml、约80mg/ml、约85mg/ml、约90mg/ml、约100mg/ml、约110mg/ml、约120mg/ml、约130mg/ml、约140mg/ml、约150mg/ml、约160mg/ml、约170mg/ml、约180mg/ml、约190mg/ml、约200mg/ml、约225mg/ml、约250mg/ml、约275mg/ml、约300mg/ml、约325mg/ml、约350mg/ml、约375mg/ml、约400mg/ml、约425mg/ml、约450mg/ml、约475mg/ml、约500mg/ml、约525mg/ml、约550mg/ml、约575mg/ml或约600mg/ml。在一些示例性实施方案中,组合物的ph值可大于约5.0。在一个示例性实施方案中,ph值可大于约5.0、大于约5.5、大于约6、大于约6.5、大于约7、大于约7.5、大于约8或大于约8.5。[0235]如本文所用,术语“数据库”是指生物信息学工具,其提供针对数据库中所有可能序列搜寻未解释的ms-ms谱的可能性。此类工具的非限制性实例是mascot(http://www.matrixscience.com)、spectrummill(http://www.chem.agilent.com)、plgs(http://www.waters.com)、peaks(http://www.bioinformaticssolutions.com)、proteinpilot(http://download.appliedbiosystems.com//proteinpilot)、phenyx(http://www.phenyx-ms.com)、sorcerer(http://www.sagenresearch.com)、omssa(http://www.pubchem.ncbi.nlm.nih.gov/omssa/)、x!tandem(http://www.thegpm.org/tandem/)、proteinprospector(http://www.http://prospector.ucsf.edu/prospector/mshome.htm)、byonic(https://www.proteinmetrics.com/products/byonic)或sequest(http://fields.scripps.edu/sequest)。[0236]如本文所用,术语“超滤”或“uf”可包括类似于逆渗透的膜过滤过程,其使用静水压力迫使水通过半透膜。超滤详细描述于:leosj.zeman和andrewl.zydney,microfiltrationandultrafiltration:principlesandapplications(1996)中,其全部教导并入本文。孔径小于0.1μm的过滤器可用于超滤。通过使用具有如此小孔径的过滤器,可经由使样品缓冲液渗透穿过过滤器而将蛋白质保留在过滤器后面来减少样品的体积。[0237]如本文所用,“渗滤”或“df”可包括使用超滤器去除和交换盐、糖和非水溶剂;将游离种类与结合种类分离;去除低分子量材料和/或引起离子和/或ph环境的快速变化的方法。通过以近似等于超滤速率的速率向经超滤的溶液中添加溶剂,可最有效地去除微溶质。由此从溶液中以恒定体积洗涤微种。在本发明的某些示例性实施方案中,可使用渗滤步骤来交换用于本发明的各种缓冲液,例如,在色谱或其他产生步骤之前,以及从蛋白质制剂中去除杂质。如本文所用,术语“下游工艺技术”是指在上游工艺技术之后用于产生蛋白质的一种或多种技术。下游工艺技术包括例如使用以下方法产生蛋白质产物:例如,亲和色谱,包括蛋白a亲和色谱以及使用固相的亲和色谱,所述固相具有明确限定的分子如vegf,其可与其同源物如vegf受体(vegfr)相互作用;离子交换色谱,例如阴离子或阳离子交换色谱;疏水相互作用色谱或置换色谱。[0238]短语“重组宿主细胞”(或简称为“宿主细胞”)包括已引入编码目标蛋白质的重组表达载体的细胞。应理解,此术语旨在不仅指特定主题细胞,而且指这种细胞的子代。因为由于突变或环境影响,某些修饰可能在后代中发生,所以所述子代实际上可与亲本细胞不同,但仍包括于如本文所用的术语“宿主细胞”的范围内。在一个实施方案中,宿主细胞包括选自任何生命王国的原核和真核细胞。在一个方面,真核细胞包括原生生物、真菌、植物和动物细胞。在另一方面,宿主细胞包括真核细胞,例如植物和/或动物细胞。细胞可为哺乳动物细胞、鱼类细胞、昆虫细胞、两栖类细胞或禽类细胞。在一个特定方面,宿主细胞是哺乳动物细胞。适于在培养物中生长的广泛多种哺乳动物细胞系可获自例如美国菌种保藏中心(manassas,va.)和其他寄存处以及商业供应商。可用于本发明的工艺中的细胞包括但不限于mk2.7细胞、per-c6细胞、中国仓鼠卵巢细胞(cho)例如cho-k1(atccccl-61)、dg44(chasin等人,1986,som.cellmolec.genet.,12:555-556;kolkekar等人,1997,biochemistry,36:10901-10909;和wo01/92337a2)、二氢叶酸还原酶阴性cho细胞(cho/-dhfr,urlaub和chasin,1980,proc.natl.acad.sci.usa,77:4216)和dp12.cho细胞(美国专利第5,721,121号);猴肾细胞(cv1,atccccl-70);由sv40转化的猴肾cv1细胞(cos细胞,cos-7,atcccrl-1651);hek293细胞和sp2/0细胞、5l8杂交瘤细胞、daudi细胞、el4细胞、hela细胞、hl-60细胞、k562细胞、jurkat细胞、thp-1细胞、sp2/0细胞、原代上皮细胞(例如角质细胞、宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾上皮细胞和视网膜上皮细胞)以及已建立的细胞系及其品系(例如人类胚胎肾细胞(例如293细胞或被亚克隆以便在悬浮培养中生长的293细胞,graham等人,1977,j.gen.virol.,36:59);幼仓鼠肾细胞(bhk,atccccl-10);小鼠足细胞(tm4,mather,1980,biol.reprod.,23:243-251);人类宫颈癌细胞(hela,atccccl-2);犬肾细胞(mdck,atccccl-34);人类肺细胞(w138,atccccl-75);人类肝癌细胞(hep-g2,hb8065);小鼠乳腺肿瘤细胞(mmt060562,atccccl-51);水牛鼠肝细胞(brl3a,atcccrl-1442);tri细胞(mather,1982,annalsnyacad.sci.,383:44-68);mcr5细胞;fs4细胞;per-c6视网膜细胞、mdbk(nbl-1)细胞、911细胞、crfk细胞、mdck细胞、bewo细胞、chang细胞、detroit562细胞、hela229细胞、helas3细胞、hep-2细胞、kb细胞、ls180细胞、ls174t细胞、nci-h-548细胞、rpmi2650细胞、sw-13细胞、t24细胞、wi-28va13,2ra细胞、wish细胞、bs-c-i细胞、llc-mk2细胞、克隆m-3细胞、1-10细胞、rag细胞、tcmk-1细胞、y-1细胞、llc-pk1细胞、pk(15)细胞、gh1细胞、gh3细胞、l2细胞、llc-rc256细胞、mh1c1细胞、xc细胞、mdok细胞、vsw细胞和th-i,b1细胞或其衍生物);来自任何组织或器官(包括但不限于心脏、肝脏、肾脏、结肠、肠、食道、胃、神经组织(脑、脊髓)、肺、血管组织(动脉、静脉、毛细血管)、淋巴组织(淋巴腺、腺样体、扁桃体、骨髓和血液)、脾脏)的成纤维细胞、以及成纤维细胞和成纤维细胞样细胞系(例如,trg-2细胞、imr-33细胞、don细胞、ghk-21细胞、瓜氨酸血症细胞、dempsey细胞、detroit551细胞、detroit510细胞、detroit525细胞、detroit529细胞、detroit532细胞、detroit539细胞、detroit548细胞、detroit573细胞、hel299细胞、imr-90细胞、mrc-5细胞、wi-38细胞、wi-26细胞、micl1细胞、cv-1细胞、cos-1细胞、cos-3细胞、cos-7细胞、非洲绿猴肾细胞(vero-76,atcccrl-1587;vero,atccccl-81);dbs-frhl-2细胞、balb/3t3细胞、f9细胞、sv-t2细胞、m-msv-balb/3t3细胞、k-balb细胞、blo-11细胞、nor-10细胞、c3h/ioti/2细胞、hsdm1c3细胞、kln205细胞、mccoy细胞、小鼠l细胞、品系2071(小鼠l)细胞、l-m品系(小鼠l)细胞、l-mtk(小鼠l)细胞、nctc克隆2472和2555、scc-psa1细胞、swiss/3t3细胞、印度黄麂细胞(indianmuntaccell)、sirc细胞、cii细胞和jensen细胞、或其衍生物)或本领域技术人员已知的任何其他细胞类型。[0239]如本文所用,术语“宿主细胞蛋白”(hcp)包括源自宿主细胞的蛋白,并且可与所需的目标蛋白无关。宿主细胞蛋白可为过程相关的杂质,其可来源于制造过程,并且可包括三个主要类别:细胞底物来源、细胞培养来源和下游来源。细胞底物来源的杂质包括但不限于来源于宿主生物的蛋白质和核酸(宿主细胞基因组、载体或总dna)。细胞培养来源的杂质包括但不限于诱导剂、抗生素、血清和其他培养基组分。下游来源的杂质包括但不限于酶、化学和生化处理试剂(例如,溴化氰、胍、氧化剂和还原剂)、无机盐(例如,重金属、砷、非金属离子)、溶剂、载剂、配体(例如单克隆抗体)和其他可浸出物。[0240]在一些示例性实施方案中,宿主细胞蛋白可具有在约4.5至约9.0范围内的pi。在一个示例性实施方案中,pi可为约4.5、约5.0、约5.5、约5.6、约5.7、约5.8、约5.9、约6.0、约6.1、约6.2、约6.3、约6.4、约6.5、约6.6、约6.7、约6.8、约6.9、约7.0、约7.1、约7.2、约7.3、约7.4、约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4、约8.5、约8.6、约8.7、约8.8、约8.9或约9.0。[0241]如本文所用,术语“水解剂”是指可进行蛋白质消化的大量不同试剂中的任何一种或组合。可进行酶消化的水解剂的非限制性实例包括来自佐氏曲霉的蛋白酶、弹性蛋白酶、枯草杆菌蛋白酶、蛋白酶xiii、胃蛋白酶、胰蛋白酶、tryp-n、胰凝乳蛋白酶、曲霉菌胃蛋白酶i、lysn蛋白酶(lys-n)、lysc胞内蛋白酶(lys-c)、胞内蛋白酶asp-n(asp-n)、胞内蛋白酶arg-c(arg-c)、胞内蛋白酶glu-c(glu-c)或外膜蛋白t(ompt)、酿脓链球菌的免疫球蛋白降解酶(ides)、嗜热菌蛋白酶、木瓜蛋白酶、链霉蛋白酶、v8蛋白酶或其生物活性片段或同源物或其组合。可进行非酶消化的水解剂的非限制性实例包括使用高温、微波、超声波、高压、红外、溶剂(非限制性实例是乙醇和乙腈)、固定化酶消化(imer)、磁粒固定化酶和芯片上固定化酶。有关论述可用的蛋白质消化技术的最新综述,参见switzar等人,“proteindigestion:anoverviewoftheavailabletechniquesandrecentdevelopments”(lindaswitzar,martingiera和wilfriedm.a.niessen,proteindigestion:anoverviewoftheavailabletechniquesandrecentdevelopments,12journalofproteomeresearch1067-1077(2013),其全部教导都并入本文)。一种水解剂或多种水解剂的组合可以序列特异性方式切割蛋白质或多肽中的肽键,从而产生较短肽的可预测集合。可适当选择水解剂与蛋白质的比率和消化所需时间以获得蛋白质的最佳消化。当酶与底物的比率过高时,相应的高消化速率将不能为肽通过质谱仪进行分析提供足够的时间,并且会损害序列覆盖率。另一方面,低e/s比率将需要长时间消化,并因此需要较长的数据采集时间。酶与底物的比率可在约1:0.5至约1:200范围内。如本文所用,术语“消化”是指蛋白质的一个或多个肽键的水解。有若干种使用适当的水解剂对生物样品中的蛋白质进行消化的方法,例如,酶消化或非酶消化。用于消化样品中的蛋白质的一种广泛接受的方法涉及使用蛋白酶。有许多蛋白酶可用,并且每种蛋白酶在特异性、效率和最佳消化条件方面都有其自身特征。蛋白酶是指内肽酶和外肽酶,根据蛋白酶在肽内的非末端或末端氨基酸上的切割能力进行分类。或者,蛋白酶还指六种不同的类别-天冬氨酸蛋白酶、谷氨酸蛋白酶和金属蛋白酶、半胱氨酸蛋白酶、丝氨酸蛋白酶和苏氨酸蛋白酶,根据催化机制进行分类。术语“蛋白酶”与“肽酶”可互换使用,以指水解肽键的酶。[0242]术语“与……相关联”表示可将本发明的组分,即抗vegf组合物与另一种剂例如抗ang2一起配制成单一组合物用于同时递送,或单独配制成两种或更多种组合物(例如,包含每种组分的试剂盒)。彼此相关联施用的组分可在与施用其他组分不同的时间向受试者施用;例如,可在给定时间段以一定时间间隔非同时(例如,单独地或依次地)进行每次施用。彼此相关联施用的单独组分还可在相同施用时段中基本上同时(例如,精确地同时或以非临床上重要的时间段间隔开)施用。此外,彼此相关联施用的单独组分可通过相同或不同途径向受试者施用,例如,阿柏西普的组合物与另一种剂例如抗ang2一起,其中阿柏西普的组合物包含约15%或更少的其变体。[0243]如本文所用,术语“液相色谱”是指以下过程:当组分流过(或流入)固定液相或固相时,由于组分的差异分布,可将由液体携带的生物/化学混合物分离为各组分。液相色谱的非限制性实例包括反相液相色谱、离子交换色谱、尺寸排阻色谱、亲和色谱、混合模式色谱、疏水色谱或混合模式色谱。[0244]如本文所用,“亲和色谱”可包括分离,所述分离包括基于两种物质对色谱材料的亲和力来分离两种物质的任何方法。其可包括使物质经历包含合适的亲和色谱介质的柱。此类色谱介质的非限制性实例包括但不限于蛋白a树脂、蛋白g树脂、包含抗原(针对所述抗原产生结合分子(例如抗体))的亲和支撑物、能够结合至目标蛋白质的蛋白质和包含fc结合蛋白的亲和支撑物。在一个方面,在样品加载之前,可用合适的缓冲液平衡亲和柱。合适的缓冲液的实例可为tris/nacl缓冲液,ph值为约7.0至8.0。熟练技术人员可开发合适的缓冲液而不会造成不当的负担。此平衡之后,可将样品加载至柱上。加载柱后,可使用例如平衡缓冲液将柱洗涤一次或多次。在洗脱柱之前,可使用其他洗涤,包括采用不同缓冲液的洗涤。接着可使用适当的洗脱缓冲液洗脱亲和柱。合适的洗脱缓冲液的一个实例可为乙酸/nacl缓冲液,ph值为约2.0至3.5。熟练技术人员还可开发适当的洗脱缓冲液而不会造成不当的负担。洗脱液可使用本领域技术人员熟知的技术(包括uv)进行监测,例如,可使用280nm处的吸光度,尤其是在目标样品包含芳环(例如,具有像色氨酸一样的芳族氨基酸的蛋白质)时。[0245]如本文所用,“离子交换色谱”可指包括任何方法的分离,通过所述方法可基于目标分子和/或色谱材料上(整体或局部位于目标分子和/或色谱材料的特定区域上)的个别离子电荷的差异来分离两种物质,并因此可使用阳离子交换材料或阴离子交换材料。离子交换色谱根据目标分子的局部电荷与色谱材料的局部电荷之间的差异来分离分子。填充式离子交换色谱柱或离子交换膜装置可在结合-洗脱模式、流通模式或混合模式下操作。用平衡缓冲液或另一种缓冲液洗涤柱或膜装置之后,可通过提高洗脱缓冲液的离子强度(即电导率)以与溶质竞争离子交换基质的带电位点来实现产物回收。改变ph值并由此改变溶质的电荷可为实现溶质洗脱的另一种方式。电导率或ph值的变化可为逐渐的(梯度洗脱)或逐步的(分步洗脱)。可将阴离子或阳离子取代基附着于基质上,以形成用于色谱法的阴离子或阳离子支撑物。阴离子交换取代基的非限制性实例包括二乙氨基乙基(deae)、季氨乙基(qae)和季胺(q)基团。阳离子取代基包括羧甲基(cm)、磺乙基(se)、磺丙基(sp)、磷酸盐(p)和磺酸盐(s)。纤维素离子交换介质或支撑物可包括可由whatmanltd.maidstone,kent,u.k获得的de23tm、de32tm、de52tm、cm-23tm、cm-32tm和cm-52tm。基和交联的离子交换剂也是已知的。例如,deae-、qae-、cm-和以及deae-、q-、cm-和以及fastflow和captotms均可由gehealthcare获得。此外,deae和cm衍生化的乙二醇-甲基丙烯酸酯共聚物,例如toyopearltmdeae-650s或m和toyopearltmcm-650s或m可由tosohaasco.,philadelphia,pa.获得,或nuvias和unospheretms可由biorad,hercules,calif.获得,s可由emdmillipore,ma获得。[0246]如本文所用,术语“疏水相互作用色谱树脂”可包括固相,其可用苯基、辛基、丁基等共价修饰。其可利用疏水性将分子彼此分离。在这种类型的色谱法中,疏水基团(例如苯基、辛基、己基或丁基)可形成柱的固定相。例如蛋白质、肽等的分子穿过hic(疏水相互作用色谱)柱,所述柱在其表面上具有一个或多个疏水区域或具有疏水袋,并且能够与构成hic固定相的疏水基团相互作用。hic树脂或支撑物的实例包括phenylsepharoseff、captophenyl(gehealthcare,uppsala,sweden)、phenyl650-m(tosohbioscience,tokyo,japan)和sartobindphenyl(sartoriuscorporation,newyork,usa)。[0247]如本文所用,术语“混合模式色谱”或“多模式色谱”(均称为“mmc”)包括以下色谱法:其中溶质经由一种以上相互作用模式或机制与固定相相互作用。mmc可用作传统反相(rp)、离子交换(iex)和正相色谱(np)的替代或补充工具。与rp、np和iex色谱(其中分别以疏水相互作用、亲水相互作用和离子相互作用作为主要相互作用模式)不同,混合模式色谱可采用这些相互作用模式中的两种或更多种的组合。混合模式色谱介质可提供无法通过单模式色谱重现的独特选择性。与基于亲和力的方法相比,混合模式色谱还可节省潜在成本、延长柱寿命和提高操作灵活性。在一些示例性实施方案中,混合模式色谱介质可包含直接或经由间隔体与有机或无机支撑物(有时表示为基础基质)偶联的混合模式配体。支撑物可呈以下形式:颗粒,例如基本上呈球形的颗粒、整料、过滤器、膜、表面、毛细管等。在一些示例性实施方案中,支撑物可由天然聚合物例如交联碳水化合物材料如琼脂糖、agpv、纤维素、右旋糖酐、壳聚糖、魔芋、角叉菜胶、结冷胶、藻酸盐等来制备。为了获得高吸附能力,支撑物可为多孔的,并且接着将配体偶联至外表面以及孔表面。此类天然聚合物支撑物可根据标准方法制备,例如反相悬浮胶凝(shjerten:biochimbiophysacta79(2),393-398(1964),其全部教导并入本文)。或者,可由以下物质来制备载体:合成聚合物,例如交联合成聚合物,例如苯乙烯或苯乙烯衍生物、二乙烯基苯、丙烯酰胺、丙烯酸酯、甲基丙烯酸酯、乙烯酯、乙烯酰胺等。此类合成聚合物可根据标准方法产生,例如“通过悬浮聚合开发的苯乙烯基聚合物支撑物(styrenebasedpolymersupportsdevelopedbysuspensionpolymerization)”(rarshady:chimicael'industria70(9),70-75(1988),其全部教导并入本文)。多孔的天然或合成聚合物支撑物也可从例如gehealthcare,uppsala,sweden的商业来源获得。[0248]如本文所用,术语“质谱仪”包括能够识别特定分子种类并测量其准确质量的装置。所述术语意在包括可表征多肽或肽的任何分子检测器。质谱仪可包括三个主要部分:离子源、质量分析仪和检测器。离子源的作用是产生气相离子。可将分析物的原子、分子或簇转移至气相中并同时(如以电喷雾电离)或经由单独过程电离。离子源的选择取决于应用。在一些示例性实施方案中,质谱仪可为串联质谱仪。如本文所用,术语“串联质谱”包括其中通过使用质量选择和质量分离的多个阶段获得关于样品分子的结构信息的技术。先决条件是将样品分子转化为气相并电离,以便在第一质量选择步骤之后以可预测和可控制的方式形成片段。多阶段ms/ms或msn可通过首先选择和分离前体离子(ms2),使其片段化,分离初级碎片离子(ms3),使其片段化,分离次级碎片(ms4)等方式进行,只要可获得有意义的信息,或碎片离子信号是可检测的。串联ms已成功地与广泛多种分析仪组合一起使用。可根据许多不同因素(例如灵敏度、选择性和速度,以及尺寸、成本和可用性)来确定对于某种应用组合哪些分析仪。串联ms方法的两个主要类别是空间串联和时间串联,但还有一些混合方案,其中时间串联分析仪在空间中或与空间串联分析仪耦合。空间串联质谱仪包括离子源、前体离子活化装置和至少两个非捕获质量分析仪。具体的m/z分离功能可被设计,以便在仪器的一个部分中选择离子,在中间区域将其解离,接着将产物离子传输至另一分析仪以进行m/z分离和数据采集。在时间串联质谱仪中,可在同一物理装置中捕获、分离、片段化和m/z分离离子源中产生的离子。质谱仪所识别的肽可用作完整蛋白及其翻译后修饰的替代代表。它们可通过将实验与理论ms/ms数据相关联来用于蛋白质表征,理论ms/ms数据是由蛋白质序列数据库中的可能的肽产生。所述表征包括但不限于对蛋白质片段的氨基酸进行测序;确定蛋白质测序;确定蛋白质从头测序;定位翻译后修饰或识别翻译后修饰;或可比性分析;或其组合。[0249]如本文所用,“mini-trap”或“minitrap”或“minitrap结合分子”能够结合至vegf分子。此类minitrap可包括(i)嵌合多肽以及(ii)包含两个或更多个例如经由一个或多个二硫桥非共价结合的多肽的多聚(例如,二聚)分子。minitrap可经由化学修饰、酶促活性产生或重组制造。[0250]如本文所用,“vegfminitrap”或“vegfminitrap结合分子”可为与vegf结合并具有一组或多组vegf受体ig样结构域(或其变体)(例如,vegfr1ig结构域2和/或vegfr2ig结构域3和/或4)的分子或分子复合物以及经修饰或不存在的多聚组分(mc),例如,其中mc是经修饰的免疫球蛋白fc。所述修饰可为vegftrap(例如,阿柏西普或康柏西普(conbercept))的蛋白水解消化或具有经缩短的mc序列的所得多肽链的直接表达的结果。(参见图1中描绘的分子结构)图1是vegfminitrap分子的描绘,其是用酿脓链球菌ides蛋白水解阿柏西普的产物。描绘了同型二聚分子,其具有通过两个平行二硫键连接的ig铰链结构域片段。指示vegfr1结构域、vegfr2结构域和铰链结构域片段(mc)。阿柏西普中发生ides切割的点用“//”指示。还指示从阿柏西普切下的fc片段。未经二聚化的单个此类嵌合多肽如果具有vegf结合活性则也可为vegfminitrap。术语“vegfminitrap”包括单个多肽,其包含第一组一个或多个vegf受体ig结构域(或其变体),所述ig结构域缺乏mc但以接头(例如,肽接头)与一个或多个其他组的一个或多个vegf受体ig结构域(或其变体)融合。在本发明的vegfminitrap中的vegf结合结构域可彼此相同或不同(参见wo2005/00895,其全部教导都并入本文)。[0251]例如,在本发明的一个实施方案中,未经修饰的免疫球蛋白fc结构域包含以下氨基酸序列或其氨基酸1-226:[0252]dkthtcpx1cpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykx2tppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno.:33;其中x1是l或p并且x2是a或t)。[0253]vegf的抑制包括例如vegf与vegf受体结合的拮抗作用,例如通过与vegf受体竞争vegf(例如,vegf110、vegf121和/或vegf165)结合。这种抑制可造成vegf介导的vegfr活化的抑制,例如,表达嵌合vegf受体(例如,其同型二聚体)的细胞系(例如,hek293)中荧光素酶表达的抑制,所述细胞系在细胞表面上具有与il18rα和/或il18rβ胞内结构域融合的vegfr胞外结构域并且还具有nfkb-荧光素酶-ires-egfp报告基因,例如本文所阐述的细胞系hek293/d9/flt-il18rα/flt-il18rβ。[0254]本发明的vegfminitrap的vegf受体ig结构域组分可包括:[0255](i)vegfr1(flt1)的一个或多个免疫球蛋白样(ig)结构域2(r1d2),[0256](ii)vegfr2(flk1或kdr)的一个或多个ig结构域3(flk1d3)(r2d3),[0257](iii)vegfr2(flk1或kdr)的一个或多个ig结构域4(flk1d4)(r2d4),和/或[0258](iv)vegfr3(flt4)的一个或多个ig结构域3(flt1d3或r3d3)。[0259]vegf受体的免疫球蛋白样结构域在本文中可称为vegfr“ig”结构域。本文所提及的vegfrig结构域,例如r1d2(在本文中可称为vegfr1(d2))、r2d3(在本文中可称为vegfr2(d3))、r2d4(在本文中可称为vegfr2(d4))和r3d3(在本文中可称为vegfr3(d3))旨在不仅涵盖完整的野生型ig结构域,而且也涵盖基本上保留野生型结构域的功能特征的其变体,例如,当并入vegfminitrap中时,保留形成功能性vegf结合结构域的能力。本领域技术人员显而易知,可获得上述ig结构域的许多变体,其将保留与野生型结构域基本上相同的功能特征。[0260]本发明提供包含以下结构域结构的vegfminitrap多肽:[0261]·((r1d2)-(r2d3))a-接头-((r1d2)-(r2d3))b;[0262]·((r1d2)-(r2d3)-(r2d4))c-接头-((r1d2)-(r2d3)-(r2d4))d;[0263]·((r1d2)-(r2d3))e-(mc)g;[0264]·((r1d2)-(r2d3)-(r2d4))f-(mc)g;[0265]其中,[0266]-r1d2是vegf受体1(vegfr1)ig结构域2(d2);[0267]-r2d3是vegfr2ig结构域3;[0268]-r2d4是vegfr2ig结构域4;[0269]-mc是多聚组分(例如,igg铰链结构域或其片段,例如来自igg1);[0270]-接头是包含约5、6、7、8、9、10、11、12、13、14、15或16个氨基酸的肽,例如(gggs)g;[0271]并且,[0272]独立地,[0273]a=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;[0274]b=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;[0275]c=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;[0276]d=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;[0277]e=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;[0278]f=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15;并且[0279]g=1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。[0280]在本发明的一个实施方案中,r1d2包含氨基酸序列:sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiid(seqidno.:34)。在一个方面,r1d2缺少n末端sdt。[0281]在本发明的一个实施方案中,r1d2包含氨基酸序列:pfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqt(seqidno.:35)。[0282]在本发明的一个实施方案中,r2d3包含氨基酸序列:vvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seqidno.:36)。[0283]在本发明的一个实施方案中,r2d4包含氨基酸序列:pfvafgsgmeslveatvgervripakylgypppeikwykngiplesnhtikaghvltimevserdtgnytviltnpiskekqshvvslvvyvppgpg(seqidno.:37)。[0284]在本发明的一个实施方案中,r2d4包含氨基酸序列:fvafgsgmeslveatvgervripakylgypppeikwykngiplesnhtikaghvltimevserdtgnytviltnpiksekqshvvslvvyvp(seqidno.:38)。[0285]在本发明的一个实施方案中,用于vegfminitrap中的多聚组分(mc)是肽,例如,经修饰的fc免疫球蛋白(例如,来自igg1),其能够与另一多聚组分结合。在一个方面,mc是包括免疫球蛋白铰链区的经修饰的fc免疫球蛋白。例如,在本发明的一个实施方案中,mc是包含一个或多个(例如1、2、3、4、5或6个)半胱氨酸的肽,所述半胱氨酸能够与另一个mc中的半胱氨酸形成一个或多个半胱氨酸桥,例如dkthtcppc(seqidno.:39)、dkthtcppcppc(seqidno.:40)、dkthtcppcppcppc(seqidno.:41)、dkthtc(ppc)h(其中h是1、2、3、4或5)、dkthtcppcpapellg(seqidno.:60)、dkthtcplcpapellg(seqidno.:43)、dkthtc(seqidno.:44)或dkthtcplcpap(seqidno.:45)。[0286]本发明还提供了一种包含以下结构域结构的vegfminitrap多肽:[0287](i)(r1d2)a-(r2d3)b-(mc)c;或[0288](ii)(r1d2)a-(r2d3)b-(r2d4)c-(mc)d;[0289]其可例如通过每个多肽的mc之间的结合与第二所述多肽同型二聚,[0290]其中[0291](i)所述r1d2结构域配位;[0292](ii)所述r2d3结构域配位;和/或[0293](iii)所述r2d4结构域配位,[0294]以形成二聚vegf结合结构域。[0295]在本发明的一个实施方案中,vegfminitrap多肽包含以下氨基酸序列:sdtgrpfvemyseipeiihmtegrelvipcrvtspn36itvtlkkfpldtlipdgkriiwdsrkgfiisn68atykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvln123ctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkkn196stfvrvhekdkthtcppcpapellg(seqidno.:46;mc加下划线);grpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhenlsvafgsgmeslveatvgervripakylgypppeikwykngiplesnhtikaghvltimevserdtgnytviltnpiskekqshvvslvvyvppgpgdkthtcplcpapellg(seqidno.:47;mc加下划线);sdtgrpfvemyseipeiihmtegrelvipcrvtspn36itvtlkkfpldtlipdgkriiwdsrkgfiisn68atykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvln123ctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkkn196stfvrvhekdkthtcppc(seqidno.:48;mc加下划线);sdtgrpfvemyseipeiihmtegrelvipcrvtspn36itvtlkkfpldtlipdgkriiwdsrkgfiisn68atykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvln123ctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkkn196stfvrvhekdkthtcppcppc(seqidno.:49;mc加下划线);sdtgrpfvemyseipeiihmtegrelvipcrvtspn36itvtlkkfpldtlipdgkriiwdsrkgfiisn68atykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvln123ctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkkn196stfvrvhekdkthtcppcppcppc(seqidno.:50;mc加下划线);或sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekdkthtc-(ppc)x(mc加下划线;其中x是1、2、3、4或5)。如所论述,此类多肽可被多聚化(例如二聚化(例如,同型二聚化)),其中多肽之间的结合是经由多聚化组分介导。[0296]在本发明的一个实施方案中,本发明的单体vegfminitrap的vegfr1ig样结构域2在n36和/或n68处具有n连接的糖基化作用;和/或在c30与c79之间具有链内二硫桥;和/或本发明的单体vegfminitrap的vegfr2ig样结构域3在n123和/或n196处具有n连接的糖基化作用;和/或在c124与c185之间具有链内二硫桥。[0297]在本发明的一个实施方案中,vegfminitrap包含以下结构:[0298]·(r1d2)1-(r2d3)1-(g4s)3-(r1d2)1-(r2d3)1;[0299]·(r1d2)1-(r2d3)1-(g4s)6-(r1d2)1-(r2d3)1;[0300]·(r1d2)1-(r2d3)1-(g4s)9-(r1d2)1-(r2d3)1;或[0301]·(r1d2)1-(r2d3)1-(g4s)12-(r1d2)1-(r2d3)1。[0302]g4s是-gly-gly-gly-gly-ser-[0303]在本发明的一个实施方案中,vegfminitrap包含以下氨基酸序列:[0304](i)[0305]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekggggsggggsggggsggggsggggsggggssdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seqidno.:51;接头加下划线);[0306](iii)[0307]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekggggsggggsggggssdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seqidno.:52;接头加下划线);[0308](iv)[0309]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekggggsggggsggggsggggsggggsggggsggggsggggsggggssdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seqidno.:53;接头加下划线);[0310](v)[0311]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekggggsggggsggggsggggsggggsggggsggggsggggsggggsggggsggggsggggssdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek(seqidno.:54;接头加下划线);[0312]或[0313](vi)[0314]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek-(ggggs)x[0315]-sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhek[0316](其中x是1、2、3、4、5、6、7、8、9、10、11、12、13、14或15)。如本文所论述,这些多肽可包含二级结构,其中同样的vegfrig结构域缔合以形成链内vegf结合结构域(例如,图2)。在本发明的一个实施方案中,两个或更多个此类多肽多聚化(例如,二聚化(例如,同型二聚化)),其中每条链的vegfrig结构域与另一条链的同样ig结构域缔合以形成链间vegf结合结构域。[0317]在本发明的某一实施方案中,本发明的vegfminitrap缺乏对vegfminitrap多肽的氨基酸残基的任何显著修饰(例如,例如在n末端和/或c末端处的直接化学修饰如peg化或碘乙酰胺化)。[0318]在本发明的一个实施方案中,多肽包含二级结构,其中在单个嵌合多肽(例如,(r1d2)a-(r2d3)b-接头-(r1d2)c-(r2d3)d;或(r1d2)a-(r2d3)b-(r2d4)c-接头-(r1d2)d-(r2d3)e-(r2d4)f)中或在单独的嵌合多肽(例如,同型二聚体)中的同样的vegfrig结构域配位以形成vegf结合结构域。例如,其中[0319](i)所述r1d2结构域配位;[0320](ii)所述r2d3结构域配位;和/或[0321](iii)所述r2d4结构域配位,[0322]以形成vegf结合结构域。图2是描绘这种结构域配位的单链vegfminitrap的说明。指示vegfr1、vegfr2和接头结构域。所示接头是(g4s)6。本发明包括具有(g4s)3、(g4s)9或(g4s)12接头的单链vegfminitrap。[0323]另外,本发明还提供了一种复合物,其包含与vegf多肽或其片段或其融合物复合的如本文所论述的vegfminitrap。在本发明的一个实施方案中,将vegf(例如,vegf165)同型二聚化和/或将vegfminitrap在2:2复合物(2个vegf:2个minitrap)中同型二聚化和/或将vegfminitrap在1:1复合物中同型二聚化。复合物可包括与同型二聚化的vegfminitrap多肽结合的同型二聚化的vegf分子。在本发明的一个实施方案中,复合物是在体外(例如,固定在固体基质上)或在受试者体内。本发明还包括与vegfminitrap复合的vegf二聚体(例如,vegf165)的复合物的组合物。[0324]如本文所用,术语“蛋白质”或“目标蛋白质”可包括具有共价连接的酰胺键的任何氨基酸聚合物。目标蛋白质的实例包括但不限于阿柏西普和minitrap。蛋白质包含一条或多条氨基酸聚合物链,在本领域中通常称为“多肽”。“多肽”是指由氨基酸残基、相关天然存在的结构变体及其经由肽键连接的合成的非天然存在的类似物、相关天然存在的结构变体及其合成的非天然存在的类似物构成的聚合物。“合成肽或多肽”是指非天然存在的肽或多肽。合成肽或多肽可例如使用自动多肽合成器来合成。各种固相肽合成方法是本领域技术人员已知的。蛋白质可包含一个或多个多肽以形成单一功能的生物分子。另一个示例性方面,蛋白质可包括抗体片段、纳米抗体、重组抗体嵌合体、细胞因子、趋化因子、肽激素等。目标蛋白质可包括以下任一者:生物治疗性蛋白、用于研究或疗法中的重组蛋白、trap蛋白和其他嵌合受体fc融合蛋白、嵌合蛋白、抗体、单克隆抗体、多克隆抗体、人类抗体和双特异性抗体。在一个特定方面,目标蛋白质是抗vegf融合蛋白(例如,阿柏西普或minitrap)。可使用以下基于重组细胞的生产系统来产生蛋白质,例如昆虫杆状病毒系统、酵母系统(例如毕赤酵母属(pichiasp.))、哺乳动物系统(例如cho细胞和cho衍生物,如cho-k1细胞)。有关论述生物治疗性蛋白及其产生的最新综述,参见ghaderi等人,“productionplatformsforbiotherapeuticglycoproteins.occurrence,impact,andchallengesofnon-humansialylation,”(dariusghaderi等人,productionplatformsforbiotherapeuticglycoproteins.occurrence,impact,andchallengesofnon-humansialylation,28biotechnologyandgeneticengineeringreviews147-176(2012),其全部教导都并入本文)。在一些示例性实施方案中,蛋白质包含修饰、加合物和其他共价连接的部分—这些修饰、加合物和部分包括例如抗生物素蛋白、链霉亲和素、生物素、聚糖(例如,n-乙酰半乳糖胺、半乳糖、神经氨酸、n-乙酰基葡糖胺、岩藻糖、甘露糖和其他单糖)、peg、聚组氨酸、flagtag、麦芽糖结合蛋白(mbp)、几丁质结合蛋白(cbp)、谷胱甘肽-s-转移酶(gst)myc表位、荧光标记和其他染料等。蛋白质可根据组成和溶解度来分类,并且因此可包括简单蛋白质,例如球状蛋白质和纤维状蛋白质;缀合蛋白,例如核蛋白、糖蛋白、粘蛋白、色蛋白、磷蛋白、金属蛋白和脂蛋白;以及衍生蛋白,例如初级衍生蛋白和次级衍生蛋白。[0325]在一些示例性实施方案中,目标蛋白质可为重组蛋白、抗体、双特异性抗体、多特异性抗体、抗体片段、单克隆抗体、融合蛋白、scfv及其组合。[0326]如本文所用,术语“重组蛋白”是指由于重组表达载体上携带的基因的转录和翻译而产生的蛋白,所述重组表达载体已引入合适的宿主细胞中。在某些示例性实施方案中,重组蛋白可为融合蛋白。在一个特定方面,重组蛋白是抗vegf融合蛋白(例如,阿柏西普或minitrap)。在某些示例性实施方案中,重组蛋白可为抗体,例如,嵌合的、人源化的或完全人类抗体。在某些示例性实施方案中,重组蛋白可为选自由以下组成的组的同种型抗体:igg、igm、iga1、iga2、igd或ige。在某些示例性实施方案中,抗体分子是全长抗体(例如,igg1),或替代地,抗体可为片段(例如,fc片段或fab片段)。[0327]如本文所用,术语“抗体”包括包含通过二硫键互连的四条多肽链(即两条重(h)链和两条轻(l)链)的免疫球蛋白分子,以及其多聚体(例如,igm)。每条重链包含重链可变区(本文中缩写为hcvr或vh)和重链恒定区。重链恒定区包含三个结构域,即ch1、ch2和ch3。每条轻链包含轻链可变区(本文中缩写为lcvr或vl)和轻链恒定区。轻链恒定区包含一个结构域(cl1)。vh区和vl区可进一步再分成称为互补决定区(cdr)的高变区,散布有称为构架区(fr)的较保守区。每个vh和vl由三个cdr和四个fr组成,所述区依以下顺序从氨基末端至羧基末端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。在本发明的不同实施方案中,抗big-et-1抗体(或其抗原结合部分)的fr可与人类种系序列相同,或者可为天然或人工修饰的。可基于两个或更多个cdr的并排分析来定义氨基酸共有序列。如本文所用,术语“抗体”还包括全抗体分子的抗原结合片段。如本文所用,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”等包括特异性结合抗原以形成复合物的任何天然存在的、以酶促方式获得的、合成或基因工程化的多肽或糖蛋白。抗体的抗原结合片段可使用以下任何合适的标准技术例如由全抗体分子衍生而来:例如蛋白水解消化或重组基因工程技术,其涉及编码抗体可变结构域和任选地恒定结构域的dna的操纵和表达。所述dna是已知的和/或可易于由例如商业来源、dna文库(包括例如噬菌体-抗体文库)获得,或者可经合成。可以化学方式或通过使用分子生物学技术对dna进行测序和操纵,例如以将一个或多个可变结构域和/或恒定结构域排列成合适的构型;或引入密码子;产生半胱氨酸残基;修饰、添加或删除氨基酸等。[0328]如本文所用,“抗体片段”包括完整抗体的一部分,例如抗体的抗原结合或可变区。抗体片段的实例包括但不限于fab片段、fab'片段、f(ab')2片段、scfv片段、fv片段、dsfv双抗体、dab片段、fd'片段、fd片段和经分离的互补决定区(cdr)区域,以及由抗体片段形成的三抗体、四抗体、线性抗体、单链抗体分子和多特异性抗体。fv片段是免疫球蛋白重链与轻链可变区的组合,并且scfv蛋白是重组单链多肽分子,其中免疫球蛋白轻链与重链可变区经由肽接头连接。在一些示例性实施方案中,抗体片段包含亲本抗体的足够的氨基酸序列,其是与亲本抗体结合相同抗原的片段;在一些示例性实施方案中,片段以与亲本抗体相当的亲和力结合至抗原和/或与亲本抗体竞争结合至抗原。抗体片段可通过任何方式产生。例如,抗体片段可通过完整抗体的片段化以酶促或化学方式产生和/或其可由编码部分抗体序列的基因以重组方式产生。或者或另外,抗体片段可全部或部分合成地产生。抗体片段可任选地包含单链抗体片段。或者或另外,抗体片段可包含例如通过二硫键联连接在一起的多条链。抗体片段可任选地包含多分子复合物。功能性抗体片段通常包含至少约50个氨基酸,并且更通常包含至少约200个氨基酸。[0329]术语“双特异性抗体”包括能够选择性地结合两个或更多个表位的抗体。双特异性抗体通常包含两条不同重链,每条重链特异性结合不同表位-在两种不同分子(例如,抗原)上或在相同分子(例如,相同抗原)上。如果双特异性抗体能够选择性地结合两个不同表位(第一表位和第二表位),则第一重链对第一表位的亲和力通常比第一重链对第二表位的亲和力低至少一个至两个或三个或四个数量级,并且反之亦然。由双特异性抗体识别的表位可在相同或不同靶标上(例如,在相同或不同蛋白质上)。双特异性抗体可例如通过组合识别相同抗原的不同表位的重链来制备。例如,可将编码识别相同抗原的不同表位的重链可变序列的核酸序列与编码不同重链恒定区的核酸序列融合,并且可在表达免疫球蛋白轻链的细胞中表达此类序列。[0330]典型的双特异性抗体具有两条重链,每条重链均具有三个重链cdr,接着是ch1结构域、铰链、ch2结构域和ch3结构域;和免疫球蛋白轻链,其不赋予抗原结合特异性但可与每条重链缔合,或者可与每条重链缔合并且可结合由重链抗原结合区结合的一个或多个表位,或者可与每条重链缔合并能够将一条或两条重链结合至一个或两个表位。bsab可分为两种主要类别,一类是带有fc区的抗体(igg样),而另一类是缺少fc区的抗体,后者通常小于包含fc的igg和igg样双特异性分子。igg样bsab可具有不同形式,例如但不限于三功能抗体(triomab)、杵臼igg(kihigg)、crossmab、orth-fabigg、双可变结构域ig(dvd-ig)、二合一或双重作用的fab(daf)、igg单链fv(igg-scfv)或κλ体。非igg样不同形式包括串联scfv、双抗体形式、单链双抗体、串联双抗体(tandab)、双亲和重靶向分子(dart)、dart-fc、纳米抗体或通过对接锁定(dnl)方法产生的抗体(gaoweifan,zujianwang和mingjuhao,bispecificantibodiesandtheirapplications,8journalofhematology&oncology130;dafnemüller和rolande.kontermann,bispecificantibodies,handbookoftherapeuticantibodies265-310(2014),其全部教导都并入本文)。产生bsab的方法不限于基于两种不同杂交瘤细胞系的体细胞融合的四源杂交瘤技术、涉及化学交联剂的化学缀合以及利用重组dna技术的遗传方法。bsab的实例包括在以下专利申请(其通过引用并入本文)中公开的那些:2010年6月25日提交的美国第12/823838号;2012年6月5日提交的美国第13/488628号;2013年9月19日提交的美国第14/031075号;2015年7月24日提交的美国第14/808171号;2017年9月22日提交的美国第15/713574号;2017年9月22日提交的美国第15/713569号;2016年12月21日提交的美国第15/386453号;2016年12月21日提交的美国第15/386443号;2016年7月29日提交的美国第15/22343号;和2017年11月15日提交的美国第15814095号。在制造双特异性抗体的几个步骤中,可存在少量同型二聚体杂质。当使用完整质量分析进行检测时,此类同型二聚体杂质的检测可具有挑战性,因为同型二聚体杂质的丰度低并且当使用常规液相色谱法进行检测时,这些杂质与主要种类共洗脱。[0331]如本文所用,“多特异性抗体”是指对至少两种不同抗原具有结合特异性的抗体。尽管此类分子通常仅结合两种抗原(即双特异性抗体,bsab),但具有额外特异性的抗体(例如三特异性抗体和kih三特异性抗体)还可由本文公开的系统和方法提出。[0332]如本文所用,术语“单克隆抗体”不限于经由杂交瘤技术产生的抗体。单克隆抗体可通过本领域可获得或已知的任何手段衍生自单一克隆,包括任何真核、原核或噬菌体克隆。可使用本领域已知的广泛多种技术来制备可用于本公开的单克隆抗体,包括使用杂交瘤、重组和噬菌体展示技术或其组合。[0333]在一些示例性实施方案中,目标蛋白质可具有在约4.5至约9.0范围内的pi。在一个示例性具体实施方案中,pi可为约4.5、约5.0、约5.5、约5.6、约5.7、约5.8、约5.9、约6.0、约6.1、约6.2、约6.3、约6.4、约6.5、约6.6、约6.7、约6.8、约6.9、约7.0、约7.1、约7.2、约7.3、约7.4、约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4、约8.5、约8.6、约8.7、约8.8、约8.9或约9.0。在一些示例性实施方案中,组合物中目标蛋白质的类型可超过一种。[0334]在一些示例性实施方案中,目标蛋白质可由哺乳动物细胞产生。哺乳动物细胞可具有人类来源或非人类来源,可包括原代上皮细胞(例如,角质细胞、宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾上皮细胞和视网膜上皮细胞);已建立的细胞系及其品系(例如,293胚胎肾细胞、bhk细胞、hela宫颈上皮细胞和per-c6视网膜细胞、mdbk(nbl-1)细胞、911细胞、crfk细胞、mdck细胞、cho细胞、bewo细胞、chang细胞、detroit562细胞、hela229细胞、helas3细胞、hep-2细胞、kb细胞、lsi80细胞、ls174t细胞、nci-h-548细胞、rpmi2650细胞、sw-13细胞、t24细胞、wi-28va13,2ra细胞、wish细胞、bs-c-i细胞、llc-mk2细胞、克隆m-3细胞、1-10细胞、rag细胞、tcmk-1细胞、y-l细胞、llc-pki细胞、pk(15)细胞、ghi细胞、gh3细胞、l2细胞、llc-rc256细胞、mhici细胞、xc细胞、mdok细胞、vsw细胞和th-i,b1细胞、bsc-1细胞、raf细胞、rk-细胞、pk-15细胞或其衍生物)、来自任何组织或器官(包括但不限于心脏、肝脏、肾脏、结肠、肠、食道、胃、神经组织(脑、脊髓)、肺、血管组织(动脉、静脉、毛细血管)、淋巴组织(淋巴腺、腺样体、扁桃体、骨髓和血液)、脾脏)的成纤维细胞、以及成纤维细胞和成纤维细胞样细胞系(例如,cho细胞、trg-2细胞、imr-33细胞、don细胞、ghk-21细胞、瓜氨酸血症细胞、dempsey细胞、detroit551细胞、detroit510细胞、detroit525细胞、detroit529细胞、detroit532细胞、detroit539细胞、detroit548细胞、detroit573细胞、hel299细胞、imr-90细胞、mrc-5细胞、wi-38细胞、wi-26细胞、midi细胞、cho细胞、cv-1细胞、cos-1细胞、cos-3细胞、cos-7细胞、vero细胞、dbs-frhl-2细胞、balb/3t3细胞、f9细胞、sv-t2细胞、m-msv-balb/3t3细胞、k-balb细胞、blo-11细胞、nor-10细胞、c3h/ioti/2细胞、hsdmic3细胞、kln205细胞、mccoy细胞、小鼠l细胞、品系2071(小鼠l)细胞、l-m品系(小鼠l)细胞、l-mtk'(小鼠l)细胞、nctc克隆2472和2555、scc-psa1细胞、swiss/3t3细胞、印度黄麂细胞、sirc细胞、cn细胞和jensen细胞、sp2/0、ns0、ns1细胞或其衍生物)。[0335]如本文所用,术语“蛋白质烷化剂”是指用于烷化蛋白质中某些游离氨基酸残基的试剂。蛋白质烷化剂的非限制性实例是碘乙酰胺(ioa)、氯乙酰胺(caa)、丙烯酰胺(aa)、n-乙基马来亚酰胺(nem)、甲烷硫代磺酸甲酯(mmts)和4-乙烯基吡啶或其组合。[0336]如本文所用,“蛋白质变性”可指其中分子的三维形状自其天然状态改变的过程。蛋白质变性可使用蛋白质变性剂进行。蛋白质变性剂的非限制性实例包括热、高或低ph值、还原剂如dtt(参见下文)或暴露于离液剂。几种离液剂可用作蛋白质变性剂。离液溶质通过干扰由非共价力(例如氢键、范德华力和疏水作用)介导的分子内相互作用增加系统的熵。离液剂的非限制性实例包括丁醇、乙醇、氯化胍、过氯酸锂、乙酸锂、氯化镁、苯酚、丙醇、十二烷基硫酸钠、硫脲、n-月桂酰肌氨酸、尿素及其盐。[0337]如本文所用,术语“蛋白质还原剂”是指用于还原蛋白质中的二硫桥的试剂。用于还原蛋白质的蛋白质还原剂的非限制性实例是二硫苏糖醇(dtt)、β-巯基乙醇、爱耳门氏试剂(ellman'sreagent)、盐酸羟胺、氰基硼氢化钠、三(2-羧乙基)膦盐酸盐(tcep-hcl)或其组合。[0338]如本文所用,术语多肽(例如,vegfrig结构域的多肽)的“变体”是指包含与目标蛋白质的参考或天然氨基酸序列至少约70-99.9%(例如70%、71%、72%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、99.9%)同一或相似的氨基酸序列的多肽。可通过例如blast算法来执行序列比较,其中选择算法的参数以在个别参考序列的整个长度上给出个别序列之间的最大匹配(例如,预期阈值:10;字长:3;查询范围内的最大匹配:0;blosum62矩阵;空位成本:存在11,延伸1;条件组成评分矩阵调整)。多肽(例如,vegfrig结构域的多肽)的变体还可指除一个或多个(例如1、2、3、4、5、6、7、8、9或10个)突变例如错义突变(例如保守取代)、无义突变、缺失或插入之外包含参考氨基酸序列的多肽。以下参考文献涉及经常用于序列分析的blast算法:blastalgorithms:altschul等人(2005)febsj.272(20):5101-5109;altschul,s.f.等人,(1990)j.mol.biol.215:403-410;gish,w.等人,(1993)naturegenet.3:266-272;madden,t.l.等人,(1996)meth.enzymol.266:131-141;altschul,s.f.等人,(1997)nucleicacidsres.25:3389-3402;zhang,j.等人,(1997)genomeres.7:649-656;wootton,j.c.等人,(1993)comput.chem.17:149-163;hancock,j.m.等人,(1994)comput.appl.biosci.10:67-70;alignmentscoringsystems:dayhoff,m.o.等人,“amodelofevolutionarychangeinproteins.”,atlasofproteinsequenceandstructure,(1978)第5卷,增刊3.m.o.dayhoff(编辑),第345-352页,natl.biomed.res.found.,washington,d.c.;schwartz,r.m.等人,“matricesfordetectingdistantrelationships.”,atlasofproteinsequenceandstructure,(1978)第5卷,增刊3.”m.o.dayhoff(编辑),第353-358页,natl.biomed.res.found.,washington,d.c.;altschul,s.f.,(1991)j.mol.biol.219:555-565;states,d.j.等人,(1991)methods3:66-70;henikoff,s.等人,(1992)proc.natl.acad.sci.usa89:10915-10919;altschul,s.f.等人,(1993)j.mol.evol.36:290-300;alignmentstatistics:karlin,s.等人,(1990)proc.natl.acad.sci.usa87:2264-2268;karlin,s.等人,(1993)proc.natl.acad.sci.usa90:5873-5877;dembo,a.等人,(1994)ann.prob.22:2022-2039;以及altschul,s.f.“evaluatingthestatisticalsignificanceofmultipledistinctlocalalignments.”,theoreticalandcomputationalmethodsingenomeresearch(s.suhai编),(1997)第1-14页,plenum,n.y.;其全部教导都并入本文。[0339]一些变体可为多肽在其核糖体合成期间(共翻译修饰)或之后(翻译后修饰“ptm”)经历的共价修饰。通常通过特定的酶或酶途径引入ptm。许多出现在蛋白质骨架内的特定特征性蛋白质序列(例如,特征序列)的位点处。已记录数百个ptm,并且这些修饰始终会影响蛋白质结构或功能的某些方面(walsh,g.“proteins”(2014)第二版,由wileyandsons,ltd.出版,isbn:9780470669853,其全部教导都并入本文)。在某些示例性实施方案中,蛋白质组合物可包含一种以上类型的目标蛋白质的蛋白质变体。[0340]在阿柏西普(和具有阿柏西普结构特征的蛋白质,例如,阿柏西普的一个或多个重链或轻链区)情况下的蛋白质变体可包含但不限于可由一个或多个在例如以下各处出现的氨基酸残基的氧化产生的氧化变体:组氨酸、半胱氨酸、甲硫氨酸、色氨酸、苯丙氨酸和/或酪氨酸残基;可由天冬酰胺残基处的脱酰胺产生的脱酰胺变体和/或由精氨酸残基处的脱氧葡糖醛酮化产生的变体。[0341]关于阿柏西普(和具有阿柏西普的结构特征的蛋白质,例如,阿柏西普的一个或多个重链或轻链区),氧化变体可包含在his86、his110、his145、his209、his95、his19和/或his203(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的组氨酸残基的氧化;在trp58和/或trp138(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的色氨酸残基的氧化;在tyr64(或具有阿柏西普的某些结构特征的蛋白质上的等效位置)处的酪氨酸残基的氧化;在phe44和/或phe166(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的苯丙氨酸残基的氧化;和/或在met10、met20、met163和/或met192(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的甲硫氨酸残基的氧化。[0342]关于阿柏西普(和具有阿柏西普的结构特征的蛋白质,例如阿柏西普的一个或多个重链或轻链区),脱酰胺变体可包含在asn84和/或asn99(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的天冬酰胺残基的脱酰胺。[0343]关于阿柏西普(和具有阿柏西普的结构特征的蛋白质,例如,阿柏西普的一个或多个重链或轻链区),脱氧葡糖醛酮化变体可包含在arg5(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的精氨酸残基的3-脱氧葡糖醛酮化。[0344]蛋白质变体可包括酸性种类和碱性种类。酸性种类通常是比cex的主峰更早洗脱或比aex的主峰更晚洗脱的变体,而碱性种类是比cex的主峰更晚洗脱或比aex的主峰更早洗脱的变体。[0345]如本文所用,术语“酸性种类”、“as”、“酸性区域”和“ar”是指特征为总酸性电荷的蛋白质变体。例如,在重组蛋白制剂中,可通过以下各种方法检测此类酸性种类,例如离子交换,例如wcx-10hplc(弱阳离子交换色谱)或ief(等电聚焦)。抗体的酸性种类可包括变体、结构变体和/或片段化变体。示例性变体可包括但不限于脱酰胺变体、无岩藻糖基化变体、氧化变体、甲基乙二醛(mgo)变体、糖化变体和柠檬酸变体。示例性结构变体包括但不限于糖基化变体和丙酮化变体。示例性片段化变体包括由于肽链的解离、酶和/或化学修饰而由靶分子产生的任何经修饰的蛋白质种类,包括但不限于fc和fab片段、缺少fab的片段、缺少重链可变结构域的片段、c末端截短变体、在轻链中切除n末端asp的变体以及具有轻链的n末端截短的变体。其他酸性种类变体包括包含以下各物的变体:未配对的二硫化物、宿主细胞蛋白和宿主核酸、色谱材料和培养基组分。通常,酸性种类在cex期间比主峰更早洗脱或在aex分析期间比主峰更晚洗脱(参见图16和图17)。[0346]在某些实施方案中,蛋白质组合物可包含一种以上类型的酸性种类变体。例如,但不作为限制,可基于出现的峰的色谱保留时间对总酸性种类进行分类。可将全部酸性种类归类的另一个实例可基于变体的类型—变体、结构变体或片段化变体。[0347]术语“酸性种类”或“as”不涉及过程相关的杂质。如本文所用,术语“过程相关的杂质”是指存在于包含蛋白质的组合物中但并非衍生自蛋白质本身的杂质。过程相关的杂质包括但不限于宿主细胞蛋白(hcp)、宿主细胞核酸、色谱材料和培养基组分。[0348]在一个示例性实施方案中,与目标蛋白质相比,抗vegf组合物中酸性种类的量可为至多约20%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一biochemistryofmethioninesulfoxideresiduesinproteins.trendsbiochem.sci.7:137-139,其全部教导都并入本文)。[0355]色氨酸的氧化可产生复杂的产物混合物。主要产物可为n-甲酰犬尿氨酸和犬尿氨酸以及单氧化、二氧化和/或三氧化产物(图4)。带有氧化的trp修饰的肽通常显示4、16、32和48da的质量增加,对应于形成犬尿氨酸(kyn)、羟基色氨酸(wox1)和n-甲酰犬尿氨酸/二羟基色氨酸(nfk/wox2,也称为“双重氧化的trp”)、三羟基色氨酸(wox3,也称为“三重氧化的trp”)及其组合,例如羟基犬尿氨酸(kynox1, 20da)。氧化为羟基色氨酸(wox1)(massspectrometricidentificationofoxidativemodificationsoftryptophanresiduesinproteins:chemicalartifactorpost-translationalmodification?j.am.soc.massspectrom.2010年7月;21(7):1114-1117,其全部教导都并入本文)。已发现色氨酸氧化而非甲硫氨酸和组氨酸氧化会在蛋白质产物中产生颜色变化(characterizationofthedegradationproductsofacolor-changedmonoclonalantibody:tryptophan-derivedchromophores.dx.doi.org/10.1021/ac404218t|anal.chem.2014,86,6850-6857)。与色氨酸相似,酪氨酸的氧化主要生成3,4-二羟基苯丙氨酸(dopa)和二酪氨酸(li,s,cschoneich和rt.borchardt.1995.chemicalinstabilityofproteinpharmaceuticals:mechanismsofoxidationandstrategiesforstabilization.biotechnol.bioeng.48:490-500)。[0356]如本文所用,术语“碱性种类”、“碱性区域”和“br”是指蛋白质,例如抗体或其抗原结合部分的变体,其特征在于相对于蛋白质中存在的初级电荷变体种类的总碱性电荷。例如,在重组蛋白制剂中,可通过各种方法,例如离子交换,例如wcx-10hplc(弱阳离子交换色谱)或ief(等电聚焦)检测此类碱性种类。示例性变体可包括但不限于赖氨酸变体、天冬氨酸的异构化、天冬酰胺处的琥珀酰亚胺形成、甲硫氨酸氧化、酰胺化、不完全二硫键形成、从丝氨酸至精氨酸的突变、无糖基化、片段化和聚集。通常,碱性种类的洗脱在cex期间晚于主峰或在aex分析期间早于主峰。(chromatographicanalysisoftheacidicandbasicspeciesofrecombinantmonoclonalantibodies.mabs.2012年9月1日;4(5):578–585.doi:10.4161/mabs.21328,其全部教导都并入本文。)[0357]在某些实施方案中,蛋白质组合物可包含一种以上类型的碱性种类变体。例如但不限于,可基于出现的峰的色谱保留时间对总碱性种类进行划分。可划分总碱性种类的另一个实例可基于变体的类型—变体、结构变体或片段化变体。[0358]如针对酸性种类所论述,术语“碱性种类”不包括过程相关的杂质,并且碱性种类可为产物制备的结果(在本文中称为“制备来源的碱性种类”)或储存的结果(在本文中称为“储存来源的碱性种类”)。[0359]在一个示例性实施方案中,与目标蛋白质相比,抗vegf组合物中碱性种类的量可为至多约15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。抗vegf组合物的实例论述于以下部分iii中。在一个方面,抗vegf组合物可包含选自由以下组成的组的抗vegf蛋白:阿柏西普、重组minitrap(其实例在美国专利第7,279,159号中公开)、scfv和其他抗vegf蛋白。在一个优选的方面,目标重组蛋白是阿柏西普。[0360]如本文所用,“样品基质”或“生物样品”可获自生物工艺的任何步骤,例如细胞培养液(ccf)、收获的细胞培养液(hccf)、下游加工中的任何步骤、原料药(ds)或包含最终配制产物的药品(dp)。在一些其他特定示例性实施方案中,生物样品可选自澄清、色谱产生、病毒灭活或过滤的下游过程的任何步骤。在一些特定示例性实施方案中,药品可选自诊所、运输、储存或处理中的制造药品。[0361]如本文所用,术语“受试者”是指哺乳动物(例如,大鼠、小鼠、猫、狗、奶牛、绵羊、马、山羊、兔),优选是需要预防和/或治疗癌症或血管生成性眼部病症的人类。受试者可能患有癌症或血管生成性眼部病症,或易患癌症或血管生成性眼部病症。[0362]就蛋白质制剂而言,如本文所用,术语“稳定的”是指在本文所定义的示例性条件下储存后,所述制剂内的目标蛋白质能够保持可接受程度的化学结构或生物功能。即使其中所含的目标蛋白质在储存限定量的时间后未保持100%的其化学结构或生物功能,制剂还可为稳定的。在某些情形下,储存限定量的时间后保持约90%、约95%、约96%、约97%、约98%或约99%的蛋白质结构或功能可视为“稳定的”。[0363]术语“治疗(treat)”或“治疗(treatment)”是指逆转、稳定或消除不希望的疾病或病症(例如,血管生成性眼部病症或癌症)的治疗措施,例如,通过使所述种疾病或病症的一种或多种症状或征象消退、稳定或消除任何临床可测量的程度(例如,关于血管生成性眼部病症);通过使糖尿病性视网膜病严重程度评分(drss)降低或维持;通过改善或维持视力(例如,最佳矫正视力,例如,通过etdrs字母的增加来量度);增加或维持视野和/或减小或维持中央视网膜厚度;以及就癌症而言,停止或逆转受试者中的癌细胞的生长、存活和/或转移。通常,治疗措施是向患有疾病或病症的受试者施用一个或多个剂量的治疗有效量的vegfminitrap。[0364]在蛋白质制备的情形下,如本文所用,术语“上游工艺技术”是指涉及在目标蛋白质的细胞培养期间或之后由细胞产生蛋白质和收集蛋白质的活动。如本文所用,术语“细胞培养”是指用于产生和维持能够产生目标重组蛋白的宿主细胞群的方法,以及用于优化目标蛋白质的产生和收集的方法和技术。例如,一旦将表达载体并入合适的宿主细胞中,则可将宿主细胞维持在适于相关核苷酸编码序列的表达以及所需重组蛋白的收集和产生的条件下。[0365]当使用本发明的细胞培养技术时,目标蛋白质可在胞内、在周质空间中产生,或直接分泌至培养基中。在胞内产生目标蛋白质的实施方案中,可通过包括但不限于离心或超滤的多种方式去除微粒碎片-宿主细胞或溶解的细胞(例如,由均质化产生的碎片)。当目标蛋白质分泌至培养基中时,可首先使用市售的蛋白质浓缩过滤器(例如,使用amicontm或milliporepellicontm超滤单元)浓缩来自此类表达系统的上清液。在一个方面,可通过离心,接着深度过滤,随后亲和捕获色谱来收获目标蛋白质。[0366]如本文所用,“vegf拮抗剂”是与vegf结合或相互作用的任何蛋白质或肽。通常,这种与vegf的结合或相互作用会抑制vegf与其受体(vegfr1和vegfr2)的结合,和/或抑制vegf的生物信号传导和活性。vegf拮抗剂包括干扰vegf与天然vegf受体之间的相互作用的分子,例如,与vegf或vegf受体结合并阻止或以其他方式阻碍vegf与vegf受体之间的相互作用的分子。特定的示例性vegf拮抗剂包括抗vegf抗体(例如兰尼单抗(ranibizumab))、抗vegf受体抗体(例如,抗vegfr1抗体、抗vegfr2抗体等)、以及基于vegf受体的嵌合分子或vegf抑制融合蛋白(在本文中也称为“vegf-trap”或“vegfminitrap”),例如阿柏西普、ziv-阿柏西普和具有seqidno.:60的氨基酸的蛋白质。vegf-trap的其他实例是alt-l9、m710、fyb203和chs-2020。vegf-trap的额外实例可见于美国专利第7,070,959号;第7,306,799号;第7,374,757号;第7,374,758号;第7,531,173号;第7,608,261号;第5,952,199号;第6,100,071号;第6,383,486号;第6,897,294号和第7,771,721号中,此类专利明确地通过引用整体并入本文。[0367]基于vegf受体的嵌合分子包括嵌合多肽,其包含vegf受体如vegfr1(也称为flt1)和/或vegfr2(也称为flk1或kdr)的两个或更多个免疫球蛋白(ig)样结构域,并且还可包含多聚结构域(例如,促进两种或更多种嵌合多肽的多聚化[例如,二聚化]的fc结构域)。示例性的基于vegf受体的嵌合分子被称为vegfr1r2-fcδc1(a)的分子(也称为阿柏西普;以商品名出售)。在某些示例性实施方案中,阿柏西普包含如下所列的氨基酸序列:[0368]sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfiisnatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctartelnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassglmtkknstfvrvhekdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfmwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk。(seqidno.:55)[0369]如本文所用,“病毒过滤”可包括使用合适的过滤器进行过滤,所述过滤器包括但不限于来自asahikaseipharma的planova20ntm、50n或bioex;来自emdmillipore的viresolvetm过滤器;来自sartorius的virosartcpv;或来自pallcorporation的ultipordv20或dv50tm过滤器。对于本领域普通技术人员显而易见的是,选择合适的过滤器以获得所需过滤性能。[0370]ii.颜色测定[0371]如本文所用,可通过各种方法来测量在重组蛋白、具体来说抗vegf蛋白的产生期间观察到的颜色。非限制性实例包括使用碘色号、黑曾(hazen)色号、加德纳(gardner)色号、洛维邦德(lovibond)色号、赛氏(saybolt)色号、矿物油色号、欧洲药典色号、美国药典色号、ciel*,a*,b*(或cielab)、凯尔特(klett)色号、hess-ives色号、黄度指数、admi色号以及asbc和ebc啤酒色号。有关此类标度的细节可见于lange的申请报告第3.9e号中,其全部教导都并入本文。[0372]基于欧洲药典(pheur)(欧洲颜色标准,参见europeanpharmacopoeia.第2.2.2章degreeofcolorationofliquids.第8版ep,其全部教导都并入本文)的视觉色彩匹配可包括制备如下中所述的颜色参考溶液:ph.eur.(ep2.2.2.degreeofcolorationofliquids2)-制备红色(氯化钴(ii))、黄色(氯化亚铁(iii))和蓝色(硫酸亚铜(ii))的三种母液以及1%盐酸,黄色(y)、绿黄色(gy)、棕黄色(by)、棕色(b)和红色(r)色相的五种颜色参考溶液。依次使用这五种参考溶液,总共制备三十七种颜色参考溶液(y1-y7、gy1-gy7、by1-by7、b1-b9和r1-r7)。每个参考溶液都在cie-lab色彩空间中由例如明度、色相和色度明确定义。在七个黄棕色标准(by标准)中,by1是最暗标准,而by7是最不暗标准。给定样品与by颜色标准的匹配通常是在漫射日光下进行。欧洲黄棕色颜色标准的组成在下表1中描述。[0373]表1.欧洲棕黄色标准的组成[0374][0375]棕黄色标准溶液(by):10.8g/lfecl3.6h2o、6.0g/lcocl2.6h2o和2.5g/lcuso4.5h2o[0376]液体颜色的测试是通过将测试溶液与标准颜色溶液进行比较来进行。根据测试溶液颜色的色相和强度来选择标准颜色溶液的组成。通常,比较是在无色、透明、中性玻璃的平底试管中进行,所述试管的内径和所有其他方面都应尽可能匹配(例如,直径为约12、15、16或25mm的试管)。例如,比较可在2或10ml的测试溶液与标准颜色溶液之间进行。液体的深度例如可为约15、25、40或50mm。分配给测试溶液的颜色不应比标准颜色更强烈。颜色比较通常是在针对白色背景的漫射光(例如,日光)下进行。可沿试管的垂直轴或水平轴比较颜色。[0377]与ep颜色测量对比,uspmonograph1061color–instrumentalmeasurement引用ciel*,a*,b*(或cielab)颜色测量的使用以便精确和客观地量化颜色。在美国药典中定义总共二十种颜色参考溶液(依次由字母a至t识别)。所测量样品的颜色自动与颜色参考溶液相关。这意味着展示最接近样品的颜色参考溶液(即,与样品颜色具有最小色差δe*的参考溶液)。δl*、δa*和δb*值给出样品的l*、a*和b*值与所示usp溶液的l*、a*和b*值之间的定量差异。ciel*a*b*坐标系,l*代表颜色的明度,标度为0–100,其中0是最暗并且100是最亮;a*代表颜色的红度或绿度(正值a*代表红色,而负值a*代表绿色),并且b*代表样品的黄度或蓝度,其中正值b*代表黄色,而负值b*代表蓝色。与标准或评估中的初始样品的颜色差异可通过个别颜色组分的变化δl*、δa*和δb*来表示。复合变化或颜色差异可使用下式来计算作为空间中的简单欧氏距离(euclidiandistance):可例如使用hunterlabsultrascanpro(hunterassociateslaboratory,reston,virginia)或bykgardnerlcsiv(byk-gardner,columbia,maryland)生成ciel*,a*,b*颜色坐标。对于hunterlabsultrascanpro,可执行didymiumfiltertest以用于波长校准。仪器在使用前可在具有0.780英寸端口插件和diw的ttran中标准化;因此,使用光阱和黑卡建立光度标度的顶部(l=100)和底部(l=0)。参见pack等人,modernizationofphysicalappearanceandsolutioncolortestsusingquantitativetristimuluscolorimetry:advantages,harmonization,andvalidationstrategies,j.pharmaceuticalsci.104:3299-3313(2015),其全部教导都并入本文。by标准的颜色也可在ciel*,a*,b*颜色空间(“cielab”或“cielab”颜色空间)下表示。参见表2。[0378]表2.ciel*,a*,b*颜色空间中欧洲棕黄色颜色标准的表征[0379]标准l*^a*^b*^l*~a*~b*~by193.95-2.7628.5592.84-3.1631.15by294.76-2.9622.6994.25-3.7726.28by396.47-2.8416.4195.92-3.4418.52by497.17-1.949.0797.67-2.6310.70by598.91-1.194.7398.75-1.615.77by699.47-0.592.0999.47-0.712.38by799.37-0.311.1399.71-0.371.17[0380]^由pack等人报告[0381]~本文中以实验方式测量-l*和b*值,针对每个by颜色标准[0382]为了对颜色测定进行高通量筛选,与by颜色标准相比,分光光度测定法(cielab)是更适合且更具量化性的量度。如实施例部分所述,进一步优化替代测定。[0383]对于评估颜色的任何样品,必须针对样品中的蛋白质浓度标准化测试样品的蛋白质浓度,例如5g/l、10g/l等用于比较。[0384]iii.抗vegf组合物[0385]调节vegf信号通路的vegf蛋白质家族中有至少有五个成员:vegf-a、vegf-b、vegf-c、vegf-d和胎盘生长因子(plgf)。抗vegf组合物可包含vegf拮抗剂,其与vegf蛋白质家族的一个或多个成员特异性相互作用,并抑制其一种或多种生物活性,例如其促有丝分裂、血管生成和/或血管通透性活性。[0386]在一个实施方案中,产生抗vegf蛋白的方法包括:(a)提供经基因工程化以表达抗vegf蛋白的宿主细胞;(b)在适于细胞表达抗vegf蛋白的条件下在cdm中培养宿主细胞;以及(c)收获由细胞产生的抗vegf蛋白的制剂。在一个方面,抗vegf蛋白选自由以下组成的组:阿柏西普、重组minitrap(其实例在美国专利第7,279,159号中公开)、scfv和其他抗vegf蛋白。在一个优选的方面,目标重组蛋白是阿柏西普。[0387]本发明人发现,在某些cdm中制造抗vegf蛋白(例如,阿柏西普)产生呈现独特颜色的生物样品。在不同制造步骤中并且甚至在包含抗vegf蛋白的最终制剂中都观察到不同颜色特性。如实施例9中所观察,为了产生vegfminitrap,在cdm中培养细胞产生具有强烈的黄棕色的抗vegf蛋白(例如,阿柏西普)。收获后的亲和捕获步骤还产生呈现某种颜色(黄棕色)的洗脱液。使用aex的其他产生步骤也呈现黄棕色,但强度降低。[0388]如下文中更详细地描述,颜色可使用以下手段来评价:(i)欧洲颜色标准by,其中进行定性目视检查;或(ii)比色测定,cielab,其比by系统更具量化性。然而,无论哪种情况,都应针对蛋白质浓度将多个样品之间的颜色评价进行归一化,以确保有意义的评价/比较。例如,参看实施例9,特别是表9-2,蛋白a洗脱液具有约2.52的b*值,大致相当于by5的by值(在蛋白a洗脱液中以5g/l的蛋白质浓度测量时)。如果要将蛋白a洗脱液的颜色与另一样品进行比较,则应使用相同的蛋白质浓度进行所述比较。因此,将蛋白a洗脱液与具有约0.74的b*值(在蛋白a洗脱液中以5g/l的蛋白质浓度测量时)的aex池相比较,产生方法显示在aex色谱之后,从蛋白a洗脱液至aex池,样品的黄棕色大幅减弱。[0389]本发明的组合物的特征可在于如本文所论述的黄棕色,例如,不比欧洲棕黄色颜色标准by2-by3、by3-by4、by4-by5或by5-by6更暗/强烈,和/或具有b*值17-23、10-17、5-10、3-5或1-3,其中组合物包含约5g/l的抗vegf蛋白或约10g/l的抗vegf蛋白,并且其中组合物是从澄清收获物或澄清收获物的蛋白a洗脱液中作为样品获得。[0390]在一个实施方案中,使用cdm产生的本发明的组合物产生具有明显黄棕色的生物样品,其中所述样品可通过公认的标准颜色表征来表征:[0391](i)黄棕色不超过欧洲颜色标准by2;[0392](ii)黄棕色不超过欧洲颜色标准by3;[0393](iii)黄棕色不超过欧洲颜色标准by4;[0394](iv)黄棕色不超过欧洲颜色标准by5;[0395](v)介于欧洲颜色标准by2与by3之间;[0396](vi)介于欧洲颜色标准by3与by4之间;[0397](vii)介于欧洲颜色标准by4与by5之间,其中组合物包含约5g/l或约10g/l的抗vegf蛋白并且其中组合物是从澄清收获物的蛋白a洗脱液中作为样品获得。[0398]在另一个实施方案中,使用cdm产生的本发明的组合物产生具有明显黄棕色的生物样品,其中所述组合物通过cielab标度中公认的标准颜色表征来表征:[0399](i)黄棕色不超过约22-23的b*值;[0400](ii)黄棕色不超过约16-17的b*值;[0401](iii)黄棕色不超过9-10的b*值;[0402](iv)黄棕色不超过4-5的b*值;[0403](v)黄棕色不超过2-3的b*值;[0404](vi)介于17-23之间的b*值;[0405](vii)介于10-17之间的b*值;[0406](viii)介于5-10之间的b*值;[0407](ix)介于3-5之间的b*值;或[0408](x)介于1-3之间的b*值,其中组合物包含约5g/l或约10g/l的抗vegf蛋白并且其中组合物是从澄清收获物的蛋白a洗脱液中作为样品获得。[0409]在一个实施方案中,使用cdm产生的本发明的组合物可包含抗vegf蛋白的其他种类或变体。这些变体包括抗vegf蛋白同功型,其包含一个或多个氧化的氨基酸残基,所述同功型统称为氧代变体。此类包含抗vegf蛋白及其氧代变体的组合物的酶消化物可包含以下一者或多者:[0410]eiglltc*eatvngh*lyk(seqidno.:18),其包含约0.004-0.013%的2-氧代-组氨酸,[0411]qtntiidvvlspsh*gielsvgek(seqidno.:19),其包含约0.006-0.028%的2-氧代-组氨酸,[0412]telnvgidfnweypsskh*qhk(seqidno.:20),其包含约0.049-0.085%的2-氧代-组氨酸,[0413]dkth*tc*ppc*papellg(seqidno.:17),其包含约0.057-0.092%的2-氧代-组氨酸,[0414]tnylth*r(seqidno.:21),其包含约0.008-0.022%的2-氧代-组氨酸,和/或[0415]iiwdsr(seqidno.:56),其包含约0.185-0.298%的二氧化色氨酸;[0416]或[0417]eiglltc*eatvngh*lyk(seqidno.:18),其包含约0.008%的2-氧代-组氨酸,[0418]qtntiidvvlspsh*gielsvgek(seqidno.:19),其包含约0.02%的2-氧代-组氨酸,[0419]telnvgidfnweypsskh*qhk(seqidno.:20),其包含约0.06%的2-氧代-组氨酸,[0420]dkth*tc*ppc*papellg(seqidno.:17),其包含约0.07%的2-氧代-组氨酸,[0421]tnylth*r(seqidno.:21),其包含约0.01%的2-氧代-组氨酸,和/或[0422]iiwdsr(seqidno.:56),其包含约0.23%的二-氧代-色氨酸,其中h*是可被氧化成2-氧代-组氨酸的组氨酸,并且其中c*是可被羧甲基化的半胱氨酸。在一个特定实施方案中,抗vegf蛋白是阿柏西普。在另一个实施方案中,抗vegf蛋白是vegfminitrap。[0423]在本发明的一个示例性实施方案中,本发明的组合物可包含抗vegf蛋白,其中抗vegf蛋白中不多于约1%、不多于约0.1%或约0.1-1%、0.2-1%、0.3-1%、0.4-1%、0.5-1%、0.6-1%、0.7-1%、0.8-1%或0.9-1%的组氨酸残基是2-氧代-组氨酸。在此类组合物中,可存在抗vegf蛋白变体的异质群体,每个变体具有不同量的2-氧代-组氨酸残基和未氧化的组氨酸残基。因此,组合物中的2-氧代-组氨酸抗vegf蛋白的百分比是指抗vegf分子中的位点特异性2-氧代-组氨酸除以抗vegf蛋白分子中的总位点特异性组氨酸(氧化加未氧化)乘以100。定量组合物中的2-氧代-组氨酸水平的一种方法是用蛋白酶(例如,lys-c和/或胰蛋白酶)消化多肽和通过例如质谱(ms)分析所得肽中的2-氧代-组氨酸的量。[0424]在消化抗vegf蛋白之前,半胱氨酸巯基通过与碘乙酰胺(iam)的反应被阻断,产生由以下化学结构表示的残基:[0425]此类修饰保护游离硫醇免于重整二硫桥,并防止二硫键加扰。本发明包括包含抗vegf蛋白及其变体的组合物(例如,水性组合物),当用iam修饰并用蛋白酶(例如,lys-c和胰蛋白酶)消化并通过质谱进行分析时,其包含以下肽:[0426]eiglltc*eatvngh*lyk(seqidno.:18),其包含约0.004-0.013%的2-氧代-组氨酸,[0427]qtntiidvvlspsh*gielsvgek(seqidno.:19),其包含约0.006-0.028%的2-氧代-组氨酸,[0428]telnvgidfnweypsskh*qhk(seqidno.:20),其包含约0.049-0.085%的2-氧代-组氨酸,[0429]dkth*tc*ppc*papellg(seqidno.:17),其包含约0.057-0.092%的2-氧代-组氨酸,[0430]tnylth*r(seqidno.:21),其包含约0.008-0.022%的2-氧代-组氨酸,和/或[0431]iiwdsr(seqidno.:56),其包含约0.185-0.298%的二氧化色氨酸;[0432]或ms)分析从亲和步骤中提取的样品时,可检测到一种或多种这些变体。[0444]本发明包括包含抗vegf蛋白的组合物,其中抗vegf蛋白中所有色氨酸的约0.1%-10%被修饰为三羟基色氨酸。此外,组合物的颜色不比欧洲棕黄色颜色标准by2-by3、by3-by4、by4-by5或by5-by6更暗/强烈,和/或具有如通过ciel*,a*,b*所表征的以下b*值:约17-23、10-17、5-10、3-5或1-3,其中组合物包含约5g/l的抗vegf蛋白或约10g/l的抗vegf蛋白。组合物是从澄清收获物或澄清收获物的蛋白a洗脱液中作为样品获得。此类组合物可使用捕获色谱获得。捕获步骤是使用例如蛋白a亲和柱的亲和色谱程序。当使用液相色谱-质谱法(lc-ms)分析从亲和中提取的样品时,可检测到一种或多种这些变体。[0445]在一个实施方案中,本发明的组合物可包含抗vegf蛋白,其中抗vegf蛋白可包含如下一个或多个残基的修饰:一个或多个天冬酰胺被脱酰胺;一个或多个天冬氨酸被转化为异天冬氨酸和/或asn;一个或多个甲硫氨酸被氧化;一个或多个色氨酸被转化为n-甲酰犬尿氨酸;一个或多个色氨酸是单羟基色氨酸;一个或多个色氨酸是二羟基色氨酸;一个或多个色氨酸是三羟基色氨酸;一个或多个精氨酸被转化为arg3-脱氧葡糖醛酮;c末端甘氨酸不存在;和/或存在一个或多个非糖基化糖位点。[0446]此类组合物可从使用包含抗vegf蛋白以及其变体的cdm制成的澄清收获物中获得,所述澄清收获物经历例如捕获色谱程序。捕获步骤是使用例如蛋白a柱的亲和色谱程序。当使用例如液相色谱-质谱法(lc-ms)分析从亲和步骤中提取的样品时,可检测到一种或多种这些变体。[0447]在一个示例性实施方案中,本发明的组合物可包含具有阿柏西普的结构特征的抗vegf蛋白,其可在以下一者或多者处被氧化:his86、his110、his145、his209、his95、his19和/或his203(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置);trp58和/或trp138(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置);tyr64(或具有阿柏西普的某些结构特征的蛋白质上的等效位置);phe44和/或phe166(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置);和/或met10、met20、met163和/或met192(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置。此类组合物可从使用包含阿柏西普以及其氧代变体的cdm制成的澄清收获物中获得,所述澄清收获物经历捕获色谱程序。捕获步骤可为使用例如蛋白a柱的亲和色谱程序。当使用例如液相色谱-质谱法(lc-ms)分析从亲和步骤中提取的样品时,可检测到一种或多种这些变体。[0448]在一个实施方案中,本发明的组合物可包含具有氨基酸序列seqidno.:46的vegfminitrap,其可在以下各处被氧化:his86、his110、his145、his209、his95、his19和/或his203;trp58和/或trp138;tyr64;phe44和/或phe166;和/或met10、met20、met163和/或met192。此类组合物可从使用包含vegfminitrap以及其氧代变体的cdm制成的澄清收获物中获得,所述澄清收获物经历捕获色谱程序。捕获步骤是使用例如蛋白a柱的亲和色谱程序-当使用液相色谱-质谱法(lc-ms)进行分析时,可检测到一种或多种这些变体。[0449]在一些示例性实施方案中,本发明的组合物可包含抗vegf蛋白及其变体(包括氧代变体),其中组合物中的蛋白质变体的量可为至多约20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。此类组合物可从使用包含抗vegf蛋白以及其变体的cdm制成的澄清收获物中获得,所述澄清收获物经历捕获色谱程序。捕获步骤是使用例如蛋白a柱的亲和色谱程序-当使用液相色谱-质谱法(lc-ms)进行分析时,可检测到一种或多种这些变体。在一个方面,这种组合物的颜色不比例如欧洲棕黄色颜色标准by2-by3、by3-by4、by4-by5或by5-by6更暗/强烈,和/或具有如通过ciel*,a*,b*所表征的以下b*值:约17-23、10-17、5-10、3-5或1-3,其中组合物包含约5g/l或约10g/l的抗vegf蛋白。[0450]在其他示例性实施方案中,本发明的组合物可包含抗vegf蛋白及其变体,其中组合物中的蛋白质变体的量可为约0%至约20%,例如,约0%至约20%、约0.05%至约20%、约0.1%至约20%、约0.2%至约20%、约0.3%至约20%、约0.4%至约20%、约0.5%至约20%、约0.6%至约20%、约0.7%至约20%、约0.8%至约20%、约0.9%至约20%、约1%至约20%、约1.5%至约20%、约2%至约20%、约3%至约20%、约4%至约20%、约5%至约20%、约6%至约20%、约7%至约20%、约8%至约20%、约9%至约20%、约10%至约20%、约0%至约10%、约0.05%至约10%、约0.1%至约10%、约0.2%至约10%、约0.3%至约10%、约0.4%至约10%、约0.5%至约10%、约0.6%至约10%、约0.7%至约10%、约0.8%至约10%、约0.9%至约10%、约1%至约10%、约1.5%至约10%、约2%至约10%、约3%至约10%、约4%至约10%、约5%至约10%、约6%至约10%、约7%至约10%、约8%至约10%、约9%至约10%、约0%至约7.5%、约0.05%至约7.5%、约0.1%至约7.5%、约0.2%至约7.5%、约0.3%至约7.5%、约0.4%至约7.5%、约0.5%至约7.5%、约0.6%至约7.5%、约0.7%至约7.5%、约0.8%至约7.5%、约0.9%至约7.5%、约1%至约7.5%、约1.5%至约7.5%、约2%至约7.5%、约3%至约7.5%、约4%至约7.5%、约5%至约7.5%、约6%至约7.5%、约7%至约7.5%、约0%至约5%、约0.05%至约5%、约0.1%至约5%、约0.2%至约5%、约0.3%至约5%、约0.4%至约5%、约0.5%至约5%、约0.6%至约5%、约0.7%至约5%、约0.8%至约5%、约0.9%至约5%、约1%至约5%、约1.5%至约5%、约2%至约5%、约3%至约5%、约4%至约5%,以及在上述一者或多者内的范围。此类组合物可通过对收获物样品进行捕获色谱而获得。捕获步骤是使用例如蛋白a柱的亲和色谱程序。当使用液相色谱-质谱法(lc-ms)分析样品时,可检测到一种或多种这些变体。在一个方面,这种组合物的颜色不比例如欧洲棕黄色颜色标准by2-by3、by3-by4、by4-by5或by5-by6更暗/强烈,和/或具有如通过ciel*,a*,b*所表征的以下b*值:约17-23、10-17、5-10、3-5或1-3,其中组合物包含约5g/l或约10g/l的抗vegf蛋白。[0451]在一个实施方案中,本发明的组合物可包含抗vegf蛋白,包括其酸性种类,其中组合物中的酸性种类的量可为约20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。如前述所论述,此类酸性种类可通过各种方法如离子交换,例如wcx(wcx-10hplc,弱阳离子交换色谱)或ief(等电聚焦)来检测。通常,酸性种类的洗脱在cex期间早于主峰或在aex分析期间晚于主峰(参见图16和图17)。包含酸性种类的组合物可使用离子交换色谱由生物材料(例如收获物或亲和产生的材料)获得。[0452]在一个方面,这种组合物的颜色不比例如欧洲棕黄色颜色标准by2-by3、by3-by4、by4-by5或by5-by6更暗/强烈,和/或具有如通过ciel*,a*,b*所表征的以下b*值:约17-23、10-17、5-10、3-5或1-3,其中组合物包含约5g/l或约10g/l。作为一个实例,参看图16和图17,级分f1和f2代表包含大部分酸性种类的酸性级分。图17中的mt1的峰1和2包含酸性种类,并且级分f1和f2包含大部分酸性级分。与其他级分相比,包含此类酸性种类的级分(f1和f2)也显示出黄棕色(图18b和图18c)。[0453]在另一个实施方案中,本发明的组合物包含抗vegf蛋白,包括其酸性种类,其中组合物中的酸性种类的量可为约0%至约20%,例如,约0%至约20%、约0.05%至约20%、约0.1%至约20%、约0.2%至约20%、约0.3%至约20%、约0.4%至约20%、约0.5%至约20%、约0.6%至约20%、约0.7%至约20%、约0.8%至约20%、约0.9%至约20%、约1%至约20%、约1.5%至约20%、约2%至约20%、约3%至约20%、约4%至约20%、约5%至约20%、约6%至约20%、约7%至约20%、约8%至约20%、约9%至约20%、约10%至约20%、约0%至约10%、约0.05%至约10%、约0.1%至约10%、约0.2%至约10%、约0.3%至约10%、约0.4%至约10%、约0.5%至约10%、约0.6%至约10%、约0.7%至约10%、约0.8%至约10%、约0.9%至约10%、约1%至约10%、约1.5%至约10%、约2%至约10%、约3%至约10%、约4%至约10%、约5%至约10%、约6%至约10%、约7%至约10%、约8%至约10%、约9%至约10%、约0%至约7.5%、约0.05%至约7.5%、约0.1%至约7.5%、约0.2%至约7.5%、约0.3%至约7.5%、约0.4%至约7.5%、约0.5%至约7.5%、约0.6%至约7.5%、约0.7%至约7.5%、约0.8%至约7.5%、约0.9%至约7.5%、约1%至约7.5%、约1.5%至约7.5%、约2%至约7.5%、约3%至约7.5%、约4%至约7.5%、约5%至约7.5%、约6%至约7.5%、约7%至约7.5%、约0%至约5%、约0.05%至约5%、约0.1%至约5%、约0.2%至约5%、约0.3%至约5%、约0.4%至约5%、约0.5%至约5%、约0.6%至约5%、约0.7%至约5%、约0.8%至约5%、约0.9%至约5%、约1%至约5%、约1.5%至约5%、约2%至约5%、约3%至约5%、约4%至约5%,以及在上述一者或多者内的范围。如上所述,可通过各种方法如离子交换,例如wcx(wcx-10hplc,弱阳离子交换色谱)或ief(等电聚焦)来检测此类酸性种类。典型地,酸性种类的洗脱在cex期间早于主峰或在aex分析期间晚于主峰(参见图16和图17)。[0454]使用阳离子交换柱,将目标主峰之前洗脱的所有峰累加为酸性区域,而目标蛋白后洗脱的所有峰累加为碱性区域。在示例性实施方案中,基于峰的特定保留时间和所用离子交换柱,可将酸性种类洗脱为两个或更多个酸性区域,并且可编号为ar1、ar2、ar3等等。[0455]在一个实施方案中,组合物可包含抗vegf蛋白,包括酸性种类,其中ar1为20%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白,包括其酸性种类,其中ar1为约0.0%至约10%、约0.0%至约5%、约0.0%至约4%、约0.0%至约3%、约0.0%至约2%、约3%至约5%、约5%至约8%、或约8%至约10%、或约10%至约15%,以及在上述一者或多者内的范围。如上文所论述,可通过各种方法如离子交换,例如wcx(wcx-10hplc,弱阳离子交换色谱)或ief(等电聚焦)来检测此类酸性区域。通常,酸性种类的洗脱在cex期间早于主峰或在aex分析期间晚于主峰(参见图16和图17)。[0456]在另一个实施方案中,组合物可包含抗vegf蛋白,包括酸性种类,其中ar2为20%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白,包括酸性种类,其中ar2为约0.0%至约10%、约0.0%至约5%、约0.0%至约4%、约0.0%至约3%、约0.0%至约2%、约3%至约5%、约5%至约8%、或约8%至约10%、或约10%至约15%,以及在上述一者或多者内的范围。[0457]在一个实施方案中,组合物可包含抗vegf蛋白,包括碱性种类,其中组合物中的碱性种类的量可为至多约20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白及其碱性种类,其中与抗vegf蛋白相比,组合物中的碱性种类的量可为0%至约20%,例如,约0%至约20%、约0.05%至约20%、约0.1%至约20%、约0.2%至约20%、约0.3%至约20%、约0.4%至约20%、约0.5%至约20%、约0.6%至约20%、约0.7%至约20%、约0.8%至约20%、约0.9%至约20%、约1%至约20%、约1.5%至约20%、约2%至约20%、约3%至约20%、约4%至约20%、约5%至约20%、约6%至约20%、约7%至约20%、约8%至约20%、约9%至约20%、约10%至约20%、约0%至约10%、约0.05%至约10%、约0.1%至约10%、约0.2%至约10%、约0.3%至约10%、约0.4%至约10%、约0.5%至约10%、约0.6%至约10%、约0.7%至约10%、约0.8%至约10%、约0.9%至约10%、约1%至约10%、约1.5%至约10%、约2%至约10%、约3%至约10%、约4%至约10%、约5%至约10%、约6%至约10%、约7%至约10%、约8%至约10%、约9%至约10%、约0%至约7.5%、约0.05%至约7.5%、约0.1%至约7.5%、约0.2%至约7.5%、约0.3%至约7.5%、约0.4%至约7.5%、约0.5%至约7.5%、约0.6%至约7.5%、约0.7%至约7.5%、约0.8%至约7.5%、约0.9%至约7.5%、约1%至约7.5%、约1.5%至约7.5%、约2%至约7.5%、约3%至约7.5%、约4%至约7.5%、约5%至约7.5%、约6%至约7.5%、约7%至约7.5%、约0%至约5%、约0.05%至约5%、约0.1%至约5%、约0.2%至约5%、约0.3%至约5%、约0.4%至约5%、约0.5%至约5%、约0.6%至约5%、约0.7%至约5%、约0.8%至约5%、约0.9%至约5%、约1%至约5%、约1.5%至约5%、约2%至约5%、约3%至约5%、约4%至约5%,以及在上述一者或多者内的范围。[0458]可将碱性种类洗脱为两个或更多个碱性区域,并且可根据峰的特定保留时间和所用离子交换将其编号为br1、br2、br3等等。[0459]在一个实施方案中,组合物可包含抗vegf蛋白,包括其碱性种类,其中br1为15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白及其碱性种类,其中br1为约0.0%至约10%、约0.0%至约5%、约0.0%至约4%、约0.0%至约3%、约0.0%至约2%、约3%至约5%、约5%至约8%、或约8%至约10%、或约10%至约15%,以及在上述一者或多者内的范围。[0460]在另一个实施方案中,组合物可包含抗vegf蛋白及其碱性种类,其中br2为15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白和抗vegf蛋白的其碱性种类,其中br2为约0.0%至约10%、约0.0%至约5%、约0.0%至约4%、约0.0%至约3%、约0.0%至约2%、约3%至约5%、约5%至约8%、或约8%至约10%、或约10%至约15%,以及在上述一者或多者内的范围。[0461]在另一个实施方案中,组合物可包含抗vegf蛋白及其碱性种类,其中br3为15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4.5%、4%、3.5%、3%、2.5%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或0.0%,以及在上述一者或多者内的范围。在一个方面,组合物可包含抗vegf蛋白和抗vegf蛋白的其碱性种类,其中br3为约0.0%至约10%、约0.0%至约5%、约0.0%至约4%、约0.0%至约3%、约0.0%至约2%、约3%至约5%、约5%至约8%、或约8%至约10%、或约10%至约15%,以及在上述一者或多者内的范围。[0462]阿柏西普的光诱导氧化[0463]除了发现使用cdm产生的抗vegf蛋白组合物的不同颜色特征或变体之外,本发明人还发现可在实验室中通过暴露于光来人工产生此类组合物。[0464]可通过使抗vegf蛋白暴露于冷白光或紫外光来产生抗vegf组合物的经修饰(包括经氧化)的变体。在一个方面,与样品相比,抗vegf组合物可包含一种或多种经修饰的寡肽约1.5至约50倍的增加,其中所述寡肽选自由以下组成的组:[0465]dkth*tc*ppc*papellg(seqidno.:17)、eiglltc*eatvngh*lyk(seqidno.:18)、qtntiidvvlspsh*gielsvgek(seqidno.:19)、telnvgidfnweypsskh*qhk(seqidno.:20)、tnylth*r(seqidno.:21)、sdtgrpfvemyseipeiih*mtegr(seqidno.:22)、vh*ekdk(seqidno.:23)、sdtgrpfvem*yseipeiihmtegr(seqidno.:64)、sdtgrpfvemyseipeiihm*tegr(seqidno.:65)、tqsgsem*k(seqidno.:66)、sdqglytc*aassglm*tk(seqidno.:67)、iiw*dsr/riiw*dsr/iiw*dsrk(seqidno.:28)、telnvgidfnw*eypssk(seqidno.:29)、gfiisnaty*k(seqidno.:69)、kf*pldtlipdgk(seqidno.:70)、f*lstltidgvtr(seqidno.:32),其中h*是被氧化为2-氧代-组氨酸的组氨酸,其中c*是被羧甲基化的半胱氨酸,其中m*是被氧化的甲硫氨酸,其中w*是被氧化的色氨酸,其中y*是被氧化的酪氨酸,并且其中f*是被氧化的苯丙氨酸。在另一方面,通过使抗vegf组合物暴露于冷白光一段时间,例如约30小时,抗vegf组合物可包含一种或多种经修饰的寡肽约1.5至约10倍的增加。在另一方面,通过使样品暴露于冷白光约75小时,抗vegf组合物可包含一种或多种经修饰的寡肽约1.5至约10倍的增加。在又一方面,通过使样品暴露于冷白光约100小时,抗vegf组合物可包含上述一种或多种寡肽约1.5至约20倍的增加。在又一方面,通过使样品暴露于冷白光约150小时,抗vegf组合物可包含上述一种或多种寡肽约1.5至约20倍的增加。在再一方面,通过使样品暴露于冷白光约300小时,抗vegf组合物可包含一种或多种寡肽约1.5至约50倍的增加—参见下文实施例4。41%、1-42%、1-43%、1-44%、1-45%、1-46%、1-47%、1-48%、1-49%、1-50%、2-10%、2-15%、2-20%、2-25%、2-30%、2-35%、2-40%、2-41%、2-42%、2-43%、2-44%、2-45%、2-46%、2-47%、2-48%、2-49%、2-50%、3-10%、3-15%、3-20%、3-25%、3-30%、3-35%、3-40%、3-41%、3-42%、3-43%、3-44%、3-45%、3-46%、3-47%、3-48%、3-49%、3-50%、4-10%、4-15%、4-20%、4-25%、4-30%、4-35%、4-40%、4-41%、4-42%、4-43%、4-44%、4-45%、4-46%、4-47%、4-48%、4-49%、4-50%或1-99%。[0477]在一个实施方案中,抗vegf蛋白可具有水平降低了约1%、1.2%、1.5%、2%、2.2%、2.5%、3%、3.2%、3.5%、4%、4.2%、4.5%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%的唾液酸化聚糖。与使用大豆水解物产生的抗vegf蛋白中的唾液酸化聚糖水平相比,在一个或多个前述值内的范围:例如,1-10%、1-15%、1-20%、1-25%、1-30%、1-35%、1-40%、1-41%、1-42%、1-43%、1-44%、1-45%、1-46%、1-47%、1-48%、1-49%、1-50%、2-10%、2-15%、2-20%、2-25%、2-30%、2-35%、2-40%、2-41%、2-42%、2-43%、2-44%、2-45%、2-46%、2-47%、2-48%、2-49%、2-50%、3-10%、3-15%、3-20%、3-25%、3-30%、3-35%、3-40%、3-41%、3-42%、3-43%、3-44%、3-45%、3-46%、3-47%、3-48%、3-49%、3-50%、4-10%、4-15%、4-20%、4-25%、4-30%、4-35%、4-40%、4-41%、4-42%、4-43%、4-44%、4-45%、4-46%、4-47%、4-48%、4-49%、4-50%或1-99%。[0478]在另一个实施方案中,抗vegf蛋白可具有水平降低了约1%、1.2%、1.5%、2%、2.2%、2.5%、3%、3.2%、3.5%、4%、4.2%、4.5%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%的半乳糖基化聚糖。与使用大豆水解物产生的抗vegf蛋白中的半乳糖基化聚糖水平相比,在一个或多个前述值内的范围:例如,1-10%、1-15%、1-20%、1-25%、1-30%、1-35%、1-40%、1-41%、1-42%、1-43%、1-44%、1-45%、1-46%、1-47%、1-48%、1-49%、1-50%、2-10%、2-15%、2-20%、2-25%、2-30%、2-35%、2-40%、2-41%、2-42%、2-43%、2-44%、2-45%、2-46%、2-47%、2-48%、2-49%、2-50%、3-10%、3-15%、3-20%、3-25%、3-30%、3-35%、3-40%、3-41%、3-42%、3-43%、3-44%、3-45%、3-46%、3-47%、3-48%、3-49%、3-50%、4-10%、4-15%、4-20%、4-25%、4-30%、4-35%、4-40%、4-41%、4-42%、4-43%、4-44%、4-45%、4-46%、4-47%、4-48%、4-49%、4-50%或1-99%。[0479]在一个实施方案中,抗vegf蛋白可具有水平提高了约1%、1.2%、1.5%、2%、2.2%、2.5%、3%、3.2%、3.5%、4%、4.2%、4.5%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%的甘露糖基化聚糖。与使用大豆水解物产生的抗vegf蛋白中的甘露糖基化聚糖水平相比,在一个或多个前述值内的范围:例如,1-10%、1-15%、1-20%、1-25%、1-30%、1-35%、1-40%、1-41%、1-42%、1-43%、1-44%、1-45%、1-46%、1-47%、1-48%、1-49%、1-50%、2-10%、2-15%、2-20%、2-25%、2-30%、2-35%、2-40%、2-41%、2-42%、2-43%、2-44%、2-45%、2-46%、2-47%、2-48%、2-49%、2-50%、3-10%、3-15%、3-20%、3-25%、3-30%、3-35%、3-40%、3-41%、3-42%、3-43%、3-44%、3-45%、3-46%、3-47%、3-48%、3-49%、3-50%、4-10%、4-15%、4-20%、4-25%、4-30%、4-35%、4-40%、4-41%、4-42%、4-43%、4-44%、4-45%、4-46%、4-47%、4-48%、4-49%、4-50%或1-99%。[0480]这个部分中所述的组合物可分别由以下部分iv和v中所述的若干个上游和下游参数产生。[0481]iv.使用上游工艺技术制备组合物[0482]对于生物制剂来说,需要施行强健而灵活的上游工艺。有效的上游工艺可实现目标蛋白质的所需产生和按比例放大。本发明人发现包含抗vegf蛋白的本发明的组合物可通过调节上游蛋白产生期间的条件,例如cdm的培养基组分的变化来产生。上游工艺中的每个步骤都会影响所制造的蛋白质的质量、纯度和数量。[0483]本公开提供了使用cdm产生的阿柏西普和/或minitrap的某些变体的存在的证据。这些变体包括包含一个或多个被氧化的氨基酸残基的同功型。被氧化残基的实例包括但不限于一个或多个组氨酸、色氨酸、甲硫氨酸、苯丙氨酸或酪氨酸残基。通过使用经修饰的cdm产生的组合物可产生抗vegf蛋白的制剂,所述制剂具有阿柏西普和/或minitrap的蛋白质变体的所需目标值。如上所述,还可存在与使用cdm产生的级分相关的黄棕色。(如上文所提及,并非本发明人测试的所有cdm都显示出明显变色。)[0484]本发明包括在细胞表达目标重组蛋白的合适条件下在经修饰的cdm中培养宿主细胞,接着收获由细胞产生的目标重组蛋白的制剂。这种经修饰的cdm可用于产生如上文部分iii中所述的组合物。(注意,cdm是表达阿柏西普时存在黄棕色的培养基。)[0485]在一个实施方案中,所述方法包括在合适的条件下在cdm中培养宿主细胞,其中宿主细胞表达目标重组蛋白,例如阿柏西普。所述方法还包括收获由细胞产生的目标重组蛋白的制剂,其中合适的条件包括具有以下的cdm:在所述cdm中小于约55μm的铁累积浓度、在所述cdm中小于或等于约0.8μm的铜累积浓度、在所述cdm中小于或等于约0.40μm的镍累积浓度、在所述cdm中小于或等于约56μm的锌累积浓度、在所述cdm中小于约10mm的半胱氨酸累积浓度;和/或在所述cdm中对于单一抗氧化剂来说浓度为约0.001mm至约10mm的抗氧化剂,和如果在所述cdm中添加多种抗氧化剂,则不大于约30mm的累积浓度。[0486]在本实施方案的一个方面,使用合适的条件获得的制剂造成阿柏西普和vegfminitrap的蛋白质变体减少至所需量的阿柏西普和vegfminitrap的蛋白质变体(称为阿柏西普和vegfminitrap的蛋白质变体的“目标值”)。在这个实施方案的另一个方面,当将包括阿柏西普和vegfminitrap的变体的蛋白质制剂归一化为5g/l、10g/l或甚至更高的浓度时,使用合适的条件获得的制剂导致制剂的颜色减至所需by值(称为“目标by值”)。[0487]在本实施方案的另一个方面,变体的目标by值和/或目标值可在效价增加或不显著减小的制剂中获得(参见实施例5)。[0488]在一些实施方案中,通过使用经修饰的cdm产生的组合物可产生具有所需目标by值的抗vegf蛋白的制剂,其中所述制剂的颜色表征如下:[0489](i)黄棕色不超过欧洲颜色标准by2;[0490](ii)黄棕色不超过欧洲颜色标准by3;[0491](iii)黄棕色不超过欧洲颜色标准by4;[0492](iv)黄棕色不超过欧洲颜色标准by5;[0493](v)介于欧洲颜色标准by2与by3之间;[0494](vi)介于欧洲颜色标准by3与by4之间;[0495](vii)介于欧洲颜色标准by4与by5之间,其中组合物包含约5g/l或约10g/l的抗vegf蛋白,并且其中组合物的样品可从澄清收获物的蛋白a洗脱液中作为样品获得。如在下文实施例9,表9-3中所见,包含5g/l阿柏西普的蛋白a洗脱液呈现黄棕色,经测量为具有1.77的b*值。这种样品当在aex下游产生时具有0.50的b*值,证明了aex降低样品的黄棕色着色的效用(表9-3)。[0496]通过使用经修饰的cdm产生的组合物可产生抗vegf蛋白的制剂,其中制剂的颜色通过cielab标度中公认的标准颜色表征来表征:[0497](i)黄棕色不超过约22-23的b*值;[0498](ii)黄棕色不超过约16-17的b*值;[0499](iii)黄棕色不超过9-10的b*值;[0500](iv)黄棕色不超过4-5的b*值;[0501](v)黄棕色不超过2-3的b*值;[0502](vi)介于17-23之间的b*值;[0503](vii)介于10-17之间的b*值;[0504](viii)介于5-10之间的b*值;[0505](ix)介于3-5之间的b*值;或[0506](x)介于1-3之间的b*值,其中组合物包含约5g/l或约10g/l的抗vegf蛋白,并且其中组合物从澄清收获物的蛋白a洗脱液中作为样品获得。参见实施例9,表9-3。[0507]对于添加至细胞培养物中以形成经修饰的cdm的组分,术语“累积量”是指在细胞培养过程中添加至生物反应器中以形成cdm的特定组分的总量,包括在培养开始时添加的组分的量(在第0天的cdm)和随后添加的组分的量。当计算组分的累积量时,还包括在生物反应器产生之前(即,在第0天的cdm之前)添加至种菌培养物或接种物中的组分的量。累积量不受培养过程中组分随时间损失(例如,经由代谢或化学降解)的影响。因此,具有相同累积量的组分的两种培养物可能仍具有不同绝对水平,例如,如果在不同时间将组分添加至两种培养物中(例如,如果在一种培养物中,所有组分均在开始时添加,而在另一种培养物中,组分是随时间的推移而添加)。累积量也不受培养过程中组分随时间的原位合成(例如,经由代谢或化学转化)的影响。因此,具有相同累积量的给定组分的两种培养物可能仍具有不同绝对水平,例如,如果组分为经由生物转化过程在两种培养物的一种中原位合成。累积量可以例如组分的克数或摩尔数为单位表示。术语“累积浓度”是指组分的累积量除以生产批次开始时生物反应器中液体的体积,包括培养中使用的任何接种物对起始体积的贡献。例如,如果生物反应器在生产批次开始时含有2升细胞培养基,并且在第0、1、2和3天添加1克的组分x,则第3天之后的累积浓度为2g/l(即4克除以2升)。如果在第4天将另外1升不含组分x的液体添加至生物反应器中,则累积浓度将保持为2g/l。如果在第5天从生物反应器中损失一些液体(例如经由蒸发),则累积浓度将保持为2g/l。累积浓度可以例如克/升或摩尔/升为单位表示。[0508]a.氨基酸:[0509]在一些实施方案中,可通过降低或提高cdm中氨基酸的累积浓度来获得经修饰的cdm。此类氨基酸的非限制性实例包括丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸(或其盐)。与起始cdm相比,经修饰的cdm中的这些氨基酸的累积量的增加或减少可为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%,以及在上述一者或多者内的范围。或者,与未经修饰的cdm相比,经修饰的cdm中的一种或多种氨基酸的累积量的增加或减少可为约5%至约20%、约10%至约30%、约30%至约40%、约30%至约50%、约40%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%,以及在上述一者或多者内的范围(参见图25-27和实施例5)。[0510]在一些实施方案中,可通过降低cdm中半胱氨酸的累积浓度来获得经修饰的cdm。与未经修饰的cdm相比,cdm中形成经修饰的cdm的半胱氨酸的量的减少可为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%,以及在上述一者或多者内的范围。或者,与cdm相比,经修饰的cdm中的半胱氨酸的累积量的减少可为约5%至约20%、约10%至约30%、约30%至约40%、约30%至约50%、约40%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%,以及在上述一者或多者内的范围。在一个方面,经修饰的cdm中的累积半胱氨酸的量小于约1mm、约2mm、约3mm、约4mm、约5mm、约6mm、约7mm、约8mm、约9mm或约10mm(参见图25-27和实施例5)。[0511]在一些实施方案中,可通过用胱氨酸替换cdm中的至少一定百分比的累积半胱氨酸来获得经修饰的cdm。与未经修饰的cdm相比,替换可为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%,以及在上述一者或多者内的范围。或者,与未经修饰的cdm相比,替换可为约5%至约20%、约10%至约30%、约30%至约40%、约30%至约50%、约40%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%,以及在上述一者或多者内的范围(参见图25-27和实施例5)。[0512]在一些实施方案中,可通过用硫酸半胱氨酸替换cdm中的至少一定百分比的累积半胱氨酸来获得经修饰的cdm。与未经修饰的cdm相比,替换可为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%,以及在上述一者或多者内的范围。或者,与未经修饰的cdm相比,替换可为约5%至约20%、约10%至约30%、约30%至约40%、约30%至约50%、约40%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%,以及在上述一者或多者内的范围。[0513]b.金属:[0514]在一些实施方案中,可通过降低或提高cdm中的金属的累积浓度来获得经修饰的cdm。金属的非限制性实例包括铁、铜、锰、钼、锌、镍、钙、钾和钠。与未经修饰的cdm相比,经修饰的cdm中的一种或多种金属的量的增加或减少可为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%,以及在上述一者或多者内的范围。或者,与未经修饰的cdm相比,经修饰的cdm中的一种或多种金属的累积量的增加或减少可为约5%至约20%、约10%至约30%、约30%至约40%、约30%至约50%、约40%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、或约90%至约100%,以及在上述一者或多者内的范围(参见图25-27和实施例5)。[0515]c.抗氧化剂:[0516]在一些实施方案中,经修饰的cdm包含一种或多种抗氧化剂。抗氧化剂的非限制性实例可包括牛磺酸、次牛磺酸、甘氨酸、硫辛酸、谷胱甘肽、氯化胆碱、氢皮质酮、维生素c、维生素e及其组合(参见图28a-e和实施例5)。[0517]在一些实施方案中,经修饰的cdm包含约0.01mm至约20mm牛磺酸,即0.01mm至约1mm、约0.01mm至约5mm、约0.01mm至约10mm、0.1mm至约1mm、约0.1mm至约5mm、约0.1mm至约10mm、约1mm至约5mm、约1mm至约10mm,以及在上述一者或多者内的范围。[0518]在一些实施方案中,经修饰的cdm包含约0.01mm至约20mm次牛磺酸,即0.01mm至约1mm、约0.01mm至约5mm、约0.01mm至约10mm、0.1mm至约1mm、约0.1mm至约5mm、约0.1mm至约10mm、约1mm至约5mm、约1mm至约10mm,以及在上述一者或多者内的范围。[0519]在一些实施方案中,经修饰的cdm包含约0.01mm至约20mm甘氨酸,即0.01mm至约1mm、约0.01mm至约5mm、约0.01mm至约10mm、0.1mm至约1mm、约0.1mm至约5mm、约0.1mm至约10mm、约1mm至约5mm、约1mm至约10mm,以及在上述一者或多者内的范围。[0520]在一些实施方案中,经修饰的cdm包含约0.01μm至约5μm硫辛酸,即,约0.01μm至约0.1μm、约0.1μm至约1μm、约1μm至约2.5μm、约1μm至约3μm、约1μm至约5μm,以及在上述一者或多者内的范围。[0521]在一些实施方案中,经修饰的cdm包含约0.01m至约5mm谷胱甘肽,即0.01mm至约1mm、0.1mm至约1mm、约0.1mm至约5mm、约1mm至约5mm,以及在上述一者或多者内的范围。[0522]在一些实施方案中,经修饰的cdm包含约0.01μm至约5μm氢皮质酮,即,约0.01μm至约0.1μm、约0.1μm至约1μm、约1μm至约2.5μm、约1μm至约3μm、约1μm至约5μm,以及在上述一者或多者内的范围。[0523]在一些实施方案中,经修饰的cdm包含约1μm至约50μm维生素c,即,约1μm至约5μm、约5μm至约20μm、约10μm至约30μm、约5μm至约30μm、约20μm至约50μm、约25μm至约50μm,以及在上述一者或多者内的范围。[0524]d.为调节糖基化而对培养基进行的改变:[0525]本公开还包括了通过改变cdm中的某些组分的累积浓度来调节抗vegf蛋白的糖基化的方法。可基于添加至cdm中的组分的累积量来改变总岩藻糖基化%、总半乳糖基化%、总唾液酸化%和甘露糖-5。[0526]在示例性实施方案中,调节抗vegf蛋白的糖基化的方法可包括向cdm中补充尿苷。抗vegf蛋白可具有约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约2%至约15%甘露糖-5、和约60%至约79%半乳糖基化聚糖。(参见下文实施例6)。[0527]在一些实施方案中,调节抗vegf蛋白的糖基化的方法可包括向cdm中补充锰。在一个方面,cdm在补充前不含锰。抗vegf蛋白可具有约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约2%至约15%甘露糖-5、和约60%至约79%半乳糖基化聚糖。(参见下文实施例6)。[0528]在一些实施方案中,调节抗vegf蛋白的糖基化的方法可包括向cdm中补充半乳糖。在一个方面,cdm在补充前不含半乳糖。抗vegf蛋白可具有约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约2%至约15%甘露糖-5、和约60%至约79%半乳糖基化聚糖。(实施例6)。[0529]在一些实施方案中,调节抗vegf蛋白的糖基化的方法可包括向cdm中补充地塞米松。在一个方面,cdm在补充前不含地塞米松。抗vegf蛋白可具有约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约2%至约15%甘露糖-5、和约60%至约79%半乳糖基化聚糖。(参见下文实施例6)。[0530]在一些实施方案中,调节抗vegf蛋白的糖基化的方法可包括向cdm中补充尿苷、锰、半乳糖和地塞米松中的一种或多种。在一个方面,cdm在补充之前不含尿苷、锰、半乳糖和地塞米松中的一种或多种。抗vegf蛋白可具有约40%至约50%总岩藻糖基化聚糖、约30%至约55%总唾液酸化聚糖、约2%至约15%甘露糖-5、和约60%至约79%半乳糖基化聚糖。(实施例6)。[0531]v.使用下游工艺技术制备组合物[0532]包含本发明的抗vegf蛋白的组合物可通过调节下游蛋白质产生过程中的条件来产生。本发明人发现优化下游程序可导致抗vegf蛋白的某些变体最少化以及变色。下游工艺的优化可产生具有减少的氧代变体以及优化的颜色特征的组合物。[0533]下游工艺技术可单独使用或与前述部分iv中所述的上游工艺技术组合使用。[0534]a.阴离子交换色谱:[0535]在一些实施方案中,本发明的组合物可涉及一种方法,所述方法包括:在cdm中在宿主细胞中表达抗vegf蛋白,其中抗vegf蛋白从宿主细胞分泌至培养基中,并获得澄清收获物。所述收获物经历以下步骤:(a)将从收获物获得的生物样品加载至阴离子交换色谱(aex)柱上;(b)用合适的洗涤缓冲液洗涤aex柱,(c)收集流通级分,任选地(d)用合适的汽提缓冲液洗涤柱,以及(e)收集汽提级分。[0536]流通级分可包含抗vegf蛋白的氧代变体,当与阴离子交换色谱柱的汽提级分中的氧代变体相比时,其为抗vegf蛋白样品的约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%。例如,参看表9-5和表9-6,流通级分包含抗vegf蛋白的氧化变体,其中与汽提级分中的氧化变体相比,若干组氨酸和色氨酸残基为约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%(以及在上述一者或多者内的范围)被氧化。[0537]用于aex柱的平衡缓冲液和洗涤缓冲液的ph值均可为约8.20至约8.60。在另一方面,用于aex柱的平衡缓冲液和洗涤缓冲液的电导率均可为约1.50至约3.0ms/cm。在一个方面,平衡缓冲液和洗涤缓冲液可为约50mmtris盐酸盐。在一个方面,汽提缓冲液包含2m氯化钠或1n氢氧化钠或两者(参见表2-2)。实施例2进一步说明优化平衡缓冲液和洗涤缓冲液的浓度和电导率。[0538]蛋白质变体可包括如下一个或多个残基的修饰:一个或多个天冬酰胺被脱酰胺;一个或多个天冬氨酸转化为异天冬氨酸和/或asn;一个或多个甲硫氨酸被氧化;一个或多个色氨酸被转化为n-甲酰犬尿氨酸;一个或多个色氨酸是单羟基色氨酸;一个或多个色氨酸是二羟基色氨酸;一个或多个色氨酸是三羟基色氨酸;一个或多个精氨酸被转化为arg3-脱氧葡糖醛酮;c末端甘氨酸不存在;和/或存在一个或多个非糖基化糖位点。[0539]目标蛋白质可为阿柏西普、抗vegf抗体或vegfminitrap。可通过以下方式中的一种或多种形成蛋白质变体:(i)从选自his86、his110、his145、his209、his95、his19和/或his203(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)的组氨酸残基的组氨酸的氧化;(ii)选自trp58和/或trp138(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)处的色氨酸残基的色氨酸残基的氧化;(iii)tyr64(或具有阿柏西普的某些结构特征的蛋白质上的等效位置)处的酪氨酸残基的氧化;(iv)选自phe44和/或phe166(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)的苯丙氨酸残基的氧化;和/或(v)选自met10、met20、met163和/或met192(或具有阿柏西普的某些结构特征的蛋白质上的等效残基位置)的甲硫氨酸残基的氧化。[0540]流通级分可包含以下一者或多者:[0541](a)一定百分比的已氧化为2-氧代-组氨酸的组氨酸残基,其中其颜色表征如下:[0542](i)黄棕色不超过欧洲颜色标准by2;[0543](ii)黄棕色不超过欧洲颜色标准by3;[0544](iii)黄棕色不超过欧洲颜色标准by4;[0545](iv)黄棕色不超过欧洲颜色标准by5;[0546](v)介于欧洲颜色标准by2与by3之间;[0547](vi)介于欧洲颜色标准by3与by4之间;[0548](vii)介于欧洲颜色标准by4与by5之间,其中组合物包含约5g/l或约10g/l的抗vegf蛋白,并且其中组合物从流通级分中作为样品获得。[0549](b)一定百分比的已氧化为2-氧代-组氨酸的组氨酸残基。此外,其颜色的特征在于具有近似于by2、by3、by4、by5、by6、by7的黄棕色;或者不比by2更暗/强烈、不比by3暗、不比by4暗、不比by5暗、不比by6暗、不比by7暗;或介于by2与by3之间、介于by2与by4之间、介于by3与by4之间或介于by3与by5之间。[0550](c)一定百分比的已氧化为2-氧代-组氨酸的组氨酸残基,其中其颜色以如下ciel*,a*,b*颜色空间中的颜色表征:[0551](i)黄棕色不超过约22-23的b*值;[0552](ii)黄棕色不超过约16-17的b*值;[0553](iii)黄棕色不超过9-10的b*值;[0554](iv)黄棕色不超过4-5的b*值;[0555](v)黄棕色不超过2-3的b*值;[0556](vi)介于17-23之间的b*值;[0557](vii)介于10-17之间的b*值;[0558](viii)介于5-10之间的b*值;[0559](ix)介于3-5之间的b*值;或[0560](x)介于1-3之间的b*值,其中组合物包含约5g/l或约10g/l的抗vegf蛋白,并且其中组合物从流通级分中作为样品获得。[0561](d)组合物中不多于约1%、不多于约0.1%或约0.1-1%、0.2-1%、0.3-1%、0.4-1%、0.5-1%、0.6-1%、0.7-1%、0.8-1%或0.9-1%的组氨酸残基被氧化为2-氧代-组氨酸。百分比计算描述于部分ii中。[0562]b.亲和色谱:[0563]在一些实施方案中,本发明的组合物可使用包括以下的方法产生:在宿主细胞中表达抗vegf蛋白,其中抗vegf蛋白由宿主细胞分泌至培养基中并获得澄清收获物。收获物经历以下步骤,包括:(a)将从澄清收获物获得的生物样品加载至亲和色谱柱上,其中亲和色谱包含能够选择性或特异性地结合至抗vegf蛋白的蛋白质;(b)用合适的洗脱缓冲液洗涤亲和色谱柱,以及(c)收集洗脱的级分。例如,如表7-1和表7-7至7-10所示例,使用vegf165作为能够选择性或特异性地结合至抗vegf蛋白的蛋白质并按照上述方法收集洗脱的级分,成功产生mt5(抗vegf蛋白)、阿柏西普和抗vegfscfv片段。表7-1还公开使用以下各物作为能够选择性或特异性地结合至mt5的不同蛋白质成功地产生mt5:(i)mab1(小鼠抗vegfr1mab人类igg1,其中seqidno.:73是重链,而seqidno.:74是轻链);(ii)mab2(小鼠抗vegfr1mab人类igg1,其中seqidno.:75是重链,而seqidno.:76是轻链);(iii)mab3(小鼠抗vegf-r1mab小鼠igg1,其中seqidno.:77是重链,而seqidno.:78是轻链);以及(iv)mab4(小鼠抗vegfr1mab小鼠igg1,其中seqidno.:79是重链,而seqidno.:80是轻链)。[0564]关于上述步骤(a),有待加载至亲和柱上的生物样品可来自其中澄清收获物可在亲和之前经历产生的样品,包括但不限于离子交换色谱(阴离子或阳离子)。在使用亲和步骤之前,还可采用本领域技术人员熟知的其他色谱程序。重要之处在于包含抗vegf蛋白的生物样品可经历亲和色谱。[0565]在一些实施方案中,本发明的组合物可使用包括以下的方法产生:在宿主细胞中表达vegfminitrap蛋白,其中vegfminitrap从宿主细胞分泌至培养基中,并且其中可进一步处理培养基以形成澄清收获物。可通过已知的色谱程序进一步处理此收获物,从而产生包含vegfminitrap的生物样品。此生物样品可通过采用以下步骤进一步处理,包括:(a)将生物样品加载至亲和色谱柱上,其中亲和色谱包含能够与vegfminitrap蛋白选择性或特异性地结合或相互作用的蛋白;(b)用合适的洗脱缓冲液洗涤亲和色谱柱,以及(c)收集洗脱的级分。再次参看表7-1,此表中公开了使用以下各物作为能够选择性或特异性地结合至mt5或与mt5相互作用的不同蛋白质成功地产生mt5(vegfminitrap):(i)vegf165;(ii)mab1(小鼠抗vegfr1mab人类igg1,其中seqidno.:73是重链,而seqidno.:74是轻链);(iii)mab2(小鼠抗vegfr1mab人类igg1,其中seqidno.:75是重链,而seqidno.:76是轻链);(iv)mab3(小鼠抗vegf-r1mab小鼠igg1,其中seqidno.:77是重链,而seqidno.:78是轻链);以及(v)mab4(小鼠抗vegfr1mab小鼠igg1,其中seqidno.:79是重链,而seqidno.:80是轻链)。[0566]在一个实施方案中,亲和色谱还可用于分离其他minitrap蛋白。切割阿柏西普之后,可使用对经切割的阿柏西普具特异性的结合物对包含经切割的阿柏西普的样品进行亲和色谱。在一个方面,结合物可为抗体或其部分。[0567]可使用例如用ides蛋白酶(fabricator)或其变体对阿柏西普进行蛋白水解消化来促进阿柏西普的切割,以产生vegfminitrap。用ides蛋白酶或其变体切割阿柏西普可产生包含fc片段和vegfminitrap的产物的混合物。vegfminitrap可通过使用本文所述的一种或多种生产策略进一步处理。[0568]在一些示例性实施方案中,能够与抗vegf蛋白例如阿柏西普或minitrap选择性或特异性结合(“结合物”)或与其相互作用的蛋白质可来源于人类或小鼠。[0569]亲和产生过程还可包括在加载生物样品之前使用平衡缓冲液平衡亲和柱。示例性平衡缓冲液可为20mm磷酸钠ph6-8(尤其是7.2)、10mm磷酸钠、500mmnaclph6-8(尤其是7.2)、50mmtrisph7-8、dpbsph7.4。[0570]可使用合适的缓冲液例如dpbs来加载生物样品。[0571]此亲和产生过程还可包括用一种或多种洗涤缓冲液洗涤亲和柱。可洗涤柱一次或多次。此外,洗涤液也可作为洗涤级分收集。洗涤缓冲液的ph值都可为约7.0至约8.60。在一个方面,洗涤缓冲液可为dpbs。在另一方面,洗涤缓冲液可为20mm磷酸钠ph6-8(尤其是7.2)、10mm磷酸钠、500mmnaclph6-8(尤其是7.2)、50mmtrisph7-8或dpbsph7.4。[0572]此亲和过程还可包括用一种或多种合适的洗脱缓冲液洗涤亲和柱并收集洗脱的级分。可洗涤柱一次或多次。这种合适的洗脱缓冲液的非限制性实例包括:乙酸铵(ph值为约2.0至约3.0)、乙酸(ph值为约2.0至约3.2)、甘氨酸-hcl(ph值为约2.0至约3.0)、柠檬酸钠(ph值为约2.0至约3.0)、柠檬酸(ph值为约2.0至约3.0)、异硫氰酸钾(ph值为约2.0至约3.0)或其组合。[0573]在一些方面,可使用中和缓冲液中和洗脱级分。这种中和缓冲液的一个实例是tris至tris-hcl(ph值为约7.0至约9.0)。[0574]c.ides突变体:[0575]用于切割fc融合蛋白(例如阿柏西普)的ides蛋白酶在碱性ph条件下会迅速丧失酶活性,这可限制其在vegfminitrap制造期间的使用。因此,已开发在碱性ph下,例如在强碱如naoh存在下更稳定的变体。此类碱性条件可为0.05nnaoh1小时或0.1nnaoh0.5小时。[0576]在一些实施方案中,ides突变体可具有在其全长上与由以下组成的组中列出的氨基酸序列具有至少约70%序列同一性的氨基酸序列:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一些方面,氨基酸序列与上文刚刚提及的氨基酸序列在其全长上具有约75%、80%、85%、90%、95%或约100%序列同一性。[0577]在一些实施方案中,ides突变体可具有编码多肽的经分离的核酸分子,所述多肽的氨基酸序列在其全长上与由以下组成的组中列出的氨基酸序列具有至少70%序列同一性:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16。在一些方面,氨基酸序列在其全长上与上文刚刚提及的氨基酸序列具有约75%、80%、85%、90%、95%或约100%序列同一性。[0578]在一些实施方案中,所述多肽具有在其全长上与由以下组成的组中列出的氨基酸序列具有至少70%序列同一性的氨基酸序列:seqidno.:2、seqidno.:3、seqidno.:4、seqidno.:5、seqidno.:6、seqidno.:7、seqidno.:8、seqidno.:9、seqidno.:10、seqidno.:11、seqidno.:12、seqidno.:13、seqidno.:14、seqidno.:15和seqidno.:16,并且由具有合适载体的宿主细胞表达,所述载体包含编码所识别的肽的核酸。在一个方面,核酸分子与表达控制序列可操作地连接,所述表达控制序列能够指导其在宿主细胞中的表达。在一个方面,载体可为质粒。在一些方面,氨基酸序列在其全长上与上文刚刚提及的氨基酸序列具有约75%、80%、85%、90%、95%或约100%序列同一性。在一些方面,经分离的核酸分子可用于编码多肽。[0579]在一些实施方案中,ides突变体可具有包含由seqidno.:1(ides)定义的亲本氨基酸序列的氨基酸序列,其中在位置87、130、182和/或274处的天冬酰胺残基突变为除天冬酰胺以外的氨基酸。在一个方面,与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高。在另一方面,与亲本氨基酸序列相比,所述突变可使在碱性ph值下的化学稳定性提高50%。在一个方面,氨基酸可选自天冬氨酸、亮氨酸和精氨酸。在一个特定方面,位置87处的天冬酰胺残基突变为天冬氨酸残基。在另一个特定方面,位置130处的天冬酰胺残基突变为精氨酸残基。在又一个特定方面,位置182处的天冬酰胺残基突变为亮氨酸残基。在又一个特定方面,位置274处的天冬酰胺残基突变为天冬氨酸残基。在又一个特定方面,位置87和130处的天冬酰胺残基经突变。在又一个特定方面,位置87和182处的天冬酰胺残基经突变。在又一个特定方面,位置87和274处的天冬酰胺残基经突变。在又一个特定方面,位置130和182处的天冬酰胺残基经突变。在又一个特定方面,位置130和274处的天冬酰胺残基经突变。在又一个特定方面,位置182和274处的天冬酰胺残基经突变。在又一个特定方面,位置87、130和182处的天冬酰胺残基经突变。在又一个特定方面,位置87、182和274处的天冬酰胺残基经突变。在又一个特定方面,位置130、182和274处的天冬酰胺残基经突变。在又一个特定方面,位置87、130、182和274处的天冬酰胺残基经突变。在一些方面,氨基酸序列在其全长上与上述氨基酸序列具有约75%、80%、85%、90%、95%或约100%序列同一性。在一些方面,经分离的核酸分子可用于编码多肽。[0580]熟悉标准分子生物学技术的本领域普通技术人员可在无过度负担的情况下制备和使用本发明的ides突变体。标准技术可用于重组dna、寡核苷酸合成、组织培养和转化(例如,电穿孔、脂质转染)。参见例如sambrook等人,molecularcloning:alaboratorymanual,同上,其出于任何目的通过引用并入本文。可根据制造商的说明或如本文所述来执行酶反应和产生技术。[0581]vi.一般蛋白质产生[0582]设想多种不同产生技术,包括但不限于亲和色谱、离子交换色谱、混合模式色谱、尺寸排阻色谱和疏水相互作用色谱(单独或以组合形式)在本发明的范围内。取决于特定分离形式,这些色谱步骤基于电荷、疏水性程度或尺寸或其组合来分离生物样品的蛋白质混合物。对于前述提及的每项技术,都可使用若干种不同的色谱树脂,从而允许根据所涉及的特定蛋白质精确调整生产方案。每种分离方法都会造成蛋白质以不同速率穿过柱,从而实现物理分离,随着蛋白质进一步穿过柱或选择性地粘附于分离介质上,物理分离会增加。接着,将蛋白质(i)使用适当的洗脱缓冲液进行差异洗脱和/或(ii)从所用柱获得的流通级分中收集,任选地,用适当的平衡缓冲液洗涤柱。在一些情况下,当杂质优先粘附于柱上并且目标蛋白质较少粘附时,目标蛋白质就会与杂质(hcp、蛋白质变体等)分离,即,目标蛋白质不会吸附于特定柱的固相上,并且因此流过柱。在一些情况下,当杂质无法吸附于柱上并因此流过柱时,它们就会与目标蛋白质分离。[0583]在使用上述上游产生方法和/或通过本领域中常规的替代产生方法产生重组蛋白后,产生过程可以分离步骤开始。一旦获得包含目标蛋白质(例如融合蛋白)的澄清溶液或混合物,就将目标蛋白质与过程相关的杂质(例如由细胞(如hcp)产生的其他蛋白质,以及产物相关的物质,例如酸性或碱性变体)分离。可采用一种或多种不同产生技术的组合,包括亲和色谱、离子交换(例如cex、aex)色谱、混合模式(mm)色谱和/或疏水相互作用色谱。此类产生步骤基于例如电荷、疏水性程度和/或表观尺寸分离生物样品内的组分混合物。对于本文提及的每项色谱技术,许多色谱树脂是市售的,从而允许根据所涉及的特定蛋白质精确调整生产方案。每种分离方法都允许蛋白质以不同速率穿过柱,从而实现物理分离,随着蛋白质进一步穿过柱或选择性地粘附于分离树脂(或介质)上,物理分离会增加。接着可差异地收集蛋白质。在一些情况下,当其他组分特异性地吸附于柱树脂上,而目标蛋白质不吸附时,目标蛋白质就与生物样品的组分分离。[0584]a.初步回收和病毒灭活[0585]在某些实施方案中,本文公开的产生方法的初始步骤涉及从生物样品中澄清和初步回收目标蛋白质。初步回收将包括一个或多个离心步骤,以便从宿主细胞和伴随的细胞碎片中分离出目标蛋白质。样品的离心可例如但不限于在7,000xg至约12,750xg下进行。在大规模生产的情形下,可以一定流率在线进行此离心,所述流率被设定成在所得上清液中达到例如150ntu的浊度水平。接着可收集所述上清液以进行进一步处理,或经由一个或多个深度过滤器进行在线过滤,以进一步澄清样品。[0586]在某些实施方案中,初步回收可包括使用一个或多个深度过滤步骤来澄清样品,从而有助于处理目标蛋白质。在其他实施方案中,初步回收可包括在离心后使用一个或多个深度过滤步骤。可在本发明的上下文中使用的深度过滤器的非限制性实例包括millistak x0hc、f0hc、d0hc、a1hc、b1hc深度过滤器(emdmillipore);3mtm型号30/60za、60/90za、vr05、vr07、delipid深度过滤器(3mcorp.)。0.2μm过滤器如sartorius的0.45/0.2μmsartoporetm双层或millipore的expressshr或shc滤筒通常在深度过滤器之后。还可使用本领域技术人员熟知的其他过滤器。[0587]在某些实施方案中,初步回收过程也可为减少或灭活可存在于生物样品中的病毒的关键。多种病毒减少/灭活方法中的任何一者或多者可在产生初步回收阶段使用,包括:热灭活(巴氏灭菌)、ph灭活、缓冲剂/清洁剂处理、uv和γ射线辐照以及添加某些化学灭活剂如β-丙内酯,或例如菲咯啉铜,如美国专利第4,534,972号中所述,其全部教导都通过引用并入本文。在本发明的某些示例性实施方案中,样品在初步回收阶段期间暴露于清洁剂病毒灭活。在其他实施方案中,样品可在初步回收阶段期间暴露于低ph灭活。[0588]在采用病毒减少/灭活的那些实施方案中,可对生物样品进行调整(在需要时)以用于其他产生步骤。例如,在低ph病毒灭活之后,在继续产生过程之前,通常将样品的ph值调节至更中性的ph值,例如,约4.5至约8.5。另外,可用注射用水(wfi)稀释混合物以获得所需电导率。[0589]b.亲和色谱[0590]在某些示例性实施方案中,使生物样品经历亲和色谱对于产生目标蛋白质可为有利的。色谱材料能够选择性地或特异性地与目标蛋白质结合或相互作用。所述色谱材料的非限制性实例包括:蛋白a和蛋白g。此外,包含例如蛋白质或其部分的色谱材料能够与目标蛋白质结合或相互作用。在一个方面,目标蛋白质是抗vegf蛋白,例如阿柏西普、minitrap或与其相关的蛋白质。[0591]亲和色谱可涉及使生物样品经历包含合适的蛋白a树脂的柱。当在本文中使用时,术语“蛋白a”涵盖从其天然来源回收的蛋白a,合成产生的蛋白a(例如,通过肽合成或通过重组技术)及其保留结合具有ch2/ch3区的蛋白质的能力的变体。在某些方面,蛋白a树脂通过与分子的fc部分(如果其具有所述区域)特异性相互作用而可用于多种抗体同种型的基于亲和力的产生和分离。[0592]蛋白a树脂有若干商业来源。一种合适的树脂是来自gehealthcare的mabselecttm。合适的树脂包括但不限于:来自gehealthcare的mabselectsuretm、mabselectsurelx、mabselect、mabselectsurepcc、mabselectxtra、rproteinasepharose;来自emdmillipore的prosephc、prosepultra和prosepultraplus;来自lifetechnologies的mapcapture。装填有mabselecttm的合适的柱的非限制性实例是直径约1.0cmx长度约21.6cm的柱(17ml床体积)。合适的柱可包含树脂,例如mabselecttmsure或类似树脂。蛋白a还可从repligen、pharmacia和fermatech商购获得。[0593]样品加载之前,可使用合适的缓冲液平衡亲和柱。加载柱后,可使用合适的洗涤缓冲液将柱洗涤一次或多次。接着可使用适当的洗脱缓冲液(例如,甘氨酸-hcl、乙酸或柠檬酸)洗脱柱。可使用本领域技术人员熟知的技术例如uv检测器来监测洗脱液。可收集洗脱的目标级分,接着准备用于进一步处理。[0594]在一个方面,可例如通过清洁剂或低ph对洗脱液进行病毒灭活。可选择合适的清洁剂浓度或ph值(和时间)以获得所需病毒灭活结果。病毒灭活后,通常对洗脱液进行ph值和/或电导率调整以便后续产生步骤。[0595]洗脱液可经由深度过滤器进行过滤以便在额外的色谱精制(chromatographicpolishing)步骤之前从目标蛋白质中去除浊度和/或各种杂质。合适的深度过滤器的实例包括但不限于millistak xohc、fohc、dohc、aihc、x0sp和bihcpod过滤器(emdmillipore)或zetaplus30za/60za、60za/90za、delipid、vr07和vr05过滤器(3m)。emphazeaexhybridpurifier多机理过滤器也可用于澄清洗脱液。为了从深度过滤步骤实现所需杂质去除和产物回收,可能需要将洗脱液池调节至特定的ph值和电导率。[0596]c.阴离子交换色谱[0597]在某些实施方案中,通过使生物样品经历至少一个阴离子交换分离步骤来产生目标蛋白质。在一种情形下,阴离子交换步骤可在亲和色谱程序(例如,蛋白a亲和)之后进行。在其他情形下,阴离子交换步骤可在亲和色谱步骤之前进行。在其他方案中,阴离子交换可在亲和色谱步骤之前和之后进行。在一个方面,目标蛋白质是阿柏西普或minitrap。[0598]相对于阳离子交换材料来说,阴离子交换材料的使用部分地基于目标蛋白质的局部电荷。阴离子交换色谱可与以下其他色谱程序组合使用:例如亲和色谱、尺寸排阻色谱、疏水相互作用色谱以及熟练技术人员已知的其他色谱模式。[0599]在进行分离时,可通过使用多种技术中的任一者,例如使用批量生产技术或色谱技术,使初始蛋白质组合物(生物样品)与阴离子交换材料接触。[0600]在批量生产的情形下,在所需起始缓冲液中制备或平衡阴离子交换材料。制备后,获得阴离子交换材料的浆液。使生物样品与浆液接触,以使蛋白质吸附于阴离子交换材料上。通过使浆液沉降并去除上清液,从浆液中分离出包含不与aex材料结合的酸性种类的溶液。浆液可经历一个或多个洗涤步骤和/或洗脱步骤。[0601]在色谱分离的情形下,色谱柱用于容纳色谱支撑物材料(树脂或固相)。将包含目标蛋白质的样品加载至特定色谱柱上。接着柱可经历一个或多个使用合适的洗涤缓冲液的洗涤步骤。未吸附于树脂上的样品组分可能会流过柱。可使用适当的洗脱缓冲液对已吸附于树脂上的组分进行差异洗脱。[0602]通常在aex色谱中使用类似于加载条件的条件或替代地通过以逐步或线性梯度方式降低洗涤液的ph值和/或提高其离子强度/电导率来进行洗涤步骤。在一个方面,在加载缓冲液和洗涤缓冲液中使用的盐水溶液的ph处于或接近目标蛋白质的等电点(pi)。通常,ph比目标蛋白质的pi高或低约0至2个单位,但其范围可为高或低0至0.5个单位。其还可位于目标蛋白质的pi处。[0603]阴离子剂可选自由乙酸盐、氯化物、甲酸盐及其组合组成的组。阳离子剂可选自由tris、精氨酸、钠及其组合组成的组。在一个特定实例中,缓冲溶液是tris/甲酸盐缓冲液。缓冲液可选自由以下组成的组:吡啶、哌嗪、l-组氨酸,bis-tris、bis-tris丙烷、咪唑、n-乙基吗啉、tea(三乙醇胺)、tris、吗啉、n-甲基二乙醇胺、ampd(2-氨基-2-甲基-1,3-丙二醇)、二乙醇胺、乙醇胺、amp(2-氨基-2-甲基-1-丙醇)、哌嗪、1,3-二氨基丙烷和哌啶。[0604]填充式阴离子交换色谱柱、阴离子交换膜装置、阴离子交换整体式装置或深度过滤器介质可以结合-洗脱模式、流通模式或混合模式操作,其中蛋白质展示与色谱材料的结合并且仍可使用与加载缓冲液相同或基本上相似的缓冲液从所述材料上洗去。[0605]在结合-洗脱模式下,首先在某些蛋白质会吸附于基于树脂的基质上的条件下,使用具有适当离子强度和ph值的缓冲液对柱或膜装置进行调节。例如,在进料加载期间,由于静电吸引,目标蛋白质可吸附于树脂上。在用平衡缓冲液或具有不同ph值和/或电导率的另一种缓冲液洗涤柱或膜装置后,通过提高洗脱缓冲液的离子强度(即电导率)以便与溶质竞争阴离子交换基质的带电位点来实现产物回收。改变ph值和由此更改溶质的电荷是实现溶质洗脱的另一种方式。电导率或ph值的变化可为逐渐的(梯度洗脱)或逐步的(分步洗脱)。[0606]在流通模式下,柱或膜装置是在选定的ph值和电导率下操作,以使目标蛋白质不会与树脂或膜结合,而酸性种类将保留在柱上或与目标蛋白质相比将具有独特的洗脱谱。在这种策略的情形下,酸性种类将在合适的条件下与色谱材料相互作用或结合,而目标蛋白质和目标蛋白质的某些聚集体和/或片段将流过柱。[0607]阴离子交换树脂的非限制性实例包括二乙氨基乙基(deae)、季氨乙基(qae)和季胺(q)基团。另外的非限制性实例包括:poros50pi和poros50hq,其为刚性聚合物珠粒,其中骨架由交联聚[苯乙烯-二乙烯苯]组成;captoqimpres和captodeae,其是高流动性琼脂糖珠粒;toyopearlqae-550、toyopearldeae-650和toyopearlgigacapq-650,其是聚合物基珠粒;emdtmaehicap,其是具有触手离子交换剂的合成聚合树脂;sartobindpanano,其是具有伯胺配体的耐盐色谱膜;sartobindqnano,其是强阴离子交换色谱膜;cunobiocap,其是由无机助滤剂、精制纤维素和离子交换树脂构成的zeta-plus深度过滤器介质;以及xohc,其是由无机助滤剂、纤维素和混合纤维素酯构成的深度过滤器介质。[0608]在某些实施方案中,可将样品的蛋白质加载量调整至以下柱的总蛋白质加载量:介于约50g/l与约500g/l之间、或介于约75g/l与约350g/l之间、或介于约200g/l与约300g/l之间。在其他实施方案中,将加载蛋白质混合物的蛋白质浓度调整至加载于柱上的材料的以下蛋白质浓度:介于约0.5g/l与约50g/l之间、介于约1g/l与约20g/l之间、或介于约3g/l与约10g/l之间。在其他实施方案中,将加载蛋白质混合物的蛋白质浓度调整至加载于柱上的材料的约37g/l蛋白质浓度。[0609]可添加添加剂,例如聚乙二醇(peg)、清洁剂、氨基酸、糖、离液剂,以增强分离性能,从而实现更好的分离、回收和/或产物质量。[0610]在某些实施方案中,包括与阿柏西普和/或vegfminitrap有关的那些实施方案,本发明的方法可用于选择性地去除、显著减少或基本上去除至少10%的蛋白质变体,从而产生具有减少的蛋白质变体的蛋白质组合物。[0611]蛋白质变体可包括如下一个或多个残基的修饰:一个或多个天冬酰胺被脱酰胺;一个或多个天冬氨酸被转化为天冬氨酸-甘氨酸和/或asn-gly;一个或多个甲硫氨酸被氧化;一个或多个色氨酸被转化为n-甲酰犬尿氨酸;一个或多个色氨酸是单羟基色氨酸;一个或多个色氨酸是二羟基色氨酸;一个或多个色氨酸是三羟基色氨酸;一个或多个精氨酸转化为arg3-脱氧葡糖醛酮;c末端甘氨酸不存在;和/或存在一个或多个非糖基化糖位点。还观察到使用aex可减少所述亲和洗脱液中的抗vegf变体的氧化和酸性种类。与亲和洗脱液相比,在使用aex后,流通级分可展示出抗vegf变体的氧化和/或酸性种类至少约20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%或5%的减少。[0612]阿柏西普和/或vegfminitrap的蛋白质变体可包括以下一者或多者:(i)来自选自his86、his110、his145、his209、his95、his19和/或his203的组氨酸残基的氧化组氨酸;(ii)选自在trp58和/或trp138处的色氨酸残基的氧化色氨酸残基;(iii)在tyr64处的氧化酪氨酸残基;(iv)选自phe44和/或phe166的氧化苯丙氨酸残基;和/或(v)选自met10、met20、met163和/或met192的氧化甲硫氨酸残基。[0613]d.阳离子交换色谱[0614]本发明的组合物可通过使包含目标蛋白质的生物样品经历至少一个阳离子交换(cex)步骤来产生。在某些示例性实施方案中,cex步骤将是aex步骤的补充,并且在aex步骤之前或之后进行。在一个方面,目标蛋白质是阿柏西普、minitrap或与其相关的分子。[0615]阳离子交换材料相对于阴离子交换材料(例如上文论述的那些阴离子交换材料)的使用部分地基于给定溶液中目标蛋白质的局部电荷和所需分离条件。在使用阴离子交换步骤之前采用阳离子交换步骤,或在使用阳离子交换步骤之前采用阴离子交换步骤都在本发明的范围内。此外,仅采用阳离子交换步骤与其他色谱程序的组合在本发明的范围内。[0616]在进行阳离子交换时,可通过使用以下多种技术中的任一种将包含目标蛋白质的样品与阳离子交换材料接触,例如,使用批量生产技术或色谱技术,如上文针对aex所述。[0617]盐水溶液既可用作加载缓冲液又可用作洗涤缓冲液,其ph值低于目标蛋白质的等电点(pi)。在一个方面,ph值比蛋白质的pi低约0至5个单位。在另一方面,其在比蛋白质的pi低1至2个单位的范围内。在又一方面,其在比蛋白质的pi低1至1.5个单位的范围内。[0618]在某些实施方案中,增加或减少盐水溶液中阴离子剂的浓度以达到以下ph值:介于约3.5与约10.5之间、或介于约4与约10之间、或介于约4.5与约9.5之间、或介于约5与约9之间、或介于约5.5与约8.5之间、或介于约6与约8之间、或介于约6.5与约7.5之间。在一个方面,增加或减少盐水溶液中阴离子剂的浓度以达到5、或5.5、或6、或6.5、或6.8、或7.5的ph值。适用于cex方法中的缓冲液系统包括但不限于tris甲酸盐、tris乙酸盐、硫酸铵、氯化钠和硫酸钠。hypercel的基础基质是高孔隙度的交联纤维素。它们的配体分别是苯丙胺和己胺。苯丙胺和己胺为蛋白质分离提供不同选择性和疏水性选择。额外的混合模式色谱支撑物包括但不限于nuviacprime、toyopearlmxtrp650m和hcx。在某些方面,混合模式色谱树脂是由直接或经由间隔体与有机或无机支撑物(有时称为基础基质)偶联的配体构成。支撑物可呈以下形式:颗粒,例如基本上呈球形的颗粒、整料、过滤器、膜、表面、毛细管等。在某些方面,支撑物是由天然聚合物例如交联碳水化合物材料如琼脂糖、琼脂、纤维素、右旋糖酐、壳聚糖、魔芋、角叉菜胶、结冷胶、藻酸盐等制备。为了获得高吸附能力,支撑物可为多孔的,接着将配体偶联至外表面以及孔表面。此类天然聚合物支撑物可根据标准方法制备,例如反相悬浮胶凝(shjerten:biochimbiophysacta79(2),393-398(1964),其全部教导都通过引用并入本文)。或者,支撑物可由合成聚合物例如交联合成聚合物,例如苯乙烯或苯乙烯衍生物、二乙烯苯、丙烯酰胺、丙烯酸酯、甲基丙烯酸酯、乙烯基酯、乙烯酰胺等制备。此类合成聚合物可根据标准方法产生,参见“styrenebasedpolymersupportsdevelopedbysuspensionpolymerization”(rarshady:chimicael'industria70(9),70-75(1988),其全部教导都通过引用并入本文)。多孔天然或合成聚合物支撑物也可从例如gehealthcare,uppsala,sweden的商业来源获得。[0628]可将包含目标蛋白质的生物样品混合物的蛋白质加载量调整至以下柱的总蛋白质加载量:介于约25g/l与约750g/l之间、或介于约75g/l与约500g/l之间、或介于约100g/l与约300g/l之间。在某些示例性实施方案中,将加载蛋白质混合物的蛋白质浓度调整至加载于柱上的材料的以下蛋白质浓度:介于约1g/l与约50g/l之间、或介于约9g/l与约25g/l之间。[0629]可添加添加剂,例如聚乙二醇、清洁剂、氨基酸、糖、离液剂,以增强分离性能,从而实现更好的分离、回收和/或产物质量。[0630]在某些实施方案中,包括与阿柏西普和/或minitrap有关的那些实施方案,本发明的方法可用于选择性地去除、显著减少或基本上去除所有ptm,包括氧代变体。[0631]用于产生本发明的组合物的方法也可以连续色谱模式实施。在这种模式下,使用至少两个柱(称为“第一”柱和“第二”柱)。在某些实施方案中,可进行此连续色谱模式,以使得洗脱级分和/或汽提级分(包含ptm,例如氧代变体)可随后或同时加载于第二柱上(有或无稀释)。[0632]在一个实施方案中,用于连续模式的介质选择可为具有侧悬疏水和阴离子交换官能基的许多色谱树脂、整料介质、膜吸附介质或深度过滤介质中的一种。[0633]f.疏水相互作用色谱[0634]本发明的组合物还可使用疏水相互作用色谱(hic)来制备。[0635]在进行分离时,例如使用批量生产技术或使用柱或膜色谱使生物样品与hic材料接触。在hic处理之前,可能需要调整盐缓冲液的浓度以实现所需蛋白质与树脂或膜的结合/相互作用。[0636]离子交换色谱依赖于目标蛋白质的局部电荷来进行选择性分离,而疏水相互作用色谱则利用蛋白质的疏水特性来实现选择性分离。蛋白质上或蛋白质内的疏水基团与色谱树脂或膜的疏水基团相互作用。通常,在合适的条件下,蛋白质(或蛋白质的一部分)的疏水性越强,其与柱或膜的相互作用就越强。因此,在合适的条件下,hic可用于促进样品中的过程相关的杂质(例如,hcp)以及产物相关的物质(例如,聚集体和碎片)与目标蛋白质的分离。[0637]像离子交换色谱一样,hic柱或hic膜装置也可在洗脱模式、流通模式或混合模式下操作,其中产物展示与色谱材料的结合或相互作用,而仍可使用与加载缓冲液相同或基本上相似的缓冲液从所述材料上洗去。(上面结合aex处理概述了这些模式的细节。)由于疏水相互作用在高离子强度下最强,所以这种分离形式宜在盐洗脱步骤(例如通常与离子交换色谱结合使用的那些)之后进行。或者,可在采用hic步骤之前将盐添加至样品中。高盐浓度有利于蛋白质吸附于hic柱上,但实际浓度可取决于目标蛋白质的性质、盐类型和所选的特定hic配体而在很大范围内变化。取决于它们是促进疏水相互作用(盐析效应)还是破坏水的结构(离液效应)并导致疏水相互作用减弱,各种离子可以所谓的疏溶(soluphobic)系列排列。根据递增的盐析效应将阳离子排序为ba2 ;ca2 ;mg2 ;li ;cs ;na ;k ;rb ;nh4 ,而阴离子可根据递增的离液效应被排序为po43-;so42-;ch3co3-;ci-;br-;no3-;clo4-;i-;scn-。[0638]一般来说,na 、k 或nh4 硫酸盐使用hic有效促进配体-蛋白质相互作用。可如以下关系所给出来配制影响相互作用强度的盐:(nh4)2so4》na2so4》nacl》nh4c1》nabr》nascn。一般来说,介于约0.75m与约2m之间的硫酸铵或介于约1m与约4m之间的nacl的盐浓度是有用的。[0639]hic介质通常包含疏水性配体(例如烷基或芳基)与其偶联的基础基质(例如,交联琼脂糖或合成共聚物材料)。合适的hic介质包含用苯基官能化的琼脂糖树脂或膜(例如,来自gehealthcare的phenylsepharosetm或来自sartorius的phenylmembrane)。许多hic树脂是市售的。实例包括但不限于:captophenyl、具有低或高取代的phenylsepharosetm6fastflow、phenylsepharosetmhighperformance、octylsepharosetmhighperformance(gehealthcare);fractogeltmemdpropyl或fractogeltmemdphenyl(e.merck,germany);macro-preptmmethyl或macro-preptmt-butyl柱(bio-rad,california);wphi-propyl(c3)tm(j.t.baker,newjersey);以及toyopearltm醚、苯基或丁基(tosohaas,pa);toyoscreenppg;toyoscreenphenyl;toyoscreenbutyl;toyoscreenhexyl;gehiscreen和butylffhiscreenoctylff。[0640]将包含目标蛋白质的样品的蛋白质加载量调整至以下柱的总蛋白质加载量:介于约50g/l至约1000g/l之间、介于约5g/l与约150g/l之间、介于约10g/l与约100g/l之间、介于约20g/l与约80g/l之间、介于约30g/l与约50g/l之间、或介于约40g/l与约50g/l之间。在某些实施方案中,将加载蛋白质混合物的蛋白质浓度调整至有待加载于柱上的以下材料的蛋白质浓度:介于约0.5g/l与约50g/l之间、或介于约1g/l与约20g/l之间。[0641]由于为任何特定生产过程选择的ph值必须与蛋白质的稳定性和活性相容,因此特定的ph值条件对每种应用可为特有的。然而,由于在ph5.0-8.5时,特定的ph值对hic分离的最终选择性和分辨率影响极小,因此此类条件可为有利的。ph值的增加削弱疏水相互作用,并且在ph值高于8.5或低于5.0时,蛋白质的保留发生更剧烈的变化。另外,离子强度的变化、有机溶剂的存在、温度和ph值(尤其是当没有净表面电荷时,在等电点pi下)会影响蛋白质的结构和溶解性,并由此影响与其他疏水性表面(例如在hic介质中的那些)的相互作用,并且因此,在某些实施方案中,本发明结合生产策略,其中对上述一者或多者进行调整,以实现过程相关的杂质和/或产物相关的物质的所需减少。[0642]在某些实施方案中,可使用光谱法,例如uv、nir、ftir、荧光、拉曼,从而以随线(on-line)、近线(at-line)或在线(in-line)模式监测目标蛋白质和杂质,接着可将其用于控制从hic吸附剂流出物中收集的汇集材料中的聚集体水平。在某些实施方案中,可在色谱步骤的流出管在线或在收集容器中使用随线、近线或在线监测方法,以实现所需产物的质量/回收。在某些实施方案中,uv信号可用作替代物以实现适当的产物质量/回收,其中uv信号可经适当处理,包括但不限于例如积分、微分、移动平均值的处理技术,以使得可解决正常过程可变性并且可实现目标产物质量。在某些实施方案中,此类测量可与在线稀释方法组合,以使得加载/洗涤液的离子浓度/电导率可通过反馈来控制,并因此有助于产物质量控制。[0643]g.尺寸排阻色谱[0644]尺寸排阻色谱或凝胶过滤依赖于随分子尺寸而变的组分的分离。分离取决于与流体中的时间相比,物质在多孔固定相中所花费的时间。分子将驻留在孔中的概率取决于分子和孔的尺寸。另外,物质渗透至孔中的能力是由大分子的扩散迁移率决定,大分子越小,扩散迁移率越高。极巨大的大分子可能根本不会渗透至固定相的孔中;而且,对于非常小的大分子,渗透的可能性接近于一。较大分子尺寸的组分更快地移动通过固定相,而较小分子尺寸的组分通过固定相的孔的路径则较长,因此在固定相中的保留时间更长。[0645]色谱材料可包含尺寸排阻材料,其中尺寸排阻材料是树脂或膜。用于尺寸排阻的基质优选是惰性凝胶介质,其可为交联多糖,例如呈球形珠粒形式的交联琼脂糖和/或右旋糖酐的复合物。交联度决定溶胀的凝胶珠粒中存在的孔的尺寸。大于某一尺寸的分子不会进入凝胶珠粒,并且因此最快移动通过色谱床。较小的分子,例如清洁剂、蛋白质、dna等,会根据其尺寸和形状而不同程度地进入凝胶珠粒,它们通过床时会受到阻碍。因此通常以分子尺寸递减的顺序洗脱分子。[0646]适用于病毒的尺寸排阻色谱的多孔色谱树脂可由具有不同物理特征的右旋糖、琼脂糖、聚丙烯酰胺或二氧化硅制成。还可使用聚合物组合。最常用的是可从amershambiosciences以商品名“sephadex”获得的那些。来自不同构造材料的其他尺寸排阻载体也是适当的,例如toyopearl55f(聚甲基丙烯酸酯,来自tosohbioscience,montgomerypa.)和bio-gelp-30fine(bioradlaboratories,hercules,ca)。[0647]可将包含目标蛋白质的样品的蛋白质加载量调整至以下柱的总蛋白质加载量:介于约50g/l至约1000g/l之间、介于约5g/l与约150g/l之间、介于约10g/l与约100g/l之间、介于约20g/l与约80g/l之间、介于约30g/l与约50g/l之间、或介于约40g/l与约50g/l之间。在某些实施方案中,将加载蛋白质混合物的蛋白质浓度调整至有待加载于柱上的以下材料的蛋白质浓度:介于约0.5g/l与约50g/l之间、或介于约1g/l与约20g/l之间。[0648]h.病毒过滤[0649]病毒过滤是产生过程中专用的病毒减少步骤。此步骤通常在色谱精制后进行。可通过使用合适的过滤器来减少病毒,此类过滤器包括但不限于来自asahikaseipharma的planova20ntm、50n或bioex;来自emdmillipore的viresolvetm过滤器;来自sartorius的virosartcpv;或来自pallcorporation的ultipordv20或dv50tm过滤器。本领域普通技术人员显而易见,选择合适的过滤器以获得所需过滤性能。[0650]i.超滤/渗滤[0651]本发明的某些实施方案采用超滤和渗滤以进一步浓缩和配制目标蛋白质。在以下文献中详细描述超滤:principlesandapplications,l.zeman和a.zydney(marceldekker,inc.,newyork,n.y.,1996);和ultrafiltrationhandbook,munircheryan(technomicpublishing,1986;isbn号87762-456-9);其全部教导都通过引用并入本文。一种过滤方法是如题为“pharmaceuticalprocessfiltrationcatalogue”第177-202页(bedford,mass.,1995/96)的millipore目录中所述的切向流过滤,所述文献的全部教导都通过引用并入本文。通常认为超滤是指使用孔径小于0.1μm的过滤器进行的过滤。使用具有如此小的孔径的过滤器,可通过使样品缓冲液渗透通过过滤器膜孔来减少样品的体积,而蛋白质则保留在膜表面之上。[0652]本领域普通技术人员可选择一种适当的膜过滤器装置用于uf/df操作。适用于本发明的膜盒(membranecassette)的实例包括但不限于来自emdmillipore的具有10kd、30kd或50kd膜的pellicon2或pellicon3盒;来自gehealthcare的kvick10kd、30kd或50kd膜盒;以及来自pallcorporation的centramate或centrasette10kd、30kd或50kd盒。[0653]j.示例性生产策略[0654]可通过依次采用ph降低、离心和过滤从生产生物反应器收获物中去除细胞和细胞碎片(包括hcp)来进行初步回收。本发明涉及使来自初步回收的包含目标蛋白质的生物样品经历一个或多个生产步骤,包括(但无特别顺序)aex、cex、sec、hic和/或mm。本发明的某些方面包括进一步处理步骤。额外的处理程序的实例包括乙醇沉淀、等电聚焦、反相hplc、硅胶色谱、肝素sepharosetm色谱、其他阴离子交换色谱和/或其他阳离子交换色谱、色谱聚焦、sds-page、硫酸铵沉淀、羟磷灰石色谱、凝胶电泳、透析和亲和色谱(例如,使用蛋白a或g、抗体、特异性底物、配体或抗原作为捕获试剂)。在某些方面,可独立地改变柱温度(以及其他参数)以提高分离效率和/或任何特定产生步骤的产率。[0655]在某些实施方案中,可将未结合的流通和洗涤级分进一步分级分离,并且可汇集提供目标产物纯度的级分的组合。[0656]柱加载和洗涤步骤可通过以下操作来控制:在柱流出物或收集池或两者中在线、近线或脱机测量产物相关的杂质/物质水平,以达到特定的目标产物质量和/或产率。在某些实施方案中,可通过用缓冲液或其他溶液在线或分批或连续稀释来动态控制加载浓度,以实现提高分离效率和/或产率所需的分配。[0657]此类生产程序的实例描绘于图5-8中。[0658]图5代表用于产生阿柏西普的一个示例性实施方案。参看图5,所述方法包括:(a)在cdm中培养的宿主细胞中表达阿柏西普;(b)使用可包括亲和捕获树脂的第一色谱支撑物捕获阿柏西普;以及(c)使阿柏西普的至少一部分与可包括阴离子交换色谱的第二色谱支撑物接触。步骤(c)还可包括洗涤aex柱以及收集包含阿柏西普的样品的流通级分。任选地,步骤(c)可包括汽提第二色谱支撑物以及收集汽提级分。所述步骤可通过常规方法联合上文提及的方法来进行。应理解,本领域技术人员可能选择采用cex而非aex或除aex之外还使用cex。还可不以特定顺序采用额外的色谱步骤,包括但不限于hic和sec。[0659]除了图5中的示例性实施方案之外,其他额外的示例性实施方案可包括(d)使步骤(c)的所述阿柏西普的至少一部分与第三色谱支撑物接触。在一个方面,方案可包括(e)使步骤(d)的至少一部分阿柏西普与第四色谱支撑物接触。在此实施方案的一个方面,方案可任选地包括使步骤(c)的包含阿柏西普的样品经历小于5.5的ph值。在一个方面,本方法包括在步骤(a)之前的澄清步骤。[0660]图6代表用于产生vegfminitrap的一个示例性实施方案。此方法包括:(a)在cdm中培养的宿主细胞中表达阿柏西普;(b)使用可包括亲和色谱树脂的第一色谱支撑物捕获阿柏西普;(c)切割阿柏西普,从而去除fc结构域并形成包含vegfminitrap的样品;(d)使步骤(c)的样品与可为亲和色谱的第二色谱支撑物接触,以及(e)使步骤(d)的流通液与可包括阴离子交换色谱的第三色谱支撑物接触。步骤(d)包括流通级分的收集,其中由于缺少fc结构域,minitrap应驻留,而阿柏西普或具有fc结构域的任何其他蛋白质应基本上与步骤(d)的亲和柱相互作用。任选地,步骤(d)可包括汽提第三色谱支撑物和收集汽提级分。所述步骤可通过常规方法结合以上概述的方法来进行。不以特定顺序,可包括额外的色谱步骤,但不限于例如hic和sec。[0661]图7代表用于产生阿柏西普的一个示例性实施方案。此方法包括:(a)在cdm中培养的宿主细胞中表达阿柏西普;(b)使用可包括阳离子交换色谱的第一色谱支撑物捕获阿柏西普;以及(c)使步骤(b)的流通液与可包括阴离子交换色谱的第二色谱支撑物接触。任选地,步骤(c)可包括汽提第二色谱支撑物和收集汽提级分。所述步骤可通过常规方法结合以上提及的方案来进行。不以特定顺序,可采用其他色谱程序,包括但不限于hic和sec。[0662]图8代表用于产生vegfminitrap的一个示例性实施方案。此方法包括:(a)在cdm中培养的宿主细胞中表达阿柏西普;(b)使用可包括离子交换色谱的第一色谱支撑物捕获阿柏西普;(c)对(b)的包含阿柏西普的流通级分进行亲和色谱;洗脱,其中洗脱液包含阿柏西普;(d)使(c)的阿柏西普经历切割活性,从而切割fc结构域,由此形成vegfminitrap。在一个方面,步骤(b)的离子交换包含aex。或者,步骤(b)可包含cex。不以特定顺序,可包括额外的色谱步骤,例如步骤(d)之后的其他离子交换色谱步骤、hic和/或sec的添加。[0663]vii.包含组合物的药物制剂[0664]本发明还公开包含抗vegf组合物(如上所述)的制剂。抗vegf蛋白的合适的制剂包括但不限于以下专利中所述的制剂:美国专利第7,608,261号、美国专利第7,807,164号、美国专利第8,092,803号、美国专利第8,481,046号、美国专利第8,802,107号、美国专利第9,340,594号、美国专利第9,914,763号、美国专利第9,580,489号、美国专利第10,400,025号、美国专利第8,110,546号、美国专利第8,404,638号、美国专利第8,710,004号、美国专利第8,921,316号、美国专利第9,416,167号、美国专利第9,511,140号、美国专利第9,636,400号和美国专利第10,406,226号,其都通过引用整体并入本文。[0665]上游工艺技术(在上文部分iv中描述)、下游工艺技术(在上文部分v中描述)可单独使用或彼此组合使用以实现制剂产生。[0666]本发明公开包含抗vegf组合物和一种或多种成分/赋形剂的制剂以及其使用方法和制备此类组合物的方法。在本发明的一个实施方案中,本发明的药物制剂具有约5.5、5.6、5.7、5.8、5.9、6.0、6.1或6.2的ph值。[0667]为了制备抗vegf组合物的药物制剂,将抗vegf组合物与药学上可接受的载剂或赋形剂混合。参见例如remington'spharmaceuticalsciencesandu.s.pharmacopeia:nationalformulary,mackpublishingcompany,easton,pa.(1984);hardman等人(2001)goodmanandgilman'sthepharmacologicalbasisoftherapeutics,mcgraw-hill,newyork,n.y.;gennaro(2000)remington:thescienceandpracticeofpharmacy,lippincott,williams,andwilkins,newyork,n.y.;avis等人(编辑)(1993)pharmaceuticaldosageforms:parenteralmedications,marceldekker,ny;lieberman等人(编辑)(1990)pharmaceuticaldosageforms:tablets,marceldekker,ny;lieberman等人(编辑)(1990)pharmaceuticaldosageforms:dispersesystems,marceldekker,n.y.;weiner和kotkoskie(2000)excipienttoxicityandsafety,marceldekker,inc.,newyork,n.y.;其全部教导都通过引用并入本文。在本发明的一个实施方案中,药物制剂是无菌的。[0668]本发明的药物制剂包括抗vegf组合物和药学上可接受的载剂,包括例如水、缓冲剂、防腐剂和/或清洁剂。[0669]本发明提供一种药物制剂,其包含本文所列的抗vegf组合物中的任一者和药学上可接受的载剂,例如,其中多肽的浓度为约40mg/ml、约60mg/ml、约80mg/ml、90mg/ml、约100mg/ml、约110mg/ml、约120mg/ml、约130mg/ml、约140mg/ml、约150mg/ml、约200mg/ml或约250mg/ml。[0670]本发明的范围包括经干燥、例如经冷冻干燥的组合物,其包含抗vegf蛋白和基本上(约85%至约99%或更高)无水的药学上可接受的载剂。[0671]在一个实施方案中,根据physicians'deskreference2003(thomsonhealthcare;第57版(2002年11月1日),其全部教导都通过引用并入本文),将与本文公开的抗vegf组合物联合向受试者施用的另一种治疗剂施用于受试者。[0672]本发明提供一种容器(例如,具有盖的塑料或玻璃小瓶或色谱柱、中空针或注射器筒),其包含本文所述的抗vegf组合物中的任一者或包含药学上可接受的载剂的药物制剂。本发明还提供一种包含本文所述的抗vegf组合物或制剂的注射装置,例如注射器、预填充注射器或自动注射器。在一个方面,将容器染色(例如棕色)以遮挡自然光或其他光。[0673]本发明包括包含抗vegf组合物以及一种或多种其他治疗剂的组合。抗vegf组合物和其他治疗剂可在单一组合物中或在单独组合物中。例如,治疗剂是ang-2抑制剂(例如奈伐苏单抗(nesvacumab))、tie-2受体活化剂、抗pdgf抗体或其抗原结合片段、抗pdgf受体或pdgf受体β抗体或其抗原结合片段和/或另外的vegf拮抗剂,例如阿柏西普、康柏西普、贝伐单抗(bevacizumab)、雷尼单抗(ranibizumab);抗vegf适体,例如哌加他尼(pegaptanib)(例如,哌加他尼钠);单链(例如,vl-vh)抗vegf抗体,例如溴珠单抗(brolucizumab);抗vegfdarpin,例如abiciparpegoldarpin;双特异性抗vegf抗体,例如其也与ang2结合,例如rg7716;或可溶形式的包含胞外结构域1-3的人类血管内皮生长因子受体3(vegfr-3),表示为fc融合蛋白。[0674]viii.治疗方法[0675]本发明提供用于在受试者中治疗或预防癌症(例如,其生长和/或转移至少部分地由vegf介导,例如vegf介导的血管生成)或血管生成性眼部病症的方法,所述方法包括施用治疗有效量的如本文(前述部分iii)所公开的组合物。[0676]上游工艺技术(前述部分iv)和下游工艺技术(前述部分v和vi)可单独使用或相互组合使用,以产生如部分iii中所述的组合物和/或如部分vii中所述的制剂,其可用于治疗或预防多种病症,包括眼科和肿瘤疾病。[0677]本发明还提供了一种向受试者(例如人类)施用本文(部分iii和vii)所述的组合物的方法,所述方法包括将在不多于约100μl,例如约50μl、约70μl或约100μl中具有约0.5mg、2mg、4mg、6mg、8mg、10mg、12mg、14mg、16mg、18mg或20mg目标蛋白质(例如阿柏西普或minitrap)和任选地另一治疗剂的组合物通过例如眼内注射(例如通过玻璃体内注射)引入受试者体内。[0678]本发明提供了一种在有需要的受试者中治疗癌症(其生长和/或转移至少部分地由vegf介导,例如vegf介导的血管生成)或血管生成性眼部病症的方法,所述方法包括向受试者施用治疗有效量的本文(以上部分iii和部分vii)所述的组合物,例如,在不多于约100μl中的2mg、4mg、6mg、8mg或10mg目标蛋白质和任选地另一治疗剂。在本发明的一个实施方案中,通过玻璃体内注射进行施用。可使用本文的方法治疗或预防的血管生成性眼部病症的非限制性实例包括:[0679]·年龄相关的黄斑变性(例如,湿性或干性),[0680]·黄斑水肿,[0681]·视网膜静脉阻塞后的黄斑水肿,[0682]·视网膜静脉阻塞(rvo),[0683]·视网膜中央静脉阻塞(crvo),[0684]·视网膜分支静脉阻塞(brvo),[0685]·糖尿病性黄斑水肿(dme),[0686]·脉络膜新生血管形成(cnv),[0687]·虹膜新生血管形成,[0688]·新生血管性青光眼,[0689]·青光眼手术后纤维化,[0690]·增生性玻璃体视网膜病(pvr),[0691]·视盘新生血管形成,[0692]·角膜新生血管形成,[0693]·视网膜新生血管形成,[0694]·玻璃体新生血管形成,[0695]·角膜翳,[0696]·翼状胬肉,[0697]·血管性视网膜病,[0698]·在患有糖尿病性黄斑水肿的受试者中的糖尿病性视网膜病;以及[0699]·糖尿病性视网膜病(例如非增生性糖尿病性视网膜病(例如,以约47或53的糖尿病性视网膜病严重程度量表(drss)分级为特征),或增生性糖尿病性视网膜病;例如,在不患有dme的受试者中)。[0700]此类组合物或制剂(部分iii和部分vii)的施用方式可改变并且由熟练从业者确定。施用途径包括肠胃外、非肠胃外、经口、直肠、透粘膜、肠、肠胃外、肌内、皮下、皮内、髓内、鞘内、直接心室内、静脉内、腹膜内、鼻内、眼内、吸入、吹入、表面、皮肤、眼内、玻璃体内、透皮或动脉内。[0701]在本发明的一个实施方案中,本发明的药物制剂(包括本发明的组合物或制剂)的玻璃体内注射包括以下步骤:用包含制剂的注射器和针(例如30号注射针)刺穿眼睛,以及将制剂(例如,小于或等于约100微升;约40、50、55、56、57、57.1、58、60或70微升)以足量体积注入眼玻璃体中以便递送如本文所述的治疗有效量,例如约2、4、6、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8或8.9、10或20mg的目标蛋白质。任选地,所述方法包括以下步骤:向所注射的眼睛施用局部麻醉剂(例如,丙美卡因(proparacaine)、利多卡因(lidocaine)或四卡因(tetracaine))、抗生素(例如,氟喹诺酮(fluoroquinolone))、防腐剂(例如,聚维酮-碘)和/或瞳孔扩张剂。在一个方面,在注射之前,在有待注射的眼睛周围建立无菌区。玻璃体内注射后,监测受试者的眼内压升高、炎症和/或血压。[0702]用于血管生成性眼部病症的目标蛋白质的有效或治疗有效量是指足以引起癌症或血管生成性眼部病症的消退、稳定或消除的目标蛋白质的量,例如,通过使癌症或血管生成性眼部病症的一种或多种症状或征象以任何临床上可测量的程度消退、稳定或消除(例如,关于血管生成性眼部病症);通过使糖尿病性视网膜病严重程度评分(drss)降低或维持;通过改善或维持视力(例如,最佳矫正视力,如通过etdrs字母的增加来量度);增加或维持视野和/或减小或维持中央视网膜厚度;以及就癌症而言,停止或逆转受试者中的癌细胞的生长、存活和/或转移。[0703]在本发明的一个实施方案中,用于治疗或预防血管生成性眼部病症的目标蛋白质(例如阿柏西普)的有效或治疗有效量为约0.5mg、2mg、3mg、4mg、5mg、6mg、7mg、7.25mg、7.7mg、7.9mg、8.0mg、8.1mg、8.2mg、8.3mg、8.4mg、8.5mg、8.6mg、8.7mg、8.8mg、8.9mg、9mg、10mg、11mg、12mg、13mg、14mg、15mg、16mg、17mg、18mg、19mg或20mg,例如,在不多于约100μl中。所述量可根据有待施用的受试者的年龄和体格、目标疾病、疾患、施用途径等而变化。在某些示例性实施方案中,可在初始剂量之后施用第二或多个后续剂量的目标蛋白质,所述第二或多个后续剂量的量可与初始剂量的剂量大致相同或更少或更多,其中后续剂量间隔至少1天至3天、至少一周、至少2周、至少3周、至少4周、至少5周、至少6周、至少7周、至少8周、至少9周、至少10周、至少12周或至少14周。[0704]应注意,剂量值可随着有待减轻的疾患的类型和严重程度而变化。应进一步理解对于任何特定受试者,具体剂量方案应根据受试者需求和施用或监督施用所述组合物的人的专业判断随时间加以调节,并且本文所列举的剂量范围仅是示例性的并且不旨在限制所要求保护的组合物的范围或实践。[0705]ix.测定蛋白质变体的方法[0706]使用本文所述的技术产生的色谱样品中的蛋白质变体的水平可如下文实施例中所述来分析。在某些实施方案中,使用带有用碳氟化合物涂覆的毛细管筒(100μπιx5cm)的ice3分析仪(proteinsimple)来采用cief方法。两性电解质溶液由以下各物在纯净水中的混合物组成:0.35%甲基纤维素(mc)、4%pharmalyte3-10载剂两性电解质、4%pharmalyte5-8载剂两性电解质、10mml-精氨酸hcl、24%甲酰胺以及pi标志物5.12和9.77。阳极电解液是80mm磷酸,而阴极电解液是100mm氢氧化钠,均在0.10%甲基纤维素中。将样品在纯净水中稀释至10mg/ml。将样品与两性电解质溶液混合,接着通过引入1500v的电位持续一分钟,接着引入3000v的电位持续7分钟来聚焦。通过使280nm紫外光穿过毛细管并进入电荷耦合装置数字相机的镜头中,获得聚焦变体的图像。随后分析此图像以确定各种电荷变体的分布。本领域技术人员可改变精确参数,同时仍达到期望结果。[0707]在整个说明书中引用各种出版物,包括专利、专利申请、公开的专利申请、登录号、技术论文和学术论文。这些引用的参考文献中的每一篇都通过引用整体并入。[0708]本公开将通过参考下文实施例更充分地理解。然而,它们不应被理解为限制本发明的范围。[0709]实施例[0710]在实施例中论述的minitraps(mt)1-6如下:[0711]mt1:通过切割使用cdm1产生的阿柏西普获得的vegfminitrap。[0712]mt2:通过切割使用cdm2产生的阿柏西普获得的vegfminitrap。[0713]mt3:通过切割使用cdm3产生的阿柏西普获得的vegfminitrap。[0714]mt4:通过切割使用大豆水解物产生的阿柏西普获得的vegfminitrap。[0715]mt5:重组vegfminitrap(二聚体)。[0716]mt6:重组vegfminitrap(scfv)。[0717]mt1、mt5和mt6的表征描述于下文实施例8中。[0718]样品颜色评价[0719]发现测量b*值(cielab)的分光光度测定法适合进行颜色评价。[0720]在可见光谱(380至780nm)上定量1ml蛋白质样品的吸光度,并且使用一组矩阵运算将吸光度曲线转换为cielab颜色空间。所述仪器每小时可处理大约6个样品。所述测定的高通量格式使用clariostar读板仪(bmglabtech)。使用需要0.3ml样品的96孔板,可分析至多96个样品。[0721]为了将by标准转换为b*值,使用高通量测定格式对by参考标准(by1至by7)进行定量。[0722]溶液是按照以上论述的by标准来制备。每个标准的b*值如图9中所示。此方法提供更快的测定、更少的样品需求和更短的运行时间,如下表3中所示。对于使用此方法评估的所有样品,将测试样品的蛋白质浓度标准化为5g/l或10g/l。[0723]表3.[0724]原始高通量量/样品1ml0.3ml测量格式比色管(单个)96孔板(整体)运行时间6个样品/小时96个样品/5分钟数据输入手动自动资料存储excellims[0725]实施例1:使用化学成分确定的培养基产生蛋白质[0726]1.1细胞来源和收获[0727]在本研究中使用产生阿柏西普的细胞系。使用化学成分确定的培养基(cdm)培养和收获产生阿柏西普的细胞系。[0728]1.2阿柏西普的蛋白水解切割[0729]将具有经固定的ides酶(获自genovis(cambridge,ma)的)的柱用于产生mt1。将获自细胞培养收获物的阿柏西普(在1.0ml切割缓冲液中的20mg)添加至柱中,并在18℃下温育30分钟。30分钟后,用切割缓冲液(1.0ml)洗涤柱。将消化混合物与洗涤溶液合并。将混合物加载于分析型蛋白a亲和柱(appliedbiosystemstm,porostm20μm蛋白a筒2.1x30mm,0.1ml(目录号2-1001-00)上并从其洗脱。根据用于porostm20μm蛋白a筒2.1x30mm,0.1ml(目录号2-1001-00)的appliedbiosystems'tm方案进行处理。柱高度为20±1.0cm,保留时间是15分钟,并且使用40mmtris、54mm乙酸盐ph7.0±0.1进行平衡/洗涤。[0730]实施例2.阴离子交换色谱(aex)用于使颜色最小化[0731](a)使用aex减少颜色形成[0732]进行aex色谱以去除在使用cdm1表达的阿柏西普的产生期间获得的着色。[0733]2.1设计[0734]如表2-1中所详示,使用如表2-2中所述的aex方案对本研究进行五次aex分离。将15.7mlqsepharosefastflow柱(19.5cm床高,1.0cmi.d.)和14.1mlporos50hq柱(18.0cm床高,1.0cmi.d.)整合至aktaavant台式液相色谱控制器中。[0735]使用2mtris碱或2m乙酸将aex加载液的ph值调节至目标±0.05个ph单位。使用5m氯化钠或去离子水将aex加载液的电导率调节至目标±0.1ms/cm。分析所有汇集样品的高分子量(hmw)、颜色和产率。[0736]表2-1.用于aex颜色减少的研究设计的概述[0737]aex分离评估条件树脂1ph8.30–8.50,1.90–2.10ms/cmporos50hq2ph7.90–8.10,2.40–2.60ms/cmqsepharoseff3ph7.90–8.10,2.40–2.60ms/cmporos50hq4ph7.70–7.90,3.90–4.10ms/cmqsepharoseff5ph7.70–7.90,3.90–4.10ms/cmporos50hq[0738]表2-2.用于颜色减少的aex方案[0739][0740]2.2结果[0741]将aex分离用于产生会呈现颜色的显著减少。(表2-3)。例如,如表2-3中所见,在aex分离1(ph8.30-8.50,1.90-2.10ms/cm)的流通液(ft)和洗涤液中观察到的颜色具有1.05的b*值,而用于aex的加载液(“aex加载液”)的颜色具有3.06的b*值。b*值的增加反映样品的黄棕色着色的强度。[0742]进行五次aex分离以评估树脂(qsepharoseff或poros50hq)以及ph和电导率设定点(ph8.40和2.00ms/cm、ph8.00和2.50ms/cm、或ph7.80和4.00ms/cm)对颜色减少的影响。对于poros50hq,产率(64.4%、81.9%和91.4%)和汇集hmw水平(1.02%、1.29%和1.83%)随着设定点变化为较低ph值和较高电导率而提高。颜色(b*值)也随着设定点变化为较低ph值和较高电导率而增加(1.05、1.33和1.55)。对于poros50hq的aex分离,较高的ph值和较低的电导率提供最大程度的颜色减少。[0743]对于qsepharosefastflow,产率(49.5%和77.7%)和汇集hmw水平(0.59%和1.25%)也随着设定点变化为较低ph值和较高电导率而提高。颜色(b*值)也随着设定点变化为较低ph值和较高电导率而增加(0.96和1.35)。[0744]aex的使用减少黄棕色着色—参见表2-3。另外,对于在两种树脂上评估的两个设定点,确定qsepharosefastflow减少的颜色比poros50hq多。在ph8.00和2.50ms/cm设定点下,poros50hq池具有1.33的b*值,而qsepharosefastflow池具有0.96的b*值。类似地,在ph7.80和4.00ms/cm设定点下,poros50hq池具有1.55的b*值,而qsepharosefastflow池具有1.35的b*值(表2-3)。[0745]表2-3.aex颜色减少研究的实验结果的概述[0746][0747]aex,阴离子交换色谱;hmw,高分子量种类;n/a,不适用[0748]将级分调节至10g/l的蛋白质浓度以用于颜色测量。[0749]2.3结论[0750]发现aex的使用减少黄棕色着色,参见表2-3。参看表2-3,aex加载液具有3.06的b*值,但在经历aex色谱(aex分离1-5)时,b*值减小表明黄棕色着色的减少。此外,随着b*值的减小,着色也随之减少;随着b*值的增大,其反映了给定样品中黄棕色的增加。[0751]使用两种aex树脂(poros50hq和qsepharosefastflow)以及三个设定点(ph8.40和2.00ms/cm、ph8.00和2.50ms/cm、以及ph7.80和4.00ms/cm)评估颜色减少。在这两种树脂下,对于较高ph值和较低电导率的设定点,颜色减少较多。此外,在对两种树脂评估的两个设定点(ph8.00和2.50ms/cm以及ph7.80和4.00ms/cm)下,qsepharosefastflow比poros50hq提供更多的颜色减少。然而,与用于aex的加载溶液(“aex加载液”)相比,所有五种aex分离方法均导致显著的颜色减少,表明在使用cdm表达的阿柏西普的产生过程中aex产生的重要性。aex加载液(浓度为10g/l)的初始b*值可在约0.5至约30的范围内,更特别是在约1.0至约25.0的范围内,并且甚至更特别是在约2.0至约20.0的范围内。使用aex之后,流通液(浓度为10g/l)的b*值可在0.5至约10.0的范围内,更特别是在约0.5至约7.0的范围内,并且甚至更特别是在约0.5至约5.0的范围内。[0752]2.4肽作图[0753]样品制备。进行从上述实验(表2-3)的aex加载液和流通液获得的还原和烷化阿柏西普样品的胰蛋白酶作图,以识别和量化翻译后修饰(ptm)。将每个样品(加载液和流通液)的等分试样用8.0m尿素、0.1mtris-hclph7.5变性,用dtt还原,接着用碘乙酰胺烷化。首先将经变性、还原和烷化的样品在37℃下用重组lys-c(rlys-c)以1:100(w/w)的酶与底物比率消化30分钟,用0.1mtris-hclph7.5稀释,使得最终尿素浓度为1.8m,随后在37℃下用胰蛋白酶以1:20(w/w)的酶与底物比率消化2小时,接着在37℃下用pngasef以1:5(w/w)的酶与底物比率去糖基化1小时。通过使用甲酸(fa)使ph值低于2.0来中止消化。[0754]lc-ms分析。将从每个样品得到的rlys-c/胰蛋白酶肽的20μg等分试样通过以下来分离和分析:使用watersacquityuplccshc18柱(1.7μm,2.1×150mm)进行反相超高效液相色谱(uplc),接着随线pda检测(在280nm、320nm和350nm的波长下)和质谱分析。流动相a是在水中的0.1%fa,而流动相b是在乙腈中的0.1%fa。样品注入后,梯度以在0.1%b下保持5分钟开始,接着在75分钟内线性增加至35%b,以实现最佳肽分离。使用thermoscientificqexactivehybridquadrupole-orbitrap质谱仪进行ms和ms/ms实验,所述质谱仪采用高能碰撞解离(hcd)进行用于ms/ms实验的肽片段化。肽身份分配是基于在全ms谱中的给定肽的经实验确定的精确质量以及在相应hcdms/ms谱中的b和y碎片离子。生成来自加载液和流通液的肽的提取离子色谱图(参见图10)。如图10中的提取离子色谱图中所见,显示了在来自aex分离1-5的“aex加载液”和“aexft/洗涤液”中识别的肽片段(如表2-3中所识别)。来自肽作图分析的在图10中识别的这些肽中的一些的相对丰度示于图11中。[0755]参看图11,此图识别所分析的各种肽片段及其相对氧化水平。特别是,第三柱识别经分离和分析的肽片段的氨基酸残基(“肽序列”)。每个肽序列都具有加下划线的氨基酸残基。加下划线的氨基酸残基识别肽序列中被氧化的氨基酸。被氧化的氨基酸对应于组氨酸(h)氧化或色氨酸(w)氧化。此图中还描绘每个肽序列右侧的行,显示氧化种类的丰度。行中的阴影表示使用在相应的列标题中识别的不同aex分离,在特定样品中的氧化残基的相对量的差异。例如,参看图11中的第二肽eiglltceatvnghlyk,当以水平方式读取时,在特定样品(“阿柏西普aex加载液”)中被氧化的此肽的相对总群体大致0.013%被氧化。当在同一行上进行时,阴影发生偏移,表明氧化种类的相对丰度发生改变。例如,使用此相同的肽序列,当遵循不同aex分离方案时,用于aex分离的氧化种类的相对丰度是0.006%至0.010%。因此,可理解,aex色谱降低氧化种类的丰度。[0756](b)使用aex来减少minitrap产生中的颜色形成[0757]进行aex色谱以去除在mt1的产生期间获得的着色,所述着色是在进行使用cdm1表达的全长阿柏西普的切割后获得。[0758]2.5设计[0759]如表2-4中所述,本研究进行4次aex分离。从mt1的过滤样品(“mt1过滤池”)获得aex加载液。将15.7mlcaptoq柱(床高20.0cm,1.0cmi.d.)、14.1mlporos50hq柱(床高18.0cm,1.0cmi.d.)和16.5mlqsepharoseff柱(床高21.0cm,1.0cmi.d.)整合至用于本实验的aktaavant台式液相色谱控制器中。[0760]使用2mtris碱或2m乙酸将aex加载液的ph值调节至目标±0.05个ph单位。使用5m氯化钠或去离子水将aex加载液的电导率调节至目标±0.1ms/cm。分析所有汇集样品的hmw、颜色和产率。[0761]表2-4.aex颜色减少研究的研究设计的概述[0762]aex分离树脂aex方案1captoq表2-62poros50hq表2-63qsepharoseff表2-64poros50hq表2-5[0763]表2-5.用于颜色减少研究的流通aex方案[0764][0765][0766]aex,阴离子交换色谱;cv,柱体积[0767]表2-6.用于颜色减少研究的结合和洗脱aex方案[0768][0769]aex,阴离子交换色谱;cv,柱体积[0770]2.6结果[0771]如对于aex分离1-4的流通液和洗涤液的着色(表2-7)所见,所有四次aex分离均导致颜色减少。虽然前三次aex分离是在结合和洗脱模式下评估(表2-6),但观察到大部分产物存在于加载和洗涤区(62%–94%)中。[0772]前三次分离评估用于captoq、poros50hq和qsepharoseff树脂的ph8.4和2.0ms/cm设定点。所有三次分离均具有良好的产率(》80%)。poros50hqaex池显示在aex池中的最低黄色(b*值为2.09),接着是qsepharoseffaex池(b*值为2.22)和captoqaex池(b*值为2.55)。[0773]表2-7.aex颜色减少研究的实验结果的概述[0774][0775]aex,阴离子交换色谱;hmw,高分子量种类。[0776]将级分调节至5g/l的蛋白质浓度以用于颜色测量。[0777]2.7结论[0778]如对于阿柏西普所见(参见以上部分2.3),发现使用aex可减少minitrap产生的黄棕色着色(表2-7)。参看表2-7,aex加载液具有4.17的b*值,但在经历aex色谱(aex分离1-4)时,b*值减小,表明黄棕色着色的减少。此外,随着b*值的减小,着色也随之减少。aex加载液(浓度为5g/l)的初始b*值可在约0.5至约25的范围内,更特别是在约1.0至约20.0的范围内,并且甚至更特别是在约1.5至约15.0的范围内。使用aex之后,流通液(浓度为5g/l)的b*值可在0.5至约10.0的范围内,更特别是在约0.5至约7.0的范围内,并且甚至更特别是在约0.5至约5.0的范围内。[0779]实施例3.氧化肽研究[0780]3.1肽作图[0781]样品制备。进行还原和烷化minitrap(mt1)和mt4(类似于mt1的minitrap,使用采用大豆水解物细胞培养产生的不同全长阿柏西普)样品的胰蛋白酶作图,以识别和量化翻译后修饰。将样品的等分试样使用在0.1mtris-hcl,ph7.5中的8.0m尿素变性,用dtt还原,接着用碘乙酰胺烷化。将经变性、还原和烷化的原料药首先在37℃下用重组lys-c(rlys-c)以1:100(w/w)的酶与底物比率消化30分钟,用0.1mtris-hclph7.5稀释,使得最终尿素浓度为1.8m,随后在37℃下用胰蛋白酶以1:20(w/w)的酶与底物比率消化2小时,接着在37℃下用pngasef以1:5(w/w)的酶底物比率去糖基化1小时。通过使用甲酸(fa)使ph值低于2.0来中止消化。[0782]lc-ms分析。将从每个样品得到的rlys-c/胰蛋白酶肽的20μg等分试样通过以下来分离和分析:使用watersacquityuplccshc18柱(1.7μm,2.1×150mm)进行反相超高效液相色谱(uplc),接着随线pda检测(在280nm、320nm和350nm的波长下)和质谱分析。流动相a是在水中的0.1%fa,而流动相b是在乙腈中的0.1%fa。样品注入后,梯度以在0.1%b下保持5分钟开始,接着在75分钟内线性增加至35%b,以实现最佳肽分离。在thermoscientificqexactivehybridquadrupole-orbitrap质谱仪上进行ms和ms/ms实验,所述质谱仪采用高能碰撞解离(hcd)进行用于ms/ms实验的肽片段化。肽身份分配是基于在全ms谱中的给定肽的经实验确定的精确质量以及在相应hcdms/ms谱中的b和y碎片离子。生成氧化肽和相应的天然肽的提取离子色谱图,并对峰面积积分,以计算mt1样品中一个或多个氧化氨基酸残基的位点特异性百分比。[0783]与增加的350nm吸光度有关的肽片段[0784]在比较mt1与mt4的胰蛋白酶肽图后,观察到mt1上的ptm(图12a显示从20.0至75分钟洗脱的肽的吸光度)。突出显示具有变化的uv峰的肽。色谱图的展开视图示于图12b中,所述图显示从16至30分钟洗脱的肽的吸光度。在mt1与mt4之间的uv吸光度具有强对比的肽是tnylth*r、iiw( 4)dsr和iiiw( 132)dsr(*或下划线表示残基的氧化)。此外,色谱图的展开视图示于图12c中,所述图显示从30至75分钟洗脱的肽的吸光度。在mt1与mt4之间的uv吸光度具有强对比的肽是dkth*tc*ppc*papellg(seqidno.:17)、telnvgidfnweypsskh*qhk(seqidno.:20)、eiglltceatvngh*lyk(seqidno.:18)和qtntiidvvlspsh*gielsvgek(seqidno.:19)(*表示残基的氧化)。肽作图揭示了在vegfminitrap之间的丰度显著不同的肽的身份。由肽作图分析识别的肽的相对丰度示于表3-1中。mt1(在cdm中产生)中的2-氧代-组氨酸的量高于mt4(在大豆水解物中产生),表明用于表达阿柏西普的培养基可对具有氧化组氨酸或氧化色氨酸的肽的相对丰度具有显著影响。例如,对于肽qtntiidvvlspsh*gielsvgek(seqidno.:19),所述肽在mt1(在cdm中产生)中的相对丰度百分比为0.015%,与肽在mt4(在大豆水解物中产生;其比mt1小约15倍)中的相对丰度百分比形成对比。[0785]表3-1.[0786][0787]颜色和2-氧代-组氨酸的定量。还显示了如通过蛋白酶消化所产生的寡肽中的2-氧代-组氨酸的百分比,如通过质谱法所测量(表3-2)。(将值针对未经修饰的肽进行归一化。)表3-2(i)显示针对以下所观察到的氧化组氨酸/色氨酸的百分比:mt1批次1的aex流通液、mt1批次2的aex流通液和mt1批次3的aex流通液。表3-2(ii)显示针对以下所观察到的氧化组氨酸/色氨酸的百分比:酸性级分1、酸性级分2和针对mt1批次3进行cex分离所获得的主要级分。根据此表中可清楚地看出,酸性变体包含氧化种类。从表3-2(i)中可明显看出,构成肽/蛋白质的2-氧代-组氨酸和色氨酸二氧化的百分比与aex汽提液相比在aex流通液中是降低的。显然,汽提aex柱可富集此类经修饰的肽的百分比。例如,经修饰的肽“eiglltc[ 57]eatvngh[ 14]lyk(seqidno.:18)”的百分比在aex流通液(mt1批次1)中为0.013%,而在“aex汽提液”中为0.080%。由此还证实aex柱捕获经修饰的肽,从而降低aex流通液中经修饰的肽的百分比。[0788]表3-2(i).2-氧代-组氨酸/色氨酸的百分比[0789][0790]表3-2(ii).2-氧代-组氨酸/色氨酸的百分比[0791][0792]在表3-2(ii)中,[ 57]表示通过碘乙酰胺使半胱氨酸烷化将在半胱氨酸上添加羧甲基胺部分,其净质量与未经修饰的半胱氨酸相比增加了约 57:[0793][0794]在表3-2(ii)中,[ 14]表示由his转化为2-氧代-his,一个氧原子添加在碳2上,但失去两个氢原子(一个来自碳2,另一个来自氮3),其净质量与未经修饰的组氨酸相比增加了约 14。[0795][0796]在表3-2(ii)中,[ 32]表示色氨酸二氧化导致形成n-甲酰犬尿氨酸,其净质量与未经修饰的色氨酸相比增加了约 32(图4)。[0797]进行第二组实验以评估通过aex色谱处理的经蛋白酶消化的fabricator切割的阿柏西普(mt4)的寡肽中2-氧代-组氨酸(和色氨酸二氧化)的百分比(以下图13和表3-3)。在经蛋白酶消化的fabricator切割的阿柏西普(mt4)的寡肽的aex汽提液中2-氧代-组氨酸和色氨酸二氧化的百分比显著高于aex流通液中2-氧代-组氨酸和色氨酸二氧化的百分比(参看下表3-3中的“mt1”)。[0798]表3-3.2-氧代-组氨酸的百分比[0799][0800]a使用全长阿柏西普的不同肽计算的值,因为c末端肽与minitrap不同。[0801]在mt1产生期间,aex汽提液中2-氧代-组氨酸和色氨酸二氧化的百分比显著高于aex流通液中2-氧代-组氨酸和色氨酸二氧化的百分比(参看上表3-3中的“mt1”)。与表3-2相比,表3-3显示相似的结果:汽提aex柱所产生的样品中的2-氧代-组氨酸和色氨酸二氧化百分比显著高于aex流通液中2-氧代-组氨酸和色氨酸二氧化百分比,表明在分离期间2-氧代-组氨酸和色氨酸二氧化种类与aex柱结合,并在汽提aex柱后去除。这在提取离子色谱图中更明显,如图14中所见。[0802]强阳离子交换色谱(cex)[0803]为了识别包含抗vegf蛋白的样品中存在的酸性种类和其他变体,进行了一系列实验。[0804]使用monos(10/100)gl柱(gelifesciences,marlborough,ma)进行强阳离子交换色谱。对于样品分离,所用流动相是20mm2-(n-吗啉基)乙磺酸(mes)ph5.7(流动相a)和40mm磷酸钠、100mm氯化钠ph9.0(流动相b)。将非线性ph梯度用于洗脱mt1的电荷变体,在280nm处检测。在相对保留时间早于主峰洗脱的峰在本文中称为酸性种类。[0805]在任何富集之前,来自mt1批次2(≤by3)的样品都使用如图15中所示的方法进行cex。为了降低mt1变体的复杂性,对样品进行去唾液酸化处理。接着进行制备型sec处理(superdex200制备级xk26/100),使用1xdpbsph7.2±0.2作为流动相。将获自包含去唾液酸化minitrap(dsmt1)的制备型sec柱的级分合并,并进一步进行强阳离子交换(scx)色谱,以便使用双重盐-ph梯度富集mt1的电荷变体。程序产生总共7个级分(f1-f7;mc表示方法对照,图16和图17)。[0806]进行cex时,酸性种类的洗脱时间早于主峰,而碱性种类的洗脱时间晚于主峰。如图17中所观察,峰3-5是主峰。在洗脱mt1的主要种类(峰3-5)之前,洗脱出峰1和2,并且因此包含酸性种类。在洗脱mt1的主要种类(峰3-5)之后,洗脱出峰6,并且因此包含碱性种类。表3-4显示在mc中的峰的相对丰度(如图16中所识别)。例如,表3-4的第二行(标记为mc)显示mc中酸性种类的总相对量为约19.8%(即峰1 峰2)。表3-4还显示每个单独级分的峰的相对丰度。尽管在不同级分中有重叠种类(如图16和图17所反映),但级分f1和f2的大部分为酸性种类(即峰1和峰2)。例如,级分f1包含63.7%峰1和19.2%峰2(总共82.9%的酸性种类)。级分f2包含9.6%峰1和75.9%峰2(总共85.5%的酸性种类)。级分f3-f5的大部分为mt1的主要种类(峰3-5)。最后,级分f6-f7的大部分为碱性种类(峰6),但确实包括一些部分的主要种类(例如峰4和峰5)。[0807]还观察到,级分f1和f2(包含酸性种类)与级分f3-f5(包含主要种类或“mt1”)相比具有强烈的黄棕色着色。在浓度≥13mg/ml下检查所有级分的颜色。从此实施例中明显看出,样品中酸性种类的存在以黄棕色着色的出现来追踪,所述着色的去除(或最小化)可通过从mt1中去除(或最少化)酸性种类来实现。[0808]表3-4.基于分析cex的峰的相对丰度[0809][0810]nd:未检测到[0811]mt1批次2和级分f1-f7的3d色谱图示于图18a-h中。mt1批次2未展现任何显著的光谱特征(图18a)。级分1和2(包含酸性种类)展现介于320-360nm之间的光谱特征(参见图18b中的圆圈)。与级分2相比,此特征在级分1中更为突出(图18b和图18c),而在级分3和级分4-7(主要种类,mt1)中则不存在(图18d和图18h),此类级分未展现黄棕色着色。[0812]因此,如上文所观察,cex实现酸性种类/酸性级分(级分1和2)的识别,它们与主要种类/级分(级分3-6)相比显示强烈的黄棕色着色。此结果也以级分f1-f2的3d色谱图中存在而级分f3-f7中不存在的独特光谱特征的形式观察到。[0813]成像毛细管等电聚焦(icief)电泳图[0814]通过icief进一步评价级分f1-7和mc(来自cex后的mt1-批次2)中的变体分布(图19)。[0815]级分f1-7和mc(来自cex后的mt1-批次2)的变体分布是使用具有用碳氟化合物涂覆的毛细管筒(100μmx5cm)的ice3分析仪(proteinsimple)通过icief来进一步评价。两性电解质溶液由以下各物于纯净水中的混合物组成:0.35%甲基纤维素(mc)、0.75%pharmalyte3-10载剂两性电解质、4.2%pharmalyte8-10.5载剂两性电解质以及0.2%pi标志物7.40和0.15%pi标志物9.77。阳极电解液是80mm磷酸,而阴极电解液是100mm氢氧化钠,均在0.10%甲基纤维素中。将样品在纯净水中稀释,并以1:200(每毫克mt1的唾液酸酶a的单位数)的酶与底物比率将唾液酸酶a添加至每个经稀释的样品中,接着在环境温度下温育大约16小时。将经唾液酸酶a处理的样品与两性电解质溶液混合,接着通过引入1500v的电位持续1分钟,随后引入3000v的电位持续7分钟来聚焦。经聚焦的mt1变体的图像是通过使280nm紫外光通过毛细管并进入电荷耦合装置数字相机的镜头中而获得。接着分析此图像以确定各种电荷变体的分布。(图19)。参看图19,级分f1和f2(或酸性级分)显示不存在mt1的峰,所述峰在mc和级分f3-f7(主要种类,mt1)中清楚地观察到。因此,认为icief电泳图能够检测和确定所考虑的蛋白质(在这种情况下是mt1)的不同电荷变体的分布。因此,很明显,进行cex分析时,酸性级分显示(a)2-氧代-组氨酸或二氧代-色氨酸的相对丰度百分比的增加(表3-2(ii));(b)黄棕色着色的增加(数据未显示);和(c)如级分1和2的3d色谱图中所见的光谱特征的存在(图18b和图18c)。[0816]实施例4.光诱导研究[0817]在此实施例中,通过使蛋白质样品暴露于变化量的冷白(cw)荧光或紫外线a(uva)光来进行vegfminitrap(mt)(例如mt1)的光诱导。测定光暴露的样品的颜色和氧化氨基酸含量。如上所述,在暴露后进行lcms分析。mt暴露于冷白光或uva光将造成氧化氨基酸残基(例如组氨酸)的增加(表4-1、表4-2和表4-3)。[0818]表4-1.光诱导研究设计[0819][0820]ich是指ich协调三方指南(ichharmonisedtripartiteguideline):稳定性测试:新原料药和产品q1b的光稳定性测试(photostabilitytestingofnewdrugsubstancesandproductsq1b),其中规定在不小于120万lux*小时冷白荧光和近紫外线能量不小于200w*hr/m2下进行光稳定性研究。[0821]表4-2描绘暴露于冷白光和紫外光的mt样品的着色的增加。例如,样品(t=0)的b值为9.58。此样品在暴露于240万lux*hr下的冷白光时,b值增加至22.14。b值的此增加表明使mt暴露于240万lux*hr下的冷白光与样品(t=0)相比,增加样品的黄棕色着色。类似地,在mt样品(t=0)暴露于400w*h/m2下的紫外光时,b值从9.58增至10.72。b值的此增加表明,与样品(t=0)相比,使mt样品暴露于400w*h/m2下的紫外光增加样品的黄棕色着色。[0822]表4-2.暴露于冷白光和紫外光的样品的着色[0823][0824]样品颜色是使用cielab颜色空间(l*、a*和b*变量)并相对于epby颜色标准表示;l*=白色至黑色(l*是明度);a*=洋红色至浅绿色;b*=黄色至蓝色,b值越高,黄色越强。[0825]表4-3(i).来自经紫外光应力处理的minitrap的肽中的2-氧代-his水平[0826][0827][0828]表4-3(ii).来自经冷白光应力处理的minitrap的肽中的2-氧代-his水平[0829][0830]阿柏西普mt暴露于冷白光或uva光是以氧化组氨酸(2-氧代-his)的出现来追踪(表4-3)。参看表4-3,在mt样品(t=0)中具有氧代-组氨酸的肽“sdtgrpfvemyseipeiihmtegr(seqidno.:22)”为0.007%,而在紫外光下暴露40小时时,其丰度增加至0.324%(表4-3(i)),而在冷白光下暴露300小时时,其丰度增加至1.309%(表4-3(ii))。[0831]观察到2-氧代-组氨酸的两种种类,即13.98da种类(如图2所示)和15.99da种类(如图3所示),其中13.98da种类在经光应力处理的minitrap样品中占优势。已知15.99da种类是铜金属催化过程的产物。j.pharm.biomedanal.,21:1093-1097(2000)。此外,13.98da种类是光驱动过程的产物。liu等人,anal.chem.86(10:4940-4948(2014))。[0832]类似于暴露于冷白光和uva光的样品中的氧化组氨酸的丰度增加,使mt暴露于冷白光或uva光还诱导其他ptm的形成(表4-4和表4-5)。[0833]表4-4(i).在来自经紫外光应力处理的minitrap的肽中的其他ptm[0834][0835]表4-4(ii).来自经冷白光应力处理的minitrap的肽中的其他ptm[0836][0837]表4-5(i).来自经紫外光应力处理的minitrap的肽中的色氨酸/酪氨酸/苯丙氨酸的氧化水平[0838][0839][0840]表4-5(ii).来自经冷白光应力处理的minitrap的肽中的色氨酸/酪氨酸/苯丙氨酸的氧化水平[0841][0842]因此,mt暴露于冷白光或uva光是以氧化残基(例如组氨酸/色氨酸(氧代-trp))的出现来追踪。观察到氧代-trp的四种种类: 4da、 16da、 32da和 48da。 4da种类是由犬尿氨酸的形成来解释(图4),而16da、 32da和 48da是色氨酸残基的单氧化、二氧化和三氧化。在320nm处监测的mt样品的胰蛋白酶消化物的肽作图如图20中所示。可在图20中比较构成肽的氧化残基的相对存在。例如,对于肽iiw( 4)dsrk来说,可看出对于t=0的mt样品、和暴露于uva40小时的mt1样品以及暴露于cwl300小时的mt样品,其存在具有显著差异。[0843]还评估了mt在暴露于冷白光或uva光下,hmw/低分子量(lmw)种类的存在(表4-6)。[0844]表4-6.在延长的uva和cwl应力处理之后产生hmw/lmw种类[0845][0846]为了追踪关于每个样品的hmw/lmw种类的着色,如上所示对所有应力处理的样品(cwl和uva)执行具有全谱pda检测的分析型尺寸排阻色谱(sec-pda)。sec-pda对经cwl应力处理的mt的分析揭示,除了lmw种类外的所有尺寸变体在~350nm处的吸光度的显著增加(图21),而对经uva应力处理的mt的sec-pda则未揭示出在~350nm处的吸光度增加(图22)。与cwl应力处理的样品不同,经uva应力处理的样品不产生任何显著可量化的黄棕色。[0847]在研究经uva和cwl应力处理的样品在320nm与280nm处的吸光度比之后,获得相似的结果。通过原始强度或总峰面积分析的a320/a280比率在经cwl应力处理的样品中以黄色强度的增加来追踪(图23),而a320/a280比率在经uva应力处理的样品中不以黄色强度的增加来追踪(图24)。这证实了先前的观察结果,即经uva应力处理的mt1样品在cwl应力处理后观察不到相同的黄棕色。[0848]实施例5.减少着色的上游方法[0849]5.1化学成分确定的培养基的温育研究[0850]考察掺入包含阿柏西普的新鲜的化学成分确定的培养基(cdm)中的各种成分对于着色的影响。[0851]将一个或多个具有10ml工作体积(新鲜cdm1)的50ml加透气盖(vent-capped)的振荡管温育7天,分别在第0天和第7天取样。将阿柏西普样品(在缓冲水溶液ph6.2中的阿柏西普重组蛋白,所述缓冲水溶液包含5mm磷酸钠、5mm柠檬酸钠和100mm氯化钠)以6g/l的浓度掺入振荡管中。[0852]添加组分以达到如下累积浓度:[0853]·半胱氨酸:16.6mm[0854]·铁:0.23mm[0855]·铜:0.0071mm[0856]·锌:0.54mm[0857]所添加的每种成分对b*值(ciel*,a*,b*颜色空间)的按比例效应在图25a中列出,并且实际b*值针对预测b*值的绘图在图25b中列出。半胱氨酸的添加导致最大的黄棕色增加。铁和锌还产生颜色。叶酸和b族维生素(包括硫胺素、烟碱酰胺、d-泛酸、d-生物素和吡哆醇)增加黄棕色。核黄素和维生素b12在统计学上没有影响颜色。[0858]5.2减少半胱氨酸和金属对b*值的影响[0859]由产阿柏西普的细胞系的种菌培养物接种生物反应器(例如2l)。使经接种的培养物在35.5℃的温度、ph7.1±0.25和22ccm的空气喷射设定点下生长。根据需要向生物反应器中补充葡萄糖、消泡剂和基础进料。在cdm1中评估表达阿柏西普时降低半胱氨酸和金属的浓度对颜色的影响。[0860]第0天的培养基=cdm1,包括1.48mm的半胱氨酸[0861]·营养进料:[0862]ο第2天=化学成分确定的进料(cdf) 1.3-2.1mm半胱氨酸[0863]ο第4天=cdf 1.6-1.7mm半胱氨酸[0864]ο第6天=cdf 1.6-1.7mm半胱氨酸[0865]ο第8天=cdf 1.6-1.7mm半胱氨酸[0866]生物反应器的条件如下:[0867]·以每l培养物约6-7毫摩尔、每l培养物8-9毫摩尔或每l培养物10-11毫摩尔的累积浓度添加半胱氨酸。[0868]·下面列出cdm1(0.5x、1x或1.5xcdm1水平)中1x水平的金属(其中浓度为接种物添加之前的浓度):[0869]οfe=每升培养物68-83微摩尔[0870]οzn=每升培养物6-7微摩尔[0871]οcu=每升培养物0.1-0.2微摩尔[0872]οni=每升培养物0.5-1微摩尔[0873]累积半胱氨酸水平降至6-7毫摩尔/l会减少黄棕色,其中对效价无明显影响。培养基中的金属浓度降至0.5x会减少颜色,其中效价有显著提高。对效价、vcc(活细胞浓度)、生存力、氨或重量渗透压摩尔浓度的影响最小(参见图26a-e)。金属含量和半胱氨酸对b*值和效价的预测的按比例效应在图27中列出。[0874]5.3抗氧化剂对b*值的影响的评估[0875]评估掺入包含阿柏西普的废cdm中的抗氧化剂、牛磺酸、次牛磺酸、硫辛酸、谷胱甘肽、甘氨酸和维生素c对颜色的影响。将一个或多个具有10ml工作体积(cdm1)的50ml加透气盖的振荡管温育7天,在第0天和第7天取样。[0876]向废cdm1中添加组分的条件如下:[0877]·阿柏西普样品(在缓冲水溶液ph6.2中的阿柏西普重组蛋白,其包含5mm磷酸钠、5mm柠檬酸钠和100mm氯化钠)以6g/l的浓度掺入振荡管中[0878]·以下列浓度添加至废cdm1中的抗氧化剂:[0879]ο牛磺酸=10mm的培养物[0880]ο次牛磺酸=10mm的培养物[0881]ο甘氨酸=10mm的培养物[0882]ο硫辛酸=0.0024mm的培养物[0883]ο还原谷胱甘肽=2mm的培养物[0884]ο氢皮质酮=0.0014mm的培养物[0885]ο维生素c(抗坏血酸)=0.028mm的培养物[0886]多重抗氧化剂减少废培养基中的颜色形成:次牛磺酸、牛磺酸和甘氨酸的组合;硫辛酸;以及维生素c。谷胱甘肽增加b*值。[0887]表5-1.抗氧化剂对minitrap的颜色形成的影响的概述[0888]条件b*值第0天的废培养基0.37第7天的废培养基对照1.47第7天的废培养基 抗氧化剂*1.02[0889]*显著减小b*值的抗氧化剂:次牛磺酸/牛磺酸/甘氨酸、硫辛酸、维生素c。[0890]各种抗氧化剂对b*值(ciel*,a*,b*颜色空间)的预测效应的概述在图28(a-c)中列出。[0891]评估掺入包含阿柏西普的废cdm中的抗氧化剂时进一步添加对颜色的影响。将一个或多个具有10ml工作体积(cdm1)的50ml加透气盖的振荡管温育7天,在第0天和第7天取样。[0892]向废cdm1中添加组分的条件如下:[0893]·阿柏西普样品(在缓冲水溶液ph6.2中的阿柏西普重组蛋白,所述缓冲水溶液包含5mm磷酸钠、5mm柠檬酸钠和100mm氯化钠)以6g/l的浓度掺入振荡管中[0894]·运行两个doe实验:[0895]·(i)抗氧化剂以下列浓度添加至废cdm1中:[0896]ο牛磺酸=10mm的培养物[0897]ο次牛磺酸=10mm的培养物[0898]ο甘氨酸=10mm的培养物[0899]ο硫辛酸=0.0024mm的培养物[0900]ο维生素c(抗坏血酸)=0.028mm的培养物[0901]·(ii)添加抗氧化剂以达到以下累积浓度:[0902]οata=2.5μm–5μm[0903]ο甲磺酸去铁胺(dfo)=5μm–10μm[0904]ο过氧化氢酶=101.5mg/l[0905]οs-羧甲基-l-半胱氨酸=10mm[0906]发现次牛磺酸减少废培养基中的颜色形成(图28d)。dfo还显著减少废培养基中的颜色形成(图28d)。其他抗氧化剂对颜色形成没有统计学上的影响。[0907]表5-2.抗氧化剂对minitrap的颜色形成的影响的概述[0908]条件b*值第0天的废培养基0.44第7天的废培养基对照1.73第7天的废培养基 次牛磺酸1.32第7天的废培养基 dfo0.92[0909]振荡瓶抗氧化剂研究:[0910]对牛磺酸、次牛磺酸、甘氨酸、硫辛酸和维生素c关于减少细胞培养物中颜色形成的能力进行单独和组合评估(表5-3)。[0911]由产阿柏西普的细胞系的种菌培养物接种250ml振荡瓶。使经接种的细胞在35.5℃下在5%co2控制下的温育箱中生长。根据需要向振荡瓶中补充葡萄糖和基础进料。使用上述工艺,其中金属在cdm1中以0.5x浓度存在,并且半胱氨酸以6-7mm的累积浓度添加。[0912]表5-3.[0913][0914]图28e显示表5-3中的抗氧化剂对b*值(ciel*,a*,b*颜色空间)和最终效价的预测效应。牛磺酸、次牛磺酸、甘氨酸显著减小b*值,而不会对效价产生负面影响。[0915]实施例6.使用cdm产生阿柏西普的糖基化和生存力研究[0916]由产阿柏西普的细胞系的种菌培养物接种生物反应器(例如2l)。使经接种的培养物在35.5℃的温度、ph7.1±0.25和22ccm的空气喷射设定点下生长。根据需要向生物反应器中补充葡萄糖、消泡剂和基础进料。阿柏西普蛋白的产生是使用cdm1(专有)进行。表达阿柏西普融合蛋白的宿主细胞系的产生是使用cdm1(专有)、cdm2(商购获得)和cdm3(商购获得)进行。使用cdm1、2和3进行一组实验,其中没有额外的培养基组分。使用cdm1-3(将锰(四水合氯化锰,sigma,3.2mg/l)、半乳糖(sigma,8g/l)和尿苷(sigma,6g/l)添加至进料中以修饰半乳糖基化谱)进行另一组实验。最后,使用cdm1-3(将锰(四水合氯化锰,sigma,3.2mg/l)、半乳糖(sigma,8g/l)和尿苷(sigma,6g/l)添加至进料中以修饰半乳糖基化谱,并将地塞米松(sigma,12mg/l)添加至进料中以修饰组合物的唾液酸化谱)进行一组实验。通过离心,接着0.45μm过滤,即可制备出使用每种cdm的澄清收获物。[0917]在n-聚糖分析之前,用蛋白a处理样品。[0918]效价测量[0919]在整个这些实施例中,除非另有说明,否则每天使用agilent(santaclara,ca)1200系列hplc或等效物测量阿柏西普效价,其中在低ph值和逐步洗脱梯度下操作,在280nm处检测。相对于参考标准校准曲线指定浓度。[0920]活细胞密度(vcd)和细胞生存力值[0921]在整个这些实施例中,除非另有说明,否则通过novabioprofileflex自动细胞计数器(novabiomedical,waltham,ma)经由台盼蓝排除法测量活细胞密度(vcd)和细胞生存力值。葡萄糖、乳酸盐、脱机ph、溶解氧(do)、pco2测量值和重量渗透压摩尔浓度是用novabioprofileflex(novabiomedical,waltham,ma)测量。[0922]n-聚糖寡糖谱分析[0923]根据watersglycoworks方案,使用glycoworks快速去糖基化和glycoworksrapifluor-mslabel试剂盒(分别为waters零件号186008939和186008091),制备大约15μg来自cdm1-3收获物的经蛋白a处理的样品以用于n-聚糖分析。通过在50.5℃下用pngase-f处理样品5分钟,接着在25℃下冷却5分钟,从阿柏西普蛋白中去除n-聚糖。经由在室温下反应5分钟,用rapifluor-ms荧光染料标记释放的聚糖。通过向反应混合物中添加乙腈使蛋白质沉淀,并通过在2,204xg下离心10分钟沉淀至孔底。收集包含经标记的聚糖的上清液,并在uplc上使用具有柱后荧光检测的亲水相互作用液相色谱(watersbehamide柱)进行分析。在结合至柱后,分离经标记的聚糖,并使用由乙腈和50mm甲酸铵水溶液(ph4.4)构成的二元流动相梯度来洗脱。使用荧光检测器检测经标记的聚糖,所述荧光检测器的激发波长为265nm并且发射波长为425nm。使用所得色谱图中n-聚糖峰的相对面积百分比,将n-聚糖分布报告为符合以下条件的n-聚糖的总百分比:(1)含有核心岩藻糖残基(总岩藻糖基化,表6-1),(2)含有至少一个唾液酸残基(总唾液酸化,表6-2),(3)识别为甘露糖-5(甘露糖-5,表6-3),(4)含有至少一个半乳糖残基(总半乳糖基化,表6-4)和(5)具有已知身份(总识别峰,表6-5)。[0924]结果[0925]对于cdm1-3(有或无额外组分),活细胞计数(vcc)、生存力和收获物效价的结果示于图29-31中。[0926]在这九种培养物中,包含尿苷、锰和半乳糖的cdm1培养物在12天时显示最高效价(5.5g/l)。无额外组分的cdm1在12天时与其他七种培养物相比也显示高效价(约4.25g/l)(图29)。[0927]直至处理第6天,在各种条件下的细胞生存力结果均相似。在处理第7天后,有或无额外培养基组分的cdm2和cdm3培养物均显示大于约90%生存力(图30)。[0928]具有尿苷、锰和半乳糖的cdm1培养物在第6天左右显示最高vcc(图31)。[0929]培养物和补充剂对总体n-聚糖分布有重要影响(表6-1至6-5)。使用由大豆水解物制成的经蛋白a处理的阿柏西普(评估两个样品)比较聚糖水平。表6-5中列出总识别峰。[0930]表6-1.总岩藻糖基化(%)[0931][0932]u是尿苷,m是锰,g是半乳糖,dex是地塞米松[0933]表6-2.总唾液酸化(%)[0934][0935]u是尿苷,m是锰,g是半乳糖,dex是地塞米松[0936]表6-3.甘露糖-5(%)[0937][0938][0939]u是尿苷,m是锰,g是半乳糖,dex是地塞米松[0940]表6-4.总半乳糖基化(%)[0941][0942]u是尿苷,m是锰,g是半乳糖,dex是地塞米松[0943]表6-5.总识别峰(%)[0944][0945]u是尿苷,m是锰,g是半乳糖,dex是地塞米松[0946]在各种cdm的培养物中,在第12天观察到的总岩藻糖基化、总唾液酸化、总半乳糖基化和甘露糖-5分别为42.61%至46.26%、30.84%至39.14%、59.02%至66%和8.86%至13.38%。这些糖基化值不同于使用大豆水解物获得的糖基化值。[0947]最后,对澄清收获物进行颜色测量,所述收获物是由在补充有尿苷、锰和半乳糖的cdm1、cdm2和cdm3中表达阿柏西普的细胞获得。生物反应器研究步骤的操作参数将是本领域普通技术人员所知。[0948]实施例7.抗vegf蛋白的亲和产生[0949]7.1vegfminitrap的表达[0950]将重组vegfminitrap(例如,mt5,seqidno.:46)的编码区与信号序列可操作地连接,克隆到哺乳动物表达载体中,并转染到中国仓鼠卵巢(cho-k1)细胞中;在用400μg/ml潮霉素选择12天之后分离经稳定转染的池。将在化学成分确定的不含蛋白质的培养基中生长的稳定cho细胞池用于产生蛋白质以进行测试。重组多肽从细胞分泌至生长培养基中。[0951]vegfminitrap的组成结构域序列[0952]·人类flt1(登录号np_001153392.1)[0953]·人类flk1(登录号np_002244.1)[0954]·人类fc(ighg1,登录号p01857-1)[0955]具有(mt5)的重组vegfminitrap是获自此工艺并进一步处理。[0956]7.2亲和色谱柱的制备[0957]评估能够与vegfminitrap(mt5)结合的五种不同蛋白质。所用蛋白质包括vegf165(seqidno.:72)、mab1(小鼠抗vegfr1mab人类igg1,其中seqidno.:73是重链,而seqidno.:74是轻链);mab2(小鼠抗vegfr1mab人类igg1,其中seqidno.:75是重链,而seqidno.:76是轻链);mab3(小鼠抗vegf-r1mab小鼠igg1,其中seqidno.:77是重链,而seqidno.:78是轻链)和mab4(小鼠抗vegfr1mab小鼠igg1,其中seqidno.:79是重链,而seqidno.:80是轻链)。[0958]通过用6个柱体积(cv)的1mm冰冷的盐酸以不超过1ml/min的流率洗涤柱来激活柱。将10mg每种蛋白质加载至三个hitrapnhs激活的hp亲和柱(1ml,gehealthcare,目录号17-0716-01)上,并封闭柱以允许偶联在室温下进行30分钟。用18个柱体积的0.5m乙酸钠、0.5mnaclph4.0洗涤柱,并用18个柱体积的0.5mtris-hcl、0.5mnaclph8.3封闭开放位点(按以下顺序进行洗涤:6个柱体积的0.5mtris-hcl、0.5mnaclph8.3;6个柱体积的0.5m乙酸钠(乙酸钠:jtbaker,目录号3470-01)、0.5mnaclph4.0;6个柱体积的0.5mtrisph8.3;在室温下温育柱30分钟;6个柱体积的0.5m乙酸钠缓冲液、0.5mnaclph4.0;6个柱体积的0.5mtris-hcl、0.5naclph8.3;以及6个柱体积的0.5m乙酸钠缓冲液、0.5mnaclph4.0)。将柱储存在dpbsph7.5中。所评估的五个柱分别指定为柱1(包含vegf165)、柱2(包含mab1)、柱3(包含mab2)、柱4(包含mab3)和柱5(包含mab4)。[0959]7.3使用亲和色谱产生minitrap[0960]样品制备。对minitrap执行两种不同产生工艺。在一种情况下,使用每个亲和柱产生包含minitrap样品的材料,其中将母体材料(minitrap)在1xdpbs缓冲液中稀释至20mg/ml并将其施加于柱上,并在室温下温育30分钟。使用亲和柱,从~7000ppm的hcp中分离minitrap。[0961]或者,使用在上清液中包含0.4mg/ml蛋白质的收获的培养物上清液,并且单独加载至不同亲和柱(1-5)上。不再进行稀释。接着将亲和柱用9cv的1xdpbs缓冲液洗涤,接着用igg洗脱缓冲液ph2.8(thermo,目录号21009)洗脱。[0962]然后,将如上所述获得的minitrap材料经由0.45μm过滤器过滤或离心,之后加载至如以上部分7.2中所述制备的柱上。将25ml包含约0.4mg/ml蛋白质的加载溶液加载至每个柱上并温育20分钟。用9cv的dpbs(invitrogen,目录号14190-144)洗涤每个柱,之后洗脱以进行平衡。洗涤级分中的mt5的量示于表7-1中。洗涤后使用6cv的ph2.8(商用洗脱缓冲液(thermo,目录号21009))和100mm甘氨酸缓冲液ph2.5来洗脱,并通过添加1mtrisph7.5(invitrogen,目录号15567-027)迅速中和各级分。洗脱级分中的minitrap的量也示于表7-1中。[0963]从所有五个亲和柱成功产生minitrap(mt5)。与mab1和mab2柱相比,使用vegf165的柱的产率更高。包含人源化抗vegfr1mab的mab3和mab4也显示mt5的成功产生,其产率与mab1和mab2相似。在表7-1中,基于100%缀合效率和亲和捕获蛋白与mt5的1:1摩尔比来计算预期产率。[0964]表7-1.[0965][0966]7.4柱稳定性研究[0967]按照部分7.3中论述的方法,使用柱1和2进行多次运行(针对柱1的表7-2和针对柱2的表7-3)。[0968]表7-2[0969][0970]表7-3[0971][0972]将柱在4℃下储存约5周。从每次产生中洗脱出相似量的mt5,表明柱具有良好稳定性。[0973]7.5所产生的vegfminitrap的稳定性研究[0974]对来自三个柱(柱1、柱2和柱3)的洗脱级分执行sds-page分析。在非还原和还原sds-page样品缓冲液中制备样品,并使用1xmes(目录号np0322,invitrogen,carlsbad,ca)在4-12%梯度的nupagebis-tris凝胶上运行。[0975]向孔中加载:(1)分子量标准物,(2)加载溶液,(3)来自柱1的柱洗涤液,(4)来自柱2的洗脱级分,(5)来自柱1的洗脱级分,(6)来自柱3的洗脱级分,(7)在ph2.8下储存1分钟的mt5,(8)在ph2.8下储存30分钟的mt5,以及(9)分子量标准物(图33和图34)。分析表明,从所有三个亲和柱(柱1-3)的洗脱级分中获得的级分显示出相似的尺寸分布,并且亲和柱的使用不会使minitrap不稳定。[0976]7.6宿主细胞蛋白水平的计算[0977]使用chohcpelisa试剂盒,3g(f550)(cygustechnologies)获得宿主细胞蛋白浓度的标准曲线(图32和表7-4)。使用如图32所示的标准曲线和表7-4中列出的曲线公式计算加载溶液和洗脱级分中的hcp的量。[0978]表7-4.[0979][0980]使用标准曲线计算总hcp,并且具有宿主细胞蛋白的总量的图表在图35a中示出。图35b也显示与来自柱1、2、4和5的洗涤液和洗脱级分相比,加载液中的宿主细胞蛋白的总量。使用柱进行多次运行并且图35b中的(#)表示评估级分的运行。[0981]使用能够结合至minitrap的蛋白质进行的亲和捕获显示hcp从约7000ppm有效降至约25-50ppm。如针对产率所观察到的,具有vegf165的柱显示来自hcp的minitrap纯度高于mab1和mab2柱所示的。[0982]7.7在亲和产生之前和之后的vegfminitrap的sec谱图[0983]将来自三个柱(柱1-3)的洗脱级分的sec谱图与加载溶液中minitrap的sec谱图相比较。如图36和表7-5中所见,在亲和产生之前或之后的mt5的sec谱图高度相似。[0984]表7-5.[0985][0986][0987]7.8vegfminitrap柱前和柱后样品与mab1、mab2和vegf165结合的动力学[0988]使用biacoret200仪器进行动力学研究。[0989]使用biacoret200仪器,使用实时表面等离子体共振生物传感器测定vegf165与来自柱1和2的洗脱液和加载溶液中的minitrap结合的平衡解离常数(kd值)。所有结合研究均在25℃下在10mmhepes、150mmnacl、3mmedta和0.05%v/v表面活性剂tween-20ph7.4(hbs-et)运行缓冲液中进行。首先通过与mab1偶联的胺衍生化biacore传感器表面,以捕获mt5。结合研究的草图表示在图37中示出。[0990]简而言之,将来自柱的洗脱液和加载溶液稀释至hbs-ep(biacore)缓冲液中,并以~70ru的捕获水平跨固定化蛋白质基质注入。接着以50μl/min的流率注入vegf165。将等价浓度的分析物同时注入未经处理的参考表面上,以充当空白传感图,用于减去总体折射率背景。在各周期之间,经由以25μl/min两次5-min注入10mm甘氨酸来使传感器芯片表面再生。接着使用bia评估4.0.1软件评估所得的实验结合传感图,以确定动力学速率参数。将每个样品的数据集拟合至1:1朗缪尔模型(langmuirmodel)。对于这些研究,在globalfitanalysis方案下分析结合和解离数据,同时选择局部拟合最大分析物结合能力(ru)或rmax属性。在这种情况下,软件计算单个解离常数(kd)、缔合常数(ka)和亲和常数(kd)。平衡解离常数是kd=kd/ka。通过使用在0.03-2nm范围内的不同vegf165浓度来确定动力学结合速率、动力学解离速率和总亲和力(表7-6)。根据动力学速率常数将解离半衰期(t1/2)计算为:t1/2=ln(2)/60*kd。表7-6中显示在25℃下亲和色谱生产之前和之后获得的mt5与vegf165的结合动力学参数。[0991]将由亲和色谱产生的mt5的亲和力(kd)、结合速率(ka,m-1s-1)和解离速率(kd)与加载溶液比较,以评价亲和色谱步骤的效果,显示来自不同样品的mt5的动力学没有变化。vegfminitrap构建体的spr传感图示于图38中。[0992]表7-6.[0993][0994]7.9多个生产周期[0995]如7.3所示,使用柱1(hvegf165)和柱2(mab1)进行如通过步骤7.1所得的收获物的色谱产生。将柱用于多个色谱周期。柱中的产率没有由于进行额外的运行而显著变化,表明柱保留结合能力(表7-7)。[0996]表7-7.[0997][0998]使用7.4中所述的方法获得柱1和2的加载溶液、洗涤级分和洗脱级分中的hcp计算(图39)。所计算的总hcp显示,重复使用柱不会降低柱与minitrap结合的能力。[0999]7.10优化亲和色谱柱[1000]使用柱1(vegf165)和柱2(mab1)进行如部分7.1中获得的收获物材料的色谱产生。为了进行优化研究,将14mg或45mg而非10mg的vegf165或抗vegf-r1mab加载至两个hitrapnhs激活的hp亲和柱(1ml,gehealthcare)上,并封闭柱以允许偶联在室温下进行30分钟。minitrap(mt5)的编码区与信号序列可操作地连接并克隆到哺乳动物表达载体中,转染到中国仓鼠卵巢(cho-k1)细胞中,并在用400μg/ml潮霉素选择12天后分离经稳定转染的池。将在cdm中生长的稳定cho细胞池用于产生蛋白质以进行分析。[1014]8.1糖蛋白的去糖基化[1015]将来自mt1、mt2和mt3的经澄清收获物的样品在1%(w/v)rg表面活性剂(rapigestsf,waters,milford,ma)和50mmhepes(ph7.9)的28.8μl溶液中稀释或重构至0.52mg/ml的浓度。将这些溶液经2分钟加热至大约95℃,允许冷却至50℃,并与1.2μl的pngasef溶液(glycoworksrapidpngasef,waters,milford,ma)混合。通过将样品在50℃下温育5分钟来完成去糖基化。[1016]8.2hilic-荧光-esi-ms(ms/ms)分析。[1017]经由hilic分离组合荧光和质谱检测对mt1进行分析。仅使用hilic分析mt2和mt3。使用配备有光电二极管阵列和荧光(flr)检测器并与waterssynaptg2-s质谱仪(ms条件)连接的waters2dacquityuplc进行色谱法。将亲水相互作用色谱(hilic)分离模式与150×2.1mm,1.7μm的watersuplcglycanbehamide柱一起使用。柱温度设定为60℃,而自动进样器温度设定为5℃。注入体积是50μl。光电二极管阵列的扫描范围为190–700nm。flr设定为:对于rapifluor标记的聚糖来说,激发265nm,发射425nm;而对于糖肽中存在的酪氨酸来说,激发274nm和发射303nm。初始流率为0.4ml/min,其中流动相a包含100mm甲酸铵(ph4.4),而流动相b为乙腈。[1018]8.3ms条件[1019]液相色谱/质谱(lc/ms)实验是使用waterssynaptg2-s质谱仪进行的。针对正离子模式和负离子模式分析,扫描范围为质荷比100-2400。扫描时间是1s,并且恒定输注(2μl/min)glu-血纤维肽b作为校准物(“锁定质量(lockmass)”)。毛细管电压设定为2.5kv,其中源温度为120℃并且去溶剂化温度为500℃。氮气喷雾器气体流量设定为700l/h。[1020]8.4天然sec-ms[1021]将acquityuplci类系统(waters,milford,ma)与qexactivehf混合四极杆orbitrap质谱仪(thermoscientific,bremen,germany)耦合,以用于所有随线sec-ms分析。将acquityuplcproteinbehsec柱(1.7μm,4.6×300mm)设定在30℃,并用于蛋白质分离。流动相是ph6.8的100mm乙酸铵。每次分离为30分钟,其中流率为0.3ml/min,并且注入量设定为40μg。以下ms参数用于随线sec-nano-esi-ms数据采集。每次获取为25分钟,在样品注入后立即开始。将去糖基化样品在3kv喷雾电压、200℃毛细管温度和70s镜头rf位准下以正模式电离。源内(in-source)cid设定为75ev。以15k解析力获取全ms扫描,质量范围介于m/z2000-8000之间。将100ms的最大注入时间、3e6的自动增益控制目标值和10次微扫描用于全ms扫描。[1022]8.5肽作图[1023]用于肽作图的样品制备。通过添加500mmol/l二硫苏糖醇(dtt)至5mmol/l的最终浓度,接着在4℃下温育60分钟来实现还原。通过添加500mmol/l碘乙酰胺(iam)至10mmol/l的最终浓度并在黑暗中于4℃下温育60分钟来进行烷化。根据制造商的说明,使用zebatmspin7kmwco尺寸排阻脱盐柱(p/n89882)(thermoscientific,waltham,ma)将变性缓冲液更换为消化缓冲液(1mol/l尿素,在0.1mol/ltrisph7.8中)。将重组猪胰蛋白酶(购自sigma,目录号03708985001)以1:18(酶:样品)质量比(基于vegfminitrap蛋白浓度,如在缓冲液交换后通过uv-vis分光光度法所测量)添加,将vegfminitrap蛋白的浓度调节至0.5μg/μl并允许在室温下温育4小时期间进行消化。消化完成时,以1:1体积比添加在lc-ms级水中的0.1%甲酸。将消化物在-80℃下储存直至分析。[1024]胰蛋白酶消化物的lc-ms/ms分析。经由自动进样器将一份或多份2.5μg(10μl)的肽消化物加载至封闭在设定为40℃的恒温柱烘箱中的c18柱上。样品在排队注入时保持在7℃。色谱方法是以98%流动相a(于水中0.1%体积分数的甲酸)和2%流动相b(于乙腈中0.1%体积分数的甲酸)开始,其中流率设定在恒定为0.200ml/min。洗涤10分钟后,将肽在110分钟的梯度上洗脱,其中流动相b含量以每分钟0.39%的速率升高,以达到包含45%流动相b的最终组成。在下一次样品注入之前,将柱用97%流动相b洗涤15分钟,接着在98%流动相a中平衡25分钟。在运行之前1.5分钟和最后5分钟将洗脱液转移至废液。通过在214nm下的uv吸收,接着在ltqorbitrapelite或discoveryxl上的质谱法,分析从色谱柱洗脱的肽。收集ps8670和rm8671样品的复制肽作图数据,以便各自包括三个串联ms(ms/ms)分析和一个仅有ms的分析。ms/ms分析是以数据依赖性模式进行以用于肽识别,其中一个实验周期由以下组成:300m/z至2000m/z的一次全ms扫描,接着五个顺序ms/ms事件,它们是在启动所述周期的ms扫描中以500的最小阈值计数检测到的第一至第五个最强离子上进行。顺序质谱法(msn)agc目标设定为1e4,其中微扫描=3。在质心模式下以正常扫描速率使用离子阱来分析ms/ms片段。使用高分辨率ftms分析仪(r=30,000)以轮廓图模式收集全ms扫描,其中全扫描agc目标是1e6并且微扫描=1。选择离子以便使用2da的隔离宽度进行ms/ms,接着使用35的归一化cid能量、0.25的激活q值和10毫秒的激活时间,通过与氦气的碰撞诱导解离(cid)进行片段化。默认电荷状态设定在z=2。如果前体离子在30s内两次触发事件,则将数据依赖性质量放置在排除清单中持续45s;排除质量宽度设定在±1da。对未经分配的电荷状态启用电荷状态拒绝。拒绝质量清单包括在以下各处的常见污染物:122.08m/z、185.94m/z、355.00m/z、371.00m/z、391.00m/z、413.30m/z、803.10m/z、1222.10m/z、1322.10m/z、1422.10m/z、1522.10m/z、1622.10m/z、1722.10m/z、1822.10m/z和1922.10m/z。进行仅有ms的分析以生成tic非还原肽图和还原图。[1025]8.6结果[1026]vegfminitrap构建体的结构。vegfminitrapmt1、mt5和mt6的结构描绘于图40、图41、图43和图44中。[1027]使用sec-ms进行的初始质量分析证实去糖基化之后在完整蛋白质水平上所有三个分子的身份(图42)。天然sec-ms分析的总离子色谱图(tic)证明在约12-13分钟时检测到完整的vegfminitrap分子。tic的低分子量(lmw)区域的扩展显示在所有三个蛋白质样品中均存在lmw杂质。[1028]vegfminitrap的去卷积质谱进一步证实它们的身份,并提供数据来阐明主要ptm存在于包含mt1和mt5(图43)(其为二聚体)和mt6(图44)(其为单链蛋白)的样品中。[1029]mt1样品的分析。提取由包含mt1的样品的sec-ms分析的tic中识别的lmw种类,以检查三种不同的lmw杂质—lmw1、lmw2和lmw3(图45a和图45b)。lmw1种类包含阿柏西普的经截短的种类。lmw2种类包含样品中存在的fc杂质,此类杂质是通过阿柏西普的切割产生,进行所述切割以产生minitrap。lmw3种类包含可能从mt1(二聚体)分子上切割的单体。[1030]mt1样品未显示fabricator酶的存在,所述酶已用于切割阿柏西普以形成minitrap蛋白。所述酶如果存在,则在约11.5和12.5分钟时检测到。在mt1样品的sec-ms分析期间未检测到所述峰(图46)。[1031]mt5样品的分析。提取由包含mt5的样品的sec-ms分析的tic中识别的lmw种类,以检查两种不同的lmw杂质—lmw1和lmw2的存在(图47)。[1032]mt6样品的分析。提取由包含mt1的样品的sec-ms分析的tic中识别的lmw种类,以检查三种不同的lmw杂质—lmw1、lmw2和lmw3的存在(图48)。lmw2种类包含mt6的片段,其中切割产生带有g4s接头的vegfminitrap的片段。lmw5种类包含mt6的片段,其中切割发生在g4s接头之前或之后。[1033]mt6样品中的聚糖是在hilic色谱法中使用由waters和nationalinstituteforbioprocessingresearchandtraining(dublin,ireland)率先提出的葡萄糖单位值通过其质量和洗脱顺序来识别(图49a和图49b)。[1034]游离硫醇定量。vegfminitrap构建体的半胱氨酸残基可参与分子内和分子间二硫键的形成,或者它们可以游离硫醇形式存在。肽和蛋白质中硫键的存在已显示会对蛋白质施加构象刚性。硫醇可通过多种试剂和分离技术来检测。针对三种vegfminitrap构建体的极低水平的游离硫醇的分析示于表8-1中。[1035]表8-1.[1036]位置肽(游离半胱氨酸的位点)mt1mt5mt6vegf-r1elvipcr(seqidno.:81)《0.1%《0.1%《0.1%vegf-r2lvlnctar(seqidno.:82)0.3%0.3%0.3%fc铰链thtcppcpapellg(seqidno.:83)0.0%0.0%n/a[1037]三硫化物定量。与vegfminitrap构建体的cys残基中的游离硫醇相似,三硫键可影响蛋白质的结构。在具有极低游离硫醇水平的条件下三种vegfminitrap构建体的分析示于表8-2中。[1038]表8-2.[1039][1040]铰链区中的链内二硫键。铰链区中的错配二硫键可对vegfminitrap构建体的结构、功能和稳定性产生影响。对三种vegfminitrap构建体关于在vegfminitrap构建体[thtc*ppc*papellg,c*展示可形成链内二硫键的位置]的铰链区中的极低或不存在的链内二硫键进行的分析示于表8-3中。[1041]表8-3.[1042]肽mt1mt5mt6二硫化物《0.1%《0.1%n/a三硫化物《0.1%《0.1%n/a[1043]交叉和平行二硫键联异构体的定量。对于mt1和mt5(它们是由铰链区中的平行二硫键连接的二聚体),存在异构体的可能性,其中铰链区中的二硫键可交叉(图50)。[1044]二硫键类型(平行对比交叉)的定量显示,与作为fabricator消化的分子的mt1相比,mt2重组表达的蛋白在fc铰链区中具有稍微较高水平的交叉二硫桥(表8-4)。[1045]表8-4.[1046]二硫化物mt1mt5mt6交叉0.2%3.9%n/a平行99.8%96.1%n/a[1047]翻译后修饰(ptm)。[1048]表8-5.[1049][1050]聚糖宏观异质性(糖基化位点占用率)和微观异质性(位点特异性聚糖结构))对于理解糖蛋白的生物合成和功能很重要。糖基化程度可根据蛋白质的表达方式而变化。对于所有三种vegfminitrap,在n36处的糖基化水平是相似的(表8-8和图51)。类似地,对于所有三种vegfminitrap,在n68处的糖基化水平也是相似的(表8-8和图52)。对于所有三种vegfminitrap,在n123处的糖基化水平也是相似的(表8-8和图53),但在mt1制剂中发现甘露糖-5升高。对于vegfminitrap构建体,与mt1相比,mt5和mt6在asn196处的糖基化程度较低(表8-8和图54)。另外,与mt4和mt6制剂相比,mt1制剂中的甘露糖-5也是升高的。[1060]表8-8.[1061]位点肽mt1mt5mt6n36(r)vtspnitvtlk(seqidno.:100)98.3%98.1%99.4%n68(k)gfiisnatyk(seqidno.:101)51.9%55.4%64.9%n123(k)lvlnctar(seqidno.:102)99.9%99.4%98.4%n196(k)nstfvr(seqidno.:103)98.6%44.5%55.1%[1062]n-聚糖的分析。n36处的糖基化示于表8-9中。g2f、g2fs、g2fs2是在所有三种vegfminitrap中存在的主要n-聚糖。对于表8-10中所示的n68处的糖基化,g2f和g2fs是在所有三种vegfminitrap中存在的主要n-聚糖。对于表8-11中的n123处的糖基化,g2f和g2s是在所有三种vegfminitrap中存在的主要n-聚糖,并且与mt5和mt6相比,在mt1中检测到高水平的甘露糖-5。对于表8-12中所示的n196处的糖基化,g2、g2s、g2s2是在所有三种vegfminitrap中存在的主要n-聚糖,并且与mt5和mt6相比,在mt1中检测到高水平的甘露糖-5。[1063]表8-9.[1064]n36处的聚糖mt1mt5mt6g0f-glcnac2.0%1.8%1.8%g1f3.2%1.0%1.4%g1f-glcnac4.8%4.6%4.9%g1fs-glcnac3.1%3.8%3.1%g2f17.4%15.1%19.8%g2f2s1.7%2.0%2.2%g2fs34.2%31.5%31.9%g2fs220.4%25.8%19.0%g3fs2.3%4.0%5.5%g3fs22.6%4.7%5.0%g3fs31.1%2.4%1.9%g1_man5 phos1.2%0.3%0.2%man6 phos5.7%2.5%2.8%[1065]表8-10.[1066]n68处的聚糖mt1mt5mt6g0f-glcnac1.2%1.1%1.1%g1f5.1%1.4%1.7%g1f-glcnac3.9%3.9%4.0%g1fs1.2%0.4%0.4%g1fs1-glcnac1.2%1.6%1.4%g2f27.4%23.6%28.6%g2f2s2.2%3.0%3.4%g2fs52.4%55.2%50.2%g2fs23.9%6.9%5.8%g3fs0.5%1.2%1.6%g3fs20.4%1.1%1.2%[1067]表8-11.[1068]n123处的聚糖mt1mt5mt6g0-glcnac3.5%3.7%3.5%g1-glcnac6.2%6.8%6.4%g1s-glcnac4.1%3.5%2.8%g210.6%16.7%17.1%g2f1.5%7.2%7.0%g2fs2.1%13.6%14.2%g2s12.7%26.1%25.5%g2s21.3%5.0%6.6%g1_man43.8%1.3%1.4%g1s_man43.9%2.1%1.8%g1_man54.0%1.2%1.1%g1s_man53.2%1.4%1.4%man42.6%1.9%1.8%man535.5%4.3%3.1%man61.1%0.1%0.1%man72.8%0.1%0.1%[1069]表8-12.[1070][1071][1072]mt3的接头处的o-聚糖。评估mt3的gs接头以研究mt3上的o-聚糖。发现o-木糖基化位于mt3(ggggsggggsggggsggggsggggsggggssdtgrpfvemyseipeiihmtegr,加下划线的丝氨酸残基被糖基化)的gs接头上的丝氨酸残基上。o-聚糖的组成示于表8-13中。[1073]表8-13.[1074][1075]hilic-flr-ms分析。如部分8.2中所述,对所有vegfminitrap蛋白进行hilic-flr-ms分析。分析表明,mt5和mt6的n-连接聚糖相似,但与针对mt1所获得的n-连接聚糖不同(图55显示全标度和叠加式色谱图,图56显示全标度和重叠式色谱图,并且图57显示全标度、叠加式和归一化色谱图)。[1076]最后,表8-14和图58a-c中分别列出所有三种vegfminitrap蛋白的糖基化百分比以及详细的聚糖识别和定量。如在所有聚糖分析中所观察到的,mt5与mt6的糖基化谱和甘露糖水平相似,但与mt1不同。[1077]表8-14.[1078]mt1mt2mt3岩藻糖基化%42.9%57.8%57.2%半乳糖基化%71.6%92.9%93.7%唾液酸化%33.1%47.6%44.8%高甘露糖%17.6%2.6%2.3%平分%(%bisecting)1.9%0.4%0.4%[1079]实施例9.使用上游培养基的生产和颜色定量以及进料工艺优化[1080](a)未优化的cdm(对照生物反应器)[1081]使用实施例5中所述的minitrap的制造。[1082]研究步骤的操作参数是本领域普通技术人员已知的。[1083]第0天的培养基=cdm1,并且包括以下营养素、抗氧化剂和金属:[1084]·以8-9mm的累积浓度添加半胱氨酸[1085]·下面以1x浓度(其中浓度是在接种物添加之前)列出起始培养基中的金属:[1086]οfe=每升培养物68-83微摩尔[1087]οzn=每升培养物6-7微摩尔[1088]οcu=每升培养物0.1-0.2微摩尔[1089]οni=每升培养物0.5-1微摩尔[1090]在收获mt1时,遵循如图59中所示的生产程序。色谱的操作参数是本领域普通技术人员已知的。用于亲和捕获(图59的步骤3)、亲和流通(图59的步骤5)、aex(图59的步骤8)和hic(图59的步骤9)的操作参数概述于表9-1中。在亲和捕获和过滤步骤之后,使用实施例1.2中概述的程序进行阿伯西普的蛋白水解切割。[1091]表9-1.[1092][1093]表9-2显示在进行各种色谱步骤时获得的池的颜色定量。使用来自蛋白质浓度为5g/l的池的样品进行颜色定量。[1094]亲和捕获池是指在进行亲和捕获步骤(图59的步骤3)时收集的洗脱液。酶池是指在进行酶切割步骤(图59的步骤4)时收集的流通液。亲和流通池是指在进行亲和流通步骤(图59的步骤5)时收集的流通液,而亲和流通洗脱液是指在进行亲和流通步骤(图59的步骤5)时收集的洗脱液。aex池和aex汽提液是指在进行阴离子交换色谱步骤(图59的步骤8)时获得的流通和汽提级分。hic池是指在进行疏水相互作用色谱步骤(图59的步骤9)时收集的流通液。[1095]如表9-2中所见的每个步骤均显示着色减少(如由池的b*值减小所观察到)。例如,在进行亲和流通色谱时,流通级分具有2.16的b*值(与从亲和捕获步骤收集的流通液的2.52的b*值相比减小)。aex分离后的流通液和洗涤液进一步减少着色,如通过b*值从2.16降至0.74所观察到。如所预期的,汽提aex柱产生带有黄棕色的样品,所述颜色比来自aex分离后的流通液和洗涤液的着色显著更强烈,如由b*值可见(8.10对比0.74)。最后,hic步骤进一步提供着色减少(b*值可针对5g/l蛋白质浓度进行归一化,所述b*值来自在28.5g/l蛋白质浓度下的hic池所获得的b*值)。[1096]表9-2.各个生产步骤处的样品的颜色定量[1097]样品浓度(g/l)l*a*b*亲和捕获池5.0±0.198.75-0.122.52酶切割池5.0±0.199.03-0.071.61亲和流通池5.0±0.198.95-0.082.16亲和流通洗脱液5.0±0.198.92-0.010.83aex池5.0±0.199.72-0.030.74aex2mnacl汽提液5.0±0.196.25-0.428.10hic池28.598.78-0.283.11[1098](b)优化的cdm(低半胱氨酸、低金属和增加的抗氧化剂生物反应器)[1099]使用以下方案评估降低的半胱氨酸浓度、降低的金属浓度和增加的抗氧化剂对着色的影响:[1100]第0天的培养基=cdm1[1101]ο以5-6mm的累积浓度添加半胱氨酸[1102]·将抗氧化剂添加至cdm1中,以达到以下累积浓度(其中浓度是接种物添加之前的浓度):[1103]ο牛磺酸=10mm的培养物[1104]ο甘氨酸=10mm的培养物[1105]ο硫辛酸=0.0024mm的培养物[1106]ο维生素c(抗坏血酸)=0.028mm的培养物[1107]·下面以1x水平列出起始培养基中的金属。[1108]οfe=每升培养物68-83微摩尔[1109]οzn=每升培养物6-7微摩尔[1110]οcu=每升培养物0.1-0.2微摩尔[1111]οni=每升培养物0.5-1微摩尔。[1112]ο所有金属的减少,包括使用0.25x上文针对培养基所示的浓度。[1113]在收获mt1样品时,遵循如图59中所示的生产程序。色谱的操作参数是本领域普通技术人员已知的。表9-1中概述用于亲和捕获、亲和流通和hic的操作参数。在亲和捕获和过滤步骤之后,使用实施例1.2中概述的程序进行阿伯西普的蛋白水解切割。[1114]表9-3显示在进行各种色谱步骤时获得的池的颜色定量。使用来自蛋白质浓度为5g/l的池的样品进行颜色定量。如表9-3中所示的步骤提供与表9-2中的步骤所见类似的生产。[1115]表9-3.minitrap的各个生产步骤处的样品的颜色定量[1116]样品浓度(g/l)l*a*b*亲和捕获池5.0±0.199.18-0.091.77酶切割池5.0±0.199.44-0.061.17亲和流通池5.0±0.199.32-0.101.58亲和流通洗脱液5.0±0.199.74-0.050.60aex池5.0±0.199.63-0.070.50aex2mnacl汽提液5.0±0.197.63-0.496.10hic池27.699.07-0.292.32[1117]比较表9-2与表9-3,很明显,与“对照生物反应器条件”(b*值为2.52)相比,“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”在亲和捕获池中具有较低的颜色(b*值为1.77)。[1118]预计浓度为160g/l的mt样品(使用表9-2和表9-3中列出的步骤形成mt)对于“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”具有13.45的b*值并且对于“对照生物反应器条件”具有17.45的b*值。经由优化上游培养基和进料,达到23%颜色减少。类似地,预计浓度为110g/l的mt样品(使用表9-2和表9-3中列出的步骤形成mt)对于“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”具有9.25的b*值并且对于“对照生物反应器条件”具有12的b*值。[1119]为了理解每个生产单元操作如何有助于减少颜色,将每个生产工艺中间体的b*值计算为亲和捕获池的颜色百分比(表9-4)。[1120]表9-4.[1121][1122][1123]aex单元操作提供最多的颜色减少(b*值变化从1.08至1.42),而hic单元操作提供一些额外的颜色减少(b*值变化从0.08至0.19)。所评估的单元操作总体上去除亲和捕获池中存在的76.3%–78.2%的颜色。[1124]还关于以下指标对“对照生物反应器条件”以及“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”的各种生产工艺中间体的颜色进行研究:通过蛋白酶消化产生的寡肽中的2-氧代-组氨酸的百分比和氧代-色氨酸的百分比,如通过质谱法所测量,如表9-5和表9-6中分别所示。如实施例3中所论述进行肽作图。[1125]参看表9-5,在比较不同生产步骤中池中的组氨酸氧化水平时,很明显,随着生产过程的进展,池中形成的mt的组氨酸氧化水平百分比的相对丰度降低。例如,对于“对照生物反应器条件”下的h209,组氨酸氧化水平的百分比对于酶切割池为0.062,并且对于aex流通液,其降至0.029,并且对于hic池,进一步降至0.020。类似地,对于“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”下的h209,组氨酸氧化水平的百分比对于酶切割池为0.039,并且对于aex流通液,其降至0.023,并且对于hic池,进一步降至0.016。因此,生产策略导致mt中组氨酸氧化水平的百分比的降低。随着着色的减少,样品中一些氧化残基的存在也减少。与组氨酸氧化相似,在“对照生物反应器条件”以及“低半胱氨酸、低金属和增加的抗氧化剂的生物反应器条件”下的不同生产步骤中,也对池的色氨酸氧化水平进行追踪(表9-6)。[1126]表9-5[1127][1128]表9-6.[1129][1130][1131]列举的实施例[1132]下文提供的示例性列举实施例不旨在限制,而应理解,基于如本领域技术人员所了解的本文中的描述,使用cdm和修改条件以减少或增加蛋白质变体和黄棕色来产生抗vegf组合物(包括阿柏西普和vegfminitrap)的另外的变化方案可按照本文中的描述实施。[1133]1.一种包含氧代-mintrap的组合物,其中minitrap的一个或多个氨基酸残基被氧化。[1134]2.如权利要求1所述的组合物,其中所述一个或多个氨基酸残基是组氨酸和/或色氨酸。[1135]3.如权利要求1所述的组合物,其中所述氧代-minitrap经酶消化,产生一种或多种寡肽,并且其中所述一种或多种寡肽选自由以下组成的组:seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.29、seqidno.30、seqidno.31、seqidno.32及其组合。[1136]4.如权利要求3所述的组合物,其中所述酶消化是使用胰蛋白酶进行的。[1137]5.一种产生minitrap的氧化种类的方法,所述方法包括使具有minitrap的样品经受约24万lux*hr至约240万lux*hr的冷白光。[1138]6.一种产生minitrap的氧化种类的方法,所述方法包括:[1139]a.使包含minitrap的样品经受约24万lux*hr至约240万lux*hr的冷白光;以及[1140]b.进行(a)的消化,形成寡肽,其中所述寡肽包含下列寡肽中的一者或多者:[1141]dkth*tc*ppc*papellg(seqidno.:17)、eiglltc*eatvngh*lyk(seqidno.:18)、qtntiidvvlspsh*gielsvgek(seqidno.:19)、telnvgidfnweypsskh*qhk(seqidno.:20)、tnylth*r(seqidno.:21)、sdtgrpfvemyseipeiih*mtegr(seqidno.:22)、vh*ekdk(seqidno.:23)、sdtgrpfvem*yseipeiihmtegr(seqidno.:64)、sdtgrpfvemyseipeiihm*tegr(seqidno.:65)、tqsgsem*k(seqidno.:66)、sdqglytc*aassglm*tk(seqidno.:67)、iiw*dsr/riiw*dsr/iiw*dsrk(seqidno.:28)、telnvgidfnw*eypssk(seqidno.:29)、gfiisnaty*k(seqidno.:69)、kf*pldtlipdgk(seqidno.:70)f*lstltidgvtr(seqidno.:32),其中h*是被氧化为2-氧代-组氨酸的组氨酸,其中c*是被羧甲基化的半胱氨酸,其中m*是被氧化的甲硫氨酸,其中w*是被氧化的色氨酸,其中y*是被氧化的酪氨酸,并且其中f*是被氧化的苯丙氨酸。[1142]7.如权利要求6所述的方法,其中在冷白光暴露后,minitrap的氧化种类的量与未经处理的minitrap相比增加约1.5至约50倍。[1143]8.如权利要求6所述的方法,其中所述消化是使用胰蛋白酶进行的。[1144]9.如权利要求6所述的方法,其中所述寡肽是使用质谱法分析的。[1145]10.如权利要求6所述的方法,其中所述冷白光具有约8klux的强度。[1146]11.如权利要求5或6所述的方法,其中所述minitrap经受约24万lux*hr的冷白光,并且其中所述minitrap的氧化种类的量与未经处理的minitrap相比增加约1.5至约10倍。[1147]12.如权利要求5或6所述的方法,其中所述minitrap经受约96万lux*hr的冷白光,并且其中所述minitrap的氧化种类的量与未经处理的minitrap相比增加约1.5至约20倍。[1148]13.如权利要求5或6所述的方法,其中所述minitrap经受约120万lux*hr的冷白光,并且其中所述minitrap的氧化种类的量与未经处理的minitrap相比增加约1.5至约20倍。[1149]14.如权利要求5或6所述的方法,其中所述minitrap经受约240万lux*hr的冷白光,其中所述minitrap的氧化种类的量与未经处理的minitrap相比增加约1.5至约50倍。[1150]15.一种产生minitrap的氧化种类的方法,所述方法包括:[1151]a.在化学成分确定的培养基(cdm)中培养经基因工程化以表达阿柏西普的细胞;[1152]b.将来自所述澄清收获物的阿柏西普结合至蛋白a树脂;[1153]c.洗脱步骤(b)的所述阿柏西普并使所述阿柏西普经历酶切割以去除其fc结构域,从而形成具有第一量的minitrap的氧化种类的minitrap;[1154]d.使来自步骤(c)的minitrap经历第二捕获色谱,其中使所述第二捕获色谱步骤经历一次或多次洗涤,并且其中第一流通级分包含minitrap;[1155]e.使步骤(d)的所述第一流通液经历阴离子交换色谱(aex);以及[1156]f.洗涤来自步骤(e)的所述aex柱并收集第二流通液;以及[1157]g.使用汽提缓冲液汽提步骤(f)的aex柱,其中在所述aex柱的所述汽提之后的所述流通液中的所述minitrap包含第二量的氧化minitrap。[1158]16.如权利要求15所述的方法,其中所述汽提缓冲液选自包括2m氯化钠(nacl)、1n氢氧化钠(naoh)或其组合的组。[1159]17.如权利要求15所述的方法,所述方法使来自步骤(c)的所述minitrap进一步经受约24万lux*hr至约240万lux*hr的冷白光,并且其中所述minitrap的氧化种类的量增加约1.5至约50倍。[1160]18.如权利要求15所述的方法,所述方法使来自步骤(c)的所述洗脱的minitrap进一步经受约96万lux*hr的冷白光,并且其中所述minitrap的氧化种类的第二量增加约1.5至约20倍。[1161]19.如权利要求15所述的方法,所述方法使来自步骤(c)的所述洗脱的minitrap进一步经受约120万lux*hr的冷白光,并且其中所述minitrap的氧化种类的第二量增加约1.5至约20倍。[1162]20.如权利要求15所述的方法,所述方法使来自步骤(c)的所述洗脱的minitrap进一步经受约240万lux*hr的冷白光,并且其中所述minitrap的氧化种类的第二量增加约1.5至约50倍。当前第1页12当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。