1.本发明涉及一种包括用于检测靶基因变异的制剂的用于诊断神经胶质瘤(glioma)或预测预后的组合物、生物标志物组合和试剂盒、提供与神经胶质瘤的诊断或预测预后有关信息的方法以及用于神经胶质瘤的个性化医疗的生物标志物组合和提供用于个性化治疗的信息的方法。
背景技术:
2.另一方面,肿瘤(tumor)是由于异常细胞过多而导致细胞不受控制、无序增殖的产物,当这些肿瘤具有破坏性的增殖性、侵袭性和转移性时,就被归类为恶性肿瘤(malignant tumor)。尤其,从分子生物学的角度来看,其可以说是一种基因变异引起的基因疾病。
3.其中,神经胶质瘤(glioma)起源于神经元和神经胶质细胞,大部分渗透到周围正常组织并生长,由于细胞生长失控而呈现快速生长,并且难以通过手术完全去除。尤其,神经胶质瘤在组织学和分子学上分为几种分类,但为了准确诊断这一点,到目前为止,正在确认idh1/2的体细胞突变、egfr的基因组扩增以及染色体1p和19q臂的共缺失。然而,idh1/2突变通常主要在低级别神经胶质瘤和继发性胶质母细胞瘤中发现,众所周知,其与患者的长期生存密切相关。另外,约50%的胶质母细胞瘤中发现了egfr的局部扩增。另外,由于已知egfr基因扩增可以促进细胞增殖,因此为了治疗癌症,经常进行egfr抑制剂的临床试验。
4.因此,为了有效诊断神经胶质瘤,免疫组化法(immunohistochemistry:ihc)和荧光原位杂交法(fluorescence in situ hybridization:fish)常用于被认为所述神经胶质瘤增殖的重要基因的idh1靶向突变与egfr局部扩增的病理诊断,但以更方便的方式有效诊断所述神经胶质瘤的需求日益增长。
技术实现要素:
5.技术问题
6.本发明的一方面涉及一种用于诊断神经胶质瘤(glioma)或预测预后的组合物和生物标志物组合,其包括用于测量选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种基因的变异的制剂。
7.本发明的一方面涉及一种试剂盒,其包括用于检测选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种基因的变异的制剂。
8.本发明另一方面涉及一种提供与神经胶质瘤的诊断或预测预后有关信息的方法,其包括:从个体的生物试料获得核酸试料;从获得的试料中检测选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种靶基因中的基因变异;以
及将检测到的基因的变异水平与正常试料的水平进行比较和分析。
9.本发明另一方面还涉及一种用于神经胶质瘤的个性化医疗的生物标志物组合,其包括用于检测选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种基因的变异的制剂。
10.本发明另一方面还涉及一种提供用于个性化治疗的信息的方法,其包括:从个体分离的生物试料中检测选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种靶基因中的基因变异;以及将从所述检测结果中检测到基因变异的所述个体设置为治疗目标。
11.技术方案
12.本发明的一方面提供一种用于诊断神经胶质瘤(glioma)或预测预后的组合物和生物标志物组合,其包括用于测量选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种基因的变异的制剂。
13.神经胶质瘤为起源于大脑和脊髓内部的神经胶质细胞的肿瘤,根据组成肿瘤的主要细胞,其可以分为星形细胞肿瘤、少突胶质细胞肿瘤和室管膜肿瘤等,可以通过一方面的组合物诊断或预测预后的组合物例如可以为选自星形细胞肿瘤(astrocytic tumours)、少突胶质细胞肿瘤(oligodendroglial tumours)、混合性神经胶质瘤(mixed gliomas)和室管膜肿瘤(ependymal tumours)中的至少一种。
14.术语“诊断”是指确定病理状况的存在或特征。就目的而言,这是为了确定神经胶质瘤是否已经发展。术语“预后”是指确定神经胶质瘤的例如该个体未来的存活率、治疗后该个体的复发、转移、药物反应性、耐药性等。这意味着,通过从个体的试料中确认根据一方面的选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种基因的变异水平,不仅可以预测该个体是否患有神经胶质瘤,还可以预测该个体未来的生存预后是否良好。
15.已知患有神经胶质瘤的个体与染色体1号短臂(1p)和19号长臂(19q)的共缺失密切相关,并且已知在患有神经胶质瘤的个体中具有1p和19q共缺失的个体与抗癌药物敏感性和存活率增的加密切相关,从而可以通过1p和19q的共缺失有效预测个体的预后。由此可以确认,本发明的一方面的制剂通过有效检测所述1p和19q的共缺失来确定20种用于准确诊断神经胶质瘤和预测预后的靶基因,并且通过检测所述20种基因的变异水平,可以高精度、高灵敏地预测患有神经胶质瘤的个体及其预后。
16.由于根据所述一方面确认的20种靶基因的变异与正常人相比,在神经胶质瘤患者的血液中高表达,因此尤其可用于临床上难以诊断的患有神经胶质瘤的个体的诊断。
17.已知所述samd11存在于染色体内的chr1:860235
‑
879558,ensemble id号为ensg00000187634。已知klhl21存在于染色体内的chr1:6653400
‑
6674692,ensemble id号为ensg00000162413。已知fam167b存在于染色体内的chr1:32712793
‑
32714227,ensemble id号为ensg00000183615。已知hpcal4存在于染色体内的chr1:40148183
‑
40157407,
ensemble id号为ensg00000116983。已知gpbp1l1存在于染色体内的chr1:46093903
‑
46152327,ensemble id号为ensg00000159592。已知lphn2存在于染色体内的chr1:81771820
‑
82458145,ensemble id号为ensg00000117114。已知gpr88存在于染色体内的chr1:101003668
‑
101007608,ensemble id号为ensg00000181656。已知znf599存在于染色体内的chr19:35249914
‑
35264159,ensemble id号为ensg00000153896。已知c19orf33存在于染色体内的chr19:38794776
‑
38795671,ensemble id号为ensg00000167644。已知b9d2存在于染色体内的chr19:41860580
‑
41870103,ensemble id号为ensg00000123810。已知bcam存在于染色体内的chr19:45312291
‑
45324698,ensemble id号为ensg00000187244。已知cabp5存在于染色体内的chr19:48533789
‑
48547336,ensemble id号为ensg00000105507。已知siglec11存在于染色体内的chr19:50453202
‑
50464454,ensemble id号为ensg00000161640。已知ervv
‑
2存在于染色体内的chr19:53547966
‑
53554405,ensemble id号为ensg00000268964。已知znf865存在于染色体内的chr19:56116746
‑
56129932,ensemble id号为ensg00000261221。已知mzf1存在于染色体内的chr19:59073414
‑
59084967,ensemble id号为ensg00000099326。已知mrto4存在于染色体内的chr1:19578008
‑
19585349,ensemble id号为ensg00000053372。已知lrig2存在于染色体内的chr1:113615767
‑
113669847,ensemble id号为ensg00000198799。已知bsnd存在于染色体内的chr1:55464581
‑
55474326,ensemble id号为ensg00000162399。已知slc30a2存在于染色体内的chr1:26365626
‑
26372654,ensemble id号为ensg00000158014。
18.根据本发明的一方面,组合物中包括的制剂可以为1)单碱基序列变异;2)1个至50个核苷酸的碱基序列区域的缺失或插入;3)拷贝数变异(copy number variant);或4)选自所述1)至3)中的至少两种组合。
19.所述“变异”是指基因组中碱基、核苷酸、多核苷酸或核酸的改变(alteration)。变异可以包括碱基、核苷酸、多核苷酸或核酸的取代(substitution)、插入(insertion)、缺失(deletion)(插入(insertion)、缺失(deletion)也称为“indel”)等。取代是指一个碱基、核苷酸、多核苷酸或核酸被另一个碱基、核苷酸、多核苷酸或核酸取代的改变。插入是指添加另一个碱基、核苷酸、多核苷酸或核酸的改变。缺失是指去除碱基、核苷酸、多核苷酸或核酸的改变。
20.单碱基序列变异或单核苷酸变异(single nucleotide variant,snv)是指基因组中表现出一个碱基或核苷酸差异的序列变化或变异。单碱基变异可与单碱基多态性(single nucleotide polymorphism,snp,以下简称“snp”)互换使用。snp是指当基因组上单碱基或核苷酸(a、t、c或g、核苷酸a表示腺嘌呤,核苷酸t表示胸腺嘧啶,核苷酸c表示胞嘧啶,核苷酸g表示鸟嘌呤)在物种成员之间或一个个体(individual)的成对染色体之间不同时出现的碱基或核苷酸序列的多样性。snp可以为群体(population)中以少数、1%以上或5%以上的频率存在的至少2个等位碱基或核苷酸序列。snp为人类基因组中最常见的基因多态性,根据snp在基因学上的位置,可能会导致每个个体的巨大差异。例如,当snp存在于编码蛋白质的位置时,其可以影响蛋白质的结构,改变蛋白质的功能,并导致疾病。当snp存在于不编码蛋白质的非编码区域,即存在于启动子(promoter)或内含子(intron)时,每个蛋白质表达水平存在差异,从而其蛋白质的整体活性可能会增加或减少,并且异常蛋白质也可以通过选择性剪接(alternative splicing)表达。
21.所述拷贝数变异是指与参考序列相比拷贝数不同的长度为1kb以上的变异段,可测量所述拷贝数变异的方法可以为例如荧光原位杂交法(fluorescence in situ hybridization,fish)、染色质免疫共沉淀(chromatin immuno precipitation,chip)和下一代测序仪(next generation sequencing,ngs),但不限于此。在一具体实施方案中,当检测samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2基因的拷贝数变异时,出现个体的染色体1号和19号的1p和19q的共缺失,从而可以有效地检测神经胶质瘤。
22.术语“生物标志物组合”通过使用用于诊断神经胶质瘤的生物标志物的任意组合来构建,所述组合可以是指整个集合,或其任何子集合或子组合。即,生物标志物组合可以指一组生物标志物,并且可以指所测量的任何类型的生物标志物。因此,当rpl23为生物标志物组合的一部分时,例如,rpl23mrna或rpl23蛋白质可以被认为所述组的一部分。尽管单个生物标志物可用作诊断剂,但有时生物标志物组合在确定特定状态方面比单独使用单个生物标志物可提供更大的值。具体地,检测试料中的多个生物标志物可以提高测试的灵敏度和/或特异性。因此,在一具体实施例中,生物标志物组合可以包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个以上的生物标志物类型。在另一具体实施例中,生物标志物组合由最少数量的生物标志物组合成以生成最大量的信息。因此,在多种具体实施例中,生物标志物组合可以由1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个以上的生物标志物类型组成。当生物标志物组合由“一组生物标志物”组成时,除了构成所述集合之外,不存在任何生物标志物。在一具体实施例中,生物标志物组合由本文公开的1个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的2个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的3个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的4个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的5个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的6个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的7个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的8个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的9个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的10个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的11个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的12个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的13个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的14个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的15个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的16个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的17个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的18个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的19个生物标志物组成。在另一具体实施例中,生物标志物组合由本文公开的20个生物标志物组成。本发明的生物标志物在神经胶质瘤的诊断和预后预测方面显示出统计学显着差异。在一具体实施例中,单独或组合使用这些生物标志物的诊断测试表现出约85%以上、约90%以上、约95%以上、约98%以上和约100%的灵敏度和特异性。
23.所述生物标志物可以从细胞的转录体数据获得。
24.本发明的一方面的所述用于检测基因变异的制剂可以包括引物对、探针或反义核苷酸。具体地,其可以为用于测量所述生物标志物基因的变异水平的制剂,也可以为与所述基因特异性结合的引物对、探针或反义核苷酸。在一具体实施例中,所述生物标志物组合可以包括至少两种引物对、探针或反义核苷酸,所述每个引物对、探针或反义核苷酸可以与samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bca m、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2特异性结合。
25.尤其,所述引物的特征在于,对序列进行扩增,使得已扩增的聚合酶链式反应产物可以获得最佳大小的比较序列,以便使用下一代测序仪(ngs)有效诊断神经胶质瘤和预测预后。
26.所述引物、探针或反义核苷酸可以为用可检测标记物标记的多核苷酸。可检测标记物为能够产生可检测信号的标记物质,可以为包括荧光材料,例如cy3和cy5等物质的能够产生可检测信号的标记物质。核酸的杂交结果可以通过所述可检测标记物来确认。
27.术语“引物(primer)”是指在聚合酶的核苷酸聚合反应中可作为起始点的单链寡核苷酸。例如,所述引物可以为单链寡核苷酸,其可以在合适的温度和合适的缓冲液中的合适的条件,即四种不同的核苷三磷酸和聚合酶的存在下用作模板定向(template
‑
directed)dna合成起始点。引物的合适长度可根据多种因素,例如温度和引物的用途而不同。所述引物的长度可以为5nt至100nt、5nt至70nt、10nt至50nt或15nt至30nt。例如,引物长度越短,在低退火温度下与模板形成的杂交复合物越稳定。
28.所述引物可以进一步包括如硫代磷酸酯(phosphorothioate)、烷基硫代磷酸酯的核苷酸类似物(analogue)、肽核酸(peptide nucleic acid)或嵌入剂(intercalating agent)。此外,进一步可以包括发出荧光、磷光或放射性的标记物质。所述荧光标记物质可以为vic、ned、fam、pet或其组合。所述标记物质可以在所述多核苷酸的5'末端标记。另外,放射性标记物质可以通过使用添加有如32p或35s的放射性同位素聚合酶链式反应(polymerase chain reaction,pcr,以下简称“pcr”)溶液的pcr反应掺入到扩增产物中。
29.术语探针(probe)是指可以与互补多核苷酸链进行序列特异性结合的多核苷酸。所述探针的长度可以为5nt至100nt、10nt至90nt、15nt至80nt、20nt至70nt或30nt至50nt。所述探针可用于杂交方法,例如使用微阵列(microarray)、southern印迹、动态等位基因特异性杂交(dynamic allele
‑
specific hybridization)和dna芯片等的方法。微阵列以本领域已知的含义使用,例如可以是指探针或探针组固定在基底上多个分离区域上。所述基板为合适的刚性或半刚性支撑物,例如可以包括膜、过滤器、芯片、载玻片、晶片、纤维、磁性珠或非磁性珠、凝胶、管、板、聚合物、微粒和毛细管。所述探针或与其互补探针可以用于可与从个体获得的核酸杂交并测量由此获得的杂交程度的方法。
30.本发明的一方面提供一种试剂盒,其包括用于检测选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种基因的变异的制剂。
31.所述试剂盒(kit)可以为用于预测靶基因的基因变异的试剂盒。试剂盒以本领域已知的意义使用。所述试剂盒可以例如包括如上所述的多核苷酸和其特定用途所需的物品。其可以包括与如上所述的多核苷酸一起其使用方法所需的试剂。
32.一方面的试剂盒可以包括用于进行扩增反应的试剂,并且可以包括耐热dna聚合
酶、dntps、缓冲液等。另外,本发明的试剂盒可以进一步包括描述最佳反应条件的用户指南。指南为解释如何使用试剂盒的打印件,例如pcr缓冲液的制备方法、建议的反应条件等。指南包括小册子或传单形式的指南书、贴在试剂盒上的标签以及包含试剂盒的包装表面上的说明。另外,指南包括通过互联网等电子媒体公开或提供的信息。
33.本发明另一方面提供一种提供与神经胶质瘤的诊断或预测预后有关信息的方法,其包括:从个体的生物试料获得核酸试料;从获得的试料中检测选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种靶基因中的基因变异;以及将检测到的基因的变异水平与正常试料的水平进行比较和分析。
34.所述方法包括从个体的生物试料获得核酸试料的步骤。
35.所述个体可以为包括人在内的哺乳动物。
36.所述生物试料是指从生物获得的试料。所述生物试料可以为例如选自由患者的血液、血浆、血清、尿液和唾液中的至少一种。
37.可以进一步包括用于检测来自所述生物试料的靶基因中的基因变异的常规dna分离方法以进行。例如,所述分离方法可以通过聚合酶链式反应(polymerase chain reaction,pcr)、连接酶链式反应(ligase chain reaction,lcr)、转录扩增(transcription amplification)或实时依赖于核酸序列的扩增(realtime
‑
nucleic acid sequence based amplification,nasba)对靶核酸进行扩增并纯化而获得。
38.在所述分析基因变异的步骤中,基于所述靶基因中特定变异的存在与否,可以确定个体或受试者是否有患神经胶质瘤的风险或患有神经胶质瘤的患者。
39.检测靶基因中基因变异的步骤可以例如通过下一代测序仪平台进行,所述下一代测序仪平台可以为但不限于全基因组测序(whole
‑
genome sequencing)、全外显子组测序(whole
‑
exomes sequencing)或靶向基因组测序(target gene panel sequencing)。
40.另外,在所检测的基因变异水平与正常试料水平的对比分析步骤中,通过基因变异水平分析,可以确认是否存在基因1p和19q染色体共缺失(co
‑
deletion)。
41.提供与所述个体神经胶质瘤的诊断或预测预后有关信息可以旨在预测针对与神经胶质瘤的表达高度相关的基因1p和19q染色体共缺失的相对风险并测量选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种基因变异水平来预测或检测针对神经胶质瘤的相对风险。例如,所述风险可以用于预测或诊断在靶基因的变异水平高于具有参考基因组序列的组时是否增加发生神经胶质瘤的可能性。当所述靶基因具有1个以上、2个以上、3个以上、4个以上、5个以上、6个以上、7个以上、8个以上、9个以上,或10个以上、11个以上、12个以上、13个以上、14个以上、15个以上、16个以上、17个以上、18个以上、19个以上或20个以上的变异时,基因1p和19q染色体共缺失的可能性很高,从而可以确定发生与其高度相关的神经胶质瘤的风险很高,并且由此可以提高神经胶质瘤的诊断或预后预测的准确性。在一具体实施例中,当在所述20种靶基因中都测量到拷贝数变异时,确认出现基因组1p和19q染色体共缺失,由此证实了可以有效诊断神经胶质瘤。
42.根据本发明的一方面,所述将检测到的基因的变异水平与正常试料的水平进行比较和分析的步骤可以包括:当在20种靶基因中都测量到拷贝数变异时,将出现基因组1p和
19q染色体共缺失的个体确定为具有出现1p和19q染色体共缺失的神经胶质瘤的个体。另外,由于在个体出现1p和19q染色体共缺失时可以确定神经胶质瘤患者的存活率是否高,因此所述将检测到的基因的变异水平与正常试料的水平进行比较和分析的步骤可以进一步包括:当所述20种靶基因中都测量到拷贝数变异,且所述个体确定为具有出现1p和19q染色体共缺失的神经胶质瘤的个体时,神经胶质瘤患者的存活率高,从而预测神经胶质瘤患者的预后良好。
43.在所述方法中,从所述基因中检测基因变异的步骤为确定核苷酸或碱基序列的方法,可以为测序,例如全基因组测序(whole
‑
genome sequencing)、全外显子组测序(whole
‑
exomes sequencing)或靶向基因组测序(target gene panel sequencing),并且可以通过选自微阵列杂交、等位基因特异性pcr(allele specific pcr)、动态等位基因特异性杂交(dynamic allele
‑
specific hybridization)、pcr延伸分析、pcr
‑
单链构象多态性(pcr
‑
single strand conformation polymorphism,pcr
‑
sscp)和taqman方法中的至少一种技术进行。在从所述基因中检测基因变异的步骤中,可以使用所述组合物或试剂盒。
44.本发明另一方面还提供一种用于神经胶质瘤的个性化医疗的生物标志物组合,其包括用于检测选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种基因的变异的制剂。
45.本发明另一方面还提供一种提供用于个性化治疗的信息的方法,其包括:从个体分离的生物试料中检测选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种靶基因中的基因变异;以及将从所述检测结果中检测到基因变异的所述个体设置为治疗目标。
46.如上所述,由于根据一具体实施例的生物标志物基因组合基于每个患者的肿瘤基因,因此可以通过定制的基因治疗来增强神经胶质瘤的治疗效果。另外,所述基因组合中的拷贝数变异为其靶点,因此可以对由所述基因变异引起的多种疾病即神经胶质瘤进行有效的靶向治疗。
47.在一具体实施例中,当在所述20种靶基因中都测量到拷贝数变异时,确认出现基因组1p和19q染色体共缺失,由此证实了可以有效诊断神经胶质瘤。由于在出现1p和19q染色体共缺失时神经胶质瘤患者的存活率较高,因此当所述20种靶基因均出现拷贝数变异时,可以预测神经胶质瘤患者的预后良好。
48.本领域已知,当出现1p和19q染色体共缺失时,对特定抗癌药物疗法的抗癌药物敏感性(chemosensitivity)和存活率可能会有所不同。例如,在少突胶质细胞肿瘤中,众所周知,出现1p和19q染色体共缺失的患者对化疗的反应不同,并且在出现1p和19q染色体共缺失的患者中,与单独放疗相比,放疗联合丙卡巴肼(procarbazine)/洛莫司汀(lomustine)/长春新碱(vincristine)化疗(pcv)可以提高存活率,由于出现1p和19q染色体共缺失的少突神经胶质瘤患者对抗癌药物敏感,因此预后良好,从而可以用根据一方面的对20种靶基因出现基因变异的个体对出现或不出现1p和19q染色体共缺失的个体进行个性化治疗,并且也有可能进行靶向治疗。
49.一具体实施例的提供信息的方法包括检测从个体分离的生物试料中定义的基因
组合的变异的步骤。具体地,所述个体是指用于预测因基因变异而发生神经胶质瘤的风险的对象。所述个体可以包括脊椎动物、哺乳动物或人(homo sapiens)。例如,所述人可以为韩国人。另外,所述生物试料可以为组织、细胞、全血、血清、血浆、唾液、痰、脑脊液或尿液。如上定义的基因组合的突变检测可以通过从所述生物试料中分离核酸后测量拷贝数变异来进行,所述分离核酸的方法和所述测量拷贝数变异的方法是本领域已知的。所述分离核酸的方法,例如可以通过直接从所述生物试料中分离dna或通过如pcr的核酸扩增方法扩增特定区域来进行。所述已分离的核酸试料不仅包括纯分离的核酸,还包括粗分离的核酸,例如含有核酸的细胞裂解物。所述核酸扩增方法包括pcr、连接酶链式反应(lcr)、转录扩增(transcription amplification)、自我维持序列复制和依赖于核酸序列的扩增(nasba)。所述分离的核酸可以为dna或rna。所述dna可以为基因组dna、cdna或重组dna。所述rna可以为mrna。另外,确定所述突变位点的方法,例如,可以通过已知核酸的核苷酸测序方法(sequencing method)直接确定突变位点的核苷酸。确定核苷酸测序的方法可以包括sanger(或双脱氧)测序方法或maxam
‑
gilbert(化学修饰)方法。另外,可以通过将包括突变位点序列的探针与目标多核苷酸杂交并分析杂交结果来确定突变位点的核苷酸。杂交程度,例如,可以通过用可检测标记物标记目标核酸并检测杂交的目标核酸,或通过电学方法等来确认。另外,可以使用单碱基引物延伸(single base primer extension,sbe)方法。
50.除非另有定义,否则本发明中使用的所有技术术语均以本发明相关领域中的普通技术人员通常理解的含义相同地使用。另外,尽管本说明书中描述了优选的方法或试料,但与此相似或等同的方法或试料也包括在本发明的范围内。本说明书中作为参考文献记载的所有刊物的内容整体作为参考并入本发明。
51.有益效果
52.根据本发明一方面,当检测选自samd11、klhl21、fam167b、hpcal4、gpbp1l1、lphn2、gpr88、znf599、c19orf33、b9d2、bcam、cabp5、siglec11、ervv
‑
2、znf865、mzf1、mrto4、lrig2、bsnd和slc30a2中的至少一种靶基因中的基因或蛋白质变异时,由于对神经胶质瘤的诊断具有高准确度和高灵敏度,因此可以有效诊断神经胶质瘤。因此,当使用从所述靶基因中检测基因变异的制剂时,其可以有效地用于诊断神经胶质瘤或预测预后的组合物、试剂盒、提供信息的方法以及提供用于个性化治疗的信息的方法。
附图说明
53.图1为将gliomascan的灵敏度与全外显子组测序(whole
‑
exome sequencing:wes)数据进行比较评估的结果示意图。
54.图2为从46个样本中确认治疗靶基因的变异谱的结果图。
55.图3为确认与影响个体神经胶质瘤的神经胶质瘤中常见变异有关的信息的示意图。
56.图4a为确认对所选20个靶基因检测1p和19q拷贝数缺失的准确性的示意图。
57.图4b为通过比较gliomascan和fish数据来验证所选20个靶基因有效性的结果图。
58.图4c为确认1p和19q的共缺失与1p和19q的野生型样本在染色体水平上的cna比较的结果图。
detector。变异效应预测器(variant effect predictor,vep)版本用于将潜在功能结果和其他相关信息注释到所预测的体细胞突变。当总基因读数大于等于20,或变异等位基因频率大于0.05时,选择了显着的突变。
69.另外,使用ngcgh python包0.4.4版本测量基因拷贝数。将与患者匹配的正常全外显子组测序数据用作预测肿瘤拷贝数的倍数变化的标准。基因组扩增和缺失分别使用0.585以上的log2标度和
‑
0.5以下的log2标度来确定。
70.实验例4:进行靶向测序的统计分析
71.全外显子组测序与靶向序列之间的变异等位基因频率相关性由pearson计算。为了使用靶向碱基序列分析来评估1p/19q状态,使用受试者工作特征曲线(receiver operating characteristic curve,roc)调查位于染色体1p和19q的基因的拷贝数状态,并测量为梯形。使用r包和复合热图来绘制oncoprint图以进行可视化更改。采用双侧fisher精确检验,将idh1的体细胞突变与gliomascan和荧光原位杂交法或免疫组化法之间的egfr的局部扩增进行了比较。
72.实施例1:从肿瘤细胞系确认组合的有效性
73.1.1、从hd753细胞系确认组合的有效性
74.通过使用gliomascan的分析,从靶向区域确认了18个变异中总共15个变异。与从突变测量组合确认的变异体相比,检测到15个所有变异,其包括3个单碱基序列变异、2个高gc含量的单碱基序列变异、1个低gc含量的单碱基序列变异、1个长插入、1个长缺失和3个短缺失。所预期和测量的等位基因频率之间存在高度相关性(r2=0.9356)。其结果显示单碱基序列变异、插入和缺失和基因拷贝数变异的灵敏度为100%。
75.1.2、从na12878细胞系确定参考序列
76.为了估计单碱基序列变异对所述组合中4330个靶向区域(1269kb)的灵敏度和特异性,对基因型进行了全面分析并将na12878细胞系用作参考序列。在组合中确认的单碱基序列变异和na12878的基因型(ftp://ftptrace.ncbi.nlm.nih.gov/giab/ftp/release/na12878_hg001/latest/grch37/)的比较中,两者间确认的单碱基序列变异均一致。另外,在靶向区域中846058个参考基因型的比较结果中,与组合中确认的基因型一致。
77.1.3、通过测量基因变异检测限和灵敏度来验证组合的有效性
78.使用基因全集(预期变异等位基因频率(variant allelic frequency,vaf)范围:4%至100%,用于验证组合的基因集中的变异数:689)测量检测限(lod)和检测灵敏度。当使用所述组合评估组合的有效性时,灵敏度和相关比(r2)分别为99.2%和0.9856,由此确认了可以非常准确地测量基因集的变异。确认了在低预期变异等位基因频率(4.1%至5%)的范围内检测到136个变异中135个(99.26%),综上所述,确认了根据组合的基因变异的检测限为5%以上。
79.实施例2、通过比较靶向测序组合和全外显子组测序之间的变异等位基因频率来确认组合的有效性
80.为了确认靶向测序组合的准确性,进行了将从靶向组合获得的体细胞突变的可变等位基因频率与全外显子组测序进行比较的实验。将与从正常血液中提取的dna匹配的28个肿瘤组织样本暴露于全外显子组测序和靶向测序组合。将来自单碱基序列变异、插入或缺失的显着突变的阈值设置为,深度范围大于或等于20,变异等位基因频率大于或等于
5%。图1中显示了在全外显子组测序和靶向序列分析中测量的所有体细胞突变的变异等位基因频率的比较。
81.根据图1中确认的结果,在两个测序组合中总共检测到118个基因组变异,并且可以在全外显子组测序或靶向序列分析中分别检测到24个或9个变异。检测到变异等位基因频率相对较低的私有突变(private mutation),因为将当应用到靶向序列化组合的dna样本与应用到全外显子组测序的肿瘤片段进行比较时,由于其来自同一肿瘤的不同部位,因此胶质母细胞瘤表现出过度的瘤内异质性(intratumoral heterogeneity),从而认为得到上述结果。我们可以从较低的变异等位基因频率确认如肿瘤细胞增殖时的亚克隆(sub
‑
clonal)突变的存在,并且确认了可以获得多种私有突变。与此相反,在全外显子组测序平台中,可以确认少量变异等位基因频率相对较高的私有突变。通过分析每个私有突变,可以确认其为真正的生殖细胞突变,因为匹配的正常血液中同时检测到所述基因变异而没有出现在靶向测序组合。全外显子组测序血液组合的缺失主要体现在全外显子组测序与靶向测序组合之间测序深度(depth)的显着差异。尤其,测量的gliomascan的范围约为800x,其远高于标准全外显子组测序的200x,但确认了全外显子组测序和靶向序列化组合在体细胞突变频率(r=0.814,p
‑
值=4.77e
‑
37;费希尔确切检验(fisher’s exact test))方面表现出高度相关性。因此,经证实,与之前建立的全外显子组测序平台相比,所述实验例中确认的靶向序列化组合能够以高置信度准确识别和测量潜在的体细胞变异。
82.实施例3、确认可以诊断胶质母细胞瘤的生物标志物基因中的基因变异
83.进行了确认作为可简单诊断出胶质母细胞瘤的生物标志物的基因突变的实验,目前为止所述胶质母细胞瘤只能通过临床判断来确认。如所述实验例所确认,在所述实验例中确认的已知具有治疗效果的94个基因中,系统地评估了所有基因中可以有效检测胶质母细胞瘤的临床上可用的突变,其评估结果如图2所示。
84.如图2所确认,经证实,46名患者中有32名(69.6%)在临床上可行的所述基因中有至少一个体细胞突变。另外,经证实,所述46名患者中有11名(23.9%)具有以前在cosmic中可确认的变异,其中,nf1基因中的突变为最常见的突变(31.3%),并且pten、pik3ca和ptpn11基因中的突变分别以28.1%、15.6%和12.5%出现,它们在所述基因之后依次显示出最多的突变。另外,如图2中所确认,在至少两名以上的患者中观察到19个基因的突变。在反复确认的突变中,32个样本中基因的体细胞突变数量从2个到81个不等。综上所述,可以确认,在从46名患者中的43名(样本的93.5%)鉴定出的可用作潜在治疗反应的预测指标的基因可以具有至少一个基因变异。
85.实施例4、确认神经胶质瘤中常见体细胞变异
86.由于可以通过使用靶向序列化组合进行的神经胶质瘤中常见的突变来有效地诊断神经胶质瘤,因此进行了分析所述突变的实验。对10个低级别神经胶质瘤(low
‑
grade gliomas,lgg)和36个胶质母细胞瘤(glioblastomas,gbm)的样本进行了单碱基变异、短插入和缺失分析。由于所述基因变异调节胶质母细胞瘤中经常失控的关键致癌途径,因此确认神经胶质瘤中是否存在此类变异很重要,现有的研究表明,tp53突变发生在多种肿瘤类型的肿瘤进展的早期阶段。由此,在who重新分类中,诊断神经胶质瘤时应考虑idh1/idh2的变异,也应考虑tp53的变异,特别是确认tp53的变异很重要,因为染色体1p和19q臂(arm)的共缺失与tp53突变不一致。另外,根据伴随转录体表达的基因变异,胶质母细胞瘤可分为四
种不同的分子亚型,已知所述分子的亚型可以根据cna和如egfr、nf1和pdgfra的致癌基因体细胞变异进行分类。由于所述基因中常见的突变在具有显著的生物学特性的分子亚型之间存在很大差异,因此选择可用作准确诊断神经胶质瘤的生物标志物的靶基因候选组非常重要。在所述靶基因候选组中的9个基因(tp53、atrx、egfr、pten、pdgfra、rb1、nf1、mdm2和cdkn2a)中确认了cna的出现率,如图3所示。
87.如图3所确认,idh1和atrx基因中的突变具有显着的表达率,在神经胶质瘤中确认了包括egfr的局部扩增和pten的基因缺失的几个重要的基因变异,这与现有已知的事实一致,即7号染色体的增加和10号染色体的缺失在胶质母细胞瘤中诱导重要的肿瘤发生。另外,可以确认,在所述低级别神经胶质瘤中,idh1基因和atrx基因的突变以10个突变中的8个和4个的频率出现。经证实,在idh基因突变中,除了在idh1蛋白质中以r20*获得终止密码子的变异外,氨基酸变为r132h。
88.实施例5、确定用于诊断神经胶质瘤和其预后的生物标志物
89.进行了用于确定生物标志物的实验,所述生物标志物用于测量染色体1p/19q的共缺失以诊断神经胶质瘤并更准确地预测其预后。使用所述实验例中确认其有效性的gliomascan来进行靶向序列分析数据,再次验证所述靶向序列分析数据比现有的标准方法相比具有有效性,据此,进行了用于确定生物标志物的实验,所述生物标志物可用于测量具有有效性的基因1p/19q的共缺失。
90.经证实,通过从经实验例中确认的gliomascan的靶向序列分析独立确认的荧光原位杂交法实验来进行的egfr扩增的费希尔确切检验的结果与p值为2.06e
‑
04,相互一致,并且即使与免疫组化法方法相比,也显示出较高的一致率(p
‑
值为6.68e
‑
07),所述免疫组化法为目前用于检测神经胶质瘤中idh1突变的标准检测方法。
91.据此,从所述实验例1的232个靶基因中选择20个能有效确认染色体1p/19q共缺失的基因,所述实验例1用于确定用于有效确认如上所述确认有效性的染色体1p/19q共缺失的生物标志物,并且基因如下表1所示。
92.【表1】
[0093][0094][0095]
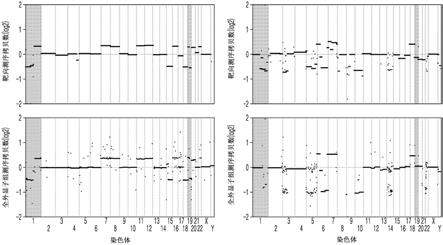
为了评估通过所述基因是否可以反映实际染色体共缺失状态,使用全外显子组测序比较了1p和19q的节段染色体水平。当11个基因中的9个基因和9个基因中的8个基因分别从1p和19q的染色体臂同时删除时,每个肿瘤中都确认了1p和19q的染色体水平的缺失。为了评估所选基因作为用于确认1p/19q共缺失状态的生物标志物的准确性,使用52个样本确认了受试者工作特征曲线,其如图4a、图4b和图4c所示。
[0096]
如图4a所确认,当整合基因集和全外显子组测序结果时,所述20个生物标志物基因可以准确预测1p和19q的染色体共缺失,其auc值为0.929,95%ci值为0.8862
‑
1,均较高。
[0097]
评估了靶向序列确定组合与如荧光原位杂交法的现有已知的诊断方法相比是否可以准确预测1p/19q的共缺失状态,其结果如图4b所示,通过受试者工作特征曲线分析确认了auc值为0.917,95%ci值为0.8596
‑
0.9737,其始终显示出高一致性。
[0098]
如图4c所确认,通过将来自全外显子组测序的1p和19q染色体共缺失与从靶向序
列化组合预测的染色体缺失进行比较的结果,确认了两个组合均显示出非常相似的染色体谱。
[0099]
因此,综上所述,通过所述20个基因生物标志物,可以以高度的准确性和灵敏度确认1p和19q的共缺失,所述1p和19q的共缺失可用于准确诊断神经胶质瘤或预测预后。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。