1.本发明涉及骨缺损修复材料技术领域,具体涉及一种可注射温敏性自固化骨修复材料及其制备方法。
背景技术:
2.腔隙性骨缺损是临床骨科常见的骨缺损类型之一,目前因骨质疏松、骨肿瘤、骨髓炎、病理性骨折、创伤性骨折或手术清创等原因造成的腔隙性骨缺损患者逐年增加。且此类腔隙性骨缺损大多是缺损部位形状不规则,不易发生自愈合。如不及时进行临床治疗和干预会发展成节段性骨缺损,后期治愈难度更大。在腔隙性骨缺损修复中,骨材料的形态和植入方式直接影响到骨修复重建过程,临床上常采用人工骨水泥或同种、异种骨颗粒,结合开放性手术进行治疗。人工骨水泥常以生物陶瓷类为原料采用紧密填充法充填骨缺损的腔隙,这类材料多存在不可降解吸收或降解速率与新骨生成速率不匹配、内部缺少微孔结构不利于物质流通输送、骨结合能力差等缺点,使骨缺损修复效果不尽理想。来自于生物体的同种或异种骨颗粒,保留了骨骼中天然的无机物和内部微孔结构,具有良好的骨传导性和低免疫原性,降解速率与新骨生成速率可控,目前已被广泛用于颧骨关节翻修术、椎体压缩性骨折的治疗。但开放性手术使患者承受手术创伤的痛苦,且手术有风险,术后不能活动;且单纯的颗粒骨,与骨细胞、蛋白和生长因子的亲和力差、缺乏骨诱导能力、骨颗粒结构松散,容易引发颗粒游走、移位、压迫神经等并发症,影响其骨修复效果。
技术实现要素:
3.针对现有技术中存在的问题本发明提供了一种可注射温敏性自固化骨修复材料的制备方法,所制备的骨修复材料解决了现有技术中存在的以上问题。
4.本发明是通过如下技术方案实现的:
5.一种可注射温敏性自固化骨修复材料,其特征在于,包括如下质量分数的组分:巯基壳聚糖5-10wt%、温敏调节剂15-20wt%、生物骨颗粒10-20wt%、余量为水。
6.进一步的,可注射温敏性自固化骨修复材料:所述的温敏调节剂选自α-甘油磷酸钠、β-甘油磷酸钠、甘露醇、木糖醇、山梨醇、三羟甲基乙烷中的一种。
7.进一步的,可注射温敏性自固化骨修复材料:所述巯基壳聚糖的巯基化度为800-1000umol/g。
8.具体的,本发明所述的可注射温敏性自固化骨修复材料构成包含温敏材料巯基壳聚糖、温敏性调节剂、天然骨颗粒及水相介质。该可注射温敏性自固化骨修复材料在37℃人体环境下,可发生凝胶化相变形成凝胶。生物骨颗粒天然的无机成分、结晶结构和微孔结构,为早期骨修复提供了天然的支架,充分发挥天然骨的骨传导性能。凝胶态修复材料可原位固定骨颗粒,避免骨颗粒的游走、移位。本发明所述的骨修复材料是物理键和化学键交联而成的双网结构凝胶,呈多孔结构,其抗压强度更高,且有利于体液和营养物质的流通输送。
9.本发明所述的可注射温敏性自固化骨修复材料在临床上可结合插管术实现腔隙性骨缺损部位的微创治疗,可操作性强,可减轻开放性手术给病人造成的痛苦或后遗症。
10.一种可注射温敏性自固化骨修复材料的制备方法,其特征在于,该方法包括如下步骤:
11.(1)将所述巯基壳聚糖溶于水中,配制巯基壳聚糖溶液;然后将所述生物骨颗粒溶于所述巯基壳聚糖溶液中,静置,过滤,得到骨颗粒-巯基壳聚糖交联物;
12.(2)将所述温敏调节剂溶于水中,配制温敏调节剂溶液,然后加入所述巯基壳聚糖和所述骨颗粒-巯基壳聚糖交联物,振荡,得到可注射温敏性自固化骨修复材料。
13.具体的,本发明所提供的可注射温敏性自固化骨修复材料的制备方法,制备了一种可注射,可自固化,可负载生物骨颗粒、蛋白或生长因子的双网络结构骨修复材料。本发明的方法制备了一种可负载天然生物骨颗粒、蛋白或生长因子,具有三维网状结构的改性壳聚糖(巯基壳聚糖),然后通过与生物骨填充材料交联,在温敏调节剂的作用下注入体内,可发生凝胶化相变,形成具有一定机械性能、双网络结构的凝胶物质。
14.具体的,本发明制备的可注射温敏性自固化骨修复材料为巯基壳聚糖、温敏调节剂、生物骨颗粒以及水相介质组成的混合体系。本发明制备的可注射温敏性自固化骨修复材料可用于骨缺损修复领域,尤其是形状不规则的腔隙性骨缺损修复。
15.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:步骤(1)将巯基壳聚糖溶于去离子水中,配制浓度2-5wt%的巯基壳聚糖溶液;所述生物骨颗粒与巯基壳聚糖溶液的质量比为(1-4):1。
16.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:步骤(1)中静置温度为1-5℃下,时间为8-12小时。
17.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:步骤(2)将温敏调节剂溶于去离子水中,配制浓度8-10wt%的温敏调节剂溶液;所述振荡时间为10-20分钟。
18.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述巯基壳聚糖的制备方法,步骤如下:
19.(1)将待改性的温敏材料溶于磷酸盐缓冲溶液中,然后在水浴条件下加入改性剂并搅拌均匀,得到混合体系;所述待改性的温敏材料为75-93%脱乙酰度、分子量10-50kda的壳聚糖;
20.(2)向所述混合体系中滴加催化剂,继续搅拌反应;将反应所得产物过滤,用有机溶剂萃取去除未反应的所述改性剂,收集产物,得到伯氨基被巯基化的壳聚糖;
21.(3)将巯基乙酸溶于二氯甲烷中,然后加入二环己基碳二亚胺,和4-二甲氨基吡啶,活化羧基基团;然后再加入上述伯氨基被巯基化的壳聚糖,并在冰浴条件下搅拌,形成混合液;
22.(4)将上述混合液蒸干,得到仲羟基被巯基化的壳聚糖改性物;然后烘干,得到巯基壳聚糖。
23.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述巯基壳聚糖的制备方法,步骤(1)中所述待改性的温敏材料与所述磷酸盐缓冲溶液的质量比为(1-3):20,所述磷酸盐缓冲溶液的ph=5。
24.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述巯基壳聚糖的
制备方法,步骤(1)中所述的改性剂选自巯基乙酸、半胱氨酸、2-亚氨基硫烷盐酸盐、n-乙酰-l-半胱氨酸、巯基乙烷中的任一种。
25.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述巯基壳聚糖的制备方法,步骤(1)中所述待改性的温敏材料与所述改性剂的质量比为1:(2-5);所述水浴温度为50-70℃。
26.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述巯基壳聚糖的制备方法,步骤(1)中所述待改性的温敏材料为80-85%脱乙酰度、分子量25-30kda的壳聚糖。
27.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述巯基壳聚糖的制备方法,步骤(2)所述的有机溶剂为乙醇和丙酮。
28.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述巯基壳聚糖的制备方法,步骤(2)得到伯氨基被巯基化的壳聚糖,巯基化度为300-400umol/g。
29.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述巯基壳聚糖的制备方法,步骤(2)中所述的催化剂为浓度0.5-1.0wt%的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺溶液或1-羟基苯并三唑溶液;所述催化剂与所述待改性的温敏材料的质量比为1:(2-3)。
30.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述巯基壳聚糖的制备方法,步骤(3)中所述巯基乙酸、所述二氯甲烷、所述二环己基碳二亚胺和所述4-二甲氨基吡啶之间的质量比为1:(3-5):(0.1-0.2):(0.04-0.06)。
31.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述巯基壳聚糖的制备方法,步骤(3)中所述伯氨基被巯基化的壳聚糖与所述巯基乙酸的质量比为(1-2):1;搅拌速率为200-300rpm,搅拌时间为8-12小时。步骤(4)中得到的巯基壳聚糖,巯基化度为800-1000umol/g。
32.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述生物骨颗粒的制备方法,步骤如下:
33.(1)将生物骨处理干净,备用;然后将处理干净的生物骨浸入脱脂溶剂中进行脱脂处理,得到脱脂骨;
34.(2)将所述脱脂骨浸入碱性溶剂中进行脱蛋白处理,得到脱脂和脱蛋白的骨;然后将脱脂和脱蛋白后的骨低温煅烧,研磨,得到生物骨颗粒。
35.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述生物骨颗粒的制备方法,步骤(1)中所述的脱脂溶剂选自烷烃类、苯类、卤代烃、酯类、醚类的一种。
36.进一步的,所述可注射温敏性自固化骨修复材料的制备方法:所述生物骨颗粒的制备方法,步骤(2)中所述的碱性溶剂选自浓度为5-20wt%的氢氧化钠溶液、乙二胺溶液、乙醇胺溶液或双氧水中的一种;煅烧温度为250-500℃,煅烧2-4小时。
37.具体的,在生物骨颗粒制备过程中煅烧的温度尤为关键,本发明的工艺通过低温煅烧(250-500℃)来达到对骨颗粒上羟基的保护。
38.本发明的有益效果:
39.(1)本发明提供的可注射温敏性自固化骨修复材料具有可注射性:该骨修复材料包含巯基壳聚糖、温敏调节剂、生物骨颗粒、水相介质,该修复材料在室温下为可注射的流
动液态,在37℃人体环境下,发生凝胶化相变形成凝胶,在临床上可结合插管术实现腔隙性骨缺损部位的微创治疗,可减轻开放性手术给病人造成的痛苦或后遗症。
40.(2)本发明提供的可注射温敏性自固化骨修复材料可自固化:该骨修复材料在37℃人体环境下,可在注射后2-10分钟内由液态自固化为凝胶态,液态混合物可充分填充不规则的骨缺损部位,凝胶态混合物可原位固定骨颗粒,避免骨颗粒的游走、移位。
41.(3)本发明提供的可注射温敏性自固化骨修复材料生物粘附性强:经改性的温敏材料巯基壳聚糖,巯基化度达到800-1000umol/g,其游离巯基与骨生长蛋白上的半胱氨酸形成共价键,生物粘附性更强。
42.(4)本发明提供的可注射温敏性自固化骨修复材料具有双网络结构:该骨修复材料是高分子与高分子之间或高分子与骨颗粒之间,通过物理键和化学键交联而成的双网络结构凝胶,呈多孔结构,抗压强度更高,且有利于体液和营养物质的流通输送,促进骨缺损修复前期的血管化生成。巯基壳聚糖的巯基和骨颗粒上的羟基结合形成交联物,这一步对凝胶形成双网络结构以及力学强度提高非常关键。在生物骨颗粒制备过程通过低温煅烧(250-500℃)来达到对羟基的保护。
43.(5)本发明提供的可注射温敏性自固化骨修复材料具有抗菌性:该骨修复材料带大量的正电荷,可结合细菌表面负电子基团抑制细菌活性,应用于骨缺损修复中,可达到抗菌效果。
44.(6)本发明提供的可注射温敏性自固化骨修复材料具有生物活性:该骨修复材料保留了生物骨颗粒天然的无机成分、结晶结构和微孔结构,为早期骨修复提供了天然的支架,充分发挥天然骨的骨传导性能;该骨修复材料带丰富的正电荷,可吸附并固定体液中的大量的血凝块,为新骨生长提供有利的微环境。
附图说明
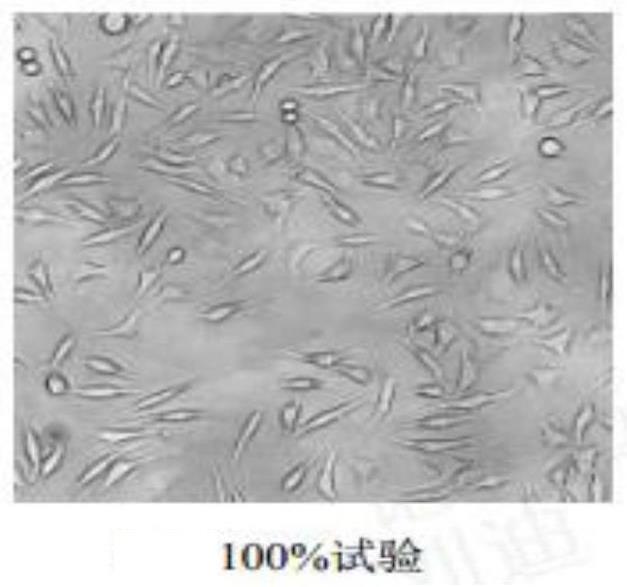
45.图1-10为细胞毒检测过程中各组别的细胞生长形态显微观察图。
具体实施方式
46.下面将结合具体实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。以下对至少一个示例性实施例的描述实际上仅仅是说明性的,决不作为对本发明及其应用或使用的任何限制。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
47.本发明所述的可注射温敏性自固化骨修复材料,包括如下质量分数的组分:巯基壳聚糖5-10wt%、温敏调节剂15-20wt%、生物骨颗粒10-20wt%、余量为水;其中所述的温敏调节剂选自α-甘油磷酸钠、β-甘油磷酸钠、甘露醇、木糖醇、山梨醇、三羟甲基乙烷中的一种。
48.本发明所述的可注射温敏性自固化骨修复材料的制备方法,包括了巯基壳聚糖的制备、生物骨颗粒的制备以及最终可注射温敏性自固化骨修复材料的制备,其具体步骤如下:
49.一、巯基壳聚糖的制备:
50.(1)将待改性的温敏材料按质量比(1-3):20溶于ph=5的磷酸盐缓冲溶液中,然后在50-70℃水浴条件下加入改性剂并搅拌均匀,得到混合体系;所述待改性的温敏材料为75-93%脱乙酰度、分子量10-50kda的壳聚糖;待改性的温敏材料与改性剂的质量比为1:(2-5);其中:改性剂选自巯基乙酸、半胱氨酸、2-亚氨基硫烷盐酸盐、n-乙酰-l-半胱氨酸、巯基乙烷中的任一种;
51.(2)向上述混合体系中滴加浓度0.5-1.0wt%的催化剂,继续搅拌反应3-6小时;将反应所得产物过滤,依次用乙醇和丙酮萃取去除未反应的改性剂,收集产物,得到伯氨基被巯基化的壳聚糖,巯基化度为300-400umol/g;其中:催化剂为浓度0.5-1.0wt%的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺溶液或者为0.5-1.0wt%的1-羟基苯并三唑溶液,且催化剂与待改性的温敏材料的质量比为1:(2-3);
52.(3)将巯基乙酸溶于二氯甲烷中,然后加入二环己基碳二亚胺,和4-二甲氨基吡啶,活化羧基基团;然后再加入上述伯氨基被巯基化的壳聚糖,并在冰浴条件下以200-300rpm搅拌8-12小时,形成混合液;其中巯基乙酸、二氯甲烷、二环己基碳二亚胺和4-二甲氨基吡啶按质量比1:(3-5):(0.1-0.2):(0.04-0.06)加入;伯氨基被巯基化的壳聚糖与巯基乙酸按质量比(1-2):1加入;
53.(4)将上述混合液采用旋蒸法蒸干,得到仲羟基被巯基化的壳聚糖改性物,然后烘干,得到巯基壳聚糖,巯基化度为800-1000umol/g;将制备的巯基壳聚糖置于液氮中保存,备用;
54.二、生物骨颗粒的制备:
55.(1)将生物骨切割成条状,通过煮沸、剔除、冲洗等物理方法将骨条处理干净,备用;然后将处理干净的生物骨浸入脱脂溶剂中,在60-130℃下反应12-24小时进行脱脂处理,得到脱脂骨;其中:生物骨选自牛、猪、马等哺乳动物离体松质骨中的任一种;所述的脱脂溶剂选自烷烃类、苯类、卤代烃、酯类、醚类的一种;优选脱脂溶剂为环己烷烷、对溴甲苯、对硝基甲苯、乙酸乙酯、石油醚中的一种;
56.(3)将所述脱脂骨浸入碱性溶剂中,在80-150℃下反应12-18小时进行脱蛋白处理,得到脱脂和脱蛋白的骨;然后将脱脂和脱蛋白后的骨置于马弗炉中,在250-500℃下煅烧2-4小时,然后再置于组织研磨仪中粉碎处理,得到粒径0.2-20μm的生物骨颗粒;其中:所述的碱性溶剂选自浓度为5-20wt%的氢氧化钠溶液、乙二胺溶液、乙醇胺溶液或双氧水中的一种;
57.三、可注射温敏性自固化骨修复材料的制备:
58.(1)将巯基壳聚糖溶于去离子水中,配制浓度2-5wt%的巯基壳聚糖溶液;然后将生物骨颗粒溶于所述巯基壳聚糖溶液中,在1-5℃下静置8-12小时,过滤,得到骨颗粒-巯基壳聚糖交联物;其中:生物骨颗粒与巯基壳聚糖溶液的质量比为(1-4):1;
59.(2)将温敏调节剂溶于去离子水中,配制浓度8-10wt%的温敏调节剂溶液,然后加入所述巯基壳聚糖和所述骨颗粒-巯基壳聚糖交联物,使用涡旋振荡器涡旋10-20分钟,得到可注射温敏性自固化骨修复材料;其中:温敏调节剂选自α-甘油磷酸钠、β-甘油磷酸钠、甘露醇、木糖醇、山梨醇、三羟甲基乙烷中的一种。
60.实施例1
61.一种可注射温敏性自固化骨修复材料,包括如下质量分数的组分:巯基壳聚糖
8wt%、温敏调节剂15wt%、生物骨颗粒10wt%、余量为水;其中:所述巯基壳聚糖的巯基化度为956umol/g,所述的温敏调节剂为β-甘油磷酸钠,所述的生物骨颗粒为牛骨颗粒。
62.实施例1所述的可注射温敏性自固化骨修复材料的制备方法,包括如下具体步骤:
63.一、巯基壳聚糖的制备:
64.(1)按重量份,将1份待改性的温敏材料溶于20份ph=5的磷酸盐缓冲溶液中,然后在60℃水浴条件下加入3份巯基乙酸(改性剂)并搅拌均匀,得到混合体系;所述待改性的温敏材料为75-93%脱乙酰度、分子量10-50kda的壳聚糖;
65.(2)向上述混合体系中滴加0.5份浓度0.5wt%的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺溶液(催化剂),继续搅拌反应6小时;将反应所得产物过滤,依次用50份乙醇和50份丙酮萃取去除未反应的巯基乙酸(改性剂),收集固体产物,得到伯氨基被巯基化的壳聚糖,巯基化度为300-400umol/g;
66.(3)将5份巯基乙酸溶于20份二氯甲烷中,然后加入0.5份二环己基碳二亚胺(cdd),再加入0.2份4-二甲氨基吡啶,活化羧基基团;然后再加入6份上述所得伯氨基被巯基化的壳聚糖,并在冰浴条件下以200rpm搅拌12小时,形成混合液;
67.(4)将上述混合液采用旋蒸法蒸干,得到仲羟基被巯基化的壳聚糖改性物,然后烘干,得到巯基壳聚糖,巯基化度为800-1000umol/g;将制备的巯基壳聚糖置于液氮中保存,备用;
68.二、牛骨颗粒的制备:
69.(1)将1份天然生物骨切割成条状,通过煮沸、剔除、冲洗等物理方法将骨条处理干净,备用;其中:生物骨为牛离体松质骨;
70.(2)将处理干净的牛骨浸入500份环己烷烷(脱脂溶剂)中,在90℃下反应18小时进行脱脂处理,得到脱脂牛骨;
71.(3)将脱脂牛骨浸入10wt%的氢氧化钠溶液(碱性溶剂)中,在80℃下反应18小时进行脱蛋白处理,得到脱脂和脱蛋白的牛骨;
72.(4)将脱脂和脱蛋白后的牛骨置于马弗炉中,在350℃下煅烧3小时,然后置于组织研磨仪中粉碎处理1小时,得到粒径0.2-20μm的牛骨颗粒;
73.三、可注射温敏性自固化骨修复材料的制备:
74.(1)将巯基壳聚糖溶于去离子水中,配制浓度2wt%的巯基壳聚糖溶液;然后将牛骨颗粒溶于巯基壳聚糖溶液中,置于4℃冰箱中浸泡过夜,使牛骨颗粒与巯基壳聚糖之间发生共价键结合,然后过滤,得到骨颗粒-巯基壳聚糖交联物;
75.(2)将β-甘油磷酸钠(温敏调节剂)溶于去离子水中,配制浓度8wt%的β-甘油磷酸钠溶液,然后按比例加入巯基壳聚糖和骨颗粒-巯基壳聚糖交联物,使用涡旋振荡器涡旋15分钟,形成巯基壳聚糖/β-甘油磷酸钠/牛骨颗粒混合体系(即可注射温敏性自固化骨修复材料);混合体系中:巯基壳聚糖占8wt%、β-甘油磷酸钠占15wt%、牛骨颗粒占10wt%、余量为水。
76.实施例2
77.一种可注射温敏性自固化骨修复材料,包括如下质量分数的组分:巯基壳聚糖8wt%、温敏调节剂20wt%、生物骨颗粒15wt%、余量为水;其中:所述巯基壳聚糖的巯基化度为800umol/g,所述的温敏调节剂为α-甘油磷酸钠,所述的生物骨颗粒为牛骨颗粒。
78.实施例2所述的可注射温敏性自固化骨修复材料的制备方法与实施例1所述的制备方法区别在于:实施例2中选用的改性剂为2-亚氨基硫烷盐酸盐、催化剂选用浓度1.0wt%的1-羟基苯并三唑(hobt)、脱脂溶剂选用对溴甲苯、碱性溶剂选用质量分数15wt%的乙醇胺溶液、温敏调节剂选用α-甘油磷酸钠;实施例2的其余工艺条件与实施例1相同。
79.实施例3
80.一种可注射温敏性自固化骨修复材料,包括如下质量分数的组分:巯基壳聚糖10wt%、温敏调节剂18wt%、生物骨颗粒10wt%、余量为水;其中:所述巯基壳聚糖的巯基化度为1000umol/g,所述的温敏调节剂为β-甘油磷酸钠,所述的生物骨颗粒为猪骨颗粒。
81.实施例3所述的可注射温敏性自固化骨修复材料的制备方法与实施例1所述的制备方法区别在于:实施例3中选用的改性剂为半胱氨酸、催化剂选用浓度0.8wt%的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)、生物骨选用猪骨、脱脂溶剂选用对硝基甲苯、碱性溶剂选用质量分数5wt%的双氧水、温敏调节剂选用β-甘油磷酸钠;实施例3的其余工艺条件与实施例1相同。
82.实施例4
83.一种可注射温敏性自固化骨修复材料,包括如下质量分数的组分:巯基壳聚糖10wt%、温敏调节剂20wt%、生物骨颗粒15wt%、余量为水;其中:所述巯基壳聚糖的巯基化度为900umol/g,所述的温敏调节剂为α-甘油磷酸钠,所述的生物骨颗粒为猪骨颗粒。
84.实施例4所述的可注射温敏性自固化骨修复材料的制备方法与实施例3所述的制备方法区别在于:实施例4中选用的改性剂为n-乙酰-l-半胱氨酸、催化剂选用浓度0.6wt%的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)、脱脂溶剂选用乙酸乙酯、碱性溶剂选用质量分数20wt%的乙二胺溶液、温敏调节剂选用α-甘油磷酸钠;实施例4的其余工艺条件与实施例3相同。
85.实施例5
86.一种可注射温敏性自固化骨修复材料,包括如下质量分数的组分:巯基壳聚糖5wt%、温敏调节剂16wt%、生物骨颗粒20wt%、余量为水;其中:所述巯基壳聚糖的巯基化度为800umol/g,所述的温敏调节剂为甘露醇,所述的生物骨颗粒为马骨颗粒。
87.实施例5所述的可注射温敏性自固化骨修复材料的制备方法与实施例1所述的制备方法区别在于:实施例5中选用的改性剂为巯基乙烷、催化剂选用浓度0.6wt%的1-羟基苯并三唑(hobt)、生物骨选用马骨、脱脂溶剂选用石油醚、碱性溶剂选用质量分数12wt%的氢氧化钠溶液、温敏调节剂选用甘露醇;实施例5的其余工艺条件与实施例1相同。
88.实施例6
89.一种可注射温敏性自固化骨修复材料,包括如下质量分数的组分:巯基壳聚糖6wt%、温敏调节剂17wt%、生物骨颗粒20wt%、余量为水;其中:所述巯基壳聚糖的巯基化度为900umol/g,所述的温敏调节剂为三羟甲基乙烷,所述的生物骨颗粒为马骨颗粒。
90.实施例6所述的可注射温敏性自固化骨修复材料的制备方法与实施例5所述的制备方法区别在于:实施例6中选用的温敏调节剂为三羟甲基乙烷,实施例6的其余工艺条件与实施例5相同。
91.实施例7
92.一种可注射温敏性自固化骨修复材料,包括如下质量分数的组分:壳聚糖8wt%、
温敏调节剂15wt%、生物骨颗粒10wt%、余量为水;其中:所述的温敏调节剂为β-甘油磷酸钠,生物骨颗粒为牛骨颗粒。
93.实施例7与实施例1的区别在于:对比例7中制备牛骨颗粒的煅烧温度为1000℃,而实施例1制备牛骨颗粒的煅烧温度为350℃;实施例7的其余条件均与实施例1相同。
94.对比例1
95.一种可注射温敏性自固化骨修复材料,包括如下质量分数的组分:壳聚糖8wt%、温敏调节剂15wt%、生物骨颗粒10wt%、余量为水;其中:所述的温敏调节剂为β-甘油磷酸钠,生物骨颗粒为牛骨颗粒。
96.对比例1与实施例1的区别在于:对比例1与实施例1选用的温敏材料不同,即对比例1选用壳聚糖,而实施例1为巯基壳聚糖。
97.上述实施例1-7及对比例1的骨修复材料的成分参见下表1:
[0098][0099]
凝胶时间检测:
[0100]
准确量取100ml纯化水和pbs缓冲液,然后加入250ml烧杯中,放入水浴锅中,保持37℃,然后用注射器向水中或pbs缓冲液中注射3.0g上述实施例1-7及对比例1的可注射温敏性自固化骨修复材料,注射后开始计时,记录初凝和终凝的时间,其结果参见下表2。
[0101]
序号介质初凝胶时间终凝胶时间实施例1100ml水3min7min
实施例2100mlpbs3min8min实施例3100mlpbs2min5min实施例4100ml水3min7min实施例5100mlpbs3min6min实施例6100ml水3min8min实施例7100ml水5min15min对比例1100ml水10min20min
[0102]
由上述表2的测试结果可以看出本发明实施例1-6提供的可注射温敏性自固化骨修复材料在37℃下可数分钟内快速固化;而对比例1的修复材料其自固化时间则较长。
[0103]
压缩强度测试:
[0104]
对上述凝胶固化后的骨修复材料,使用电子万能试验机进行强度检测,其检测结果参见下表3。
[0105][0106][0107]
由上述表3的强度检测结果可以看出本发明实施例1-6的骨修复材料自固化后,其强度较高,可原位固定骨颗粒,避免骨颗粒的游走、移位;而对比例1的修复材料由于选用的是壳聚糖作为温敏材料,其压缩强度大幅削减。可以看出本发明的可注射温敏性自固化骨修复材料在固化后,其强度相对于对比例1更加优异。由于实施例7采用的是高温煅烧(1000℃)的牛骨颗粒,高温煅烧后骨颗粒上的羟基减少,达不到双网络结构,因此会导致其强度降低。
[0108]
粘附性检测:
[0109]
用上述凝胶固化后的骨修复材料,培养小鼠成纤维细胞l929,用原子力显微镜技术进行单细胞粘附性测试,其检测结果参见下表4。
[0110]
序号粘附力
实施例12.10nn实施例22.00nn实施例32.55nn实施例42.40nn实施例51.92nn实施例61.98nn实施例72.15nn对比例11.17nn
[0111]
由上述的粘附力检测结果可以看出本发明实施例1-6的骨修复材料自固化后,其细胞黏附性较强;实施例7中的修复材料采用的是高温煅烧(1000℃)的牛骨颗粒,骨修复材料中游离巯基增多,其细胞黏附性相对于实施例1稍强。由于对比例1的修复材料选用的是壳聚糖作为温敏材料,其细胞黏附性不及巯基壳聚糖作为温敏材料的骨修复材料;可以看出本发明的可注射温敏性自固化骨修复材料在固化后,其细胞黏附性相对于对比例1更加优异。
[0112]
冻干后孔隙率的表征:
[0113]
将所得产品经过冻干后进行xrs检测,获得其孔径的大下,结果参见下表5。
[0114]
序号孔隙率孔径实施例182%150-500um实施例285%250-650um实施例387%200-550um实施例490%200-650um实施例588%250-600um实施例684%200-550um
[0115]
生物学评价:
[0116]
(1)细胞毒检测:将上述实施例3作为样品,采用mtt比色法,检测供试品100%、80%、40%、20%浓度浸提液24小时内对小鼠成纤维细胞l929细胞相对增殖率的影响,并结合显微镜下细胞生长形态(参见图1-10)评价其细胞毒性;结果参见下表6;
[0117]
表6为小鼠成纤维细胞l929体外细胞相对增值率与细胞毒性评价结果
[0118][0119]
注:与空白对照组比较,*p<0.05,**p<0.01
[0120]
结果:与空白对照组相比,各浓度的阳性对照组及4个试验组,细胞增值率均显著下降;浓度为100%、80%的阳性对照组,rgr值分级均为3级;浓度为40%、20%的阳性对照组,rgr值分级均为2级;阴性对照组、各浓度的试验组细胞增殖无明显差异,rgr值分级均为0级,细胞毒评价合格。
[0121]
图1-10的显微镜观察结果显示,空白对照组的细胞形态正常,贴壁生长良好,形态呈梭形或类圆形,胞核卵圆,胞质均匀,未见异常核分裂相。与空白对照组相比,各浓度的阳性对照组细胞增值率均显著下降;阴性对照组、各浓度的样品试验组细胞增殖无明显差异。
[0122]
(2)皮内刺激的检测:按照《gb/t16886.10-2017医疗器械生物学评价第10部分:刺激与皮肤致敏试验》中“图2注射点排列”规定,在每只兔脊柱一侧的5个点皮内注射0.2ml样品,注射后即可,并在(24
±
2)h、(48
±
2)h和(72
±
2)h观察记录各注射情况;其最终的计分均不大于1.0,均符合试验要求。
[0123]
(3)溶血的检测:
[0124]
取实施例2和3作为溶血试验样品,取家兔血液,用0.9%氯化钠溶液制成2%的红细胞混悬液,取洁净试管5只,编号1、2管为样品管,3号为阴性对照管,4号为阳性对照管,5号为供试品对照管。按下表6所示依次加入2%红细胞悬液、0.9%氯化钠溶液、纯化水混匀,在37℃
±
0.5℃的恒温箱中温育,3小时后观察溶血和凝聚反应。
[0125]
表6为溶血检测设置表
[0126]
试管编号123452%红细胞悬液/ml2.52.52.52.5 0.9%氯化钠溶液2.22.22.5 4.7纯化水
ꢀꢀꢀ
2.5 供试品溶液0.30.3
ꢀꢀ
0.3
[0127]
结果:阴性对照管中红细胞全部下沉;阳性对照管呈澄明红色,管底细胞残留;实
施例2、3的样品管和阴性对照管肉眼观察无明显差异。
[0128]
上述为本发明的较佳实施例仅用于解释本发明,并不用于限定本发明。凡由本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
