1.本发明涉及微生物及核酸基因组检测领域,特别涉及人类疱疹病毒的病 原体核酸检测引物探针组合、试剂盒及其应用。
背景技术:
2.eb病毒(epstein-barr virus,ebv)是人类疱疹病毒家族中的双链dna病 毒,可引起多种常见的临床疾病,ebv感染是传染性单核细胞增多症的主要 病因,在儿童中常见,也与b淋巴瘤相关疾病和鼻咽癌密切相关。与其他人 类疱疹病毒一样,eb病毒感染也可引起神经系统感染、呼吸道疾病等。eb 病毒还具有潜伏特性,感染人体后,往往会潜伏于人类b淋巴细胞,当人体 免疫力低下的情况下,容易再激活引发相关疾病,特别是在发育未完全的新 生儿中、患有hiv感染患者和接受器官移植的患者中,严重危害人类的生命 和健康。
3.目前,在临床上对eb病毒感染的病原学鉴定主要包括免疫学检测和分子 生物学检测。免疫学检测适合于流行病学调查,但存在有耗时长、窗口期不 稳定等问题。虽然异嗜性凝集试验可以提示ebv感染,但在儿童中往往呈阴 性,影响临床大夫对疾病判断。近几年,定量聚合酶链反应(quantitativepolymerase chain reaction,qpcr)逐渐成为病原体核酸检测的“金标准”,对病原 体的核酸定量检测,为临床提供早期诊断和可依据的预防治疗。然而,昂贵 且精密的复杂设备在基层应用中难度较大,因此有必要开发一种简单、快速、 方便、适用的核酸检测方法。
技术实现要素:
4.有鉴于此,本发明提供了人类疱疹病毒(eb病毒)的病原体核酸检测引 物探针组合、试剂盒及其应用。本发明提供的引物组合与探针,特异性好, 灵敏度高。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了引物探针组合,包括第一引物探针组合和/或第二引物探针 组合;
7.所述第一引物探针组合为含有外源性内参的等温核酸扩增体系组合,具 有:
8.(i).上游引物具有如seq id no.1所示的核苷酸序列;和
9.(ii).下游引物具有如seq id no.2所示的核苷酸序列;和
10.(iii).探针具有如seq id no.4所示的核苷酸序列;或
11.(iv).如(i)、(ii)和/或(iii)所示的核苷酸序列经取代、缺失或 添加一个或多个碱基获得的核苷酸序列,且与(i)、(ii)和/或(iii)所示 的核苷酸序列功能相同或相似的核苷酸序列;或
12.(v).与(i)、(ii)、(iii)和/或(iv)所示的核苷酸序列至少有 80%同一性的核苷酸序列;和/或
13.所述第二引物探针组合为含有内源性内参的等温核酸扩增体系组合,具 有:
14.(i).上游引物具有如seq id no.5所示的核苷酸序列;和
15.(ii).下游引物具有如seq id no.6所示的核苷酸序列;和
16.(iii).探针具有如seq id no.7所示的核苷酸序列;或
17.(iv).如(i)、(ii)和/或(iii)所示的核苷酸序列经取代、缺失或 添加一个或多个碱基获得的核苷酸序列,且与(i)、(ii)和/或(iii)所示 的核苷酸序列功能相同或相似的核苷酸序列;或
18.(v).与(i)、(ii)、(iii)和/或(iv)所示的核苷酸序列至少有 80%同一性的核苷酸序列。
19.在本发明的一些具体实施方案中,所述引物探针组合还包括靶基因探针, 所述靶基因探针具有:
20.(i).如seq id no.3所示的核苷酸序列;或
21.(ii).如(i)所示的核苷酸序列经取代、缺失或添加一个或多个碱基获 得的核苷酸序列,且与(i)所示的核苷酸序列功能相同或相似的核苷酸序列; 或
22.(iii).与(i)和/或(ii)所示的核苷酸序列至少有80%同一性的核苷 酸序列。
23.在本发明的一些具体实施方案中,所述第二引物探针组合为含有内源性 内参的等温核酸扩增体系组合,还包括:
24.(i).上游引物具有如seq id no.1所示的核苷酸序列;和
25.(ii).下游引物具有如seq id no.2所示的核苷酸序列;和
26.(iii).探针具有如seq id no.3所示的核苷酸序列;或
27.(iv).如(i)、(ii)和/或(iii)所示的核苷酸序列经取代、缺失或 添加一个或多个碱基获得的核苷酸序列,且与(i)、(ii)和/或(iii)所示 的核苷酸序列功能相同或相似的核苷酸序列;或
28.(v).与(i)、(ii)、(iii)和/或(iv)所示的核苷酸序列至少有 80%同一性的核苷酸序列。
29.基于上述研究,本发明还提供了所述的引物组合在制备检测eb病毒的试 剂或试剂盒中的应用。在本发明的一些具体实施方案中,所述人类疱疹病毒 为eb病毒。在本发明的一些具体实施方案中,所述检测的扩增温度为39℃, 扩增时间为30min。
30.此外,本发明还提供了人类疱疹病毒的检测试剂,包括所述的引物探针 组合以及可接受的助剂。在本发明的一些具体实施方案中,所述人类疱疹病 毒为eb病毒。
31.更重要的是,本发明还提供了人类疱疹病毒的检测试剂盒,包括所述的 引物探针组合以及可接受的助剂或载体。在本发明的一些具体实施方案中, 所述人类疱疹病毒为eb病毒。
32.重组酶介导的等温核酸扩增技术(recombinase-aided amplification,raa) 是近几年新出现的具有我国自主知识产权的等温核酸扩增技术,在病原体核 酸检测领域和单核苷酸多态性检测中被广泛应用,raa技术在恒温条件下, 体系内的重组酶与引物紧密结合,形成酶和引物的聚合体,当引物在模板dna 上搜索到与之完全匹配的序列时,在单链dna结合蛋白的作用下,使模板双 链打开,并在dna聚合酶的作用下,启动模板合成,形成dna双链,如此 循环重复进而实现指数扩增,反应30min即可快速完成扩增,通过特异性荧 光探针检测,最快几分钟即可判断结果。内部质控(internalcontrol,ic)包 括外源性内参和内源性内参,是核酸检测反应的一个重要的体系监控,在核 酸检测反应体系中引入ic,
实时监测整个反应体系以此避免因操作失误、温 度不当、反应体系混合物不正确、酶活性差或样品基质中存在抑制物质等原 因导致的假阴性结果。外源性内参,是在反应体系或标本中添加一段内参模 板。内源性内参采用来源于样本中的人类基因组,使用不同的引物对对靶基 因和人运行基因分别进行扩增检测,更重要的是,可以对核酸提取到结果判 读整个过程进行实时监控,不仅对扩增反应进行监控,还能够对样本采集质 量和核酸提取质量进行解释。
33.本发明采用两种不同形式的ic引入raa反应体系内,实现对eb病毒的 实时核酸检测和监测。具体涉及利用等温核酸扩增技术对临床上一种常见的 人类疱疹病毒(eb病毒)核酸检测的引物组合和探针。本发明提供的引物组 合与探针,特异性好,灵敏度高。
附图说明
34.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实 施例或现有技术描述中所需要使用的附图作简单地介绍。
35.图1(a)~图1(b)示含有外源性内参的等温核酸扩增检测ebv技术的 外源性内参浓度分析图,靶基因为100拷贝/反应。其中,1:1,2:2,3:4;4:10;
36.图2(a)~图2(b)示含有外源性内参的等温核酸扩增检测ebv技术的 外源性内参浓度分析图,靶基因为5拷贝/反应;其中,1:1,2:2,3:4;4:10;
37.图3(a)~图3(b)示含有外源性内参的等温核酸扩增检测ebv技术的 外源性内参浓度分析图,靶基因为101拷贝/反应;其中,1:1,2:2,3:4;4:10;
38.图4(a)~图4(b)示含有外源性内参的等温核酸扩增检测ebv技术的 灵敏度分析图。其中,1:阴性,2:5,3:101,4:102,5:103,6:104;
39.图5(a)~图5(b)示含有外源性内参的等温核酸扩增检测ebv技术的 特异性分析图;
40.图6(a)~图6(b)示含有内源性内参的等温核酸扩增检测ebv技术的 灵敏度分析图,内源性内参浓度为2
×
104拷贝/μl。其中,1:104,2:103,3: 1024:101,5:2,6:阴性;
41.图7(a)~图7(b)示含有内源性内参的等温核酸扩增检测ebv技术的 灵敏度分析图,内源性内参浓度为2
×
102拷贝/μl;其中,1:104,2:103,3:1024: 101,5:2,6:阴性;
42.图8(a)~图8(b)示含有内源性内参的等温核酸扩增检测ebv技术的 灵敏度分析图,内源性内参浓度为2拷贝/μl;其中,1:104,2:103,3:1024: 101,5:2,6:阴性;
43.图9(a)~图9(b)示含有内源性内参的等温核酸扩增检测ebv技术的 特异性分析图;
44.注:所有图a均代表本发明的ebv靶基因扩增图(fam荧光),所有图b 代表图a相对应的内参dna扩增图(hex荧光);x轴代表时间(min),y 轴代表荧光值(mv)。
具体实施方式
45.本发明公开了人类疱疹病毒的病原体核酸检测引物探针组合、试剂盒及 其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别 需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的, 它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行 了描述,相关人员明显能在不脱离本发明内容、
精神和范围内对本文所述的 方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
46.为了实现上述发明目的,发明人根据eb病毒基因组序列和人源性基因组 (rnasp)序列,寻找同源性高的保守序列,设计适用于等温核酸扩增技术的 特异性引物对和靶探针。经过比对提供两种目的基因的特异性dna序列,两 种目的基因的片段位置分别是genbank登录号m80571.1公开的序列第 177631
–
177771bp位(ebv)和genbank登录号u77664.1公开的序列第 554
–
708bp位(rnasep)。
47.本发明提供了引物探针组合,包括第一引物探针组合和/或第二引物探针 组合;
48.所述第一引物探针组合为含有外源性内参的等温核酸扩增体系组合,具 有:
49.(i).上游引物具有如seq id no.1所示的核苷酸序列;和
50.(ii).下游引物具有如seq id no.2所示的核苷酸序列;和
51.(iii).探针具有如seq id no.4所示的核苷酸序列;或
52.(iv).如(i)、(ii)和/或(iii)所示的核苷酸序列经取代、缺失或 添加一个或多个碱基获得的核苷酸序列,且与(i)、(ii)和/或(iii)所示 的核苷酸序列功能相同或相似的核苷酸序列;或
53.(v).与(i)、(ii)、(iii)和/或(iv)所示的核苷酸序列至少有 80%同一性的核苷酸序列;和/或
54.所述第二引物探针组合为含有内源性内参的等温核酸扩增体系组合,具 有:
55.(i).上游引物具有如seq id no.5所示的核苷酸序列;和
56.(ii).下游引物具有如seq id no.6所示的核苷酸序列;和
57.(iii).探针具有如seq id no.7所示的核苷酸序列;或
58.(iv).如(i)、(ii)和/或(iii)所示的核苷酸序列经取代、缺失或 添加一个或多个碱基获得的核苷酸序列,且与(i)、(ii)和/或(iii)所示 的核苷酸序列功能相同或相似的核苷酸序列;或
59.(v).与(i)、(ii)、(iii)和/或(iv)所示的核苷酸序列至少有 80%同一性的核苷酸序列。
60.在本发明的一些具体实施方案中,引物探针组合还包括靶基因探针,所 述靶基因探针具有:
61.(i).如seq id no.3所示的核苷酸序列;或
62.(ii).如(i)所示的核苷酸序列经取代、缺失或添加一个或多个碱基获 得的核苷酸序列,且与(i)所示的核苷酸序列功能相同或相似的核苷酸序列; 或
63.(iii).与(i)和/或(ii)所示的核苷酸序列至少有80%同一性的核苷 酸序列。
64.在本发明的一些具体实施方案中,引物探针组合中所述第二引物探针组 合为含有内源性内参的等温核酸扩增体系组合还包括:
65.(i).上游引物具有如seq id no.1所示的核苷酸序列;和
66.(ii).下游引物具有如seq id no.2所示的核苷酸序列;和
67.(iii).探针具有如seq id no.3所示的核苷酸序列;或
68.(iv).如(i)、(ii)和/或(iii)所示的核苷酸序列经取代、缺失或 添加一个或多个碱基获得的核苷酸序列,且与(i)、(ii)和/或(iii)所示 的核苷酸序列功能相同或相似的
核苷酸序列;或
69.(v).与(i)、(ii)、(iii)和/或(iv)所示的核苷酸序列至少有 80%同一性的核苷酸序列。
70.基于上述研究,本发明还提供了所述的引物组合在制备检测人类疱疹病 毒的试剂或试剂盒中的应用。在本发明的一些具体实施方案中,引物探针组 合,所述人类疱疹病毒为eb病毒。
71.本发明实施例中,本发明采用的等温核酸扩增体系具体配置如下:缓冲 液、冻干粉、靶基因正向引物、靶基因反向引物、靶基因探针、内参正向引 物、内参反向引物、内参探针、内参和靶基因模板、无核酶水、醋酸镁。
72.更重要的是,本发明还提供了人类疱疹病毒的检测试剂,包括所述的引 物探针组合以及可接受的助剂。在本发明的一些具体实施方案中,所述人类 疱疹病毒为eb病毒。
73.本发明还提供了人类疱疹病毒(eb病毒)的检测试剂盒,包括所述的引物 探针组合以及可接受的助剂或载体。在本发明的一些具体实施方案中,所述 人类疱疹病毒为eb病毒。
74.本发明所采用的两种形式的内参。一种为外源性内参(重组dna),由 植物病毒片段和靶基因片段(本发明为ebv片段)组成,其中ebv靶基因探针 (seq id no.3)互补区被植物病毒片段所替换,其他序列位置保留。在这种情 况下,外源性内参dna提前添加在等温核酸扩增反应体系中,ebv靶基因 和外源性内参共同使用完全相同的引物序列,分别使用各自的探针进行荧光 检测。另一种为内源性内参,内源性内参为人类基因组dna片段,这种情况 下,ebv靶基因和外源性内参分别使用各自的引物和探针进行扩增检测。
75.在本发明的一些具体实施方案中,所述扩增检测温度为39-42℃,优选 39℃,扩增检测时间为15~30min,优选30min。
76.结果判读:体系混合后置于带有fam(靶基因)和hex(内参)通道的 荧光检测仪中。在扩增时间范围内,设置荧光检测仪的曲线扩增斜率大于等 于20且具有明显的扩增曲线,即可判断为阳性。
77.其中,fam和hex均为阳性,判断为阳性结果。
78.fam为阳性,hex为阴性,判断为阳性结果。
79.fam为阴性,hex为阳性,判断为阴性结果。
80.fam和hex均为阴性判断为无效结果。
81.本发明提供了利用等温核酸扩增技术对两种临床上常见的人类疱疹病毒 的病原体核酸检测的引物组合和探针。本发明提供的引物组合与探针,特异 性好,灵敏度高。
82.本发明提供的人类疱疹病毒的病原体核酸检测引物探针组合、试剂盒及 其应用中,所用原料及试剂均可有市场购得。raa扩增检测试剂盒(荧光法) 购于江苏奇天有限公司。
83.下面结合实施例,进一步阐述本发明:
84.实施例1在等温核酸扩增技术中用于检测ebv靶基因和内参的引物探针设 计合成,以及重组靶基因质粒和内参质粒的构建
85.下载并比对全部ebv全基因组序列和rnasep的基因组序列,选择保守 性高的序列。根据raa引物和探针设计原理,针对ebv barf1基因和rpp38 基因手工设计了引物和探
针。引物和探针的长度范围分别为30-35bp和 46-52bp。探针由携带5
‘‑
fam(靶基因探针)和5
’‑
hex(ic探针)的上游寡核苷 酸组成,分别通过thf间隔区与相邻的下游寡核苷酸相连。下游寡核苷酸的 3
‘
端带有c3’间隔区(聚合酶延伸阻断基团),用oligo7.0软件和ncbi的primerblast软件对引物和探针的特异性进行分析和评价,引物和探针的序列如 seq id no.1-seq id no.7所示。所有的引物和探针均委托专业公司合成,引 物采用page纯化,探针采用hplc纯化。三条探针采用双标记探针,靶基 因探针使用fam,ic探针使用hex,淬灭集团均采用bhq-1,两个荧光基 团之间为四氢呋喃。
86.外源性内参序列为选择好的ebv靶基因序列,其靶基因探针位置被植物 病毒序列片段代替。用所选ebv基因组序列中的玫瑰花环序列替换靶探针位 置。委托专业公司合成构建和返回靶基因和两种内参目的片,用于后续发明 中体系建立和优化。
87.ebv靶基因序列5
’‑3’
:(如seq id no.8所示)
88.atggccaggttcatcgctcagctcctcctgttggcctcctgtgtggccgc cggccaggctgtcaccgctttcttgggtgagcgagtcaccctgacctcc tactggaggagggtgagcctcggtccagagattgaggtcagctggttta aactgggcccaggagaggagcaggtgcttattgggcgcatgcaccacg atgtcatctttatagagtggcctttcaggggcttctttgatatccacaga agtgccaacaccttctttttagtagtcaccgctgccaacatctcccatga cggcaactacctgtgccgcatgaaactgggcgagaccgaggtcaccaa gcaggaacacctgagcgtggtgaagcctctaacgctgtctgtccactcc gaaaggtctcagttcccagacttctctgtccttactgtgacatgcaccg tgaatgcatttccccatccccacgtccagtggctcatgcccgagggcgt ggagcccgcaccaactgcggcaaatggcggtgttatgaaggaaaagga tgggagcctctctgttgctgttgacctgtcacttcccaagccctggcac ctgccagtgacctgcgttgggaaaaatgacaaggaggaagcccacggg gtttatgtttctggatacttgtcgcaataa
89.外源性内参序列5
’‑3’
:(如seq id no.9所示)
90.atggccaggttcatcgctcagctcctcctgttggcctcctgtgtggccg ccggccaggctgtcaccgctttcttgggtgagcgagtcaccctgacctc ctactggaggagggtgagcctcggtccagagattgaggtcagctggtt taaactgggcccaggagaggagcaggtgcttattgggcgcatgcacca cgatgtcatctttatagagtggcctttcaggggcttctttgatatccac agaagtgccaacaccttctttttagtagtcaccgctgccaacatctccc atgacggcaactacctgtgccgcatgaaactgggcgagaccgaggtca ccaagcaggaacacctgagcgtggtgaagcctctaacgctgtctgtcc actccgaaaggtctcagttcccagacttctctgtccttactgtgacatg caccgtgaatgcatttccccatccccacgtccagtggctcatgcccgag ggcgtggagcccgcaccaactgcggcaaatggcggtgttatgaaggaa aaggatgggagcctctctgttgctgttgacctgtcacttcccaagccct ggcacctgccagtgacctgcgttgggaaaaatgacaaggaggaagccc acggggtttatgtttctggatacttgtcgcaataa
91.内源性内参序列5
’‑3’
:(如seq id no.10所示)
92.tggacttcagaagattgaagataagaagaaaaagaacaaaacaccttt tctgaaaaaagaaagcagagagaaatgcagcattgctgttgatattag tgataatctgaaggagaagaaaacagatgctaagcagcaagtgtcag ggtggacgcctgcacacgtcaggaagcagcttgtcattggcgttaacg aagttaccagagccctggaaaggagggaactgctgttagttctggtgt gtaaatcagtcaagcctgccatgatcacctcacacttgattcagttaag cctaagcagaagtgtccctgcctgtcaggtcccccggctcagtgagag aatcgcccccgtcattggcttaaaatgtgttctagccttggcgttcaaa aagaacaccactgactttgtggacgaagtaagagccatcatccccaga gtccccagtttaagtgtaccatggcttcaagacagaattgaagattctg gggaaaatttagagactgaacctctggaaagcca
agacagagagcttt tggacacttcatttgaagatctgtcaaaacctaagagaaagcttgctg acggtcggcaggcttctgtaacattacaacc
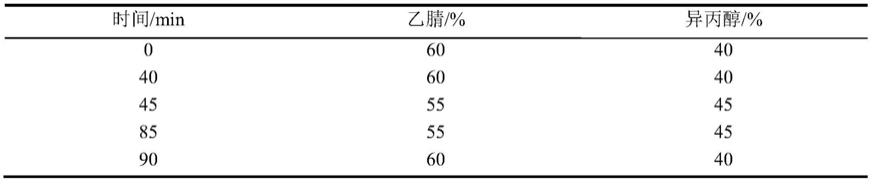
93.实施例2含有外源性内参的等温核酸扩增检测ebv技术体系建立、灵敏度 分析和特异性分析、临床评估
94.1.引物和探针采用实施例1中设计合成好的引物探针(seq id no.1-seqid no.4)。模板采用实施例1中构建合成好的ebv靶基因dna和外源性内 参dna。
95.2.反应试剂采用江苏奇天的raa荧光检测试剂盒,整个等温核酸扩增体 系(50ul)配置如下:缓冲液25μl、靶基因正向引物(如seq id no.1所示, 420nm)、反向引物(如seq id no.2所示,420nm)、靶基因探针(如seqid no.3所示,120nm)、外源性内参探针(如seq id no.4所示,120nm)、 外源性内参dna、模板1μl、无核酸酶水体积可调。将混合好的反应体系加 入到预先装有冻干粉的反应管(单链结合蛋白500ng/μl、dna聚合酶90ng/μl、 重组酶400ng/μl、核酸外切酶85ng/μl和uvsy蛋白70ng/μl),最后添加醋 酸镁14mm。
96.3.结果判读:体系混合后将反应管置于带有fam(靶基因)和hex(内 参)通道的荧光检测仪中。在扩增时间范围内,设置荧光检测仪的曲线扩增 斜率大于等于20且具有明显的扩增曲线,即可判断为阳性。扩增效果主要通 过荧光信号强度和起峰时间判断。
97.其中,fam和hex均为阳性,判断为阳性结果。
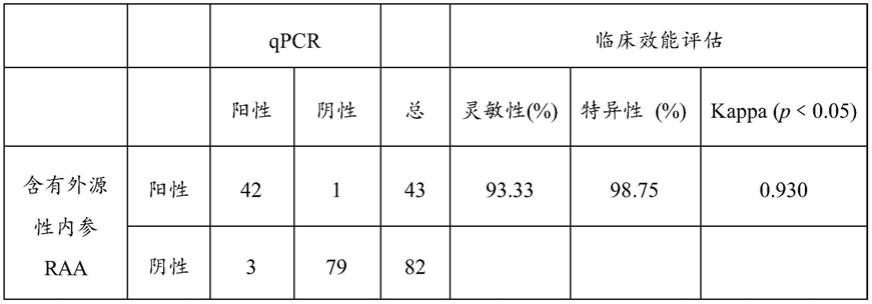
98.fam为阳性,hex为阴性,判断为阳性结果。
99.fam为阴性,hex为阳性,判断为阴性结果。
100.fam和hex均为阴性判断为无效结果,建议重新检测。
101.4.外源性内参浓度的确认
102.根据经验,在外源性内参dna浓度分别为10拷贝/μl、4拷贝/μl、2拷 贝/μl和1拷贝/μl时,检测低拷贝的ebv靶基因标准质粒(1、5、10拷贝/ 反应),保证外源性内参的扩增不会影响靶基因的正常扩增并确认合适的外 源性内参dna浓度。
103.结果显示,当ebv靶基因拷贝数为10拷贝时,4种不同浓度的外源性内 参均被判断为阳性,而且并未影响到靶基因的正常扩增,靶基因的扩增效果 无明显差异。如图3a-图3b所示。当ebv靶基因拷贝数为5拷贝时,4种不 同浓度的外源性内参均被判断为阳性,而且并未影响到靶基因的正常扩增。 其中,在外源性内参dna浓度为1拷贝/μl存在情况下,靶基因(1拷贝)的扩 增效果(荧光值和起峰时间)要优于另外3种外源性内参dna浓度存在情况 下靶基因的扩增效果。如图3a-图3b所示。当ebv靶基因拷贝数为1拷贝, 4种不同浓度的外源性内参均被判断为阳性,而靶基因为阴性。如图3a-图3b 所示。重复以上实施例,能得到相同的扩增结果,重复性好。因此本发明根 据本实施例中所得到的,内参的扩增并未影响靶基因的扩增,且靶基因的扩 增效果达到最优。最终选择的合适的外源性内参dna浓度为1拷贝每微升。
104.5.按照本实施例中确定的体系和外源性内参dna浓度对本发明中检测 ebv的含有外源性内参的等温核酸扩增技术进行灵敏度和特异性分析。
105.使用实时例中1的ebv靶基因模板(104、103、102、101、5、100拷贝/ 反应)进行灵敏度分析。在外源性内参dna浓度为1拷贝/μl时,内参的扩增 不影响靶基因的正常扩增,且靶基因的灵敏度为5拷贝/反应。重复以上结果, 重复性好。结果如图4a-图4b所示。
106.使用本发明中收集的其他病毒的临床样本阳性核酸,包括ebv、人类疱 疹病毒1
型、2型、5型、6型、人类乙型肝炎病毒、人类丙型肝炎病毒和西 尼罗病毒以及人类基因组。结果显示,与其他种类病原体均无无交叉反应, 表明方法特异性好。如图5a-图5b所示。
107.实施例3含有内源性内参的等温核酸扩增检测ebv技术体系的建立、灵敏 度分析、特异性分析
108.1.与实施例2不同的是,引物和探针采用实施例1中设计合成好的引物 探针(seq id no.1-seq id no.3和seq id no.5-seq id no.7)。模板采用实 施例1中构建合成好的ebv靶基因dna和内源性内参dna。
109.2.反应试剂采用江苏奇天的raa荧光检测试剂盒,整个等温核酸扩增体 系(50ul)配置如下:缓冲液25μl、靶基因正向引物(如seq id no.1所示, 420nm)、反向引物(如seq id no.2所示,420nm)、靶基因探针(如seqid no.3所示,120nm)、内源性内参正向引物(如seq id no.4所示,120nm)、 内源性内参反向引物(如seq id no.4所示,120nm)、内源性内参探针(如 seq id no.4所示,50nm)、无核酸酶水和模板的体积可调。将混合好的反 应体系加入到预先装有冻干粉的反应管(单链结合蛋白500ng/μl、dna聚合 酶90ng/μl、重组酶400ng/μl、核酸外切酶85ng/μl和uvsy蛋白70ng/μl), 最后添加醋酸镁14mm。
110.3.结果判读:体系混合后将反应管置于带有fam(靶基因)和hex(内 参)通道的荧光检测仪中。在扩增时间范围内,设置荧光检测仪的曲线扩增 斜率大于等于20且具有明显的扩增曲线,即可判断为阳性。扩增效果主要通 过荧光信号强度和起峰时间判断。
111.其中,fam和hex均为阳性,判断为阳性结果。
112.fam为阳性,hex为阴性,判断为阳性结果。
113.fam为阴性,hex为阳性,判断为阴性结果。
114.fam和hex均为阴性判断为无效结果,建议重新检测。
115.4.按照本实施例中确定的体系,对本发明中检测ebv的含有外源性内参 的等温核酸扩增技术进行灵敏度和特异性分析。
116.根据经验,使用实时例中1的ebv靶基因模板(104、103、102、101、2 拷贝/反应),在3种不同的内源性内参存在情况下进行进行灵敏度分析。结果 显示,在内源性内参浓度为2
×
104拷贝/μl,8次重复检测结果,其灵敏度均 可以达到2拷贝每反应。结果如图6a-图6b所示;在内源性内参浓度为2
×
102拷贝/μl,8次重复检测结果,其灵敏度均可以达到2拷贝每反应。结果如图 7a-图7b所示;在内源性内参浓度为2拷贝/μl,8次重复检测结果,其灵敏 度均可以达到2拷贝每反应。结果如图8a-图8b所示。
117.使用本发明中收集的其他病毒的临床样本阳性核酸,包括ebv、人类疱 疹病毒1型、2型、5型、6型、人类乙型肝炎病毒、人类丙型肝炎病毒和西 尼罗病毒。结果显示,与其他种类病原体均无无交叉反应,表明方法特异性 好。如图9a-图9b所示。
118.实施例4临床样本的评价
119.收集125份怀疑有ebv感染患者的临床样本,采用qiagen minidna kit 试剂盒提取dna,对两种ebv ic-raa方法进行临床样本的评估。
120.1.使用ebv的商业化聚合酶链反应定量试剂盒对样本进行dna检测。
121.2.反应程序均为:93℃,2min;93℃,45s,55℃,1min,10个循环;93℃, 30s,55℃,45s,30个循环。
122.3.反应组分:42μlpcr反应液,3μltaq酶,5μldna。
123.4.结果判读:当ct≤30,阳性;ct>30,阴性。
124.5.按照实施例2中确立好的含有外源性内参的等温核酸扩增检测ebv技术体 系和实施例3中确立好的含有内源性内参的等温核酸扩增检测ebv技术体系 对上述收集到的标本进行检测。
125.6.结果判读方式参考实施例2和实施例3。
126.检测结果如下表所示:
127.表1
[0128][0129][0130]
使用本发明中的实施例2中确立好的含有外源性内参的等温核酸扩增检 测ebv技术体系和实施例3中确立好的含有内源性内参的等温核酸扩增检测 ebv技术体系分别对收集的临床样本进行评估,与商业化的定量pcr试剂盒 进行统计学比较,展现出了良好的一致性,且重复性好。
[0131]
两种方法的临床样本评估种发现两种不同形式的内参均检测为阳性结 果,并未影响到靶基因ebv扩增,适合于对raa反应体系的扩增监测。在 含有内源性内参的raa技术中,通过临床样本的评估间接证明样本核酸dan 提取效果良好。本发明中两种不同形式的内参均可以成功应用于raa技术中, 且效果良好,重复性好。
[0132]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普 通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润 饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。