1.本发明涉及药物载体技术领域,具体而言,涉及一种自供氧靶向型仿生核膜结构纳米复合物及其制备方法和应用。
背景技术:
2.传统的纳米医学靶向策略分为两步:首先,对纳米颗粒表面进行聚乙二醇修饰,用于逃避网状内皮系统的清除;然后,进行配体修饰从而获得靶向能力。然而,最近研究表明,经聚乙二醇修饰的纳米药物,在持续给药后会被肝脏迅速清除,而配体修饰技术繁琐,且存在修饰广度不够等问题,因此,体内实际的靶向效果往往不尽如人意。
3.肿瘤乏氧微环境与肿瘤的发生发展息息相关,是肿瘤治疗中面临的一个巨大挑战。肿瘤乏氧可导致各种治疗抵抗,极大地限制了肿瘤治疗的疗效,因此,寻找合适的改善肿瘤乏氧的策略对提高肿瘤治疗疗效至关重要。目前,改善肿瘤乏氧的策略主要有基于肿瘤血管正常化的乏氧改善、基于人工供氧载体的乏氧改善、基于肿瘤原位产氧的乏氧改善。
技术实现要素:
4.本发明的发明目的之一是提供一种可用于磁共振成像、荧光成像、肿瘤化疗及光学治疗的自供氧靶向型仿生核膜结构纳米复合物。
5.为了解决上述发明目的,本发明提供了一种自供氧靶向型仿生核膜结构纳米复合物,所述纳米复合物包括有仿生脂质膜和中空mno2的核膜结构;所述仿生脂质膜为表面含有肿瘤细胞膜蛋白修饰的磷脂双分子膜;所述中空mno2用于装载肿瘤治疗性药物,所述药物是化疗药、免疫治疗药物中的至少一种。
6.可选地,所述仿生脂质膜内含有光敏剂,所述光敏剂是二氢卟吩e6(ce6)、icg-oda、icg-nh2、icg-cooh、icg-nhs、icg-mal、icg-sh、icg-n3、icg-alk、icg-biotin、ir780和ir783或ir808中的至少一种。
7.可选地,所述中空mno2质量占比为30%~80%。进一步可选地,所述中空mno2质量百分比选自80%、75%、70%、65%、60%、55%、50%、30%、35%、40%、45%。
8.可选地,所述中空mno2的比表面积为60~200m2/g,平均孔径为1.5~10nm,介孔表面无序。
9.进一步可选地,所述中空mno2比表面积上选自200m2/g、180m2/g、160m2/g、140m2/g、60m2/g、80m2/g、100m2/g、120m2/g。
10.可选地,所述中空mno2粒径为50~150nm,孔径2~10nm;其具有良好的药物负载能力。
11.可选地,所述磷脂双分子膜包括卵磷脂、氢化大豆磷脂、氢化蛋黄磷脂、二棕榈酰磷脂酰乙醇、二棕榈酰磷脂酰胆碱、二油酰磷酯酰乙醇胺、聚乙二醇-二硬脂酰磷脂酰乙醇胺、1,2-二棕榈酰基-sn-甘油基-3-磷脂酸甘油基-钠盐、1,2-二硬脂酰基-sn-甘油基-3-磷
脂酰胆碱、1,2-二棕榈酰基-sn-甘油基-3-磷脂酸-钠盐和1,2-二棕榈酰基-sn-甘油基-3-磷脂酰胆碱。
12.可选地,所述癌症包括乳腺癌、甲状腺癌、胰腺癌、肺癌、肾癌、肝癌和黑色素瘤。
13.可选地,所述光敏剂是吲哚类花菁染料,其包括icg的脂溶性衍生物如icg-oda、icg-nh2、icg-cooh、icg-nhs、icg-mal、icg-sh、icg-n3、icg-alk、icg-biotin、ir780、ir783、ir808或二氢卟吩e6中的一种两种以上药物的混合。
14.可选地,所述化疗药选自蒽环类抗癌药物、紫杉醇类抗癌药物、长春花生物碱类抗癌药物、铂类抗癌药物以及5-氟脲嘧啶、甲氨蝶呤、环磷酰胺、替莫唑胺和培美曲塞中的至少一种。
15.进一步可选的,所述蒽环类抗癌药物为阿霉素或表阿霉素;所述紫杉醇类抗癌药物为紫杉醇或多西紫杉醇;所述长春花生物碱类抗癌药物为长春碱、长春新碱、长春地辛或长春瑞宾;所述铂类抗癌药物为奥沙利铂或奈达铂。
16.可选地,所述光敏剂的质量百分含量为2~5%;所述抗肿瘤药物质量百分含量为8%~25%。
17.可选地,icg的质量百分含量为2~5%、dox质量百分含量为8%~25%。
18.可选地,所述自供氧靶向型仿生核膜结构纳米复合物的整体大小为100~400nm。
19.进一步可选地,所述自供氧靶向型仿生核膜结构纳米复合物的粒径范围上限任选自400nm、350nm、300nm、250nm、200nm、100nm、120nm、150nm。
20.可选地,所述自供氧靶向型仿生核膜结构纳米复合物分散在去离子水、pbs、生理盐水等溶液中。
21.可选地,所述自供氧靶向型仿生核膜结构纳米复合物7天内粒径变化《95%、14天内粒径《92%、21天内粒径变化《90%、28天内粒径变化《88%、35天内粒径变化《85%、42天内粒径变化《80%、49天内粒径变化《75%、56天内粒径变化《70%。
22.可选地,所述中空mno2通过模版刻蚀法、共沉淀法、沉淀法、水热反应、溶剂热反应、超声合成法中的任一一种方法制得。
23.可选地,当通过所述模版刻蚀法制备中空mno2时,刻蚀试剂选自碳酸钠、氢氟酸、氟化氢铵、氟化铵、四氟甲烷、缓冲氧化物刻蚀液(boe)、chf3、ch2f2、chf3/ch2f2、c4f8、c5f8、c4f8/c5f8中的任意一种。
24.可选地,所述中空mno2的离心清洗的离心速度选自4000~14000g。
25.进一步可选地,所述离心速度选自14000g、13000g、12000g、11000g、10000g、9000g、4000g、5000g、6000g、7000g、8000g。
26.可选地,所述核膜复合物的制备采用手动脂质体挤出器或自动脂质体挤出器制备。
27.进一步可选地,手动脂质体挤出器挤出速度为2~10ml/s,挤出速度选自10ml/s、9ml/s、8ml/s、7ml/s、6ml/s,、2ml/s、3ml/s、4ml/s、5ml/s。自动脂质体挤出器挤出力为2000~6000psi。
28.进一步可选地,所述挤出速度上限任选自5000psi、4500psi、4000psi、3500psi、3000psi,下限任选自1000psi、1500psi、2000psi、2500psi。
29.可选地,核膜复合物挤出的温度控制范围为4~45℃。进一步可选地,所述挤出温
度任选自45℃、42℃、40℃、37℃、35℃、32℃、30℃、27℃、25℃、22℃、20℃、5℃、7℃、10℃、12℃、15℃、17℃。
30.本发明的第二目的在于提供一种本发明的另一方面涉及所述的自供氧靶向型仿生核膜结构纳米复合物的制备方法,所述方法包括以下步骤:
31.s1、制备具备靶向性能的载光敏剂仿生脂质体:将合成载有光敏剂的脂质体与肿瘤细胞的膜蛋白通过共挤压法合成肿瘤细胞膜蛋白修饰的载光敏剂的仿生脂质体;
32.s2、制备载药中空mno2:以sio2为模版,制备中空mno2;将所得中空二氧化锰与疏水性治疗药物共搅拌,实现中空核内疏水性药物的负载;
33.s3、制备仿生脂质体/载药中空mno2复合体:将步骤s1中制得的仿生脂质体与步骤s2中载药中空mno2通过聚碳酸酯膜共挤压,反复挤压多次后,离心冷冻干燥制得成品。
34.可选地,所述步骤s1中所述的仿生脂质体水化溶液选自去离子水、pbs缓冲液、tris-hcl缓冲液、tris缓冲液、生理盐水、5%蔗糖溶液、5%葡萄糖糖溶液中的任意一种。
35.可选地,所述合成载有光敏剂的脂质体通过薄膜水化法、薄膜超声分散法、逆向蒸发法或微乳超声分散法制得。
36.可选地,步骤s1中共挤压法的挤压次数在20~60次之间。
37.进一步可选地,所述挤压次数上任选自60次、55次、50次、45次、40次、20次、25次、30次、35次。
38.可选地,步骤s1中所述合成载有光敏剂的脂质体通过薄膜超声波分散法制备,其包括以下步骤:取摩尔比为100:20:4:10的磷脂双分子膜、dspe-peg2000、胆固醇和光敏剂溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs,在60℃超声条件下水化,去离子水离心清洗后获得所述合成载有光敏剂的脂质体。
39.进一步可选地,步骤s2中所述载药中空mno2通过以下步骤制备:采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续搅拌后,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于蚀刻液中刻蚀sio2内核,依次经过离心、洗涤、干燥后获得中空mno2;将中空mno2与药物混合,在常温下依次进行物理搅拌、离心、分离、冷冻干燥获得载药中空mno2。
40.进一步可选地,所述步骤s2中制备单分散sio2纳米微球时,所述sio2制备的搅拌速度为100~700rpm,反应时间为12~36h,反应温度为25~60℃。
41.进一步可选地,所述步骤s2中的所述超声条件包括:超声功率为20~50w/cm2,超声时间控制在0.5~6h。
42.进一步可选地,所述步骤s2中获得中空mno2的过程中,干燥方式是加热烘干、加热真空干燥、冷冻真空干燥中的任意一种。当采用真空干燥时,加热的温度任选自60~300℃;真空时间任选自3h~72h;冷冻温度任选自-70~-80℃。
43.进一步可选地,所述步骤s2中,在制得载药中空mno2的过程中,物理搅拌的速度为100~800rpm,搅拌时间任选自12~48h。
44.进一步可选地,所述步骤s2中在制得载药中空mno2的过程中,即最终产物离心的速度任选自4000~20000rpm,离心温度任选自4~25℃。
45.本发明的第三目的在于提供一种自供氧靶向型仿生核膜结构纳米复合物在制备
治疗癌症的药物中的应用,所述复合物用于在制备治疗癌症的药物中用于多种肿瘤的精准靶向及联合增效治疗。
46.可选地,所述癌症包括乳腺癌、甲状腺癌、食管癌、胰腺癌、肺癌、肾癌、肝癌、黑色素瘤等。
47.可选地,所述自供氧靶向型仿生核膜结构纳米复合物具有t1加权mri成像性能,可借助mri成像性能所述复合物用于在制备治疗癌症的药物中用于癌症的精准诊断及边界鉴定。
48.可选地,所述自供氧靶向型仿生核膜结构纳米复合物具有荧光成像性能,可借助荧光成像性能所述复合物用于在制备治疗癌症的药物中用于癌症的精准诊断及边界鉴定。
49.可选地,所述自供氧靶向型仿生核膜结构纳米复合物在808nm波长处有吸收峰,辐照下可产生ros及热能,具有良好的光热及光动力性能,所述复合物用于在制备治疗癌症的药物中用于肿瘤的光热及光动力治疗。
50.可选地,所述自供氧靶向型仿生核膜结构纳米复合物具有同源靶向型能。
51.可选地,所述自供氧靶向型仿生核膜结构纳米复合物具有肿瘤微环境响应性,能在肿瘤部位原位产生氧气,用于改善肿瘤乏氧。
52.可选地,所述自供氧靶向型仿生核膜结构纳米复合物搭载化疗药物,所述复合物用于在制备治疗癌症的药物中用于肿瘤化疗。
53.可选地,所述自供氧靶向型仿生核膜结构纳米复合物具有良好的生物安全性,未见明显溶血反应。
54.本技术能产生的有益效果包括:
55.1)本发明中利用细胞膜作为载体,其不仅具有良好的生物相容性,且可在不考虑内核纳米材料特性的情况下,促进核内纳米粒在体内的长循环及靶向递送。
56.2)本发明所提供的自供氧靶向型仿生核膜结构纳米复合物以mno2作为内核,具有ph、h2o2及谷胱甘肽响应性,可在肿瘤原位产生o2及mn
2
,使得纳米复合物具有响应性产氧及mri成像性能,从而实现精准诊断并增强联合治疗的效果。
57.3)本发明的原料经济易得,制备方法条件温和,对设备和操作、环境等要求不高,易于实施且稳定性、重现性好,具备扩大生产的前景。
58.4)细胞膜仿生技术是一种简单的自上而下的方法,利用肿瘤细胞膜表面蛋白表达的差异,特异性地靶向同源肿瘤细胞,实现药物精准靶向,具有更高的生物安全性。mno2是一种具有肿瘤微环境响应性的无机材料,其具有ph、h2o2及谷胱甘肽响应性,可产生o2及mn
2
,不仅可改善肿瘤局部乏氧、增效肿瘤治疗疗效,还可用于mr造影成像,监测肿瘤生长及药物在体内的分布代谢。
附图说明
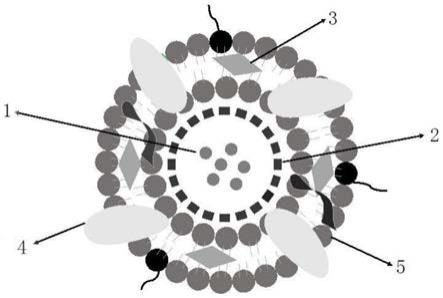
59.图1为实施例1所得到的自供氧靶向型仿生核膜结构纳米复合物组成示意图;
60.图2为实施例1所得到的自供氧靶向型仿生核膜结构纳米复合物的tem图;
61.图3为实施例1中自供氧靶向型仿生核膜结构纳米复合物体外产氧含量示意图;
62.图4为实施例1中自供氧靶向型仿生核膜结构纳米复合物在4t1肿瘤细胞中的摄取图;
63.图5为实施例1中自供氧靶向型仿生核膜结构纳米复合物的体外磁共振成像;
64.图6为实施例1中自供氧靶向型仿生核膜结构纳米复合物的体外光热性能图;
65.图7为实施例1中自供氧靶向型仿生核膜结构纳米复合物的单线态氧检测图;
66.图8为实施例1中自供氧靶向型仿生核膜结构纳米复合物的小动物荧光成像图。
67.附图标记说明:
68.1、阿霉素;2、中空二氧化锰;3、吲哚箐绿;4、4t1肿瘤细胞膜蛋白;5、磷脂双分子膜。
具体实施方式
69.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现结合具体实施例对本发明的技术方案进行以下详细说明,应理解这些实例仅用于说明本发明而不用于限制本发明的范围。实施例中,各原始试剂均可商购获得,未注明具体条件的实验方案为所述领域熟知的常规方法和常规条件,或按照制造商所建议的条件。实施例中采用的仪器及测试条件如下:
70.材料形貌在jeol-2100透射电子显微镜上观察,测试条件:200kv,101μa。
71.粒径分布在zetasizer nano zs型动态光散射粒度分析仪上进行材料粒径测试。
72.表面蛋白标志检测在bio-rad电泳仪上进行sds-page电泳。
73.细胞毒性测试利用mtt法在uv-2102pc型紫外可见分光光度计上进行材料细胞毒性分析。
74.磁共振成像分析在3.0t磁共振成像仪上进行材料成像研究,测试条件t1:tr=650ms,te=200ms。
75.实施例1
76.按照如下步骤合成自供氧靶向型仿生核膜结构纳米复合物:
77.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在冰浴条件下以400nm聚碳酸脂膜共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
78.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续搅拌12h,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中60℃过夜加热以刻蚀sio2内核,8000g离心、洗涤、冷冻干燥48h获得中空mno2;将中空mno2与dox混合,在常温下进行300rpm物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
79.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml载dox中空二氧化锰通过200mm聚碳酸脂膜在冰浴条件下共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物,该产物如图1所示。
80.实施例2
81.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空3h使有机溶剂
挥发完全;向成膜后的圆底烧瓶中加入5%蔗糖,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在冰浴条件下以400nm聚碳酸脂膜共挤压获得载icg仿生脂质体,离心清洗,冷冻干燥保存。
82.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续超声1h后搅拌过夜,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中60℃过夜加热以刻蚀sio2内核,8000g离心、洗涤、冷冻干燥48h获得中空mno2;将中空mno2与dox混合,在常温下进行400rpm物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
83.s3、取500μl的2mg/ml载icg仿生脂质体与500μl的1mg/ml载dox中空二氧化锰通过200mm聚碳酸脂膜在冰浴条件下共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
84.实施例3
85.按照如下步骤合成自供氧靶向型仿生核膜结构纳米复合物
86.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器以400nm聚碳酸脂膜共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
87.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续搅拌过夜,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中60℃加热24h以刻蚀sio2内核,9000g离心、洗涤、冷冻干燥48h获得中空mno2;将中空mno2与dox混合,在常温下进行400rpm物理搅拌,离心、分离,获得载药中空mno2。
88.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的2mg/ml载dox中空二氧化锰通过200mm聚碳酸脂膜在冰浴条件下共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
89.实施例4
90.按照如下步骤合成自供氧靶向型仿生核膜结构纳米复合物
91.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器以400nm聚碳酸脂膜共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
92.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续搅拌过夜,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中常温搅拌3h以刻蚀sio2内核,7000g离心、洗涤、冷冻干燥48h获得中空mno2;将中空mno2与dox混合,在常温下进行400rpm物理搅拌,离心、分离,获得载药中空mno2。
93.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的2mg/ml载dox中空二氧化锰通过200mm聚碳酸脂膜在冰浴条件下共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
94.实施例5
95.按照如下步骤合成自供氧靶向型仿生核膜结构纳米复合物
96.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的mda-mb-468细胞膜蛋白采用脂质体挤出器以400nm聚碳酸脂膜共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
97.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续搅拌24h,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中常温搅拌3h以刻蚀sio2内核,7000g离心、洗涤、冷冻干燥48h获得中空mno2;将中空mno2与dox混合,在常温下进行400rpm物理搅拌,离心、分离,获得载药中空mno2。
98.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的2mg/ml载dox中空二氧化锰通过200mm聚碳酸脂膜在冰浴条件下共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
99.实施例6
100.按照如下步骤合成自供氧靶向型仿生核膜结构纳米复合物
101.s1、制备载ce6仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、ce6溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载ce6脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器以400nm聚碳酸脂膜共挤压获得载ce6仿生脂质体,离心清洗,4℃保存。
102.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续搅拌过夜,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中常温搅拌2h以刻蚀sio2内核,7000g离心、洗涤、冷冻干燥48h获得中空mno2;将中空mno2与dox混合,在常温下进行400rpm物理搅拌,离心、分离,获得载药中空mno2。
103.s3、取500μl的1mg/ml载ce6仿生脂质体与500μl的2mg/ml载dox中空二氧化锰通过200mm聚碳酸脂膜在冰浴条件下共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
104.实施例7
105.按照如下步骤合成自供氧靶向型仿生核膜结构纳米复合物
106.s1、制备载ir780仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、ir780溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载ir780脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体
挤出器以400nm聚碳酸脂膜共挤压获得载ir780仿生脂质体,离心清洗,4℃保存。
107.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续搅拌过夜,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中常温搅拌1h以刻蚀sio2内核,7000g离心、洗涤、冷冻干燥48h获得中空mno2;将中空mno2与dox混合,在常温下进行400rpm物理搅拌,离心、分离,获得载药中空mno2。
108.s3、取500μl的1mg/ml载ir780仿生脂质体与500μl的1mg/ml载dox中空二氧化锰通过200mm聚碳酸脂膜在冰浴条件下共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
109.实施例8
110.按照如下步骤合成自供氧靶向型仿生核膜结构纳米复合物
111.s1、制备载ir780仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、ir780溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空4h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载ir780脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器以400nm聚碳酸脂膜共挤压获得载ir780仿生脂质体,离心清洗,4℃保存。
112.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续搅拌过夜,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中常温搅拌2h以刻蚀sio2内核,7000g离心、洗涤、冷冻干燥48h获得中空mno2;将中空mno2与dox混合,在常温下进行400rpm物理搅拌,离心、分离,获得载药中空mno2。
113.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml载dox中空二氧化锰通过200mm聚碳酸脂膜在冰浴条件下共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
114.实施例9
115.制备载icg仿生脂质体:取摩尔比为100:20:5:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在冰浴条件下以200nm聚碳酸脂膜共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
116.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续搅拌过夜12h,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中65℃过夜加热以刻蚀sio2内核,7000g离心、洗涤、冷冻干燥48h获得中空mno2;将中空mno2与dox混合,在常温下进行400rpm物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
117.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml载dox中空二氧化锰通过200mm聚碳酸脂膜在冰浴条件下共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
118.实施例10
119.制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,40℃旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的mcf-7细胞膜蛋白采用脂质体挤出器在冰浴条件下以200nm聚碳酸脂膜共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
120.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,乙醇/水溶液洗涤、常温离心,超声条件下加入kmno4,继续搅拌过夜12h,获得mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中60℃过夜加热以刻蚀sio2内核,8000g离心、洗涤、冷冻干燥48h获得中空mno2;将中空mno2与dox混合,在常温下进行300rpm物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
121.s3、取500μl的2mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过100mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
122.实施例11
123.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
124.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
125.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的2mg/ml氧化锰通过100mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
126.实施例12
127.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的akr肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
128.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
129.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml载dox中空二氧化锰通过100mm聚碳酸脂膜共挤压冰浴,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
130.实施例13
131.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发
完全;向成膜后的圆底烧瓶中加入pbs,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
132.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
133.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
134.实施例14
135.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%蔗糖溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
136.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
137.s3、取500μl的2mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
138.实施例15
139.s1、制备载icg仿生脂质体:取摩尔比为100:20:5:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%蔗糖溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冻干保存。
140.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌24h,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
141.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的2mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
142.实施例16
143.s1、制备载icg仿生脂质体:取摩尔比为100:20:5:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空4h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
144.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌24h,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
145.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的2mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
146.实施例17
147.s1、制备载ce6仿生脂质体:取摩尔比为100:20:5:20的卵磷脂、dspe-peg2000、胆固醇、ce6溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空5h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载ce6脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载ce6仿生脂质体,离心清洗,4℃保存。
148.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌24h,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
149.s3、取500μl的1mg/ml载ce6仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
150.实施例18
151.s1、制备载ir780仿生脂质体:取摩尔比为100:20:5:20的卵磷脂、dspe-peg2000、胆固醇、ir780溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空5h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs溶液,在60℃超声条件下水化,去离子水离心清洗后获得载ir780脂质体;将获得的载ir780脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在冰浴条件下以400nm聚碳酸脂膜共挤压获得载ir780仿生脂质体,离心清洗,4℃保存。
152.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌24h,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
153.s3、取500μl的2mg/ml载ir780仿生脂质体与500μl的2mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
154.实施例19
155.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%葡萄糖溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冻干保存。
156.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物
置于氢氟酸中,常温搅拌以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
157.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
158.实施例20
159.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空4h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冻干保存。
160.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中,常温搅拌以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
161.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
162.实施例21
163.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
164.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中,常温搅拌以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
165.s3、取500μl的2mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
166.实施例22
167.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%葡萄糖溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冻干保存。
168.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中,60℃搅拌以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
169.s3、取500μl的2mg/ml载icg仿生脂质体与500μl的2mg/ml氧化锰通过200mm聚碳酸
脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
170.实施例23
171.s1、制备载ir780仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、ir780溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%葡萄糖溶液,在60℃超声条件下水化,去离子水离心清洗后获得载ir780脂质体;将获得的载ir780脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载ir780仿生脂质体,离心清洗,冻干保存。
172.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中,常温搅拌以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
173.s3、取500μl的1mg/ml载ir780仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
174.实施例24
175.s1、制备载ce6仿生脂质体:取摩尔比为100:20:4:10的卵磷脂、dspe-peg2000、胆固醇、ce6溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs溶液,在60℃超声条件下水化,去离子水离心清洗后获得载ce6脂质体;将获得的载ce6脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载ce6仿生脂质体,离心清洗,4℃保存。
176.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸中,常温搅拌以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
177.s3、取500μl的1mg/ml载ce6仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
178.实施例25
179.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:15的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空4h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液中,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
180.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3中60℃条件下搅拌过夜以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌24h,离心、分离、冷冻干燥获得载药中空mno2。
181.s3、取500μl的2mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
182.实施例26
183.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:15的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
184.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,常温继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸溶液中低速搅拌1h以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
185.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的2mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
186.实施例27
187.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:15的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空4h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%蔗糖溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冷冻干燥保存。
188.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,常温继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸溶液中低速搅拌2h以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
189.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
190.实施例28
191.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:15的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空5h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%葡萄糖溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
192.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续超声3h后常温继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
193.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
194.实施例29
195.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:15的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空6h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入pbs溶液,在60℃超声条件下水化,去离子水离心清洗后
获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冷冻干燥保存。
196.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,常温继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸溶液中低速搅拌3h以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
197.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的2mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
198.实施例30
199.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:15的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
200.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,常温继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸溶液中低速震荡1h以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
201.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过100mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
202.实施例31
203.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:15的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空3h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冷冻干燥保存。
204.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,常温继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸溶液中低速震荡2h以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
205.s3、取500μl的2mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
206.实施例32
207.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:15的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空4h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
208.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入
kmno4,常温继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
209.s3、取500μl的2mg/ml载icg仿生脂质体与500μl的2mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压25次后,离心冷冻干燥制得纳米复合物产物。
210.实施例33
211.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空6h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在55℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
212.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,常温继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
213.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
214.实施例34
215.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空5h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冷冻干燥保存。
216.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,常温继续搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
217.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
218.实施例35
219.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空5h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冷冻干燥保存。
220.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续超声30min后常温搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,在常温下进行物理搅拌,离心、分离、冷冻干燥获得载药中空
mno2。
221.s3、取500μl的2mg/ml载icg仿生脂质体与500μl的2mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
222.实施例36
223.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空5h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%葡萄糖溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冷冻干燥保存。
224.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续超声1h后常温搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,冰浴条件下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
225.s3、取500μl的2mg/ml载icg仿生脂质体与500μl的2mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
226.实施例37
227.s1、制备载icg仿生脂质体:取摩尔比为100:20:6:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空6h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%蔗糖溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冷冻干燥保存。
228.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续超声1h后常温搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,冰浴条件下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
229.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
230.实施例38
231.s1、制备载icg仿生脂质体:取摩尔比为100:20:5:10的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空6h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%蔗糖溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冷冻干燥保存。
232.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续超声1h后常温搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,冰浴条件下进行物理搅拌,离心、分离、冷冻干燥获得载药中空
mno2。
233.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过100mm聚碳酸脂膜共挤压,反复挤压30次后,离心冷冻干燥制得纳米复合物产物。
234.实施例39
235.s1、制备载icg仿生脂质体:取摩尔比为100:20:5:15的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空6h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入5%蔗糖溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,冷冻干燥保存。
236.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续超声1h后常温搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与紫杉醇混合,冰浴条件下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
237.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过100mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
238.实施例40
239.s1、制备载icg仿生脂质体:取摩尔比为100:20:5:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空6h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
240.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续超声1h后常温搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,冰浴条件下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
241.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
242.实施例41
243.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:15的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空6h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在400nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
244.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续超声1h后常温搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,冰浴条件下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
245.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过200mm聚碳酸
脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
246.实施例42
247.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空5h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
248.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续超声1h后常温搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于氢氟酸溶液中低速震荡3h以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,冰浴条件下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
249.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml氧化锰通过100mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
250.对比例1
251.s1、制备载icg普通脂质体:取摩尔比为100:20:4:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空5h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体,4℃保存。
252.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,洗涤、离心,超声条件下加入kmno4,继续超声1h后常温搅拌过夜,制备mno2包裹的sio2纳米复合物;将所得mno2包裹的sio2纳米复合物置于na2co3溶液中以刻蚀sio2内核,离心、分离、冷冻干燥获得中空mno2;将中空mno2与dox混合,冰浴条件下进行物理搅拌,离心、分离、冷冻干燥获得载药中空mno2。
253.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml载药中空mno2通过200mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
254.本对比例中制得的纳米复合物产物为非仿生修饰核膜纳米复合物(hmd-i-l)。
255.对比例2
256.s1、制备载icg仿生脂质体:取摩尔比为100:20:4:20的卵磷脂、dspe-peg2000、胆固醇、icg-oda溶于氯仿溶液充分混合后,旋转蒸发成膜,成膜后抽真空5h使有机溶剂挥发完全;向成膜后的圆底烧瓶中加入tris溶液,在60℃超声条件下水化,去离子水离心清洗后获得载icg脂质体;将获得的载icg脂质体与提取的4t1肿瘤细胞膜蛋白采用脂质体挤出器在200nm聚碳酸脂膜条件下共挤压获得载icg仿生脂质体,离心清洗,4℃保存。
257.s2、采用溶胶-凝胶法制备单分散sio2纳米微球,将所获的sio2纳米微球溶液中先后加入ctab溶液、氨水及bteb继续搅拌,获得实心sio2为核、介孔sio2为壳的ssio2@msio2纳米粒子。将所得核壳结构复合物置于na2co3溶液中去除模版,离心、分离、冷冻干燥获得中空介孔sio2;将中空介孔sio2与dox混合进行物理搅拌,离心、分离、冷冻干燥获得载dox中空介孔sio2。
258.s3、取500μl的1mg/ml载icg仿生脂质体与500μl的1mg/ml载dox中空介孔sio2通过200mm聚碳酸脂膜共挤压,反复挤压20次后,离心冷冻干燥制得纳米复合物产物。
259.本对比例制得的纳米复合物产物为中空介孔sio2载药核膜纳米复合物(hsd-i-bl)。
260.实验例1
261.自供氧靶向型仿生核膜结构纳米复合物的结构表征
262.对实施例1中制备的各复合物进行结构表征
263.表征方法:透射电子显微扫描仪器:feitecnai f20
264.图2给出了实施例1所得到产物的tem图。
265.对本发明的其他实施例中制备的各复合物进行同样的结构表征,证明通过本发明的方法确实用于得到自供氧靶向型仿生核膜结构纳米复合物。
266.实验例2
267.自供氧靶向型仿生核膜结构纳米复合物产氧实验
268.配置实施例1所得到的自供氧靶向型仿生核膜结构纳米复合物(hmd-i-bl)及对比例2所的到的中空介孔sio2载药核膜纳米复合物(hsd-i-bl),将两者分别加入到含过氧化氢(10mm h2o2)及谷胱甘肽(10mm gsh)的水溶液中,用来模拟纳米复合物在体外肿瘤微环境中的响应性产氧情况。在808nm激光下辐照5分钟(1w/cm2),测定溶液中氧气含量。氧气含量如图3所示。
269.该结果说明中空介孔sio2载药核膜纳米复合物在体外为观察到明显的产氧,而所得到的自供氧靶向型仿生核膜结构纳米复合物在激光辐照下具有较好体外产氧能力,用于原位改善肿瘤乏氧。
270.实验例3
271.自供氧靶向型仿生核膜结构纳米复合物靶向实验
272.5000个4t1乳腺癌细胞接种于6孔板中37摄氏度,5%co2孵育过夜,分别加入20μg/ml icg计量的实施例1所制备得到的自供氧靶向型仿生核膜纳米复合物(hmd-i-bl)及对比例1所得到的非仿生修饰核膜纳米复合物(hmd-i-l),共孵育2小时后,pbs清洗,4%多聚甲醛固定。采用激光共聚焦显微镜观察4t1细胞对复合物的摄取情况如图4所示。
273.所得到的自供氧靶向型仿生核膜结构纳米复合物在4t1细胞中的摄取明显高于非仿生修饰的纳米复合物,具有良好的靶向效果,用于肿瘤靶向递药。
274.实验例4
275.自供氧靶向型仿生核膜结构纳米复合物的体外磁共振成像性能
276.以实施例1为典型代表,其磁共振造影图如图5所示。可以看出在周围水相环境呈黑色时,实施例1呈现出浓度依赖性亮信号(mri t1造影功能增强),说明样品自供氧靶向型仿生核膜结构纳米复合物具有明显的t1加权磁共振成像功能。
277.实验例5
278.自供氧靶向型仿生核膜结构纳米复合物的体外光热性能
279.取20μg/ml icg计量的实施例1制备得到的自供氧靶向型仿生核膜纳米复合物溶解于去离子水中,采用808nm激光器照射5min,在近红外热成像仪观察激光照射下溶液的温度变化情况如图6所示。
280.所得到的自供氧靶向型仿生核膜结构纳米复合物在激光照射下的具有明显的升温效果,且升温作用与同浓度的游离icg相似,说明自供氧靶向型仿生核膜结构纳米复合物
具有良好的光热性能,用于肿瘤光热治疗。
281.实验例6
282.自供氧靶向型仿生核膜结构纳米复合物的体外1o2生成评估
283.取20μg/ml icg计量的实施例1制备得到的自供氧靶向型仿生核膜纳米复合物溶解于含h2o2及dpbf的去离子水中,采用808nm激光器照射5min,在紫外分光光度计观察溶液在不同时间点吸光度的变化情况如图7所示。
284.所得到的自供氧靶向型仿生核膜结构纳米复合物在激光照射下的具有吸光度明显下降,说明自供氧靶向型仿生核膜结构纳米复合物在激光照射下能有效产生1o2,用于肿瘤光动力治疗。
285.实验例7
286.自供氧靶向型仿生核膜结构纳米复合物的小动物荧光成像
287.取20μg/ml icg计量的实施例1制备得到的自供氧靶向型仿生核膜纳米复合物溶解于去离子水中,经尾静脉注射进小鼠体内,通过小动物活体成像仪观察荧光强度变化情况如图8所示。
288.所得到的自供氧靶向型仿生核膜结构纳米复合物逐渐富集于肿瘤部位,且浓度明显高于非仿生修饰的复合物,说明自供氧靶向型仿生核膜结构纳米复合物具有良好的靶向型能,用于肿瘤精准靶向治疗。
289.虽然本公开披露如上,但本公开的保护范围并非仅限于此。本领域技术人员,在不脱离本公开的精神和范围的前提下,可进行各种变更与修改,这些变更与修改均将落入本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。